<4D F736F F D E34208EA18CB18EE891B182AB977697CC C8E8DB782B591D682A688CB978A>
|
|
|
- やすはる よしくに
- 5 years ago
- Views:
Transcription
1 Ver 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ 医療機関情報 治験審査委員会 をご確認ください 2. 手続き書式 治験依頼者作成 提出の書式は HP の 治験依頼者の方へ 治験の手続き 書式 からダウンロードしてご使用ください < 統一書式の押印について > 統一書式の押印については 責任医師が作成する一部の書式を除き不要とします 詳細は 治験関連書類への押印省略等に関する手順書 (HP の 治験依頼者の方へ 治験の手続き 手順書 ) をご確認ください 3. 提出書類 新規申請の流れは HP の 治験依頼者の方へ 治験の手続き 治験開始までの流れ をご確認ください 治験依頼決定後下記の書類を治験事務局へご提出ください * 治験実施計画書 8 部 * 治験薬概要書 1 部 * 症例報告書の見本 1 部 * 説明 同意文書 ( 依頼者案 ) 電子媒体でご提供ください 説明文書 同意文書作成上の手順 (HP の 治験依頼者の方へ 治験の手続き その他 ) に沿って当院で作成します * 補償に関する資料 * 治験費用資料 ( 案 ) 被験者への支払いに関する資料 治験経費算出表 各ポイント算出表 電子媒体でご提出ください 1
2 被験者への支払いに関する資料 ( 負担軽減費の支払い ) は HP の 治験依頼者の方へ 治験の手続き その他 からダウンロードしてご使用ください * 治験依頼書 ( 書式 3)( 案 ) 電子媒体でご提出ください * その他 ( 審査対象となる資料等 ) 治験責任医師の 履歴書 ( 書式 1) 治験分担医師 治験協力者リスト ( 書式 2) は治験事務局が作成します 当院の治験経費規程および治験経費資料 ( 治験経費算出表 各ポイント表 ( 研究経費ポイント CRC 費用ポイント 治験薬管理費ポイント ) のフォームを治験事務局から電子媒体でご提供します 治験依頼 申請下記の書類を治験事務局へご提出ください 1) 治験依頼書 ( 書式 3)1 部 2) 治験実施計画書の合意書 1 部 3) 治験の費用の負担に関する資料 1 部 被験者への支払( 被験者への負担軽減費支払い ) に関する資料 治験経費に関する資料( 治験経費算出表 各ポイント算出表 ) 4)IRB 審査資料ファイル 21 部 1 治験実施計画書 ( 合意書の写しを含む ) 2 治験薬概要書 3 症例報告書の見本 ( 治験実施計画書において症例報告書に記載すべき事項が十分に読み取れる場合は不要 ) 4 説明 同意文書 補償に関する説明資料 5 治験責任医師の履歴書 ( 書式 1) の写し 6 治験分担医師 治験協力者リスト ( 書式 2) の写し 7 治験の費用の負担に関する資料 ( 被験者への支払に関する資料 ) 8 被験者の健康被害に対する補償に関する資料 9 被験者の募集手順 ( 広告等 ) に関する資料 ( 募集する場合 ) 10 被験者の安全等に係る報告 ( 必要時 ) 11その他審査に必要となる資料 IRB 受託審査下記の書類を治験事務局へご提出ください * IRB 審査時の説明資料 21 部 IRB 前日までに紙媒体の他 電子媒体もご提出ください 治験実施計画の概要説明は責任医師が行います スライド資料作成のご協力をお願いします 説明時間は約 15 分程度 資料は A4 版両面 2 分割とします 指示決定通知 契約締結 2
3 下記の書類を治験事務局へご提出ください * 治験契約書 各覚書 ( 案 )( 当院書式 19 20) 変更履歴付の電子媒体でご提出ください 契約書は原則当院書式を使用し必要に応じて覚書を締結します * 治験薬の取り扱い及び保管 管理等に関する手順書等 * 治験概要 ( 診療報酬明細書添付用 ) HP の 治験依頼者の方へ 治験の手続き その他 からダウンロードし 必要事項を記載後 電子媒体でご提出ください * 治験責任医師 分担医師 協力者の署名が必要な書類等 スタートアップミーティング前までにフォームをご提出ください 院長からの指示決定通知は IRB 開催後 約 2 週間です 変更申請 各報告等の手続きは契約締結後に開始となります 治験実施中 修正報告 下記の書類を治験事務局へご提出ください * 治験実施計画書等修正報告書 ( 書式 6)1 部添付資料 : 変更対比表 1 部 IRB 資料 : 書式 6 写し + 変更対比表 23 部 受託審査または変更審査の結果が 修正の上で承認 となった場合は 本報告にて院長が修正されたことを確認した後に契約締結または変更となります 説明 同意文書のみの修正の場合は治験責任医師が提出します 継続審査 下記の書類を治験責任医師が提出します * 治験実施状況報告書 ( 書式 11)1 部 契約締結後 終了報告まで 1 年毎に契約締結月に開催する IRB で審査します 変更申請 下記の書類を治験事務局にご提出ください 治験実施計画書 治験薬概要書 症例報告書の見本 ( 治験実施計画書において症例報告書に記載すべき事項が十分に読み取れる場合は不要 ) 説明 同意文書 被験者への支払に関する資料 補償に関する資料 募集の手順に関する資料 ) の変更 * 治験に関する変更申請書 ( 書式 10)1 部 添付資料: 改訂文書 1 部 変更対比表 1 部 IRB 資料 : 変更対比表 23 部 治験責任医師の変更 伴う説明 同意文書の変更 * 治験に関する変更申請書 ( 書式 10)1 部 添付資料: 改訂文書 1 部 変更対比表 1 部 IRB 資料 : 履歴書 ( 書式 1) の写し + 治験分担医師 治験協力者リスト ( 書式 2) の写し + 変更対比表 23 部 治験契約内容変更に関する覚書書式 20( 契約書変更 ) 3
4 治験分担医師の追加 * 治験に関する変更申請書 ( 書式 10)1 部 書式 10 の申請日は空欄でご提出ください 責任医師の確認後に記入します 責任医師の押印は治験事務局が対応します 説明 同意文書のみの変更の場合は治験責任医師が提出します 治験責任医師 治験分担医師の変更の際 治験責任医師の 履歴書 ( 書式 1) 治験分担医師 治験協力者リスト ( 書式 2) は治験事務局が作成します 迅速審査下記の変更は迅速審査とし審査結果は直近の IRB で報告します * 治験分担医師の追加 * 治験実施計画書の 治験実施期間 の延長 * その他軽微な変更 審査対象外下記の変更は審査不要とします 改訂文書または連絡文書 その他必要書類 をご提出ください * 治験実施計画書の事務的事項に関する変更による改訂 治験依頼者の組織 体制の変更 実施医療機関情報の変更 * 症例報告書見本のレイアウト変更による改訂 * 審査対象となる資料における誤植の訂正 ( 明らかであり治験実施に影響を与えないもの ) * 健康被害に対する補償に関する資料のうち付保証明書の保険期間の更新 * 治験分担医師の削除 ( 治験分担医師 治験協力者リスト ( 書式 2) は治験事務局が作成します ) * 治験契約書の変更 治験依頼者の代表者名 社名 住所等の変更( 連絡文書には契約書読み替えの旨を記載のこと ) 開発業務受託機関(CRO) の追加 削除 ( 契約書または覚書 ) 治験契約期間の延長( 治験契約内容変更に関する覚書 治験に係る経費に関する覚書 追加費用が発生する場合はポイント算出表 ) 契約症例数の追加( 治験契約内容変更に関する覚書 治験に係る経費に関する覚書 ) 治験実施計画書からの逸脱( 緊急の危険回避 ) 下記の書類を治験責任医師が提出します * 緊急の危険を回避するための治験実施計画書からの逸脱に関する報告書 ( 書式 8)1 部下記の書類を治験事務局にご提出ください * 緊急の危険を回避するための治験実施計画書からの逸脱に関する通知書 ( 書式 9)1 部 書式 8 の提出に対し検討結果を通知してください 4
5 重篤な有害事象発生 下記の書類を治験責任医師が提出します * 重篤な有害事象に関する報告書 ( 書式 ) 2 部 当該報告は直近の IRB で審査します 安全性情報 下記の書類を治験事務局にご提出ください * 安全性情報等に関する報告書 ( 書式 16)2 部 添付資料: 個別症例報告 ラインリスト 当局への報告様式等各 2 部年次報告 研究報告 措置報告 当局への報告様式各 2 部 IRB 資料 : 書式 16 の写し + 上記添付資料 23 部 治験責任医師の見解確認については別途ご相談ください 年次報告において副作用等症例の発現がない場合は 書式 16 の提出は不要です 治験終了報告書の提出前に当該報告を終了する場合はその旨を文書にてご連絡ください 治験終了後 終了( 中止 中断 ) 報告 下記の書類を治験責任医師が提出します * 治験終了 ( 中止 中断 ) 報告書 ( 書式 17) 1 部 症例 文書の直接閲覧 治験薬回収を終えてからの提出となります 開発中止 治験の中止 中断 製造販売承認取得 再審査 再評価結果の通知 下記の書類を治験事務局ご提出ください * 開発の中止等に関する報告書 ( 書式 18) 1 部 開発中止 治験中止 中断の場合は理由を記載した文書を添付してください 製造販売承認取得 再審査 再評価結果の通知も IRB へ報告します GCP で定められた期間以上の保管期間を希望される場合は事前にご相談ください 直接閲覧下記の書類を治験事務局にご提出ください * 直接閲覧実施連絡票 ( 参考書式 2) 当院担当者と日時を調整後 治験事務局に 添付にてご提出ください 立会人 の記載症例 SDV: 治験協力者文書 SDV: その他 ( 治験事務局 ) 閲覧されるご担当者全員の氏名を記載してください モニターの所属 氏名 が治験実施計画書等に記載されていない場合は確認できるものを事前にご提出ください 以上 5
臨床試験(治験)の手続きについて
 臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
Microsoft PowerPoint - 運用 [互換モード]
![Microsoft PowerPoint - 運用 [互換モード] Microsoft PowerPoint - 運用 [互換モード]](/thumbs/91/105850431.jpg) 押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
標準業務手順 目次
 浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
申請等の手引き
 新規治験の手続きについて 治験に関する問い合わせ先臨床研究支援センター治験事務局 Tel:06-6692-1201 ( 内線 2024) 平日 9:00~17:00 新規治験を実施する場合は 医師へ問い合わせ前に必ず治験事務局へご連絡ください 本文中のはホームページ上の をご確認ください 手順書等は最新版をホームページに掲載しております 各自ダウンロードしてください
新規治験の手続きについて 治験に関する問い合わせ先臨床研究支援センター治験事務局 Tel:06-6692-1201 ( 内線 2024) 平日 9:00~17:00 新規治験を実施する場合は 医師へ問い合わせ前に必ず治験事務局へご連絡ください 本文中のはホームページ上の をご確認ください 手順書等は最新版をホームページに掲載しております 各自ダウンロードしてください
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下
 北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
<4D F736F F D208EA18CB182C98AD682B782E995578F808BC696B18EE88F878F E7B8D732E646F6378>
 治験に関する標準業務手順書 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医薬品及び医療機器の臨床試験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和
治験に関する標準業務手順書 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医薬品及び医療機器の臨床試験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和
山形県立中央病院治験審査委員会業務手順書
 山形県立中央病院治験審査委員会業務手順書 第 1 目的この手順書は山形県立中央病院医薬品等臨床試験受託研究取扱要綱 ( 以下 取扱要綱 という ) に基づいて山形県立中央病院治験審査委員会 ( 以下 本委員会 という ) の運用方法を定め それに基づく業務手順書を示すものである なお 製造販売後臨床試験においては 以下 治験 とあるのを 製造販売後臨床試験 と読み替えるものとする 第 2 本委員会の責務本委員会は全ての被験者の人権の保護
山形県立中央病院治験審査委員会業務手順書 第 1 目的この手順書は山形県立中央病院医薬品等臨床試験受託研究取扱要綱 ( 以下 取扱要綱 という ) に基づいて山形県立中央病院治験審査委員会 ( 以下 本委員会 という ) の運用方法を定め それに基づく業務手順書を示すものである なお 製造販売後臨床試験においては 以下 治験 とあるのを 製造販売後臨床試験 と読み替えるものとする 第 2 本委員会の責務本委員会は全ての被験者の人権の保護
<4D F736F F D208EA18CB182C98AD682B782E995578F808BC696B18EE88F878F E38E748EE593B1816A E7B8D732E646F637
 治験に関する標準業務手順書 ( 医師主導治験 ) 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医師主導治験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 (
治験に関する標準業務手順書 ( 医師主導治験 ) 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医師主導治験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 (
1. 各項目に共通する注意点等について *IRB 審査資料の提出期限は IRB 開催日の 2 週間前までとします * 事前確認依頼については 資料提出期限の 1 週間前を目安に電子にて事務局担当者までご依頼ください スケジュールについては 当センター HP の IRB 年間開催日程と書類提出締切日
 西暦 2016 年 9 月 1 日 大阪市立大学医学部附属病院 医薬品 食品効能評価センター 治験事務局 新規契約締結以降の IRB 等の対応について 1. 各項目に共通する注意事項 2. 安全性情報 ( 委員会審査 ) 3.1 変更申請 ( 委員会審査 ) 2 変更申請 ( 軽微な変更委員会審査及び迅速審査 ) 3 変更契約書 各種覚書の締結について 4. 継続審査 ( 委員会審査 ) 5. 症例数確定後の手続きについて
西暦 2016 年 9 月 1 日 大阪市立大学医学部附属病院 医薬品 食品効能評価センター 治験事務局 新規契約締結以降の IRB 等の対応について 1. 各項目に共通する注意事項 2. 安全性情報 ( 委員会審査 ) 3.1 変更申請 ( 委員会審査 ) 2 変更申請 ( 軽微な変更委員会審査及び迅速審査 ) 3 変更契約書 各種覚書の締結について 4. 継続審査 ( 委員会審査 ) 5. 症例数確定後の手続きについて
医師主導治験取扱要覧
 15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
<93648EA593498B4C985E82C98AD682B782E E838A F E315F C668DDA95AA292E786C7378>
 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 ( 版 :2013 年 9 月 1 日 ver2.0) 2 3 電磁的記録として扱う治験関連文書 電磁的記録の交付
1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 ( 版 :2013 年 9 月 1 日 ver2.0) 2 3 電磁的記録として扱う治験関連文書 電磁的記録の交付
<4D F736F F F696E74202D2090BB91A294CC94848CE392B28DB CC905C90BF82C982C282A282C45F F566F6C2E33>
 この冊 における製造販売後調査等とは 使 成績調査 特定使 成績調査 副作 感染症報告 です 1/Mar/2016 Vol.3 1 ホームページのご案内 1 当院ホームページに手続き内容や 必要書類等を UP しています 2 依頼者のページ 3 製造販売後調査について 1 治験のお知らせ 2 ホームページのご案内 2 当院ホームページに手続き内容や 必要書類等を UP しています 申請の内容に応じて
この冊 における製造販売後調査等とは 使 成績調査 特定使 成績調査 副作 感染症報告 です 1/Mar/2016 Vol.3 1 ホームページのご案内 1 当院ホームページに手続き内容や 必要書類等を UP しています 2 依頼者のページ 3 製造販売後調査について 1 治験のお知らせ 2 ホームページのご案内 2 当院ホームページに手続き内容や 必要書類等を UP しています 申請の内容に応じて
IRB の 4 週間前までに事前確認に必要な資料をご提出ください 必要時にはヒアリングも実施いたします IRB 審議用確認資料 電子 ( メール ) にてご提出ください 製造販売後調査申請書 ( 様式 1) 1 部 審査用資料 1 薬品概要書 ( 添付文書でも可 ) 1 部 2 調査実施計画書 (
 国立大学法人信州大学医学部附属病院製造販売後調査実施に係わる手続き要領 2018 年 4 月 はじめにご確認ください 本要領の対象となる調査は 再審査 再評価のために GPSP で規定された日常診療下で実施される調査です 製薬会社が独自で行う調査 (= 観察研究 ) は対象外です 独自に実施する調査は 臨床研究として信州大学医学部医倫理委員会で審議となります 各種手続きについて担当医師又は信州大学医学部庶務係
国立大学法人信州大学医学部附属病院製造販売後調査実施に係わる手続き要領 2018 年 4 月 はじめにご確認ください 本要領の対象となる調査は 再審査 再評価のために GPSP で規定された日常診療下で実施される調査です 製薬会社が独自で行う調査 (= 観察研究 ) は対象外です 独自に実施する調査は 臨床研究として信州大学医学部医倫理委員会で審議となります 各種手続きについて担当医師又は信州大学医学部庶務係
臨床試験(治験)実施の手続き
 製造販売後調査実施の手続き はじめに 本書は 昭和大学藤が丘病院における製造販売後調査実施の手続き方法等について記載したものです 本書内のは当院が提供する書類を示し は審査等に必要な書類を示しております 調査内容により提出書類 資料に変更が生じる場合があります 詳細は支援室にご確認ください 申請する書類および資料は 事前に E-mail に添付して支援室にお送りください 内容の確認をし ご連絡させて頂きます
製造販売後調査実施の手続き はじめに 本書は 昭和大学藤が丘病院における製造販売後調査実施の手続き方法等について記載したものです 本書内のは当院が提供する書類を示し は審査等に必要な書類を示しております 調査内容により提出書類 資料に変更が生じる場合があります 詳細は支援室にご確認ください 申請する書類および資料は 事前に E-mail に添付して支援室にお送りください 内容の確認をし ご連絡させて頂きます
治験実施に必要な手続きについて (HP 用 ) 治験 製造販売後臨床試験 聖マリアンナ医科大学病院治験管理室 聖マリアンナ医科大学病院治験管理室 2011 年 10 月作成 2013 年 1 月改訂 2014 年 4 月改訂 2018 年 4 月改定 2018 年 5 月改定 Ⅰ. 治験審査委員会
 治験実施に必要な手続きについて (HP 用 ) 治験 製造販売後臨床試験 2011 年 10 月作成 2013 年 1 月改訂 2014 年 4 月改訂 2018 年 4 月改定 2018 年 5 月改定 Ⅰ. 治験審査委員会 (IRB) と連絡先 治験審査委員会名称 治験審査委員会設置者 聖マリアンナ医科大学附属病院等治験審査委員会 St. Marianna University Group Institutional
治験実施に必要な手続きについて (HP 用 ) 治験 製造販売後臨床試験 2011 年 10 月作成 2013 年 1 月改訂 2014 年 4 月改訂 2018 年 4 月改定 2018 年 5 月改定 Ⅰ. 治験審査委員会 (IRB) と連絡先 治験審査委員会名称 治験審査委員会設置者 聖マリアンナ医科大学附属病院等治験審査委員会 St. Marianna University Group Institutional
12_モニタリングの実施に関する手順書
 12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
国立病院機構大阪医療センター受託研究取扱細則
 国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
第 4 章治験責任医師の業務 目次 1. 目的と適用範囲 1 2. 治験責任医師の要件 1 3. 治験実施計画書の遵守に関する合意 1 4. 同意説明文書の作成 1 5. 治験分担医師及び治験協力者のリストの作成 2 6. 治験の実施依頼 ( 新規 変更 継続 ) 3 7. 治験の実施等の了承 3
 第 4 章 治験責任医師の業務 第 4 章治験責任医師の業務 目次 1. 目的と適用範囲 1 2. 治験責任医師の要件 1 3. 治験実施計画書の遵守に関する合意 1 4. 同意説明文書の作成 1 5. 治験分担医師及び治験協力者のリストの作成 2 6. 治験の実施依頼 ( 新規 変更 継続 ) 3 7. 治験の実施等の了承 3 8. 治験の契約 3 9. 被験者の選定 3 10. 被験者の同意の取得
第 4 章 治験責任医師の業務 第 4 章治験責任医師の業務 目次 1. 目的と適用範囲 1 2. 治験責任医師の要件 1 3. 治験実施計画書の遵守に関する合意 1 4. 同意説明文書の作成 1 5. 治験分担医師及び治験協力者のリストの作成 2 6. 治験の実施依頼 ( 新規 変更 継続 ) 3 7. 治験の実施等の了承 3 8. 治験の契約 3 9. 被験者の選定 3 10. 被験者の同意の取得
(Ver
 治験手続き要領 担当者連絡先 治験事務局 治験審査委員会事務局 : TEL (092) 801-1011 ( 内線 2796 2797) 企業治験 医師主導治験 臨床研究支援センター浦塚正伸, 室長山口賢二 E mail : rinshou@adm.fukuoka-u.ac.jp 臨床研究支援センター室長山口賢二 E mail : rinshou@adm.fukuoka-u.ac.jp 保険外併用療養費支給対象外費用の請求臨床研究支援センター堂園伸代
治験手続き要領 担当者連絡先 治験事務局 治験審査委員会事務局 : TEL (092) 801-1011 ( 内線 2796 2797) 企業治験 医師主導治験 臨床研究支援センター浦塚正伸, 室長山口賢二 E mail : rinshou@adm.fukuoka-u.ac.jp 臨床研究支援センター室長山口賢二 E mail : rinshou@adm.fukuoka-u.ac.jp 保険外併用療養費支給対象外費用の請求臨床研究支援センター堂園伸代
治験審査委員会手順書 平成 27 年 10 月 1 日 医療法人新光会
 治験審査委員会手順書 平成 27 年 10 月 1 日 医療法人新光会 第 1 条 ( 目的 ) 1. 本手順書は 新光会治験審査委員会 ( 以下 委員会という ) において 医薬品及び医療機器 ( 以下 医薬品等という ) の治験の調査審議を実施するに当たり 薬事法 ( 昭和 35 年 8 月 10 日法律第 145 号 ) に基づく 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3
治験審査委員会手順書 平成 27 年 10 月 1 日 医療法人新光会 第 1 条 ( 目的 ) 1. 本手順書は 新光会治験審査委員会 ( 以下 委員会という ) において 医薬品及び医療機器 ( 以下 医薬品等という ) の治験の調査審議を実施するに当たり 薬事法 ( 昭和 35 年 8 月 10 日法律第 145 号 ) に基づく 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3
治験は、医薬品として未だ認められていない物質を人(被験者)に投与して、有効性、安全性等を検討する臨床試験のことであり、新薬の承認申請資料の作成を目的としています
 このページでは 名古屋大学医学部附属病院において治験を実施する場合の手順を紹介しています ご不明な点がありましたら 臨床治験管理センターまでお問い合わせ下さい 治験責任医師の基本的な責務 治験責任医師は 治験に関連する医療上のすべての判断に責任を負う (GCP 第 45 条第 3 4 項 ) 治験責任医師は 治験依頼者と合意した治験実施計画書を遵守する (GCP 第 46 条第 1 項 ) 治験責任医師は
このページでは 名古屋大学医学部附属病院において治験を実施する場合の手順を紹介しています ご不明な点がありましたら 臨床治験管理センターまでお問い合わせ下さい 治験責任医師の基本的な責務 治験責任医師は 治験に関連する医療上のすべての判断に責任を負う (GCP 第 45 条第 3 4 項 ) 治験責任医師は 治験依頼者と合意した治験実施計画書を遵守する (GCP 第 46 条第 1 項 ) 治験責任医師は
実施医療機関治験審査委員会標準的業務手順書
 地方独立行政法人静岡市立静岡病院 治験審査委員会標準業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 及び医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器
地方独立行政法人静岡市立静岡病院 治験審査委員会標準業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 及び医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器
依頼者様
 2080530 治験実施に必要な手続き 治験依頼者様 船橋市立医療センターの治験管理室は 治験事務局 と 治験審査委員会事務局 を兼務しています 治験実施を依頼又は依頼を検討される際には 下記治験管理室へご連絡ください 治験管理室 273-8588 千葉県船橋市金杉 -2- TEL:047-438-332( 内線 :20) FAX:047-438-7223( 直通 ) e-mail:chiken@mmc.funabashi.chiba.jp
2080530 治験実施に必要な手続き 治験依頼者様 船橋市立医療センターの治験管理室は 治験事務局 と 治験審査委員会事務局 を兼務しています 治験実施を依頼又は依頼を検討される際には 下記治験管理室へご連絡ください 治験管理室 273-8588 千葉県船橋市金杉 -2- TEL:047-438-332( 内線 :20) FAX:047-438-7223( 直通 ) e-mail:chiken@mmc.funabashi.chiba.jp
治験実施規程
 京都市立病院 治験実施要綱 平成 25 年 9 月 2 日 ( 第 7 版 ) 目次 第 Ⅰ 章総則 1 第 1 条 ( 目的 ) 1 第 2 条 ( 治験に関する原則事項 ) 1 第 3 条 ( 用語 ) 2 第 4 条 ( 秘密の保全 ) 2 第 5 条 ( 直接閲覧 ) 2 第 Ⅱ 章院長 2 第 6 条 ( 治験実施体制の構築 ) 2 第 7 条 ( 治験の受託 ) 3 第 8 条 ( 治験の継続
京都市立病院 治験実施要綱 平成 25 年 9 月 2 日 ( 第 7 版 ) 目次 第 Ⅰ 章総則 1 第 1 条 ( 目的 ) 1 第 2 条 ( 治験に関する原則事項 ) 1 第 3 条 ( 用語 ) 2 第 4 条 ( 秘密の保全 ) 2 第 5 条 ( 直接閲覧 ) 2 第 Ⅱ 章院長 2 第 6 条 ( 治験実施体制の構築 ) 2 第 7 条 ( 治験の受託 ) 3 第 8 条 ( 治験の継続
実施医療機関治験審査委員会標準的業務手順書
 実施医療機関治験審査委員会標準業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器 GCP 省令 という
実施医療機関治験審査委員会標準業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器 GCP 省令 という
製造販売後調査事務手続き等 について
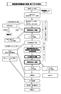 製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
静岡県立静岡がんセンター臨床研究事務局の業務手順書
 治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
3 治験実施計画書目的 当該治験について 治験実施計画書が手順書に従い適切に作成及び改訂されていることを確認する 次の事項を調べる (1) 治験実施計画書の記載項目 ( 再生医療等製品 GCP 省令第 7 条第 1 項に規定する項目 ) (2) 治験実施計画書の作成 改訂の手順と日付 (3) 治験計
 別添 10 再生医療等製品 GCP 省令チェックリスト Ⅰ 治験依頼者 ( 受託機関を含む ) 用 1 組織及び体制目的 治験の依頼及び管理に当たって 再生医療等製品 GCP 省令に沿った業務を行うために適切にして十分な人材を有し かつ 組織及び体制が確立していることを確認する 1 治験依頼者の組織 ( 当該被験機器の開発組織を含む ) と再生医療等製品 G CP 省令に係わる組織との関係 2 治験の依頼及び管理の業務に従事する者の氏名
別添 10 再生医療等製品 GCP 省令チェックリスト Ⅰ 治験依頼者 ( 受託機関を含む ) 用 1 組織及び体制目的 治験の依頼及び管理に当たって 再生医療等製品 GCP 省令に沿った業務を行うために適切にして十分な人材を有し かつ 組織及び体制が確立していることを確認する 1 治験依頼者の組織 ( 当該被験機器の開発組織を含む ) と再生医療等製品 G CP 省令に係わる組織との関係 2 治験の依頼及び管理の業務に従事する者の氏名
M. 旅行計画書 A. 1 申請の際には当院の標準業務手順書 契約書 ( 案 ) 覚書 ( 案 ) マニュアル等を熟読の上 目標症例数を責任医師と依頼者で十分協議 し 実施可能な症例数を申し込んでくだ 1 申請の際には当院の標準業務手順書 契約書 ( 案 ) マニュアル等を熟 読の上
 広島大学病院製造販売後医薬品調査マニュアル変更対比表 変更前 変更後 頁 項目等 Ver.6.20 2015 年 1 月 30 日 Ver.6.30 2017 年 2 月 27 日 (2015 年 2 月 1 日より適用 ) (2017 年 3 月 1 日より適用 ) 表紙 (ver.6.20) (ver.6.30) ver.6.30 2017 年 2 月 27 日 (2017 年 3 月 1 日より適用
広島大学病院製造販売後医薬品調査マニュアル変更対比表 変更前 変更後 頁 項目等 Ver.6.20 2015 年 1 月 30 日 Ver.6.30 2017 年 2 月 27 日 (2015 年 2 月 1 日より適用 ) (2017 年 3 月 1 日より適用 ) 表紙 (ver.6.20) (ver.6.30) ver.6.30 2017 年 2 月 27 日 (2017 年 3 月 1 日より適用
神戸市立医療センター西市民病院治験審査委員会業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関
 神戸市立医療センター西市民病院治験審査委員会 標準業務手順書 目次 第 1 章治験審査委員会 目的と適用範囲 1 治験審査委員会の責務 1 治験審査委員会の設置及び構成 1 治験審査委員会の業務 2 治験審査委員会の運営 4 第 2 章治験審査委員会事務局治験審査委員会事務局の業務 6 第 3 章記録の保存記録の保存責任者 6 記録の保存期間 6 手順書の改訂 7 第 4 章情報公開会議の記録等の公表
神戸市立医療センター西市民病院治験審査委員会 標準業務手順書 目次 第 1 章治験審査委員会 目的と適用範囲 1 治験審査委員会の責務 1 治験審査委員会の設置及び構成 1 治験審査委員会の業務 2 治験審査委員会の運営 4 第 2 章治験審査委員会事務局治験審査委員会事務局の業務 6 第 3 章記録の保存記録の保存責任者 6 記録の保存期間 6 手順書の改訂 7 第 4 章情報公開会議の記録等の公表
新規申請に関する手順書
 新規申請に関する手順書 - 新規申請から契約までの手順 - ( 改訂第 8 版 ) Ⅰ 目的 本手順書は 当院で実施する治験を申請する際の手続きを定めたものである Ⅱ 申請前の手順 1. 新規相談 ( 施設調査も含む ) (1) 相談受付 1) 治験依頼者又は自ら治験を実施する者 ( 以下 治験依頼者等 という ) は 臨床試験推進部にあらかじめ予約を入れ新規治験相談を行う a) 予約の受付時間 8
新規申請に関する手順書 - 新規申請から契約までの手順 - ( 改訂第 8 版 ) Ⅰ 目的 本手順書は 当院で実施する治験を申請する際の手続きを定めたものである Ⅱ 申請前の手順 1. 新規相談 ( 施設調査も含む ) (1) 相談受付 1) 治験依頼者又は自ら治験を実施する者 ( 以下 治験依頼者等 という ) は 臨床試験推進部にあらかじめ予約を入れ新規治験相談を行う a) 予約の受付時間 8
治 験 実 施 標 準 業 務 手 順 書
 治験審査委員会標準業務手順書 < 企業治験 > 横浜労災病院 目 次 第 1 章治験審査委員会 2 目的と適用範囲 2 治験審査委員会の責務 2 治験審査委員会の設置及び構成 2 治験審査委員会の業務 3 治験審査委員会の運営 5 第 2 章治験審査委員会事務局 6 治験審査委員会事務局の設置と業務 6 第 3 章記録の保存と公開 7 記録の保存責任者 7 記録の保存期間 7 記録の公開 8 1 第
治験審査委員会標準業務手順書 < 企業治験 > 横浜労災病院 目 次 第 1 章治験審査委員会 2 目的と適用範囲 2 治験審査委員会の責務 2 治験審査委員会の設置及び構成 2 治験審査委員会の業務 3 治験審査委員会の運営 5 第 2 章治験審査委員会事務局 6 治験審査委員会事務局の設置と業務 6 第 3 章記録の保存と公開 7 記録の保存責任者 7 記録の保存期間 7 記録の公開 8 1 第
実施医療機関における治験に係る標準的業務手順書
 静岡市立清水病院における治験に係る標準業務手順書 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器 GCP 省令
静岡市立清水病院における治験に係る標準業務手順書 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器 GCP 省令
<4D F736F F D2090BB91A294CC94848CE392B28DB8905C90BF8E9E92F18F6F8F9197DE82A882E682D1928D88D38E968D E48DEC90AC816A
 申請時提出書類 ( 新規 ) 医薬品等の製造販売後調査実施依頼申請書 様式第 1 ( 以下 依頼書 ) 医薬品等の製造販売後調査実施申請書 様式第 2 ( 以下 申請書 ) 医薬品等の製造販売後調査実施に関する通知書 ( 病院用 依頼者用 ) 様式第 3 様式第 4 ( 以下 通知書 ) 医薬品等の製造販売後調査実施契約書 ( 病院用 依頼者用 ) 様式第 5 様式第 5の2 ( 以下 契約書 )
申請時提出書類 ( 新規 ) 医薬品等の製造販売後調査実施依頼申請書 様式第 1 ( 以下 依頼書 ) 医薬品等の製造販売後調査実施申請書 様式第 2 ( 以下 申請書 ) 医薬品等の製造販売後調査実施に関する通知書 ( 病院用 依頼者用 ) 様式第 3 様式第 4 ( 以下 通知書 ) 医薬品等の製造販売後調査実施契約書 ( 病院用 依頼者用 ) 様式第 5 様式第 5の2 ( 以下 契約書 )
実施医療機関治験審査委員会標準的業務手順書
 静岡市立清水病院治験審査委員会標準業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器 GCP 省令 という
静岡市立清水病院治験審査委員会標準業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器 GCP 省令 という
ICH-GCPとJ-GCPとの比較表
 参考資料 10 我が国の GCP と ICH-GCP の主な 1 治験の契約に関する規定 1-1 契約者に関する規定 1-2 実施医療機関の長との契約を規定したことに伴う規定 2 治験審査委員会 (IRB) に関する規定 2-1 IRB の設置に関する規定 2-2 IRB への審議依頼に関する規定 1/11 1. 治験の契約に関する規定 1-1. 契約者に関する規定 ICH-GCP 1.17( 用語の定義
参考資料 10 我が国の GCP と ICH-GCP の主な 1 治験の契約に関する規定 1-1 契約者に関する規定 1-2 実施医療機関の長との契約を規定したことに伴う規定 2 治験審査委員会 (IRB) に関する規定 2-1 IRB の設置に関する規定 2-2 IRB への審議依頼に関する規定 1/11 1. 治験の契約に関する規定 1-1. 契約者に関する規定 ICH-GCP 1.17( 用語の定義
治験の原則
 大阪大学医学部附属病院 治験に係わる標準業務手順書 平成 26 年 1 月 1 日作成平成 26 年 4 月 1 日改訂平成 27 年 4 月 1 日改訂平成 29 年 4 月 1 日改訂平成 30 年 10 月 16 日改訂平成 30 年 12 月 16 日改訂 目 次 治験の原則 第 1 章目的と適用範囲第 1 条目的と適用範囲 第 2 章病院長の業務 第 2 条 治験の申請等 第 3 条 治験実施の了承等
大阪大学医学部附属病院 治験に係わる標準業務手順書 平成 26 年 1 月 1 日作成平成 26 年 4 月 1 日改訂平成 27 年 4 月 1 日改訂平成 29 年 4 月 1 日改訂平成 30 年 10 月 16 日改訂平成 30 年 12 月 16 日改訂 目 次 治験の原則 第 1 章目的と適用範囲第 1 条目的と適用範囲 第 2 章病院長の業務 第 2 条 治験の申請等 第 3 条 治験実施の了承等
独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版
 独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版 第 1 章総則 1. 目的と適用範囲この標準業務手順書は 独立行政法人国立病院機構仙台医療センターにおける医薬品の再審査申請 再評価申請の際に提出すべき資料の収集のための 使用成績調査 及び 特定使用成績調査
独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版 第 1 章総則 1. 目的と適用範囲この標準業務手順書は 独立行政法人国立病院機構仙台医療センターにおける医薬品の再審査申請 再評価申請の際に提出すべき資料の収集のための 使用成績調査 及び 特定使用成績調査
<4D F736F F D EA18CB182C98C5782E98EE88F878F915F8EC08E7B88E397C38B408AD F392E30816A2E646F63>
 JA 静岡厚生連静岡厚生病院における治験に係る標準業務手順書 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器 GCP
JA 静岡厚生連静岡厚生病院における治験に係る標準業務手順書 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日 厚生省令第 28 号 )( 以下 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令( 平成 17 年 3 月 23 日 厚生労働省令第 36 号 )( 以下 医療機器 GCP
治験手続きについて
 2 国立研究開発法人国立精神 神経医療研究センターにおける治験手続き要領 治験申込みは 治験審査依頼を希望する IRB の原則として 8 週間前が締切りです 当センター IRB は 毎月第 4 木曜に実施しています 新規申請の流れと必要な書類 1. 電話受付 新規申込み希望の場合は 治験主任 ( 内線 3783) へ電話連絡下さい その際に施設選定受入の日程 調整を行います 2. 施設選定受入 治験実施計画内容等の説明をお願いします
2 国立研究開発法人国立精神 神経医療研究センターにおける治験手続き要領 治験申込みは 治験審査依頼を希望する IRB の原則として 8 週間前が締切りです 当センター IRB は 毎月第 4 木曜に実施しています 新規申請の流れと必要な書類 1. 電話受付 新規申込み希望の場合は 治験主任 ( 内線 3783) へ電話連絡下さい その際に施設選定受入の日程 調整を行います 2. 施設選定受入 治験実施計画内容等の説明をお願いします
治験事務局標準業務マニュアル
 治験申請等に関する手順書 Ⅰ) 新規治験の申請 1. 実施体制 治験事務局院内スタッフが SMO との提携し 事務局を運営する なお SMO の費用は院内費用とは別に算定するため 別途相談とする CRC 院内スタッフを用いる場合 SMO を利用する場合 どちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され 責任医師との合意が文書で得られた時点で予約は可能とする
治験申請等に関する手順書 Ⅰ) 新規治験の申請 1. 実施体制 治験事務局院内スタッフが SMO との提携し 事務局を運営する なお SMO の費用は院内費用とは別に算定するため 別途相談とする CRC 院内スタッフを用いる場合 SMO を利用する場合 どちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され 責任医師との合意が文書で得られた時点で予約は可能とする
医療機関のの指示 決定に 医療機関のが 治験審査委員会の決定 関する文書 に基づく医療機関のの指示 決定を ( 治験に関する指 治験依頼者及びに通知す 示決定通知書 ) ( 治験審査委員会の通知文 る文書 書写しを含む ) 治験審査委員会の日付入り通知文書の 写し の業務内容に関 医療機関のがの業務
 必須文書保管管理 治験開始前 治験審査委員会の設置記録 医療機関のが 治験審査委員会 ( 同事 治験取扱要綱 務局を含む ) を設置したことを示す ( 第 5 条 ) 治験審査委員会委員の指名 治験審査委員会の設置者が治験審査委 治験審査委員会委 記録 員会の委員を指名した文書 員指名記録 治験審査委員会の運営に関 治験審査委員会の運営の手続き 及び記 治験審査委員会内 する文書 録の保存に関する事項を定めた文書
必須文書保管管理 治験開始前 治験審査委員会の設置記録 医療機関のが 治験審査委員会 ( 同事 治験取扱要綱 務局を含む ) を設置したことを示す ( 第 5 条 ) 治験審査委員会委員の指名 治験審査委員会の設置者が治験審査委 治験審査委員会委 記録 員会の委員を指名した文書 員指名記録 治験審査委員会の運営に関 治験審査委員会の運営の手続き 及び記 治験審査委員会内 する文書 録の保存に関する事項を定めた文書
規程書
 独立行政法人国立病院機構栃木医療センター 受託研究取扱規程 平成 25 年 4 月 1 日 独立行政法人国立病院機構栃木医療センター受託研究取 扱規程 ( 通則 ) 第 1 条独立行政法人国立病院機構栃木医療センター ( 以下 当院 という ) における国及びそれに準じる機関以外の者 ( 以下 依頼者 という ) から委託を受けて行う研究 ( 以下 受託研究 という ) の取扱いについては この規程定めるところによる
独立行政法人国立病院機構栃木医療センター 受託研究取扱規程 平成 25 年 4 月 1 日 独立行政法人国立病院機構栃木医療センター受託研究取 扱規程 ( 通則 ) 第 1 条独立行政法人国立病院機構栃木医療センター ( 以下 当院 という ) における国及びそれに準じる機関以外の者 ( 以下 依頼者 という ) から委託を受けて行う研究 ( 以下 受託研究 という ) の取扱いについては この規程定めるところによる
SOP(IRB有)1203版
 医療法人仁楡会 仁楡会病院 標準業務手順書 第 7 版 :( 西暦 )2014 年 8 月 14 日改訂 院長松村欣也 印 第 1 章 総則 1. 目的と適用範囲本標準業務手順書 ( 以下 本手順書 という ) は 当院において 医薬品の臨床試験の実施の基準に関する省令 ( 厚生省令第 28 号 平成 9 年 3 月 27 日 GCP 省令 ) 医療機器の臨床試験の実施の基準に関する省令 ( 厚生労働省令第
医療法人仁楡会 仁楡会病院 標準業務手順書 第 7 版 :( 西暦 )2014 年 8 月 14 日改訂 院長松村欣也 印 第 1 章 総則 1. 目的と適用範囲本標準業務手順書 ( 以下 本手順書 という ) は 当院において 医薬品の臨床試験の実施の基準に関する省令 ( 厚生省令第 28 号 平成 9 年 3 月 27 日 GCP 省令 ) 医療機器の臨床試験の実施の基準に関する省令 ( 厚生労働省令第
静岡県立静岡がんセンター臨床研究事務局の業務手順書
 治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 1 目次 1. 目的と適用範囲...
治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 1 目次 1. 目的と適用範囲...
日本医科大学付属第二病院治験標準業務手順書
 日本医科大学武蔵小杉病院 薬物治験審査委員会標準業務手順書 日本医科大学武蔵小杉病院 治験管理事務局 設定 :1998.4.1 改訂 :2005.9.1 :2006.4.1 :2010.7.1 :2012.9.1 :2014.1.1 :2015.12.1 :2016.3.1 :2018.10.1-1 - 日本医科大学武蔵小杉病院薬物治験審査委員会標準業務手順書 目次第 1 章薬物治験審査委員会 3
日本医科大学武蔵小杉病院 薬物治験審査委員会標準業務手順書 日本医科大学武蔵小杉病院 治験管理事務局 設定 :1998.4.1 改訂 :2005.9.1 :2006.4.1 :2010.7.1 :2012.9.1 :2014.1.1 :2015.12.1 :2016.3.1 :2018.10.1-1 - 日本医科大学武蔵小杉病院薬物治験審査委員会標準業務手順書 目次第 1 章薬物治験審査委員会 3
第1章 総則
 ( 第 1 章総則 ) 第 1 章総則 1. 治験実施に関する標準業務手順書 (SOP) 制定の目的医療法人防治会いずみの病院 ( 以下 当該医療機関 という ) において ヘルシンキ宣言に基づく倫理的原則及び薬事法第 14 条の第 3 項及び第 80 条の 2 の規定に基づき 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日厚生省令第 28 号 ) 医療機器の臨床試験の実施の基準に関する省令
( 第 1 章総則 ) 第 1 章総則 1. 治験実施に関する標準業務手順書 (SOP) 制定の目的医療法人防治会いずみの病院 ( 以下 当該医療機関 という ) において ヘルシンキ宣言に基づく倫理的原則及び薬事法第 14 条の第 3 項及び第 80 条の 2 の規定に基づき 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日厚生省令第 28 号 ) 医療機器の臨床試験の実施の基準に関する省令
京都府立医科大学附属病院
 治験費用の取扱に関する手順書 京都府立医科大学附属病院 第 1 版平成 21 年 11 月 16 日 第 2 版平成 23 年 3 月 16 日 第 3 版平成 25 年 2 月 1 日 1. 目的 本手順書は 京都府立医科大学附属病院治験実施取扱規定の定めるところにより 治験 費用の取り扱いに関する運用方法を定め それに基づく業務手順を示すものである 2. 治験に係る経費の範囲 (1) 治験経費
治験費用の取扱に関する手順書 京都府立医科大学附属病院 第 1 版平成 21 年 11 月 16 日 第 2 版平成 23 年 3 月 16 日 第 3 版平成 25 年 2 月 1 日 1. 目的 本手順書は 京都府立医科大学附属病院治験実施取扱規定の定めるところにより 治験 費用の取り扱いに関する運用方法を定め それに基づく業務手順を示すものである 2. 治験に係る経費の範囲 (1) 治験経費
医療機関における治験業務
 国立大学法人東京医科歯科大学医学部附属病院 治験等審査委員会標準手順書 東京医科歯科大学医学部附属病院 臨床試験管理センター 制定日 :2015 年 8 月 3 日 改訂日 : 年月日 目次 第 1 章治験等審査委員会 2 第 2 章治験等審査委員会事務局 7 第 3 章記録の保存 8 第 4 章調査 審議の受託 9 第 5 章その他 9-1 - 第 1 章治験等審査委員会 ( 目的と適用範囲 )
国立大学法人東京医科歯科大学医学部附属病院 治験等審査委員会標準手順書 東京医科歯科大学医学部附属病院 臨床試験管理センター 制定日 :2015 年 8 月 3 日 改訂日 : 年月日 目次 第 1 章治験等審査委員会 2 第 2 章治験等審査委員会事務局 7 第 3 章記録の保存 8 第 4 章調査 審議の受託 9 第 5 章その他 9-1 - 第 1 章治験等審査委員会 ( 目的と適用範囲 )
平成11年 10月 日
 広島大学病院製造販売後医薬品調査マニュアル (Ver.6.31) 使用成績調査 特定使用成績調査 副作用 感染症報告 作成 : 広島大学病院総合医療研究推進センター Ver.6.00 作成年月日 :2008 年 10 月 24 日 2008 年 11 月 1 日より適用 Ver.6.10 作成年月日 :2014 年 8 月 11 日 Ver.6.20 作成年月日 :2015 年 1 月 30 日 2015
広島大学病院製造販売後医薬品調査マニュアル (Ver.6.31) 使用成績調査 特定使用成績調査 副作用 感染症報告 作成 : 広島大学病院総合医療研究推進センター Ver.6.00 作成年月日 :2008 年 10 月 24 日 2008 年 11 月 1 日より適用 Ver.6.10 作成年月日 :2014 年 8 月 11 日 Ver.6.20 作成年月日 :2015 年 1 月 30 日 2015
川崎市水道局規程第 号
 川崎市立川崎病院治験取扱要綱 ( 要旨 ) 第 1 条川崎市立川崎病院 ( 川崎市病院事業の設置等に関する条例 ( 昭和 41 年川崎市条例第 42 号 ) 第 2 条第 2 項の表に規定する病院 以下 病院 という ) の医薬品等の臨床研究の実施については 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 以下 法 という ) 医薬品の臨床試験の実施の基準に関する省令
川崎市立川崎病院治験取扱要綱 ( 要旨 ) 第 1 条川崎市立川崎病院 ( 川崎市病院事業の設置等に関する条例 ( 昭和 41 年川崎市条例第 42 号 ) 第 2 条第 2 項の表に規定する病院 以下 病院 という ) の医薬品等の臨床研究の実施については 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 以下 法 という ) 医薬品の臨床試験の実施の基準に関する省令
<ヒアリング内容 > 1 依頼者からの説明 ( 概要書 プロトコールの要点 をそれぞれ10 分程度で ) ハンドアウト等の資料を準備すること 2 質疑 応答 ( 手順の確認を中心に ) 3 提出資料の確認 検討 修正指示 4その他 当該治験で検討を要する事項についての協議 保険外併用療養費の支給対象
 Ⅰ) 新規治験の申請 藤田医科大学病院治験申請等に関する手順書 1. 実施体制 治験事務局 SMO 費用は院内費用とは別に算定するため 別途相談とする 臨床研究コーディネーター (CRC) CRC は 院内または SMO のどちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され ( 治験届提出後 14 日 ( 初回届けの場合は 30 日 ) 経過したか否かは問わない
Ⅰ) 新規治験の申請 藤田医科大学病院治験申請等に関する手順書 1. 実施体制 治験事務局 SMO 費用は院内費用とは別に算定するため 別途相談とする 臨床研究コーディネーター (CRC) CRC は 院内または SMO のどちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され ( 治験届提出後 14 日 ( 初回届けの場合は 30 日 ) 経過したか否かは問わない
大阪府立成人病センター治験標準業務手順書(平成23年12月21日改正案)
 大阪国際がんセンター治験標準業務手順書 制定平成 10 年 4 月 1 日改訂平成 21 年 3 月 1 日改訂平成 21 年 5 月 20 日改訂平成 21 年 8 月 19 日改訂平成 22 年 2 月 15 日改訂平成 22 年 5 月 17 日改訂平成 24 年 2 月 1 日改訂平成 24 年 5 月 1 日改訂平成 25 年 4 月 1 日改訂平成 25 年 12 月 1 日改訂平成 27
大阪国際がんセンター治験標準業務手順書 制定平成 10 年 4 月 1 日改訂平成 21 年 3 月 1 日改訂平成 21 年 5 月 20 日改訂平成 21 年 8 月 19 日改訂平成 22 年 2 月 15 日改訂平成 22 年 5 月 17 日改訂平成 24 年 2 月 1 日改訂平成 24 年 5 月 1 日改訂平成 25 年 4 月 1 日改訂平成 25 年 12 月 1 日改訂平成 27
<4D F736F F D20362D318EA18CB190528DB888CF88F589EF8BC696B18EE88F878F912E646F63>
 独立行政法人国立病院機構敦賀医療センターにおける企業主導治験に係る治験審査委員会業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は当院における 受託研究取扱規程 及び 企業主導治験に係る標準業務手順書 に基づいて 企業主導治験に係る標準業務手順書第 12 条第 1 項の規定により院内に設置された治験審査委員会の運営に関する手続き及び記録の保存方法等を定めるものである
独立行政法人国立病院機構敦賀医療センターにおける企業主導治験に係る治験審査委員会業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は当院における 受託研究取扱規程 及び 企業主導治験に係る標準業務手順書 に基づいて 企業主導治験に係る標準業務手順書第 12 条第 1 項の規定により院内に設置された治験審査委員会の運営に関する手続き及び記録の保存方法等を定めるものである
Microsoft Word - 4月議事録概要
 平成 21 年 4 月 13 日 ( 月 ) 12:45 ~ 13:39 福岡リハビリテーション病院企画会議室副院長 脳神経外科部長 整形外科医師 形成外科医師看護部長 看護課長 管理部長 係長外部委員 2 名 審議事項 議題 1 扶桑薬品工業株式会社の依頼 [ 慢性非がん性疼痛を対象とした FTB-8127 の第 Ⅲ 相臨床試験 ] 治験薬概要書の改訂内容について 引き続き治験を実施することの妥当性について審議
平成 21 年 4 月 13 日 ( 月 ) 12:45 ~ 13:39 福岡リハビリテーション病院企画会議室副院長 脳神経外科部長 整形外科医師 形成外科医師看護部長 看護課長 管理部長 係長外部委員 2 名 審議事項 議題 1 扶桑薬品工業株式会社の依頼 [ 慢性非がん性疼痛を対象とした FTB-8127 の第 Ⅲ 相臨床試験 ] 治験薬概要書の改訂内容について 引き続き治験を実施することの妥当性について審議
第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品の臨床試験の実施の基準に関する省令 ; 平成 9 年厚生省令第 28 号 ( 以下 医薬品 GCP という ) 医療機器の臨床試験の実施の基準に関する省令 ; 平成 17 年厚生労働省令第 36 号 ( 以下 医療機器 G
 千葉大学医学部附属病院治験取扱手順書 ( 治験依頼者による治験 ) 治験の原則 治験は 次に掲げる原則に則って実施されなければならない 1. 治験は ヘルシンキ宣言に基づく倫理的原則及び GCP を遵守して行われなければならない 2. 治験を開始する前に 個々の被験者及び社会にとって期待される利益と予想される危険及び不便とを比較考量するものとする 期待される利益によって危険を冒すことが正当化される場合に限り
千葉大学医学部附属病院治験取扱手順書 ( 治験依頼者による治験 ) 治験の原則 治験は 次に掲げる原則に則って実施されなければならない 1. 治験は ヘルシンキ宣言に基づく倫理的原則及び GCP を遵守して行われなければならない 2. 治験を開始する前に 個々の被験者及び社会にとって期待される利益と予想される危険及び不便とを比較考量するものとする 期待される利益によって危険を冒すことが正当化される場合に限り
企業主導治験IRB標準業務手順書
 独立行政法人国立病院機構刀根山病院における 治験 受託研究審査委員会標準業務手順書 第 1 章治験 受託研究審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は当院における 受託研究取扱規程 企業主導治験に係る標準業務手順書 及び 受託研究に係る標準業務手順書 に基づいて 治験 受託研究審査委員会の運営に関する手続き及び記録の保存方法を定めるものである 2 製造販売後臨床試験に対しては 医薬品
独立行政法人国立病院機構刀根山病院における 治験 受託研究審査委員会標準業務手順書 第 1 章治験 受託研究審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は当院における 受託研究取扱規程 企業主導治験に係る標準業務手順書 及び 受託研究に係る標準業務手順書 に基づいて 治験 受託研究審査委員会の運営に関する手続き及び記録の保存方法を定めるものである 2 製造販売後臨床試験に対しては 医薬品
( 委員会の業務 ) 第 4 条委員会は その責務の遂行のために以下の最新資料を病院長から入手する なお あらかじめ 自ら治験を実施する者 委員会及び病院長の合意が得られている場合においては GCP 省令第 26 条の6 第 2 項に関する通知に限り 自ら治験を実施する者から入手することができる ま
 秋田大学医学部附属病院医師主導治験における治験審査委員会規程 第 1 章医師主導治験審査委員会 ( 目的と適用範囲 ) 第 1 条本規程は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 医薬品の臨床試験の実施の基準に関する省令( 平成 9 年 3 月 27 日厚生省令第 28 号 )( 以下 GCP 省令 という ) 並びにGCP 省令に関連する通知書等に基づいて
秋田大学医学部附属病院医師主導治験における治験審査委員会規程 第 1 章医師主導治験審査委員会 ( 目的と適用範囲 ) 第 1 条本規程は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 医薬品の臨床試験の実施の基準に関する省令( 平成 9 年 3 月 27 日厚生省令第 28 号 )( 以下 GCP 省令 という ) 並びにGCP 省令に関連する通知書等に基づいて
目次 第 1 章治験審査委員会... 3 ( 目的と適用範囲 )... 3 ( 治験審査委員会の責務 )... 3 ( 治験審査委員会の設置及び構成 )... 3 ( 治験審査委員会の業務 )... 4 ( 治験審査委員会の運営 )... 6 第 2 章治験審査委員会事務局... 8 ( 治験審査委
 治験審査委員会標準業務手順書 < 医師主導治験 > 横浜労災病院 目次 第 1 章治験審査委員会... 3 ( 目的と適用範囲 )... 3 ( 治験審査委員会の責務 )... 3 ( 治験審査委員会の設置及び構成 )... 3 ( 治験審査委員会の業務 )... 4 ( 治験審査委員会の運営 )... 6 第 2 章治験審査委員会事務局... 8 ( 治験審査委員会事務局の設置と業務 )... 8
治験審査委員会標準業務手順書 < 医師主導治験 > 横浜労災病院 目次 第 1 章治験審査委員会... 3 ( 目的と適用範囲 )... 3 ( 治験審査委員会の責務 )... 3 ( 治験審査委員会の設置及び構成 )... 3 ( 治験審査委員会の業務 )... 4 ( 治験審査委員会の運営 )... 6 第 2 章治験審査委員会事務局... 8 ( 治験審査委員会事務局の設置と業務 )... 8
<4D F736F F F696E74202D EA18CB18AD B68F9182C982A882AF82E993648EA593498B4C985E82CC8A C98AD682B782E98AEE967B93498D6C82A695FB817682CC82DC82C682DF817C8F4390B32E >
 治験関連文書における電磁的記録の 活用に関する基本的考え方 のまとめ JSQA GCP 部会特別プロジェクト 3 1 GCPにおいて 治験に係る様々な文書の交付及び保存が規定されていますが 治験関連業務の効率化として電磁的記録の更なる活用が期待されています これに伴い 平成 25 年 7 月 1 日に事務連絡 1) が発出され その後 平成 26 年 7 月 1 日に一部改正 された事務連絡 2)
治験関連文書における電磁的記録の 活用に関する基本的考え方 のまとめ JSQA GCP 部会特別プロジェクト 3 1 GCPにおいて 治験に係る様々な文書の交付及び保存が規定されていますが 治験関連業務の効率化として電磁的記録の更なる活用が期待されています これに伴い 平成 25 年 7 月 1 日に事務連絡 1) が発出され その後 平成 26 年 7 月 1 日に一部改正 された事務連絡 2)
<4D F736F F D2093D689EA88E397C3835A E815B8AE98BC68EE593B195578F808BC696B18EE88F878F BD90AC E378C8E313393FA89FC92F9816A2E646F6378>
 独立行政法人国立病院機構敦賀医療センターにおける 企業主導治験に係る業務手順書 第 1 章 目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本手順書は 独立行政法人国立病院機構敦賀医療センター受託研究取扱規程 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第 28 号 以下 医薬品 G CP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年厚生労働省令第
独立行政法人国立病院機構敦賀医療センターにおける 企業主導治験に係る業務手順書 第 1 章 目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本手順書は 独立行政法人国立病院機構敦賀医療センター受託研究取扱規程 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第 28 号 以下 医薬品 G CP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令 ( 平成 17 年厚生労働省令第
<4D F736F F D EA18CB18EE88F878F E C5816A>
 第 Ⅰ 部 札幌医科大学附属病院 治験及び製造販売後臨床試験に係る業務手順書 目次第 1 章総則 1 ( 総則 )... 1 ( 原則 )... 1 第 2 章病院長 2 ( 病院長の責務 )... 2 ( 治験実施の承認等 )... 2 ( 治験実施の契約等 )... 4 ( 治験の継続 )... 5 ( 治験実施計画書の変更 )... 5 ( 治験実施計画書からの逸脱 )... 5 ( 有害事象の発生
第 Ⅰ 部 札幌医科大学附属病院 治験及び製造販売後臨床試験に係る業務手順書 目次第 1 章総則 1 ( 総則 )... 1 ( 原則 )... 1 第 2 章病院長 2 ( 病院長の責務 )... 2 ( 治験実施の承認等 )... 2 ( 治験実施の契約等 )... 4 ( 治験の継続 )... 5 ( 治験実施計画書の変更 )... 5 ( 治験実施計画書からの逸脱 )... 5 ( 有害事象の発生
本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員
 ( 第 1 版 :2015 年 7 月 1 日 ) 本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員会の間での電子的記録の作成, 交付, 受領及び保存に用いるシステム規定や文書等で責任者の行うべき業務の権限を与えられ,
( 第 1 版 :2015 年 7 月 1 日 ) 本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員会の間での電子的記録の作成, 交付, 受領及び保存に用いるシステム規定や文書等で責任者の行うべき業務の権限を与えられ,
医療機関における治験業務
 国立大学法人東京医科歯科大学医学部附属病院 企業治験業務標準手順書 東京医科歯科大学医学部附属病院 臨床試験管理センター 制定日 :1998 年 3 月 27 日改訂日 :1998 年 7 月 21 日 改訂日 :1998 年 10 月 21 日改訂日 :1999 年 8 月 4 日 改訂日 :2001 年 6 月 6 日改訂日 :2003 年 6 月 19 日 改訂日 :2004 年 4 月 1
国立大学法人東京医科歯科大学医学部附属病院 企業治験業務標準手順書 東京医科歯科大学医学部附属病院 臨床試験管理センター 制定日 :1998 年 3 月 27 日改訂日 :1998 年 7 月 21 日 改訂日 :1998 年 10 月 21 日改訂日 :1999 年 8 月 4 日 改訂日 :2001 年 6 月 6 日改訂日 :2003 年 6 月 19 日 改訂日 :2004 年 4 月 1
( 書式 4), 治験責任医師の履歴書及び治験実施計画書等の審査の対象となる文書を委員会に提出し, 治験の実施について意見を求めるものとする 2 病院長は, 委員会が治験の実施を承認する決定をし, 又は治験実施計画書, 症例報告書, 説明文書及び同意書並びにその他の手順について何らかの修正を条件に治
 秋田大学医学部附属病院医薬品等の受託研究取扱細則 病 7-07 [ 制定 ] 平成 16 年 4 月 1 日 ( 趣旨と適用範囲 ) 第 1 条この細則は, 秋田大学医学部附属病院医薬品等の受託研究取扱規程第 15 条に基づき, 治験の実施に必要な手続きと運営に関する手順を定めるものとする 本細則の運用に関しては医薬品の臨床試験の実施に関する省令 ( 平成 9 年厚生省令第 28 号 以下 医薬品
秋田大学医学部附属病院医薬品等の受託研究取扱細則 病 7-07 [ 制定 ] 平成 16 年 4 月 1 日 ( 趣旨と適用範囲 ) 第 1 条この細則は, 秋田大学医学部附属病院医薬品等の受託研究取扱規程第 15 条に基づき, 治験の実施に必要な手続きと運営に関する手順を定めるものとする 本細則の運用に関しては医薬品の臨床試験の実施に関する省令 ( 平成 9 年厚生省令第 28 号 以下 医薬品
国立仙台病院受託研究取扱規程
 独立行政法人国立病院機構仙台医療センター受託研究取扱規程 ( 通則 ) 第 1 条独立行政法人国立病院機構仙台医療センター ( 以下 当院 という ) における国及びそれに準じる機関以外の者 ( 以下 依頼者 という ) から委託を受けて行う研究 ( 以下 受託研究 という ) の取扱いについては この規程の定めるところによる 2 契約 経理及び書式等については 原則として独立行政法人国立病院機構
独立行政法人国立病院機構仙台医療センター受託研究取扱規程 ( 通則 ) 第 1 条独立行政法人国立病院機構仙台医療センター ( 以下 当院 という ) における国及びそれに準じる機関以外の者 ( 以下 依頼者 という ) から委託を受けて行う研究 ( 以下 受託研究 という ) の取扱いについては この規程の定めるところによる 2 契約 経理及び書式等については 原則として独立行政法人国立病院機構
市立札幌病院治験に係わる業務手順書 治験の原則 治験は 次に掲げる原則に則って実施されなければならない 1. 治験は ヘルシンキ宣言に基づく倫理的原則及びGCPを遵守して行われなければならない (GCP: 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 以下薬機法とする ) 平成
 市立札幌病院治験に係わる業務手順書 市立札幌病院治験に係わる業務手順書 治験の原則 治験は 次に掲げる原則に則って実施されなければならない 1. 治験は ヘルシンキ宣言に基づく倫理的原則及びGCPを遵守して行われなければならない (GCP: 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 以下薬機法とする ) 平成 9 年厚生省令第 28 号 (GCP 省令 ) 平成 15 年厚生労働省令第
市立札幌病院治験に係わる業務手順書 市立札幌病院治験に係わる業務手順書 治験の原則 治験は 次に掲げる原則に則って実施されなければならない 1. 治験は ヘルシンキ宣言に基づく倫理的原則及びGCPを遵守して行われなければならない (GCP: 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 以下薬機法とする ) 平成 9 年厚生省令第 28 号 (GCP 省令 ) 平成 15 年厚生労働省令第
平成22年月1日要領第59号
 平成 22 年 4 月 1 日要領第 59 号 国立研究開発法人国立がん研究センター治験等に係わる標準業務手順書 第 1 版平成 22 年 4 月 1 日第 2 版平成 22 年 8 月 1 日第 3 版平成 22 年 10 月 1 日第 4 版平成 23 年 4 月 1 日第 5 版平成 24 年 4 月 1 日第 6 版平成 24 年 7 月 1 日第 7 版平成 25 年 4 月 1 日第 8
平成 22 年 4 月 1 日要領第 59 号 国立研究開発法人国立がん研究センター治験等に係わる標準業務手順書 第 1 版平成 22 年 4 月 1 日第 2 版平成 22 年 8 月 1 日第 3 版平成 22 年 10 月 1 日第 4 版平成 23 年 4 月 1 日第 5 版平成 24 年 4 月 1 日第 6 版平成 24 年 7 月 1 日第 7 版平成 25 年 4 月 1 日第 8
実施医療機関における治験に係る標準的業務手順書
 国立病院機構大阪医療センター 企業主導治験に係る業務細則 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本規程は 国立病院機構大阪医療センター受託研究取扱細則第 5 条に定める治験又は製造販売後臨床試験 ( 以下 治験等 という ) に関する研究の依頼 申請 契約並びに終了等 治験に関する書式とその取扱いについて定めるものとする 2 本細則は 平成 9 年 3 月 27 日厚生省令第
国立病院機構大阪医療センター 企業主導治験に係る業務細則 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本規程は 国立病院機構大阪医療センター受託研究取扱細則第 5 条に定める治験又は製造販売後臨床試験 ( 以下 治験等 という ) に関する研究の依頼 申請 契約並びに終了等 治験に関する書式とその取扱いについて定めるものとする 2 本細則は 平成 9 年 3 月 27 日厚生省令第
2 IRB 審査書類の作成 1. 必要部数 : 20 部 (1) 保管 事務処理用ア病院長保管用 1 部イ IRB 審査依頼用 1 部 (2)IRB 審査用ア委員配布用 10 部イ治験責任医師用 1 部ウ治験管理室員用 7 部 2. 提出書類内訳 ( 事務局担当者との摺り合わせが必要 ) (1) 試
 治験の手続きについて 治験実施までの手続き 1 治験相談 施設調査 1. 治験管理室来室依頼表を提出 治験管理室来室依頼票 にご記入の上 こちら (aokenchu_chiken@med.pref.aomori.jp) までお送りください 後日担当より 面談可能日をご回答差し上げます (1) 施設調査 でご来室の場合治験事務局が対応します 当院の治験実施体制をホームページ上に公開しておりますので ご来室までにご確認いただき
治験の手続きについて 治験実施までの手続き 1 治験相談 施設調査 1. 治験管理室来室依頼表を提出 治験管理室来室依頼票 にご記入の上 こちら (aokenchu_chiken@med.pref.aomori.jp) までお送りください 後日担当より 面談可能日をご回答差し上げます (1) 施設調査 でご来室の場合治験事務局が対応します 当院の治験実施体制をホームページ上に公開しておりますので ご来室までにご確認いただき
参考1
 独立行政法人国立病院機構北海道医療センターにおける 治験審査委員会標準業務手順書 ( 企業主導治験 ) 独立行政法人国立病院機構北海道医療センターにおける 企業主導治験に係る治験審査委員会標準業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は当院における 受託研究取扱規程 及び 企業主導治験に係る標準業務手順書 に基づいて 企業主導治験に係る標準業務手順書第 12 条第
独立行政法人国立病院機構北海道医療センターにおける 治験審査委員会標準業務手順書 ( 企業主導治験 ) 独立行政法人国立病院機構北海道医療センターにおける 企業主導治験に係る治験審査委員会標準業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は当院における 受託研究取扱規程 及び 企業主導治験に係る標準業務手順書 に基づいて 企業主導治験に係る標準業務手順書第 12 条第
長崎大学病院治験審査委員会内規 平成 21 年 4 月 1 日 病院内規第 3 号 ( 趣旨 ) 第 1 条この内規は, 長崎大学病院における医薬品の臨床試験の実施に関する内規 ( 以下 治験内規 という ) 第 4 条第 2 項, 長崎大学病院における医療機器の臨床試験の実施に関する内規 ( 以下
 長崎大学病院治験審査委員会内規 平成 21 年 4 月 1 日 病院内規第 3 号 ( 趣旨 ) 第 1 条この内規は, 長崎大学病院における医薬品の臨床試験の実施に関する内規 ( 以下 治験内規 という ) 第 4 条第 2 項, 長崎大学病院における医療機器の臨床試験の実施に関する内規 ( 以下 医療機器治験内規 という ) 第 4 条第 2 項及び長崎大学病院における再生医療等製品の臨床試験の実施に関する内規
長崎大学病院治験審査委員会内規 平成 21 年 4 月 1 日 病院内規第 3 号 ( 趣旨 ) 第 1 条この内規は, 長崎大学病院における医薬品の臨床試験の実施に関する内規 ( 以下 治験内規 という ) 第 4 条第 2 項, 長崎大学病院における医療機器の臨床試験の実施に関する内規 ( 以下 医療機器治験内規 という ) 第 4 条第 2 項及び長崎大学病院における再生医療等製品の臨床試験の実施に関する内規
本手順書の構成 第 1 章総則... 1 ( 治験の原則 )... 1 ( 目的と適用範囲 )... 2 第 2 章病院長の業務... 2 ( 組織の設置及び運営 )... 2 ( 治験依頼の申請等 )... 2 ( 治験実施の了承等 )... 4 ( 治験実施の契約等 )... 5 ( 契約内容の
 学校法人藤田学園 藤田医科大学病院 治験標準業務手順書 2.0 版作成日 2018 年 10 月 10 日 i 本手順書の構成 第 1 章総則... 1 ( 治験の原則 )... 1 ( 目的と適用範囲 )... 2 第 2 章病院長の業務... 2 ( 組織の設置及び運営 )... 2 ( 治験依頼の申請等 )... 2 ( 治験実施の了承等 )... 4 ( 治験実施の契約等 )... 5 (
学校法人藤田学園 藤田医科大学病院 治験標準業務手順書 2.0 版作成日 2018 年 10 月 10 日 i 本手順書の構成 第 1 章総則... 1 ( 治験の原則 )... 1 ( 目的と適用範囲 )... 2 第 2 章病院長の業務... 2 ( 組織の設置及び運営 )... 2 ( 治験依頼の申請等 )... 2 ( 治験実施の了承等 )... 4 ( 治験実施の契約等 )... 5 (
Ⅲ. 新規申請 1. 受付期間 : 毎月 31 日締め ( 事前に 申請日時 を下記申請窓口に必ずご連絡下さい ) 月末 (31 日 ) までに提出されたものが翌月の治験審査委員会で審査されます なお 3 月については原則として継続審査のみとなりますのでご了承ください 例 )7 月 1 日 ~7 月
 治験 製造販売後臨床試験 申請時提出書類等について I. 申請前に 1 原則として申請希望日の 2 週前までに事前ヒアリングを行いますので必ず予約を取って下さい (TEL)092-642-5924(ARO 次世代医療センター 治験事務局西田 ) 2 事前ヒアリング予約後 治験情報管理システム (Clinical Effort) の利用申込書 ( 九大書式 ) を 作成し FAX(092-642-5775)
治験 製造販売後臨床試験 申請時提出書類等について I. 申請前に 1 原則として申請希望日の 2 週前までに事前ヒアリングを行いますので必ず予約を取って下さい (TEL)092-642-5924(ARO 次世代医療センター 治験事務局西田 ) 2 事前ヒアリング予約後 治験情報管理システム (Clinical Effort) の利用申込書 ( 九大書式 ) を 作成し FAX(092-642-5775)
 独立行政法人国立病院機構 名古屋医療センター治験取扱規程 作成日 :2004.04.01 2004.10.01 2005.04.01 2005.07.01 2005.11.01 2006.05.01 2006.08.01 2007.04.02 2008.05.01 2009.03.02 2010.02.01 2012.04.01 2013.07.01 2015.03.13 2015.05.13 2016.12.07
独立行政法人国立病院機構 名古屋医療センター治験取扱規程 作成日 :2004.04.01 2004.10.01 2005.04.01 2005.07.01 2005.11.01 2006.05.01 2006.08.01 2007.04.02 2008.05.01 2009.03.02 2010.02.01 2012.04.01 2013.07.01 2015.03.13 2015.05.13 2016.12.07
大学病院治験受託手順書
 千葉大学医学部附属病院治験審査委員会運営手順書 第 1 条目的本手順書は 千葉大学医学部附属病院各種委員会規程の定めるところにより 千葉大学医学部附属病院治験審査委員会 ( 以下 委員会 という ) の運営方法を定め 医薬品等の治験 製造販売後調査および臨床試験等に関わる業務手順を示すものである 第 2 条委員会の責務 1 本委員会は 千葉大学医学部附属病院 ( 以下 本院 という ) において 治験及び製造販売後臨床試験
千葉大学医学部附属病院治験審査委員会運営手順書 第 1 条目的本手順書は 千葉大学医学部附属病院各種委員会規程の定めるところにより 千葉大学医学部附属病院治験審査委員会 ( 以下 委員会 という ) の運営方法を定め 医薬品等の治験 製造販売後調査および臨床試験等に関わる業務手順を示すものである 第 2 条委員会の責務 1 本委員会は 千葉大学医学部附属病院 ( 以下 本院 という ) において 治験及び製造販売後臨床試験
<4D F736F F F696E74202D20362E208EA18CB182F08EC08E7B82B782E988E397C38B408AD682C982A882AF82E997AF88D3935F2E B8CDD8AB B83685D>
 治験を実施する医療機関における留意点 1 本日の内容 1. 企業主導治験での事例と留意事項治験実施体制に関する事例と留意事項個別症例に関する事例と留意事項 2. 医師主導治験での事例と留意事項 2 本日の内容 1. 企業主導治験での事例と留意事項治験実施体制に関する事例と留意事項個別症例に関する事例と留意事項 3 GCP 実地調査では 治験に関する記録から 治験が 被験者の人権 安全 福祉の向上を図り
治験を実施する医療機関における留意点 1 本日の内容 1. 企業主導治験での事例と留意事項治験実施体制に関する事例と留意事項個別症例に関する事例と留意事項 2. 医師主導治験での事例と留意事項 2 本日の内容 1. 企業主導治験での事例と留意事項治験実施体制に関する事例と留意事項個別症例に関する事例と留意事項 3 GCP 実地調査では 治験に関する記録から 治験が 被験者の人権 安全 福祉の向上を図り
Ⅲ 治験に係る直接費用と間接費用 ( 但し 治験検討会議出席に係る旅費については 下記 Ⅳにて記載する ) 1. 算出方法 (1) 治験に係る経費設定( 表 1) に従い費用を算出する 2. 覚書の作成と請求方法 (1) 治験契約の際 病院長と治験依頼者は 治験契約書 ( 別記様式第 12 号第 3
 治験費用に関する手順書 ( 改訂第 5 版 ) Ⅰ 目的 本手順書は 当院で実施される治験費用の事務手続き方法を定めたものである Ⅱ 治験に係る経費の範囲 1. 治験に係る直接費用 間接費用 及び治験検討会議出席に係る指導料 ( 表 1) (1) 直接費用 1) 研究費 2) 治験検討会議出席に係る旅費 3) 治験審査委員会外部委員の講師指導 4) 治験に関し雇用したアルバイト賃金及び備品費 5)
治験費用に関する手順書 ( 改訂第 5 版 ) Ⅰ 目的 本手順書は 当院で実施される治験費用の事務手続き方法を定めたものである Ⅱ 治験に係る経費の範囲 1. 治験に係る直接費用 間接費用 及び治験検討会議出席に係る指導料 ( 表 1) (1) 直接費用 1) 研究費 2) 治験検討会議出席に係る旅費 3) 治験審査委員会外部委員の講師指導 4) 治験に関し雇用したアルバイト賃金及び備品費 5)
操作マニュアル(ユーザ画面)
 (Document Receive and Safety Information management System) 操作マニュアル 株式会社ファイブリングス Ver.1.1 作成日 2016 年 4 月 1 日 DRaSIS について I. 本システムの概略 本システムは 治験関連文書及び安全性情報の共有及び一元管理を目的としたクラウドシステムです ダウンロード 治験調整委員会事務局 受信確認
(Document Receive and Safety Information management System) 操作マニュアル 株式会社ファイブリングス Ver.1.1 作成日 2016 年 4 月 1 日 DRaSIS について I. 本システムの概略 本システムは 治験関連文書及び安全性情報の共有及び一元管理を目的としたクラウドシステムです ダウンロード 治験調整委員会事務局 受信確認
Microsoft Word - 儻師主尔治é¨fiㆫ俇㇉樎溌æ¥�å‰Žæ›‰é€ƒæł¸( )
 国立研究開発法人国立長寿医療研究センターにおける 医師主導治験に係る標準業務手順書 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 医薬品の臨床試験の実施の基準に関する省令( 平成 9 年厚生省令第 28 号 )( 以下 医薬品 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令
国立研究開発法人国立長寿医療研究センターにおける 医師主導治験に係る標準業務手順書 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 医薬品の臨床試験の実施の基準に関する省令( 平成 9 年厚生省令第 28 号 )( 以下 医薬品 GCP 省令 という ) 医療機器の臨床試験の実施の基準に関する省令
宮城県立がんセンター受託研究業務手順書
 平成 26 年 4 月 1 日一部改正使用成績調査 特定使用成績調査編 本編は 薬事法第 14 条の 4 及び第 14 条の 6 に基づく医薬品及び医療機器の再審査 再評価申請の際に提出すべき資料の収集のために行われる製造販売後調査 ( 使用成績調査及び特定使用成績調査 )( 以下 使用成績調査等 ) に適用するものとする 本編は 薬事法第 14 条の 4 第 4 項 薬事法第 14 条の 6 第
平成 26 年 4 月 1 日一部改正使用成績調査 特定使用成績調査編 本編は 薬事法第 14 条の 4 及び第 14 条の 6 に基づく医薬品及び医療機器の再審査 再評価申請の際に提出すべき資料の収集のために行われる製造販売後調査 ( 使用成績調査及び特定使用成績調査 )( 以下 使用成績調査等 ) に適用するものとする 本編は 薬事法第 14 条の 4 第 4 項 薬事法第 14 条の 6 第
医師主導治験取扱要覧
 9. 安全性情報の取扱いに関する手順書 1. 目的及び適用範囲 本手順書は 安全性情報の取扱いに係る用語の定義を定め 当該治験に関与する者が 安全性情報を適 切に取扱うための手順その他必要な事項を定めるものである 2. 用語の定義等 2.1. 用語の定義 2.1.1. 治験責任医師等 本手順書は 自ら治験を実施する者を 治験責任医師 と記載し また 治験責任医師及び治験分担医師 を併せて 治験責任医師等
9. 安全性情報の取扱いに関する手順書 1. 目的及び適用範囲 本手順書は 安全性情報の取扱いに係る用語の定義を定め 当該治験に関与する者が 安全性情報を適 切に取扱うための手順その他必要な事項を定めるものである 2. 用語の定義等 2.1. 用語の定義 2.1.1. 治験責任医師等 本手順書は 自ら治験を実施する者を 治験責任医師 と記載し また 治験責任医師及び治験分担医師 を併せて 治験責任医師等
2) 治験薬概要書 (GCP 省令第 15 条の5 第 2 項の規定により改訂されたものを含む ) 3) 症例報告書の見本 ( 治験実施計画書において 症例報告書に記載すべき事項が十分に読み取れる場合は 当該治験実施計画書をもって症例報告書の見本に関する事項を含む ) 4) 説明文書 同意文書 (
 秋田大学医学部附属病院医師主導治験取扱規程 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本規程は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 医薬品の臨床試験の実施の基準に関する省令( 平成 9 年 3 月 27 日厚生省令第 28 号 )( 以下 GCP 省令 という ) 並びにGCP 省令に関連する通知書等に基づいて
秋田大学医学部附属病院医師主導治験取扱規程 第 1 章目的と適用範囲 ( 目的と適用範囲 ) 第 1 条本規程は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 医薬品の臨床試験の実施の基準に関する省令( 平成 9 年 3 月 27 日厚生省令第 28 号 )( 以下 GCP 省令 という ) 並びにGCP 省令に関連する通知書等に基づいて
一
 医師主導治験の取り扱いに関する標準業務手順書 公立大学法人大阪市立大学 医学部附属病院 12 版 :2018 年 4 月 1 日 OCUMC-102 医師主導治験の取り扱いに関する標準業務手順書 12 版 OCUMC-102 医師主導治験の取り扱いに関する標準業務手順書 12 版 目次 治験の原則... 1 第 1 章目的と適用範囲... 2 ( 目的と適用範囲 )... 2 第 2 章組織...
医師主導治験の取り扱いに関する標準業務手順書 公立大学法人大阪市立大学 医学部附属病院 12 版 :2018 年 4 月 1 日 OCUMC-102 医師主導治験の取り扱いに関する標準業務手順書 12 版 OCUMC-102 医師主導治験の取り扱いに関する標準業務手順書 12 版 目次 治験の原則... 1 第 1 章目的と適用範囲... 2 ( 目的と適用範囲 )... 2 第 2 章組織...
目次 Ⅰ. はじめに からのお願い 開始から終了までの流れ... 4 Ⅱ. 新規申込みの提出資料 書類について 使用成績調査 特定使用成績調査 ) 審査ファイル (A4 判 ) について 副作用 感染症症例報告
 製造販売後調査の申し込み手続き 使用成績調査特定使用成績調査 副作用 感染症症例報告 - 調 1 / 11- 目次 Ⅰ. はじめに... 3 1. からのお願い... 3 2. 開始から終了までの流れ... 4 Ⅱ. 新規申込みの提出資料 書類について... 5 1. 使用成績調査 特定使用成績調査... 5 1) 審査ファイル (A4 判 ) について... 5 2. 副作用 感染症症例報告...
製造販売後調査の申し込み手続き 使用成績調査特定使用成績調査 副作用 感染症症例報告 - 調 1 / 11- 目次 Ⅰ. はじめに... 3 1. からのお願い... 3 2. 開始から終了までの流れ... 4 Ⅱ. 新規申込みの提出資料 書類について... 5 1. 使用成績調査 特定使用成績調査... 5 1) 審査ファイル (A4 判 ) について... 5 2. 副作用 感染症症例報告...
 治験責任医師のための 治験実施チェックリスト 平成 24 年 4 月版 日本製薬工業協会医薬品評価委員会 臨床評価部会治験啓発チーム Ver.3 はじめに 日夜 世界中の製薬企業では病気の原因を解明するための研究をしています 医薬品の開発は その病気の原因に対して 効果があると推定される新しい化合物を合成したり 天然に存在している物質から抽出したりすることから始まります そのようにしてできた化合物類は
治験責任医師のための 治験実施チェックリスト 平成 24 年 4 月版 日本製薬工業協会医薬品評価委員会 臨床評価部会治験啓発チーム Ver.3 はじめに 日夜 世界中の製薬企業では病気の原因を解明するための研究をしています 医薬品の開発は その病気の原因に対して 効果があると推定される新しい化合物を合成したり 天然に存在している物質から抽出したりすることから始まります そのようにしてできた化合物類は
医師主導治験実施医療機関を対象とした調査協力のお願い Ver 医師主導治験における治験調整事務局業務の標準化 効率化に関する研究 班へのご協力をいただき ありがとうございます 本研究班では 医師主導治験を実施する医療機関において 準備や実施に役立つ教育コンテンツやモデル標準業務手順
 医師主導治験実施医療機関を対象とした調査協力のお願い 医師主導治験における治験調整事務局業務の標準化 効率化に関する研究 班へのご協力をいただき ありがとうございます 本研究班では 医師主導治験を実施する医療機関において 準備や実施に役立つ教育コンテンツやモデル標準業務手順書 ロードマップなどを作成し 公開することを目指しています 本調査では 医師主導治験の現状やニーズに沿った成果物を提供するため
医師主導治験実施医療機関を対象とした調査協力のお願い 医師主導治験における治験調整事務局業務の標準化 効率化に関する研究 班へのご協力をいただき ありがとうございます 本研究班では 医師主導治験を実施する医療機関において 準備や実施に役立つ教育コンテンツやモデル標準業務手順書 ロードマップなどを作成し 公開することを目指しています 本調査では 医師主導治験の現状やニーズに沿った成果物を提供するため
臨床研究に関する標準業務手順書
 臨床研究に関する標準業務手順書 2018/04/01 第 15 版 改定履歴 日付 版 改定理由 改定箇所 内容 2010/02/06 1 新規制定 2010/04/14 2 COI 関連手順の明確化 フローチャートに COI に関する手順の追記 2010/08/19 3 様式 必要書類の追加 COI 関連様式の追記 安全性に関する報告の手順および様式 ( 様式 11) の追加 委託研究に関する手順
臨床研究に関する標準業務手順書 2018/04/01 第 15 版 改定履歴 日付 版 改定理由 改定箇所 内容 2010/02/06 1 新規制定 2010/04/14 2 COI 関連手順の明確化 フローチャートに COI に関する手順の追記 2010/08/19 3 様式 必要書類の追加 COI 関連様式の追記 安全性に関する報告の手順および様式 ( 様式 11) の追加 委託研究に関する手順
<4D F736F F F696E74202D208EA18CB B90B389BB8DEC8BC694C F E B93C782DD8EE682E890EA97705D205B8CDD8AB
 治験等適正化作業班における 検討 独立行政法人国立病院機構本部伊藤澄信 第 6 回治験中核病院 拠点医療機関等協議会 本日の内容 設置の経緯等について 主な検討内容について 今後の課題について その他 1 設置の経緯 (1) 1. 設置の背景 新たな治験活性化 5 カ年計画の中間見直しに関する検討会 報告の 重点的取組事項 ( アクションプラン ) の進捗 において 今後 取組みをより加速かつ強化すべき課題
治験等適正化作業班における 検討 独立行政法人国立病院機構本部伊藤澄信 第 6 回治験中核病院 拠点医療機関等協議会 本日の内容 設置の経緯等について 主な検討内容について 今後の課題について その他 1 設置の経緯 (1) 1. 設置の背景 新たな治験活性化 5 カ年計画の中間見直しに関する検討会 報告の 重点的取組事項 ( アクションプラン ) の進捗 において 今後 取組みをより加速かつ強化すべき課題
untitled
 1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
企業登録の更新 1. メインメニュー の 有効期限の更新 ( 期限 30 日前から手続可能 ) をします 有効期限切れまでの日数を警告 2. 登録申請書を作成する をし 企業情報に変更がなければ ( 変更がある場合は修正し ) 署名者 ( サイナー ) 登録リストへ をします 1 登録申請書を作成す
 発給システムにおける 企業登録の更新 / 変更および署名者 ( サイナー ) の変更 / 追加 / 削除 操作説明書 目 次 企業登録の更新 2 企業情報の変更 5 署名者 ( サイナー ) の変更 9 署名者 ( サイナー ) の追加 削除 13 2018 年 11 月日本商工会議所 1 企業登録の更新 1. メインメニュー の 有効期限の更新 ( 期限 30 日前から手続可能 ) をします 有効期限切れまでの日数を警告
発給システムにおける 企業登録の更新 / 変更および署名者 ( サイナー ) の変更 / 追加 / 削除 操作説明書 目 次 企業登録の更新 2 企業情報の変更 5 署名者 ( サイナー ) の変更 9 署名者 ( サイナー ) の追加 削除 13 2018 年 11 月日本商工会議所 1 企業登録の更新 1. メインメニュー の 有効期限の更新 ( 期限 30 日前から手続可能 ) をします 有効期限切れまでの日数を警告
特定臨床研究に関する手順書
 学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
1998
 新潟県立中央病院医療機器製造販売後調査及び臨床研究取扱い要領 2012.7.5 (1) 製造販売後調査及び臨床研究の対象医療機器は 当院採用の医療機器に限るものとする 当該医療機器は保険適用内で使用し 医薬品の市販後調査の基準に関する省令 ( 平成 9 年 3 月 10 日厚生省令第 10 号 :GPMSP 省令 (Good Post-marketing Surveillance Practice)
新潟県立中央病院医療機器製造販売後調査及び臨床研究取扱い要領 2012.7.5 (1) 製造販売後調査及び臨床研究の対象医療機器は 当院採用の医療機器に限るものとする 当該医療機器は保険適用内で使用し 医薬品の市販後調査の基準に関する省令 ( 平成 9 年 3 月 10 日厚生省令第 10 号 :GPMSP 省令 (Good Post-marketing Surveillance Practice)
改正履歴 版番号改訂日改正内容 初版 1991/4/1 NA( 治験薬等臨床試験取扱要綱 ) 第 2.0 版 1994/4/1 第 2.1 版 1997/4/1 細則廃止 第 3.0 版 1998/4/1 第 4.0 版 2000/4/1 名称改正 : 昭和大学病院における臨床試験取扱規程改廃方法変
 臨床研究 ( 治験 / 臨床試験等 ) 標準業務手順書 改訂日 : 2015 年 10 月 1 日 版番号 : 第 12 版 承認日 : 2015 年 9 月 17 日 承認者 : 病院長有賀徹 医療機関名 : 昭和大学病院 1 改正履歴 版番号改訂日改正内容 初版 1991/4/1 NA( 治験薬等臨床試験取扱要綱 ) 第 2.0 版 1994/4/1 第 2.1 版 1997/4/1 細則廃止
臨床研究 ( 治験 / 臨床試験等 ) 標準業務手順書 改訂日 : 2015 年 10 月 1 日 版番号 : 第 12 版 承認日 : 2015 年 9 月 17 日 承認者 : 病院長有賀徹 医療機関名 : 昭和大学病院 1 改正履歴 版番号改訂日改正内容 初版 1991/4/1 NA( 治験薬等臨床試験取扱要綱 ) 第 2.0 版 1994/4/1 第 2.1 版 1997/4/1 細則廃止
国立がんセンター受託研究取扱規程
 平成 22 年 4 月 1 日規程第 31 号 国立研究開発法人国立がん研究センター受託研究取扱規程 第 1 版平成 22 年 4 月 1 日第 2 版平成 22 年 10 月 1 日第 3 版平成 23 年 4 月 1 日第 4 版平成 24 年 4 月 1 日第 5 版平成 24 年 7 月 1 日第 6 版平成 25 年 4 月 1 日第 7 版平成 27 年 4 月 1 日 ( 通則 ) 第
平成 22 年 4 月 1 日規程第 31 号 国立研究開発法人国立がん研究センター受託研究取扱規程 第 1 版平成 22 年 4 月 1 日第 2 版平成 22 年 10 月 1 日第 3 版平成 23 年 4 月 1 日第 4 版平成 24 年 4 月 1 日第 5 版平成 24 年 7 月 1 日第 6 版平成 25 年 4 月 1 日第 7 版平成 27 年 4 月 1 日 ( 通則 ) 第
治験関連文書を電磁的記録として扱う際に確認すべきチェックリスト ( 第 2 版 ) 番号 必須 授受 保存 確認内容チェック項目メモ欄 ( 協議事項を記載する ) 備考 主な確認資料及びその版数 / 制定日 1. 長崎大学病院治験審査委員会に係る電子化に関する要項 ( 平成 26 年 2 月 10
 主な確認資料及びその版数 / 制定日 1. 長崎大学病院治験審査委員会に係る電子化に関する要項 ( 平成 26 年 2 月 10 日 ) 2. 3. 4. 5. 同じ確認資料を複数回利用する場合は本メモ欄に記載し 各項目にはの記載ののみでよい 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認
主な確認資料及びその版数 / 制定日 1. 長崎大学病院治験審査委員会に係る電子化に関する要項 ( 平成 26 年 2 月 10 日 ) 2. 3. 4. 5. 同じ確認資料を複数回利用する場合は本メモ欄に記載し 各項目にはの記載ののみでよい 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認
先進医療の実績報告要領 Ⅰ 実績報告の実施について (1) 実績報告の目的先進医療の実施状況を把握し 保険導入等に係る検討のための基礎資料とすることを目的とするものである (2) 実績報告の対象医療機関平成 30 年 6 月 30 日現在において 先進医療を実施している医療機関平成 30 年 3 月
 先進医療の実績報告要領 Ⅰ 実績報告の実施について (1) 実績報告の目的先進医療の実施状況を把握し 保険導入等に係る検討のための基礎資料とすることを目的とするものである (2) 実績報告の対象医療機関平成 30 年 6 月 30 日現在において 先進医療を実施している医療機関平成 30 年 3 月 31 日現在において 先進医療を実施している医療機関 ( 保険導入等分 ) 先進医療 A 告示番号
先進医療の実績報告要領 Ⅰ 実績報告の実施について (1) 実績報告の目的先進医療の実施状況を把握し 保険導入等に係る検討のための基礎資料とすることを目的とするものである (2) 実績報告の対象医療機関平成 30 年 6 月 30 日現在において 先進医療を実施している医療機関平成 30 年 3 月 31 日現在において 先進医療を実施している医療機関 ( 保険導入等分 ) 先進医療 A 告示番号
untitled
 1 2 有害事象とは何ですか? 有害事象 (Adverse Event) 治験薬又は製造販売後臨床試験薬を投与された被験者に生じたすべての好ましくない又は意図しない疾病又はその徴候をいう 当該治験薬又は当該製造販売後臨床試験薬との因果関係の有無は問わない 副作用とは何ですか? 副作用 (Adverse Drug Reaction) 治験薬 ( 対象薬として用いられる市販薬を除く ) については以下のとおり
1 2 有害事象とは何ですか? 有害事象 (Adverse Event) 治験薬又は製造販売後臨床試験薬を投与された被験者に生じたすべての好ましくない又は意図しない疾病又はその徴候をいう 当該治験薬又は当該製造販売後臨床試験薬との因果関係の有無は問わない 副作用とは何ですか? 副作用 (Adverse Drug Reaction) 治験薬 ( 対象薬として用いられる市販薬を除く ) については以下のとおり
本日の内容 1. 未承認対照薬等の取り扱い別添の 4.(3) ウ.( ア ) 2. 対象疾患の悪化等を評価項目にする試験別添の 7.(3) イ.( ア ) 3. 承認取得者以外の治験国内管理人が治験 依頼者となる場合別添の7.(3) オ. 4. 医師主導治験との情報共有別添の7.(3) カ. 5.
 治験の安全性対応シンポジウム 安全性二課長通知の改訂点平成 25 年 5 月 15 日付二課長通知 ( 薬食審査発 0515 第 1 号 薬食安発 0515 第 1 号 ) 2013 年 12 月 16 日 日本製薬工業協会医薬品評価委員会臨床評価部会五十嵐元 山城恭子 1 本日の内容 1. 未承認対照薬等の取り扱い別添の 4.(3) ウ.( ア ) 2. 対象疾患の悪化等を評価項目にする試験別添の
治験の安全性対応シンポジウム 安全性二課長通知の改訂点平成 25 年 5 月 15 日付二課長通知 ( 薬食審査発 0515 第 1 号 薬食安発 0515 第 1 号 ) 2013 年 12 月 16 日 日本製薬工業協会医薬品評価委員会臨床評価部会五十嵐元 山城恭子 1 本日の内容 1. 未承認対照薬等の取り扱い別添の 4.(3) ウ.( ア ) 2. 対象疾患の悪化等を評価項目にする試験別添の
目次 1 はじめに 1 2 治験審査委員会 2 3 書類提出と受領 4 4 安全性情報等に関する報告 5 5 治験に関する変更申請 8 6 治験継続申請 ( 実施状況報告 ) 20 7 治験終了 / 開発中止等の報告 22 8 直接閲覧 監査 査察 24 9 ご担当者様の交代 登録 /
 治験 製造販売後臨床試験 開始後の手続き要領ご担当者様へ 本手続き要領は医薬品の治験並びに製造販売後臨床試験の実施中に必要な手続きを示したものです 2018 年 12 月 独立行政法人国立病院機構九州がんセンター治験推進室治験事務局 目次 1 はじめに 1 2 治験審査委員会 2 3 書類提出と受領 4 4 安全性情報等に関する報告 5 5 治験に関する変更申請 8 6 治験継続申請 ( 実施状況報告
治験 製造販売後臨床試験 開始後の手続き要領ご担当者様へ 本手続き要領は医薬品の治験並びに製造販売後臨床試験の実施中に必要な手続きを示したものです 2018 年 12 月 独立行政法人国立病院機構九州がんセンター治験推進室治験事務局 目次 1 はじめに 1 2 治験審査委員会 2 3 書類提出と受領 4 4 安全性情報等に関する報告 5 5 治験に関する変更申請 8 6 治験継続申請 ( 実施状況報告
