HUMお知らせ文書2018年3-4月
|
|
|
- こごろう もてぎ
- 5 years ago
- Views:
Transcription
1 - 医薬品の適正使 に かせない情報です 必ずお読みください - 使用上の注意改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 9-10 月 この度 標記製品の 使用上の注意 を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお 改訂添付文書を封入した製品がお手元に届くまでに 日数を要する場合がございますので ご了承くださいますようお願い申し上げます 改訂内容ダイジェスト ( 詳細はお知らせ本 をご参照ください ) 改訂の概要 主な改訂項目 主な改訂内容 備考 副作用 - その他の副作用 - 皮膚 ( 頻度不明 ) 苔癬様皮膚反応 を追記 自発報告において苔癬関連事象が集積していることから追記しました 通知によらない改訂 ( 自主改訂 ) 使用上の注意改訂内容は 医薬品安全対策情報 (Drug Safety Update) No.273 (2018 年 10 月発行予定 ) にも掲載される予定です 製品に関するお問合せ先: エーザイ株式会社 hhc ホットラインフリーダイヤル 時 ( 祝 9 17 時 ) 製品情報は エーザイホームページ ( アッヴィホームページ ( にてご覧いただけます 注 ) 注意 - 医師等の処方箋により使用すること 1
2 改訂内容 ( 該当部のみ抜粋 ) 改訂後 ( 下線部 : 追加 ) 使用上の注意 4. 副作用 ⑵ その他の副作用次のような症状があらわれた場合には, 症状に応じて適切な処置を行うこと. 5% 以上 1~5% 未満 1% 未満頻度不明 改訂前 使用上の注意 4. 副作用 ⑵ その他の副作用次のような症状があらわれた場合には, 症状に応じて適切な処置を行うこと. 5% 以上 1~5% 未満 1% 未満頻度不明 皮膚 血管浮腫, 斑状出血, 脂肪織炎, 血管神経性浮腫, 皮膚血管炎, 苔癬様皮膚反応 皮膚 血管浮腫, 斑状出血, 脂肪織炎, 血管神経性浮腫, 皮膚血管炎 改訂理由 通知によらない改訂 ( 主改訂 ) 副作 - その他の副作 - 膚 ( 頻度不明 ) の項 : 苔癬様 膚反応の追記 自発報告において苔癬関連事象が集積していることから追記しました ( 苔癬様皮膚反応 : 扁平苔癬 扁平苔癬型薬疹 苔癬様角化症等の苔癬関連の事象 ) 本製品の最新添付 書情報は PMDA ホームページ 医薬品に関する情報 からご覧下さい 2 CODE DI J 年 9 月作成 (1903)
3 - 医薬品の適正使用に欠かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 生物由来製品 劇薬 処方箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお 改訂添付文書を封入した製品がお手元に届くまでに 日数を要する場合がございますので ご了承くださいますようお願い申し上げます 改訂内容ダイジェスト ( 詳細はお知らせ本文をご参照ください ) 改訂の概要 主な改訂項目 主な改訂内容 備考 警告効能 効果効能 効果に関連する使用上の注意用法 用量用法 用量に関連する使用上の注意重要な基本的注意副作用その他の注意 妊婦, 産婦, 授乳婦等への投与 膿疱性乾癬の効能追加に伴い それに関連する項目を改訂致しました 本剤がヒト母乳中へ移行したとの報告があることから改訂致しました 承認事項の一部変更 通知によらない改訂 ( 自主改訂 ) 使用上の注意改訂内容は 医薬品安全対策情報 (Drug Safety Update) No.268 (2018 年 4 月発行予定 ) にも掲載される予定です 製品に関するお問合せ先: エーザイ株式会社 hhc ホットラインフリーダイヤル 時 ( 土 日 祝日 9 17 時 ) 製品情報は エーザイホームページ( アッヴィホームページ ( にてご覧いただけます 注 ) 注意 - 医師等の処方箋により使用すること 薬価基準未収載 1
4 膿疱性乾癬の効能追加 ( 承認事項の 部変更承認 ) に伴う改訂 改訂内容 ( 該当部のみ抜粋 ) 警告 1.~3. 4. 関節リウマチ患者では, 本剤の治療を行う前に, 少なくとも 1 剤の抗リウマチ薬等の使用を十分勘案すること. また, 本剤についての十分な知識とリウマチ治療の経験をもつ医師が使用すること. 5. 尋常性乾癬, 関節症性乾癬及び膿疱性乾癬の患者では, 本剤の治療を行う前に, 既存の全身療法 ( 紫外線療法を含む ) の適用を十分に勘案すること. 乾癬の治療経験を持つ医師と本剤の副作用への対応について十分な知識を有する医師との連携のもと使用すること. 6. 強直性脊椎炎では, 本剤の治療を行う前に, 既存治療薬 ( 非ステロイド性抗炎症薬等 ) の使用を十分勘案すること. また, 本剤についての十分な知識と強直性脊椎炎の診断及び治療の経験をもつ医師が使用すること. 7. 多関節に活動性を有する若年性特発性関節炎の患者では, 本剤の治療を行う前に, 少なくとも 1 剤の抗リウマチ薬等の使用を十分勘案すること. また, 本剤についての十分な知識と若年性特発性関節炎治療の経験をもつ医師が使用すること ( 小児等への投与 の項参照 ). 8. 腸管型ベーチェット病では, 本剤の治療を行う前に, ステロイド又は免疫調節剤等の使用を十分勘案すること. また, 本剤についての十分な知識と腸管型ベーチェット病治療の経験をもつ医師が使用すること. 9. クローン病では, 本剤の治療を行う前に, 栄養療法, ステロイド, 免疫調節剤等の使用を十分勘案すること. また, 本剤についての十分な知識とクローン病治療の経験をもつ医師が使用すること. 10. 潰瘍性大腸炎では, 本剤の治療を行う前に, ステロイド又は免疫調節剤等の使用を十分勘案すること. また, 本剤についての十分な知識と潰瘍性大腸炎治療の経験をもつ医師が使用すること. 11. 非感染性ぶどう膜炎では, 本剤の治療を行う前に, 既存治療薬 ( ベーチェット病によるぶどう膜炎ではシクロスポリン等, その他の非感染性ぶどう膜炎では経口ステロイド剤等 ) の使用を十分勘案すること. また, 本剤についての十分な知識と非感染性ぶどう膜炎治療の経験をもつ眼科医と本剤について十分な知識をもつ内科等の医師が診断と治療に対して十分な連携をとり使用すること. 警告 1.~3. 4. 関節リウマチ患者では, 本剤の治療を行う前に, 少なくとも 1 剤の抗リウマチ薬等の使用を十分勘案すること. また, 本剤についての十分な知識とリウマチ治療の経験をもつ医師が使用し, 自己投与の場合もその管理指導のもとで使用すること. 5. 尋常性乾癬及び関節症性乾癬の患者では, 本剤の治療を行う前に, 既存の全身療法 ( 紫外線療法を含む ) の適用を十分に勘案すること. 乾癬の治療経験を持つ医師と本剤の副作用への対応について十分な知識を有する医師との連携のもと使用すること. 自己投与の場合もこれらの医師の管理指導のもとで使用すること. 6. 強直性脊椎炎では, 本剤の治療を行う前に, 既存治療薬 ( 非ステロイド性抗炎症薬等 ) の使用を十分勘案すること. また, 本剤についての十分な知識と強直性脊椎炎の診断及び治療の経験をもつ医師が使用し, 自己投与の場合もその管理指導のもとで使用すること. 7. 多関節に活動性を有する若年性特発性関節炎の患者では, 本剤の治療を行う前に, 少なくとも 1 剤の抗リウマチ薬等の使用を十分勘案すること. また, 本剤についての十分な知識と若年性特発性関節炎治療の経験をもつ医師が使用し, 自己投与の場合もその管理指導のもとで使用すること ( 小児等への投与 の項参照 ). 8. 腸管型ベーチェット病では, 本剤の治療を行う前に, ステロイド又は免疫調節剤等の使用を十分勘案すること. また, 本剤についての十分な知識と腸管型ベーチェット病治療の経験をもつ医師が使用し, 自己投与の場合もその管理指導のもとで使用すること. 9. クローン病では, 本剤の治療を行う前に, 栄養療法, ステロイド, 免疫調節剤等の使用を十分勘案すること. また, 本剤についての十分な知識とクローン病治療の経験をもつ医師が使用し, 自己投与の場合もその管理指導のもとで使用すること. 10. 潰瘍性大腸炎では, 本剤の治療を行う前に, ステロイド又は免疫調節剤等の使用を十分勘案すること. また, 本剤についての十分な知識と潰瘍性大腸炎治療の経験をもつ医師が使用し, 自己投与の場合もその管理指導のもとで使用すること. 11. 非感染性ぶどう膜炎では, 本剤の治療を行う前に, 既存治療薬 ( ベーチェット病によるぶどう膜炎ではシクロスポリン等, その他の非感染性ぶどう膜炎では経口ステロイド剤等 ) の使用を十分勘案すること. また, 本剤についての十分な知識と非感染性ぶどう膜炎治療の経験をもつ眼科医と本剤について十分な知識をもつ内科等の医師が診断と治療に対して十分な連携をとり使用し, 自己投与の場合もその管理指導のもとで使用すること. 2
5 改訂内容 つづき ( 該当部のみ抜粋 ) 効能 効果ヒュミラ皮下注 20mg シリンジ 0.4mL ヒュミラ皮下注 20mg シリンジ 0.2mL ヒュミラ皮下注 40mg ペン 0.4mL 既存治療で効果不十分な下記疾患多関節に活動性を有する若年性特発性関節炎 ヒュミラ皮下注 80mg シリンジ 0.8mL ヒュミラ皮下注 40mg ペン 0.4mL ヒュミラ皮下注 80mg ペン 0.8mL 関節リウマチ ( 関節の構造的損傷の防止を含む ) 既存治療で効果不十分な下記疾患尋常性乾癬, 関節症性乾癬, 膿疱性乾癬強直性脊椎炎腸管型ベーチェット病非感染性の中間部, 後部又は汎ぶどう膜炎中等症又は重症の活動期にあるクローン病の寛解導入及び維持療法 ( 既存治療で効果不十分な場合に限る ) 中等症又は重症の潰瘍性大腸炎の治療 ( 既存治療で効果不十分な場合に限る ) ( 参考 ) ヒュミラ皮下注 2 0 m g シリンジ 0.4mL 4 0 m g 2 0 m g シリンジ 0.2mL シリンジ 0.8mL 4 0 m g 8 0 m g シリンジシリンジ 0.4mL0.8mL 40mg ペン 80mg ペン 0.4mL0.8mL 関節リウマチ - 尋常性乾癬, 関節症性乾癬, 膿疱性乾癬 - 強直性脊椎炎 - 多関節に活動性を有する若年性特発性関節炎 - 腸管型ベーチェット病 - クローン病 - 潰瘍性大腸炎 - 非感染性の中間部, 後部又は汎ぶどう膜炎 - 効能 効果ヒュミラ皮下注 20mg シリンジ 0.4mL ヒュミラ皮下注 20mg シリンジ 0.2mL ヒュミラ皮下注 40mg ペン 0.4mL 既存治療で効果不十分な下記疾患多関節に活動性を有する若年性特発性関節炎 ヒュミラ皮下注 80mg シリンジ 0.8mL ヒュミラ皮下注 40mg ペン 0.4mL ヒュミラ皮下注 80mg ペン 0.8mL 関節リウマチ ( 関節の構造的損傷の防止を含む ) 既存治療で効果不十分な下記疾患尋常性乾癬, 関節症性乾癬強直性脊椎炎腸管型ベーチェット病非感染性の中間部, 後部又は汎ぶどう膜炎中等症又は重症の活動期にあるクローン病の寛解導入及び維持療法 ( 既存治療で効果不十分な場合に限る ) 中等症又は重症の潰瘍性大腸炎の治療 ( 既存治療で効果不十分な場合に限る ) ( 参考 ) ヒュミラ皮下注 2 0 m g シリンジ 0.4mL 4 0 m g 2 0 m g シリンジ 0.2mL シリンジ 0.8mL 4 0 m g シリンジ 0.4mL 8 0 m g シリンジ 0.8mL 40mg ペン 80mg ペン 0.4mL 0.8mL 関節リウマチ - 尋常性乾癬, 関節症性乾癬 - 強直性脊椎炎 - 多関節に活動性を有する若年性特発性関節炎 腸管型ベーチェット病 - - クローン病 - 潰瘍性大腸炎 - 非感染性の中間部, 後部又は汎ぶどう膜炎 - < 効能 効果に関連する使用上の注意 > 関節リウマチ ⑴~⑵ 尋常性乾癬, 関節症性乾癬, 膿疱性乾癬 ⑴ ⑵ 難治性の皮疹, 関節症状又は膿疱を有する場合に投与すること. 強直性脊椎炎 多関節に活動性を有する若年性特発性関節炎 腸管型ベーチェット病 クローン病 潰瘍性大腸炎 非感染性の中間部, 後部又は汎ぶどう膜炎 < 効能 効果に関連する使用上の注意 > 関節リウマチ ⑴~⑵ 尋常性乾癬及び関節症性乾癬 ⑴ ⑵ 難治性の皮疹又は関節症状を有する場合に投与すること. 強直性脊椎炎 多関節に活動性を有する若年性特発性関節炎 腸管型ベーチェット病 クローン病 潰瘍性大腸炎 非感染性の中間部, 後部又は汎ぶどう膜炎 3
6 改訂内容 つづき ( 該当部のみ抜粋 ) 用法 用量ヒュミラ皮下注 20mg シリンジ 0.4mL ヒュミラ皮下注 20mg シリンジ 0.2mL ヒュミラ皮下注 40mg ペン 0.4mL 多関節に活動性を有する若年性特発性関節炎通常, アダリムマブ ( 遺伝子組換え ) として, 体重 15kg 以上 30kg 未満の場合は 20mg を, 体重 30kg 以上の場合は 40mg を 2 週に 1 回, 皮下注射する. ヒュミラ皮下注 80mg シリンジ 0.8mL ヒュミラ皮下注 40mg ペン 0.4mL ヒュミラ皮下注 80mg ペン 0.8mL 関節リウマチ 尋常性乾癬, 関節症性乾癬, 膿疱性乾癬通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 80mg を皮下注射し, 以後 2 週に 1 回,40mg を皮下注射する. なお, 効果不十分な場合には 1 回 80mg まで増量できる. 強直性脊椎炎 腸管型ベーチェット病 クローン病 潰瘍性大腸炎 非感染性の中間部, 後部又は汎ぶどう膜炎 < 用法 用量に関連する使用上の注意 > ⑴~⑶ ⑷ 尋常性乾癬, 関節症性乾癬及び膿疱性乾癬において, 本剤による治療反応は, 通常投与開始から 16 週以内に得られる.16 週以内に治療反応が得られない場合は, 現在の治療計画の継続を慎重に再考すること. また, 増量を行っても効果が得られない場合, 現在の治療計画の継続を慎重に再考すること. ⑸~⑼ 使用上の注意 2. 重要な基本的注意 ⑴~⑾ ⑿ 本剤の投与により, 本剤に対する抗体が産生されることがある. 臨床試験における日本人での産生率は, 関節リウマチ 44.0%( メトトレキサート併用下では 19.3%), 尋常性乾癬 11.6%, 膿疱性乾癬 30.0%, 強直性脊椎炎 16.0%, 若年性特発性関節炎 20.0%( メトトレキサート併用下では 15.0%), 腸管型ベーチェット病 5.0%, クローン病 6.1%, 潰瘍性大腸炎 7.8% 及び非感染性ぶどう膜炎 12.5% であった. 臨床試験において本剤に対する抗体の産生が確認された患者においては, 本剤の血中濃度が低下する傾向がみられた. 血中濃度が低下した患者では効果減弱のおそれがある. ⒀~⒂ 用法 用量ヒュミラ皮下注 20mg シリンジ 0.4mL ヒュミラ皮下注 20mg シリンジ 0.2mL ヒュミラ皮下注 40mg ペン 0.4mL 多関節に活動性を有する若年性特発性関節炎通常, アダリムマブ ( 遺伝子組換え ) として, 体重 15kg 以上 30kg 未満の場合は 20mg を, 体重 30kg 以上の場合は 40mg を 2 週に 1 回, 皮下注射する. ヒュミラ皮下注 80mg シリンジ 0.8mL ヒュミラ皮下注 40mg ペン 0.4mL ヒュミラ皮下注 80mg ペン 0.8mL 関節リウマチ 尋常性乾癬及び関節症性乾癬通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 80mg を皮下注射し, 以後 2 週に 1 回,40mg を皮下注射する. なお, 効果不十分な場合には 1 回 80mg まで増量できる. 強直性脊椎炎 腸管型ベーチェット病 クローン病 潰瘍性大腸炎 非感染性の中間部, 後部又は汎ぶどう膜炎 < 用法 用量に関連する使用上の注意 > ⑴~⑶ ⑷ 尋常性乾癬及び関節症性乾癬において, 本剤による治療反応は, 通常投与開始から 16 週以内に得られる.16 週以内に治療反応が得られない場合は, 現在の治療計画の継続を慎重に再考すること. また, 増量を行っても効果が得られない場合, 現在の治療計画の継続を慎重に再考すること. ⑸~⑼ 使用上の注意 2. 重要な基本的注意 ⑴~⑾ ⑿ 本剤の投与により, 本剤に対する抗体が産生されることがある. 臨床試験における日本人での産生率は, 関節リウマチ 44.0%( メトトレキサート併用下では 19.3%), 尋常性乾癬 11.6%, 強直性脊椎炎 16.0%, 若年性特発性関節炎 20.0%( メトトレキサート併用下では 15.0%), 腸管型ベーチェット病 5.0%, クローン病 6.1%, 潰瘍性大腸炎 7.8% 及び非感染性ぶどう膜炎 12.5% であった. 臨床試験において本剤に対する抗体の産生が確認された患者においては, 本剤の血中濃度が低下する傾向がみられた. 血中濃度が低下した患者では効果減弱のおそれがある. ⒀~⒂ 4
7 改訂内容 つづき ( 該当部のみ抜粋 ) 4. 副作用 本剤の臨床試験における副作用の発現状況は, 以下のと おりである. < 国内臨床試験 > 関節リウマチ, 尋常性乾癬, 関節症性乾癬, 膿疱性乾癬, 強直性脊椎炎, 若年性特発性関節炎, 腸管型ベーチェッ ト病, クローン病, 潰瘍性大腸炎及び非感染性ぶどう膜 炎の臨床試験において, 日本人安全性評価対象 1,308 例中 1,079 例 (82.5%) に副作用が認められ, その主なものは, 鼻咽頭炎 389 例 (29.7%), 注射部位紅斑 126 例 (9.6%), 注射部位反応 111 例 (8.5%), 発疹 98 例 (7.5%), 上気道 感染 83 例 (6.3%) 等であった. < 海外臨床試験 > ⑴ 重大な副作用 ⑵その他の副作用 次のような症状があらわれた場合には, 症状に応じて 適切な処置を行うこと. 5% 以上 1~5% 未満 1% 未満 頻度不明 血液 自己抗体陽性 ( 抗 リンパ DNA 抗体陽性, 抗核抗体陽性 ) (16.4%) 呼吸器上気道感染 ( 鼻咽頭 炎等 )(55.1%), 咳嗽 筋骨格系, 四肢 投与部位 注射部位反応 ( 紅斑, そう痒感, 発疹, 出血, 腫脹, 硬結等 )(25.4%) 不快感, 腰部脊柱管狭窄, 筋痙縮, 4. 副作用本剤の臨床試験における副作用の発現状況は, 以下のとおりである. < 国内臨床試験 > 関節リウマチ, 尋常性乾癬, 関節症性乾癬, 強直性脊椎炎, 若年性特発性関節炎, 腸管型ベーチェット病, クローン病, 潰瘍性大腸炎及び非感染性ぶどう膜炎の臨床試験において, 日本人安全性評価対象 1,298 例中 1,076 例 (82.9%) に副作用が認められ, その主なものは, 鼻咽頭炎 389 例 (30.0%), 注射部位紅斑 126 例 (9.7%), 注射部位反応 111 例 (8.6%), 発疹 98 例 (7.6%), 上気道感染 83 例 (6.4%) 等であった. < 海外臨床試験 > ⑴ 重大な副作用 ⑵ その他の副作用次のような症状があらわれた場合には, 症状に応じて適切な処置を行うこと. 5% 以上 1~5% 未満 1% 未満頻度不明 血液 自己抗体陽性 ( 抗 リンパ DNA 抗体陽性, 抗核抗体陽性 ) (16.5%) 呼吸器 上気道感染 ( 鼻咽頭 炎等 )(55.5%), 咳嗽 筋骨格系, 四肢 不快感, 腰部脊椎管狭窄, 筋痙縮, 投与部位 注射部位反応 ( 紅斑, そう痒感, 発疹, 出血, 腫脹, 硬結等 )(25.6%) 10. その他の注意 ⑴ ⑵ 尋常性乾癬, 関節症性乾癬及び膿疱性乾癬患者において, 本剤と紫外線療法又は既存の全身療法との併用について, 有効性及び安全性は確立されていない. ⑶~⑸ 10. その他の注意 ⑴ ⑵ 尋常性乾癬及び関節症性乾癬患者において, 本剤と紫外線療法又は既存の全身療法との併用について, 有効性及び安全性は確立されていない. ⑶~⑸ 改訂理由 膿疱性乾癬の効能追加 ( 承認事項の 部変更承認 ) に伴い 関連する以下の項目について改訂致しました 1. 警告 の項本剤での治療を行う前に 膿疱性乾癬に対する既存の全身療法の適用を十分勘案し 本剤についての十分な知識と膿疱性乾癬治療の経験をもつ医師と十分な連携をとり使用する旨を追記致しました また 自己投与の記載について 既存の注意喚起と重複するため記載整備致しました 5
8 2. 効能 効果 用法 用量 の項新たに承認された事項を記載するとともに 既存の内容についても記載整備致しました 3. 効能 効果に関連する使用上の注意 の項 (2) 膿疱性乾癬の皮膚病変を有する場合に投与する旨を追記致しました 4. 用法 用量に関連する使用上の注意 の項膿疱性乾癬についても治療反応の確認を適切に行い 16 週以内に治療反応が得られない場合または増量を行っても効果が得られない場合には 現在の治療計画の継続を慎重に再考する旨を追記致しました 5. 重要な基本的注意 の項膿疱性乾癬の臨床試験において認められた抗アダリムマブ抗体産生率の結果を追記致しました 6. 副作用 の項膿疱性乾癬の臨床試験において認められた副作用について 既存の副作用集計と合算し 症例数及び副作用発現頻度を更新致しました また副作用用語を記載整備致しました 7. その他の注意 の項膿疱性乾癬についても紫外線療法又は既存の全身療法との併用について 有効性及び安全性は確立されていないことから追記致しました 6
9 妊婦, 産婦, 授乳婦等への投与 の項における通知によらない改訂 ( 自主改訂 ) 改訂内容 ( 該当部のみ抜粋 ) 使用上の注意 6. 妊婦, 産婦, 授乳婦等への投与 ⑴,⑵ ⑶ 授乳中の投与に関する安全性は確立していない. 授乳中の婦人には授乳を中止させること [ ヒト母乳中へ移行することが報告されている ( 薬物動態 の項参照 )]. 使用上の注意 6. 妊婦, 産婦, 授乳婦等への投与 ⑴,⑵ ⑶ 授乳中の投与に関する安全性は確立していない. 授乳中の婦人には授乳を中止させること [ 本剤のヒト乳汁への移行は不明である. 他の抗 TNF 製剤では動物実験で乳汁への移行が報告されている ]. 改訂理由 通知によらない改訂 ( 自主改訂 ) これまで本剤のヒト母乳中への移行の有無は不明でしたが ヒト母乳中へ移行したとの報告があることから改訂致しました 引き続き 本剤投与中は授乳を避けていただきますようお願いします < 参考文献 > Ben-Horin S, et al.:clin. Gastroenterol. Hepatol., 8(5): ,
10 本製品の最新添付文書情報は PMDA ホームページ 医薬品に関する情報 からご覧下さい CODE DI-J 年 3 月作成 (1809) 8
11 - 医薬品の適正使 に かせない情報です 必ずお読み下さい - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2016 年 9-10 月 この度 新たな効能として既存治療で効果不 分な 感染性の中間部 後部 は汎ぶどう膜炎 ( 以下 感染性ぶどう膜炎 ) が承認され これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照下さいますようお願い申し上げます なお 改訂添付文書を封入した製品がお手元に届くまでに 日数を要する場合がございますので ご了承下さいますようお願い申し上げます 改訂内容ダイジェスト ( 詳細はお知らせ本 をご参照下さい ) 改訂の概要 主な改訂項目主な改訂内容備考 警告効能 効果効能 効果に関連する使用上の注意用法 用量重要な基本的注意副作用 非感染性ぶどう膜炎の効能追加に伴い それに関連する項目を改訂致しました 承認事項の一部変更 使用上の注意改訂内容は 医薬品安全対策情報 (Drug Safety Update) No.254 (2016 年 11 月発行予定 ) にも掲載される予定です 製品に関するお問合せ先: エーザイ株式会社 hhc ホットラインフリーダイヤル 時 ( 祝 9 17 時 ) 製品情報は エーザイホームページ( アッヴィホームページ ( にてご覧いただけます 注 ) 注意 - 医師等の処方箋により使用すること 薬価基準未収載 1
12 改訂内容 ( 該当部のみ抜粋 ) 警告 1.~ 非感染性ぶどう膜炎では, 本剤の治療を行う前に, 既存治療薬 ( ベーチェット病によるぶどう膜炎ではシクロスポリン等, その他の非感染性ぶどう膜炎では経口ステロイド剤等 ) の使用を十分勘案すること. また, 本剤についての十分な知識と非感染性ぶどう膜炎治療の経験をもつ眼科医と本剤について十分な知識をもつ内科等の医師が診断と治療に対して十分な連携をとり使用し, 自己投与の場合もその管理指導のもとで使用すること. 警告 1.~10. 効能 効果ヒュミラ皮下注 20mg シリンジ 0.4mL 既存治療で効果不十分な下記疾患多関節に活動性を有する若年性特発性関節炎 ヒュミラ皮下注 80mg シリンジ 0.8mL 関節リウマチ ( 関節の構造的損傷の防止を含む ) 既存治療で効果不十分な下記疾患尋常性乾癬, 関節症性乾癬強直性脊椎炎腸管型ベーチェット病非感染性の中間部, 後部又は汎ぶどう膜炎中等症又は重症の活動期にあるクローン病の寛解導入及び維持療法 ( 既存治療で効果不十分な場合に限る ) 中等症又は重症の潰瘍性大腸炎の治療 ( 既存治療で効果不十分な場合に限る ) ( 参考 ) ヒュミラ皮下注 20mgシリ 40mgシリ 40mgシリ 80mgシリ ンジ0.4mL ンジ0.8mL ンジ0.4mL ンジ0.8mL 関節リウマチ - 尋常性乾癬, 関節症性乾癬 - 強直性脊椎炎 - 多関節に活動性を有する若年性特発 - 性関節炎 腸管型ベーチェット病 - クローン病 - 潰瘍性大腸炎 - 非感染性の中間部, 後部又は汎ぶどう膜炎 - 効能 効果ヒュミラ皮下注 20mgシリンジ0.4mL 既存治療で効果不十分な下記疾患多関節に活動性を有する若年性特発性関節炎ヒュミラ皮下注 40mgシリンジ0.8mL ヒュミラ皮下注 40mgシリンジ0.4mL 関節リウマチ ( 関節の構造的損傷の防止を含む ) 既存治療で効果不十分な下記疾患尋常性乾癬, 関節症性乾癬強直性脊椎炎多関節に活動性を有する若年性特発性関節炎腸管型ベーチェット病中等症又は重症の活動期にあるクローン病の寛解導入及び維持療法 ( 既存治療で効果不十分な場合に限る ) 中等症又は重症の潰瘍性大腸炎の治療 ( 既存治療で効果不十分な場合に限る ) ヒュミラ皮下注 80mgシリンジ0.8mL 関節リウマチ ( 関節の構造的損傷の防止を含む ) 既存治療で効果不十分な下記疾患尋常性乾癬, 関節症性乾癬強直性脊椎炎腸管型ベーチェット病中等症又は重症の活動期にあるクローン病の寛解導入及び維持療法 ( 既存治療で効果不十分な場合に限る ) 中等症又は重症の潰瘍性大腸炎の治療 ( 既存治療で効果不十分な場合に限る ) ( 参考 ) ヒュミラ皮下注 20mgシリ 40mgシリ 40mgシリ 80mgシリンジ0.4mL ンジ0.8mL ンジ0.4mL ンジ0.8mL 関節リウマチ - 尋常性乾癬, - 関節症性乾癬強直性脊椎炎 - 多関節に活動性を有する若年性特発 - 性関節炎腸管型ベーチェット - 病クローン病 - 潰瘍性大腸炎 - 2
13 改訂内容 つづき ( 該当部のみ抜粋 ) < 効能 効果に関連する使用上の注意 > 関節リウマチ 尋常性乾癬及び関節症性乾癬 強直性脊椎炎 多関節に活動性を有する若年性特発性関節炎 腸管型ベーチェット病 クローン病 潰瘍性大腸炎 非感染性の中間部, 後部又は汎ぶどう膜炎過去の治療において, 既存治療薬 ( ベーチェット病によるぶどう膜炎ではシクロスポリン等, その他の非感染性ぶどう膜炎では経口ステロイド剤等 ) による適切な治療を行っても, 疾患に起因する明らかな臨床症状が残る場合に投与すること. < 効能 効果に関連する使用上の注意 > 関節リウマチ 尋常性乾癬及び関節症性乾癬 強直性脊椎炎 多関節に活動性を有する若年性特発性関節炎 腸管型ベーチェット病 クローン病 潰瘍性大腸炎 用法 用量ヒュミラ皮下注 20mg シリンジ 0.4mL 多関節に活動性を有する若年性特発性関節炎通常, アダリムマブ ( 遺伝子組換え ) として, 体重 15kg 以上 30kg 未満の場合は 20mg を, 体重 30kg 以上の場合は 40mg を 2 週に 1 回, 皮下注射する. ヒュミラ皮下注 80mg シリンジ 0.8mL 関節リウマチ通常, 成人にはアダリムマブ ( 遺伝子組換え ) として 40mg を 2 週に 1 回, 皮下注射する. なお, 効果不十分な場合,1 回 80mg まで増量できる. 尋常性乾癬及び関節症性乾癬通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 80mg を皮下注射し, 以後 2 週に 1 回,40mg を皮下注射する. なお, 効果不十分な場合には 1 回 80mg まで増量できる. 強直性脊椎炎通常, 成人にはアダリムマブ ( 遺伝子組換え ) として 40mg を 2 週に 1 回, 皮下注射する. なお, 効果不十分な場合,1 回 80mg まで増量できる. 腸管型ベーチェット病通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 160mg を, 初回投与 2 週間後に 80mg を皮下注射する. 初回投与 4 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. クローン病通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 160mg を, 初回投与 2 週間後に 80mg を皮下注射する. 初回投与 4 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. なお, 効果が減弱した場合には 1 回 80mg に増量できる. 潰瘍性大腸炎通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 160mg を, 初回投与 2 週間後に 80mg を皮下注射する. 初回投与 4 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. 非感染性の中間部, 後部又は汎ぶどう膜炎通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 80mg を, 初回投与 1 週間後に 40mg を皮下注射する. 初回投与 3 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. 用法 用量 ヒュミラ皮下注 80mg シリンジ 0.8mL 関節リウマチ通常, 成人にはアダリムマブ ( 遺伝子組換え ) として 40mg を 2 週に 1 回, 皮下注射する. なお, 効果不十分な場合,1 回 80mg まで増量できる. 尋常性乾癬及び関節症性乾癬通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 80mg を皮下注射し, 以後 2 週に 1 回,40mg を皮下注射する. なお, 効果不十分な場合には 1 回 80mg まで増量できる. 強直性脊椎炎通常, 成人にはアダリムマブ ( 遺伝子組換え ) として 40mg を 2 週に 1 回, 皮下注射する. なお, 効果不十分な場合,1 回 80mg まで増量できる. ヒュミラ皮下注 20mg シリンジ 0.4mL 多関節に活動性を有する若年性特発性関節炎通常, アダリムマブ ( 遺伝子組換え ) として, 体重 15kg 以上 30kg 未満の場合は 20mg を, 体重 30kg 以上の場合は 40mg を 2 週に 1 回, 皮下注射する. ヒュミラ皮下注 80mg シリンジ 0.8mL 腸管型ベーチェット病通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 160mg を, 初回投与 2 週間後に 80mg を皮下注射する. 初回投与 4 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. クローン病通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 160mg を, 初回投与 2 週間後に 80mg を皮下注射する. 初回投与 4 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. なお, 効果が減弱した場合には 1 回 80mg に増量できる. ヒュミラ皮下注 80mg シリンジ 0.8mL クローン病通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 160mg を, 初回投与 2 週間後に 80mg を皮下注射する. 初回投与 4 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. ヒュミラ皮下注 80mg シリンジ 0.8mL 潰瘍性大腸炎通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 160mg を, 初回投与 2 週間後に 80mg を皮下注射する. 初回投与 4 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. 3
14 改訂内容 つづき ( 該当部のみ抜粋 ) 使用上の注意 2. 重要な基本的注意 ⑴~⑼ ⑽ 本剤において, サルコイドーシスの悪化 ( 皮膚, 肺又は眼症状 ) が報告されている. サルコイドーシス患者に本剤を投与する場合には, 十分な観察を行い, サルコイドーシスの悪化に注意すること. サルコイドーシス症状が悪化した場合には, 適切な処置を行うこと. ⑾ メトトレキサート等の抗リウマチ薬を併用する場合は, 80mg 隔週投与への増量は行わないこと. ⑿ 本剤の投与により, 本剤に対する抗体が産生されることがある. 臨床試験における日本人での産生率は, 関節リウマチ 44.0%( メトトレキサート併用下では 19.3%), 尋常性乾癬 11.6%, 強直性脊椎炎 16.0%, 若年性特発性関節炎 20.0%( メトトレキサート併用下では 15.0%), 腸管型ベーチェット病 5.0%, クローン病 6.1%, 潰瘍性大腸炎 7.8% 及び非感染性ぶどう膜炎 12.5% であった. 臨床試験において本剤に対する抗体の産生が確認された患者においては, 本剤の血中濃度が低下する傾向がみられた. 血中濃度が低下した患者では効果減弱のおそれがある. ⒀~⒂( 略以下繰り下げ ) 使用上の注意 2. 重要な基本的注意 ⑴~⑼ ⑽ メトトレキサート等の抗リウマチ薬を併用する場合は, 80mg 隔週投与への増量は行わないこと. ⑾ 本剤の投与により, 本剤に対する抗体が産生されることがある. 国内臨床試験における産生率は, 関節リウマチ 44.0%( メトトレキサート併用下では 19.3%), 尋常性乾癬 11.6%, 強直性脊椎炎 16.0%, 若年性特発性関節炎 20.0%( メトトレキサート併用下では 15.0%), 腸管型ベーチェット病 5.0%, クローン病 6.1% 及び潰瘍性大腸炎 7.8% であった. 臨床試験において本剤に対する抗体の産生が確認された患者においては, 本剤の血中濃度が低下する傾向がみられた. 血中濃度が低下した患者では効果減弱のおそれがある. ⑿~⒁ 4. 副作用本剤の臨床試験における副作用の発現状況は, 以下のとおりである. < 国内臨床試験 > 関節リウマチ, 尋常性乾癬, 関節症性乾癬, 強直性脊椎炎, 若年性特発性関節炎, 腸管型ベーチェット病, クローン病, 潰瘍性大腸炎及び非感染性ぶどう膜炎の臨床試験において, 日本人安全性評価対象 1,298 例中 1,076 例 (82.9%) に副作用が認められ, その主なものは, 鼻咽頭炎 389 例 (30.0%), 注射部位紅斑 126 例 (9.7%), 注射部位反応 111 例 (8.6%), 発疹 98 例 (7.6%), 上気道感染 83 例 (6.4%) 等であった. < 海外臨床試験 > 海外における関節リウマチ ( 本剤単独投与 ), 尋常性乾癬, 関節症性乾癬, 強直性脊椎炎, 若年性特発性関節炎, クローン病, 潰瘍性大腸炎及び非感染性ぶどう膜炎の臨床試験において, 本剤総症例数 6,594 例中 3,403 例 (51.6%) に認められた主な副作用は, 鼻咽頭炎 361 例 (5.5%), 頭痛 347 例 (5.3%), 注射部位反応 316 例 (4.8%), 注射部位疼痛 247 例 (3.7%), 上気道感染 231 例 (3.5%) 等であった. ⑴ 重大な副作用 1) 敗血症 (0.3%), 肺炎 (2.8%) 等の重篤な感染症 : 敗血症, 肺炎等の重篤な感染症 ( 細菌, 真菌 ( ニューモシスティス等 ), ウイルス等の日和見感染によるもの ) があらわれることがあるので, 治療中は十分に観察を行い, 異常が認められた場合には投与を中止する等の適切な処置を行うこと. なお, 感染症により死亡に至った症例が報告されている. 2)~8) 4. 副作用本剤の臨床試験における副作用の発現状況は, 以下のとおりである. < 国内臨床試験 > 関節リウマチ, 尋常性乾癬, 関節症性乾癬, 強直性脊椎炎, 若年性特発性関節炎, 腸管型ベーチェット病, クローン病及び潰瘍性大腸炎の国内の臨床試験において, 安全性評価対象 1,252 例中 1,048 例 (83.7%) に副作用が認められ, その主なものは, 鼻咽頭炎 382 例 (30.5%), 注射部位紅斑 125 例 (10.0%), 注射部位反応 111 例 (8.9%), 発疹 97 例 (7.7%), 上気道感染 82 例 (6.5%) 等であった. < 海外臨床試験 > 海外における関節リウマチ ( 本剤単独投与 ), 尋常性乾癬, 関節症性乾癬, 強直性脊椎炎, 若年性特発性関節炎, クローン病及び潰瘍性大腸炎の臨床試験において, 本剤総症例数 6,130 例中 3,079 例 (50.2%) に認められた主な副作用は, 注射部位反応 312 例 (5.1%), 頭痛 298 例 (4.9%), 鼻咽頭炎 286 例 (4.7%), 注射部位疼痛 229 例 (3.7%), 上気道感染 198 例 (3.2%) 等であった. ⑴ 重大な副作用 1) 敗血症 (0.2%), 肺炎 (2.8%) 等の重篤な感染症 : 敗血症, 肺炎等の重篤な感染症 ( 細菌, 真菌 ( ニューモシスティス等 ), ウイルス等の日和見感染によるもの ) があらわれることがあるので, 治療中は十分に観察を行い, 異常が認められた場合には投与を中止する等の適切な処置を行うこと. なお, 感染症により死亡に至った症例が報告されている. 2)~8) 4
15 改訂内容 つづき ( 該当部のみ抜粋 ) (2) その他の副作用次のような症状があらわれた場合には, 症状に応じて適切な処置を行うこと. 5% 以上 1~5% 未満 1% 未満頻度不明 血液 リンパ 自己抗体陽 性 ( 抗 DNA 抗体陽性, 抗核抗体陽性 ) (16.5%) 感覚器結膜炎, 眼の難聴, 中耳炎, 耳鳴, 眼 異常感, 麦粒瞼浮腫, 外耳炎, 白内腫障, 耳不快感, 耳出血, 結膜出血, 眼脂, 乾性角結膜炎, 乱視, 眼瞼炎, 霰粒腫, 複視, 角膜炎, 角膜症, 高眼圧症, 光視症, 網膜変性, 網膜静脈閉塞, 高血圧性網膜症, 強膜出血, 強膜炎, 真珠腫, 緑内障, 耳痛, 角膜損傷, 耳垢栓塞, 角膜びらん, 眼出血, 硝子体浮遊物, 耳感染, 聴覚刺激検査異常, 流涙増加, 霧視, 一過性視力低下, 網膜出血, 眼圧上昇 呼吸器上気道感染 ( 鼻咽頭炎等 ) (55.5%), 咳嗽消化器 腹痛, 歯周胃不快感, ウイルス性 病, 便秘, 悪胃腸炎, 痔核, 食道心, 口内炎, 炎, 歯痛 ( 歯知覚過敏腸炎, 齲歯, を含む ), 胃潰瘍, 口腔嘔吐, 胃炎, カンジダ症, 口内乾口唇炎, 腹部燥, 消化不良, 歯肉腫膨満, 口腔ヘ脹, 腹部不快感, 腹部ルペス, イレ腫瘤, 痔瘻, 結腸ポウスリープ,( 中略 ), 肛門周囲膿瘍, 歯髄炎, 膵臓の良性新生物, 腸管穿孔, 肛門性器疣贅, 肛門狭窄, 横隔膜下膿瘍, 瘢痕ヘルニア, 鼡径ヘルニア, 胃酸過多, 膵腫大, 急性膵炎, 直腸腺腫, 胃腸異形成, 口唇痛, 唾液腺炎 (2) その他の副作用次のような症状があらわれた場合には, 症状に応じて適切な処置を行うこと. 5% 以上 1~5% 未満 1% 未満頻度不明 血液 リンパ 自己抗体陽 性 ( 抗 DNA 抗体陽性, 抗核抗体陽性 ) (17.1%) 感覚器結膜炎, 眼の中耳炎, 耳鳴, 眼瞼浮 異常感, 麦粒腫, 外耳炎, 白内障, 耳腫, 難聴不快感, 耳出血, 結膜出血, 眼脂, 乾性角結膜炎, 乱視, 眼瞼炎, 霰粒腫, 複視, 角膜炎, 角膜症, 高眼圧症, 光視症, 網膜変性, 網膜静脈閉塞, 高血圧性網膜症, 強膜出血, 強膜炎, 真珠腫, 緑内障, 耳痛, 角膜損傷, 耳垢栓塞, 角膜びらん, 眼出血, 硝子体浮遊物, 耳感染, 聴覚刺激検査異常, 流涙増加, 霧視, 一過性視力低下 呼吸器 上気道感染 ( 鼻咽頭炎等 ) (56.8%), 咳嗽 消化器 腹痛, 歯周痔核, 食道炎, 歯痛 ( 歯 病, 便秘, 悪知覚過敏を含む ), 胃心, 口内炎, 潰瘍, 口腔カンジダ症, 腸炎, 齲歯, 口内乾燥, 消化不良, 嘔吐, 胃炎, 歯肉腫脹, 腹部不快胃不快感, 口感, 腹部腫瘤, 痔瘻, 結唇炎, 腹部膨腸ポリープ,( 中略 ), 肛満, 口腔ヘル門周囲膿瘍, 歯髄炎, ペス, ウイル膵臓の良性新生物, 腸ス性胃腸炎, 管穿孔, 肛門性器疣 イレウス 贅, 肛門狭窄, 横隔膜 下膿瘍, 瘢痕ヘルニ ア, 鼡径ヘルニア, 胃 酸過多, 膵腫大, 急性 膵炎, 直腸腺腫, 胃腸 異形成, 口唇痛, 唾液 腺炎 5
16 改訂内容 つづき ( 該当部のみ抜粋 ) (2) その他の副作用 5% 以上 1~5% 未満 1% 未満 頻度不明 皮膚 紅斑, 蕁麻皮下出血, 脱毛症, 爪 疹, 毛包炎, 囲炎, 皮膚潰瘍, 皮膚皮膚炎 ( 接触乾燥, 過角化, 皮下組性皮膚炎, ア織膿瘍, 紫斑, 感染性レルギー性表皮嚢胞, 伝染性軟属皮膚炎を含腫, 皮膚細菌感染, 手む ), 皮膚真足口病, 膿痂疹, 膿皮菌感染, 皮膚症, 挫傷, 結核菌皮膚乳頭腫, 帯状テスト陽性, メラノサイト 疱疹, ざ瘡 性母斑, 脂漏性角化 症, 脂肪腫, 黄色腫, 紅色汗疹, ヘノッホ シェンライン紫斑病, 膿 疱性乾癬, 多汗症, 嵌 入爪, 乾癬, 水疱, 褥 瘡性潰瘍, 皮膚嚢腫, 発汗障害, 皮膚疼痛, 光線過敏性反応, 脂 漏, 皮膚びらん, 皮膚 剥脱, 皮膚硬結, 顔面 腫脹, 乾皮症, 黄色爪 症候群, せつ, 冷汗, 面皰, 皮膚エリテマトー デス, 痂皮, 皮膚小結 節, 肉芽腫, 肥厚性瘢 痕, 多形紅斑, 爪の障 害, 口唇色素沈着, 禿 瘡 筋骨格 背部痛, 関節骨折, 四肢痛, 筋痛, 骨 系 痛 粗鬆症, 滑液嚢腫, 腱断裂, 骨密度減少, 筋骨格硬直, 変形性脊椎炎, 関節破壊, 筋骨格系胸痛, 筋骨格痛, 環軸椎不安定, 鼡径部腫瘤, 椎間板突出, 関節腫脹, 四肢不快感, 腰部脊椎管狭窄, 筋痙縮, 筋力低下, 頚部痛, 骨関節炎, 肩回旋筋腱板症候群, 筋肉減少症, 関節炎, 関節障害, 四肢の結節, 脊椎すべり症, 臀部痛, 椎間板変性症, 関節周囲炎, 肩痛, 椎間板炎, 関節捻挫, 頚部腫瘤, 筋炎, 手根管症候群, 滑液包炎, ミオパチー, 骨壊死 内分泌系 甲状腺腫, 甲状腺機能 亢進症, 血中ヒト絨毛性ゴナドトロピン増加, 甲状腺機能低下症, 副腎腺腫, クッシング様症状 (2) その他の副作用 5% 以上 1~5% 未満 1% 未満 頻度不明 皮膚 紅斑, 蕁麻爪囲炎, 皮膚潰瘍, 皮 疹, 毛包炎, 膚乾燥, 過角化, 皮下皮膚炎 ( 接触組織膿瘍, 紫斑, 感染性皮膚炎, ア性表皮嚢胞, 伝染性軟レルギー性属腫, 皮膚細菌感染, 皮膚炎を含手足口病, 膿痂疹, 膿む ), 皮膚真皮症, 挫傷, 結核菌皮菌感染, 皮膚膚テスト陽性, メラノサイ乳頭腫, 皮下ト性母斑, 脂漏性角化出血, 帯状疱症, 脂肪腫, 黄色腫, 紅疹, ざ瘡, 脱色汗疹, ヘノッホ シェ 毛症 ンライン紫斑病, 膿疱性 乾癬, 多汗症, 嵌入爪, 乾癬, 水疱, 褥瘡性潰 瘍, 皮膚嚢腫, 発汗障 害, 皮膚疼痛, 光線過 敏性反応, 脂漏, 皮膚 びらん, 皮膚剥脱, 皮 膚硬結, 顔面腫脹, 乾 皮症, 黄色爪症候群, せつ, 冷汗, 面皰, 皮 膚エリテマトーデス, 痂 皮, 皮膚小結節, 肉芽 腫, 肥厚性瘢痕, 多形 紅斑, 爪の障害, 口唇 色素沈着 筋骨格系 内分泌系 骨折, 背部骨粗鬆症, 滑液嚢腫, 痛, 関節痛, 腱断裂, 骨密度減少, 四肢痛, 筋痛筋骨格硬直, 変形性脊椎炎, 関節破壊, 筋骨格系胸痛, 筋骨格痛, 環軸椎不安定, 鼡径部腫瘤, 椎間板突出, 関節腫脹, 四肢不快感, 腰部脊椎管狭窄, 筋痙縮, 筋力低下, 頚部痛, 骨関節炎, 肩回旋筋腱板症候群, 筋肉減少症, 関節炎, 関節障害, 四肢の結節, 脊椎すべり症, 臀部痛, 椎間板変性症, 関節周囲炎, 肩痛, 椎間板炎, 関節捻挫, 頚部腫瘤, 筋炎, 手根管症候群, 滑液包炎, ミオパチー 甲状腺腫, 甲状腺機能 亢進症, 血中ヒト絨毛性ゴナドトロピン増加, 甲状腺機能低下症, 副腎腺腫 6
17 改訂内容 つづき ( 該当部のみ抜粋 ) (2) その他の副作用 5% 以上 1~5% 未満 1% 未満 頻度不明 泌尿器 生殖器 投与部位 注射部位反応 ( 紅斑, そう痒感, 発疹, 出血, 腫脹, 硬結等 ) (25.6%) 血尿, 膀胱血中尿素増加, 尿中白 炎, 女性生殖血球エステラーゼ陽器系感染, 蛋性, 尿中ブドウ糖陽性, 白尿, 尿沈渣尿中ケトン体陽性, 尿中陽性細菌検出, 夜間頻尿, 不正子宮出血, 腎 尿路結石, 腎膿瘍, 血中クレアチニン増加, 子宮平滑筋腫, 腎機能障害, 頻尿, 慢性腎不全, 水腎症, 腎梗塞, 腺筋症, 性器出血, 月経過多, 前立腺炎, 陰部そう痒症, 腟分泌物, 尿 ph 上昇, 陰嚢水瘤, 尖圭コンジローマ, 淋疾, 尿道炎, 尿中結晶陽性, 排尿困難, 尿意切迫, 腎血管障害, 良性前立腺肥大症, 精巣上体炎, 膣腫脹, 前立腺特異性抗原増加, 緊張性膀胱, 無月経, 不規則月経, 閉経期症状 (2) その他の副作用 5% 以上 1~5% 未満 1% 未満 頻度不明 泌尿器 生殖器 投与部位 注射部位反応 ( 紅斑, そう痒感, 発疹, 出血, 腫脹, 硬結等 ) (26.3%) 血尿, 膀胱尿中白血球エステラー 炎, 女性生殖ゼ陽性, 尿中ブドウ糖器系感染, 蛋陽性, 尿中ケトン体陽白尿, 血中尿性, 尿中細菌検出, 夜素増加, 尿沈間頻尿, 不正子宮出渣陽性血, 腎 尿路結石, 腎膿瘍, 血中クレアチニン増加, 子宮平滑筋腫, 腎機能障害, 頻尿, 慢性腎不全, 水腎症, 腎梗塞, 腺筋症, 性器出血, 月経過多, 前立腺炎, 陰部そう痒症, 腟分泌物, 尿 ph 上昇, 陰嚢水瘤, 尖圭コンジローマ, 淋疾, 尿道炎, 尿中結晶陽性, 排尿困難, 尿意切迫, 腎血管障害, 良性前立腺肥大症, 精巣上体炎, 膣腫脹, 前立腺特異性抗原増加, 緊張性膀胱, 無月経, 不規則月経, 閉経期症状 改訂理由 感染性ぶどう膜炎の効能追加 ( 承認事項の 部変更承認 ) に伴い 関連する以下の項 について改訂致しました 1. 警告 の項本剤での治療を行う前に ぶどう膜炎に対する既存治療薬の使用を十分勘案してください また 副作用等に対する処置が適切に行えるよう 本剤についての十分な知識と非感染性ぶどう膜炎治療の経験をもつ眼科医と 本剤について十分な知識をもつ内科等の医師が診断と治療に対して十分な連携をとり使用することとし 自己投与の場合もその管理指導のもとで使用してください 2. 効能 効果 法 量 の項新たに承認された事項を記載するとともに 既存の内容についても記載整備致しました 3. 効能 効果に関連する使 上の注意 の項本剤による非感染性ぶどう膜炎治療は既存治療で効果不十分な場合にのみ適用されます 既存治療薬 ( ベーチェット病によるぶどう膜炎ではシクロスポリン等 その他の非感染性ぶどう膜炎では経口ステロイド剤等 ) による適切な治療を行っても 疾患に起因する明らかな臨床症状が残る場合に使用してください 7
18 4. 重要な基本的注意 の項非感染性ぶどう膜炎の臨床試験において サルコイドーシスを有する患者でサルコイドーシスの悪化が報告されています 本剤との関連性は明らかではありませんが サルコイドーシス患者に本剤を投与する場合には 十分な観察を行い サルコイドーシスの悪化に注意してください サルコイドーシス症状が悪化した場合には 適切な処置を行ってください また 非感染性ぶどう膜炎の臨床試験において認められた抗アダリムマブ抗体産生率の情報を追記しました 5. 副作 の項非感染性ぶどう膜炎の臨床試験において認められた副作用について 既存の副作用集計と合算し 副作用発現頻度及び その他の副作用 の記載を更新致しました 本製品の最新添付 書情報は PMDA ホームページ 医薬品に関する情報 からご覧下さい 8 CODE DI-J 年 9 月作成 (1703)
19 - 医薬品の適正使 に かせない情報です 必ずお読み下さい - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2016 年 6-7 月 この度 ヒュミラ 下注 40mg シリンジ 0.8mL 製剤の クローン病 の 法 量について 80mg への増量投与が追加承認されました これに伴い添付文書 ( 用法 用量 使用上の注意 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照下さいますようお願い申し上げます なお 改訂添付文書を封入した製品がお手元に届くまでに 日数を要する場合がございますので ご了承下さいますようお願い申し上げます 改訂内容ダイジェスト ( 詳細はお知らせ本 をご参照下さい ) 改訂の概要 改訂項目主な改訂内容備考 用法 用量用法 用量に関連する使用上の注意副作用 クローン病 の増量投与が追加承認されたこと承認事項の一部変に伴い それに関連する項目を改訂致しました 更 使用上の注意改訂内容は 医薬品安全対策情報 (Drug Safety Update) No.251 (2016 年 7 月発行予定 ) にも掲載される予定です 製品に関するお問合せ先: エーザイ株式会社 hhc ホットラインフリーダイヤル 時 ( 祝 9 17 時 ) 製品情報は エーザイホームページ( アッヴィホームページ ( にてご覧いただけます 注 ) 注意 - 医師等の処方箋により使用すること 1
20 改訂内容 ( 該当部のみ抜粋 ) 用法 用量関節リウマチ 尋常性乾癬及び関節症性乾癬 強直性脊椎炎 多関節に活動性を有する若年性特発性関節炎 腸管型ベーチェット病 クローン病通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 160mg を, 初回投与 2 週間後に 80mg を皮下注射する. 初回投与 4 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. なお, 効果が減弱した場合には 1 回 80mg に増量できる. 潰瘍性大腸炎 用法 用量関節リウマチ 尋常性乾癬及び関節症性乾癬 強直性脊椎炎 多関節に活動性を有する若年性特発性関節炎 腸管型ベーチェット病 クローン病通常, 成人にはアダリムマブ ( 遺伝子組換え ) として初回に 160mg を, 初回投与 2 週間後に 80mg を皮下注射する. 初回投与 4 週間後以降は,40mg を 2 週に 1 回, 皮下注射する. 潰瘍性大腸炎 < 用法 用量に関連する使用上の注意 > (1)~(6) (7) クローン病において, 本剤による治療反応は, 通常投与開始から 4 週以内に得られる.4 週時点で臨床症状や内視鏡所見等による治療反応が得られない場合は, 本剤の継続投与の必要性を検討し, 他の治療法への切替えを考慮すること. また,80mg への増量は,40mg による治療で効果は認められたものの, 維持療法中に効果が減弱した患者に対して行うこと.80mg に増量しても効果が得られない場合, 本剤の継続投与の必要性を慎重に再考すること. (8)~(9) < 用法 用量に関連する使用上の注意 > (1)~(6) (7) クローン病において, 本剤による治療反応は, 通常投与開始から 4 週以内に得られる.4 週時点で臨床症状や内視鏡所見等による治療反応が得られない場合, また, 寛解維持投与中に効果不十分となった場合は, 本剤の継続投与の必要性を検討し, 他の治療法への切替えを考慮すること. (8)~(9) 使用上の注意 4. 副作用本剤の臨床試験における副作用の発現状況は, 以下のとおりである. < 国内臨床試験 > 関節リウマチ, 尋常性乾癬, 関節症性乾癬, 強直性脊椎炎, 若年性特発性関節炎, 腸管型ベーチェット病, クローン病及び潰瘍性大腸炎の国内の臨床試験において, 安全性評価対象 1,252 例中 1,048 例 (83.7%) に副作用が認められ, その主なものは, 鼻咽頭炎 382 例 (30.5%), 注射部位紅斑 125 例 (10.0%), 注射部位反応 111 例 (8.9%), 発疹 97 例 (7.7%), 上気道感染 82 例 (6.5%) 等であった. 使用上の注意 4. 副作用本剤の臨床試験における副作用の発現状況は, 以下のとおりである. < 国内臨床試験 > 関節リウマチ, 尋常性乾癬, 関節症性乾癬, 強直性脊椎炎, 若年性特発性関節炎, 腸管型ベーチェット病, クローン病及び潰瘍性大腸炎の国内の臨床試験において, 安全性評価対象 1,224 例中 1,043 例 (85.2%) に副作用が認められ, その主なものは, 鼻咽頭炎 380 例 (31.0%), 注射部位紅斑 125 例 (10.2%), 注射部位反応 110 例 (9.0%), 発疹 97 例 (7.9%), 上気道感染 81 例 (6.6%) 等であった. (1) 重大な副作用 (2) その他の副作用次のような症状があらわれた場合には, 症状に応じて適切な処置を行うこと. 5% 以上 1~5% 未満 1% 未満頻度不明 血液 リンパ 自己抗体陽性 ( 抗 DNA 抗体陽性, 抗核抗体陽性 ) (17.1%) 呼吸器上気道感染 ( 鼻咽 頭炎等 )(56.8%), 咳嗽 投与部 注射部位反応 ( 紅 位 斑, そう痒感, 発疹, 出血, 腫脹, 硬結等 )(26.3%) (1) 重大な副作用 (2) その他の副作用次のような症状があらわれた場合には, 症状に応じて適切な処置を行うこと. 5% 以上 1~5% 未満 1% 未満頻度不明 血液 リンパ 呼吸器 投与部位 自己抗体陽性 ( 抗 DNA 抗体陽性, 抗核抗体陽性 ) (17.5%) 上気道感染 ( 鼻咽 頭炎等 )(57.8%), 咳嗽 注射部位反応 ( 紅 斑, そう痒感, 発疹, 出血, 腫脹, 硬結等 )(26.8%) 2
21 改訂理由 クローン病 の 法 量 追加承認 ( 承認事項の 部変更承認 ) に伴い 関連する以下の項 について改訂致しました 1. 法 量 の項効果が減弱した場合の増量投与について追記致しました 2. 法 量に関連する使 上の注意 の項 80mgへの増量については40mgで有効性が認められたものの 維持療法中に効果が減弱した症例について行うこと また 増量しても効果が得られない場合は 本剤継続の必要性を慎重に再考する旨を追記致しました 3. 副作 の項 クローン病の増量投与における国内臨床試験において認められた副作用について 既存の副作用集計と合算し 副作用発現頻度を更新致しました 本製品の最新添付 書情報は PMDA ホームページ 医薬品に関する情報 からご覧下さい 3
22 4 CODE DI-J 年 6 月作成 (1612)
膿疱性乾癬の効能追加 ( 承認事項の 部変更承認 ) に伴う改訂 改訂内容 ( 該当部のみ抜粋 ) 警告 1.~3. 4. 関節リウマチ患者では, 本剤の治療を行う前に, 少なくとも 1 剤の抗リウマチ薬等の使用を十分勘案すること. また, 本剤についての十分な知識とリウマチ治療の経験をもつ医師が使
 - 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
- 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
- 医薬品の適正使用に欠かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 生物由来製品 劇薬 処方箋医薬品 2019 年 2-3 月 この度 承認事項の一部変更として 化膿性汗腺炎 の効能 ( 追加 ) が新たに承認され 関連する事項について添付文書 ( 効能 効果 用法 用
 - 医薬品の適正使用に欠かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 生物由来製品 劇薬 処方箋医薬品 2019 年 2-3 月 この度 承認事項の一部変更として 化膿性汗腺炎 の効能 ( 追加 ) が新たに承認され 関連する事項について添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました また 承認に関連する事項以外においても使用上の注意を改訂致しました
- 医薬品の適正使用に欠かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 生物由来製品 劇薬 処方箋医薬品 2019 年 2-3 月 この度 承認事項の一部変更として 化膿性汗腺炎 の効能 ( 追加 ) が新たに承認され 関連する事項について添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました また 承認に関連する事項以外においても使用上の注意を改訂致しました
p 13
 p 12 p 13 p 14 p 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 10. 安全性 (1) 副作用 ( 臨床検査値異常を含む ) 総症例 1030 例中 副作用が報告されたのは 519 例 (50.4%) でした 主な症状は鼓腸 197 例 (19.1%) 下痢 188 例 (18.3%) 腹部膨満
p 12 p 13 p 14 p 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 10. 安全性 (1) 副作用 ( 臨床検査値異常を含む ) 総症例 1030 例中 副作用が報告されたのは 519 例 (50.4%) でした 主な症状は鼓腸 197 例 (19.1%) 下痢 188 例 (18.3%) 腹部膨満
改訂後改訂前 << 効能 効果に関連する使用上の注意 >> 関節リウマチ 1. 過去の治療において 少なくとも1 剤の抗リウマチ薬 ( 生物製剤を除く ) 等による適切な治療を行っても 疾患に起因する明らかな症状が残る場合に投与すること 2. 本剤とアバタセプト ( 遺伝子組換え ) の併用は行わな
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
Microsoft Word - オーソ_201302_Final.docx
 医薬品の適正使用に欠かせない情報です 必ずお読みください H24-11 平成 25 年 2 月 / ( ノルエチステロン エチニルエストラジオール錠 ) 使用上の注意改訂のご案内 製造販売元ヤンセンファーマ株式会社 / 発売元持田製薬株式会社 この度 オーソ 777-21 錠 / オーソ M-21 錠の 使用上の注意 を改訂致しましたので ご案内申し上げます 今後のご使用に際しましては 下記内容にご留意くださいますようお願い致します
医薬品の適正使用に欠かせない情報です 必ずお読みください H24-11 平成 25 年 2 月 / ( ノルエチステロン エチニルエストラジオール錠 ) 使用上の注意改訂のご案内 製造販売元ヤンセンファーマ株式会社 / 発売元持田製薬株式会社 この度 オーソ 777-21 錠 / オーソ M-21 錠の 使用上の注意 を改訂致しましたので ご案内申し上げます 今後のご使用に際しましては 下記内容にご留意くださいますようお願い致します
<4D F736F F D DC58F4994C5817A54524D5F8AB38ED28CFC88E396F B CF8945C8CF889CA92C789C1816A5F3294C52E646
 患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
ハイゼントラ20%皮下注1g/5mL・2g/10mL・4g/20mL
 CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
改訂後 ⑴ 依存性連用により薬物依存を生じることがあるので 観察を十分に行い 用量及び使用期間に注意し慎重に投与すること また 連用中における投与量の急激な減少ないし投与の中止により 痙攣発作 せん妄 振戦 不眠 不安 幻覚 妄想等の離脱症状があらわれることがあるので 投与を中止する場合には 徐々に
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ ETIZOLAM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること 注 1) 注意 - 習慣性あり注 2) 注意 - 医師等の処方箋により使用すること 向精神薬 習慣性医薬品注 1) 注 2) 処方箋医薬品 注 1) 注意 - 習慣性あり注 2) 注意 - 医師等の処方箋により使用すること 2017
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ ETIZOLAM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること 注 1) 注意 - 習慣性あり注 2) 注意 - 医師等の処方箋により使用すること 向精神薬 習慣性医薬品注 1) 注 2) 処方箋医薬品 注 1) 注意 - 習慣性あり注 2) 注意 - 医師等の処方箋により使用すること 2017
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
<4D F736F F D DC58F4994C5817A53544C2094E789BA928D5F8AB38ED28CFC834B F94CC94848CB392C78B4C C5292E646F63>
 ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
Microsoft Word - sa_niflec_ doc
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 年 3 月 26 日放送 第 29 回日本乾癬学会 2 乾癬本音トーク乾癬治療とメトトレキサート 名古屋市立大学大学院加齢 環境皮膚科教授森田明理 はじめに乾癬は 鱗屑を伴う紅色局面を特徴とする炎症性角化症です 全身のどこにでも皮疹は生じますが 肘や膝などの力がかかりやすい場所や体幹 腰部
 2015 年 3 月 26 日放送 第 29 回日本乾癬学会 2 乾癬本音トーク乾癬治療とメトトレキサート 名古屋市立大学大学院加齢 環境皮膚科教授森田明理 はじめに乾癬は 鱗屑を伴う紅色局面を特徴とする炎症性角化症です 全身のどこにでも皮疹は生じますが 肘や膝などの力がかかりやすい場所や体幹 腰部や下腿などが好発部位になります 被髪頭部 顔面 臀部 爪などは 難治な部位ですが 被髪頭部では頭部乾癬として
2015 年 3 月 26 日放送 第 29 回日本乾癬学会 2 乾癬本音トーク乾癬治療とメトトレキサート 名古屋市立大学大学院加齢 環境皮膚科教授森田明理 はじめに乾癬は 鱗屑を伴う紅色局面を特徴とする炎症性角化症です 全身のどこにでも皮疹は生じますが 肘や膝などの力がかかりやすい場所や体幹 腰部や下腿などが好発部位になります 被髪頭部 顔面 臀部 爪などは 難治な部位ですが 被髪頭部では頭部乾癬として
審査報告書 平成 28 年 5 月 16 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ヒュミラ皮下注 40 mg シリンジ 0.8 ml [ 一般名 ] アダリムマブ ( 遺伝子組換え )
![審査報告書 平成 28 年 5 月 16 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ヒュミラ皮下注 40 mg シリンジ 0.8 ml [ 一般名 ] アダリムマブ ( 遺伝子組換え ) 審査報告書 平成 28 年 5 月 16 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ヒュミラ皮下注 40 mg シリンジ 0.8 ml [ 一般名 ] アダリムマブ ( 遺伝子組換え )](/thumbs/98/135488646.jpg) 審査報告書 平成 28 年 5 月 16 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ヒュミラ皮下注 40 mg シリンジ 0.8 ml [ 一般名 ] アダリムマブ ( 遺伝子組換え ) [ 申請者 ] アッヴィ合同会社 [ 申請年月日 ] 平成 27 年 7 月 28 日 [ 剤形 含量
審査報告書 平成 28 年 5 月 16 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ヒュミラ皮下注 40 mg シリンジ 0.8 ml [ 一般名 ] アダリムマブ ( 遺伝子組換え ) [ 申請者 ] アッヴィ合同会社 [ 申請年月日 ] 平成 27 年 7 月 28 日 [ 剤形 含量
尋常性及び関節症性 副作用項目 眼脂 (0.6%) 眼出血 1 1 (0.2%) 眼痛 3 3 (0.6%) 眼そう痒症 1 1 (0.2%) 眼瞼浮腫 (1.1%) 緑内障 1 1 (0.2%) 角膜炎 1 1 (0.2%) 乾性角結膜炎 2 2 (0.4%) 角膜症 1
 1 国内の臨床試験において, 安全性評価対象 545 例中 523 例 (96.0%) に副作用が認められ, その主なものは, 鼻咽頭炎 227 例 (41.7%), 注射部位紅斑 104 例 (19.1%), 発疹 63 例 (11.6%), 上気道感染 54 例 (9.9%), 注射部位反応 54 例 (9.9%), 下痢 51 例 (9.4%), そう痒症 49 例 (9.0%) 等でした (
1 国内の臨床試験において, 安全性評価対象 545 例中 523 例 (96.0%) に副作用が認められ, その主なものは, 鼻咽頭炎 227 例 (41.7%), 注射部位紅斑 104 例 (19.1%), 発疹 63 例 (11.6%), 上気道感染 54 例 (9.9%), 注射部位反応 54 例 (9.9%), 下痢 51 例 (9.4%), そう痒症 49 例 (9.0%) 等でした (
市販直後調査の実施状況 デベルザ 錠 アプルウェイ 錠 一般的名称 イプラグリフロジン L- プロリン ダパグリフロジンプロピレン グリコール水和物 ルセオグリフロジン水和物 トホグリフロジン水和物 調査実施期間 製造承認 2014/04/30 製造承認 2014/08/22 製造承認 2014/0
 市販直後調査の副作用集計 市販直後調査期間 : 各販売元市販直後調査第三回中間報告より 市販直後調査の実施状況 デベルザ 錠 アプルウェイ 錠 一般的名称 イプラグリフロジン L- プロリン ダパグリフロジンプロピレン グリコール水和物 ルセオグリフロジン水和物 トホグリフロジン水和物 調査実施期間 製造承認 2014/04/30 製造承認 2014/08/22 製造承認 2014/08/14 製造承認
市販直後調査の副作用集計 市販直後調査期間 : 各販売元市販直後調査第三回中間報告より 市販直後調査の実施状況 デベルザ 錠 アプルウェイ 錠 一般的名称 イプラグリフロジン L- プロリン ダパグリフロジンプロピレン グリコール水和物 ルセオグリフロジン水和物 トホグリフロジン水和物 調査実施期間 製造承認 2014/04/30 製造承認 2014/08/22 製造承認 2014/08/14 製造承認
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
<4D F736F F D2082A8926D82E782B995B68F A A E5F89968FF E372E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意改訂のお知らせ 2011 年 7 月 東和薬品株式会社 このたび 標記製品の 使用上の注意 を改訂いたしましたのでお知らせ申し上げます なお 改訂添付文書を封入した製品がお手元に届くまでには日数を要する場合がございますので 今後のご使用に際しましては 下記内容にご留意くださいますようお願い申し上げます 1. 改訂内容 改訂後 ( 下線部改訂
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意改訂のお知らせ 2011 年 7 月 東和薬品株式会社 このたび 標記製品の 使用上の注意 を改訂いたしましたのでお知らせ申し上げます なお 改訂添付文書を封入した製品がお手元に届くまでには日数を要する場合がございますので 今後のご使用に際しましては 下記内容にご留意くださいますようお願い申し上げます 1. 改訂内容 改訂後 ( 下線部改訂
ヒアルロン酸ナトリウム架橋体製剤 特定使用成績調査
 ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び
![2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び 2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び](/thumbs/91/105459093.jpg) - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
タフィンラーカプセル50mg/75mg、メキニスト錠0.5mg/2mg 添付文書改訂のお知らせ
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 添付文書改訂のお知らせ 製造販売 2018 年 7 月 このたび 標記製品の効能又は効果の一部変更承認に伴い 添付文書の記載内容を改訂いたしましたのでお知らせいたします 今後のご使用に際しましてご参照下さいますようお願い申し上げます 効能又は効果 ( タフィンラーカプセル メキニスト錠共通 ) 改訂後 (2018 年 7 月改訂 ) 効能又は効果
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 添付文書改訂のお知らせ 製造販売 2018 年 7 月 このたび 標記製品の効能又は効果の一部変更承認に伴い 添付文書の記載内容を改訂いたしましたのでお知らせいたします 今後のご使用に際しましてご参照下さいますようお願い申し上げます 効能又は効果 ( タフィンラーカプセル メキニスト錠共通 ) 改訂後 (2018 年 7 月改訂 ) 効能又は効果
10038 W36-1 ワークショップ 36 関節リウマチの病因 病態 2 4 月 27 日 ( 金 ) 15:10-16:10 1 第 5 会場ホール棟 5 階 ホール B5(2) P2-203 ポスタービューイング 2 多発性筋炎 皮膚筋炎 2 4 月 27 日 ( 金 ) 12:4
 10001 P1-089 ポスタービューイング 1 関節リウマチの治療 :DMARDs NSAIDs 4 月 26 日 ( 木 ) 13:20-14:40 - ポスター 展示会場ホール E B2 階 ホール E 10002 P2-041 ポスタービューイング 2 関節リウマチの治療評価と予測 2 4 月 27 日 ( 金 ) 12:40-14:00 - ポスター 展示会場ホール E B2 階 ホール
10001 P1-089 ポスタービューイング 1 関節リウマチの治療 :DMARDs NSAIDs 4 月 26 日 ( 木 ) 13:20-14:40 - ポスター 展示会場ホール E B2 階 ホール E 10002 P2-041 ポスタービューイング 2 関節リウマチの治療評価と予測 2 4 月 27 日 ( 金 ) 12:40-14:00 - ポスター 展示会場ホール E B2 階 ホール
5. 死亡 (1) 死因順位の推移 ( 人口 10 万対 ) 順位年次 佐世保市長崎県全国 死因率死因率死因率 24 悪性新生物 悪性新生物 悪性新生物 悪性新生物 悪性新生物 悪性新生物 位 26 悪性新生物 350
 5. 死亡 () 死因順位の推移 ( 人口 0 万対 ) 順位年次 佐世保市長崎県全国 死因率死因率死因率 24 悪性新生物 328.4 悪性新生物 337.0 悪性新生物 286.6 25 悪性新生物 377.8 悪性新生物 354. 悪性新生物 290.3 位 26 悪性新生物 350.3 悪性新生物 355.7 悪性新生物 290.3 27 悪性新生物 332.4 悪性新生物 35. 悪性新生物
5. 死亡 () 死因順位の推移 ( 人口 0 万対 ) 順位年次 佐世保市長崎県全国 死因率死因率死因率 24 悪性新生物 328.4 悪性新生物 337.0 悪性新生物 286.6 25 悪性新生物 377.8 悪性新生物 354. 悪性新生物 290.3 位 26 悪性新生物 350.3 悪性新生物 355.7 悪性新生物 290.3 27 悪性新生物 332.4 悪性新生物 35. 悪性新生物
販売名 製造販売業者 インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書 (RMP) の概要 インフリキシマブ BS 点滴静注用 100mg CTH セルトリオン ヘルスケア ジャパン株式会社 ( 選任製造販売業者 ) 提出年月 有効成分 インフリキシマブ ( 遺伝
 インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はセルトリオン ヘルスケア ジャパン株式会社にあります 当該製品の適正使用以外の営利目的に本資料を利用することはできません セルトリオン ヘルスケア ジャパン株式会社 販売名 製造販売業者 インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書
インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はセルトリオン ヘルスケア ジャパン株式会社にあります 当該製品の適正使用以外の営利目的に本資料を利用することはできません セルトリオン ヘルスケア ジャパン株式会社 販売名 製造販売業者 インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書
Untitled
 重要な情報が記載されています ので 必ずお読み下さい 平成 29 年 3 月 販売元 製造販売元 使用上使用上の注意注意 改訂改訂のおのお知らせ 拝啓時下 益々ご清栄のこととお慶び申し上げます 平素は弊社製品につきまして格別のお引立てを賜り 厚く御礼申し上げます さて 平成 29 年 3 月 21 日付厚生労働省医薬厚生労働省医薬 生活衛生局安全対策課長通知生活衛生局安全対策課長通知によりにより 標記製品標記製品の
重要な情報が記載されています ので 必ずお読み下さい 平成 29 年 3 月 販売元 製造販売元 使用上使用上の注意注意 改訂改訂のおのお知らせ 拝啓時下 益々ご清栄のこととお慶び申し上げます 平素は弊社製品につきまして格別のお引立てを賜り 厚く御礼申し上げます さて 平成 29 年 3 月 21 日付厚生労働省医薬厚生労働省医薬 生活衛生局安全対策課長通知生活衛生局安全対策課長通知によりにより 標記製品標記製品の
適応病名とレセプト病名とのリンクDB
 データベース データベースの概要 添付文書に記載されている適応病名とそれに対応するレセプト病名を関連付けたデータベースです 保険請求に関連したレセプト病名の検索や薬品との整合性チェックを行うことが可能です 本データベースは 医療用医薬品の添付文書に記載されている全ての適応病名情報を網羅しており 下記参考情報のレセプト病名の改定 ( 年 2 回 ) にも対応しています 参考情報 : 傷病名マスター (
データベース データベースの概要 添付文書に記載されている適応病名とそれに対応するレセプト病名を関連付けたデータベースです 保険請求に関連したレセプト病名の検索や薬品との整合性チェックを行うことが可能です 本データベースは 医療用医薬品の添付文書に記載されている全ての適応病名情報を網羅しており 下記参考情報のレセプト病名の改定 ( 年 2 回 ) にも対応しています 参考情報 : 傷病名マスター (
改訂前 用法 用量 多発性骨髄腫デキサメタゾンとの併用において 通常 成人にはレナリドミドとして 1 日 1 回 25 mg を 21 日間連日経口投与した後 7 日間休薬する これを 1 サイクルとして投与を繰り返す なお 患者の状態により適宜減量する 5 番染色体長腕部欠失を伴う骨髄異形成症候群
 レブラミド カプセル 2.5mg 5mg 医薬品の適正使用に欠かせない情報です 必ずお読みください 平成 29 年 3 月 効能 効果 及び 用法 用量 の一部変更 使用上の注意改訂のお知らせ 製造販売元 : セルジーン株式会社 この度 標記製品について 効能 効果 を 再発又は難治性の成人 T 細胞白血病リンパ腫 とする承認事項一部変更が承認されたことに伴い 効能 効果 及び 用法 用量 を追加し
レブラミド カプセル 2.5mg 5mg 医薬品の適正使用に欠かせない情報です 必ずお読みください 平成 29 年 3 月 効能 効果 及び 用法 用量 の一部変更 使用上の注意改訂のお知らせ 製造販売元 : セルジーン株式会社 この度 標記製品について 効能 効果 を 再発又は難治性の成人 T 細胞白血病リンパ腫 とする承認事項一部変更が承認されたことに伴い 効能 効果 及び 用法 用量 を追加し
RA に対する長期投与試験 [RLN3] 13/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(2) 全症例 YM mg BID 投与時 YM mg BID 以上増量時 自律神経系障害 8(5.1%)[8] 2(
![RA に対する長期投与試験 [RLN3] 13/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(2) 全症例 YM mg BID 投与時 YM mg BID 以上増量時 自律神経系障害 8(5.1%)[8] 2( RA に対する長期投与試験 [RLN3] 13/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(2) 全症例 YM mg BID 投与時 YM mg BID 以上増量時 自律神経系障害 8(5.1%)[8] 2(](/thumbs/92/108546146.jpg) 2.7.6.43 RA に対する長期投与試験 [RLN3] 12/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(1) 全症例 YM177 200mg BID 投与時 関連性が否定できない害事象 YM177 300mg BID 以上増量時 安全性解析対象例数 156 156 45 全事象 135(86.5%)[412]37(23.7%)[50]122(78.2%)[325]31(19.9%)[41]
2.7.6.43 RA に対する長期投与試験 [RLN3] 12/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(1) 全症例 YM177 200mg BID 投与時 関連性が否定できない害事象 YM177 300mg BID 以上増量時 安全性解析対象例数 156 156 45 全事象 135(86.5%)[412]37(23.7%)[50]122(78.2%)[325]31(19.9%)[41]
感染性関節炎 1 件 1 件 感染性脊椎炎 1 件 1 件 耳帯状疱疹 1 件 1 件 口腔ヘルペス 3 件 3 件 ニューモシスチス イロベチイ肺炎 13 件 13 件 眼部単純ヘルペス 1 件 1 件 2 件 アスペルギルス感染 1 件 1 件 感染性胆管炎 1 件 1 件 良性 悪性および詳細
 感染症および寄生虫症 110 例 123 件 68 例 80 件 177 例 203 件 体部白癬 1 件 1 件 気管支炎 9 件 9 件 気管支肺炎 2 件 2 件 気管支肺アスペルギルス症 1 件 1 件 蜂巣炎 4 件 3 件 7 件 膀胱炎 2 件 2 件 サイトメガロウイルス肝炎 2 件 2 件 憩室炎 1 件 1 件 2 件 硬結性紅斑 1 件 1 件 せつ 2 件 2 件 胃腸炎 2
感染症および寄生虫症 110 例 123 件 68 例 80 件 177 例 203 件 体部白癬 1 件 1 件 気管支炎 9 件 9 件 気管支肺炎 2 件 2 件 気管支肺アスペルギルス症 1 件 1 件 蜂巣炎 4 件 3 件 7 件 膀胱炎 2 件 2 件 サイトメガロウイルス肝炎 2 件 2 件 憩室炎 1 件 1 件 2 件 硬結性紅斑 1 件 1 件 せつ 2 件 2 件 胃腸炎 2
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
デベルザ錠20mg 適正使用のお願い
 2014 年 3 月作成薬価基準未収載 - 医薬品の適正使用に欠かせない情報です 使用前に必ずお読みください - 適正使用のお願い 処方せん医薬品 : 注意 - 医師等の処方せんにより使用すること 製造販売元 販売元 適応となる患者さんとデベルザ錠の使い方 本剤を投与する前に 以下のことを確認してください 2 型糖尿病の患者さんですか 本剤の効能 効果は 2 型糖尿病 です 1 型糖尿病の患者さんは
2014 年 3 月作成薬価基準未収載 - 医薬品の適正使用に欠かせない情報です 使用前に必ずお読みください - 適正使用のお願い 処方せん医薬品 : 注意 - 医師等の処方せんにより使用すること 製造販売元 販売元 適応となる患者さんとデベルザ錠の使い方 本剤を投与する前に 以下のことを確認してください 2 型糖尿病の患者さんですか 本剤の効能 効果は 2 型糖尿病 です 1 型糖尿病の患者さんは
ヒュミラ皮下注20mgシリンジ0.4mL、ヒュミラ皮下注20mgシリンジ0.2mL、 ヒュミラ皮下注40mgシリンジ0.4mL、 ヒュミラ皮下注80mgシリンジ0.8mL、ヒュミラ皮下注40mgペン0.4mL、 ヒュミラ皮下注80mgペン0.8mL
 712000/R34 **2018 年 9 月改訂 ( 第 32 版 ) *2018 年 7 月改訂 貯法 : 遮光, 凍結を避け 2 ~ 8 で保存使用期限 : 製造後 2 年 ( 最終使用年月をラベル, 外箱に表示 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 )
712000/R34 **2018 年 9 月改訂 ( 第 32 版 ) *2018 年 7 月改訂 貯法 : 遮光, 凍結を避け 2 ~ 8 で保存使用期限 : 製造後 2 年 ( 最終使用年月をラベル, 外箱に表示 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 )
腹部膿瘍 1 件 1 件 細菌感染 1 件 1 件 細菌性肺炎 4 件 4 件 感染性脊椎炎 1 件 1 件 耳帯状疱疹 1 件 1 件 口腔ヘルペス 3 件 3 件 ニューモシスチス イロベチイ肺炎 13 件 13 件 眼部単純ヘルペス 1 件 1 件 2 件 アスペルギルス感染 1 件 1 件
 感染症および寄生虫症 121 例 134 件 72 例 85 件 191 例 219 件 体部白癬 1 件 1 件 気管支炎 9 件 9 件 気管支肺炎 2 件 2 件 気管支肺アスペルギルス症 1 件 1 件 蜂巣炎 4 件 3 件 7 件 膀胱炎 1 件 1 件 サイトメガロウイルス肝炎 2 件 2 件 播種性結核 1 件 1 件 憩室炎 1 件 1 件 2 件 硬結性紅斑 1 件 1 件 せつ
感染症および寄生虫症 121 例 134 件 72 例 85 件 191 例 219 件 体部白癬 1 件 1 件 気管支炎 9 件 9 件 気管支肺炎 2 件 2 件 気管支肺アスペルギルス症 1 件 1 件 蜂巣炎 4 件 3 件 7 件 膀胱炎 1 件 1 件 サイトメガロウイルス肝炎 2 件 2 件 播種性結核 1 件 1 件 憩室炎 1 件 1 件 2 件 硬結性紅斑 1 件 1 件 せつ
AC 療法について ( アドリアシン + エンドキサン ) おと治療のスケジュール ( 副作用の状況を考慮して 抗がん剤の影響が強く残っていると考えられる場合は 次回の治療開始を延期することがあります ) 作用めやすの時間 イメンドカプセル アロキシ注 1 日目は 抗がん剤の投与開始 60~90 分
 TC( 乳腺 ) 療法について ( ドセタキセル + エンドキサン ) おと治療のスケジュール ( 副作用の状況を考慮して 抗がん剤の影響が強く残っていると考えられる場合は 次回の治療開始を延期することがあります ) 作用めやすの時間 グラニセトロン注 ワンタキソテール注 1 時間 エンドキサン注 出血性膀胱炎 ( 血尿 排尿痛 ) 手足のしびれ 色素沈着 血小板減少 排尿時の不快感 尿に血が混ざるなどの症状があるときはお知らせください
TC( 乳腺 ) 療法について ( ドセタキセル + エンドキサン ) おと治療のスケジュール ( 副作用の状況を考慮して 抗がん剤の影響が強く残っていると考えられる場合は 次回の治療開始を延期することがあります ) 作用めやすの時間 グラニセトロン注 ワンタキソテール注 1 時間 エンドキサン注 出血性膀胱炎 ( 血尿 排尿痛 ) 手足のしびれ 色素沈着 血小板減少 排尿時の不快感 尿に血が混ざるなどの症状があるときはお知らせください
 医薬品の使用上の注意の改訂について ( 平成 14 年 6 月 5 日 ) ( 医薬安発第 0605002 号 ) ( 各都道府県衛生主管部 ( 局 ) 長あて厚生労働省医薬局安全対策課長通知 ) 医薬品の安全対策については 日頃よりご尽力いただいているところでありますが 今般 別添のとおり日本製薬団体連合会安全性委員会委員長あて通知及び連絡したので ご承知願います 医薬品の使用上の注意の改訂について
医薬品の使用上の注意の改訂について ( 平成 14 年 6 月 5 日 ) ( 医薬安発第 0605002 号 ) ( 各都道府県衛生主管部 ( 局 ) 長あて厚生労働省医薬局安全対策課長通知 ) 医薬品の安全対策については 日頃よりご尽力いただいているところでありますが 今般 別添のとおり日本製薬団体連合会安全性委員会委員長あて通知及び連絡したので ご承知願います 医薬品の使用上の注意の改訂について
h29c04
 総数 第 1 位第 2 位第 3 位第 4 位第 5 位 総数 悪性新生物 25,916 心疾患 14,133 肺炎 7,239 脳血管疾患 5,782 老衰 4,483 ( 29.8) ( 16.2) ( 8.3) ( 6.6) ( 5.1) PAGE - 1 0 歳 先天奇形 変形及び染色体異 38 胎児及び新生児の出血性障害 10 周産期に特異的な呼吸障害及 9 不慮の事故 9 妊娠期間及び胎児発育に関連
総数 第 1 位第 2 位第 3 位第 4 位第 5 位 総数 悪性新生物 25,916 心疾患 14,133 肺炎 7,239 脳血管疾患 5,782 老衰 4,483 ( 29.8) ( 16.2) ( 8.3) ( 6.6) ( 5.1) PAGE - 1 0 歳 先天奇形 変形及び染色体異 38 胎児及び新生児の出血性障害 10 周産期に特異的な呼吸障害及 9 不慮の事故 9 妊娠期間及び胎児発育に関連
レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14 回 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 29 年 10 月 1.1. 安全性検討事項 重要な特
 レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
301128_課_薬生薬審発1128第1号_ニボルマブ(遺伝子組換え)製剤の最適使用推進ガイドラインの一部改正について
 薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
ヒュミラ の投与 p7~11 参照 ヒュミラ 治療スケジュール 適正な患者の選択 p1~4 参照インフォームド コンセント p5 参照 問診 検査での確認 p6 参照 適合 患者への注意喚起 p12 参照副作用のモニタリング p13~24 参照 本冊子中では, 日本国内で承認されたヒュミラの名称を有
 医薬品リスク管理計画 (RMP) 適正使用ガイド 禁忌 ( 次の患者には投与しないこと ) 1. 重篤な感染症 ( 敗血症等 ) の患者 [ 症状を悪化させるおそれがある.] 2. 活動性結核の患者 [ 症状を悪化させるおそれがある.] 3. 本剤の成分に対し過敏症の既往歴のある患者 4. 脱髄疾患 ( 多発性硬化症等 ) 及びその既往歴のある患者 [ 症状の再燃及び悪化のおそれがある.] 5. うっ血性心不全の患者
医薬品リスク管理計画 (RMP) 適正使用ガイド 禁忌 ( 次の患者には投与しないこと ) 1. 重篤な感染症 ( 敗血症等 ) の患者 [ 症状を悪化させるおそれがある.] 2. 活動性結核の患者 [ 症状を悪化させるおそれがある.] 3. 本剤の成分に対し過敏症の既往歴のある患者 4. 脱髄疾患 ( 多発性硬化症等 ) 及びその既往歴のある患者 [ 症状の再燃及び悪化のおそれがある.] 5. うっ血性心不全の患者
化膿性汗腺炎におけるアダリムマブの使用上の注意 / 化膿性汗腺炎の診療の手引き アダリムマブ 化膿性汗腺炎診療の手引き策定委員会 照井 1 正 6 鳥居秀嗣 2 大槻マミ太郎 林 7 伸和 3 黒川一郎 8 森田明理 4 佐藤伸一 5 高橋健造 目的 アダリムマブは皮膚科領域において尋常性乾癬, 関
 化膿性汗腺炎におけるアダリムマブの使用上の注意 / 化膿性汗腺炎の診療の手引き アダリムマブ 化膿性汗腺炎診療の手引き策定委員会 照井 1 正 6 鳥居秀嗣 2 大槻マミ太郎 林 7 伸和 3 黒川一郎 8 森田明理 4 佐藤伸一 5 高橋健造 目的 アダリムマブは皮膚科領域において尋常性乾癬, 関 節症性乾癬, 膿疱性乾癬の適応症を有する生物学的製 剤の一つである.2019 年 2 月に化膿性汗腺炎がアダリ
化膿性汗腺炎におけるアダリムマブの使用上の注意 / 化膿性汗腺炎の診療の手引き アダリムマブ 化膿性汗腺炎診療の手引き策定委員会 照井 1 正 6 鳥居秀嗣 2 大槻マミ太郎 林 7 伸和 3 黒川一郎 8 森田明理 4 佐藤伸一 5 高橋健造 目的 アダリムマブは皮膚科領域において尋常性乾癬, 関 節症性乾癬, 膿疱性乾癬の適応症を有する生物学的製 剤の一つである.2019 年 2 月に化膿性汗腺炎がアダリ
改訂の理由及び調査の結果直近 3 年度の国内副作用症例の集積状況 転帰死亡症例 国内症例が集積したことから専門委員の意見も踏まえた調査の結果 改訂することが適切と判断した 低カルニチン血症関連症例 16 例 死亡 0 例
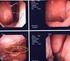 ピボキシル基を有する抗菌薬の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1セフカペンピボキシ 1フロモックス小児用細粒 100mg 同錠ル塩酸塩水和物 75mg 同錠 100mg( 塩野義製薬株式 2セフジトレンピボキ会社 ) 他シル 2メイアクト MS 小児用細粒 10% 同 3セフテラムピボキシ MS 錠 100mg(Meiji Seika
ピボキシル基を有する抗菌薬の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1セフカペンピボキシ 1フロモックス小児用細粒 100mg 同錠ル塩酸塩水和物 75mg 同錠 100mg( 塩野義製薬株式 2セフジトレンピボキ会社 ) 他シル 2メイアクト MS 小児用細粒 10% 同 3セフテラムピボキシ MS 錠 100mg(Meiji Seika
< 本冊子について > ヒュミラ は, 本邦ではアッヴイ合同会社 ( 承認時はアボットジャパン株式会社 ) とエーザイ株式会社が共同開発し,2008 年 4 月, 隔週 1 回投与の皮下注射製剤として承認されました. ヒュミラ は発売開始後, 使用成績調査等より安全性情報を集積しておりますが, 重篤
 医薬品リスク管理計画 (RMP) 適正使用ガイド 禁忌 ( 次の患者には投与しないこと ) 1. 重篤な感染症 ( 敗血症等 ) の患者 [ 症状を悪化させるおそれがある.] 2. 活動性結核の患者 [ 症状を悪化させるおそれがある.] 3. 本剤の成分に対し過敏症の既往歴のある患者 4. 脱髄疾患 ( 多発性硬化症等 ) 及びその既往歴のある患者 [ 症状の再燃及び悪化のおそれがある.] 5. うっ血性心不全の患者
医薬品リスク管理計画 (RMP) 適正使用ガイド 禁忌 ( 次の患者には投与しないこと ) 1. 重篤な感染症 ( 敗血症等 ) の患者 [ 症状を悪化させるおそれがある.] 2. 活動性結核の患者 [ 症状を悪化させるおそれがある.] 3. 本剤の成分に対し過敏症の既往歴のある患者 4. 脱髄疾患 ( 多発性硬化症等 ) 及びその既往歴のある患者 [ 症状の再燃及び悪化のおそれがある.] 5. うっ血性心不全の患者
5_使用上の注意(37薬効)Web作業用.indd
 34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
Microsoft Word - LIA RMP_概要ver2.docx
 リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
<4D F736F F D2082A8926D82E782B995B68F C D815B838B43505F4F E31302E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
2. 改訂内容と改訂理由 (1) 効能 効果 改訂後 ( 下線部 : 改訂部分 ) 効能 効果 気管支喘息 ( 既存治療によっても喘息症状をコントロールできない難治の患者に限る ) 既存治療で効果不十分な好酸球性多発血管炎性肉 改訂前 効能 効果 気管支喘息 ( 既存治療によっても喘息症状をコントロ
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量使用上の注意改訂のお知らせ 2018 年 5 月 ヒト化抗 IL-5 モノクローナル抗体 ( 一般名 : メポリズマブ ( 遺伝子組換え )) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 効能 効果 用法 用量 使用上の注意
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量使用上の注意改訂のお知らせ 2018 年 5 月 ヒト化抗 IL-5 モノクローナル抗体 ( 一般名 : メポリズマブ ( 遺伝子組換え )) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 効能 効果 用法 用量 使用上の注意
ラベキュアパック200・400 使用上の注意改訂のお知らせ_ pdf
 医薬品の適正使用に欠かせない情報です 必ずお読みください 使用上の注意改訂のお知らせ 処方箋医薬品注意 - 医師等の処方箋により使用すること 2017 年 2-3 月 このたび 標記製品の使用上の注意を下記のとおり改訂致しました 今後のご使用に際しましては 下記内容をご参照頂き 本書を適正使用情報としてご活用頂きますようお願い申し上げます 改訂内容ダイジェスト ( 詳細はお知らせ本文をご参照下さい
医薬品の適正使用に欠かせない情報です 必ずお読みください 使用上の注意改訂のお知らせ 処方箋医薬品注意 - 医師等の処方箋により使用すること 2017 年 2-3 月 このたび 標記製品の使用上の注意を下記のとおり改訂致しました 今後のご使用に際しましては 下記内容をご参照頂き 本書を適正使用情報としてご活用頂きますようお願い申し上げます 改訂内容ダイジェスト ( 詳細はお知らせ本文をご参照下さい
< F B A838B93EE8D70959B8DEC A E786C73>
 1 テラ コートリル軟膏オキシテトラサイクリン塩酸塩 ヒドロコルチゾン気持ちが悪い未知非重篤不明疑われるテラ コートリル軟膏オキシテトラサイクリン塩酸塩 ヒドロコルチゾン胃痛未知非重篤不明疑われる 2 テラ コートリル軟膏 オキシテトラサイクリン塩酸塩 ヒドロコルチゾン 赤黒くかぶれた 既知 非重篤 不明 否定できない 3 テラ コートリル軟膏 オキシテトラサイクリン塩酸塩 ヒドロコルチゾン 接触性皮膚炎
1 テラ コートリル軟膏オキシテトラサイクリン塩酸塩 ヒドロコルチゾン気持ちが悪い未知非重篤不明疑われるテラ コートリル軟膏オキシテトラサイクリン塩酸塩 ヒドロコルチゾン胃痛未知非重篤不明疑われる 2 テラ コートリル軟膏 オキシテトラサイクリン塩酸塩 ヒドロコルチゾン 赤黒くかぶれた 既知 非重篤 不明 否定できない 3 テラ コートリル軟膏 オキシテトラサイクリン塩酸塩 ヒドロコルチゾン 接触性皮膚炎
副作用収集状況 市販直後調査期間中 (2011 年 4 月 11 日 ~2011 年 10 月 31 日 ) に収集された副作用は 200 例 258 件でした そのうち 重篤な副作用は 8 例 14 件でした 副作用の内訳を表 1 に示します 重篤な副作用は 高カルシウム血症 3 件 意識変容状態
 医師 薬剤師の先生方へ 2012 年 1 月 中外製薬株式会社 安全管理責任者 エディロール R カプセル 0.5µg 0.75µg 市販直後調査結果のご報告 市販直後調査期間 :2011 年 4 月 11 日 ~2011 年 10 月 31 日 謹啓 先生方におかれましては ますますご清祥のこととお慶び申し上げます 平素は格別のご高配を賜り 厚く御礼申し上げます エディロール カプセル 0.5µg
医師 薬剤師の先生方へ 2012 年 1 月 中外製薬株式会社 安全管理責任者 エディロール R カプセル 0.5µg 0.75µg 市販直後調査結果のご報告 市販直後調査期間 :2011 年 4 月 11 日 ~2011 年 10 月 31 日 謹啓 先生方におかれましては ますますご清祥のこととお慶び申し上げます 平素は格別のご高配を賜り 厚く御礼申し上げます エディロール カプセル 0.5µg
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
pdf0_1ページ目
 平成 年 月 日 担 当 課 衛生環境研究所 ( 担当者 ) ( 高田 梁川 ) 電話 5-5-5 鳥取県感染症流行情報 第 週 [ 平成 年 月 7 日 ( 月 ) ~ 月 日 ( 日 ) ] 疾 病 名 東 部 中 部 西 部 イ ン フ ル エ ン ザ 感 染 性 胃 腸 炎 〇 水 痘 ( 水 ぼ う そ う ) 〇 流行性耳下腺炎 ( おたふくかぜ ) 〇 手 足 口 病 〇 ヘ ル パ
平成 年 月 日 担 当 課 衛生環境研究所 ( 担当者 ) ( 高田 梁川 ) 電話 5-5-5 鳥取県感染症流行情報 第 週 [ 平成 年 月 7 日 ( 月 ) ~ 月 日 ( 日 ) ] 疾 病 名 東 部 中 部 西 部 イ ン フ ル エ ン ザ 感 染 性 胃 腸 炎 〇 水 痘 ( 水 ぼ う そ う ) 〇 流行性耳下腺炎 ( おたふくかぜ ) 〇 手 足 口 病 〇 ヘ ル パ
スライド 1
 入院患者内訳 退院時年齢による年代別内訳 22 3.9% 年代男性女性計割合 ~29 2 3 0.3% 70~79 6 8.3% 880 ( 人 ) 398 5.2% 80~89 30~39 0 0 0 0.0% 0~9 7 8 0.9% 50~59 6 7.9% 60~69 6 3 92 0.5% 70~79 87 7 6 8.3% 80~89 83 25 398 5.2% 90~99 99 22.6%
入院患者内訳 退院時年齢による年代別内訳 22 3.9% 年代男性女性計割合 ~29 2 3 0.3% 70~79 6 8.3% 880 ( 人 ) 398 5.2% 80~89 30~39 0 0 0 0.0% 0~9 7 8 0.9% 50~59 6 7.9% 60~69 6 3 92 0.5% 70~79 87 7 6 8.3% 80~89 83 25 398 5.2% 90~99 99 22.6%
pdf0_1ページ目
 平成 年 月 日 担 当 課 衛生環境研究所 ( 担当者 ) ( 高田 梁川 ) 電話 -- 鳥取県感染症流行情報 第 [ 平成 年 月 7 日 ( 月 ) ~ 月 日 ( 日 祝 ) ] 疾 病 名 東 部 中 部 西 部 イ ン フ ル エ ン ザ 〇 感 染 性 胃 腸 炎 〇 〇 〇 水 痘 ( 水 ぼ う そ う ) 流行性耳下腺炎 ( おたふくかぜ ) 手 足 口 病 〇 〇 〇 ヘ ル
平成 年 月 日 担 当 課 衛生環境研究所 ( 担当者 ) ( 高田 梁川 ) 電話 -- 鳥取県感染症流行情報 第 [ 平成 年 月 7 日 ( 月 ) ~ 月 日 ( 日 祝 ) ] 疾 病 名 東 部 中 部 西 部 イ ン フ ル エ ン ザ 〇 感 染 性 胃 腸 炎 〇 〇 〇 水 痘 ( 水 ぼ う そ う ) 流行性耳下腺炎 ( おたふくかぜ ) 手 足 口 病 〇 〇 〇 ヘ ル
Microsoft Word - JAID_JSC 2014 正誤表_ 原稿
 JAID/JSC 感染症治療ガイド 2014 表 記載にりがありましたので, 下記のように追加 訂させていただきます 2016 年 9 月 JAID/JSC 感染症治療ガイド ガイドライン作成委員会 P106 Ⅶ 呼吸器感染症,A-2 院内肺炎 3 Definitive Therapy P. aeruginosa 多剤耐性の場合 CL:5mg/kg 1 回ローディング その 24 時間後に以下の維持用量を開始する
JAID/JSC 感染症治療ガイド 2014 表 記載にりがありましたので, 下記のように追加 訂させていただきます 2016 年 9 月 JAID/JSC 感染症治療ガイド ガイドライン作成委員会 P106 Ⅶ 呼吸器感染症,A-2 院内肺炎 3 Definitive Therapy P. aeruginosa 多剤耐性の場合 CL:5mg/kg 1 回ローディング その 24 時間後に以下の維持用量を開始する
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
より詳細な情報を望まれる場合は 担当の医師または薬剤師におたずねください また 患者向医薬品ガイド 医療専門家向けの 添付文書情報 が医薬品医療機器総合機構のホームページに掲載されています
 くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
OK__
 0年月改訂の製品情報概要より ゼローダ錠 00 単剤療法における副作用発現状況の概要 0年月改訂の製品情報概要より つづき 0年月改訂の製品情報概要より 0年月改訂の製品情報概要より 0年月改訂の製品情報概要より 0年月改訂の製品情報概要より 他の抗悪性腫瘍剤との併用投与時における副作用発現状況の概要 承認時迄の調査例 注 において 副作用は例(00 )に認められた 主な副作用は 神経毒性 末梢性感覚ニューロパシー
0年月改訂の製品情報概要より ゼローダ錠 00 単剤療法における副作用発現状況の概要 0年月改訂の製品情報概要より つづき 0年月改訂の製品情報概要より 0年月改訂の製品情報概要より 0年月改訂の製品情報概要より 0年月改訂の製品情報概要より 他の抗悪性腫瘍剤との併用投与時における副作用発現状況の概要 承認時迄の調査例 注 において 副作用は例(00 )に認められた 主な副作用は 神経毒性 末梢性感覚ニューロパシー
た 18 歳以上の AD/HD 患者を対象に 日本人を含むアジア人によるプラセボ対照二重盲検比較試験及びその長期継続投与試験が現在実施されており 本剤の製造販売者によれば これらの試験成績に基づき 本剤の成人期 AD/HD 患者への追加適応に関する承認事項一部変更承認申請が行われる予定とされている
 ( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
桜町病院対応病名小分類別 診療科別 手術数 (2017/04/ /03/31) D12 D39 Ⅳ G64 女性生殖器の性状不詳又は不明の新生物 D48 その他及び部位不明の性状不詳又は不明の新生物 Ⅲ 総数 構成比 (%) 該当無し Ⅰ 感染症及び寄生虫症 Ⅱ 新生物 C54 子宮体部
 D12 D39 Ⅳ G64 女性生殖器の性状不詳又は不明の新生物 D48 その他及び部位不明の性状不詳又は不明の新生物 Ⅲ 総数 構成比 (%) 該当無し Ⅰ 感染症及び寄生虫症 Ⅱ 新生物 C54 子宮体部の悪性新生物 結腸 直腸 肛門及び肛門管の良性新生物 D25 子宮平滑筋腫 D27 卵巣の良性新生物 血液及び造血器の疾患並びに免疫機構の障害 内分泌 栄養及び代謝疾患 Ⅴ 精神及び行動の障害
D12 D39 Ⅳ G64 女性生殖器の性状不詳又は不明の新生物 D48 その他及び部位不明の性状不詳又は不明の新生物 Ⅲ 総数 構成比 (%) 該当無し Ⅰ 感染症及び寄生虫症 Ⅱ 新生物 C54 子宮体部の悪性新生物 結腸 直腸 肛門及び肛門管の良性新生物 D25 子宮平滑筋腫 D27 卵巣の良性新生物 血液及び造血器の疾患並びに免疫機構の障害 内分泌 栄養及び代謝疾患 Ⅴ 精神及び行動の障害
タルグレチンカプセル75mg‗副作用報告状況
 副作用報告状況 集計期間 :2016 年 6 月 23 日 ~2019 年 1 月 21 日 謹啓時下 ますますご清祥のこととお慶び申し上げます 平素は弊社製品につき格別のご高配を賜り厚く御礼申し上げます さて 本剤の発売開始 (2016 年 6 月 23 日 )~2019 年 1 月 21 日の副作用報告状況を取りまとめましたのでご報告いたします 本剤のより一層の適正使用にお役立て頂ければ誠に幸甚と存じます
副作用報告状況 集計期間 :2016 年 6 月 23 日 ~2019 年 1 月 21 日 謹啓時下 ますますご清祥のこととお慶び申し上げます 平素は弊社製品につき格別のご高配を賜り厚く御礼申し上げます さて 本剤の発売開始 (2016 年 6 月 23 日 )~2019 年 1 月 21 日の副作用報告状況を取りまとめましたのでご報告いたします 本剤のより一層の適正使用にお役立て頂ければ誠に幸甚と存じます
ルミセフによる治療を受ける方へ
 医薬品リスク管理計画 (RMP) ルミセフ による治療を受ける方へ < 第 4 版 > 本資材は RMP の一環として位置付けられた資材です 監修 : 東京慈恵会医科大学名誉教授 中川秀己先生 目次 ルミセフ とは 3 どのような人がルミセフ の治療を受けられますか? 4 治療に際して どのような検査を行いますか? 5 ルミセフ の治療はどのように行いますか? 6 注意すべきことはありますか? 7
医薬品リスク管理計画 (RMP) ルミセフ による治療を受ける方へ < 第 4 版 > 本資材は RMP の一環として位置付けられた資材です 監修 : 東京慈恵会医科大学名誉教授 中川秀己先生 目次 ルミセフ とは 3 どのような人がルミセフ の治療を受けられますか? 4 治療に際して どのような検査を行いますか? 5 ルミセフ の治療はどのように行いますか? 6 注意すべきことはありますか? 7
Microsoft Word エリンダシン使注意.doc
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意改訂のお知らせ エルカトニン製剤 劇薬 指定医薬品 処方せん医薬品 ( 注意 - 医師等の処方せんにより使用すること ) エリンダシン注 10 単位 エリンダシン注 20 単位 エリンダシン注 このたび エルカトニン製剤エリンダシン注 10 単位 エリンダシン注 20 単位及びエリンダシン注 [ 東菱薬品工業 製造販売 ] につきまして
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意改訂のお知らせ エルカトニン製剤 劇薬 指定医薬品 処方せん医薬品 ( 注意 - 医師等の処方せんにより使用すること ) エリンダシン注 10 単位 エリンダシン注 20 単位 エリンダシン注 このたび エルカトニン製剤エリンダシン注 10 単位 エリンダシン注 20 単位及びエリンダシン注 [ 東菱薬品工業 製造販売 ] につきまして
160223メトトレキサート1_4.indd
 使用上の注意改訂のお知らせ 2016 年 3 月 田辺三菱製薬株式会社 このたび 標記製品につきまして 使用上の注意 を改訂しましたのでお知らせ致します 今後のご使用に際しましては 下記内容をご参照下さいますようお願い致します 改訂概要 改訂項目改訂内容 副作用 ( その他の副作用 ) 悪寒を追記し 先発医薬品の記載順に合わせて記載整備しました -1- 使用上の注意 の改訂内容 (3~6 頁に改訂後の
使用上の注意改訂のお知らせ 2016 年 3 月 田辺三菱製薬株式会社 このたび 標記製品につきまして 使用上の注意 を改訂しましたのでお知らせ致します 今後のご使用に際しましては 下記内容をご参照下さいますようお願い致します 改訂概要 改訂項目改訂内容 副作用 ( その他の副作用 ) 悪寒を追記し 先発医薬品の記載順に合わせて記載整備しました -1- 使用上の注意 の改訂内容 (3~6 頁に改訂後の
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
自己免疫疾患の治療ハンドブック 他の医療機関を受診される場合は本剤を服用中である旨を必ず医師にお伝えください 主治医または薬剤師の連絡先 川崎医科大学リウマチ 膠原病学 ( 17 年 3 月印刷 )IS-NK PRG23011A01 教授守田吉孝先生
 自己免疫疾患の治療ハンドブック 他の医療機関を受診される場合は本剤を服用中である旨を必ず医師にお伝えください 主治医または薬剤師の連絡先 川崎医科大学リウマチ 膠原病学 ( 17 年 3 月印刷 )IS-NK PRG23011A01 教授守田吉孝先生 はじめに 免疫抑制療法が行われる疾患 私たちの体には 外部からの異物や危険な物質を排除して体を守ろうとする 免疫 という生体防御システムが備わっています
自己免疫疾患の治療ハンドブック 他の医療機関を受診される場合は本剤を服用中である旨を必ず医師にお伝えください 主治医または薬剤師の連絡先 川崎医科大学リウマチ 膠原病学 ( 17 年 3 月印刷 )IS-NK PRG23011A01 教授守田吉孝先生 はじめに 免疫抑制療法が行われる疾患 私たちの体には 外部からの異物や危険な物質を排除して体を守ろうとする 免疫 という生体防御システムが備わっています
クラリチンドライシロップ 1% クラリチン錠 10mg クラリチンレディタブ錠 10mg 第 1 部申請書等行政情報及び添付文書に関する情報 (7) 同種同効品一覧 シェリング プラウ株式会社
 クラリチンドライシロップ 1% クラリチン錠 10mg クラリチンレディタブ錠 10mg 第 1 部申請書等行政情報及び添付文書に関する情報 (7) 同種同効品一覧 シェリング プラウ株式会社 Loratadine Section 1.7 Listing of Similar drugs 表 1.7-1 同種同効品一覧 ( ロラタジン, 塩酸オロパタジン )(1 of 5) ロラタジン塩酸オロパタジンクラリチン
クラリチンドライシロップ 1% クラリチン錠 10mg クラリチンレディタブ錠 10mg 第 1 部申請書等行政情報及び添付文書に関する情報 (7) 同種同効品一覧 シェリング プラウ株式会社 Loratadine Section 1.7 Listing of Similar drugs 表 1.7-1 同種同効品一覧 ( ロラタジン, 塩酸オロパタジン )(1 of 5) ロラタジン塩酸オロパタジンクラリチン
健康な生活を送るために(高校生用)第2章 喫煙、飲酒と健康 その2
 11 1 長期にわたる大量飲酒が 引き起こす影響 脳への影響 アルコールは 脳の神経細胞に影響を及ぼし その結果 脳が縮んでいきます 脳に対 するアルコールの影響は 未成年者で特に強いことが知られています 写真B 写真A 正常な脳のCT 写真C 写真D アルコール 依 存 症 患者の脳の 正常な脳のCT Aに比べてやや CT Aとほぼ同じ高さの位置の 低い位置の断面 断面 脳の外側に溝ができ 中央
11 1 長期にわたる大量飲酒が 引き起こす影響 脳への影響 アルコールは 脳の神経細胞に影響を及ぼし その結果 脳が縮んでいきます 脳に対 するアルコールの影響は 未成年者で特に強いことが知られています 写真B 写真A 正常な脳のCT 写真C 写真D アルコール 依 存 症 患者の脳の 正常な脳のCT Aに比べてやや CT Aとほぼ同じ高さの位置の 低い位置の断面 断面 脳の外側に溝ができ 中央
目次 C O N T E N T S 1 下痢等の胃腸障害 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副
 目次 C O N T E N T S 1 下痢等の胃腸障害 3 1.1 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 5 1.2 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副作用発現状況 6 胃腸障害に関連する重篤な副作用発現症例 6 1.3 消化性潰瘍, 炎症性腸疾患等の胃腸疾患のある患者さんにおける安全性について
目次 C O N T E N T S 1 下痢等の胃腸障害 3 1.1 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 5 1.2 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副作用発現状況 6 胃腸障害に関連する重篤な副作用発現症例 6 1.3 消化性潰瘍, 炎症性腸疾患等の胃腸疾患のある患者さんにおける安全性について
患者向医薬品ガイド
 患者向医薬品ガイド 2013 年 6 月作成 オレンシア皮下注 125mg シリンジ 一般名アバタセプト ( 遺伝子組換え ) 含有量 (1 シリンジ中 125mg) この薬の効果は? この薬は 抗リウマチ薬と呼ばれるグループに属する注射薬です この薬は 免疫をつかさどる T リンパ球という細胞 (T 細胞 ) のはたらきを抑えます これにより サイトカインという炎症や痛みにかかわっている物質が過剰に作られなくなり
患者向医薬品ガイド 2013 年 6 月作成 オレンシア皮下注 125mg シリンジ 一般名アバタセプト ( 遺伝子組換え ) 含有量 (1 シリンジ中 125mg) この薬の効果は? この薬は 抗リウマチ薬と呼ばれるグループに属する注射薬です この薬は 免疫をつかさどる T リンパ球という細胞 (T 細胞 ) のはたらきを抑えます これにより サイトカインという炎症や痛みにかかわっている物質が過剰に作られなくなり
耐性菌届出基準
 37 ペニシリン耐性肺炎球菌感染症 (1) 定義ペニシリン G に対して耐性を示す肺炎球菌による感染症である (2) 臨床的特徴小児及び成人の化膿性髄膜炎や中耳炎で検出されるが その他 副鼻腔炎 心内膜炎 心嚢炎 腹膜炎 関節炎 まれには尿路生殖器感染から菌血症を引き起こすこともある 指定届出機関の管理者は 当該指定届出機関の医師が (2) の臨床的特徴を有する者を診察した結果 症状や所見からペニシリン耐性肺炎球菌感染症が疑われ
37 ペニシリン耐性肺炎球菌感染症 (1) 定義ペニシリン G に対して耐性を示す肺炎球菌による感染症である (2) 臨床的特徴小児及び成人の化膿性髄膜炎や中耳炎で検出されるが その他 副鼻腔炎 心内膜炎 心嚢炎 腹膜炎 関節炎 まれには尿路生殖器感染から菌血症を引き起こすこともある 指定届出機関の管理者は 当該指定届出機関の医師が (2) の臨床的特徴を有する者を診察した結果 症状や所見からペニシリン耐性肺炎球菌感染症が疑われ
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認され
 ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI 関連の企業などはありません
 医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
高齢者に対する特定使用成績調査 調査概要 中間集計結果 1. 症例構成 図 1 症例構成図 表 1 中止 脱落中止 脱落および内訳 ( 例 ) 症例数 割合 ( )
 トホグリフロジン水和物錠デベルザ 錠 20mg アプルウェイ 錠 20mg 高齢者に対する特定使用成績調査中間報告 Japanese Study of Tofogliflozin with type 2 diabetes mellitus Patient / ELderly J-STEP/EL 謹啓 時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配 を賜り 厚く御礼申し上げます さて
トホグリフロジン水和物錠デベルザ 錠 20mg アプルウェイ 錠 20mg 高齢者に対する特定使用成績調査中間報告 Japanese Study of Tofogliflozin with type 2 diabetes mellitus Patient / ELderly J-STEP/EL 謹啓 時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配 を賜り 厚く御礼申し上げます さて
背部痛などがあげられる 詳細な問診が大切で 臨床症状を確認し 高い確率で病気を診断できる 一方 全く症状を伴わない無症候性血尿では 無症候性顕微鏡的血尿は 放置しても問題のないことが多いが 無症候性肉眼的血尿では 重大な病気である可能性がある 特に 50 歳以上の方の場合は 膀胱がんの可能性があり
 おしっこが赤い どのような泌尿器科疾患があるの? 埼玉医科大学病院泌尿器科 朝倉博孝 1. はじめに血尿は 肉眼的には認識できないが 検査で尿中に血液を認める場合と肉眼的におしっこが赤いという臨床症状でわかる場合がある 前者を顕微鏡的血尿 ( 顕微鏡でわかる ) 後者を肉眼的血尿( 肉眼で赤くみえる ) という 一般的には 顕微鏡的血尿よりも 肉眼的血尿の方が重大な病気がかくれている可能性が高い また
おしっこが赤い どのような泌尿器科疾患があるの? 埼玉医科大学病院泌尿器科 朝倉博孝 1. はじめに血尿は 肉眼的には認識できないが 検査で尿中に血液を認める場合と肉眼的におしっこが赤いという臨床症状でわかる場合がある 前者を顕微鏡的血尿 ( 顕微鏡でわかる ) 後者を肉眼的血尿( 肉眼で赤くみえる ) という 一般的には 顕微鏡的血尿よりも 肉眼的血尿の方が重大な病気がかくれている可能性が高い また
食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり
![食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり 食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり](/thumbs/91/105740782.jpg) くすりのしおり内服剤 2013 年 11 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : グラクティブ錠 12.5mg 主成分 : シタグリプチンリン酸塩水和物 (Sitagliptin phosphate hydrate) 剤形
くすりのしおり内服剤 2013 年 11 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : グラクティブ錠 12.5mg 主成分 : シタグリプチンリン酸塩水和物 (Sitagliptin phosphate hydrate) 剤形
改訂の理由及び調査の結果直近 3 年度の国内副作用症例の集積状況 転帰死亡症例 アモキシシリン水和物及びクラブラン酸カリウム アモキシシリン水和物の国内症例が集積したことから 専門委員の意見も踏まえた調査の結果 改訂することが適切と判断した 血小板減少関連症例 1 アモキシシリン水和物 3 例 (
 アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
<4D F736F F D2082A8926D82E782B995B68F D815B838B8FF E31312E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
改訂後 ( 下線 : 追加記載 ) 改訂前 ( 下線 : 削除 ) 使用上の注意 1) 腎障害のある患者 [ 高い血中濃度が持続するおそれがある ]( 用法 用量に関連する使用上の注意 の項参照 ) 2)~ 4) 現行のとおり テオフィリン リトナビル 中枢神経抑制剤アルコール ( 飲酒 ) ピルシ
 2)~ 4) 現行のとおり テオフィリン リトナビル 中枢神経抑制剤アルコール ( 飲酒 ) ピルシ 改訂後 ( 下線 : 追加記載 ) 改訂前 ( 下線 : 削除 ) 使用上の注意 1) 腎障害のある患者 [ 高い血中濃度が持続するおそれがある ]( 用法 用量に関連する使用上の注意 の項参照 ) 2)~ 4) 現行のとおり テオフィリン リトナビル 中枢神経抑制剤アルコール ( 飲酒 ) ピルシ](/thumbs/93/111540608.jpg) 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 持続性選択 H 1 受容体拮抗 アレルギー性疾患治療剤 注 ) 処方せん医薬品 CETIRIZINE HYDROCHLORIDE TABLETS 2011 年 7 月 注 ) 注意 医師等の処方せんにより使用すること このたび 当社の持続性選択 H 1 受容体拮抗 アレルギー性疾患治療剤 セチリジン塩酸塩錠 5mg NP
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 持続性選択 H 1 受容体拮抗 アレルギー性疾患治療剤 注 ) 処方せん医薬品 CETIRIZINE HYDROCHLORIDE TABLETS 2011 年 7 月 注 ) 注意 医師等の処方せんにより使用すること このたび 当社の持続性選択 H 1 受容体拮抗 アレルギー性疾患治療剤 セチリジン塩酸塩錠 5mg NP
IF 利用の手引きの概要 日本病院薬剤師会 1. 医薬品インタビューフォーム作成の経緯医療用医薬品の基本的な要約情報として医療用医薬品添付文書 ( 以下, 添付文書と略す ) がある. 医療現場で医師 薬剤師等の医療従事者が日常業務に必要な医薬品の適正使用情報を活用する際には, 添付文書に記載された
 2016 年 7 月改訂 ( 第 15 版 ) 日本標準商品分類番号 873999 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 (2013 年 ) に準拠して作成 剤形注射剤 ( プレフィルドシリンジ ) 製剤の規制区分 生物由来製品劇薬処方箋医薬品注 ) 注 ) 注意 医師等の処方箋により使用すること 規格 含量 一般名 製造販売承認年月日 薬価基準収載 発売年月日 開発 製造販売
2016 年 7 月改訂 ( 第 15 版 ) 日本標準商品分類番号 873999 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 (2013 年 ) に準拠して作成 剤形注射剤 ( プレフィルドシリンジ ) 製剤の規制区分 生物由来製品劇薬処方箋医薬品注 ) 注 ) 注意 医師等の処方箋により使用すること 規格 含量 一般名 製造販売承認年月日 薬価基準収載 発売年月日 開発 製造販売
pdf0_1ページ目
 平成 年 月 日 担 当 課 衛生環境研究所 ( 担当者 ) ( 高田 梁川 ) 電話 -- 鳥取県感染症流行情報 第 [ 平成 年 月 日 ( 月 ) ~ 月 日 ( 日 ) ] 疾 病 名 東 部 中 部 西 部 イ ン フ ル エ ン ザ 感 染 性 胃 腸 炎 水 痘 ( 水 ぼ う そ う ) 〇 流行性耳下腺炎 ( おたふくかぜ ) 手 足 口 病 〇 〇 ヘ ル パ ン ギ ー ナ (
平成 年 月 日 担 当 課 衛生環境研究所 ( 担当者 ) ( 高田 梁川 ) 電話 -- 鳥取県感染症流行情報 第 [ 平成 年 月 日 ( 月 ) ~ 月 日 ( 日 ) ] 疾 病 名 東 部 中 部 西 部 イ ン フ ル エ ン ザ 感 染 性 胃 腸 炎 水 痘 ( 水 ぼ う そ う ) 〇 流行性耳下腺炎 ( おたふくかぜ ) 手 足 口 病 〇 〇 ヘ ル パ ン ギ ー ナ (
オプジーボ 胃癌 副作用発現状況(集計期間:2017/09/22~2018/11/30)
 オプジーボ点滴静注 対象 胃癌 ( 単剤 ) 副作用件数一覧 承認事項一部変更承認 (2017/09/22)~2018/11/30 承認事項一部変更承認 (2017/09/22)~2018/11/30までに 胃癌( 単剤 ) で収集した副作用について 下記にお示しします 副作用件数一覧 副作用は 以下に記載した745 例 1107 件です 内 例は381 例 485 件です 器官別大分類 血液およびリンパ系障害
オプジーボ点滴静注 対象 胃癌 ( 単剤 ) 副作用件数一覧 承認事項一部変更承認 (2017/09/22)~2018/11/30 承認事項一部変更承認 (2017/09/22)~2018/11/30までに 胃癌( 単剤 ) で収集した副作用について 下記にお示しします 副作用件数一覧 副作用は 以下に記載した745 例 1107 件です 内 例は381 例 485 件です 器官別大分類 血液およびリンパ系障害
医薬品の適正使用に欠かせない情報です
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 劇薬 処方せん医薬品 ( 注意 - 医師等の処方せんにより使用すること ) 高血圧症 狭心症治療剤持続性 Ca 拮抗剤日本薬局方アムロジピンベシル酸塩錠アムロジピン錠 2.5mg フソー アムロジピン錠 5mg フソー アムロジピン錠 10mg フソー 日本薬局方アムロジピンベシル酸塩口腔内崩壊錠アムロジピン OD
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 劇薬 処方せん医薬品 ( 注意 - 医師等の処方せんにより使用すること ) 高血圧症 狭心症治療剤持続性 Ca 拮抗剤日本薬局方アムロジピンベシル酸塩錠アムロジピン錠 2.5mg フソー アムロジピン錠 5mg フソー アムロジピン錠 10mg フソー 日本薬局方アムロジピンベシル酸塩口腔内崩壊錠アムロジピン OD
改訂内容 ( 部追加 改訂 部削除 ) ビ シフロール 錠, ミラペックス LA 錠 共通 改 訂 後 改 訂 前 2. 重要な基本的注意 2. 重要な基本的注意 (5) レボドパ又はドパミン受容体作動薬の投与により 病的賭博 ( 個人的生活の崩壊等の社会的に不利な結果を招くにもかかわらず 持続的に
 医薬品の適正使用に欠かせない情報です 必ずお読みください 使用上の注意改訂のお知らせ 2013 年 8 月日本ベーリンガーインゲルハイム株式会社 ドパミン作動性パーキンソン病治療剤レストレスレッグス症候群治療剤注 ) 劇薬 処方せん医薬品 ( プラミペキソール塩酸塩水和物製剤 ) ドパミン作動性パーキンソン病治療徐放性製剤注 ) 劇薬 処方せん医薬品 ( プラミペキソール塩酸塩水和物徐放錠 ) 注
医薬品の適正使用に欠かせない情報です 必ずお読みください 使用上の注意改訂のお知らせ 2013 年 8 月日本ベーリンガーインゲルハイム株式会社 ドパミン作動性パーキンソン病治療剤レストレスレッグス症候群治療剤注 ) 劇薬 処方せん医薬品 ( プラミペキソール塩酸塩水和物製剤 ) ドパミン作動性パーキンソン病治療徐放性製剤注 ) 劇薬 処方せん医薬品 ( プラミペキソール塩酸塩水和物徐放錠 ) 注
「ガスメット錠10mg・20mg」「ガスメットD錠10mg・20mg」使用上の注意改訂のお知らせ
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意改訂のお知らせ H2 受容体拮抗剤 このたび H2 受容体拮抗剤ガスメット錠 10mg ガスメット錠 20mg 及びガスメット D 錠 10mg ガスメット D 錠 20mg につきまして 自主改訂に基づき 使用上の注意を下記のとおり改訂致しましたので お知らせ申し上げます 平成 25 年 8 月 記 ガスメット錠 10mg ガスメット錠
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意改訂のお知らせ H2 受容体拮抗剤 このたび H2 受容体拮抗剤ガスメット錠 10mg ガスメット錠 20mg 及びガスメット D 錠 10mg ガスメット D 錠 20mg につきまして 自主改訂に基づき 使用上の注意を下記のとおり改訂致しましたので お知らせ申し上げます 平成 25 年 8 月 記 ガスメット錠 10mg ガスメット錠
ルナベル配合錠 使用上の注意改訂のお知らせ 富士製薬
 N 16-27 2016 年 10 月 医薬品の適正使用に欠かせない情報です 必ずお読みください 再審査結果及び 使用上の注意 改訂のお知らせ 適正使用に関するお願い 月経困難症治療剤注 ) 処方箋医薬品 販売元富士製薬工業株式会社製造販売元ノーベルファーマ株式会社 ノルエチステロン エチニルエストラジオール配合製剤 注 ) 注意 - 医師等の処方箋により使用すること 謹啓時下ますますご清栄のこととお慶び申し上げます
N 16-27 2016 年 10 月 医薬品の適正使用に欠かせない情報です 必ずお読みください 再審査結果及び 使用上の注意 改訂のお知らせ 適正使用に関するお願い 月経困難症治療剤注 ) 処方箋医薬品 販売元富士製薬工業株式会社製造販売元ノーベルファーマ株式会社 ノルエチステロン エチニルエストラジオール配合製剤 注 ) 注意 - 医師等の処方箋により使用すること 謹啓時下ますますご清栄のこととお慶び申し上げます
ヒュミラ皮下注20mgシリンジ0.4mL、ヒュミラ皮下注40mgシリンジ0.8mL
 712000/R21 **2015 年 6 月改訂 ( 第 20 版 ) *2014 年 9 月改訂 貯法 : 遮光, 凍結を避け 2 ~ 8 で保存使用期限 : 製造後 2 年 ( 最終使用年月をラベル, 外箱に表示 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 ) 注 ) 注意 - 医師等の処方箋により使用すること ヒト型抗ヒト TNFα モノクローナル抗体製剤 皮下注射用アダリムマブ
712000/R21 **2015 年 6 月改訂 ( 第 20 版 ) *2014 年 9 月改訂 貯法 : 遮光, 凍結を避け 2 ~ 8 で保存使用期限 : 製造後 2 年 ( 最終使用年月をラベル, 外箱に表示 ) 生物由来製品劇薬処方箋医薬品注 ) 生物由来製品劇薬処方箋医薬品注 ) 注 ) 注意 - 医師等の処方箋により使用すること ヒト型抗ヒト TNFα モノクローナル抗体製剤 皮下注射用アダリムマブ
ヒュミラ使用上の注意改訂のお知らせ2010年9月
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 9 月 生物由来製品劇薬処方せん医薬品注 ) この度 標記製品の 使用上の注意 を改訂致しました 今後のご使用に際しましては 以下の内容をご参照下さいますようお願い申し上げます なお 改訂添付文書を封入した製品がお手元に届くまでに 日数を要する場合がございますので ご了承下さいますようお願い申し上げます
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 9 月 生物由来製品劇薬処方せん医薬品注 ) この度 標記製品の 使用上の注意 を改訂致しました 今後のご使用に際しましては 以下の内容をご参照下さいますようお願い申し上げます なお 改訂添付文書を封入した製品がお手元に届くまでに 日数を要する場合がございますので ご了承下さいますようお願い申し上げます
ヒュミラ を投与されている 投与を検討されている皆様へ 体調管理ノート 受診時には必ず持参しましょう 監修 : 東京慈恵会医科大学名誉教授中川秀己先生 No. 使用開始年月年月 お名前
 ヒュミラ を投与されている 投与を検討されている皆様へ 体調管理ノート 受診時には必ず持参しましょう 監修 : 東京慈恵会医科大学名誉教授中川秀己先生 No. 使用開始年年 お名前 目次 わたしのこと 3 ご自身で体調を管理することが大切なお薬です 4 こんな症状には注意してください 5 チェックシートのつけかた 6 チェックシート (6 ヵ分 ) 8 主治医との通信欄 20 ヒュミラ R で起こりうる副作用
ヒュミラ を投与されている 投与を検討されている皆様へ 体調管理ノート 受診時には必ず持参しましょう 監修 : 東京慈恵会医科大学名誉教授中川秀己先生 No. 使用開始年年 お名前 目次 わたしのこと 3 ご自身で体調を管理することが大切なお薬です 4 こんな症状には注意してください 5 チェックシートのつけかた 6 チェックシート (6 ヵ分 ) 8 主治医との通信欄 20 ヒュミラ R で起こりうる副作用
untitled
 患者向医薬品ガイド 2017 年 6 月更新 オレンシア皮下注 125mg シリンジ 1mL オレンシア皮下注 125mg オートインジェクター 1mL この薬は? 販売名一般名含有量 (1 シリンジ中 ) オレンシア皮下注 125mg オレンシア皮下注 125mg シリンジ 1mL オートインジェクター 1mL ORENCIA SYRINGE FOR ORENCIA AUTOINJECTOR FOR
患者向医薬品ガイド 2017 年 6 月更新 オレンシア皮下注 125mg シリンジ 1mL オレンシア皮下注 125mg オートインジェクター 1mL この薬は? 販売名一般名含有量 (1 シリンジ中 ) オレンシア皮下注 125mg オレンシア皮下注 125mg シリンジ 1mL オートインジェクター 1mL ORENCIA SYRINGE FOR ORENCIA AUTOINJECTOR FOR
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
2018 年 10 月 4 日放送 第 47 回日本皮膚アレルギー 接触皮膚炎学会 / 第 41 回皮膚脈管 膠原病研究会シンポジウム2-6 蕁麻疹の病態と新規治療法 ~ 抗 IgE 抗体療法 ~ 島根大学皮膚科 講師 千貫祐子 はじめに蕁麻疹は膨疹 つまり紅斑を伴う一過性 限局性の浮腫が病的に出没
 2018 年 10 月 4 日放送 第 47 回日本皮膚アレルギー 接触皮膚炎学会 / 第 41 回皮膚脈管 膠原病研究会シンポジウム2-6 蕁麻疹の病態と新規治療法 ~ 抗 IgE 抗体療法 ~ 島根大学皮膚科 講師 千貫祐子 はじめに蕁麻疹は膨疹 つまり紅斑を伴う一過性 限局性の浮腫が病的に出没する疾患であり 多くは痒みを伴います 日本皮膚科学会の 2011 年版の蕁麻疹診療ガイドラインでは 蕁麻疹及び血管性浮腫を
2018 年 10 月 4 日放送 第 47 回日本皮膚アレルギー 接触皮膚炎学会 / 第 41 回皮膚脈管 膠原病研究会シンポジウム2-6 蕁麻疹の病態と新規治療法 ~ 抗 IgE 抗体療法 ~ 島根大学皮膚科 講師 千貫祐子 はじめに蕁麻疹は膨疹 つまり紅斑を伴う一過性 限局性の浮腫が病的に出没する疾患であり 多くは痒みを伴います 日本皮膚科学会の 2011 年版の蕁麻疹診療ガイドラインでは 蕁麻疹及び血管性浮腫を
性の症例や 関節炎の激しい症例に推奨されるが 副作用 ( 肝障害 骨髄抑制 間質性肺炎など ) に留意し 十分なインフォームドコンセントに配慮する必要がある 妊娠までの最低限の薬剤中止期間は エトレチナートでは女性 2 年間 男性 6か月 メトトレキサートでは男女とも3か月とされている TNFα 阻
 37 膿疱性乾癬 ( 汎発型 ) 概要 1. 概要乾癬には 最も発症頻度の高い尋常性乾癬の他に亜型として 乾癬性関節炎 ( 関節症性乾癬 ) 乾癬性紅皮症 膿疱性乾癬がある 広義の膿疱性乾癬には膿疱性乾癬 ( 汎発型 ) と限局性膿疱性乾癬 ( 掌蹠膿疱症 アロポー稽留性肢端皮膚炎 ) があり 本稿で取り扱うのは膿疱性乾癬 ( 汎発型 ) である 膿疱性乾癬 ( 汎発型 ) には急性汎発性膿疱性乾癬
37 膿疱性乾癬 ( 汎発型 ) 概要 1. 概要乾癬には 最も発症頻度の高い尋常性乾癬の他に亜型として 乾癬性関節炎 ( 関節症性乾癬 ) 乾癬性紅皮症 膿疱性乾癬がある 広義の膿疱性乾癬には膿疱性乾癬 ( 汎発型 ) と限局性膿疱性乾癬 ( 掌蹠膿疱症 アロポー稽留性肢端皮膚炎 ) があり 本稿で取り扱うのは膿疱性乾癬 ( 汎発型 ) である 膿疱性乾癬 ( 汎発型 ) には急性汎発性膿疱性乾癬
< F2D CF6926D905C90BF82C98C5782E992CA926D88C4>
 保医発 1031 第 1 号平成 24 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において 別添 1の7
保医発 1031 第 1 号平成 24 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において 別添 1の7
