(1) 書面による助言書面による助言は 上記 2. の対面助言の日程調整により対面助言を受けることが決定した品目のうち相談者の事前の了解が得られた場合に行います 書面による助言を希望する場合には 対面助言日程調整依頼書及び日程調整結果を受けて提出する 医薬品対面助言申込書 ( 業務方法書実施細則の様
|
|
|
- しおり むこやま
- 5 years ago
- Views:
Transcription
1 ( 別添 1) 対面助言のうち 新医薬品及び生物学的製剤等 1) の治験相談 ( 新医薬品の先駆け総合評価相談 新医薬品の事前評価相談 新医薬品の優先審査品目該当性相談 ファーマコゲノミクス バイオマーカー相談 新医薬品の対面助言事後相談 新医薬品の申請電子データ提出確認相談 医薬品 GCP/GLP/GPSP 相談及び医薬品信頼性基準適合性調査相談を除く ) に関する実施要綱 1. 対面助言の区分及び内容本実施要綱の対象とする対面助言の区分及び内容については 本通知の別紙 1 のとおりです なお 拡大治験の実施が予想される医薬品の開発においては 可能な限り 主たる治験に関する臨床試験デザインの相談を利用することを勧めます 2. 対面助言の日程調整対面助言の日程調整を希望する場合には 以下の手順に従って対面助言日程調整依頼書を作成し ファクシミリ 郵送又は電子メールにより 審査マネジメント部審査マネジメント課あてに提出してください なお 受付時間外に到着したものは 受付の対象外としますので 了承ください (1) 本通知の別紙 1に示す相談区分 ( 医薬品手続相談 医薬品拡大治験開始前相談 医薬品製造販売後臨床試験等計画相談及び医薬品製造販売後臨床試験等終了時相談を除く ) の対面助言を希望する場合は 実施日を調整するため 対面助言日程調整依頼書 ( 本通知の別紙様式 1 ) に必要事項を記入してください ただし 優先対面助言品目に指定された医薬品 ( 先駆け審査指定制度の対象医薬品 ( 以下 先駆け審査指定医薬品 という ) 及び希少疾病用医薬品に指定された医薬品を含む 以下 優先対面助言品目 という ) のうち対面助言の優先的な取扱いを希望するものについては (2) の手順に従ってください 1 対面助言日程調整依頼書の受付日時は 機構ホームページに掲載します 原則として 相談を実施する月の2ヵ月前の月の第 1 勤務日の午前 10 時から午後 4 時としていますが 土曜日 日曜日又は国民の祝日の場合には 状況に応じて受付日を変更しますので 機構ホームページを確認してください 2 対面助言日程調整依頼書の 持ち点 (A+B+C) 欄には 対面助言日程調整依頼品目の持ち点の計算方法について ( 本通知の別紙 1-2 ) の持ち点の計算方法に基づき算出した持ち点を漏れなく記入してください 同一日に複数の相談申込みがあった場合等には 算定した各品目の持ち点を参考にして日程調整を行います (2) 医薬品手続相談 医薬品拡大治験開始前相談 医薬品製造販売後臨床試験等計画相談及び医薬品製造販売後臨床試験等終了時相談を希望する場合 並びに優先対面助言品目のうち対面助言の優先的な取扱いを希望する場合には 実施日を調整するため 独立行政法人医薬品医療機器総合機構審査等業務関係業務方法書実施細則 ( 平成 16 年細則第 4 号 以下 業務方法書実施細則 という ) の様式第 1 号又は第 2 号の表題部分を 対面助言日程調整依頼書 と修正し 必要事項 ( 備考欄への対面助言希望日時の記載を含む ) を記入してください なお 予定する相談が医薬品手続相談に該当するか否か不明な場合には あらかじめ事前面談等により確認してください 受付日は国民の祝日等の休日を除く月曜日から金曜日としています (3) なお 上記 (1) に該当するものであっても 保健衛生の観点から迅速に対応する必要がある場合等 対面助言を適時適切に行う必要があると機構が判断した場合には (1) とは別に対面助言の日程調整を行うことがありますので 必要に応じて事前面談等により確認してください 3. 相談の形態
2 (1) 書面による助言書面による助言は 上記 2. の対面助言の日程調整により対面助言を受けることが決定した品目のうち相談者の事前の了解が得られた場合に行います 書面による助言を希望する場合には 対面助言日程調整依頼書及び日程調整結果を受けて提出する 医薬品対面助言申込書 ( 業務方法書実施細則の様式第 1 号又は第 2 号 以下同じ ) の備考欄に 書面による助言を希望する旨を記入してください なお 不明な点がありましたら 事前面談等により適宜確認してください (2) 開発戦略に係る相談以下の留意点を踏まえた上で 本相談を申し込んでください 開発戦略に係る相談は より効率的かつ効果的な医薬品の開発戦略を練ることを目的として 機構と相談者がその時点で得られている試験成績 科学的見地に基づき 予想される開発の結果を想定した上で 当該医薬品の開発計画の全体像 申請データパッケージ等について 将来的予測も踏まえつつ議論を行うものです したがって 当該相談以降に得られた試験成績や科学技術の発展による仮説設定の妥当性の変化等により 機構の判断等が変わることがあります 本相談を申し込む場合は 対面助言日程調整依頼書の 相談内容の種類 欄に 開発戦略の相談あり と記載してください また 医薬品対面助言申込書には 相談内容の種類 欄に 開発戦略の相談あり と記載し 相談資料には相談事項の項目ごとに開発戦略に係る相談であることを明示してください 申込先及び疑義がある場合の照会先 : 東京都千代田区霞が関 新霞が関ビル9 階独立行政法人医薬品医療機器総合機構審査マネジメント部審査マネジメント課電話 ( タ イヤルイン ) ファクシミリ 電子メールアドレス : shinyaku-uketsuke@pmda.go.jp なお 電子メールによる申込みは セキュアメールをご利用ください 受付時間 : 月曜日から金曜日 ( 国民の祝日等の休日を除く ) の午前 9 時 30 分から午後 5 時までです ただし 上記 2.(1) に従い対面助言日程調整依頼書を提出する場合の受付時間は午前 10 時から午後 4 時までです 4. 対面助言日程の調整方法 (1) 上記 2.(1) に従い対面助言日程調整依頼書が提出されたものは 本通知の別紙 9 に定める分野ごとに以下の手順に従って 対面助言実施日時を調整します 1 対面助言日程調整依頼書の 希望日時 欄及び 持ち点 欄の記載を参考にして 対面助言実施日時を調整します 2 希望日時 欄に記載された日時で決定できなかった場合には 原則として受付日からの第 2 3 勤務日に電話により日程調整依頼月の前後 1 ヵ月以内の別の日時に設定可能か相談します (2) 上記 2.(2) に従い対面助言日程調整依頼書が提出されたものは (1) とは別に 随時 対面助言実施日時を調整します 5. 対面助言の日程等のお知らせ (1) 対面助言の日程調整結果は 受付日から起算して原則として 5 勤務日以内に 対面助言実施のご案内 により 相談者の連絡先あてにファクシミリで連絡します (2) 書面による助言を行う場合であっても 事務運用上 対面助言実施日は上記 4. の日程調整により決定した対面助言実施日とします 6. 対面助言手数料の払込みと対面助言の申込み
3 (1) 上記 5.(1) の対面助言実施のご案内を受信した日の翌日から起算して 15 勤務日以内に 該当する相談区分の手数料を市中銀行等から振り込んだ上で 医薬品対面助言申込書に必要事項を記入し 振込金受取書等の写しを添付の上 持参又は郵送により審査マネジメント部審査マネジメント課に提出してください 郵送の場合には 封筒の表に 対面助言申込書在中 と朱書きしてください なお 手数料額及び振込方法の詳細については それぞれ業務方法書実施細則の別表及び 独立行政法人医薬品医療機器総合機構が行う審査等の手数料について ( 平成 26 年 11 月 21 日薬機発第 号独立行政法人医薬品医療機器総合機構理事長通知 ) を参照してください (2) 医薬品対面助言申込書の提出時に 同申込書の 相談内容の概略 欄の記入内容の電子媒体 ( テキスト形式 ) での提出も併せてお願いします なお 当該内容が A4 版複数枚にわたる場合は 別に A4 版 1 枚に要約 ( 図表等を除く ) を作成し提出してください (3) 医薬品対面助言申込書の備考欄には 日程調整の結果を 例えば 日程調整の結果 平成 年 月 日午前 ( 午後 ) 分野の対面助言実施予定 のように記入してください その際 書面による助言を行う場合でも 上記 5.(2) の対面助言実施予定日を記入してください 7. 対面助言の資料対面助言の資料については 持参又は郵送により 審査マネジメント部審査マネジメント課へ提出してください (1) 資料の提出部数 1 医薬品手続相談及び医薬品拡大治験開始前相談 10 部 2 7.(1)1 以外の相談 20 部 (2) 資料の提出日相談資料の提出日は対面助言実施のご案内の備考欄に記入して連絡します ( 先駆け審査指定医薬品の優先対面助言を除く ) 相談資料提出時には 資料の電子媒体での提出も併せてお願いします 1 医薬品手続相談及び医薬品拡大治験開始前相談では 原則として対面助言実施予定日の2~3 週間前の月曜日 ( 午後 3 時まで ) 2 医薬品手続相談 医薬品拡大治験開始前相談及び優先対面助言以外の治験相談では 原則として対面助言実施予定日の5 週間前の月曜日 ( 午後 3 時まで ) が目安となります 3 先駆け審査指定医薬品の優先対面助言では 原則として対面助言日程調整依頼書の提出日と同日 ( 午後 3 時まで ) となります 先駆け審査指定医薬品以外の優先対面助言では 別途指示する日とします (3) 資料の表紙には 20 部 ( 医薬品手続相談及び医薬品拡大治験開始前相談にあっては10 部 ) それぞれに 治験成分記号 治験薬の成分名 相談区分 対面助言実施日 ( 先駆け審査指定医薬品の優先対面助言にあっては記載不要 ) 対面助言を受ける者の氏名( 会社名 ) に加えて 右上部と背表紙上部に受付番号 ( 例 :P100) 右下部に資料の通し番号(1 番から20 番まで ( 医薬品手続相談及び医薬品拡大治験開始前相談にあっては1 番から10 番まで )) を付してください (4) 書面による助言を行う際に 機構の相談担当者より相談希望者に資料の提出日を早めることについて事前に相談し 了解が得られた場合にはこの目安よりも早めることがあります (5) 提出された資料は原則として機構において廃棄しますが 返却希望の確認を資料提出の際に行います (6) 医薬品拡大治験開始前相談を医薬品第 Ⅱ 相試験終了後相談又は医薬品申請前相談と同時に申し込む場合であって 医薬品第 Ⅱ 相試験終了後相談又は医薬品申請前相談と全く同一の添付資料 ( 実施済みの治験総括報告書 関係論文等 ) については 医薬品拡大治験開始前相談への添付は省略可能とします なお 申し込み手続き等については それぞれの相談で行うようお願いします
4 8. 対面助言の資料に盛り込む内容 (1) 資料に盛り込む内容は 相談事項により異なりますが 例えば新医薬品及び生物学的製剤等の治験計画を相談する場合には 以下の情報が全体として含まれていれば有用と考えられます 1 当該疾病に対する治療法類似薬があれば 効能 効果 用法 用量 使用上の注意等について 比較表を作成してください 2 既存治療法の問題点と治験薬の予想されるメリット既存治療法の問題点があれば示し 治験薬にメリットの可能性があれば説明してください 3 欧米の添付文書及びその邦訳 EU 各国で同一の場合は一カ国の英文のもので十分です 4 開発の経緯図製剤開発 非臨床試験 国内外の第 Ⅰ 相試験 第 Ⅱ 相試験 第 Ⅲ 相試験等のうち主要なものを それぞれ開始から終了まで年表形式により一覧表としたものを作成してください また 開発業者の合併等による会社名の変更を除き 開発者が変更された場合はこれがわかるように記載してください 5 完全な臨床データパッケージア薬物動態試験 薬力学試験 第 Ⅱ 相用量設定試験 第 Ⅲ 相比較試験などの試験カテゴリーに 試験番号及び試験実施期間 ( 計画の場合はその旨 ) を付記して 承認申請に用いる臨床パッケージを記載してください イ海外データの利用を検討している場合には 国内 国外に分けて それぞれを記載するとともに ブリッジング戦略による開発を計画している場合には ブリッジング試験及びブリッジング対象試験が明らかとなるようにしてください 6 最新の治験薬概要書ア初回治験届の対象となる品目で 初めての対面助言の場合には 非臨床試験成績について より詳しい資料を作成してください イ生物由来製品 ( 特定生物由来製品を含む ) に該当する薬物及び該当することが見込まれる薬物並びに遺伝子組換え技術を応用して製造される薬物については 製法等品質についてより詳しい資料を作成してください 7 プロトコル案及び患者用説明文書案 8 臨床試験一覧表ア国内における臨床試験及び承認申請に利用することを考えている海外における臨床試験成績については 新医薬品の製造又は輸入の承認申請に際し承認申請書に添付すべき資料の作成要領について ( 平成 13 年 6 月 21 日医薬審発第 899 号厚生労働省医薬局審査管理課長通知 以下 資料作成要領通知 という ) 別紙 5 の表 5.1 に沿ってこれらをとりまとめ 一覧表を作成してください なお 各臨床試験に使用した製剤の製法 規格等が異なる場合には その旨を備考に示してください イ本表については 機構の担当者の作業の円滑化のため 表データ形式にして フレキシブルディスク等の磁気媒体で提供してください 9 毒性試験一覧表既に実施されている毒性試験について 資料作成要領通知別紙 4 の表 に沿ってこれらをとりまとめ 一覧表を作成してください 10 関係論文重要なもののみで結構です 11 過去の対面助言 ( 治験相談含む ) 記録 ( 該当する場合に限る ) 12 最新の安全性定期報告 ( 該当する場合に限る )
5 (2) 自ら治験を実施しようとする者による治験に係る相談においては その者が開発計画全体を把握していない場合であっても 少なくとも以下のような申込添付資料を用意してください 1 当該疾病に対する治療法類似薬があれば 効能 効果 用法 用量 使用上の注意等について 比較表を作成してください 2 既存治療法の問題点と治験薬の予想されるメリット既存治療法の問題点があれば示し 治験薬にメリットの可能性があれば説明してください 3 欧米の添付文書及びその邦訳 EU 各国で同一の場合は一カ国の英文のもので十分です 4 最新の治験薬概要書 5 プロトコル案及び患者用説明文書案 6 関係論文重要なもののみで結構です 9. 対面助言の取下げ 日程変更 (1) 対面助言の申込み後 ( 先駆け審査指定医薬品の優先対面助言にあっては対面助言日程調整依頼書の提出後 ) その実施日までに 申込者の都合で 取下げを行う場合には 業務方法書実施細則の様式第 33 号の 対面助言申込書取下願 に必要事項を記入し 審査マネジメント部審査マネジメント課に提出してください 先駆け審査指定医薬品の優先対面助言において 対面助言日程調整依頼書の提出後 申込みの前に取下げることになった場合は 一旦 申込みを行ってから 対面助言申込書取下願 を提出してください 先駆け審査指定医薬品の優先対面助言以外の対面助言では 対面助言申込書取下願 と併せて 業務方法書実施細則の様式第 34 号の 医薬品等審査等手数料還付請求書 に必要事項記入の上 提出された場合には 手数料の半額を還付します 先駆け審査指定医薬品の優先対面助言については 手数料の還付は行いませんので ご注意ください (2) 申込者の都合で実施日の変更を行う場合は 一旦 対面助言申込書取下願 を提出し 再度申込みを行っていただきますので 対面助言申込書取下願 を審査マネジメント部審査マネジメント課に提出してください 先駆け審査指定医薬品の優先対面助言以外の対面助言においては 併せて 医薬品等審査等手数料還付請求書 に必要事項記入の上 提出された場合には 手数料の半額を還付します 先駆け審査指定医薬品の優先対面助言については 手数料の還付は行いませんので ご注意ください (3) 機構側の都合で実施日の変更を行う場合や 実施日の変更がやむを得ないものと機構が認めた場合は 対面助言申込書取下願 を提出する必要はありません (4) 取下げる場合であっても 機構がやむを得ないものとして認めた場合は 手数料の全額を還付します 10. 対面助言の実施 (1) 対面助言実施日の前日までに 出席者人数 相談者側専門家又は外国人の出席の有無 ( 通訳出席の有無を含む ) プレゼンテーションの際に使用する機材について 機構の担当者まで連絡してください なお 出席人数については 会議室の広さとの関係上 1 相談につき 15 名以内としてください (2) 対面助言当日は 機構受付で対面助言の予約がある旨を伝えていただき その案内に従ってください (3) 医薬品手続相談及び医薬品拡大治験開始前相談を除く治験相談においては 相談者側からの相談事項の概略についての 20 分程度のプレゼンテーションをお願いします その後相談を実施します なお プレゼンテーション用資料の写しにつきましては できれば 1 週間前に 遅くとも前々日までに相談担当者までファクシミリ等により提出してください
6 (4) 医薬品手続相談においては 相談者側からの相談事項の説明と機構側からの指導及び助言をあわせて 全体として 30 分以内を目途として実施します また原則として 専門委員は同席しません (5) 医薬品拡大治験開始前相談においては 相談者側からの相談事項の説明と機構側からの指導及び助言をあわせて 全体として 60 分以内を目途として実施します 11. 対面助言記録の伝達対面助言が終了した後には 相談者に内容を確認の上 機構において記録を作成し 相談者に伝達します なお 医薬品手続相談にあってはポイントを簡潔に整理した要旨とします 12. その他 (1) 相談内容に対する機構の見解を対面助言の前に文書で提示します 注 : 1) 生物学的製剤 遺伝子組換え技術を応用して製造される医薬品 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年政令第 11 号 ) 第 80 条第 2 項第 7 号ヘの規定に基づき厚生労働大臣の指定する製造管理又は品質管理に特別の注意を要する医薬品 ( 人又は動物の細胞を培養する技術を応用して製造される医薬品 特定生物由来製品 )
(2) 開発戦略に係る相談以下の留意点を踏まえた上で 本相談を申し込んでください 開発戦略に係る相談は より効率的かつ効果的な再生医療等製品の開発戦略を練ることを目的として 機構と相談者がその時点で得られている試験成績 科学的見地に基づき 予想される開発の結果を想定した上で 当該再生医療等製品の開発
 ( 別添 8) 対面助言のうち 再生医療等製品の治験相談 ( 再生医療等製品の先駆け総合評価相談 事前評価相談 対面助言事後相談及び信頼性基準適合性調査相談を除く ) に関する実施要綱 1. 対面助言の区分及び内容本実施要綱の対象とする対面助言の区分及び内容については 本通知の別紙 5 のとおりです なお 拡大治験の実施が予想される再生医療等製品の開発においては 可能な限り 主たる治験に関する臨床試験デザインの相談を利用することを勧めます
( 別添 8) 対面助言のうち 再生医療等製品の治験相談 ( 再生医療等製品の先駆け総合評価相談 事前評価相談 対面助言事後相談及び信頼性基準適合性調査相談を除く ) に関する実施要綱 1. 対面助言の区分及び内容本実施要綱の対象とする対面助言の区分及び内容については 本通知の別紙 5 のとおりです なお 拡大治験の実施が予想される再生医療等製品の開発においては 可能な限り 主たる治験に関する臨床試験デザインの相談を利用することを勧めます
(3) 事前面談の日程等の連絡申込書を受け付けた後に 機構担当者より 電話で日程等を連絡します なお 事前面談の質問内容に応じて 電話による回答を行う場合があります (4) (5)( 略 ) (3) 事前面談の日程等の連絡申込書を受付けた後に 機構担当者より 電話で日程等を連絡します なお 事前面談
 レギュラトリーサイエンス戦略相談に関する実施要綱新旧対照表 改正後 3. 相談の種類 RS 戦略相談の申込みに際しては 予め 事前面談を申し込みいただき 機構の担当者と上に示した事項について面談を行ってください 事前面談の結果を踏まえた上で 対面助言の申込みをしていただくことになります 対面助言の対象については 原則として 優先分野 ( 下記 ) に該当し かつ 有望性が期待できるものとします (
レギュラトリーサイエンス戦略相談に関する実施要綱新旧対照表 改正後 3. 相談の種類 RS 戦略相談の申込みに際しては 予め 事前面談を申し込みいただき 機構の担当者と上に示した事項について面談を行ってください 事前面談の結果を踏まえた上で 対面助言の申込みをしていただくことになります 対面助言の対象については 原則として 優先分野 ( 下記 ) に該当し かつ 有望性が期待できるものとします (
薬品の申請電子データ提出確認相談 医薬品 GCP/GLP/GPSP 相談及び医薬品信頼性基準適合性調査相談を除く ) に関する実施要綱 ( 別添 1) (2) 対面助言のうち 先駆け総合評価相談に関する実施要綱 ( 別添 2) (3) 対面助言のうち 新医薬品の事前評価相談に関する実施要綱 ( 別添
 薬機発第 0302070 号平成 24 年 3 月 2 日一部改正平成 26 年 6 月 30 日一部改正平成 26 年 11 月 21 日一部改正平成 26 年 12 月 25 日一部改正平成 27 年 5 月 15 日一部改正平成 27 年 9 月 14 日一部改正平成 27 年 9 月 15 日一部改正平成 28 年 1 月 22 日一部改正平成 28 年 4 月 1 日一部改正平成 28 年
薬機発第 0302070 号平成 24 年 3 月 2 日一部改正平成 26 年 6 月 30 日一部改正平成 26 年 11 月 21 日一部改正平成 26 年 12 月 25 日一部改正平成 27 年 5 月 15 日一部改正平成 27 年 9 月 14 日一部改正平成 27 年 9 月 15 日一部改正平成 28 年 1 月 22 日一部改正平成 28 年 4 月 1 日一部改正平成 28 年
( 別添 1) 対面助言のうち 新医薬品及び生物学的製剤等 1) の治験相談 ( 新医薬品の先駆け総合評価相談 新医薬品の事前評価相談 新医薬品の優先審査品目該当性相談 ファーマコゲノミクス バイオマーカー相談 新医薬品の対面助言事後相談 新医薬品の申請電子データ提出確認相談 医薬品 GCP /GL
 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について新旧対照表改正現行 独立行政法人医薬品医療機器総合機構 ( 以下 機構 という ) が行う対面助言 証明確認調査等の実施要綱等については 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について ( 平成 24 年 3 月 2 日薬機発第 0302070 号独立行政法人医薬品医療機器総合機構理事長通知
独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について新旧対照表改正現行 独立行政法人医薬品医療機器総合機構 ( 以下 機構 という ) が行う対面助言 証明確認調査等の実施要綱等については 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について ( 平成 24 年 3 月 2 日薬機発第 0302070 号独立行政法人医薬品医療機器総合機構理事長通知
(12) 対面助言のうち GCP/GLP/GPSP 相談に関する実施要綱 ( 別添 12) (13) 対面助言のうち 簡易相談に関する実施要綱 ( 別添 13) 2. 新医薬品 後発医薬品 一般用医薬品 及び再生医療等製品の事前面談に関する実施要綱 ( 別添 14) 3. 医療機器及び体外診断用医薬
 別記殿 薬機発第 0302070 号平成 24 年 3 月 2 日一部改正平成 2 6 年 6 月 3 0 日一部改正平成 26 年 11 月 21 日 独立行政法人医薬品医療機器総合機構理事長近藤達也 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について 独立行政法人医薬品医療機器総合機構 ( 以下 機構 という ) が行う対面助言 証明確認調査等の実施要綱等については
別記殿 薬機発第 0302070 号平成 24 年 3 月 2 日一部改正平成 2 6 年 6 月 3 0 日一部改正平成 26 年 11 月 21 日 独立行政法人医薬品医療機器総合機構理事長近藤達也 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について 独立行政法人医薬品医療機器総合機構 ( 以下 機構 という ) が行う対面助言 証明確認調査等の実施要綱等については
(8) 対面助言のうち 医療機器 体外診断用医薬品の事前評価相談に関する実施要綱 ( 別添 8) (9) 対面助言のうち 簡易相談に関する実施要綱 ( 別添 9) 2. 新医薬品 後発医薬品 一般用医薬品 医療機器及び体外診断用医薬品の事前面談に関する実施要綱 ( 別添 10) 3. 優先対面助言
 別記殿 薬機発第 0302070 号平成 24 年 3 月 2 日一部改正平成 2 6 年 6 月 3 0 日 独立行政法人医薬品医療機器総合機構理事長近藤達也 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について 独立行政法人医薬品医療機器総合機構 ( 以下 機構 という ) が行う対面助言 証明確認調査等の実施要綱等については 独立行政法人医薬品医療機器総合機構が行う対面助言
別記殿 薬機発第 0302070 号平成 24 年 3 月 2 日一部改正平成 2 6 年 6 月 3 0 日 独立行政法人医薬品医療機器総合機構理事長近藤達也 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について 独立行政法人医薬品医療機器総合機構 ( 以下 機構 という ) が行う対面助言 証明確認調査等の実施要綱等については 独立行政法人医薬品医療機器総合機構が行う対面助言
独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について新旧対照表 別添 改正後 改正前 ( 下線部分は改正部分 ) 今般 後発医薬品変更管理事前確認相談を新設しました ( 別添 6-3) スイッチ OTC 等開発前相談及び OTC 品質相談を新設し 新一般用医薬品開発妥
 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について新旧対照表 別添 改正後 改正前 ( 下線部分は改正部分 ) 今般 後発医薬品変更管理事前確認相談を新設しました ( 別添 6-3) スイッチ OTC 等開発前相談及び OTC 品質相談を新設し 新一般用医薬品開発妥当性相談の相談枠を増設しました ( 別添 7) 医薬品申請電子データ提出方法相談及び医薬品申請電子データ提出免除相談を新設しました
独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について新旧対照表 別添 改正後 改正前 ( 下線部分は改正部分 ) 今般 後発医薬品変更管理事前確認相談を新設しました ( 別添 6-3) スイッチ OTC 等開発前相談及び OTC 品質相談を新設し 新一般用医薬品開発妥当性相談の相談枠を増設しました ( 別添 7) 医薬品申請電子データ提出方法相談及び医薬品申請電子データ提出免除相談を新設しました
(6) 対面助言のうち 医療機器 体外診断用医薬品及び細胞 組織利用製品の治験相談等 ( 医療機器 体外診断用医薬品の事前評価相談及び信頼性基準適合性相談を除く ) に関する実施要領 ( 別添 6) (7) 対面助言のうち 医療機器 体外診断用医薬品の事前評価相談に関する実施要領 ( 別添 7) (
 薬機発第 0901001 号平成 23 年 9 月 1 日 別記 殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要領等について 独立行政法人医薬品医療機器総合機構 ( 以下 機構 という ) が行う対面助言 証明確認調査等の実施要領等については 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要領等について
薬機発第 0901001 号平成 23 年 9 月 1 日 別記 殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要領等について 独立行政法人医薬品医療機器総合機構 ( 以下 機構 という ) が行う対面助言 証明確認調査等の実施要領等については 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要領等について
<4D F736F F D2093FA96F AD91E D86>
 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について新旧対照表 別添 改正後 改正前 ( 下線部分 : 改正部分 ) 今般 医薬部外品の審査の迅速化や円滑化を図ることを目的として 新たに医薬部外品 ( 防除用医薬部外品を除く 以下同じ ) 開発相談を新設するとともに 医薬品再審査適合性調査相談について 対象範囲を拡大する改訂を行いました ( 中略 ) 1. 対面助言
独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について新旧対照表 別添 改正後 改正前 ( 下線部分 : 改正部分 ) 今般 医薬部外品の審査の迅速化や円滑化を図ることを目的として 新たに医薬部外品 ( 防除用医薬部外品を除く 以下同じ ) 開発相談を新設するとともに 医薬品再審査適合性調査相談について 対象範囲を拡大する改訂を行いました ( 中略 ) 1. 対面助言
薬機発第 号 平成 29 年 11 月 1 日 別記 殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 レギュラトリーサイエンス戦略相談に関する実施要綱の一部改正について 平素より 独立行政法人医薬品医療機器総合機構の審査等業務に対し ご理解 ご協力をいただき ありがとうございま
 薬機発第 1101050 号 平成 29 年 11 月 1 日 別記 殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 レギュラトリーサイエンス戦略相談に関する実施要綱の一部改正について 平素より 独立行政法人医薬品医療機器総合機構の審査等業務に対し ご理解 ご協力をいただき ありがとうございます 当機構が行うレギュラトリーサイエンス戦略相談については 医薬品 医療機器薬事戦略相談事業の実施について
薬機発第 1101050 号 平成 29 年 11 月 1 日 別記 殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 レギュラトリーサイエンス戦略相談に関する実施要綱の一部改正について 平素より 独立行政法人医薬品医療機器総合機構の審査等業務に対し ご理解 ご協力をいただき ありがとうございます 当機構が行うレギュラトリーサイエンス戦略相談については 医薬品 医療機器薬事戦略相談事業の実施について
員長及び医薬品医療機器等法登録認証機関協議会代表幹事宛て送付するこ ととしていることを申し添えます 記 1. 基本要件基準第 13 条第 5 項及び第 6 項への適合性確認の基本的な考え方について (1)2023 年 ( 平成 35 年 )2 月 28 日 ( 以下 経過措置期間終了日 という )
 薬生機審発 0301 第 1 号 平成 30 年 3 月 1 日 各都道府県薬務主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医療機器審査管理課長 ( 公印省略 ) 医療機器の電磁両立性に関する日本工業規格の改正の取扱いについて すべての能動型医療機器は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第四十一条第三項の規定により厚生労働大臣が定める医療機器の基準 ( 平成 17
薬生機審発 0301 第 1 号 平成 30 年 3 月 1 日 各都道府県薬務主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医療機器審査管理課長 ( 公印省略 ) 医療機器の電磁両立性に関する日本工業規格の改正の取扱いについて すべての能動型医療機器は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第四十一条第三項の規定により厚生労働大臣が定める医療機器の基準 ( 平成 17
Microsoft Word - 【案1】登録認証機関立入要領改正通知(Ver )
 薬食機参発 1121 第 38 号平成 26 年 11 月 21 日 各登録認証機関の長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) 登録認証機関等に対する立入検査の実施要領の改正について 薬事法 ( 昭和 35 年法律第 145 号 ) の規定による登録認証機関等に対する立入 検査の実施要領については 登録認証機関等に対する立入検査の実施要領について ( 平成 18
薬食機参発 1121 第 38 号平成 26 年 11 月 21 日 各登録認証機関の長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) 登録認証機関等に対する立入検査の実施要領の改正について 薬事法 ( 昭和 35 年法律第 145 号 ) の規定による登録認証機関等に対する立入 検査の実施要領については 登録認証機関等に対する立入検査の実施要領について ( 平成 18
ともに 申請者が承認審査のスケジュールに沿って法令上求められる製造体制を整備することや承認後円滑に医療現場に提供するための対応が十分になされることで 更なる迅速な実用化を促すものである この制度では 原則として新規原理 新規作用機序等により 生命に重大な影響がある重篤な疾患等に対して 極めて高い有効
 ともに 申請者が承認審査のスケジュールに沿って法令上求められる製造体制を整備することや承認後円滑に医療現場に提供するための対応が十分になされることで 更なる迅速な実用化を促すものである この制度では 原則として新規原理 新規作用機序等により 生命に重大な影響がある重篤な疾患等に対して 極めて高い有効性が期待される医療機器 体外診断用医薬品 再生医療等製品を指定することとする また 本制度では PMDA
ともに 申請者が承認審査のスケジュールに沿って法令上求められる製造体制を整備することや承認後円滑に医療現場に提供するための対応が十分になされることで 更なる迅速な実用化を促すものである この制度では 原則として新規原理 新規作用機序等により 生命に重大な影響がある重篤な疾患等に対して 極めて高い有効性が期待される医療機器 体外診断用医薬品 再生医療等製品を指定することとする また 本制度では PMDA
Microsoft Word - (発番)医療機器の製造販売承認申請について
 薬食発 1120 第 5 号 平成 26 年 11 月 20 日 各都道府県知事殿 厚生労働省医薬食品局長 ( 公印省略 ) 医療機器の製造販売承認申請について 医療機器の製造販売承認申請の取扱いについては 医療機器の製造販売承認申請について ( 平成 17 年 2 月 16 日付け薬食発第 0216002 号厚生労働省医薬食品局長通知 以下 旧通知 という ) 等により実施してきたところです 先般
薬食発 1120 第 5 号 平成 26 年 11 月 20 日 各都道府県知事殿 厚生労働省医薬食品局長 ( 公印省略 ) 医療機器の製造販売承認申請について 医療機器の製造販売承認申請の取扱いについては 医療機器の製造販売承認申請について ( 平成 17 年 2 月 16 日付け薬食発第 0216002 号厚生労働省医薬食品局長通知 以下 旧通知 という ) 等により実施してきたところです 先般
Microsoft Word - (発出)マル製通知案
 薬食機参発 1119 第 7 号 薬食監麻発 1119 第 12 号 平成 26 年 11 月 19 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 厚生労働省医薬食品局監視指導 麻薬対策課長 ( 公印省略 ) 医療機器及び体外診断用医薬品の製造所の変更又は追加に係る手続 の迅速化について 医療機器及び体外診断用医薬品の製造所の変更に係る手続きの迅速化については
薬食機参発 1119 第 7 号 薬食監麻発 1119 第 12 号 平成 26 年 11 月 19 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 厚生労働省医薬食品局監視指導 麻薬対策課長 ( 公印省略 ) 医療機器及び体外診断用医薬品の製造所の変更又は追加に係る手続 の迅速化について 医療機器及び体外診断用医薬品の製造所の変更に係る手続きの迅速化については
通知(一括更新手続き)
 薬食審査発 0330 第 6 号 平成 27 年 3 月 30 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 ( 公印省略 ) 化粧品製造販売届書の届出先の都道府県が変更になる場合等の取扱いについて 化粧品製造販売届書の取扱いについては 改正薬事法の施行に伴う製造販売の承認を要しない医薬品等の取扱い等について ( 平成 17 年 3 月 31 日付け薬食審査発第 0331015
薬食審査発 0330 第 6 号 平成 27 年 3 月 30 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 ( 公印省略 ) 化粧品製造販売届書の届出先の都道府県が変更になる場合等の取扱いについて 化粧品製造販売届書の取扱いについては 改正薬事法の施行に伴う製造販売の承認を要しない医薬品等の取扱い等について ( 平成 17 年 3 月 31 日付け薬食審査発第 0331015
記 記 1.~6.( 略 ) 7. 医薬品の再審査申請時に添付する資料のうち 既に終了した製造販売後臨床試験 使用成績調査又は特定使用成績調査に関する資料について 当該試験 調査実施当時の GPSP 実施体制等を確認し 機構が実質的な適合性に対する調査を行う相談に関する要綱医薬品再審査適合性調査相談
 独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について新旧対照表改正現行 薬機発第 0302070 号平成 24 年 3 月 2 日一部改正平成 26 年 6 月 30 日一部改正平成 26 年 11 月 21 日一部改正平成 26 年 12 月 25 日一部改正平成 27 年 5 月 15 日一部改正平成 27 年 9 月 14 日一部改正平成 27 年 9 月 15
独立行政法人医薬品医療機器総合機構が行う対面助言 証明確認調査等の実施要綱等について新旧対照表改正現行 薬機発第 0302070 号平成 24 年 3 月 2 日一部改正平成 26 年 6 月 30 日一部改正平成 26 年 11 月 21 日一部改正平成 26 年 12 月 25 日一部改正平成 27 年 5 月 15 日一部改正平成 27 年 9 月 14 日一部改正平成 27 年 9 月 15
別添 治験副作用等症例の定期報告に関する質疑応答集 (Q&A) について < 半年ごとの定期報告の受け付け> Q1 平成 26 年 6 月 30 日までの間は 治験依頼者 ( 自ら治験を実施する者を除く ) が提出する副作用等症例の定期報告は なお従前の例によることができる とあるが 平成 26 年
 事務連絡 平成 25 年 7 月 1 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬食品局審査管理課 治験副作用等症例の定期報告に関する質疑応答集 (Q&A) について 薬事法施行規則 ( 昭和 36 年厚生省令第 1 号 ) 第 273 条第 3 項に基づく治験副作用等定期報告については 薬事法施行規則等の一部を改正する省令の施行に関する留意事項について ( 平成 24 年
事務連絡 平成 25 年 7 月 1 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬食品局審査管理課 治験副作用等症例の定期報告に関する質疑応答集 (Q&A) について 薬事法施行規則 ( 昭和 36 年厚生省令第 1 号 ) 第 273 条第 3 項に基づく治験副作用等定期報告については 薬事法施行規則等の一部を改正する省令の施行に関する留意事項について ( 平成 24 年
管下関係業者に周知いただくとともに 適切な指導を行い その実施に遺漏な きようお願いいたします 記 第 1 体外診断用医薬品の製造販売業又は製造業を行う旨の届出等について 1. 届出対象者旧薬事法に基づき 体外診断用医薬品を取り扱う以下の者 (1) 旧薬事法第 12 条第 1 項の第二種医薬品製造販
 薬食機参発 0 8 2 1 第 1 号 薬食安発 0 8 2 1 第 1 号 平成 2 6 年 8 月 2 1 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 厚生労働省医薬食品局安全対策課長 ( 公印省略 ) 体外診断用医薬品の製造販売業又は製造業を行う旨の届出等について 薬事法等の一部を改正する法律 ( 平成
薬食機参発 0 8 2 1 第 1 号 薬食安発 0 8 2 1 第 1 号 平成 2 6 年 8 月 2 1 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 厚生労働省医薬食品局安全対策課長 ( 公印省略 ) 体外診断用医薬品の製造販売業又は製造業を行う旨の届出等について 薬事法等の一部を改正する法律 ( 平成
 医学会発第 49 号 平成 29 年 3 月 23 日 日本医学会分科会 理事長 会長殿 日本医学会長 髙久史麿 公印省略 薬事戦略相談に関する実施要綱の一部改正等について ( 周知依頼 ) 平素より, 本会の事業推進にご協力を賜りまして, 誠にありがとうございます. このほど, 医薬品医療機器総合機構 (PMDA) から本職宛に, 標記の依頼が参りました.PMDA では平成 23 年 6 月 30
医学会発第 49 号 平成 29 年 3 月 23 日 日本医学会分科会 理事長 会長殿 日本医学会長 髙久史麿 公印省略 薬事戦略相談に関する実施要綱の一部改正等について ( 周知依頼 ) 平素より, 本会の事業推進にご協力を賜りまして, 誠にありがとうございます. このほど, 医薬品医療機器総合機構 (PMDA) から本職宛に, 標記の依頼が参りました.PMDA では平成 23 年 6 月 30
Microsoft Word - 【発送版】製造所の登録通知
 薬食機参発 1003 第 1 号 平成 26 年 10 月 3 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いについて 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業は登録制に移行され
薬食機参発 1003 第 1 号 平成 26 年 10 月 3 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いについて 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業は登録制に移行され
本日の内容 1. 医薬品の再審査に係る関連法規 2. 医薬品の再審査申請資料の適合性調査 2.1. GPSP 実地調査における調査の視点 2.2. 適合性書面調査における調査の視点 2.3. ( 参考 ) 医薬品再審査適合性調査相談の現況 3. 適合性調査の効率化に向けて 3.1. 安全性情報管理シ
 医薬品の製造販売後調査の 現状と留意点 1 本日の内容 1. 医薬品の再審査に係る関連法規 2. 医薬品の再審査申請資料の適合性調査 2.1. GPSP 実地調査における調査の視点 2.2. 適合性書面調査における調査の視点 2.3. ( 参考 ) 医薬品再審査適合性調査相談の現況 3. 適合性調査の効率化に向けて 3.1. 安全性情報管理シートの任意提出と事前提出資料 ( 実施手続き通知の改正 )
医薬品の製造販売後調査の 現状と留意点 1 本日の内容 1. 医薬品の再審査に係る関連法規 2. 医薬品の再審査申請資料の適合性調査 2.1. GPSP 実地調査における調査の視点 2.2. 適合性書面調査における調査の視点 2.3. ( 参考 ) 医薬品再審査適合性調査相談の現況 3. 適合性調査の効率化に向けて 3.1. 安全性情報管理シートの任意提出と事前提出資料 ( 実施手続き通知の改正 )
Microsoft Word - 奈良県GQP-GVPガイドライン doc
 三. 安全確保措置の実施に関する手順 1. 目的安全確保措置の実施に関する手順の目的を記載する < 記載例 > 本手順は GVP 省令の第 9 条に基づき 安全確保措置の実施を適正かつ円滑に行うために必要な手順を定めるものである 2. 適用範囲安全確保措置の実施に関する手順の適用範囲を記載する < 記載例 > 本手順書は 二. 安全管理情報の検討及びその結果に基づく安全確保措置の立案に関する手順 で立案された安全確保措置の決定
三. 安全確保措置の実施に関する手順 1. 目的安全確保措置の実施に関する手順の目的を記載する < 記載例 > 本手順は GVP 省令の第 9 条に基づき 安全確保措置の実施を適正かつ円滑に行うために必要な手順を定めるものである 2. 適用範囲安全確保措置の実施に関する手順の適用範囲を記載する < 記載例 > 本手順書は 二. 安全管理情報の検討及びその結果に基づく安全確保措置の立案に関する手順 で立案された安全確保措置の決定
写 薬生発 0131 第 1 号 平成 30 年 1 月 31 日 都道府県知事 殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 関係手数料令の一部を改正する政令の公布について この度 医薬品 医療機器等の品質 有効性及び安全性の確
 薬生発 0131 第 3 号 平成 30 年 1 月 31 日 独立行政法人医薬品医療機器総合機構理事長殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 関係手数料令の一部を改正する政令の公布について 標記につきまして 別添写しのとおり都道府県知事宛てに通知しましたので お 知らせいたします 写 薬生発 0131 第 1 号 平成 30
薬生発 0131 第 3 号 平成 30 年 1 月 31 日 独立行政法人医薬品医療機器総合機構理事長殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 関係手数料令の一部を改正する政令の公布について 標記につきまして 別添写しのとおり都道府県知事宛てに通知しましたので お 知らせいたします 写 薬生発 0131 第 1 号 平成 30
PSP 省令 と それぞれ略称する 記 1. 改正施行規則について希少疾病用医療機器その他の医療上特にその必要性が高いと認められる医療機器であり かつ 当該医療機器についての臨床試験の実施に特に長期間を要すると認められるものに係る承認申請をする場合においては 改正 GVP 省令第 9 条の3 第 1
 PSP 省令 と それぞれ略称する 記 1. 改正施行規則について希少疾病用医療機器その他の医療上特にその必要性が高いと認められる医療機器であり かつ 当該医療機器についての臨床試験の実施に特に長期間を要すると認められるものに係る承認申請をする場合においては 改正 GVP 省令第 9 条の3 第 1 項第 1 号に定める医療機器リスク管理計画書をもって 承認申請資料のうち臨床試験の試験成績に関する資料又はこれに代替するものとして厚生労働大臣が認める資料の一部に代えることができることとしたこと
PSP 省令 と それぞれ略称する 記 1. 改正施行規則について希少疾病用医療機器その他の医療上特にその必要性が高いと認められる医療機器であり かつ 当該医療機器についての臨床試験の実施に特に長期間を要すると認められるものに係る承認申請をする場合においては 改正 GVP 省令第 9 条の3 第 1 項第 1 号に定める医療機器リスク管理計画書をもって 承認申請資料のうち臨床試験の試験成績に関する資料又はこれに代替するものとして厚生労働大臣が認める資料の一部に代えることができることとしたこと
ドラッグラグの現状 日本においては平均して世界初上市から約 4 年遅れて上市されており 最も遅れの少ない米国と比較しておよそ 2.5 年の開きがある * 1,417 (= 約 4 年 ) 約 2.5 年 日本 フランス デン マーク ドイツ ス
 今後の機構の体制について 平成 19 年 6 月 8 日医薬品医療機器総合機構 ドラッグラグの現状 日本においては平均して世界初上市から約 4 年遅れて上市されており 最も遅れの少ない米国と比較しておよそ 2.5 年の開きがある * 1,417 (= 約 4 年 ) 915 757 約 2.5 年 620 583 538 512 505 日本 フランス デン マーク ドイツ スウェーデン スイス英国米国
今後の機構の体制について 平成 19 年 6 月 8 日医薬品医療機器総合機構 ドラッグラグの現状 日本においては平均して世界初上市から約 4 年遅れて上市されており 最も遅れの少ない米国と比較しておよそ 2.5 年の開きがある * 1,417 (= 約 4 年 ) 915 757 約 2.5 年 620 583 538 512 505 日本 フランス デン マーク ドイツ スウェーデン スイス英国米国
る として 平成 20 年 12 月に公表された 規制改革推進のための第 3 次答申 において 医療機器開発の円滑化の観点から 薬事法の適用範囲の明確化を図るためのガイドラインを作成すべきであると提言したところである 今般 薬事法の適用に関する判断の透明性 予見可能性の向上を図るため 臨床研究におい
 都道府県知事 各保健所設置市長殿 特別区長 薬食発 0331 第 7 号 平成 22 年 3 月 31 日 厚生労働省医薬食品局長 臨床研究において用いられる未承認医療機器の提供等に係る 薬事法の適用について 薬事法 ( 昭和 35 年法律第 145 号 ) は 医療機器について品質 有効性及び安全性の確保がなされた製品のみが流通するよう種々の規制を設けているが 薬事法第 14 条第 1 項の承認を受けていない医療機器
都道府県知事 各保健所設置市長殿 特別区長 薬食発 0331 第 7 号 平成 22 年 3 月 31 日 厚生労働省医薬食品局長 臨床研究において用いられる未承認医療機器の提供等に係る 薬事法の適用について 薬事法 ( 昭和 35 年法律第 145 号 ) は 医療機器について品質 有効性及び安全性の確保がなされた製品のみが流通するよう種々の規制を設けているが 薬事法第 14 条第 1 項の承認を受けていない医療機器
薬生安発 0302 第 1 号 平成 30 年 3 月 2 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について の一部改正について 再審査期間中の新医薬品以外の医薬品の医薬品リ
 薬生安発 0302 第 1 号 平成 30 年 3 月 2 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について の一部改正について 再審査期間中の新医薬品以外の医薬品の医薬品リスク管理計画の実施状況及び得られた結果の評価に関する報告の様式 提出等の取扱いについては 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について
薬生安発 0302 第 1 号 平成 30 年 3 月 2 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について の一部改正について 再審査期間中の新医薬品以外の医薬品の医薬品リスク管理計画の実施状況及び得られた結果の評価に関する報告の様式 提出等の取扱いについては 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について
PSP 省令 と それぞれ略称する 記 1. 改正施行規則について希少疾病用医療機器その他の医療上特にその必要性が高いと認められる医療機器であり かつ 当該医療機器についての臨床試験の実施に特に長期間を要すると認められるものに係る承認申請をする場合においては 改正 GVP 省令第 9 条の3 第 1
 薬生発 07 31 第 4 号 平成 29 年 7 月 31 日 各都道府県知事殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則の一部を改正する省令 医薬品 医薬部外品 化粧品 医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令の一部を改正する省令 及び 医療機器の製造販売後の調査及び試験の実施の基準に関する省令の一部を改正する省令
薬生発 07 31 第 4 号 平成 29 年 7 月 31 日 各都道府県知事殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則の一部を改正する省令 医薬品 医薬部外品 化粧品 医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令の一部を改正する省令 及び 医療機器の製造販売後の調査及び試験の実施の基準に関する省令の一部を改正する省令
医薬品たるコンビネーション製品の不具合報告等に関する Q&A [ 用いた略語 ] 法 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 施行規則 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則 ( 昭和 36 年
![医薬品たるコンビネーション製品の不具合報告等に関する Q&A [ 用いた略語 ] 法 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 施行規則 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則 ( 昭和 36 年 医薬品たるコンビネーション製品の不具合報告等に関する Q&A [ 用いた略語 ] 法 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 施行規則 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則 ( 昭和 36 年](/thumbs/91/107149459.jpg) 事務連絡 平成 29 年 6 月 9 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬 生活衛生局安全対策課 コンビネーション製品の副作用等報告に関する Q&A について の改訂について コンビネーション製品の副作用等報告に関するQ&Aについては コンビネーション製品の副作用等報告に関するQ&Aについて ( 平成 26 年 10 月 31 日付け厚生労働省医薬食品局安全対策課事務連絡
事務連絡 平成 29 年 6 月 9 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬 生活衛生局安全対策課 コンビネーション製品の副作用等報告に関する Q&A について の改訂について コンビネーション製品の副作用等報告に関するQ&Aについては コンビネーション製品の副作用等報告に関するQ&Aについて ( 平成 26 年 10 月 31 日付け厚生労働省医薬食品局安全対策課事務連絡
( 別紙 ) 承認申請時の電子データ提出に関する基本的考え方について ( 平成 26 年 6 月 20 日付け薬食審査発 0620 第 6 号厚生労働省医薬食品局審査管理課長通知 ) 新旧対照表 ( 別添 ) 改正後 承認申請時の電子データ提出に関する基本的考え方 1. 承認申請時に電子データ提出を
 ( 別紙 ) 承認申請時の電子データ提出に関する基本的考え方について ( 平成 26 年 6 月 20 日付け薬食審査発 0620 第 6 号厚生労働省医薬食品局審査管理課長通知 ) 新旧対照表 ( 別添 ) 改正後 承認申請時の電子データ提出に関する基本的考え方 1. 承認申請時に電子データ提出を求める背景 2. 電子データの提出対象となる品目と資料の範囲 (1) 対象となる品目 原則として 医薬品の承認申請について
( 別紙 ) 承認申請時の電子データ提出に関する基本的考え方について ( 平成 26 年 6 月 20 日付け薬食審査発 0620 第 6 号厚生労働省医薬食品局審査管理課長通知 ) 新旧対照表 ( 別添 ) 改正後 承認申請時の電子データ提出に関する基本的考え方 1. 承認申請時に電子データ提出を求める背景 2. 電子データの提出対象となる品目と資料の範囲 (1) 対象となる品目 原則として 医薬品の承認申請について
Microsoft Word - 【発送版】記載整備通知
 薬食機参発 0929 第 1 号 平成 26 年 9 月 29 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の承認書又は認証書の記載整備について 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業が登録制に移行されること等に伴い
薬食機参発 0929 第 1 号 平成 26 年 9 月 29 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の承認書又は認証書の記載整備について 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業が登録制に移行されること等に伴い
はじめて医療機器を製造販売または製造される方へ
 を製造 ( 輸入 ) 販売するには 国内で必要な許可等について を製造販売 製造 ( 輸入 ) するためには 医薬品 等の品質 有効性及び安全性の確保等に関する法律 ( 以下 薬機法という ) の許可等 ( 製造販売業許可 製造業登録 ) が必要になります 製品を市場に出荷するために必要な許可 販売する製品に対して最終責製造販売業任を持ち 自社の名前で市場へ出荷する この許可では製造することはできません
を製造 ( 輸入 ) 販売するには 国内で必要な許可等について を製造販売 製造 ( 輸入 ) するためには 医薬品 等の品質 有効性及び安全性の確保等に関する法律 ( 以下 薬機法という ) の許可等 ( 製造販売業許可 製造業登録 ) が必要になります 製品を市場に出荷するために必要な許可 販売する製品に対して最終責製造販売業任を持ち 自社の名前で市場へ出荷する この許可では製造することはできません
ICH Q4B Annex12
 薬食審査発 0321 第 1 号平成 2 5 年 3 月 21 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 ( 公印省略 ) ICHQ4B ガイドラインに基づく事項別付属文書 ( エンドトキシン試験法 ) について 今般 日米 EU 医薬品規制調和国際会議 (ICH) において ICHQ4B ガイドライン ( 平成 21 年 5 月 26 日付け薬食審査発第 0526001
薬食審査発 0321 第 1 号平成 2 5 年 3 月 21 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 ( 公印省略 ) ICHQ4B ガイドラインに基づく事項別付属文書 ( エンドトキシン試験法 ) について 今般 日米 EU 医薬品規制調和国際会議 (ICH) において ICHQ4B ガイドライン ( 平成 21 年 5 月 26 日付け薬食審査発第 0526001
前項に規定する事項のうち当該被験薬の治験薬概要書から予測できないもの に改め 同項を同条第三項とし 同条第一項の次に次の一項を加える 2治験依頼者は 被験薬について法第八十条の二第六項に規定する事項を知ったときは その発現症例一覧等を当該被験薬ごとに 当該被験薬について初めて治験の計画を届け出た日等
 厚生労働省令第二十四号薬事法(昭和三十五年法律第百四十五号)第十四条第三項(同条第九項及び同法第十九条の二第五項において準用する場合を含む ) 第十四条の四第四項及び第十四条の六第四項(これらの規定を同法第十九条の四において準用する場合を含む ) 第八十条の二第一項 第四項及び第五項並びに第八十二条の規定に基づき 医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令を次のように定める 平成二十年二月二十九日厚生労働大臣舛添要一医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令医薬品の臨床試験の実施の基準に関する省令(平成九年厚生省令第二十八号)の一部を次のように改正する
厚生労働省令第二十四号薬事法(昭和三十五年法律第百四十五号)第十四条第三項(同条第九項及び同法第十九条の二第五項において準用する場合を含む ) 第十四条の四第四項及び第十四条の六第四項(これらの規定を同法第十九条の四において準用する場合を含む ) 第八十条の二第一項 第四項及び第五項並びに第八十二条の規定に基づき 医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令を次のように定める 平成二十年二月二十九日厚生労働大臣舛添要一医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令医薬品の臨床試験の実施の基準に関する省令(平成九年厚生省令第二十八号)の一部を次のように改正する
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下
 北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
医療機器プログラムの取扱いに関する Q&A について ( その 2) ( 別紙 ) 用いた略語 改正法 : 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 ) 法 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 施行令
 事務連絡平成 27 年 9 月 30 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬食品局医療機器 再生医療等製品担当参事官室 厚生労働省医薬食品局監視指導 麻薬対策課 医療機器プログラムの取扱いに関する Q&A について ( その 2) 医療機器プログラムの取扱いについては 医療機器プログラムの取扱いについて ( 平成 26 年 11 月 21 日付け薬食機参発 1121 第
事務連絡平成 27 年 9 月 30 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬食品局医療機器 再生医療等製品担当参事官室 厚生労働省医薬食品局監視指導 麻薬対策課 医療機器プログラムの取扱いに関する Q&A について ( その 2) 医療機器プログラムの取扱いについては 医療機器プログラムの取扱いについて ( 平成 26 年 11 月 21 日付け薬食機参発 1121 第
医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など ) 医薬品候補物質のスクリーニン
 特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
薬生発 0926 第 5 号 平成 29 年 9 月 26 日 都道府県知事 各保健所設置市長殿 特別区長 厚生労働省医薬 生活衛生局長 ( 公印省略 ) コンタクトレンズの適正使用に関する情報提供等の徹底について コンタクトレンズ ( カラーコンタクトレンズを含む ) の販売に関しては これまで
 薬生発 0926 第 5 号 平成 29 年 9 月 26 日 都道府県知事 各保健所設置市長殿 特別区長 厚生労働省医薬 生活衛生局長 ( 公印省略 ) コンタクトレンズの適正使用に関する情報提供等の徹底について コンタクトレンズ ( カラーコンタクトレンズを含む ) の販売に関しては これまで コンタクトレンズの適正使用に関する情報提供等の徹底について ( 平成 24 年 7 月 18 日付け薬食発
薬生発 0926 第 5 号 平成 29 年 9 月 26 日 都道府県知事 各保健所設置市長殿 特別区長 厚生労働省医薬 生活衛生局長 ( 公印省略 ) コンタクトレンズの適正使用に関する情報提供等の徹底について コンタクトレンズ ( カラーコンタクトレンズを含む ) の販売に関しては これまで コンタクトレンズの適正使用に関する情報提供等の徹底について ( 平成 24 年 7 月 18 日付け薬食発
<4D F736F F F696E74202D CA9976C A A4F8D9190BB91A28BC68ED282CC944692E890A793782E E B8CDD8AB B83685D>
 外国製造業者の認定制度 独立行政法人医薬品医療機器総合機構機構 品質管理部長 新見裕一 2009 年 6 月 23 日 CPhI China 2009 1 本日の話題 1. 外国製造業者認定制度の概要 2. 申請手続き 3. 提出資料 4. 申請から認定を受けるまでの流れ 5.PMDA のホームページの紹介 2 1. 外国製造業者認定制度の概要 (1) 認定とは (2) 外国製造業者の認定の区分 (3)
外国製造業者の認定制度 独立行政法人医薬品医療機器総合機構機構 品質管理部長 新見裕一 2009 年 6 月 23 日 CPhI China 2009 1 本日の話題 1. 外国製造業者認定制度の概要 2. 申請手続き 3. 提出資料 4. 申請から認定を受けるまでの流れ 5.PMDA のホームページの紹介 2 1. 外国製造業者認定制度の概要 (1) 認定とは (2) 外国製造業者の認定の区分 (3)
Microsoft PowerPoint - ⑨140925,30日薬連講習会(後発RMP)930.ppt [互換モード]
![Microsoft PowerPoint - ⑨140925,30日薬連講習会(後発RMP)930.ppt [互換モード] Microsoft PowerPoint - ⑨140925,30日薬連講習会(後発RMP)930.ppt [互換モード]](/thumbs/101/151698947.jpg) 後発医薬品 RMP について 厚生労働省医薬食品局安全対策課磯﨑正季子 1 後発医薬品への RMP の適用 平成 24 年 4 月 11 日薬食安発 0411 第 1 号 薬食審査発 0411 第 2 号安全対策課長 審査管理課長連名通知 医薬品リスク管理計画指針について 適用範囲医療用医薬品 ( 新医薬品 バイオ後続品 後発医薬品 ) 策定検討の時点 承認申請時 新医薬品 バイオ後続品後発医薬品
後発医薬品 RMP について 厚生労働省医薬食品局安全対策課磯﨑正季子 1 後発医薬品への RMP の適用 平成 24 年 4 月 11 日薬食安発 0411 第 1 号 薬食審査発 0411 第 2 号安全対策課長 審査管理課長連名通知 医薬品リスク管理計画指針について 適用範囲医療用医薬品 ( 新医薬品 バイオ後続品 後発医薬品 ) 策定検討の時点 承認申請時 新医薬品 バイオ後続品後発医薬品
薬局を利用するために必要な情報の掲示 ( 薬事法第 9 条の 4) 次の事項について 掲示板等により 薬局内に掲示 しなければなりません また 第 3 については 特定販売を行うことについての広告をする場合 ホームページ等に表示しなければなりません < 具体例 > 第 1 薬局の管理及び運営に関する
 薬局を利用するために必要な情報の掲示 ( 薬事法第 9 条の 4) 次の事項について 掲示板等により 薬局内に掲示 しなければなりません また 第 3 については 特定販売を行うことについての広告をする場合 ホームページ等に表示しなければなりません < 具体例 > 第 1 薬局の管理及び運営に関する事項 1 許可の区分の別薬局 開設者氏名 株式会社 開設者の氏名又は名称その 薬局の名称 薬局 店 2
薬局を利用するために必要な情報の掲示 ( 薬事法第 9 条の 4) 次の事項について 掲示板等により 薬局内に掲示 しなければなりません また 第 3 については 特定販売を行うことについての広告をする場合 ホームページ等に表示しなければなりません < 具体例 > 第 1 薬局の管理及び運営に関する事項 1 許可の区分の別薬局 開設者氏名 株式会社 開設者の氏名又は名称その 薬局の名称 薬局 店 2
Ⅲ-3 試用医薬品に関する基準 平成 10 年 1 月 20 日公正取引委員会届出改定平成 13 年 3 月 19 日公正取引委員会届出改定平成 16 年 5 月 25 日公正取引委員会届出改定平成 17 年 3 月 29 日公正取引委員会届出改定平成 26 年 6 月 16 日公正取引委員会 消費
 Ⅲ-3 試用医薬品に関する基準 平成 10 年 1 月 20 日公正取引委員会届出改定平成 13 年 3 月 19 日公正取引委員会届出改定平成 16 年 5 月 25 日公正取引委員会届出改定平成 17 年 3 月 29 日公正取引委員会届出改定平成 26 年 6 月 16 日公正取引委員会 消費者庁長官届出 本基準は規約第 5 条第 3 号 施行規則第 2 条 ( 試用医薬品提供基準 ) に基づくものである
Ⅲ-3 試用医薬品に関する基準 平成 10 年 1 月 20 日公正取引委員会届出改定平成 13 年 3 月 19 日公正取引委員会届出改定平成 16 年 5 月 25 日公正取引委員会届出改定平成 17 年 3 月 29 日公正取引委員会届出改定平成 26 年 6 月 16 日公正取引委員会 消費者庁長官届出 本基準は規約第 5 条第 3 号 施行規則第 2 条 ( 試用医薬品提供基準 ) に基づくものである
<4D F736F F D2093FA96F AD91E D86>
 レギュラトリーサイエンス戦略相談に関する実施要綱新旧対照表 別添 改正後 改正前 ( 下線部分は改正部分 ) 6. 関西支部においてテレビ会議システムを用いた相談対面助言を希望する場合 (1) 日程調整関西支部テレビ会議システムの利用を希望される方は 業務方法書実施細則の様式第 36 号 ( 本通知の別添 6) の表題部分のうち レギュラトリーサイエンス戦略相談における関西支部テレビ会議システム利用申込書
レギュラトリーサイエンス戦略相談に関する実施要綱新旧対照表 別添 改正後 改正前 ( 下線部分は改正部分 ) 6. 関西支部においてテレビ会議システムを用いた相談対面助言を希望する場合 (1) 日程調整関西支部テレビ会議システムの利用を希望される方は 業務方法書実施細則の様式第 36 号 ( 本通知の別添 6) の表題部分のうち レギュラトリーサイエンス戦略相談における関西支部テレビ会議システム利用申込書
< F2D819B955C8EA692CA926D DC58F4994AD8F6F>
 薬食監麻発第 0331008 号平成 17 年 3 月 31 日 各都道府県衛生主管部 ( 局 ) 長 薬事法及び採血及び供血あつせん業取締法の一部を改正する法律 ( 平成 14 年法律第 96 号 以下 一部改正法 という ) 第 2 条の規定による改正後の薬事法 ( 昭和 35 年法律第 145 号 以下 法 という ) 及び関係政省令等の規定に基づく医薬品 医薬部外品 化粧品及び医療機器 (
薬食監麻発第 0331008 号平成 17 年 3 月 31 日 各都道府県衛生主管部 ( 局 ) 長 薬事法及び採血及び供血あつせん業取締法の一部を改正する法律 ( 平成 14 年法律第 96 号 以下 一部改正法 という ) 第 2 条の規定による改正後の薬事法 ( 昭和 35 年法律第 145 号 以下 法 という ) 及び関係政省令等の規定に基づく医薬品 医薬部外品 化粧品及び医療機器 (
国立病院機構大阪医療センター受託研究取扱細則
 国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
改正薬事法の施行に伴う製造販売の承認を要しない医薬品等の取扱い等について
 薬食審査発第 0331015 号平成 17 年 3 月 31 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 改正薬事法の施行に伴う製造販売の承認を要しない医薬品等の取扱い等について 薬事法及び採血及び供血あっせん業取締法の一部を改正する法律 ( 平成 14 年法律第 96 号 以下 薬事法等一部改正法 という ) による改正後の薬事法 ( 昭和 35 年法律第 145
薬食審査発第 0331015 号平成 17 年 3 月 31 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 改正薬事法の施行に伴う製造販売の承認を要しない医薬品等の取扱い等について 薬事法及び採血及び供血あっせん業取締法の一部を改正する法律 ( 平成 14 年法律第 96 号 以下 薬事法等一部改正法 という ) による改正後の薬事法 ( 昭和 35 年法律第 145
中医協総 医薬品及び医療機器の費用対効果評価に関する取扱いについて 1 既収載品に係る費用対効果評価の手続き (1) 対象品目の指定中央社会保険医療協議会の定める以下の選定基準に基づき 費用対効果評価専門部会において指定 公表されたものとする 次の全ての要件を満たす品
 中医協総 - 5 2 8. 2. 1 0 医薬品及び医療機器の費用対効果評価に関する取扱いについて 1 既収載品に係る費用対効果評価の手続き (1) 対象品目の指定中央社会保険医療協議会の定める以下の選定基準に基づき 費用対効果評価専門部会において指定 公表されたものとする 次の全ての要件を満たす品目を対象とする なお 2においてイのⅰ イのⅱ ロのⅰ 及びロのⅱは それぞれ1 品目が該当するものとし
中医協総 - 5 2 8. 2. 1 0 医薬品及び医療機器の費用対効果評価に関する取扱いについて 1 既収載品に係る費用対効果評価の手続き (1) 対象品目の指定中央社会保険医療協議会の定める以下の選定基準に基づき 費用対効果評価専門部会において指定 公表されたものとする 次の全ての要件を満たす品目を対象とする なお 2においてイのⅰ イのⅱ ロのⅰ 及びロのⅱは それぞれ1 品目が該当するものとし
薬食機発 0131 第 1 号平成 25 年 1 月 31 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課医療機器審査管理室長 薬事法に基づく登録認証機関の基準改正に伴う留意事項について ( その 2) 薬事法 ( 昭和 35 年法律第 145 号 以下 法 という )
 薬食機発 0131 第 1 号平成 25 年 1 月 31 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課医療機器審査管理室長 薬事法に基づく登録認証機関の基準改正に伴う留意事項について ( その 2) 薬事法 ( 昭和 35 年法律第 145 号 以下 法 という ) 第 23 条の 2 第 1 項の登録認証機関の登録申請等の取扱いについては 薬事法及び採血及び供血あつせん業取締法の一部を改正する法律等の施行に関する適合性認証機関の登録申請等について
薬食機発 0131 第 1 号平成 25 年 1 月 31 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課医療機器審査管理室長 薬事法に基づく登録認証機関の基準改正に伴う留意事項について ( その 2) 薬事法 ( 昭和 35 年法律第 145 号 以下 法 という ) 第 23 条の 2 第 1 項の登録認証機関の登録申請等の取扱いについては 薬事法及び採血及び供血あつせん業取締法の一部を改正する法律等の施行に関する適合性認証機関の登録申請等について
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
医師主導治験取扱要覧
 15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
医師主導治験取扱要覧
 9. 安全性情報の取扱いに関する手順書 1. 目的及び適用範囲 本手順書は 安全性情報の取扱いに係る用語の定義を定め 当該治験に関与する者が 安全性情報を適 切に取扱うための手順その他必要な事項を定めるものである 2. 用語の定義等 2.1. 用語の定義 2.1.1. 治験責任医師等 本手順書は 自ら治験を実施する者を 治験責任医師 と記載し また 治験責任医師及び治験分担医師 を併せて 治験責任医師等
9. 安全性情報の取扱いに関する手順書 1. 目的及び適用範囲 本手順書は 安全性情報の取扱いに係る用語の定義を定め 当該治験に関与する者が 安全性情報を適 切に取扱うための手順その他必要な事項を定めるものである 2. 用語の定義等 2.1. 用語の定義 2.1.1. 治験責任医師等 本手順書は 自ら治験を実施する者を 治験責任医師 と記載し また 治験責任医師及び治験分担医師 を併せて 治験責任医師等
 薬機発第 1101050 号 平成 29 年 11 月 1 日 別記 殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 レギュラトリーサイエンス戦略相談に関する実施要綱の一部改正について 平素より 独立行政法人医薬品医療機器総合機構の審査等業務に対し ご理解 ご協力をいただき ありがとうございます 当機構が行うレギュラトリーサイエンス戦略相談については 医薬品 医療機器薬事戦略相談事業の実施について
薬機発第 1101050 号 平成 29 年 11 月 1 日 別記 殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 レギュラトリーサイエンス戦略相談に関する実施要綱の一部改正について 平素より 独立行政法人医薬品医療機器総合機構の審査等業務に対し ご理解 ご協力をいただき ありがとうございます 当機構が行うレギュラトリーサイエンス戦略相談については 医薬品 医療機器薬事戦略相談事業の実施について
00 事務連絡案
 事務連絡 平成 30 年 10 月 30 日 都道府県知事 各保健所設置市 特別区 衛生検査所業務担当部 ( 局 ) 御中 厚生労働省医政局地域医療計画課 医療関連サービス室 衛生検査所において新たに作成する標準作業書及び台帳の参考例について 医療法等の一部を改正する法律 ( 平成 29 年法律第 57 号 以下 改正法 という ) の一部の規定が平成 30 年 12 月 1 日に施行されることに伴い
事務連絡 平成 30 年 10 月 30 日 都道府県知事 各保健所設置市 特別区 衛生検査所業務担当部 ( 局 ) 御中 厚生労働省医政局地域医療計画課 医療関連サービス室 衛生検査所において新たに作成する標準作業書及び台帳の参考例について 医療法等の一部を改正する法律 ( 平成 29 年法律第 57 号 以下 改正法 という ) の一部の規定が平成 30 年 12 月 1 日に施行されることに伴い
別紙 1 販売名 医療機器保険適用希望書 ( 決定区分 A1( 包括 )) 整理番号 : 空欄で提出 薬事法承認又は認証された販売名を記載 製品名 製品コード 製品名 製品コード JAN コードの場合必ず 13 桁 薬事法承認書又は認証書上 薬事法承認書又は認証書上記載 記載された類別を記載 された
 事務連絡 平成 24 年 3 月 19 日 日本医療機器産業連合会会長 米国医療機器 IVD 工業会会長 欧州ビジネス協会医療機器委員会委員長 殿 厚生労働省医政局経済課医療機器政策室 医療機器保険適用希望書の記載例等について 平素より 厚生労働行政にご協力いただきありがとうございます 医療機器保険適用希望書の提出に関連した通知として 医療機器の保険適用等に関する取扱いについて ( 平成 24 年
事務連絡 平成 24 年 3 月 19 日 日本医療機器産業連合会会長 米国医療機器 IVD 工業会会長 欧州ビジネス協会医療機器委員会委員長 殿 厚生労働省医政局経済課医療機器政策室 医療機器保険適用希望書の記載例等について 平素より 厚生労働行政にご協力いただきありがとうございます 医療機器保険適用希望書の提出に関連した通知として 医療機器の保険適用等に関する取扱いについて ( 平成 24 年
本日の内容 1. 再審査申請と関連法規 2. 医薬品の再審査申請資料適合性調査 2.1. 実地調査 2.2. 書面調査 3. 適合性調査の効率化に向けて 3.1. 安全性情報管理シートの見直し 3.2. 医薬品再審査適合性調査相談 ( 新設 ) 2
 医薬品の製造販売後調査の 現状と留意点 1 本日の内容 1. 再審査申請と関連法規 2. 医薬品の再審査申請資料適合性調査 2.1. 実地調査 2.2. 書面調査 3. 適合性調査の効率化に向けて 3.1. 安全性情報管理シートの見直し 3.2. 医薬品再審査適合性調査相談 ( 新設 ) 2 本日の内容 1. 再審査申請と関連法規 2. 医薬品の再審査申請資料適合性調査 2.1. 実地調査 2.2.
医薬品の製造販売後調査の 現状と留意点 1 本日の内容 1. 再審査申請と関連法規 2. 医薬品の再審査申請資料適合性調査 2.1. 実地調査 2.2. 書面調査 3. 適合性調査の効率化に向けて 3.1. 安全性情報管理シートの見直し 3.2. 医薬品再審査適合性調査相談 ( 新設 ) 2 本日の内容 1. 再審査申請と関連法規 2. 医薬品の再審査申請資料適合性調査 2.1. 実地調査 2.2.
MDSAP の調査結果の 試行的受入れについて ( 独 ) 医薬品医療機器総合機構 品質管理部 登録認証機関監督課 1
 MDSAP の調査結果の 試行的受入れについて ( 独 ) 医薬品医療機器総合機構 品質管理部 登録認証機関監督課 1 MDSAP 報告書の受入れの概要 (1/2) 日本は 平成 27 年 6 月にMDSAPに参加する旨を発表 関係者との意見交換を行い MDSAP 報告書の受け入れについて 以下の通知を発出した 平成 28 年 6 月 22 日薬生監麻発 0622 第 3 号 薬生機審発 0622
MDSAP の調査結果の 試行的受入れについて ( 独 ) 医薬品医療機器総合機構 品質管理部 登録認証機関監督課 1 MDSAP 報告書の受入れの概要 (1/2) 日本は 平成 27 年 6 月にMDSAPに参加する旨を発表 関係者との意見交換を行い MDSAP 報告書の受け入れについて 以下の通知を発出した 平成 28 年 6 月 22 日薬生監麻発 0622 第 3 号 薬生機審発 0622
4. 独立行政法人医薬品医療機器総合機構 (PMDA) との連携創薬シーズの実用化に向けて 独立行政法人医薬品医療機器総合機構 (PMDA) が実施する RS 総合相談 RS 戦略相談を利用することが想定される場合 相談者からの同意を得た上で 独立行政法人医薬品医療機器総合機構 (PMDA) に対し
 創薬ナビに関する実施要領 平成 27 年 4 月 1 日平成 27 年 7 月 1 日改定平成 27 年 12 月 25 日改定平成 29 年 11 月 10 日改定 1. 事業の目的創薬ナビは 我が国の大学や公的研究機関で生み出された優れた研究成果 ( 創薬シーズ ) を確実に実用化につなげるため 創薬研究に取り組む大学等の研究者からの様々な相談に応じることでアカデミア発創薬を支援することを目的としています
創薬ナビに関する実施要領 平成 27 年 4 月 1 日平成 27 年 7 月 1 日改定平成 27 年 12 月 25 日改定平成 29 年 11 月 10 日改定 1. 事業の目的創薬ナビは 我が国の大学や公的研究機関で生み出された優れた研究成果 ( 創薬シーズ ) を確実に実用化につなげるため 創薬研究に取り組む大学等の研究者からの様々な相談に応じることでアカデミア発創薬を支援することを目的としています
Microsoft Word - (課×県・指定)【頭紙】「精神障害者保健福祉手帳の診断書の記入に当たって留意すべき事項について」等の一部改正について.rtf
 ( 別添 3) 精神科病院に入院する時の告知等に係る書面及び入退院の届出等について ( 平成 12 年 3 月 30 日障精第 22 号厚生省大臣官房障害保健福祉部精神保健福祉課長通知 ) 新旧対照表 ( 変更点は下線部 ) 改正後現行 障精第 2 2 号平成 12 年 3 月 30 日一部改正障精発第 0325001 号平成 17 年 3 月 25 日一部改正障精発第 0929005 号平成 18
( 別添 3) 精神科病院に入院する時の告知等に係る書面及び入退院の届出等について ( 平成 12 年 3 月 30 日障精第 22 号厚生省大臣官房障害保健福祉部精神保健福祉課長通知 ) 新旧対照表 ( 変更点は下線部 ) 改正後現行 障精第 2 2 号平成 12 年 3 月 30 日一部改正障精発第 0325001 号平成 17 年 3 月 25 日一部改正障精発第 0929005 号平成 18
製造販売後調査事務手続き等 について
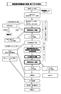 製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
特定臨床研究に関する手順書
 学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
申請ソフトの起動 申請ソフトを起動して ファイル 申請書の新規作成 を選択 様式から C04 を選択し 了解 クリック ( 参考 1) FD 申請ソフトでの申請書鑑の打出しは 印字されない空欄箇所がありますので 別途 書面による鑑の作成が必要です その方法は FD 申請ソフトの入力手順の次 (P14
 外国製造業者認定申請の作成例 - C04( 医療機器外国製造業者認定申請 ) の事例 - 本作成例は FD 申請ソフトで作成した申請書の提出を前提に その入力方法や申請時に必要な書類などの説明をしています FD 申請へのご協力をお願いします PMDA へ提出する 医療機器医療機器の外国製造業者認定外国製造業者認定申請において 入力情報を最小限にとどめた 簡易入力による簡易入力による FD 申請の受付を平成
外国製造業者認定申請の作成例 - C04( 医療機器外国製造業者認定申請 ) の事例 - 本作成例は FD 申請ソフトで作成した申請書の提出を前提に その入力方法や申請時に必要な書類などの説明をしています FD 申請へのご協力をお願いします PMDA へ提出する 医療機器医療機器の外国製造業者認定外国製造業者認定申請において 入力情報を最小限にとどめた 簡易入力による簡易入力による FD 申請の受付を平成
<4D F736F F D E34208EA18CB18EE891B182AB977697CC C8E8DB782B591D682A688CB978A>
 Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
企画競争説明書 平成 29 年 6 月 独立行政法人医薬品医療機器総合機構が行う 平成 29 年度医薬品副作用被害救済制度に 係る広報業務 については 仕様書に定めるもののほかこの企画競争説明書によるものとす る 1. 契約担当者 独立行政法人医薬品医療機器総合機構契約担当役井上誠一 2. 事項 (
 企画競争説明書 平成 29 年 6 月 独立行政法人医薬品医療機器総合機構が行う 平成 29 年度医薬品副作用被害救済制度に 係る広報業務 については 仕様書に定めるもののほかこの企画競争説明書によるものとす る 1. 契約担当者 独立行政法人医薬品医療機器総合機構契約担当役井上誠一 2. 事項 (1) 件名平成 29 年度医薬品副作用被害救済制度に係る広報業務 (2) 実施期間契約した日から平成
企画競争説明書 平成 29 年 6 月 独立行政法人医薬品医療機器総合機構が行う 平成 29 年度医薬品副作用被害救済制度に 係る広報業務 については 仕様書に定めるもののほかこの企画競争説明書によるものとす る 1. 契約担当者 独立行政法人医薬品医療機器総合機構契約担当役井上誠一 2. 事項 (1) 件名平成 29 年度医薬品副作用被害救済制度に係る広報業務 (2) 実施期間契約した日から平成
薬食審査発第 号
 薬食審査発第 0928004 号 平成 19 年 9 月 28 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 第十五改正日本薬局方第一追補の制定に伴う 医薬品製造販売承認申請等の取扱いについて 平成 19 年 9 月 28 日厚生労働省告示第 316 号をもって第十五改正日本薬局方第一追補 ( 以下 第一追補 という ) が告示され 平成 19 年 9 月 28 日付け薬食発第
薬食審査発第 0928004 号 平成 19 年 9 月 28 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 第十五改正日本薬局方第一追補の制定に伴う 医薬品製造販売承認申請等の取扱いについて 平成 19 年 9 月 28 日厚生労働省告示第 316 号をもって第十五改正日本薬局方第一追補 ( 以下 第一追補 という ) が告示され 平成 19 年 9 月 28 日付け薬食発第
事務連絡 平成 28 年 3 月 29 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬 生活衛生局審査管理課 厚生労働省医薬 生活衛生局監視指導 麻薬対策課 医薬品等の製造業許可 外国製造業者認定等に関する質疑応答集 (Q&A) について 今般 標記 Q&A を別添のとおりとり
 事務連絡 平成 28 年 3 月 29 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬 生活衛生局審査管理課 厚生労働省医薬 生活衛生局監視指導 麻薬対策課 医薬品等の製造業許可 外国製造業者認定等に関する質疑応答集 (Q&A) について 今般 標記 Q&A を別添のとおりとりまとめましたので 御了知の上 貴管下関係業 者に対して周知願います なお 本通知の写しを別記関係団体宛て送付することとしています
事務連絡 平成 28 年 3 月 29 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬 生活衛生局審査管理課 厚生労働省医薬 生活衛生局監視指導 麻薬対策課 医薬品等の製造業許可 外国製造業者認定等に関する質疑応答集 (Q&A) について 今般 標記 Q&A を別添のとおりとりまとめましたので 御了知の上 貴管下関係業 者に対して周知願います なお 本通知の写しを別記関係団体宛て送付することとしています
<4D F736F F F696E74202D FA967B82CC96F28E9690A C982C282A282C42E >
 日本の薬事制度について 厚生労働省 医薬食品局審査管理課中西民二 本日の内容 医薬品の製造販売 外国製造業者の認定と GMP 適合性調査 外国製造業者の認定 承認審査における GMP 適合性調査 原薬等登録原簿 (MF) 医薬品の製造販売 医薬品の製造販売に関する規制 製造販売とは 製造等製造等 ( 他に委託して製造をする場合を含む ) をし 又は輸入をした医薬品 ( 原薬たる医薬品を除く ) を
日本の薬事制度について 厚生労働省 医薬食品局審査管理課中西民二 本日の内容 医薬品の製造販売 外国製造業者の認定と GMP 適合性調査 外国製造業者の認定 承認審査における GMP 適合性調査 原薬等登録原簿 (MF) 医薬品の製造販売 医薬品の製造販売に関する規制 製造販売とは 製造等製造等 ( 他に委託して製造をする場合を含む ) をし 又は輸入をした医薬品 ( 原薬たる医薬品を除く ) を
標準業務手順 目次
 浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
( 保 99) 平成 29 年 9 月 4 日 都道府県医師会 社会保険担当理事殿 日本医師会常任理事 松本純一 被保険者証の氏名表記について 被保険者証の氏名表記につきましては 性同一性障害を有する被保険者又は被扶養者から 被保険者証において通称名の記載を希望する旨の申出があったことから 保険者が
 ( 保 99) 平成 29 年 9 月 4 日 都道府県医師会 社会保険担当理事殿 日本医師会常任理事 松本純一 被保険者証の氏名表記について 被保険者証の氏名表記につきましては 性同一性障害を有する被保険者又は被扶養者から 被保険者証において通称名の記載を希望する旨の申出があったことから 保険者がやむを得ないと判断した場合には 被保険者証における氏名の表記方法を工夫しても差し支えない取扱いとなりましたので
( 保 99) 平成 29 年 9 月 4 日 都道府県医師会 社会保険担当理事殿 日本医師会常任理事 松本純一 被保険者証の氏名表記について 被保険者証の氏名表記につきましては 性同一性障害を有する被保険者又は被扶養者から 被保険者証において通称名の記載を希望する旨の申出があったことから 保険者がやむを得ないと判断した場合には 被保険者証における氏名の表記方法を工夫しても差し支えない取扱いとなりましたので
確定版【都道府県宛】
 薬生発 0329 第 10 号 平成 29 年 3 月 29 日 各都道府県知事 殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律関係手数料令 の一部改正について この度 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律関係手数料令の一部を改正する政令 ( 平成 29 年政令第 62 号 以下 改正政令 という ) が平成
薬生発 0329 第 10 号 平成 29 年 3 月 29 日 各都道府県知事 殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律関係手数料令 の一部改正について この度 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律関係手数料令の一部を改正する政令 ( 平成 29 年政令第 62 号 以下 改正政令 という ) が平成
2 有効成分名 添付文書及び審査報告書に基づき記載する 3 品目名 ( 後発医薬品 ) 添付文書及び審査報告書のほか薬価基準収載品目リストにより記載する 複数の品目がある場合は 個別医薬品コード (YJ コード ) 順に番号を振り 記載する ( 複数規格があっても 全規格まとめて YJ コード順とす
 第 18 回ジェネリック医薬品品質情報検討会 参考資料 2 医療用医薬品最新品質情報集 ( ブルーブック ) 作成要領 ( 案 ) 1 対象品目 別途定めるブルーブック作成対象品目に基づく なお 薬価削除経過措置期間中のものは記載対象外とする 2 記載項目 1 作成年月日 2 有効成分名 3 品目名 ( 後発医薬品 ) 4 品目名 ( 先発医薬品 ) 5 効能 効果 6 用法 用量 7 添加物 8
第 18 回ジェネリック医薬品品質情報検討会 参考資料 2 医療用医薬品最新品質情報集 ( ブルーブック ) 作成要領 ( 案 ) 1 対象品目 別途定めるブルーブック作成対象品目に基づく なお 薬価削除経過措置期間中のものは記載対象外とする 2 記載項目 1 作成年月日 2 有効成分名 3 品目名 ( 後発医薬品 ) 4 品目名 ( 先発医薬品 ) 5 効能 効果 6 用法 用量 7 添加物 8
別添 3 意見公募要領 1 意見公募対象 集 電波法施行規則等の一部を改正する省令案及び関係告示の制定 改正案に対する意見募 2 意見公募の趣旨 目的 背景令和元年 5 月 17 日に公布された電波法の一部を改正する法律において 適合表示無線設備ではない小電力無線設備の実験等利用に関する特例の整備等
 別添 3 意見公募要領 1 意見公募対象 集 電波法施行規則等の一部を改正する省令案及び関係告示の制定 改正案に対する意見募 2 意見公募の趣旨 目的 背景令和元年 5 月 17 日に公布された電波法の一部を改正する法律において 適合表示無線設備ではない小電力無線設備の実験等利用に関する特例の整備等については 公布の日から起算して一年を超えない範囲内において政令で定める日に施行することとされました
別添 3 意見公募要領 1 意見公募対象 集 電波法施行規則等の一部を改正する省令案及び関係告示の制定 改正案に対する意見募 2 意見公募の趣旨 目的 背景令和元年 5 月 17 日に公布された電波法の一部を改正する法律において 適合表示無線設備ではない小電力無線設備の実験等利用に関する特例の整備等については 公布の日から起算して一年を超えない範囲内において政令で定める日に施行することとされました
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
3 治験実施計画書目的 当該治験について 治験実施計画書が手順書に従い適切に作成及び改訂されていることを確認する 次の事項を調べる (1) 治験実施計画書の記載項目 ( 再生医療等製品 GCP 省令第 7 条第 1 項に規定する項目 ) (2) 治験実施計画書の作成 改訂の手順と日付 (3) 治験計
 別添 10 再生医療等製品 GCP 省令チェックリスト Ⅰ 治験依頼者 ( 受託機関を含む ) 用 1 組織及び体制目的 治験の依頼及び管理に当たって 再生医療等製品 GCP 省令に沿った業務を行うために適切にして十分な人材を有し かつ 組織及び体制が確立していることを確認する 1 治験依頼者の組織 ( 当該被験機器の開発組織を含む ) と再生医療等製品 G CP 省令に係わる組織との関係 2 治験の依頼及び管理の業務に従事する者の氏名
別添 10 再生医療等製品 GCP 省令チェックリスト Ⅰ 治験依頼者 ( 受託機関を含む ) 用 1 組織及び体制目的 治験の依頼及び管理に当たって 再生医療等製品 GCP 省令に沿った業務を行うために適切にして十分な人材を有し かつ 組織及び体制が確立していることを確認する 1 治験依頼者の組織 ( 当該被験機器の開発組織を含む ) と再生医療等製品 G CP 省令に係わる組織との関係 2 治験の依頼及び管理の業務に従事する者の氏名
本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員
 ( 第 1 版 :2015 年 7 月 1 日 ) 本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員会の間での電子的記録の作成, 交付, 受領及び保存に用いるシステム規定や文書等で責任者の行うべき業務の権限を与えられ,
( 第 1 版 :2015 年 7 月 1 日 ) 本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員会の間での電子的記録の作成, 交付, 受領及び保存に用いるシステム規定や文書等で責任者の行うべき業務の権限を与えられ,
<4D F736F F D2090BB91A294CC94848CE392B28DB8905C90BF8E9E92F18F6F8F9197DE82A882E682D1928D88D38E968D E48DEC90AC816A
 申請時提出書類 ( 新規 ) 医薬品等の製造販売後調査実施依頼申請書 様式第 1 ( 以下 依頼書 ) 医薬品等の製造販売後調査実施申請書 様式第 2 ( 以下 申請書 ) 医薬品等の製造販売後調査実施に関する通知書 ( 病院用 依頼者用 ) 様式第 3 様式第 4 ( 以下 通知書 ) 医薬品等の製造販売後調査実施契約書 ( 病院用 依頼者用 ) 様式第 5 様式第 5の2 ( 以下 契約書 )
申請時提出書類 ( 新規 ) 医薬品等の製造販売後調査実施依頼申請書 様式第 1 ( 以下 依頼書 ) 医薬品等の製造販売後調査実施申請書 様式第 2 ( 以下 申請書 ) 医薬品等の製造販売後調査実施に関する通知書 ( 病院用 依頼者用 ) 様式第 3 様式第 4 ( 以下 通知書 ) 医薬品等の製造販売後調査実施契約書 ( 病院用 依頼者用 ) 様式第 5 様式第 5の2 ( 以下 契約書 )
M. 旅行計画書 A. 1 申請の際には当院の標準業務手順書 契約書 ( 案 ) 覚書 ( 案 ) マニュアル等を熟読の上 目標症例数を責任医師と依頼者で十分協議 し 実施可能な症例数を申し込んでくだ 1 申請の際には当院の標準業務手順書 契約書 ( 案 ) マニュアル等を熟 読の上
 広島大学病院製造販売後医薬品調査マニュアル変更対比表 変更前 変更後 頁 項目等 Ver.6.20 2015 年 1 月 30 日 Ver.6.30 2017 年 2 月 27 日 (2015 年 2 月 1 日より適用 ) (2017 年 3 月 1 日より適用 ) 表紙 (ver.6.20) (ver.6.30) ver.6.30 2017 年 2 月 27 日 (2017 年 3 月 1 日より適用
広島大学病院製造販売後医薬品調査マニュアル変更対比表 変更前 変更後 頁 項目等 Ver.6.20 2015 年 1 月 30 日 Ver.6.30 2017 年 2 月 27 日 (2015 年 2 月 1 日より適用 ) (2017 年 3 月 1 日より適用 ) 表紙 (ver.6.20) (ver.6.30) ver.6.30 2017 年 2 月 27 日 (2017 年 3 月 1 日より適用
がなされていない者であること (5) 提案書を提出する日の前日現在で 今回の募集に付する事項に関し 原則として 1 年以上の営業実績を有していること (6) 参加申込み期限において 本市の 平成 年度物品登録業者名簿 に登録済みであって 本市から参加指名停止の措置を受けていないこと 4
 防府市シンクライアント環境サービス提供事業に係る企画提案募集要領 1 目的この企画提案募集は 防府市シンクライアント環境サービス提供事業を実施するに当たり 最も適切な者を当該事業の履行の候補者として選定することを目的として実施するものである 2 事業概要 (1) 事業名防府市シンクライアント環境サービス提供事業 (2) 事業内容別添 防府市シンクライアント環境サービス提供事業要求仕様書 のとおり (3)
防府市シンクライアント環境サービス提供事業に係る企画提案募集要領 1 目的この企画提案募集は 防府市シンクライアント環境サービス提供事業を実施するに当たり 最も適切な者を当該事業の履行の候補者として選定することを目的として実施するものである 2 事業概要 (1) 事業名防府市シンクライアント環境サービス提供事業 (2) 事業内容別添 防府市シンクライアント環境サービス提供事業要求仕様書 のとおり (3)
( 別添 2) ( 別添 2) 平成 14 年 9 月 27 日保発第 号の別添 2 組合管掌健康保険一括適用取扱要領 組合管掌健康保険一括適用取扱要領 ( 準則 ) 第 1 健康保険法 ( 以下 法 という ) 第 34 条第 1 項の規定による厚生労働大臣の承認 ( 以下 一括適
 ( 別添 1) 新 ( 別添 1) 健康保険 厚生年金保険一括適用承認基準 健康保険一括適用承認基準 健康保険法第 34 条第 1 項又は厚生年金保険法第 8 条の 2 の規定による厚生労働大 臣の承認 ( 以下 一括適用の承認 という ) は 次の各項に定める基準に適合する適 用事業所について行うものとする 健康保険法第 34 条の規定による厚生労働大臣の承認 ( 以下 一括適用の承認 と いう
( 別添 1) 新 ( 別添 1) 健康保険 厚生年金保険一括適用承認基準 健康保険一括適用承認基準 健康保険法第 34 条第 1 項又は厚生年金保険法第 8 条の 2 の規定による厚生労働大 臣の承認 ( 以下 一括適用の承認 という ) は 次の各項に定める基準に適合する適 用事業所について行うものとする 健康保険法第 34 条の規定による厚生労働大臣の承認 ( 以下 一括適用の承認 と いう
Microsoft PowerPoint - 運用 [互換モード]
![Microsoft PowerPoint - 運用 [互換モード] Microsoft PowerPoint - 運用 [互換モード]](/thumbs/91/105850431.jpg) 押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
1. サービスの概要 1.1. 目的独立行政法人医薬品医療機器総合機構 ( 以下 機構 といいます ) の審査等業務において 電子証明書による署名を付し 暗号化した電子メール ( 以下 セキュアメール といいます ) の適切な利用を通じて 機構と申請企業等との間における情報伝達の安全性及び効率性を確
 ( 別紙 3) PMDA セキュアメール ID Class1 plus 電子証明書発行サービスの 利用について 1. サービスの概要 2. 認証局及び電子証明書 3. 利用環境 4. 利用手順 電子証明書申請及び取得手続き 電子証明書の利用 電子証明書の失効手続き 本サービスの利用の終了等 5. その他 平成 27 年 9 月 29 日 独立行政法人医薬品医療機器総合機構 1. サービスの概要 1.1.
( 別紙 3) PMDA セキュアメール ID Class1 plus 電子証明書発行サービスの 利用について 1. サービスの概要 2. 認証局及び電子証明書 3. 利用環境 4. 利用手順 電子証明書申請及び取得手続き 電子証明書の利用 電子証明書の失効手続き 本サービスの利用の終了等 5. その他 平成 27 年 9 月 29 日 独立行政法人医薬品医療機器総合機構 1. サービスの概要 1.1.
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
Microsoft Word - 【発出版2】製造所取扱いに関するQ&A -
 薬食機参発 1020 第 4 号 平成 26 年 10 月 20 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いに関する質疑応答集 (Q&A) について 医療機器及び体外診断用医薬品の製造業の登録の範囲等については 医療機器及び体外診断用医薬品の製造業の取扱いについて
薬食機参発 1020 第 4 号 平成 26 年 10 月 20 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いに関する質疑応答集 (Q&A) について 医療機器及び体外診断用医薬品の製造業の登録の範囲等については 医療機器及び体外診断用医薬品の製造業の取扱いについて
(Microsoft Word -
 事務連絡 平成 30 年 2 月 28 日 医薬品 医療機器等製造販売業者殿 奈良県医療政策部薬務課薬物監視係長 医薬品 医療機器等の回収の取扱いについて 医薬品 医薬部外品 化粧品及び医療機器等の回収については 医薬品 医療機器等の回収について ( 平成 26 年 12 月 21 日付け薬食発 1121 第 10 号厚生労働省医薬食品局長通知 ) 及び 医薬品 医療機器等の回収の取扱いについて (
事務連絡 平成 30 年 2 月 28 日 医薬品 医療機器等製造販売業者殿 奈良県医療政策部薬務課薬物監視係長 医薬品 医療機器等の回収の取扱いについて 医薬品 医薬部外品 化粧品及び医療機器等の回収については 医薬品 医療機器等の回収について ( 平成 26 年 12 月 21 日付け薬食発 1121 第 10 号厚生労働省医薬食品局長通知 ) 及び 医薬品 医療機器等の回収の取扱いについて (
3. 実施時期平成 29 年 4 月 3 日より本件改修後のQMS 調査申請書の作成及び機構受付が可能となります 4. その他 本改修により承認申請書とQMS 調査申請書の同時申請が可能となるのは 両申請書をDW APで作成した場合に限ります (FD 申請ソフトによる申請の場合は同時申請できません
 事務連絡平成 29 年 3 月 17 日 一般社団法人日本医療機器産業連合会御中 独立行政法人医薬品医療機器総合機構審査業務部 承認申請書及び QMS 調査申請書の同時申請にかかる DWAP の改修について 今般 医療機器 WEB 申請プラットフォーム ( 以下 DWAP という ) を活用した医療機器製造販売承認申請書又は外国製造医療機器製造販売承認申請書 ( 一部変更承認申請書を含む 以下 承認申請書
事務連絡平成 29 年 3 月 17 日 一般社団法人日本医療機器産業連合会御中 独立行政法人医薬品医療機器総合機構審査業務部 承認申請書及び QMS 調査申請書の同時申請にかかる DWAP の改修について 今般 医療機器 WEB 申請プラットフォーム ( 以下 DWAP という ) を活用した医療機器製造販売承認申請書又は外国製造医療機器製造販売承認申請書 ( 一部変更承認申請書を含む 以下 承認申請書
特定保健指導における情報通信技術を活用した面接による指導の実施の手引き 新旧対照表 改正後 特定保健指導における情報通信技術を活用した面接による指導の実施の手引き 現行 ICT を活用した特定保健指導の実施の手引き 最終改正平成 30 年 2 月 9 日 1.ICTを活用した特定保健指導の実施者保険
 特定保健指導における情報通信技術を活用した面接による指導の実施の手引き 新旧対照表 改正後 特定保健指導における情報通信技術を活用した面接による指導の実施の手引き 現行 ICT を活用した特定保健指導の実施の手引き 最終改正平成 30 年 2 月 9 日 1.ICTを活用した特定保健指導の実施者保険者が実施する特定保健指導の初回面接は 原則として直接会って行うものとする ただし 平成 25 年 8
特定保健指導における情報通信技術を活用した面接による指導の実施の手引き 新旧対照表 改正後 特定保健指導における情報通信技術を活用した面接による指導の実施の手引き 現行 ICT を活用した特定保健指導の実施の手引き 最終改正平成 30 年 2 月 9 日 1.ICTを活用した特定保健指導の実施者保険者が実施する特定保健指導の初回面接は 原則として直接会って行うものとする ただし 平成 25 年 8
<4D F736F F D2088E396F BB91A28BC EF C8EA695DB8AC78BE695AA816A C826F8AEE8F808F918EE88F878F B2E646F63>
 16 12 24 179 26 1 5 26 1 5 注意 品質部門は製造部門から独立していなければならない 各部門の業務を適切かつ円滑に実施しうる能力のある責任者を 組織 規模 業務の種類に応じ 適切な人数を配置すること ( 必要に応じ 上記に挙げた責任者の枠を増やしてもよい ) 各責任者は業務に支障がない限り兼務することができる ただし 製造部門責任者と品質部門責任者は兼務することはできない 出荷可否決定者は品質部門の者とすること
16 12 24 179 26 1 5 26 1 5 注意 品質部門は製造部門から独立していなければならない 各部門の業務を適切かつ円滑に実施しうる能力のある責任者を 組織 規模 業務の種類に応じ 適切な人数を配置すること ( 必要に応じ 上記に挙げた責任者の枠を増やしてもよい ) 各責任者は業務に支障がない限り兼務することができる ただし 製造部門責任者と品質部門責任者は兼務することはできない 出荷可否決定者は品質部門の者とすること
意見公募要領 1 意見公募対象 放送法施行規則の一部を改正する省令案 日本放送協会のインターネット活用業務の実施基準の認可に関するガイドライン案 日本放送協会の子会社等の事業運営の在り方に関するガイドライン案 2 意見公募の趣旨 目的 背景令和元年 6 月 5 日に公布された 放送法の一部を改正する
 意見公募要領 1 意見公募対象 放送法施行規則の一部を改正する省令案 日本放送協会のインターネット活用業務の実施基準の認可に関するガイドライン案 日本放送協会の子会社等の事業運営の在り方に関するガイドライン案 2 意見公募の趣旨 目的 背景令和元年 6 月 5 日に公布された 放送法の一部を改正する法律 ( 令和元年法律第 23 号 ) は 一部を除き 公布の日から9 月を超えない範囲で施行することとされているところです
意見公募要領 1 意見公募対象 放送法施行規則の一部を改正する省令案 日本放送協会のインターネット活用業務の実施基準の認可に関するガイドライン案 日本放送協会の子会社等の事業運営の在り方に関するガイドライン案 2 意見公募の趣旨 目的 背景令和元年 6 月 5 日に公布された 放送法の一部を改正する法律 ( 令和元年法律第 23 号 ) は 一部を除き 公布の日から9 月を超えない範囲で施行することとされているところです
法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品 医療機器等の品質
 医療機器クラス分類表 ( 平成 30 年 10 月 19 日現在 ) 香川県健康福祉部薬務感染症対策課薬事指導グループ 法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品
医療機器クラス分類表 ( 平成 30 年 10 月 19 日現在 ) 香川県健康福祉部薬務感染症対策課薬事指導グループ 法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品
平成14年8月 日
 平成 30 年 11 月 15 日福祉保健局 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 に基づく行政処分 ( 回収命令 ) について 都は本日 以下の事業者に対し 医薬品 医療機器等の品質 有効性及び安全性の確保 等に関する法律 ( 昭和 35 年法律第 145 号 以下 法 という ) 第 70 条第 1 項の 規定に基づく 回収命令 を行ったので お知らせします 1 対象事業者氏名ピュアハートキングス株式会社
平成 30 年 11 月 15 日福祉保健局 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 に基づく行政処分 ( 回収命令 ) について 都は本日 以下の事業者に対し 医薬品 医療機器等の品質 有効性及び安全性の確保 等に関する法律 ( 昭和 35 年法律第 145 号 以下 法 という ) 第 70 条第 1 項の 規定に基づく 回収命令 を行ったので お知らせします 1 対象事業者氏名ピュアハートキングス株式会社
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
< F2D8E9197BF A836F815B2E6A7464>
 ( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
IRB の 4 週間前までに事前確認に必要な資料をご提出ください 必要時にはヒアリングも実施いたします IRB 審議用確認資料 電子 ( メール ) にてご提出ください 製造販売後調査申請書 ( 様式 1) 1 部 審査用資料 1 薬品概要書 ( 添付文書でも可 ) 1 部 2 調査実施計画書 (
 国立大学法人信州大学医学部附属病院製造販売後調査実施に係わる手続き要領 2018 年 4 月 はじめにご確認ください 本要領の対象となる調査は 再審査 再評価のために GPSP で規定された日常診療下で実施される調査です 製薬会社が独自で行う調査 (= 観察研究 ) は対象外です 独自に実施する調査は 臨床研究として信州大学医学部医倫理委員会で審議となります 各種手続きについて担当医師又は信州大学医学部庶務係
国立大学法人信州大学医学部附属病院製造販売後調査実施に係わる手続き要領 2018 年 4 月 はじめにご確認ください 本要領の対象となる調査は 再審査 再評価のために GPSP で規定された日常診療下で実施される調査です 製薬会社が独自で行う調査 (= 観察研究 ) は対象外です 独自に実施する調査は 臨床研究として信州大学医学部医倫理委員会で審議となります 各種手続きについて担当医師又は信州大学医学部庶務係
臨床試験(治験)の手続きについて
 臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
薬食審査発第 号平成 19 年 9 月 28 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 国際共同治験に関する基本的考え方について 従来 我が国においては ICH-E5 ガイドラインに基づく 外国臨床データを受け入れる際に考慮すべき民族的要因について
 薬食審査発第 0928010 号平成 19 年 9 月 28 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 国際共同治験に関する基本的考え方について 従来 我が国においては ICH-E5 ガイドラインに基づく 外国臨床データを受け入れる際に考慮すべき民族的要因について ( 平成 10 年 8 月 11 日医薬審第 7 62 号厚生省医薬安全局審査管理課長通知 ) により
薬食審査発第 0928010 号平成 19 年 9 月 28 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬食品局審査管理課長 国際共同治験に関する基本的考え方について 従来 我が国においては ICH-E5 ガイドラインに基づく 外国臨床データを受け入れる際に考慮すべき民族的要因について ( 平成 10 年 8 月 11 日医薬審第 7 62 号厚生省医薬安全局審査管理課長通知 ) により
薬機発第 号平成 29 年 3 月 23 日 各都道府県薬務主管 ( 部 ) 長殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 独立行政法人医薬品医療機器総合機構が行う審査等の手数料について の一部改正について 平素より 独立行政法人医薬品医療機器総合機構の審査等業務に対し ご
 薬機発第 0323005 号平成 29 年 3 月 23 日 各都道府県薬務主管 ( 部 ) 長殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 独立行政法人医薬品医療機器総合機構が行う審査等の手数料について の一部改正について 平素より 独立行政法人医薬品医療機器総合機構の審査等業務に対し ご理解 ご協力いただきありがとうございます 当機構が行う審査等業務の手数料の取扱いについては 独立行政法人医薬品医療機器総合機構が行う審査等の手数料について
薬機発第 0323005 号平成 29 年 3 月 23 日 各都道府県薬務主管 ( 部 ) 長殿 独立行政法人医薬品医療機器総合機構理事長近藤達也 独立行政法人医薬品医療機器総合機構が行う審査等の手数料について の一部改正について 平素より 独立行政法人医薬品医療機器総合機構の審査等業務に対し ご理解 ご協力いただきありがとうございます 当機構が行う審査等業務の手数料の取扱いについては 独立行政法人医薬品医療機器総合機構が行う審査等の手数料について
審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ
![審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ 審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ](/thumbs/92/110667825.jpg) 審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
年管管発第 1026 第 2 号平成 24 年 10 月 26 日 地方厚生 ( 支 ) 局年金調整 ( 年金管理 ) 課長殿 厚生労働省年金局事業管理課長 ( 公印省略 ) 生活に困窮する外国人に対する生活保護の措置について ( 通知 ) に基づく保護を受けている外国人の国民年金保険料免除の申請の
 事務連絡 平成 24 年 10 月 26 日 全国社会保険労務士会連合会会長殿 厚生労働省年金局事業管理課長 生活に困窮する外国人に対する生活保護の措置について ( 通知 ) に基づく保護を 受けている外国人の国民年金保険料免除の申請の取扱いについて 標記について 別添のとおり 地方厚生 ( 支 ) 局年金調整 ( 年金管理 ) 課長宛て通 知したので 連絡いたします 年管管発第 1026 第 2
事務連絡 平成 24 年 10 月 26 日 全国社会保険労務士会連合会会長殿 厚生労働省年金局事業管理課長 生活に困窮する外国人に対する生活保護の措置について ( 通知 ) に基づく保護を 受けている外国人の国民年金保険料免除の申請の取扱いについて 標記について 別添のとおり 地方厚生 ( 支 ) 局年金調整 ( 年金管理 ) 課長宛て通 知したので 連絡いたします 年管管発第 1026 第 2
0831_02_落合_発表.pptx
 申請電子データシステムを利用した臨床薬理領域の電子データ提出について 独立行政法人医薬品医療機器総合機構次世代審査等推進室落合義徳 1 はじめに 本講演は臨床薬理領域に関わる申請電子データの提出時の留意点と申請電子データシステムについて説明をします 詳細は各種通知および申請電子データシステム操作マニュアル等を参照してください 2016/08/31 2 内容 1. 臨床薬理領域の電子データ提出について
申請電子データシステムを利用した臨床薬理領域の電子データ提出について 独立行政法人医薬品医療機器総合機構次世代審査等推進室落合義徳 1 はじめに 本講演は臨床薬理領域に関わる申請電子データの提出時の留意点と申請電子データシステムについて説明をします 詳細は各種通知および申請電子データシステム操作マニュアル等を参照してください 2016/08/31 2 内容 1. 臨床薬理領域の電子データ提出について
