タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg 有効成分 ボノプラザンフマル酸塩 製造販売業者 武田薬品工業株式会社 薬効分類 提出年月 2018 年 4 月 1.1. 安全性検討事項 重要
|
|
|
- ゆいと こうじょう
- 5 years ago
- Views:
Transcription
1 タケキャブ錠 10 mg タケキャブ錠 20 mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は 武田薬品工業株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません 武田薬品工業株式会社
2 タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg 有効成分 ボノプラザンフマル酸塩 製造販売業者 武田薬品工業株式会社 薬効分類 提出年月 2018 年 4 月 1.1. 安全性検討事項 重要な特定されたリスク 頁 重要な潜在的リスク 頁 重要な不足情報 頁 なし 4 肝機能障害 4 なし 6 骨折 4 クロストリジウム ディフィシルによる胃腸感染 5 血清ガストリン値の上昇による神経内分泌腫瘍 5 肺炎 有効性に関する検討事項使用実態下における有効性 7 長期投与における有効性 7 上記に基づく安全性監視のための活動 2. 医薬品安全性監視計画の概要頁通常の医薬品安全性監視活動 8 追加の医薬品安全性監視活動使用成績調査 ( 胃潰瘍 十二指腸潰瘍及び 8 逆流性食道炎 ) 特定使用成績調査 ( 逆流性食道炎の維持療 9 法 : 長期使用 ) 特定使用成績調査 ( 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再 10 発抑制 : 長期使用 ) 特定使用成績調査 ( 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰 10 瘍の再発抑制 : 長期使用 ) 3. 有効性に関する調査 試験の計頁画の概要使用成績調査 ( 胃潰瘍 十二指腸潰瘍及び 12 逆流性食道炎 ) 特定使用成績調査 ( 逆流性食道炎の維持療 12 法 : 長期使用 ) 特定使用成績調査 ( 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再 12 発抑制 : 長期使用 ) 特定使用成績調査 ( 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰 12 瘍の再発抑制 : 長期使用 ) 各項目の内容は RMP の本文でご確認下さい 上記に基づくリスク最小化のための活動 4. リスク最小化計画の概要頁通常のリスク最小化活動 12 追加のリスク最小化活動なし 12
3 医薬品リスク管理計画書 ( 別紙様式 ) 2018 年 4 月 25 日 独立行政法人医薬品医療機器総合機構理事長殿 住所 : 大阪市中央区道修町四丁目 1 番 1 号氏名 : 武田薬品工業株式会社代表取締役社長クリストフウェバー 標記について次のとおり提出します 品目の概要 承認年月日 2014 年 12 月 26 日薬効分類 再審査期間 8 年承認番号 AMX AMX 国際誕生日 2014 年 12 月 26 日 販売名 1 タケキャブ錠 10 mg 2 タケキャブ錠 20 mg 有効成分ボノプラザンフマル酸塩 含量及び剤型 用法及び用量 11 錠中にボノプラザンとして 10 mg を含有するフィルムコーティング錠 21 錠中にボノプラザンとして 20 mg を含有する両面割線入りのフィルムコーティング錠 胃潰瘍 十二指腸潰瘍の場合通常 成人にはボノプラザンとして 1 回 20 mg を 1 日 1 回経口投与する なお 通常 胃潰瘍では 8 週間まで 十二指腸潰瘍では 6 週間までの投与とする 逆流性食道炎の場合通常 成人にはボノプラザンとして 1 回 20 mg を 1 日 1 回経口投与する なお 通常 4 週間までの投与とし 効果不十分の場合は 8 週間まで投与することができる さらに 再発 再燃を繰り返す逆流性食道炎の維持療法においては 1 回 10 mg を 1 日 1 回経口投与するが 効果不十分の場合は 1 回 20 mg を 1 日 1 回経口投与することができる 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制の場合通常 成人にはボノプラザンとして 1 回 10 mg を 1 日 1 回経口投与する 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制の場合通常 成人にはボノプラザンとして 1 回 10 mg を 1 日 1 回経口投与する 1
4 ヘリコバクター ピロリの除菌の補助の場合 通常 成人にはボノプラザンとして 1 回 20 mg アモキシシリン水和物として 1 回 750 mg( 力価 ) 及びクラリスロマイシンとして 1 回 200 mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する なお クラリスロマイシンは 必要に応じて適宜増量することができる ただし 1 回 400 mg ( 力価 )1 日 2 回を上限とする プロトンポンプインヒビター アモキシシリン水和物及びクラリスロマイシンの 3 剤投与によるヘリコバクター ピロリの除菌治療が不成功の場合は これに代わる治療として 通常 成人にはボノプラザンとして 1 回 20 mg アモキシシリン水和物として 1 回 750 mg( 力価 ) 及びメトロニダゾールとして 1 回 250 mg の 3 剤を同時に 1 日 2 回 7 日間経口投与する 効能又は効果 胃潰瘍 十二指腸潰瘍 逆流性食道炎 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 下記におけるヘリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 承認条件医薬品リスク管理計画を策定の上 適切に実施すること 備 考 2
5 前回提出日 2018 年 2 月 23 日 変更の履歴 変更内容の概要 : 1.1. 医薬品リスク管理計画の概要 2. 医薬品安全性監視計画の概要及び 3. 有効性に関する調査 試験の計画の概要の使用成績調査 ( ヘリコバクター ピロリの除菌の補助 ) を削除 医薬品安全性監視計画の一覧の 追加の医薬品安全性監視活動 及び 5.2 有効性に関する調査 試験の計画の一覧の使用成績調査 ( ヘリコバクター ピロリの除菌の補助 ) について 実施状況及び報告書の作成予定日を更新 変更理由 : 1. 使用成績調査 ( ヘリコバクター ピロリの除菌の補助 ) が終了したため 2. 使用成績調査 ( ヘリコバクター ピロリの除菌の補助 ) が終了し 報告書を提出したため 3
6 1. 医薬品リスク管理計画の概要 1.1 安全性検討事項 該当なし 重要な特定されたリスク 重要な潜在的リスク 肝機能障害 骨折 重要な潜在的リスクとした理由 : 本剤の国内臨床試験において 肝機能障害の発現頻度は対照薬と同程度であり 特段の懸念は認められていない しかしながら 他のカリウムイオン競合型アシッドブロッカー (P-CAB) において薬剤性肝機能障害との関連性が報告されており (Pharmacol Ther 2005: 294, Clin Gastroenterol Hepatol 2007: 1385) また 本剤のイヌ及びラットを用いた非臨床での反復経口投与毒性試験において トランスアミナーゼの高値が認められている 医薬品安全性監視活動の内容及びその選択理由 : 内容 通常の医薬品安全性監視活動 追加の医薬品安全性監視活動: 使用成績調査 特定使用成績調査 ( 2. 医薬品安全性監視計画の概要 の項参照 ) 選択理由 承認後に使用が想定される各患者集団では本剤の投与期間や併用薬が異なることから 各患者集団における肝機能障害の発現状況 ( 発現頻度 発現時期 重症度及び危険因子等 ) を詳細に把握するため リスク最小化活動の内容及びその選択理由 : 内容 通常のリスク最小化活動として 使用上の注意 の その他の副作用 の項に記載して注意喚起する 選択理由 臨床試験では特段の懸念は認められていないが 非臨床試験においてトランスアミナーゼの高値が認められていることから 使用上の注意 に記載し 医療従事者への情報提供を行うため 重要な潜在的リスクとした理由 : 他の酸分泌抑制剤 プロトンポンプインヒビター (PPI) において 骨折リスク上昇が報告されており (Am J Gastroenterol 2011: 1209) 添付文書において注意喚起されている PPI と骨折リスク上昇との関連については評価が確定しておらず その作用機序は明らかではないが 酸分泌抑制による胃内 ph 上昇がカルシウムの吸収に影響することが一因との指摘もあり 本剤についても PPI と同様に骨折リスクを示す可能性が考えられる 4
7 医薬品安全性監視活動の内容及びその選択理由 : 内容 通常の医薬品安全性監視活動 追加の医薬品安全性監視活動 : 特定使用成績調査 ( 2. 医薬品安全性監視計画の概要 の項参照 ) 選択理由 骨折の発現状況 ( 発現頻度 発現部位 発現時期等 ) を詳細に把握するため リスク最小化活動の内容及びその選択理由 : 内容 通常のリスク最小化活動として 使用上の注意 の その他の注意 の項に記載して注意喚起する 選択理由 骨折リスク上昇の可能性が考えられることから 使用上の注意 に記載し 医療従事者への情報提供を行うため クロストリジウム ディフィシルによる胃腸感染 重要な潜在的リスクとした理由 : 他の酸分泌抑制剤 (PPI) において クロストリジウム ディフィシル (CD) による胃腸感染リスク上昇が報告されており (Clin Gastroenterol Hepatol 2012: 225) 添付文書において注意喚起されている PPI と CD による胃腸感染リスクとの関連については評価が確定しておらず その作用機序は明らかではないが 酸分泌抑制による胃内 ph 上昇が一因との指摘もあり 本剤についても PPI と同様に CD による胃腸感染リスクを示す可能性が考えられる 医薬品安全性監視活動の内容及びその選択理由 : 内容 通常の医薬品安全性監視活動 追加の医薬品安全性監視活動: 使用成績調査 特定使用成績調査 ( 2. 医薬品安全性監視計画の概要 の項参照 ) 選択理由 CD による胃腸感染の発現状況 ( 発現頻度 併用薬の投与状況及び入院等の発現時の患者背景等 ) を詳細に把握するため リスク最小化活動の内容及びその選択理由 : 内容 通常のリスク最小化活動として 使用上の注意 の その他の注意 の項に記載して注意喚起する 選択理由 CD による胃腸感染リスク上昇の可能性が考えられることから 使用上の注意 に記載し 医療従事者への情報提供を行うため 血清ガストリン値の上昇による神経内分泌腫瘍 重要な潜在的リスクとした理由 : 本剤のマウス及びラットを用いた非臨床のがん原性試験において 胃の神経内分泌腫瘍が認められている その発生機序として酸分泌抑制による持続的かつ顕著な高ガストリン血症に基づくものと考えられている 他の酸分泌抑制剤 (PPI) のがん原性試験におい 5
8 て同様の変化が認められている しかしながら 臨床試験において本剤では既存の PPI であるランソプラゾールよりも血清ガストリン値が高い傾向を示していることから 血清ガストリン値の上昇の長期的な影響について情報を収集する 医薬品安全性監視活動の内容及びその選択理由 : 内容 通常の医薬品安全性監視活動 追加の医薬品安全性監視活動: 特定使用成績調査 ( 2. 医薬品安全性監視計画の概要 の項参照 ) 選択理由 神経内分泌腫瘍の発現状況を詳細に把握するため リスク最小化活動の内容及びその選択理由 : 内容 通常のリスク最小化活動として 使用上の注意 の その他の注意 にがん原性試験成績を 臨床成績 の項に血清ガストリン値に及ぼす影響を記載し 注意喚起する 選択理由 使用上の注意 及び 臨床成績 の項に記載し 医療従事者への情報提供を行うため 肺炎 重要な潜在的リスクとした理由 : 他の酸分泌抑制剤 (PPI) において 肺炎リスク上昇が報告されている しかし リスクを上昇させないとの報告もあり (Pharmacoepidemiol Drug Saf 2010: 792) PPI と肺炎リスク上昇との関連については評価が確定していない また PPI が肺炎リスクを上昇させる機序は明らかではない 医薬品安全性監視活動の内容及びその選択理由 : 内容 通常の医薬品安全性監視活動 選択理由 肺炎の発現状況を把握するため リスク最小化活動の内容及びその選択理由 : 内容 なし 選択理由 現状 特記すべき注意喚起内容はなく 新たな情報が得られた場合に検討する 該当なし 重要な不足情報 6
9 1.2 有効性に関する検討事項 使用実態下における有効性 有効性に関する検討事項とした理由 : 日常診療の使用実態下における本剤の有効性を検討する 有効性に関する調査 試験の名称 : 使用成績調査 ( 胃潰瘍 十二指腸潰瘍及び逆流性食道炎 ) 調査 試験の目的 内容及び手法の概要並びに選択理由 : 使用成績調査 ( 胃潰瘍 十二指腸潰瘍及び逆流性食道炎 ) 使用実態下における有効性の検討を目的とし 内視鏡検査所見及び自覚症状の程度を有効性評価項目に設定し 内視鏡による治癒率及び自覚症状改善率の集計を行う 詳細は 2. 医薬品安全性監視計画の概要 の項参照 長期投与における有効性 有効性に関する検討事項とした理由 : 日常診療の使用実態下における本剤の長期投与時の有効性を検討する 有効性に関する調査 試験の名称 : 特定使用成績調査 ( 逆流性食道炎の維持療法 : 長期使用 ) 特定使用成績調査 ( 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 特定使用成績調査 ( 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 調査 試験の目的 内容及び手法の概要並びに選択理由 : 特定使用成績調査 ( 逆流性食道炎の維持療法 : 長期使用 ) 使用実態下における長期投与時の有効性の検討を目的とし 内視鏡検査所見及び自覚症状の程度を有効性評価項目に設定し 内視鏡による再発率及び自覚症状の程度の推移の集計を行う 詳細は 2. 医薬品安全性監視計画の概要 の項参照 特定使用成績調査 ( 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 使用実態下における長期投与時の有効性の検討を目的とし 本剤投与後の胃潰瘍又は十二指腸潰瘍 胃又は十二指腸の出血性病変を有効性評価項目に設定し 本剤投与後の胃潰瘍又は十二指腸潰瘍 胃又は十二指腸の出血性病変の発症の有無の集計を行う 詳細は 2. 医薬品安全性監視計画の概要 の項参照 特定使用成績調査 ( 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 使用実態下における長期投与時の有効性の検討を目的とし 本剤投与後の胃潰瘍又は十二指腸潰瘍 胃又は十二指腸の出血性病変を有効性評価項目に設定し 本剤投与後の胃潰瘍又は十二指腸潰瘍 胃又は十二指腸の出血性病変の発症の有無の集計を行う 詳細は 2. 医薬品安全性監視計画の概要 の項参照 7
10 2. 医薬品安全性監視計画の概要 通常の医薬品安全性監視活動の概要 : 通常の医薬品安全性監視活動 自発報告 文献 学会情報及び外国措置情報等の収集 評価 分析を実施し それらの結果に基づく安全対策を検討し 実行する 本剤は新規作用機序の薬剤であることから 予測できない副作用の発現には特に留意し 頻回の副作用集積評価を実施し 安全対策について検討する 追加の医薬品安全性監視活動 使用成績調査 ( 胃潰瘍 十二指腸潰瘍及び逆流性食道炎 ) 安全性検討事項 肝機能障害 CD による胃腸感染 目的 日常診療の使用実態下での胃潰瘍 十二指腸潰瘍及び逆流性食道炎患者に対する本剤の安全性及び有効性を検討する 実施計画 調査期間 :2016 年 3 月 ~2018 年 10 月 31 日患者登録期間 :2016 年 3 月 ~2018 年 8 月 31 日予定症例数 :3,000 例 ( 胃潰瘍 十二指腸潰瘍はそれぞれ 500 例以上 逆流性食道炎は 1,000 例以上とする ) 実施方法 : 中央登録方式にて実施する 観察期間は 胃潰瘍 逆流性食道炎は 8 週間 十二指腸潰瘍は 6 週間 実施計画の設定根拠 日常診療の使用実態下における本剤の安全性及び有効性を検討するために本調査を計画した 本調査の中で肝機能障害 CD による胃腸感染の発現時には 詳細情報を可能な限り収集する 胃潰瘍 十二指腸潰瘍及び逆流性食道炎は いずれも胃酸によって消化管の粘膜傷害が引き起こされるという共通した病態を有している 各疾患患者を対象とした本剤の国内臨床試験における投与期間は 胃潰瘍及び逆流性食道炎が 8 週間まで 十二指腸潰瘍が 6 週間までとほぼ同程度であり また 副作用の発現頻度 程度及び発現頻度が高い副作用等の安全性プロファイルは類似している 以上のことから 胃潰瘍 十二指腸潰瘍及び逆流性食道炎をまとめて これら三つの酸関連疾患を対象とした予定症例数 3,000 例の使用成績調査を実施する 各疾患患者における本剤の安全性評価が可能な患者数として 胃潰瘍及び十二指腸潰瘍患者については 500 例以上を収集することとした 逆流性食道炎患者については 我が国における患者数が年々急速に増加し 本剤の適用となる患者が最も多い疾患と考えられることから 1,000 例以上を収集することとした これにより 日常診療の使用実態下における各疾患別の副作用発現頻度 程度及び主な副作用の相違について検討が可能と考える ( 例数は 統計学的に算出したものではない ) 節目となる予定の時期及びその根拠 調査終了後の最終集計時 : 登録症例全例のデータ固定後に最終集計を実施する なお 安全性定期報告時にも 安全性情報の報告状況について集計する 当該医薬品安全性監視活動の結果に基づいて実施される可能性のある追加の措置及びそ 8
11 の開始の決定基準 本剤の使用に関して 安全性の問題が認められた場合には 添付文書の改訂等を検討する 節目となる時期に 医薬品リスク管理計画の見直しを行い 新たな安全性検討事項の有無を検討する 新たな安全性検討事項が認められた場合には リスク最小化計画の策定の要否について検討する 特定使用成績調査 ( 逆流性食道炎の維持療法 : 長期使用 ) 安全性検討事項 肝機能障害 骨折 CD による胃腸感染 血清ガストリン値の上昇による神経内分泌腫瘍 目的 日常診療の使用実態下で 逆流性食道炎の維持療法として本剤を長期投与した際の安全性及び有効性を検討する 実施計画 調査期間 :2016 年 3 月 ~2018 年 8 月 31 日患者登録期間 :2016 年 3 月 ~2017 年 8 月 31 日予定症例数 :1,000 例実施方法 : 中央登録方式にて実施する 観察期間は 12 ヵ月間 実施計画の設定根拠 長期投与における副作用発現状況を確認するため 本調査を計画した 肝機能障害 骨折 CD による胃腸感染 神経内分泌腫瘍の発現時には 詳細情報を可能な限り収集する 12 ヵ月間投与例を 300 例収集するために 1,000 例を目標症例数とする タケプロンの製造販売後調査の結果 から 12 ヵ月間投与される症例の割合を保守的に 30% と見込み 1,000 例収集することで 12 ヵ月間投与例を 300 例収集することが可能と考える 300 例収集することで 1% 以上の頻度で発現する副作用を 95% 以上の確率で検出でき 長期投与時に特異的に見られる副作用があるかどうかを検討できる 逆流性食道炎/ 維持療法 3 ヵ月以上 6 ヵ月 :6 ヵ月間投与例 57% 低用量アスピリン投与時における潰瘍の再発抑制: 長期使用 :12 ヵ月間投与例 79.1% 非ステロイド性抗炎症薬投与時における潰瘍の再発抑制: 長期使用 :12 ヵ月間投与例 46.1% 節目となる予定時期及びその根拠 調査終了後の最終集計時 : 登録症例全例のデータ固定後に最終集計を実施する なお 安全性定期報告時にも 安全性情報の報告状況について集計する 当該医薬品安全性監視活動の結果に基づいて実施される可能性のある追加の措置及びその開始の決定基準 本剤の使用に関して 安全性の問題が認められた場合には 添付文書の改訂等を検討する 節目となる時期に 医薬品リスク管理計画の見直しを行い 新たな安全性検討事項の有無を検討する 新たな安全性検討事項が認められた場合には リスク最小化計画の策定の要否について検討する 9
12 特定使用成績調査 ( 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 安全性検討事項 肝機能障害 骨折 CD による胃腸感染 血清ガストリン値の上昇による神経内分泌腫瘍 目的 日常診療の使用実態下で 低用量アスピリン投与中の患者に本剤を最長 12 ヵ月間投与した際の安全性及び有効性を検討する 実施計画 調査期間 :2016 年 9 月 ~2019 年 2 月 28 日患者登録期間 :2016 年 9 月 ~2018 年 2 月 28 日予定症例数 :1,000 例実施方法 : 中央登録方式にて実施する 観察期間は 12 ヵ月間 実施計画の設定根拠 長期投与における副作用発現状況を確認するため 本調査を計画した 肝機能障害 骨折 CD による胃腸感染 神経内分泌腫瘍 心血管系又は脳血管系イベントの発現時には 詳細情報を可能な限り収集する 12 ヵ月間投与例を 300 例収集するために 1,000 例を目標症例数とする タケプロンの製造販売後調査の結果 から 12 ヵ月間投与される症例の割合を保守的に 30% と見込み 1,000 例収集することで 12 ヵ月間投与例を 300 例収集することが可能と考える 300 例収集することで 1% 以上の頻度で発現する副作用を 95% 以上の確率で検出でき 長期投与時に特異的に見られる副作用があるかどうかを検討できる 逆流性食道炎/ 維持療法 3 ヵ月以上 6 ヵ月 :6 ヵ月間投与例 57% 低用量アスピリン投与時における潰瘍の再発抑制: 長期使用 :12 ヵ月間投与例 79.1% 非ステロイド性抗炎症薬投与時における潰瘍の再発抑制: 長期使用 :12 ヵ月間投与例 46.1% 節目となる予定時期及びその根拠 調査終了後の最終集計時 : 登録症例全例のデータ固定後に最終集計を実施する なお 安全性定期報告時にも 安全性情報の報告状況について集計する 当該医薬品安全性監視活動の結果に基づいて実施される可能性のある追加の措置及びその開始の決定基準 本剤の使用に関して 安全性の問題が認められた場合には 添付文書の改訂等を検討する 節目となる時期に 医薬品リスク管理計画の見直しを行い 新たな安全性検討事項の有無を検討する 新たな安全性検討事項が認められた場合には リスク最小化計画の策定の要否について検討する 特定使用成績調査 ( 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 安全性検討事項 肝機能障害 骨折 CD による胃腸感染 血清ガストリン値の上昇による神経内分泌腫瘍 目的 日常診療の使用実態下で 非ステロイド性抗炎症薬投与中の患者に本剤を最長 12 ヵ月間投与した際の安全性及び有効性を検討する 10
13 実施計画 調査期間 :2016 年 9 月 ~2020 年 4 月 30 日 患者登録期間 :2016 年 9 月 ~2019 年 4 月 30 日 予定症例数 :1,000 例 実施方法 : 中央登録方式にて実施する 観察期間は 12 ヵ月間 実施計画の設定根拠 長期投与における副作用発現状況を確認するため 本調査を計画した 肝機能障害 骨折 CD による胃腸感染 神経内分泌腫瘍の発現時には 詳細情報を可能な限り収集する 12 ヵ月間投与例を 300 例収集するために 1,000 例を目標症例数とする タケプロンの製造販売後調査の結果 から 12 ヵ月間投与される症例の割合を保守的に 30% と見込み 1,000 例収集することで 12 ヵ月間投与例を 300 例収集することが可能と考える 300 例収集することで 1% 以上の頻度で発現する副作用を 95% 以上の確率で検出でき 長期投与時に特異的に見られる副作用があるかどうかを検討できる 逆流性食道炎 / 維持療法 3 ヵ月以上 6 ヵ月 :6 ヵ月間投与例 57% 低用量アスピリン投与時における潰瘍の再発抑制 : 長期使用 :12 ヵ月間投与例 79.1% 非ステロイド性抗炎症薬投与時における潰瘍の再発抑制 : 長期使用 :12 ヵ月間投与例 46.1% 節目となる予定時期及びその根拠 調査終了後の最終集計時 : 登録症例全例のデータ固定後に最終集計を実施する なお 安全性定期報告時にも 安全性情報の報告状況について集計する 当該医薬品安全性監視活動の結果に基づいて実施される可能性のある追加の措置及びその開始の決定基準 本剤の使用に関して 安全性の問題が認められた場合には 添付文書の改訂等を検討する 節目となる時期に 医薬品リスク管理計画の見直しを行い 新たな安全性検討事項の有無を検討する 新たな安全性検討事項が認められた場合には リスク最小化計画の策定の要否について検討する 11
14 3. 有効性に関する調査 試験の計画の概要 使用成績調査 ( 胃潰瘍 十二指腸潰瘍及び逆流性食道炎 ) 2. 医薬品安全性監視計画の概要 の項参照 特定使用成績調査 ( 逆流性食道炎の維持療法 : 長期使用 ) 2. 医薬品安全性監視計画の概要 の項参照 特定使用成績調査 ( 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 2. 医薬品安全性監視計画の概要 の項参照 特定使用成績調査 ( 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 2. 医薬品安全性監視計画の概要 の項参照 4. リスク最小化計画の概要通常のリスク最小化活動通常のリスク最小化活動の概要 : 添付文書により情報提供及び注意喚起を行う 追加のリスク最小化活動該当なし 12
15 5. 医薬品安全性監視計画 有効性に関する調査 試験の計画及びリスク最小化計画の一覧 5.1 医薬品安全性監視計画の一覧 通常の医薬品安全性監視活動 自発報告 文献 学会情報 外国措置情報等の収集 評価 分析を実施し それらの結果に基づく安全対策を検討し 実行する 追加の医薬品安全性監視活動 追加の医薬品安全性監視活動の名称 節目となる症例数 / 目標症例数 節目となる予定の時期 実施状況 報告書の作成予定日 市販直後調査 該当せず 販売開始 6 ヵ月後 終了 作成済 (2015 年 10 月提出 ) 使用成績調査 ( 胃潰瘍 3,000 例 /3,000 例 安全性定期報告 実施中 十二指腸潰瘍及び逆流性食道炎 ) 時 使用成績調査 ( ヘリコバクター ピロリの除菌の補助 ) 特定使用成績調査 ( 逆流性食道炎の維持療法 : 長期使用 ) 特定使用成績調査 ( 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 特定使用成績調査 ( 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 500 例 /500 例安全性定期報告時 調査終了 1 年 4 ヵ月後 ( 報告書作成時 ) 1,000 例 /1,000 例安全性定期報告時 1,000 例 /1,000 例安全性定期報告時 1,000 例 /1,000 例安全性定期報告時 終了 実施中 実施中 実施中 作成済 (2018 年 3 月提出 ) 13
16 5.2 有効性に関する調査 試験の計画の一覧 有効性に関する調査 試験の名称 節目となる症例数 / 目標症例数 節目となる予定の時期 使用成績調査 ( 胃潰瘍 3,000 例 /3,000 例 調査終了 10 ヵ 十二指腸潰瘍及び逆流 月後 ( 報告書作 性食道炎 ) 成時 ) 実施状況 実施中 報告書の作成予定日 使用成績調査 ( ヘリコバクター ピロリの除菌の補助 ) 500 例 /500 例調査終了 1 年 4 ヵ月後 ( 報告書作成時 ) 終了作成済 (2018 年 3 月提出 ) 特定使用成績調査 ( 逆流性食道炎の維持療法 : 長期使用 ) 特定使用成績調査 ( 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 特定使用成績調査 ( 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 : 長期使用 ) 1,000 例 /1,000 例 1,000 例 /1,000 例 1,000 例 /1,000 例 実施中 実施中 実施中 5.3 リスク最小化計画の一覧 添付文書により情報提供及び注意喚起を行う 通常のリスク最小化活動 追加のリスク最小化活動 追加のリスク最小化活動の名称 節目となる予定の時期 実施状況 市販直後調査による情報提供販売開始から 6 ヵ月後終了 14
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14 回 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 29 年 10 月 1.1. 安全性検討事項 重要な特
 レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
Microsoft Word - LIA RMP_概要ver2.docx
 リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
シダキュアスギ舌下錠 2,000JAU 5,000JAU に係る医薬品リスク管理計画書 (RMP) の概要 販売名 シダキュアスギ舌下錠 2,000JAU,5,000JAU 有効成分 スギ花粉エキス原末 承認取得者名 鳥居薬品株式会社 薬効分類 提出年月 平成 30 年 8 月 1.1.
 シダキュアスギ舌下錠 2,000JAU シダキュアスギ舌下錠 5,000JAU に係る医薬品リスク管理計画書 本資料に記載された情報に関する権利及び内容についての責任は 鳥居薬品株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 鳥居薬品株式会社 1 シダキュアスギ舌下錠 2,000JAU 5,000JAU に係る医薬品リスク管理計画書 (RMP) の概要 販売名 シダキュアスギ舌下錠
シダキュアスギ舌下錠 2,000JAU シダキュアスギ舌下錠 5,000JAU に係る医薬品リスク管理計画書 本資料に記載された情報に関する権利及び内容についての責任は 鳥居薬品株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 鳥居薬品株式会社 1 シダキュアスギ舌下錠 2,000JAU 5,000JAU に係る医薬品リスク管理計画書 (RMP) の概要 販売名 シダキュアスギ舌下錠
販売名 製造販売業者 ジャクスタピッドカプセル 5mg 10mg 20mg に係る医薬品リスク管理計画書 (RMP) の概要 ジャクスタピッドカプセル 5mg 10mg 20mg AEGERION PHARMACEUTICALS 株式会社提出年月 有効成分 ロミタピドメシル酸塩 薬効分類 87218
 ジャクスタピッドカプセル 5mg ジャクスタピッドカプセル 10mg ジャクスタピッドカプセル 20mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は AEGERION PHARMACEUTICALS 株式 会社にあります 当該情報を適正使用以外の営利目的に利用することはできません AEGERION PHARMACEUTICALS 株式会社 販売名 製造販売業者
ジャクスタピッドカプセル 5mg ジャクスタピッドカプセル 10mg ジャクスタピッドカプセル 20mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は AEGERION PHARMACEUTICALS 株式 会社にあります 当該情報を適正使用以外の営利目的に利用することはできません AEGERION PHARMACEUTICALS 株式会社 販売名 製造販売業者
ケブザラ皮下注 150mg/200mg シリンジ ケブザラ皮下注 150mg/200mg オートインジェクターに係る医薬品リスク管理計画書 (RMP) の概要 販売名 製造販売業者 1 ケブザラ皮下注 150mg シリンジ 2 ケブザラ皮下注 200mg シリンジ 3 ケブザラ皮下注 150mg オ
 ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジケブザラ皮下注 150mgオートインジェクターケブザラ皮下注 200mgオートインジェクターに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジ
ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジケブザラ皮下注 150mgオートインジェクターケブザラ皮下注 200mgオートインジェクターに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジ
ケブザラ皮下注 150mg/200mg シリンジに係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 ケブザラ皮下注 150mg シリンジ 2 ケブザラ皮下注 200mg シリンジ 有効成分 サリルマブ ( 遺伝子組換え ) 製造販売業者 サノフィ株式会社 薬効分類 399 提出年月 平成
 ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジに係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 ケブザラ皮下注 150mg シリンジ
ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジに係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 ケブザラ皮下注 150mg シリンジ
<4D F736F F D2082A8926D82E782B995B68F C D815B838B43505F4F E31302E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
販売名 ベージニオ 錠に係る医薬品リスク管理計画書 (RMP) の概要 ベージニオ錠 50mg ベージニオ錠 100mg ベージニオ錠 150mg 有効成分 アベマシクリブ 製造販売業者 日本イーライリリー株式会社 薬効分類 提出年月 平成 30 年 9 月 ( 別紙様式 ) 1.1
 ベージニオ錠 50mg ベージニオ錠 100mg ベージニオ錠 150mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は日本イーライリリー株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 日本イーライリリー株式会社 販売名 ベージニオ 錠に係る医薬品リスク管理計画書 (RMP) の概要 ベージニオ錠 50mg ベージニオ錠 100mg
ベージニオ錠 50mg ベージニオ錠 100mg ベージニオ錠 150mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は日本イーライリリー株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 日本イーライリリー株式会社 販売名 ベージニオ 錠に係る医薬品リスク管理計画書 (RMP) の概要 ベージニオ錠 50mg ベージニオ錠 100mg
<4D F736F F D208BA38D DA81458BA38D878AE98BC6838A E646F6378>
 平成 26 年 10 月 14 日 ジャディアンス錠 平成 25 年 10 月 8 日 ( 錠 25mg) 日本ベーリンガー 品目 10mg, 同錠 25mg 年月日 平成 25 年 12 月 13 日 ( 錠 10mg) 者名 インゲルハイム株式会社 薬事分科会審議参加規程における, 上記品目に係る競合品目, 競合企業及びその選定理由は以下のとおりです 競合品目 1 競合品目 2 競合品目 3 スーグラ錠
平成 26 年 10 月 14 日 ジャディアンス錠 平成 25 年 10 月 8 日 ( 錠 25mg) 日本ベーリンガー 品目 10mg, 同錠 25mg 年月日 平成 25 年 12 月 13 日 ( 錠 10mg) 者名 インゲルハイム株式会社 薬事分科会審議参加規程における, 上記品目に係る競合品目, 競合企業及びその選定理由は以下のとおりです 競合品目 1 競合品目 2 競合品目 3 スーグラ錠
アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全性検討事項 重要な特定されたリスク 頁 重要な潜在
 アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
厚生労働省告示024号/平成22年1月22日告示/平成22年1月22日施行
 厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
パルモディア錠 0.1mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名 パルモディア錠 0.1mg 有効成分 ペマフィブラート 製造販売業者 興和株式会社 薬効分類 提出年月 平成 30 年 11 月 1.1 安全性検討事項 重要な特定されたリスク 頁 重要な潜在的リスク
 パルモディア錠 0.1mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は興和株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 興和株式会社 パルモディア錠 0.1mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名 パルモディア錠 0.1mg 有効成分 ペマフィブラート 製造販売業者 興和株式会社 薬効分類 87218
パルモディア錠 0.1mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は興和株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 興和株式会社 パルモディア錠 0.1mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名 パルモディア錠 0.1mg 有効成分 ペマフィブラート 製造販売業者 興和株式会社 薬効分類 87218
< F2D C D838A8BDB92CA926D2E6A7464>
 保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
150800247.indd
 ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
スイッチ OTC 医薬品の候補となる成分についての要望 に対する見解 1. 要望内容に関連する事項 組織名日本消化器病学会 要望番号 H28-11 H28-12 H28-16 成分名 ( 一般名 ) オメプラゾール ランソプラゾール ラベプラゾールオメプラゾール : 胸やけ ( 胃酸の逆流 ) 胃痛
 スイッチ OTC 医薬品の候補となる成分についての要望 に対する見解 1. 要望内容に関連する事項 組織名日本消化器病学会 要望番号 H28-11 H28-12 H28-16 成分名 ( 一般名 ) オメプラゾール ランソプラゾール ラベプラゾールオメプラゾール : 胸やけ ( 胃酸の逆流 ) 胃痛 もたれ むかつき 要望内容 効能 効果 ランソプラゾール : 繰り返しおこる胸やけ ( 食道への胃酸の逆流
スイッチ OTC 医薬品の候補となる成分についての要望 に対する見解 1. 要望内容に関連する事項 組織名日本消化器病学会 要望番号 H28-11 H28-12 H28-16 成分名 ( 一般名 ) オメプラゾール ランソプラゾール ラベプラゾールオメプラゾール : 胸やけ ( 胃酸の逆流 ) 胃痛 もたれ むかつき 要望内容 効能 効果 ランソプラゾール : 繰り返しおこる胸やけ ( 食道への胃酸の逆流
<4D F736F F D2082A8926D82E782B995B68F D815B838B8FF E31312E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
レキサルティに係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) レキサルティ錠 1mg 販売名有効成分ブレクスピプラゾールレキサルティ錠 2mg 製造販売業者大塚製薬株式会社薬効分類 安全性検討事項 提出年月 重要な特定されたリスク 平成 30 年 5 月 錐
 レキサルティ錠 1 mgレキサルティ錠 2 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は大塚製薬株式会社にありま す 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません 大塚製薬株式会社 レキサルティに係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) レキサルティ錠 1mg 販売名有効成分ブレクスピプラゾールレキサルティ錠
レキサルティ錠 1 mgレキサルティ錠 2 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は大塚製薬株式会社にありま す 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません 大塚製薬株式会社 レキサルティに係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) レキサルティ錠 1mg 販売名有効成分ブレクスピプラゾールレキサルティ錠
販売名 製造販売業者 レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 (RMP) の概要 レフィキシア静注用 500/1000/2000 ノボノルディスクファーマ株式会社提出年月 ( 別紙様式 ) 有効成分ノナコグベータペゴル ( 遺伝子組換え ) 薬効分類 6343
 レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はノボノルディスクファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ノボノルディスクファーマ株式会社 販売名 製造販売業者 レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 (RMP) の概要 レフィキシア静注用
レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はノボノルディスクファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ノボノルディスクファーマ株式会社 販売名 製造販売業者 レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 (RMP) の概要 レフィキシア静注用
ネキシウムに係る医薬品リスク管理計画書 (RMP) の概要 販売名 ネキシウム カプセル 10 mg 20mg ネキシウム 懸濁用顆粒分包 10mg 20mg 有効成分 エソメプラゾールマグネシウム水和物 製造販売業者アストラゼネカ株式会社薬効分類 提出年月 平成 30 年 10 月
 ネキシウム カプセル 10 mg ネキシウム カプセル 20 mg ネキシウム 懸濁用顆粒分包 10 mg ネキシウム 懸濁用顆粒分包 20 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はアストラゼネカ株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません アストラゼネカ株式会社 ネキシウムに係る医薬品リスク管理計画書 (RMP)
ネキシウム カプセル 10 mg ネキシウム カプセル 20 mg ネキシウム 懸濁用顆粒分包 10 mg ネキシウム 懸濁用顆粒分包 20 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はアストラゼネカ株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません アストラゼネカ株式会社 ネキシウムに係る医薬品リスク管理計画書 (RMP)
改訂の理由及び調査の結果直近 3 年度の国内副作用症例の集積状況 転帰死亡症例 アモキシシリン水和物及びクラブラン酸カリウム アモキシシリン水和物の国内症例が集積したことから 専門委員の意見も踏まえた調査の結果 改訂することが適切と判断した 血小板減少関連症例 1 アモキシシリン水和物 3 例 (
 アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
患者 ID: 氏名 : ピロリ菌外来説明文書 1. ピロリ菌はいつ誰によって発見されたのでしょうかピロリ菌はオーストラリアのウォレンとマーシャルによって 1983 年ヒトの胃の中から発見されました その後 ピロリ菌がヒトの胃に与える様々な影響が解明
 ピロリ菌外来 についてのお知らせ ( 平成 21 年 11 月開設 ) 平成 21 年 11 月より当院消化器内科外来において 保険適応のない方についてピロリ菌の判定 除菌を目的とする ピロリ菌外来を実施してきましたが 平成 26 年 4 月からは 内視鏡検査を 6 ヶ月以内に行った方については 原則すべての患者において保険診療でピロリ菌の除菌ができるようになりました しかしながら 保険診療では除菌治療は
ピロリ菌外来 についてのお知らせ ( 平成 21 年 11 月開設 ) 平成 21 年 11 月より当院消化器内科外来において 保険適応のない方についてピロリ菌の判定 除菌を目的とする ピロリ菌外来を実施してきましたが 平成 26 年 4 月からは 内視鏡検査を 6 ヶ月以内に行った方については 原則すべての患者において保険診療でピロリ菌の除菌ができるようになりました しかしながら 保険診療では除菌治療は
ローブレナ錠 25mg / ローブレナ錠 100mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名 ローブレナ錠 25mg ローブレナ錠 100mg 有効成分 ロルラチニブ 製造販売業者 ファイザー株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全性検討
 ローブレナ錠 25mg / ローブレナ錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はファイザー株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ファイザー株式会社 ローブレナ錠 25mg / ローブレナ錠 100mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名 ローブレナ錠 25mg ローブレナ錠 100mg
ローブレナ錠 25mg / ローブレナ錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はファイザー株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ファイザー株式会社 ローブレナ錠 25mg / ローブレナ錠 100mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名 ローブレナ錠 25mg ローブレナ錠 100mg
ウプトラビ錠 0.2mg ウプトラビ錠 0.4mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 ウプトラビ錠 0.2mg ウプトラビ錠 0.4mg 有効成分 セレキシパグ 製造販売業者 日本新薬株式会社 薬効分類 提出年月 平成 30 年 11 月 29 日 1.1. 安
 ウプトラビ錠 0.2mg ウプトラビ錠 0.4mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は日本新薬株式会社にあります 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません 日本新薬株式会社 ウプトラビ錠 0.2mg ウプトラビ錠 0.4mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 ウプトラビ錠 0.2mg ウプトラビ錠
ウプトラビ錠 0.2mg ウプトラビ錠 0.4mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は日本新薬株式会社にあります 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません 日本新薬株式会社 ウプトラビ錠 0.2mg ウプトラビ錠 0.4mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 ウプトラビ錠 0.2mg ウプトラビ錠
先発品とのの相違の一覧 エダラボン点滴静注 30mg 杏林 エダラボン点滴静注 30mg 杏林 脳梗塞急性期に伴う神経症候 日常生活動作障害 機能障害の改善 通常 成人に 1 回 1 管 ( エダラボンとして 30mg) を適当量の生理食塩液等で用時希釈し 30 分かけて 1 日朝夕 2 回の点滴静
 先発品とのの相違の一覧 ( ご注意 ) 赤字は 先発品と異なる です この一覧に掲載している項目は 主に です その他使用上の注意などにつきましては 各製品の添付文書をご参照下さい 用語や文面など 一部異なる場合があります 詳細は各製品の添付文書ご参照ください 2018 年 4 月 4 日 アリピプラゾール OD 錠 3mg/6mg/12mg 杏林 アリピプラゾール OD 錠 3mg 杏林 アリピプラゾール
先発品とのの相違の一覧 ( ご注意 ) 赤字は 先発品と異なる です この一覧に掲載している項目は 主に です その他使用上の注意などにつきましては 各製品の添付文書をご参照下さい 用語や文面など 一部異なる場合があります 詳細は各製品の添付文書ご参照ください 2018 年 4 月 4 日 アリピプラゾール OD 錠 3mg/6mg/12mg 杏林 アリピプラゾール OD 錠 3mg 杏林 アリピプラゾール
<4D F736F F D2082A8926D82E782B995B68F D815B838B4E618FF931306D E3131>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加及び 使用上の注意 改訂のお知らせ 2012 年 11 月 東和薬品株式会社 このたび 平成 24 年 5 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 24 年 11 月 19 日付にて 下記の内容で承認されました また 使用上の注意 の項も改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加及び 使用上の注意 改訂のお知らせ 2012 年 11 月 東和薬品株式会社 このたび 平成 24 年 5 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 24 年 11 月 19 日付にて 下記の内容で承認されました また 使用上の注意 の項も改訂致しましたので 併せてお知らせ申し上げます
エビリファイに係る ( 別紙様式 ) 販売名 医薬品リスク管理計画書 (RMP) の概要 1 エビリファイ錠 1 mg /3 mg /6 mg /12 mg 2 エビリファイ散 1% 3 エビリファイ内用液 0.1% 4 エビリファイ OD 錠 3 mg /6 mg /12 mg /24 mg 5
 エビリファイ錠 1 mgエビリファイ錠 3 mg エビリファイ錠 6 mg エビリファイ錠 12 mg エビリファイ散 1 % エビリファイ内用液 0.1 % エビリファイ OD 錠 3 mg エビリファイ OD 錠 6 mg エビリファイ OD 錠 12 mg エビリファイ OD 錠 24 mg エビリファイ持続性水懸筋注用 300 mg エビリファイ持続性水懸筋注用 400 mg エビリファイ持続性水懸筋注用
エビリファイ錠 1 mgエビリファイ錠 3 mg エビリファイ錠 6 mg エビリファイ錠 12 mg エビリファイ散 1 % エビリファイ内用液 0.1 % エビリファイ OD 錠 3 mg エビリファイ OD 錠 6 mg エビリファイ OD 錠 12 mg エビリファイ OD 錠 24 mg エビリファイ持続性水懸筋注用 300 mg エビリファイ持続性水懸筋注用 400 mg エビリファイ持続性水懸筋注用
販売名 テクフィデラカプセル 120mg/240mg に係る医薬品リスク管理計画書 (RMP) の概要 テクフィデラカプセル 120mg/240mg 有効成分 ( 別紙様式 ) フマル酸ジメチル 製造販売業者 バイオジェン ジャパン株式会社 薬効分類 119 提出年月 平成 30 年 2 月 1.1
 テクフィデラカプセル 120mg/240mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はバイオジェン ジャパン株式会社にあります 当該情報を適正使用以外の営利目的に使用することはできません バイオジェン ジャパン株式会社 販売名 テクフィデラカプセル 120mg/240mg に係る医薬品リスク管理計画書 (RMP) の概要 テクフィデラカプセル 120mg/240mg
テクフィデラカプセル 120mg/240mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はバイオジェン ジャパン株式会社にあります 当該情報を適正使用以外の営利目的に使用することはできません バイオジェン ジャパン株式会社 販売名 テクフィデラカプセル 120mg/240mg に係る医薬品リスク管理計画書 (RMP) の概要 テクフィデラカプセル 120mg/240mg
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
したことによると考えられています 4. ピロリ菌の検査法ピロリ菌の検査法にはいくつかの種類があり 内視鏡を使うものとそうでないものに大きく分けられます 前者は 内視鏡を使って胃の組織を採取し それを材料にしてピロリ菌の有無を調べます 胃粘膜組織を顕微鏡で見てピロリ菌を探す方法 ( 鏡検法 ) 先に述
 ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
スライド 1
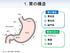 1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
<4D F736F F F696E74202D208E7396AF835A837E B814088DD82AA82F1975C966882C68C9F D838A8BDB82C682CC90ED82A >
 胃がん予防と検診 ピロリ菌との戦い けいあいクリニックク木村正之 2012.01.21 横浜市民セミナー 本日の内容 ピロリ菌の発見 ピロリ菌の感染 ピロリ菌の特徴 ピロリ菌の検査方法 ピロリ菌と胃の病気 ピロリ菌の治療 ( 除菌治療 ) 胃がんの予防 ピロリ菌の発見 細菌は胃内に棲息できない? 胃の中に細菌がすみつくことはありえるのだろうか? ピロリ菌って ピロリ菌の正式名 : ヘリコバクターピロリHelicobacter
胃がん予防と検診 ピロリ菌との戦い けいあいクリニックク木村正之 2012.01.21 横浜市民セミナー 本日の内容 ピロリ菌の発見 ピロリ菌の感染 ピロリ菌の特徴 ピロリ菌の検査方法 ピロリ菌と胃の病気 ピロリ菌の治療 ( 除菌治療 ) 胃がんの予防 ピロリ菌の発見 細菌は胃内に棲息できない? 胃の中に細菌がすみつくことはありえるのだろうか? ピロリ菌って ピロリ菌の正式名 : ヘリコバクターピロリHelicobacter
Microsoft Word - 新薬123(2018.4).doc
 新薬情報 平成 30 年 4 月 18 日付内用薬 12 品目 外用薬 2 品目 注射薬 8 品目が薬価収載されました [ 内用薬 ] は最小包装単位 [ 新医薬品情報 ] 2018.5.1 薬効分類番号 商品名 ( 社名 ) 薬価 成分 含量 ホンタイ識別コード * 効能 効果 / 用法 用量 117 レキサルティ錠 1mg 268.90 ブレクスピプラゾール1mg/ 錠 BRX1 レキサルティ錠
新薬情報 平成 30 年 4 月 18 日付内用薬 12 品目 外用薬 2 品目 注射薬 8 品目が薬価収載されました [ 内用薬 ] は最小包装単位 [ 新医薬品情報 ] 2018.5.1 薬効分類番号 商品名 ( 社名 ) 薬価 成分 含量 ホンタイ識別コード * 効能 効果 / 用法 用量 117 レキサルティ錠 1mg 268.90 ブレクスピプラゾール1mg/ 錠 BRX1 レキサルティ錠
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能
 医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
区分商品名規格単位薬価 ( 円 ) 包装単位製造販売成分名効能 効果用法 用量規制等承認年月日備考 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger-Ellison 症候群ネキシウム懸濁用顆粒分包 10mg1 包 円 28 包アストラゼネエソメプラ 胃潰瘍 十二指腸潰処方 新用量 剤
 新医薬品が薬価収載されましたのでお知らせいたします 区分 商品名 規格単位 薬価 ( 円 ) 包装単位 製造販売 成分名 効能 効果 用法 用量 規制等 承認年月日 備考 レキサルティ錠 1mg 1mg1 錠 268.90 円 [PTP]100 錠 10) 500 錠 50) [ プラスチックボトル ] 500 錠 1,000 錠 大塚製薬 ブレクスピプラゾール 統合失調症 通常 成人にはブレクスピプラゾールとして1
新医薬品が薬価収載されましたのでお知らせいたします 区分 商品名 規格単位 薬価 ( 円 ) 包装単位 製造販売 成分名 効能 効果 用法 用量 規制等 承認年月日 備考 レキサルティ錠 1mg 1mg1 錠 268.90 円 [PTP]100 錠 10) 500 錠 50) [ プラスチックボトル ] 500 錠 1,000 錠 大塚製薬 ブレクスピプラゾール 統合失調症 通常 成人にはブレクスピプラゾールとして1
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
Microsoft PowerPoint - __________________________ ppt
 日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
薬生安発 0302 第 1 号 平成 30 年 3 月 2 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について の一部改正について 再審査期間中の新医薬品以外の医薬品の医薬品リ
 薬生安発 0302 第 1 号 平成 30 年 3 月 2 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について の一部改正について 再審査期間中の新医薬品以外の医薬品の医薬品リスク管理計画の実施状況及び得られた結果の評価に関する報告の様式 提出等の取扱いについては 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について
薬生安発 0302 第 1 号 平成 30 年 3 月 2 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について の一部改正について 再審査期間中の新医薬品以外の医薬品の医薬品リスク管理計画の実施状況及び得られた結果の評価に関する報告の様式 提出等の取扱いについては 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について
Microsoft PowerPoint - ⑨140925,30日薬連講習会(後発RMP)930.ppt [互換モード]
![Microsoft PowerPoint - ⑨140925,30日薬連講習会(後発RMP)930.ppt [互換モード] Microsoft PowerPoint - ⑨140925,30日薬連講習会(後発RMP)930.ppt [互換モード]](/thumbs/101/151698947.jpg) 後発医薬品 RMP について 厚生労働省医薬食品局安全対策課磯﨑正季子 1 後発医薬品への RMP の適用 平成 24 年 4 月 11 日薬食安発 0411 第 1 号 薬食審査発 0411 第 2 号安全対策課長 審査管理課長連名通知 医薬品リスク管理計画指針について 適用範囲医療用医薬品 ( 新医薬品 バイオ後続品 後発医薬品 ) 策定検討の時点 承認申請時 新医薬品 バイオ後続品後発医薬品
後発医薬品 RMP について 厚生労働省医薬食品局安全対策課磯﨑正季子 1 後発医薬品への RMP の適用 平成 24 年 4 月 11 日薬食安発 0411 第 1 号 薬食審査発 0411 第 2 号安全対策課長 審査管理課長連名通知 医薬品リスク管理計画指針について 適用範囲医療用医薬品 ( 新医薬品 バイオ後続品 後発医薬品 ) 策定検討の時点 承認申請時 新医薬品 バイオ後続品後発医薬品
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
ランソプラゾールOD錠15mg「武田テバ」/ランソプラゾールOD錠30mg「武田テバ」
 作成年月 :2018 年 2 月 ( 第 1 版 ) 貯法 : 室温保存使用期限 : 外装に表示の使用期限内に使用すること ( 使用期限内であっても開封後はなるべく速やかに使用すること ) 規制区分 : 処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 日本標準商品分類番号 872329 15mg 30mg 承認番号 23000AMX00200000 23000AMX00201000
作成年月 :2018 年 2 月 ( 第 1 版 ) 貯法 : 室温保存使用期限 : 外装に表示の使用期限内に使用すること ( 使用期限内であっても開封後はなるべく速やかに使用すること ) 規制区分 : 処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 日本標準商品分類番号 872329 15mg 30mg 承認番号 23000AMX00200000 23000AMX00201000
改訂後 ( 下線 : 追加記載 ) 改訂前 用法 用量 用法 用量 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger Ellison 症候群 Ellison 症候群現行のとおり略 逆流性食道炎 逆流性食道炎現行のとおり略 非びらん性胃食道逆流
 適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 の一部変更承認に伴う 使用上の注意 改訂のお知らせ 2013 年 7 月 注 ) 注意 - 医師等の処方せんにより使用すること このたび 標記製品の 効能 効果 用法 用量 が一部変更承認されました それに伴い 関連する 使用上の注意 を下記のとおり改訂致しましたのでお知らせ申し上げます 本剤のご使用に際しましては 添付文書の各項を十分ご覧くださいますようお願い申し上げます
適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 の一部変更承認に伴う 使用上の注意 改訂のお知らせ 2013 年 7 月 注 ) 注意 - 医師等の処方せんにより使用すること このたび 標記製品の 効能 効果 用法 用量 が一部変更承認されました それに伴い 関連する 使用上の注意 を下記のとおり改訂致しましたのでお知らせ申し上げます 本剤のご使用に際しましては 添付文書の各項を十分ご覧くださいますようお願い申し上げます
医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など ) 医薬品候補物質のスクリーニン
 特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
【資料7】目次
 資料 7 オメプラゾール ランソプラゾール ラベプラゾールナトリウム 資料 7-1 PPI に関する論点 p.2 資料 7-2 PPI( 各要望成分 ) の概要 p.3 資料 7-3 PPI の安全性について p.4 資料 7-4 日本における医薬品販売の制度と現状 p.9 参考資料 1 平成 28 年度医薬品販売制度実態把握 調査結果について ( 概要 ) p.15-1- 資料 7-1 PPI に関する論点
資料 7 オメプラゾール ランソプラゾール ラベプラゾールナトリウム 資料 7-1 PPI に関する論点 p.2 資料 7-2 PPI( 各要望成分 ) の概要 p.3 資料 7-3 PPI の安全性について p.4 資料 7-4 日本における医薬品販売の制度と現状 p.9 参考資料 1 平成 28 年度医薬品販売制度実態把握 調査結果について ( 概要 ) p.15-1- 資料 7-1 PPI に関する論点
医薬品の適正使用に欠かせない情報です
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 平成 25 年 7 月 プロトンポンプ阻害剤 処方せん医薬品注 ) 一般名 : ラベプラゾールナトリウム錠注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は弊社製品につきまして格別のお引立てを賜り 厚く御礼申し上げます この度平成 25
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 平成 25 年 7 月 プロトンポンプ阻害剤 処方せん医薬品注 ) 一般名 : ラベプラゾールナトリウム錠注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は弊社製品につきまして格別のお引立てを賜り 厚く御礼申し上げます この度平成 25
審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ
![審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ 審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ](/thumbs/92/110667825.jpg) 審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
ランソプラゾールOD錠15mg「テバ」/ランソプラゾールOD錠30mg「テバ」
 印 :2017 年 10 月改訂 ( 第 18 版 ) 印 :2017 年 4 月改訂 貯法 : 室温保存 ( 開封後は湿気を避けて保存すること ) 使用期限 : 外装に表示の使用期限内に使用すること 注意 : の項参照規制区分 : 処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 腸溶性口腔内崩壊錠 15mg 日本標準商品分類番号 872329 30mg 承認番号 22600AMX00160000
印 :2017 年 10 月改訂 ( 第 18 版 ) 印 :2017 年 4 月改訂 貯法 : 室温保存 ( 開封後は湿気を避けて保存すること ) 使用期限 : 外装に表示の使用期限内に使用すること 注意 : の項参照規制区分 : 処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 腸溶性口腔内崩壊錠 15mg 日本標準商品分類番号 872329 30mg 承認番号 22600AMX00160000
2017 年 10 月改訂 ( 第 3 版 ) 2017 年 4 月改訂プロトンポンプインヒビター 日本薬局方ランソプラゾール腸溶性口腔内崩壊錠 日本標準商品分類番号 Lansoprazole OD 規制区分 : 処方箋医薬品注意 - 医師等の処方箋によ
 217 年 1 月改訂 ( 第 3 版 ) 217 年 4 月改訂プロトンポンプインヒビター 日本薬局方ランソプラゾール腸溶性口腔内崩壊錠 日本標準商品分類番号 872329 4 98719 5973 Lansoprazole OD 規制区分 : 処方箋医薬品注意 - 医師等の処方箋により使用すること貯法 : 気密容器 室温保存使用期限 : 外装に表示 15mg 3mg 承認番号 223AMX765
217 年 1 月改訂 ( 第 3 版 ) 217 年 4 月改訂プロトンポンプインヒビター 日本薬局方ランソプラゾール腸溶性口腔内崩壊錠 日本標準商品分類番号 872329 4 98719 5973 Lansoprazole OD 規制区分 : 処方箋医薬品注意 - 医師等の処方箋により使用すること貯法 : 気密容器 室温保存使用期限 : 外装に表示 15mg 3mg 承認番号 223AMX765
審査報告書 平成 29 年 10 月 13 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] 1ネキシウムカプセル 10 mg 2 同カプセル 20 mg 3ネキシウム懸濁用顆粒分包 10 mg
![審査報告書 平成 29 年 10 月 13 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] 1ネキシウムカプセル 10 mg 2 同カプセル 20 mg 3ネキシウム懸濁用顆粒分包 10 mg 審査報告書 平成 29 年 10 月 13 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] 1ネキシウムカプセル 10 mg 2 同カプセル 20 mg 3ネキシウム懸濁用顆粒分包 10 mg](/thumbs/91/105640160.jpg) 審議結果報告書 平成 29 年 11 月 16 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] ネキシウムカプセル10mg 同カプセル20mg 同懸濁用顆粒分包 10mg 同懸濁用顆粒分包 20mg [ 一 般 名 ] エソメプラゾールマグネシウム水和物 [ 申請者名 ] アストラゼネカ株式会社 [ 申請年月日 ] 平成 28 年 12 月 20 日 [ 審議結果 ] 平成 29 年 11
審議結果報告書 平成 29 年 11 月 16 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] ネキシウムカプセル10mg 同カプセル20mg 同懸濁用顆粒分包 10mg 同懸濁用顆粒分包 20mg [ 一 般 名 ] エソメプラゾールマグネシウム水和物 [ 申請者名 ] アストラゼネカ株式会社 [ 申請年月日 ] 平成 28 年 12 月 20 日 [ 審議結果 ] 平成 29 年 11
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
販売名 製造販売業者 インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書 (RMP) の概要 インフリキシマブ BS 点滴静注用 100mg CTH セルトリオン ヘルスケア ジャパン株式会社 ( 選任製造販売業者 ) 提出年月 有効成分 インフリキシマブ ( 遺伝
 インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はセルトリオン ヘルスケア ジャパン株式会社にあります 当該製品の適正使用以外の営利目的に本資料を利用することはできません セルトリオン ヘルスケア ジャパン株式会社 販売名 製造販売業者 インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書
インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はセルトリオン ヘルスケア ジャパン株式会社にあります 当該製品の適正使用以外の営利目的に本資料を利用することはできません セルトリオン ヘルスケア ジャパン株式会社 販売名 製造販売業者 インフリキシマブ BS 点滴静注用 100mg CTH に係る医薬品リスク管理計画書
[ 症例概要 ]( 国内自発報告 ) [ 症例 (1)] 患者 性 年齢男 90 代 使用理由 ( 合併症 ) 胃食道逆流性疾患 ( 高血圧 良性前立腺肥大症 心筋虚血 緑内障 ) 1 日投与量投与期間 20mg 不明 副作用 経過及び処置 2~3ヶ月前 A 院にてオメプラゾールから本剤へ切り替えた
 [ 症例 (1)] 患者 性 年齢男 90 代 使用理由 ( 合併症 ) 胃食道逆流性疾患 ( 高血圧 良性前立腺肥大症 心筋虚血 緑内障 ) 1 日投与量投与期間 20mg 不明 副作用 経過及び処置 2~3ヶ月前 A 院にてオメプラゾールから本剤へ切り替えた [ 症例概要 ]( 国内自発報告 ) [ 症例 (1)] 患者 性 年齢男 90 代 使用理由 ( 合併症 ) 胃食道逆流性疾患 ( 高血圧 良性前立腺肥大症 心筋虚血 緑内障 ) 1 日投与量投与期間 20mg 不明 副作用 経過及び処置 2~3ヶ月前 A 院にてオメプラゾールから本剤へ切り替えた](/thumbs/91/105029300.jpg) 医薬品の適正使用に欠かせない情報です 必ずお読み下さい プロトンポンプ インヒビター 2016 年 2 月 エソメプラゾールマグネシウム水和物カプセル この度 ネキシウムカプセルの 使用上の注意 を 厚生労働省医薬 生活衛生局安全対策課長通知 ( 平成 28 年 2 月 16 日 ) により改訂を行いましたので ご連絡申し上げます なお 新しい添付文書を封入した製品をお届けするのに日数を要すると存じますので
医薬品の適正使用に欠かせない情報です 必ずお読み下さい プロトンポンプ インヒビター 2016 年 2 月 エソメプラゾールマグネシウム水和物カプセル この度 ネキシウムカプセルの 使用上の注意 を 厚生労働省医薬 生活衛生局安全対策課長通知 ( 平成 28 年 2 月 16 日 ) により改訂を行いましたので ご連絡申し上げます なお 新しい添付文書を封入した製品をお届けするのに日数を要すると存じますので
ヘリコバクター ピロリの除菌の補助の場合通常 成人にはとして 1 回 3mg アモキシシリン水和物として 1 回 75mg( 力価 ) 及びクラリスロマイシンとして 1 回 2mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する なお クラリスロマイシンは 必要に応じて適宜増量
 **217 年 1 月改訂 ( 第 11 版 ) *217 年 4 月改訂 日本標準商品分類番号 8 7 2 3 2 9 987792 21519 貯法 : 室温保存 気密容器使用期限 : 外箱等に表示注意 : 取扱い上の注意 の項参照 規制区分 : 処方箋医薬品 注意 - 医師等の処方箋により使用すること 承認番号薬価収載販売開始効能追加 OD 錠 15mg JG 222AMX582 21 年 11
**217 年 1 月改訂 ( 第 11 版 ) *217 年 4 月改訂 日本標準商品分類番号 8 7 2 3 2 9 987792 21519 貯法 : 室温保存 気密容器使用期限 : 外箱等に表示注意 : 取扱い上の注意 の項参照 規制区分 : 処方箋医薬品 注意 - 医師等の処方箋により使用すること 承認番号薬価収載販売開始効能追加 OD 錠 15mg JG 222AMX582 21 年 11
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
用法 用量 発作性夜間ヘモグロビン尿症における溶血抑制 mg mg mg mg kg 30kg 40kg 20kg 30kg 10kg 20kg 5kg 10kg 1900mg mg mg mg
 C EculizumabGenetical Recombination AMX 警告 1 2 禁忌 ( 次の患者には投与しないこと ) 1 2 組成 性状 ml mg mg mg mg mg ph ph mgml 効能 効果 発作性夜間ヘモグロビン尿症における溶血抑制 < 効能 効果に関連する使用上の注意 > 共通 1C5 C5b-9 b 発作性夜間ヘモグロビン尿症における溶血抑制 1 2 3 4
C EculizumabGenetical Recombination AMX 警告 1 2 禁忌 ( 次の患者には投与しないこと ) 1 2 組成 性状 ml mg mg mg mg mg ph ph mgml 効能 効果 発作性夜間ヘモグロビン尿症における溶血抑制 < 効能 効果に関連する使用上の注意 > 共通 1C5 C5b-9 b 発作性夜間ヘモグロビン尿症における溶血抑制 1 2 3 4
Microsoft Word - 医薬品情報_ コピー
 2018 年 6 月号 医薬品情報 2018 年 5 月 25 日発行 1. 採用医薬品 5 月薬事委員会における採用 2018 年 5 月 30 日 ( 水 ) より処方して下さい 1 テセントリク点滴静注 1200mg --------------------------------------- 1 2 ネキシウム懸濁用顆粒分包 10mg 20mg --------------------------
2018 年 6 月号 医薬品情報 2018 年 5 月 25 日発行 1. 採用医薬品 5 月薬事委員会における採用 2018 年 5 月 30 日 ( 水 ) より処方して下さい 1 テセントリク点滴静注 1200mg --------------------------------------- 1 2 ネキシウム懸濁用顆粒分包 10mg 20mg --------------------------
はじめに 胃の中に住みつくヘリコバクター ピロリ ( ピロリ菌 ) が発見されたのは 1982 年のことです 以後 今日までにさまざかいようまな研究が進められ ピロリ菌感染が胃炎や消化性潰瘍 ( 胃潰じゅうにしちょうかいよう瘍 十二指腸潰瘍 ) の重要な原因であることが明らかになりました 現在では
 ヘリコバクター じゅうにしちょうピロリと胃 十二指腸 監修 医療法人新生会 高田中央病院 総院長藤岡利生 ( 大分大学名誉教授 ) はじめに 胃の中に住みつくヘリコバクター ピロリ ( ピロリ菌 ) が発見されたのは 1982 年のことです 以後 今日までにさまざかいようまな研究が進められ ピロリ菌感染が胃炎や消化性潰瘍 ( 胃潰じゅうにしちょうかいよう瘍 十二指腸潰瘍 ) の重要な原因であることが明らかになりました
ヘリコバクター じゅうにしちょうピロリと胃 十二指腸 監修 医療法人新生会 高田中央病院 総院長藤岡利生 ( 大分大学名誉教授 ) はじめに 胃の中に住みつくヘリコバクター ピロリ ( ピロリ菌 ) が発見されたのは 1982 年のことです 以後 今日までにさまざかいようまな研究が進められ ピロリ菌感染が胃炎や消化性潰瘍 ( 胃潰じゅうにしちょうかいよう瘍 十二指腸潰瘍 ) の重要な原因であることが明らかになりました
(別添様式)
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会協和発酵キリン株式会社 要要望番号望成分名さ ( 一般名 ) れ販売名た未承認薬 適応医薬品 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) II-23 アモキシシリン水和物パセトシン細粒 10% 未承認薬適応外薬胃潰瘍又は十二指腸潰瘍におけるヘリコバクター
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会協和発酵キリン株式会社 要要望番号望成分名さ ( 一般名 ) れ販売名た未承認薬 適応医薬品 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) II-23 アモキシシリン水和物パセトシン細粒 10% 未承認薬適応外薬胃潰瘍又は十二指腸潰瘍におけるヘリコバクター
どのくらいの人がピロリ菌に感染しているのですか? 日本人のピロリ菌感染者は約 3500 万人といわれています 日本では欧米に比べると感染率が高く 特に 50 歳以上の人で感染している割合が高いとされています しかし 衛生環境が整って来た事により若い世代の感染は減少傾向にあります ピロリ菌に感染すると
 ピロリ菌専門外来 ピロリ菌除菌治療の勧め日本ヘリコバクター 学会は ヘリコバクター ピロリ感染の診断と治療のガイドライン (2009 年 ) で すべてのヘリコバクター ピロリ感染者に対し除菌治療を行なうよう推奨致しました しかし ピロリ菌に対する検査 除菌治療の保険適応は 胃 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡治療後 の 4 疾患に限られ 胃がん予防としての
ピロリ菌専門外来 ピロリ菌除菌治療の勧め日本ヘリコバクター 学会は ヘリコバクター ピロリ感染の診断と治療のガイドライン (2009 年 ) で すべてのヘリコバクター ピロリ感染者に対し除菌治療を行なうよう推奨致しました しかし ピロリ菌に対する検査 除菌治療の保険適応は 胃 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡治療後 の 4 疾患に限られ 胃がん予防としての
記 第 1 再審査資料の構成及び作成上の注意事項再審査資料の構成及び作成上の注意事項は次のとおりとすること また 再審査申請書の写し及び平成 10 年 12 月 1 日付け医薬審第 1058 号厚生省医薬安全局審査管理課長通知 新医薬品等の申請資料の信頼性の基準の遵守について により添付することとし
 薬生薬審発 1128 第 2 号 平成 29 年 11 月 28 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 新医療用医薬品の再審査申請に際し添付すべき資料について 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 第 14 条の4 第 4 項に基づく新医療用医薬品の再審査申請に際し添付すべき資料
薬生薬審発 1128 第 2 号 平成 29 年 11 月 28 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 新医療用医薬品の再審査申請に際し添付すべき資料について 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 第 14 条の4 第 4 項に基づく新医療用医薬品の再審査申請に際し添付すべき資料
ネキシウムカプセル10mg/ネキシウムカプセル20mg
 NEX-9.0 **2016 年 2 月改訂 ( 第 9 版 ) * 2015 年 1 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 プロトンポンプ インヒビター エソメプラゾールマグネシウム水和物カプセル 日本標準商品分類番号 872329 10mg 20mg 承認番号 22300AMX00598 22300AMX00599
NEX-9.0 **2016 年 2 月改訂 ( 第 9 版 ) * 2015 年 1 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 プロトンポンプ インヒビター エソメプラゾールマグネシウム水和物カプセル 日本標準商品分類番号 872329 10mg 20mg 承認番号 22300AMX00598 22300AMX00599
ランソプラゾールOD錠15/30mg「トーワ」インタビューホーム
 2016 年 6 月 ( 改訂第 19 版 ) 日本標準商品分類番号 :872329 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 ランソプラゾールカプセル 15mg/30mg トーワ ランソプラゾールカプセル LANSOPRAZOLE CAPSULES 15mg TOWA / CAPSULES 30mg TOWA プロトンポンプ インヒビター ランソプラゾール
2016 年 6 月 ( 改訂第 19 版 ) 日本標準商品分類番号 :872329 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 ランソプラゾールカプセル 15mg/30mg トーワ ランソプラゾールカプセル LANSOPRAZOLE CAPSULES 15mg TOWA / CAPSULES 30mg TOWA プロトンポンプ インヒビター ランソプラゾール
ネキシウムカプセル10mg/ネキシウムカプセル20mg
 NEX-10.0 **2018 年 1 月改訂 ( 第 10 版 ) * 2016 年 2 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 プロトンポンプ インヒビター エソメプラゾールマグネシウム水和物カプセル 日本標準商品分類番号 872329 10mg 20mg 承認番号 22300AMX00598 22300AMX00599
NEX-10.0 **2018 年 1 月改訂 ( 第 10 版 ) * 2016 年 2 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 プロトンポンプ インヒビター エソメプラゾールマグネシウム水和物カプセル 日本標準商品分類番号 872329 10mg 20mg 承認番号 22300AMX00598 22300AMX00599
目次 C O N T E N T S 1 下痢等の胃腸障害 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副
 目次 C O N T E N T S 1 下痢等の胃腸障害 3 1.1 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 5 1.2 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副作用発現状況 6 胃腸障害に関連する重篤な副作用発現症例 6 1.3 消化性潰瘍, 炎症性腸疾患等の胃腸疾患のある患者さんにおける安全性について
目次 C O N T E N T S 1 下痢等の胃腸障害 3 1.1 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 5 1.2 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副作用発現状況 6 胃腸障害に関連する重篤な副作用発現症例 6 1.3 消化性潰瘍, 炎症性腸疾患等の胃腸疾患のある患者さんにおける安全性について
2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社 (TPC) 大阪市中央区道修町四丁目 1 番 1 号 治験課題名 : びらん性食道炎の患者を対象にした TAK-438 の 20 mg を 1 日 1 回経口投与したときの有効性及び安全性を 1 日 1 回経口投与
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
( 別紙様式 ) タシグナカプセル 200mg, 150mg, 50mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 タシグナカプセル 200 mg 2 タシグナカプセル 150 mg 有効成分 ニロチニブ塩酸塩水和物 3 タシグナカプセル 50 mg 製造販売業者 ノバルティスフ
 タシグナカプセル 200 mg,150mg,50mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はノバルティスファーマ株式会社にあります 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません ノバルティスファーマ株式会社 ( 別紙様式 ) タシグナカプセル 200mg, 150mg, 50mg に係る医薬品リスク管理計画書 (RMP)
タシグナカプセル 200 mg,150mg,50mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はノバルティスファーマ株式会社にあります 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません ノバルティスファーマ株式会社 ( 別紙様式 ) タシグナカプセル 200mg, 150mg, 50mg に係る医薬品リスク管理計画書 (RMP)
本日の内容 添付文書の改訂医薬品の添付文書がどのように作成され 改訂されるかを知る リスクコミュニケーション医療現場 行政 企業とのリスクコミュニケーションツールとその活用方法を知る 2
 平成 28 年 10 月 10 日第 49 回日本薬剤師会学術大会 PMDA が行う安全性情報の収集 評価 添付文書の改訂と リスクコミュニケーション 独立行政法人医薬品医療機器総合機構安全第二部鷹見明奈 1 本日の内容 添付文書の改訂医薬品の添付文書がどのように作成され 改訂されるかを知る リスクコミュニケーション医療現場 行政 企業とのリスクコミュニケーションツールとその活用方法を知る 2 医薬品の開発から市販後までのかかわり
平成 28 年 10 月 10 日第 49 回日本薬剤師会学術大会 PMDA が行う安全性情報の収集 評価 添付文書の改訂と リスクコミュニケーション 独立行政法人医薬品医療機器総合機構安全第二部鷹見明奈 1 本日の内容 添付文書の改訂医薬品の添付文書がどのように作成され 改訂されるかを知る リスクコミュニケーション医療現場 行政 企業とのリスクコミュニケーションツールとその活用方法を知る 2 医薬品の開発から市販後までのかかわり
< 維持療法 > 再発 再燃を繰り返す逆流性食道炎の維持療法においては 通常 成人にはラベプラゾールナトリウムとして 1 回 10mg を 1 日 1 回経口投与する また プロトンポンプインヒビターによる治療で効果不十分な逆流性食道炎の維持療法においては 1 回 10mg を 1 日 2 回経口投
 **2017 年 9 月改訂 ( 第 30 版 ) *2017 年 2 月改訂 プロトンポンプ阻害剤 ラベプラゾールナトリウム製剤 貯法 室温保存 PTP 包装はアルミ袋開封後 バラ包装は開栓後 湿気を避けて保存すること ( 含量が低下することがある ) 使用期限 外箱又はラベルに表示の使用期限内に使用すること ( 使用期限内であっても開封後はなるべく速やかに使用すること ) 注 ) 注意 - 医師等の処方箋により使用すること
**2017 年 9 月改訂 ( 第 30 版 ) *2017 年 2 月改訂 プロトンポンプ阻害剤 ラベプラゾールナトリウム製剤 貯法 室温保存 PTP 包装はアルミ袋開封後 バラ包装は開栓後 湿気を避けて保存すること ( 含量が低下することがある ) 使用期限 外箱又はラベルに表示の使用期限内に使用すること ( 使用期限内であっても開封後はなるべく速やかに使用すること ) 注 ) 注意 - 医師等の処方箋により使用すること
DRAFT#9 2011
 報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
Drug Infomation
 PPI と 今日のお話 H2 ブロッカーの特徴 何のために処方していますか? 胃酸分泌抑制薬 ( 特に PPI ) について 薬剤部医薬品情報課 松本早苗 2016 年 10 月 21 日救急部カンファレンス 胃酸分泌抑制薬 ( 特に PPI) の落とし穴 (*_*;) ストレスや敗血症による潰瘍予防の適正使用 NST の立場から PPI と H2 ブロッカーの比較 PPI と H2 ブロッカーの特徴
PPI と 今日のお話 H2 ブロッカーの特徴 何のために処方していますか? 胃酸分泌抑制薬 ( 特に PPI ) について 薬剤部医薬品情報課 松本早苗 2016 年 10 月 21 日救急部カンファレンス 胃酸分泌抑制薬 ( 特に PPI) の落とし穴 (*_*;) ストレスや敗血症による潰瘍予防の適正使用 NST の立場から PPI と H2 ブロッカーの比較 PPI と H2 ブロッカーの特徴
要望番号 ;Ⅱ-286 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後 予測因子および副作用発現の危険因子についての探索的研究 (JACCRO GC-07AR) という臨床研究について説明したものです この文書と私の説明のな かで わかりにくいと
 StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
消化性潰瘍(扉ページ)
 患者さんと家族のための 消化性潰瘍 ガイドブック 編集 日本消化器病学会 Copyright C THE JAPANESE SOCIETY OF GASTROENTEROLOGY. d 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 1 消化性潰瘍の理解のために 2 消化性潰瘍の原因は 日本での消化性潰瘍の原因は
患者さんと家族のための 消化性潰瘍 ガイドブック 編集 日本消化器病学会 Copyright C THE JAPANESE SOCIETY OF GASTROENTEROLOGY. d 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 1 消化性潰瘍の理解のために 2 消化性潰瘍の原因は 日本での消化性潰瘍の原因は
用法・用量DB
 データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
PowerPoint プレゼンテーション
 ピロリ菌と胃がん ピロリ菌の早期除菌で 胃がんは予防できる ナポレオンの死因は胃癌だった!? 社内資料 ピロリ菌って何ですか ピロリ菌は正式にはヘリコバクター ピロリという細菌で 1983 年にオーストラリアのウォレンとマーシャルによって発見されました ピロリ菌が胃 十二指腸かいようなどの原因になっていることがわかり ウォレンとマーシャルは 2005 年にノーベル医学生理学賞を受賞しています
ピロリ菌と胃がん ピロリ菌の早期除菌で 胃がんは予防できる ナポレオンの死因は胃癌だった!? 社内資料 ピロリ菌って何ですか ピロリ菌は正式にはヘリコバクター ピロリという細菌で 1983 年にオーストラリアのウォレンとマーシャルによって発見されました ピロリ菌が胃 十二指腸かいようなどの原因になっていることがわかり ウォレンとマーシャルは 2005 年にノーベル医学生理学賞を受賞しています
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
医薬品リスク管理計画書(本文)
 ジェブタナ点滴静注 60mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません サノフィ株式会社 ジェブタナ点滴静注 60mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 ジェブタナ点滴静注 60mg 有効成分 カバジタキセルアセトン付加物 製造販売業者 サノフィ株式会社
ジェブタナ点滴静注 60mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません サノフィ株式会社 ジェブタナ点滴静注 60mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 ジェブタナ点滴静注 60mg 有効成分 カバジタキセルアセトン付加物 製造販売業者 サノフィ株式会社
Microsoft Word - sa_niflec_ doc
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開
![審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開 審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開](/thumbs/53/31072016.jpg) 審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
PT51_p69_77.indd
 臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
タケプロンカプセル15・30/タケプロンOD錠15・30 インタビューフォーム
 OD OD Capsules, & Tablets, IF 利用の手引きの概要 日本病院薬剤師会 1. 医薬品インタビューフォーム作成の経緯医療用医薬品の基本的な要約情報として医療用医薬品添付文書 ( 以下 添付文書と略す ) がある 医療現場で医師 薬剤師等の医療従事者が日常業務に必要な医薬品の適正使用情報を活用する際には 添付文書に記載された情報を裏付ける更に詳細な情報が必要な場合がある 医療現場では
OD OD Capsules, & Tablets, IF 利用の手引きの概要 日本病院薬剤師会 1. 医薬品インタビューフォーム作成の経緯医療用医薬品の基本的な要約情報として医療用医薬品添付文書 ( 以下 添付文書と略す ) がある 医療現場で医師 薬剤師等の医療従事者が日常業務に必要な医薬品の適正使用情報を活用する際には 添付文書に記載された情報を裏付ける更に詳細な情報が必要な場合がある 医療現場では
記載データ一覧 品目名 製造販売業者 BE 品質再評価 1 マグミット錠 250mg 協和化学工業 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 # 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 # 5 酸化マグネシ
 医療用医薬品最新品質情報集 ( ブルーブック ) 2017.7.7 初版 有効成分 酸化マグネシウム 品目名 ( 製造販売業者 ) 1 マグミット錠 250mg 協和化学工業 後発医薬品 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 5 酸化マグネシウム錠 250mg ケンエー
医療用医薬品最新品質情報集 ( ブルーブック ) 2017.7.7 初版 有効成分 酸化マグネシウム 品目名 ( 製造販売業者 ) 1 マグミット錠 250mg 協和化学工業 後発医薬品 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 5 酸化マグネシウム錠 250mg ケンエー
IF 利用の手引きの概要 - 日本病院薬剤師会 - 1. 医薬品インタビューフォーム作成の経緯医療用医薬品の基本的な要約情報として医療用医薬品添付文書 ( 以下 添付文書と略す ) がある 医療現場で医師 薬剤師等の医療従事者が日常業務に必要な医薬品の適正使用情報を活用する際には 添付文書に記載され
 2018 年 11 月改訂 ( 改訂第 11 版 ) 日本標準商品分類番号 872329 医薬品インタビューフォーム日本病院薬剤師会の IF 記載要領 2008 に準拠して作成 プロトンポンプ インヒビター 日本薬局方オメプラゾール腸溶錠 剤 形腸溶性フィルムコーティング錠 製剤の規制区分処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 規格 含量 一般名 製造販売承認年月日 薬価基準収載
2018 年 11 月改訂 ( 改訂第 11 版 ) 日本標準商品分類番号 872329 医薬品インタビューフォーム日本病院薬剤師会の IF 記載要領 2008 に準拠して作成 プロトンポンプ インヒビター 日本薬局方オメプラゾール腸溶錠 剤 形腸溶性フィルムコーティング錠 製剤の規制区分処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 規格 含量 一般名 製造販売承認年月日 薬価基準収載
オメプラール錠10/オメプラール錠20
 OMP-19.1 **2015 年 1 月改訂 ( 第 26 版 ) * 2014 年 7 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 日本薬局方 プロトンポンプ インヒビター オメプラゾール腸溶錠 日本標準商品分類番号 872329 オメプラール錠 10 オメプラール錠 20 承認番号 21200AMZ00641 21300AMZ00054
OMP-19.1 **2015 年 1 月改訂 ( 第 26 版 ) * 2014 年 7 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 日本薬局方 プロトンポンプ インヒビター オメプラゾール腸溶錠 日本標準商品分類番号 872329 オメプラール錠 10 オメプラール錠 20 承認番号 21200AMZ00641 21300AMZ00054
膿疱性乾癬の効能追加 ( 承認事項の 部変更承認 ) に伴う改訂 改訂内容 ( 該当部のみ抜粋 ) 警告 1.~3. 4. 関節リウマチ患者では, 本剤の治療を行う前に, 少なくとも 1 剤の抗リウマチ薬等の使用を十分勘案すること. また, 本剤についての十分な知識とリウマチ治療の経験をもつ医師が使
 - 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
- 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
ランソプラゾールOD錠15,30mg「ケミファ」IF
 2017 年 12 月改訂 ( 第 9 版 ) 日本標準商品分類番号 872329 医薬品インタビューフォーム日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 プロトンポンプインヒビター 日本薬局方ランソプラゾール腸溶性口腔内崩壊錠 剤形素錠 ( 口腔内崩壊錠 ) 製剤の規制区分処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 規格 含量 一般名 製造販売承認年月日薬価基準収載
2017 年 12 月改訂 ( 第 9 版 ) 日本標準商品分類番号 872329 医薬品インタビューフォーム日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 プロトンポンプインヒビター 日本薬局方ランソプラゾール腸溶性口腔内崩壊錠 剤形素錠 ( 口腔内崩壊錠 ) 製剤の規制区分処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 規格 含量 一般名 製造販売承認年月日薬価基準収載
