<4D F736F F D2097CF979D88CF816991E693F1816A8B638E E7C88C E372E A2E646F63>
|
|
|
- みがね ふじした
- 4 years ago
- Views:
Transcription
1 東京大学医科学研究所倫理審査委員会第二委員会平成 28 年度第 3 回議事要旨 日 時 : 平成 28 年 7 月 21 日 ( 木 )10:00~12:10 場 所 : 旧ゲノム解析センター 2 階会議室 出 席 者 : 長村 ( 文 ) 委員長成澤 田村 須田 藤本 関 加藤 吉田 東條 田中 松田 井元の各委員 陪 席 者 : 武藤研究倫理支援室長 神里研究倫理支援室特任准教授 上原研究支援課長 研究推進チーム金沢主任 佐々木一般職員 議事に先立ち 研究倫理支援室長武藤香織教授より AMED 再生医療実現化ハイウェイ ( 課題 D) における倫理審査委員養成講座より共同実施者及び受講者 3 名について 守秘義務締結の上での傍聴の依頼があり 委員長が許可した ( 議事 ) 1. 倫理審査申請書の審査について (1)28-21 悪液質を有するがん患者の QOL 評価における EORTC がん悪液質モジュール (EORTC QLQ-CAX24) ならびに EORTC QLQ-C30 質問票の信頼性と有効性についての国際共同研究 (Phase IV study) ( 新規 ) ( 申請者 : 緩和医療科 特任助教 石木寛人 ) 本件の申請内容について 申請者である石木寛人特任助教より説明があった 次いで 申請者が変更できる質問票様式の範囲 研究従事者の利益相反関係等について質疑応答があった 審議の結果 以下の点を修正することを条件に承認することとした 6.2) 研究費の出途と使用期限 について 研究費の使用期限を研究期間と整合させること 2 説明文書について 以下の点を修正すること 文書を作成した日付を記載し 欧州がん研究治療機関へ提出する同意文書の記載と整合させること 研究の方法 5 の 質問票調査を依頼する期間について 4. 方法 ( 図参照 ) と統一すること 研究の方法 に 質問票の正式名称で以後使用する略称を記載すること 4. 方法 ( 図参照 )2 の 症状 を 症状チェックリスト に修正すること また 2 回目の質問票調査を依頼する研究協力者の選定基準を記載すること 6. 研究担当者と役割 の < 研究メンバー > の氏名の記載を修正すること また 国際事務局 について名称を記載し 共同研究機関及び共同研究者についても具体的に記載すること 6.(3) データ入力 に関して 個人情報保護責任者が個人情報を匿名化するよう記載を修正すること 7. 利益と危険性 の 質問票 について具体的に名称を記載すること 8. プライバシーは保護されます の 研究事務局 について具体的に名称を記載すること また 当セ院 ~ の誤記を修正すること 9. 本研究のための費用について の 当科 の名称を具体的に記載すること 10. 利益相反 の 当施設 について具体的に記載すること また企業との利益相反の有無について確認し 必要に応じて記載すること 11. 本研究のサポート体制について の標題と記載の内容を整合させること
2 12. 研究結果の公表について の 本研究の成果により特許権が生み出された場合 の権利について 欧州がん研究治療機関に確認し記載すること 13. 参加される皆さんの人権は守られています について 人権 がさす内容を確認し 必要に応じて記載を修正すること 以上の内容について ~ の または記名 押印 の記載を削除すること 3 本研究所附属病院への同意文書について 研究課題名に本研究の正式課題名を追記すること 4 本研究所附属病院への同意撤回文書について 研究課題名に本研究の正式課題名を追記すること また 担当医 担当医師 の記載を統一すること 5 EORTC への同意文書について 以下の点を修正すること 行政当局 研究後援者 について 該当の名称を具体的に記載すること またそれらの者には守秘義務があるため 研究協力者のプライバシーは保護される旨も記載すること 匿名であなたのご意見や感想が ~ を 匿名でわたしの意見や感想が ~ に修正すること (2)28-23 大腸癌腫瘍組織および培養大腸癌細胞を用いた大腸癌の病態解明と治療法開発に関する研究 ( 新規 ) ( 申請者 : 外科 准教授 篠崎大 ) 本件について 研究分担者である立野陽子医学系研究科大学院生から申請内容について説明があった 次いで 本研究所附属病院での大学院生の診療資格 腫瘍細胞 に 幹細胞 も含めているかどうか 細胞バンクに寄託する際の匿名化の方針等について質疑応答があった 審議の結果 以下の点を修正することを条件に承認することとした 2 1 目的 に がん幹細胞 ウイルス療法 等の内容も盛り込み より具体的な記載とすること 2 3 1)< 有効な同意が得られるか?> について 代諾の必要な研究協力者の見込み数を記載すること また 有効な同意が得られにくいと判断される者を対象に含む理由 について記載すること 6 1) 研究結果の個別開示方針 に 非開示とする理由をより詳しく記載すること 2 説明文書について 以下の点を修正すること 研究の目的と方法 に ウイルス療法を行う旨を記載し 申請書の記載と整合させること また あなたの癌組織の ~ の誤記を修正し 文頭に この研究では を入れる等 表現を柔らかくすること また研究に免疫不全マウスを使用する旨を記載すること 細胞バンクへの細胞寄託の可能性 について 組織バンク の誤記を修正すること また寄託の際は個人情報を匿名化する旨を記載すること 3 同意文書について 以下の点を修正すること 細胞を細胞バンクへ寄託した場合 同意の撤回ができない可能性がある旨を記載すること 代諾者自署欄に 研究協力者との続柄を記載する項目を設けること
3 (3)28-19 ( 審査依頼 ) 任意型検診における新規健康マーカーの探索 ( 新規 ) ( 申請者 : 先端ゲノム医学分野 准教授 加藤直也 ) 本件について 研究分担者である中川良特任研究員から申請内容について説明があった 次いで 検証に必要な血液の量 今後の研究費の追加の予定 研究協力者のゲノム解析を行うかどうか 対照実験の有無 特許 知財の取扱等について質疑応答があった 審議の結果 以下の点を修正することを条件に承認することとした 研究課題名を研究のデザイン 実態と合わせて必要に応じて修正すること 1. 研究課題名 を表紙の記載と統一すること 2 4 研究参加者の実体験 について 本施設 の具体的な名称を記載すること 4 2 2)1 匿名化の実施場所 方針 の 医科研において の記載を 実態に合わせて修正すること 2 説明文書について 以下の点を修正すること << 研究協力の任意性と同意撤回の自由 >> の 必要事項をご記入 ご署名の上 受付に ~ の記載と 同意撤回文書の お手数ですが ~ の記載を整合させ 郵送での提出も可能である旨を記載すること 研究の目的と方法 の そういった新しい検査法の ~ の誤記を修正すること 研究期間 の 当クリニック理事長による の記載を 本研究所長による に修正すること 漀 研究結果の公表 の 本研究で一定の成果が得られた場合 について 成果が得られない場合も公表することよう 記載を修正すること 結果の開示 について ただし ~ の一文を削除し 申請書 2 2< 対象者に予測される利益 不利益 > に記載されている 解析結果により生命に関わる疾患が ~ の内容を記載すること またその内容を同意文書にも記載し 生命に関わる疾患が発見された場合でも知らせてほしくない研究協力者に配慮すること 研究に協力することによる利益と不利益 について また 本研究のために ~ の文章を意味が通じるように修正すること その他 の この研究は ~ に記載された 東大 の記載を 東京大学 とし他の表記と統一すること 以上の点をご理解いただいた上 ~ の重複を削除すること < ご質問 苦情等に関する連絡先 > について 申請者が本研究所の研究責任者であることがわかるよう記載すること 3 同意文書について 説明を受け理解した項目 の 資料及び情報の二次利用 の記載を削除すること 4 対象者募集用ポスターについて 新しい検査法の実用化に向け ~ の誤記を修正すること
4 5 共同研究機関からの審査依頼について 文書の日付を修正すること 6 アンケート調査票について 以下の点を修正すること 調査 1 (1) 労働時間は平均的な日で 1 日何時間ですか の項目等について 必要に応じて 就労していない研究協力者もいることを考慮して修正すること 調査 3 1 の しごと の記載を漢字に修正すること なお 共同研究機関に通知する審査結果には 利益相反 研究倫理教育等の管理については先方機関に一任する旨を付記することとした (4)28-20 ヒト樹状細胞を用いたワクチン開発の基礎解析 ( 新規 ) ( 申請者 : 自然免疫制御分野 特任助教 武村直紀 ) 本件について 申請者である武村直紀特任助教から申請内容について説明があった 審議の結果 以下の点を修正することを条件に承認することとした 2 2 方法 について 採血量によって解析できる内容が異なること 研究協力者の希望で採血量を選択できることがわかるよう修正すること 匿名化の方針について研究デザインに合わせて検討し 必要に応じて該当箇所を修正すること 2 フローチャートについて 申請者あるいは健常人ボランティアから ~ の記載を 申請者及び ~ に修正すること 3 説明文書について 以下の点を修正すること 研究の概要 について 樹状細胞は ~ 記載を 研究協力者がより理解しやすい表現に修正すること 研究期間 の 倫理審査委員会承認日 を 所長承認日 に修正すること ご協力いただきたい内容と方法 について 血液約 10~50cc 分 の 分 を削除す ること また採血量に幅があるため 採血量によって解析できる内容が異なること 研究協力者の希望で採血量を選択できることがわかるよう修正すること その他 の 1 点目について ご希望があれば ~ の記載を削除すること その他 の 2 点目について 支出され のあとに 利益相反に関しては と記載するこ と また 利益相反関係の管理 の後の 印に関し 削除するか注釈を記載すること 4 募集ポスターの 募集人数 対象 について 性別は問わず もしくは ( 男女問わず ) いずれかの記載を削除すること また複数回採血する可能性がある旨を記載すること (5)27-19 臨床検体を用いた血液細胞の表面マーカー解析 ( 変更 ) ( 申請者 : 血液腫瘍内科 助教 小沼貴晶 ) 本件について 申請者である小沼貴晶助教から変更内容について説明があった 次いで 匿名化の方針等について質疑応答があった 審議の結果 以下の点を修正することを条件に承認することとした なお 東條委員は本研究の研究従事者であるため 本件の審議 採決に不参加
5 であった 企業に所属する研究分担者を所外研究関係者として記載すること 2 4 2) 健常人ボランティア について 本研究における 健常ボランティア の定義を記載すること 4 2 2)2 匿名化の方法 の記載について 患者と健常人ボランティアの匿名化の方法が混在しないよう整理して記載すること 6. 備考 3) 利益相反 について 研究分担者の所属する企業との利益相反関係を記載すること 3 説明文書について 以下の点を修正すること 研究の概要 の 器械 の記載を 機械 に修正すること ご協力いただきたい内容と方法 について 研究期間中に複数回の採血を依頼する可能性がある旨を記載すること その他 について 研究分担者の所属する企業との利益相反関係について記載すること 4 募集ポスターについて 研究協力者に研究期間中に複数回の採血を依頼する可能性がある旨を記載すること (6)27-32 ips 細胞を活用した血液 免疫難病に対する革新的治療薬の開発 ( 変更 ) ( 申請者 :ALA 先端医療学社会連携部門 特任教授 谷憲三朗 ) 本件について 申請者である谷憲三朗特任教授 研究分担者である小原洋志特任講師から変更内容について説明があった 審議の結果 以下の点を修正することを条件に承認することとした 1 申請書について 2 4 組織採取の場所 の ( 採血に限る ) について 当該共同研究機関にて骨髄も採取する可能性がある場合には削除すること 2. 迅速審査の報告 委員長から 以下の申請について迅速審査により承認された旨説明があり 了承された 27-47( 変更 ) ヒト腸管に存在する微生物群の解析 ( 申請者 : システム免疫学社会連携研究部門 特任准教授 佐藤毅史 ) 28-8 ワルデンシュトレームマクログロブリン血症に関する多施設共同後方視的調査研究 ( 申請者 : 分子療法分野 教授 東條有伸 ) 抗 HIV 療法開始 変更前後の臨床経過の検討 ( 申請者 : 感染症分野 助教 菊地正 ) ( 変更 ) 抗 HIV 療法開始 変更前後の臨床経過の検討 ( 申請者 : 感染症分野 助教 菊地正 ) 造血器疾患患者の転倒要因調査 ( 申請者 : 看護部 看護師 三輪依子 )
6 3. 前回議事要旨の確認 4. その他審査依頼を出した共同研究機関での研究従事者の利益相反や研究倫理教育の有無を本委員会でどのように扱うかについて議論が行われた また 書類のコピーが不鮮明であること 文字のフォントが小さいことについて 委員より指摘があった 以上
1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後 予測因子および副作用発現の危険因子についての探索的研究 (JACCRO GC-07AR) という臨床研究について説明したものです この文書と私の説明のな かで わかりにくいと
 StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
する 研究実施施設の環境 ( プライバシーの保護状態 ) について記載する < 実施方法 > どのような手順で研究を実施するのかを具体的に記載する アンケート等を用いる場合は 事前にそれらに要する時間を測定し 調査による患者への負担の度合いがわかるように記載する 調査手順で担当が複数名いる場合には
 参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
6. 研究が終わった後 血液を他の研究に使わせてください 詳しくは ページへ 病には未解決の部分がまだ多く残っています 今後のさらなる研究のため ご協力をお願いいたします ( 必要に応じて ) バンク事業へのご協力をお願いします 遺伝子を扱う研究を推進するため 多くの人の遺伝子の情報を集めて研究に使
 赤字で示した部分はポイントとして挙げています適当な言葉を入れたあと 削除してください * ヘッダーに研究名とバージョンを記載 * 研究内容に合わせて適切に変更してください 要約口頭説明に利用コントロール用 研究名 研究参加のお願い 1. 研究の目的 詳しくは ページへ 病は という病気です ( 疾患の簡単な説明 ) 病については ということを調べ に役立てたいと考えて います 遺伝子って何?( 必要に応じて
赤字で示した部分はポイントとして挙げています適当な言葉を入れたあと 削除してください * ヘッダーに研究名とバージョンを記載 * 研究内容に合わせて適切に変更してください 要約口頭説明に利用コントロール用 研究名 研究参加のお願い 1. 研究の目的 詳しくは ページへ 病は という病気です ( 疾患の簡単な説明 ) 病については ということを調べ に役立てたいと考えて います 遺伝子って何?( 必要に応じて
<4D F736F F D20819B8CA48B868C7689E68F D A8CA9967B5F E646F63>
 研究計画書 本委員会ではゲノム解析研究を審査対象としている 臨床試験などは対象とならないため, 試験計画 ではない 以下, 計画書では 研究 を使用する 委員には, 医学の専門外の方もいます 研究計画は専門外の者にも理解しやすいように, 平易な表現で分かり易く記載する 研究課題名 : 1. 提供者を選ぶ方針 申請者氏名 ( 所属 職名 ): 合理的に選択していることが分かる具体的な方法を記載する 提供者が疾病や薬剤反応性異常を有する場合等にあっては,
研究計画書 本委員会ではゲノム解析研究を審査対象としている 臨床試験などは対象とならないため, 試験計画 ではない 以下, 計画書では 研究 を使用する 委員には, 医学の専門外の方もいます 研究計画は専門外の者にも理解しやすいように, 平易な表現で分かり易く記載する 研究課題名 : 1. 提供者を選ぶ方針 申請者氏名 ( 所属 職名 ): 合理的に選択していることが分かる具体的な方法を記載する 提供者が疾病や薬剤反応性異常を有する場合等にあっては,
血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 に関する説明書 一般財団法人脳神経疾患研究所先端医療研究センター 所属長衞藤義勝 この説明書は 血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 の内容について説明したものです この研究についてご理解 ご賛同いただける場合は, 被
 血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 に関する説明書 一般財団法人脳神経疾患研究所先端医療研究センター 所属長衞藤義勝 この説明書は 血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 の内容について説明したものです この研究についてご理解 ご賛同いただける場合は, 被験者 ( 研究の対象者 ) として研究にご参加くださいますようお願い申し上げます この研究に参加されない場合でも,
血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 に関する説明書 一般財団法人脳神経疾患研究所先端医療研究センター 所属長衞藤義勝 この説明書は 血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 の内容について説明したものです この研究についてご理解 ご賛同いただける場合は, 被験者 ( 研究の対象者 ) として研究にご参加くださいますようお願い申し上げます この研究に参加されない場合でも,
同意説明文書(見本)
 同意説明文書 患者さんへ 膠原病の皮膚症状と血管障害の関連性について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者群馬大学大学院医学系研究科皮膚科学講師茂木精一郎 臨床研究責任医師群馬大学大学院医学系研究科皮膚科学講師茂木精一郎
同意説明文書 患者さんへ 膠原病の皮膚症状と血管障害の関連性について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者群馬大学大学院医学系研究科皮膚科学講師茂木精一郎 臨床研究責任医師群馬大学大学院医学系研究科皮膚科学講師茂木精一郎
ただし 対象となることを希望されないご連絡が 2016 年 5 月 31 日以降にな った場合には 研究に使用される可能性があることをご了承ください 研究期間 研究を行う期間は医学部長承認日より 2019 年 3 月 31 日までです 研究に用いる試料 情報の項目群馬大学医学部附属病院産科婦人科で行
 人を対象とする医学系研究についての 情報公開文書 研究課題名 : 予定帝王切開における脊椎麻酔による血圧変動と出生後の児への影響についての検討 はじめに現在 日本のほとんどの施設の標準的な麻酔方法は脊椎麻酔であり 当院でも帝王切開に対する標準的な麻酔方法を脊椎麻酔としています 脊椎麻酔では全身麻酔と比較し児への麻酔の影響が少ないとされていますが 麻酔導入後のお母さんの血圧低下を認めることが多く その際に赤ちゃんへどのような影響があるかは明らかにされていません
人を対象とする医学系研究についての 情報公開文書 研究課題名 : 予定帝王切開における脊椎麻酔による血圧変動と出生後の児への影響についての検討 はじめに現在 日本のほとんどの施設の標準的な麻酔方法は脊椎麻酔であり 当院でも帝王切開に対する標準的な麻酔方法を脊椎麻酔としています 脊椎麻酔では全身麻酔と比較し児への麻酔の影響が少ないとされていますが 麻酔導入後のお母さんの血圧低下を認めることが多く その際に赤ちゃんへどのような影響があるかは明らかにされていません
臨床研究の概要および研究計画
 別紙第 2 説明書 1 原発性免疫不全症の早期診断法について ( 臍帯血採取用 ) 原発性免疫不全症は 免疫系を作るプログラムが一部障害されたために起こる疾患です 感染に対する抵抗力が極めて弱く 乳児期に重症の感染症を起こして発見される場合もあります 早期に適切な治療が施されなければ命に関わる疾患ですが 早期発見および早期治療により重症化を防ぐことができ 最近では造血幹細胞移植により根治も可能となってきました
別紙第 2 説明書 1 原発性免疫不全症の早期診断法について ( 臍帯血採取用 ) 原発性免疫不全症は 免疫系を作るプログラムが一部障害されたために起こる疾患です 感染に対する抵抗力が極めて弱く 乳児期に重症の感染症を起こして発見される場合もあります 早期に適切な治療が施されなければ命に関わる疾患ですが 早期発見および早期治療により重症化を防ぐことができ 最近では造血幹細胞移植により根治も可能となってきました
Microsoft Word - *Xpert Flu検討 患者用説明書 修正.docx
 患者さんへ 自主臨床研究 全自動遺伝子解析装置におけるインフルエンザ試薬の性 能評価 についてのご説明 札幌医科大学附属病院 作成年月日 :2019 年 1 月 25 日 第 3 版 1 1. はじめに 臨床研究により新しい治療法を確立することは大学病院の使命であり 患者さんのご協力により成し遂げることができるものです 今回参加をお願いする臨床研究は 自主臨床研究 と呼ばれるもので 実際の診療に携わる医師が医学的必要性
患者さんへ 自主臨床研究 全自動遺伝子解析装置におけるインフルエンザ試薬の性 能評価 についてのご説明 札幌医科大学附属病院 作成年月日 :2019 年 1 月 25 日 第 3 版 1 1. はじめに 臨床研究により新しい治療法を確立することは大学病院の使命であり 患者さんのご協力により成し遂げることができるものです 今回参加をお願いする臨床研究は 自主臨床研究 と呼ばれるもので 実際の診療に携わる医師が医学的必要性
(目的)
 計画書作成時留意点 計画書は医療関係者以外の方からも審査されます 医療関係者以外の方がみて理解でき るように配慮してください また 各項目は簡潔に記載してください 項目の幅は自由 に広げていただいて結構です 多くの研究は患者様に参加を求めるわけですから あくまで自由意思で参加する環境を 作ることが倫理性を評価するうえで大切になります 研究参加者に加わる危害をいかに 減らすか 最小限にしたときの研究参加者の受ける侵襲と研究から得られる社会的効果
計画書作成時留意点 計画書は医療関係者以外の方からも審査されます 医療関係者以外の方がみて理解でき るように配慮してください また 各項目は簡潔に記載してください 項目の幅は自由 に広げていただいて結構です 多くの研究は患者様に参加を求めるわけですから あくまで自由意思で参加する環境を 作ることが倫理性を評価するうえで大切になります 研究参加者に加わる危害をいかに 減らすか 最小限にしたときの研究参加者の受ける侵襲と研究から得られる社会的効果
認定議事概要10月分(固定版).docx
 滋賀医科大学臨床研究審査委員会議事 日時 : 2018 年 10 月 23 日 ( 火 )15:10~16:53 場所 : マルチメディアセンター会議室 D 委員 氏名 属性 性別 利害関係 出欠 委員長 伊藤俊之 1 男 有 出 委員 小原有弘 1 男 無 出 南学 1 男 無 出 平田多佳子 1 女 有 欠 田邉昇 2 男 無 出 藤田みさお 2 女 無 出 中野由紀子 3 女 無 出 宮本健二郎
滋賀医科大学臨床研究審査委員会議事 日時 : 2018 年 10 月 23 日 ( 火 )15:10~16:53 場所 : マルチメディアセンター会議室 D 委員 氏名 属性 性別 利害関係 出欠 委員長 伊藤俊之 1 男 有 出 委員 小原有弘 1 男 無 出 南学 1 男 無 出 平田多佳子 1 女 有 欠 田邉昇 2 男 無 出 藤田みさお 2 女 無 出 中野由紀子 3 女 無 出 宮本健二郎
再発小児 B 前駆細胞性急性リンパ性白血病におけるキメラ遺伝子の探索 ( この研究は 小児白血病リンパ腫研究グループ (JPLSG)ALL-B12 治療研究の付随研究として行われます ) 研究機関名及び研究責任者氏名 この研究が行われる研究機関と研究責任者は次に示す通りです 研究代表者眞田昌国立病院
 < 小児 B 前駆細胞性急性リンパ性白血病に対する 多施設共同臨床試験 (ALL-B12 研究 ) に参加された方へ > 研究課題 再発小児 B 前駆細胞性急性リンパ性白血病におけるキメラ遺伝子の探索 への保存検体の使用について 日本小児白血病リンパ腫研究グループ (JPLSG) が行っております小児 B 前駆細胞性急性リンパ性白血病に対する多施設共同臨床試験 (ALL-B12 研究 ) に参加された患者さんの中で検体提供への同意を文書で頂いている方につきましては
< 小児 B 前駆細胞性急性リンパ性白血病に対する 多施設共同臨床試験 (ALL-B12 研究 ) に参加された方へ > 研究課題 再発小児 B 前駆細胞性急性リンパ性白血病におけるキメラ遺伝子の探索 への保存検体の使用について 日本小児白血病リンパ腫研究グループ (JPLSG) が行っております小児 B 前駆細胞性急性リンパ性白血病に対する多施設共同臨床試験 (ALL-B12 研究 ) に参加された患者さんの中で検体提供への同意を文書で頂いている方につきましては
群馬大学人を対象とする医学系研究倫理審査委員会 _ 情報公開 通知文書 人を対象とする医学系研究についての 情報公開文書 研究課題名 : がんサバイバーの出産の実際調査 はじめに近年 がん治療の進歩によりがん治療後に長期間生存できる いわゆる若年のがんサバイバーが増加しています これらのがんサバイバ
 人を対象とする医学系研究についての 情報公開文書 研究課題名 : がんサバイバーの出産の実際調査 はじめに近年 がん治療の進歩によりがん治療後に長期間生存できる いわゆる若年のがんサバイバーが増加しています これらのがんサバイバーにおいて生命の質の維持 向上は重要な問題で 中でもがん治療による妊孕性 ( 将来の妊娠の可能性 ) への影響は人生を左右する大きな問題と考えられますが 我が国においては がん患者の妊孕性温存治療に対する一定の指針がないのが現状です
人を対象とする医学系研究についての 情報公開文書 研究課題名 : がんサバイバーの出産の実際調査 はじめに近年 がん治療の進歩によりがん治療後に長期間生存できる いわゆる若年のがんサバイバーが増加しています これらのがんサバイバーにおいて生命の質の維持 向上は重要な問題で 中でもがん治療による妊孕性 ( 将来の妊娠の可能性 ) への影響は人生を左右する大きな問題と考えられますが 我が国においては がん患者の妊孕性温存治療に対する一定の指針がないのが現状です
疫学研究の病院HPによる情報公開 様式の作成について
 阪大版 課題名 新薬創出を加速する人工知能の開発 研究対象者 呼吸器系 免疫疾患における細胞外小胞に着目した病態解明及び診断法の開発 にご協力いただきました患者さま 2012 年 4 月 1 日から 2019 年 3 月 31 日までの期間に大阪大学医学部附属病院内において 間質性肺炎 並びに 特発性肺線維症 と診断されて 研究課題名 呼吸器系 免疫疾患における細胞外小胞に着目した病態解明及び診断法の開発
阪大版 課題名 新薬創出を加速する人工知能の開発 研究対象者 呼吸器系 免疫疾患における細胞外小胞に着目した病態解明及び診断法の開発 にご協力いただきました患者さま 2012 年 4 月 1 日から 2019 年 3 月 31 日までの期間に大阪大学医学部附属病院内において 間質性肺炎 並びに 特発性肺線維症 と診断されて 研究課題名 呼吸器系 免疫疾患における細胞外小胞に着目した病態解明及び診断法の開発
九州大学病院の遺伝子治療臨床研究実施計画(慢性重症虚血肢(閉塞
 平成 23 年 2 月 7 日 東京大学医科学研究所附属病院から申請のあったヒト幹細胞臨床研究実施計画に係る意見について ヒト幹細胞臨床研究に関する審査委員会委員長永井良三 東京大学医科学研究所附属病院から申請のあった下記のヒト幹細胞臨床研究実施計画について 本審査委員会で検討を行い その結果を別紙のとおりとりまとめたので報告いたします 記 1. 自己骨髄由来培養骨芽細胞様細胞を用いた歯槽骨再生法の検討
平成 23 年 2 月 7 日 東京大学医科学研究所附属病院から申請のあったヒト幹細胞臨床研究実施計画に係る意見について ヒト幹細胞臨床研究に関する審査委員会委員長永井良三 東京大学医科学研究所附属病院から申請のあった下記のヒト幹細胞臨床研究実施計画について 本審査委員会で検討を行い その結果を別紙のとおりとりまとめたので報告いたします 記 1. 自己骨髄由来培養骨芽細胞様細胞を用いた歯槽骨再生法の検討
臨床研究実施計画書
 心臓超音波検査を用いた臨床研究について 御理解 御協力いただける方へ 心エコー図法による心不全患者の予後予測に 関する研究 に関する説明 これは心臓超音波検査の所見の一部を用いた臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうかお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者 群馬大学医学部附属病院循環器内科
心臓超音波検査を用いた臨床研究について 御理解 御協力いただける方へ 心エコー図法による心不全患者の予後予測に 関する研究 に関する説明 これは心臓超音波検査の所見の一部を用いた臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうかお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者 群馬大学医学部附属病院循環器内科
料 情報の提供に関する記録 を作成する方法 ( 作成する時期 記録の媒体 作成する研究者等の氏名 別に作成する書類による代用の有無等 ) 及び保管する方法 ( 場所 第 12 の1⑴の解説 5に規定する提供元の機関における義務 8 個人情報等の取扱い ( 匿名化する場合にはその方法等を含む ) 9
 北里研究所病院研究倫理委員会研究申請時確認シート ( 補助資料 ) 20170425 Ver.2.0 < 研究計画書の確認 > 記載項目 1 研究の名称 2 研究の実施体制 ( 研究機関の名称及び研究者等の氏名を含む ) 3 研究の目的及び意義 4 研究の方法及び期間 5 研究対象者の選定方針 6 研究の科学的合理性の根拠 7インフォームド コンセントを受ける手続等 ( インフォームド コンセントを受ける場合には
北里研究所病院研究倫理委員会研究申請時確認シート ( 補助資料 ) 20170425 Ver.2.0 < 研究計画書の確認 > 記載項目 1 研究の名称 2 研究の実施体制 ( 研究機関の名称及び研究者等の氏名を含む ) 3 研究の目的及び意義 4 研究の方法及び期間 5 研究対象者の選定方針 6 研究の科学的合理性の根拠 7インフォームド コンセントを受ける手続等 ( インフォームド コンセントを受ける場合には
臨床研究に参加される研究対象者の方へ 皮膚症状を呈する膠原病における炎症性サイトカインの病態への関与について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さ
 臨床研究に参加される研究対象者の方へ 皮膚症状を呈する膠原病における炎症性サイトカインの病態への関与について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者群馬大学大学院医学系研究科皮膚科学茂木精一郎臨床研究責任医師群馬大学大学院医学系研究科皮膚科学茂木精一郎
臨床研究に参加される研究対象者の方へ 皮膚症状を呈する膠原病における炎症性サイトカインの病態への関与について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者群馬大学大学院医学系研究科皮膚科学茂木精一郎臨床研究責任医師群馬大学大学院医学系研究科皮膚科学茂木精一郎
特定臨床研究に関する手順書
 学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
標準業務手順 目次
 浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下
 北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
埼玉医科大学倫理委員会
 全国大腸癌肝転移登録事業および登録情報に基づく研究 研究計画書 研究責任者 埼玉医科大学総合医療センター消化管 一般外科 石橋敬一郎 Version 1.0 2017 年 10 月 31 日 0 1. 研究の名称 全国大腸癌肝転移登録事業および登録情報に基づく研究 2. 研究組織について研究代表者 : 大腸癌研究会大腸癌肝転移データベース合同委員会委員長高橋慶一がん 感染症センター都立駒込病院外科副委員長山本雅一東京女子医科大学消化器外科研究事務局
全国大腸癌肝転移登録事業および登録情報に基づく研究 研究計画書 研究責任者 埼玉医科大学総合医療センター消化管 一般外科 石橋敬一郎 Version 1.0 2017 年 10 月 31 日 0 1. 研究の名称 全国大腸癌肝転移登録事業および登録情報に基づく研究 2. 研究組織について研究代表者 : 大腸癌研究会大腸癌肝転移データベース合同委員会委員長高橋慶一がん 感染症センター都立駒込病院外科副委員長山本雅一東京女子医科大学消化器外科研究事務局
目次 1. はじめに 1 2. 研究課題の倫理審査について 2 3. プライバシーの保護について 2 4. 提供試料の解析 / 分析等について 3 5. 研究課題と成果等の公表について 3 6. 追加の採血について 3 7. 過去の研究に提供した試料等の保管について 4 8. 試料 診療情報の提供先
 バイオバンク事業へのご協力のお願い ( 同意説明書 ) 国立研究開発法人国立長寿医療研究センター メディカルゲノムセンター 説明書 A3.1 目次 1. はじめに 1 2. 研究課題の倫理審査について 2 3. プライバシーの保護について 2 4. 提供試料の解析 / 分析等について 3 5. 研究課題と成果等の公表について 3 6. 追加の採血について 3 7. 過去の研究に提供した試料等の保管について
バイオバンク事業へのご協力のお願い ( 同意説明書 ) 国立研究開発法人国立長寿医療研究センター メディカルゲノムセンター 説明書 A3.1 目次 1. はじめに 1 2. 研究課題の倫理審査について 2 3. プライバシーの保護について 2 4. 提供試料の解析 / 分析等について 3 5. 研究課題と成果等の公表について 3 6. 追加の採血について 3 7. 過去の研究に提供した試料等の保管について
臨床研究許可申請書の提出に際しての留意事項
 患者さん ( 患者さんのご家族 ) へ ICU における睡眠障害およびせん妄に対する予防的介入の効果 多施設共同臨床研究 についての説明文書 1 これからあなたに この臨床研究等への参加をお願いするため 研究の内容や参加に同意していただくための手続きなどについて説明します この説明を十分理解し 研究に参加しても良いと考えられた場合には 説明を受け理解された 研究参加同意書 の中の項目の にご自分でチェックのうえ
患者さん ( 患者さんのご家族 ) へ ICU における睡眠障害およびせん妄に対する予防的介入の効果 多施設共同臨床研究 についての説明文書 1 これからあなたに この臨床研究等への参加をお願いするため 研究の内容や参加に同意していただくための手続きなどについて説明します この説明を十分理解し 研究に参加しても良いと考えられた場合には 説明を受け理解された 研究参加同意書 の中の項目の にご自分でチェックのうえ
Microsoft Word - JONIE-TR 患者説明書.docx
 患者さんへ :JONIE-1 試験の付随研究の説明 原発乳癌に対する術前化学療法にゾレドロン酸併用のランダム化比較試験にご参加いただいた患者様に 本試験の付随研究としてゾレドロン酸の治療効果を予測する仕組みを解明するために以下の追加研究を計画しましたのご報告するとともに すでに各病院にて保管されています病理組織検体を利用させて頂くことに関してご理解いただきたく存じます 研究対象は組織検体ですので
患者さんへ :JONIE-1 試験の付随研究の説明 原発乳癌に対する術前化学療法にゾレドロン酸併用のランダム化比較試験にご参加いただいた患者様に 本試験の付随研究としてゾレドロン酸の治療効果を予測する仕組みを解明するために以下の追加研究を計画しましたのご報告するとともに すでに各病院にて保管されています病理組織検体を利用させて頂くことに関してご理解いただきたく存じます 研究対象は組織検体ですので
倫理委員会審査手順書
 昭和大学歯科病院 臨床研究申請手順書 昭和大学歯科病院 臨床試験支援室 2015 年 4 月 1 日 平成 27 年 4 月から 人を対象とする医学系研究に関する倫理指針 が施行され 臨床研究を行う場合 被験者を保護し その尊厳及び人権を尊重しつつ 一層の適正な推進を図ることが求められております 昭和大学歯科病院臨床試験審査委員会においても改正された指針に適合した運用を行いますので 下記の申請手順を確認し
昭和大学歯科病院 臨床研究申請手順書 昭和大学歯科病院 臨床試験支援室 2015 年 4 月 1 日 平成 27 年 4 月から 人を対象とする医学系研究に関する倫理指針 が施行され 臨床研究を行う場合 被験者を保護し その尊厳及び人権を尊重しつつ 一層の適正な推進を図ることが求められております 昭和大学歯科病院臨床試験審査委員会においても改正された指針に適合した運用を行いますので 下記の申請手順を確認し
( 委員以外の者の出席 ) 第 5 条委員長は 必要に応じ当該研究に必要な知見及び専門知識を持つ教員 産業医または看護師等を委員会の同意を得て出席させ 意見を聴くことができる ただし 上記の者の出席が困難な場合は 委員長又は委員長が指名した者が口頭等で意見を聴取し 委員会で報告することができる (
 一関工業高等専門学校における人を対象とする研究倫理審査委員会規則 ( 平成 28 年 6 月 9 日制定 ) ( 設置 ) 第 1 条一関工業高等専門学校 ( 以下 本校 という ) に, 人を対象とする研究における研究倫理について審査するため, 人を対象とする研究倫理審査委員会 ( 以下 委員会 という ) を置く ( 目的 ) 第 2 条委員会は, 本校における人を対象とする研究が, 独立行政法人国立高等専門学校機構における研究者等の行動規範
一関工業高等専門学校における人を対象とする研究倫理審査委員会規則 ( 平成 28 年 6 月 9 日制定 ) ( 設置 ) 第 1 条一関工業高等専門学校 ( 以下 本校 という ) に, 人を対象とする研究における研究倫理について審査するため, 人を対象とする研究倫理審査委員会 ( 以下 委員会 という ) を置く ( 目的 ) 第 2 条委員会は, 本校における人を対象とする研究が, 独立行政法人国立高等専門学校機構における研究者等の行動規範
<4D F736F F D2090BB91A294CC94848CE392B28DB8905C90BF8E9E92F18F6F8F9197DE82A882E682D1928D88D38E968D E48DEC90AC816A
 申請時提出書類 ( 新規 ) 医薬品等の製造販売後調査実施依頼申請書 様式第 1 ( 以下 依頼書 ) 医薬品等の製造販売後調査実施申請書 様式第 2 ( 以下 申請書 ) 医薬品等の製造販売後調査実施に関する通知書 ( 病院用 依頼者用 ) 様式第 3 様式第 4 ( 以下 通知書 ) 医薬品等の製造販売後調査実施契約書 ( 病院用 依頼者用 ) 様式第 5 様式第 5の2 ( 以下 契約書 )
申請時提出書類 ( 新規 ) 医薬品等の製造販売後調査実施依頼申請書 様式第 1 ( 以下 依頼書 ) 医薬品等の製造販売後調査実施申請書 様式第 2 ( 以下 申請書 ) 医薬品等の製造販売後調査実施に関する通知書 ( 病院用 依頼者用 ) 様式第 3 様式第 4 ( 以下 通知書 ) 医薬品等の製造販売後調査実施契約書 ( 病院用 依頼者用 ) 様式第 5 様式第 5の2 ( 以下 契約書 )
<4D F736F F D F82A482C C B835E B83588CA48B C668DDA95B68F912E646F6378>
 うつ不安の患者自主登録データベース研究 の説明書 本文書は, あなたに研究内容, 同意に関する事柄などについて説明したものです この研究は千葉大学大学院医学研究院の倫理審査委員会で, 人権擁護の面を含めその倫理性について検討を受け承認されております この文書をよく理解した上であなたが研究に同意していただける場合には, うつ不安レコード アプリをダウンロードして 研究参加の同意 の画面で同意ボタンを押して回答をお願いいたします
うつ不安の患者自主登録データベース研究 の説明書 本文書は, あなたに研究内容, 同意に関する事柄などについて説明したものです この研究は千葉大学大学院医学研究院の倫理審査委員会で, 人権擁護の面を含めその倫理性について検討を受け承認されております この文書をよく理解した上であなたが研究に同意していただける場合には, うつ不安レコード アプリをダウンロードして 研究参加の同意 の画面で同意ボタンを押して回答をお願いいたします
研究課題名 臨床研究実施計画書 研究責任者 : 独立行政法人地域医療推進機構群馬中央病院 群馬県前橋市紅雲町 1 丁目 7 番 13 号 Tel: ( 内線 )Fax: 臨床研究期間 : 年月 ~ 年月 作成日 : 年月日 ( 第 版
 臨床研究実施計画書ひな型 第 1.1 版平成 28 年 4 月 28 日 黒字 : テンプレート部分 ( ほぼそのまま使用できるもの ) 赤字 : 解説部分 ( 手引きとしての説明であり 研究実施計画書完成時には削除されるもの ) 青字 : 記載例 ( 文章や表の例であり 修飾して使用が可能なもの ) 研究課題名 臨床研究実施計画書 研究責任者 : 独立行政法人地域医療推進機構群馬中央病院 370-0025
臨床研究実施計画書ひな型 第 1.1 版平成 28 年 4 月 28 日 黒字 : テンプレート部分 ( ほぼそのまま使用できるもの ) 赤字 : 解説部分 ( 手引きとしての説明であり 研究実施計画書完成時には削除されるもの ) 青字 : 記載例 ( 文章や表の例であり 修飾して使用が可能なもの ) 研究課題名 臨床研究実施計画書 研究責任者 : 独立行政法人地域医療推進機構群馬中央病院 370-0025
<4D F736F F D A835E838A F8B7982D18AC48DB85F20534F A68CEB8E9A E9A8F4390B38DCF2
 自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
課題名
 急性期重度嚥下障害患者に対する完全側臥位法の有効性 研究責任者氏名長尾恭史 岡崎市民病院リハビリテーション室 副主任 共同研究者脳神経内科小林靖歯科口腔外科長尾徹看護局西嶋久美子 西暦 2017 年 6 月 15 日版数 1 目次 1. 実施計画の経緯 ( 背景 )... 1 2. 目的... 1 3. 研究対象者について... 1 3-1 選択基準... 1 3-2 除外基準... 1 3-3 中止基準...
急性期重度嚥下障害患者に対する完全側臥位法の有効性 研究責任者氏名長尾恭史 岡崎市民病院リハビリテーション室 副主任 共同研究者脳神経内科小林靖歯科口腔外科長尾徹看護局西嶋久美子 西暦 2017 年 6 月 15 日版数 1 目次 1. 実施計画の経緯 ( 背景 )... 1 2. 目的... 1 3. 研究対象者について... 1 3-1 選択基準... 1 3-2 除外基準... 1 3-3 中止基準...
臨床研究に関する研修会1
 臨床研究に関する研修会 Ⅱ 長崎大学病院臨床研究センター 平成 27 年 9 月 24 日 倫理委員会申請時の注意点 臨床研究センター 副センター長福島千鶴 e-learning の受講 研究を申請する研究者及び 研究分担者は 申請前に必ず e-learning を受講して下さい CITI JAPAN プロジェクト ( 医学研究者標準コース ) 所属関係なし 研究責任者は研究分担者の受講状況を確認の上
臨床研究に関する研修会 Ⅱ 長崎大学病院臨床研究センター 平成 27 年 9 月 24 日 倫理委員会申請時の注意点 臨床研究センター 副センター長福島千鶴 e-learning の受講 研究を申請する研究者及び 研究分担者は 申請前に必ず e-learning を受講して下さい CITI JAPAN プロジェクト ( 医学研究者標準コース ) 所属関係なし 研究責任者は研究分担者の受講状況を確認の上
検討課題の整理 1 第 1 回合同会議での意見及びその後委員から提出された意見を 第 1 回合同会議の 検討の進め方 ( 下記参照 ) に沿って分類 第 1 回合同会議資料 合同会議における検討の進め方 の抜粋 合同会議においては 以下の順で検討を進める (1) ゲノム指針と医学系指針との条文の整合
 第 1 回医学研究等に係る倫理指針の見直しに関する合同会議 TF 平成 30 年 10 月 29 日 参考資料 1 合同会議における委員コメント ( 追記版 ) 検討課題の整理 1 第 1 回合同会議での意見及びその後委員から提出された意見を 第 1 回合同会議の 検討の進め方 ( 下記参照 ) に沿って分類 第 1 回合同会議資料 合同会議における検討の進め方 の抜粋 合同会議においては 以下の順で検討を進める
第 1 回医学研究等に係る倫理指針の見直しに関する合同会議 TF 平成 30 年 10 月 29 日 参考資料 1 合同会議における委員コメント ( 追記版 ) 検討課題の整理 1 第 1 回合同会議での意見及びその後委員から提出された意見を 第 1 回合同会議の 検討の進め方 ( 下記参照 ) に沿って分類 第 1 回合同会議資料 合同会議における検討の進め方 の抜粋 合同会議においては 以下の順で検討を進める
<4D F736F F D E34208EA18CB18EE891B182AB977697CC C8E8DB782B591D682A688CB978A>
 Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
手順書03
 杏林大学医学部倫理委員会 人を対象とする医学系研究に関する業務手順書 ➂ 研究計画書の作成等に関する手続等 1 はじめに本手順書は 杏林大学医学部倫理委員会規程に基づき 杏林大学医学部及び医学部付属病院の専任教職員が行う人を対象とした医学系研究について 医の倫理に関するヘルシンキ宣言の趣旨に添い 人を対象とする医学系研究に関する倫理指針及び その他関連通知に基づいて適正かつ円滑に行われるよう これらの研究等に係る必要な手順を定めるものである
杏林大学医学部倫理委員会 人を対象とする医学系研究に関する業務手順書 ➂ 研究計画書の作成等に関する手続等 1 はじめに本手順書は 杏林大学医学部倫理委員会規程に基づき 杏林大学医学部及び医学部付属病院の専任教職員が行う人を対象とした医学系研究について 医の倫理に関するヘルシンキ宣言の趣旨に添い 人を対象とする医学系研究に関する倫理指針及び その他関連通知に基づいて適正かつ円滑に行われるよう これらの研究等に係る必要な手順を定めるものである
実験計画書
 研究計画書 本委員会ではゲノム解析研究を審査対象としている 臨床試験などは対象とならないため, 試験計画 ではない 以下, 計画書では 研究 を使用する 委員には, 医学の専門外の方もいます 研究計画は専門外の者にも理解しやすいように, 平易な表現で分かり易く記載する 研究課題名 : 1. 提供者を選ぶ方針 申請者 ( 研究責任者 ) 氏名 ( 所属 職名 ): 合理的に選択していることが分かる具体的な方法を記載する
研究計画書 本委員会ではゲノム解析研究を審査対象としている 臨床試験などは対象とならないため, 試験計画 ではない 以下, 計画書では 研究 を使用する 委員には, 医学の専門外の方もいます 研究計画は専門外の者にも理解しやすいように, 平易な表現で分かり易く記載する 研究課題名 : 1. 提供者を選ぶ方針 申請者 ( 研究責任者 ) 氏名 ( 所属 職名 ): 合理的に選択していることが分かる具体的な方法を記載する
1. 研究の名称 : 芽球性形質細胞様樹状細胞腫瘍の分子病理学的研究 2. 研究組織 : 研究責任者 : 埼玉医科大学総合医療センター病理部 准教授 百瀬修二 研究実施者 : 埼玉医科大学総合医療センター病理部 教授 田丸淳一 埼玉医科大学総合医療センター血液内科 助教 田中佑加 基盤施設研究責任者
 資料 1 研究計画書 芽球性形質細胞様樹状細胞腫瘍の分子病理学的研究 埼玉医科大学総合医療センター病理部 研究責任者百瀬修二 Ver1.0 2018 年 1 月 31 日 1. 研究の名称 : 芽球性形質細胞様樹状細胞腫瘍の分子病理学的研究 2. 研究組織 : 研究責任者 : 埼玉医科大学総合医療センター病理部 准教授 百瀬修二 研究実施者 : 埼玉医科大学総合医療センター病理部 教授 田丸淳一 埼玉医科大学総合医療センター血液内科
資料 1 研究計画書 芽球性形質細胞様樹状細胞腫瘍の分子病理学的研究 埼玉医科大学総合医療センター病理部 研究責任者百瀬修二 Ver1.0 2018 年 1 月 31 日 1. 研究の名称 : 芽球性形質細胞様樹状細胞腫瘍の分子病理学的研究 2. 研究組織 : 研究責任者 : 埼玉医科大学総合医療センター病理部 准教授 百瀬修二 研究実施者 : 埼玉医科大学総合医療センター病理部 教授 田丸淳一 埼玉医科大学総合医療センター血液内科
CROCO について
 CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
医師主導治験取扱要覧
 15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
1. この臨床研究は患者さんの治療のためではなく 新たな診断の確立のために行われます 尿路感染症の重症度を診断する際には CRP やプロカルシトニンなどの炎症マーカーが使用されておりますが これらのマーカーは 炎症が起きてから血中に出てくるまで時間がかかったり 炎症が良くなっても血液中からなかなか消
 患者さんへ 臨床研究の説明書 細菌性尿路感染症における血中プレセプシンを用いた敗血症診断に関する臨床研究 (part2) これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 研究代表医師群馬大学大学院医学系研究科泌尿器科学教授鈴木和浩
患者さんへ 臨床研究の説明書 細菌性尿路感染症における血中プレセプシンを用いた敗血症診断に関する臨床研究 (part2) これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 研究代表医師群馬大学大学院医学系研究科泌尿器科学教授鈴木和浩
治療を受けられる患者様へのご説明 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) について 仙台画像検診クリニック 宮城県仙台市青葉区五橋 TEL: この説明文書は 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) ( 以下 ハイパ
 治療を受けられる患者様へのご説明 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) について 仙台画像検診クリニック 宮城県仙台市青葉区五橋 2-1-25 TEL:022-211-9877 この説明文書は 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) ( 以下 ハイパー DC 療法 ) による治療を勧められた患者様が この治療法を受けられるに際して 知っておいていただきたいことを文書にしたものです
治療を受けられる患者様へのご説明 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) について 仙台画像検診クリニック 宮城県仙台市青葉区五橋 2-1-25 TEL:022-211-9877 この説明文書は 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) ( 以下 ハイパー DC 療法 ) による治療を勧められた患者様が この治療法を受けられるに際して 知っておいていただきたいことを文書にしたものです
9 中止基準 ( 研究対象者の中止 研究全体の中止について ) 10 研究対象者への研究実施後の医療提供に関する対応 通常の診療を超える医療行為 を伴う研究を実施した場合 研究実施後において 研究対象者が研究の結果より得られた利用可能な最善の予防 診断及び治療が受けられるように努めること 11 研究
 倫理審査書類 ( 研究計画書 ) チェックシート 研究計画書には 原則として以下の項目を含めてください 申請時 提出は不要です 2017.5.2 1 研究の名称 ( 標題 ) 2 研究の実施体制 ( 研究組織 ) 多施設共同研究の場合 共同研究機関の研究者名 役割も詳細に記載 3 研究の背景及び意義 研究を実施する意義 必要性に関して 文献等を用いて研究の 科学的合理性の根拠 と 本研究で得られる成果
倫理審査書類 ( 研究計画書 ) チェックシート 研究計画書には 原則として以下の項目を含めてください 申請時 提出は不要です 2017.5.2 1 研究の名称 ( 標題 ) 2 研究の実施体制 ( 研究組織 ) 多施設共同研究の場合 共同研究機関の研究者名 役割も詳細に記載 3 研究の背景及び意義 研究を実施する意義 必要性に関して 文献等を用いて研究の 科学的合理性の根拠 と 本研究で得られる成果
eRequest - Frequently Asked Questions
 2018 年度 UCBJ 研究支援申請方法 1. 趣旨 ユーシービージャパン株式会社 ( 以下 UCBJ ) は 革新的な医薬品を開発し 患者の皆様の治療に貢献するとともに 医学 薬学領域の学術研究活動を支援いたします UCBJ は 2017 年から研究支援の公募を開始いたしました 患者の皆様にとって有益な治療につながる革新的で独創性のある研究に対して 研究支援金 ( 以下 支援金 ) の拠出をもって支援いたします
2018 年度 UCBJ 研究支援申請方法 1. 趣旨 ユーシービージャパン株式会社 ( 以下 UCBJ ) は 革新的な医薬品を開発し 患者の皆様の治療に貢献するとともに 医学 薬学領域の学術研究活動を支援いたします UCBJ は 2017 年から研究支援の公募を開始いたしました 患者の皆様にとって有益な治療につながる革新的で独創性のある研究に対して 研究支援金 ( 以下 支援金 ) の拠出をもって支援いたします
宮城県立がんセンター受託研究業務手順書
 平成 26 年 4 月 1 日一部改正使用成績調査 特定使用成績調査編 本編は 薬事法第 14 条の 4 及び第 14 条の 6 に基づく医薬品及び医療機器の再審査 再評価申請の際に提出すべき資料の収集のために行われる製造販売後調査 ( 使用成績調査及び特定使用成績調査 )( 以下 使用成績調査等 ) に適用するものとする 本編は 薬事法第 14 条の 4 第 4 項 薬事法第 14 条の 6 第
平成 26 年 4 月 1 日一部改正使用成績調査 特定使用成績調査編 本編は 薬事法第 14 条の 4 及び第 14 条の 6 に基づく医薬品及び医療機器の再審査 再評価申請の際に提出すべき資料の収集のために行われる製造販売後調査 ( 使用成績調査及び特定使用成績調査 )( 以下 使用成績調査等 ) に適用するものとする 本編は 薬事法第 14 条の 4 第 4 項 薬事法第 14 条の 6 第
Microsoft Word - HP用 同意書・説明書 130121
 市立秋田総合病院でマンモグラフィ併用乳がん検診を受診する皆様へ ~ 断層撮影を加えたマンモグラフィ検診にご協力ください ~ 当院では平成 24 年 7 月に断層撮影可能な最新マンモグラフィ撮影装置が導入されました この装置は 乳房を圧迫して その垂直方向から撮影する従来の平面型に加え 撮影装置が角度を変えながら断層撮影をする立体型の機能をあわせて持っています ( 別ページを参照下さい ) 撮影を多方向から行うので
市立秋田総合病院でマンモグラフィ併用乳がん検診を受診する皆様へ ~ 断層撮影を加えたマンモグラフィ検診にご協力ください ~ 当院では平成 24 年 7 月に断層撮影可能な最新マンモグラフィ撮影装置が導入されました この装置は 乳房を圧迫して その垂直方向から撮影する従来の平面型に加え 撮影装置が角度を変えながら断層撮影をする立体型の機能をあわせて持っています ( 別ページを参照下さい ) 撮影を多方向から行うので
疫 学 研 究 許 可 申 請 書
 疫学研究許可申請書 申請日 :2011 年 7 月 13 日 改訂日 :2011 年 8 月 2 日 自治医科大学学長殿 受付番号 : 疫 11-18 下記のとおり申請致します 研究責任者 : 所属地域医療学センター公衆衛生学部門 職名 教授 氏名 中村好一印 所属長 : 職名 教授 氏名 中村好一印 ( 枠にこだわらずに, 分量自由で記載すること ) 1. 研究課題名栃木県小山市における こんにちは赤ちゃん事業
疫学研究許可申請書 申請日 :2011 年 7 月 13 日 改訂日 :2011 年 8 月 2 日 自治医科大学学長殿 受付番号 : 疫 11-18 下記のとおり申請致します 研究責任者 : 所属地域医療学センター公衆衛生学部門 職名 教授 氏名 中村好一印 所属長 : 職名 教授 氏名 中村好一印 ( 枠にこだわらずに, 分量自由で記載すること ) 1. 研究課題名栃木県小山市における こんにちは赤ちゃん事業
B型肝炎ウイルスのキャリアで免疫抑制・化学療法を受ける患者さんへ
 B 型肝炎ウイルスの既往感染例で免疫抑制 化学療法を受ける患者さんへ - 厚生労働省研究班の調査への協力のお願い - 1. B 型肝炎ウイルスの 既往感染例 とは B 型肝炎ウイルス (HBV) は血液や体液を介してヒトに感染するウイルスで, 肝炎, 肝硬変, 肝癌などの病気の原因になります 感染したウイルスは肝臓の細胞に入り込み, その遺伝子がヒトの遺伝子に組み込まれてしまいます このため, ウイルスが一旦感染すると肝臓に居続けることになり,
B 型肝炎ウイルスの既往感染例で免疫抑制 化学療法を受ける患者さんへ - 厚生労働省研究班の調査への協力のお願い - 1. B 型肝炎ウイルスの 既往感染例 とは B 型肝炎ウイルス (HBV) は血液や体液を介してヒトに感染するウイルスで, 肝炎, 肝硬変, 肝癌などの病気の原因になります 感染したウイルスは肝臓の細胞に入り込み, その遺伝子がヒトの遺伝子に組み込まれてしまいます このため, ウイルスが一旦感染すると肝臓に居続けることになり,
4. 結果はお返ししない予定です [ 結果を開示しない場合 ] 今すぐに診療に役立てることができないため結果をお返ししない予定です ご理解く ださいますようお願いいたします 詳しくは ページへ ( 必要に応じて )5. 親権者の承諾のもと 未成年者の参加をお願いしています 詳しくは ページへ 6.
![4. 結果はお返ししない予定です [ 結果を開示しない場合 ] 今すぐに診療に役立てることができないため結果をお返ししない予定です ご理解く ださいますようお願いいたします 詳しくは ページへ ( 必要に応じて )5. 親権者の承諾のもと 未成年者の参加をお願いしています 詳しくは ページへ 6. 4. 結果はお返ししない予定です [ 結果を開示しない場合 ] 今すぐに診療に役立てることができないため結果をお返ししない予定です ご理解く ださいますようお願いいたします 詳しくは ページへ ( 必要に応じて )5. 親権者の承諾のもと 未成年者の参加をお願いしています 詳しくは ページへ 6.](/thumbs/91/105290688.jpg) 赤字で示した部分はポイントとして挙げています適当な言葉を入れたあと 削除してください * ヘッダーに研究名とバージョンを記載 * 研究内容に合わせて適切に変更してください 要約口頭説明に利用一般参加者 代諾者用 研究名 研究参加のお願い 1. 研究の目的 詳しくは ページへ 病については ということを調べ に役立てたいと考えています *( 必要に応じて ) 病は遺伝の可能性があると考えられています
赤字で示した部分はポイントとして挙げています適当な言葉を入れたあと 削除してください * ヘッダーに研究名とバージョンを記載 * 研究内容に合わせて適切に変更してください 要約口頭説明に利用一般参加者 代諾者用 研究名 研究参加のお願い 1. 研究の目的 詳しくは ページへ 病については ということを調べ に役立てたいと考えています *( 必要に応じて ) 病は遺伝の可能性があると考えられています
平成 26 年 3 月 6 日千葉医療センター 地域医療連携ネットワーク運用管理規定 (Ver.8) 千葉医療センター地域医療連携ネットワーク運用管理規定 第 1 章総則 ( 目的 ) 第 1 条この運用管理規定は 千葉医療センター地域医療連携ネットワーク ( 以下 千葉医療ネットワーク ) に参加
 千葉医療センター地域医療連携ネットワーク運用管理規定 第 1 章総則 ( 目的 ) 第 1 条この運用管理規定は 千葉医療センター地域医療連携ネットワーク ( 以下 千葉医療ネットワーク ) に参加する医療機関等 ( 以下 参加施設 ) を結んだネットワークシステム これに接続される機器及び周辺装置の運用及び管理に関し必要な事項を定め システムの効率的な運用及び適正な管理を図り 併せてデータの漏洩
千葉医療センター地域医療連携ネットワーク運用管理規定 第 1 章総則 ( 目的 ) 第 1 条この運用管理規定は 千葉医療センター地域医療連携ネットワーク ( 以下 千葉医療ネットワーク ) に参加する医療機関等 ( 以下 参加施設 ) を結んだネットワークシステム これに接続される機器及び周辺装置の運用及び管理に関し必要な事項を定め システムの効率的な運用及び適正な管理を図り 併せてデータの漏洩
山形県立中央病院治験審査委員会業務手順書
 山形県立中央病院治験審査委員会業務手順書 第 1 目的この手順書は山形県立中央病院医薬品等臨床試験受託研究取扱要綱 ( 以下 取扱要綱 という ) に基づいて山形県立中央病院治験審査委員会 ( 以下 本委員会 という ) の運用方法を定め それに基づく業務手順書を示すものである なお 製造販売後臨床試験においては 以下 治験 とあるのを 製造販売後臨床試験 と読み替えるものとする 第 2 本委員会の責務本委員会は全ての被験者の人権の保護
山形県立中央病院治験審査委員会業務手順書 第 1 目的この手順書は山形県立中央病院医薬品等臨床試験受託研究取扱要綱 ( 以下 取扱要綱 という ) に基づいて山形県立中央病院治験審査委員会 ( 以下 本委員会 という ) の運用方法を定め それに基づく業務手順書を示すものである なお 製造販売後臨床試験においては 以下 治験 とあるのを 製造販売後臨床試験 と読み替えるものとする 第 2 本委員会の責務本委員会は全ての被験者の人権の保護
12_モニタリングの実施に関する手順書
 12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
平成29年度 第1回 臨床研究に関する研修会
 平成 29 年度臨床研究に関する研修会 1 臨床研究とは 人を対象とする医学系研究 人 ( 試料 情報を含む ) を対象として 疾病の成因及び病態の理解並びに疾病の予防方法並びに医療における診断方法及び治療方法の改善又は有効性の検証を通じて 国民の健康の保持増進又は患者の疾病からの回復若しくは生活の質の向上に資する知識を得ることを目的として実施される活動をいう 2 指針の対象になる研究 個人の健康に関する情報を用いた疫学的手法による研究
平成 29 年度臨床研究に関する研修会 1 臨床研究とは 人を対象とする医学系研究 人 ( 試料 情報を含む ) を対象として 疾病の成因及び病態の理解並びに疾病の予防方法並びに医療における診断方法及び治療方法の改善又は有効性の検証を通じて 国民の健康の保持増進又は患者の疾病からの回復若しくは生活の質の向上に資する知識を得ることを目的として実施される活動をいう 2 指針の対象になる研究 個人の健康に関する情報を用いた疫学的手法による研究
<93648EA593498B4C985E82C98AD682B782E E838A F E315F C668DDA95AA292E786C7378>
 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 ( 版 :2013 年 9 月 1 日 ver2.0) 2 3 電磁的記録として扱う治験関連文書 電磁的記録の交付
1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 ( 版 :2013 年 9 月 1 日 ver2.0) 2 3 電磁的記録として扱う治験関連文書 電磁的記録の交付
資料2_ヒト幹同等性
 資料 2 文科省指針とヒト幹指針の倫理的事項における同等性について 樹立の要件において既に同等性が担保されている事項 1 ヒト ES 細胞の樹立に用いるヒト受精胚の要件は両指針とも同じ ( 無償提供 余剰胚 IC 凍結保存 受精後 14 日以内 ) 2 ヒト受精胚の提供者の同意撤回に関する要件も同じ (30 日の撤回期間確保 ) 樹立の要件が異なっており同等性を確認すべき事項 3 ヒト幹指針では 余剰胚の提供者の個人情報を連結可能匿名化した後
資料 2 文科省指針とヒト幹指針の倫理的事項における同等性について 樹立の要件において既に同等性が担保されている事項 1 ヒト ES 細胞の樹立に用いるヒト受精胚の要件は両指針とも同じ ( 無償提供 余剰胚 IC 凍結保存 受精後 14 日以内 ) 2 ヒト受精胚の提供者の同意撤回に関する要件も同じ (30 日の撤回期間確保 ) 樹立の要件が異なっており同等性を確認すべき事項 3 ヒト幹指針では 余剰胚の提供者の個人情報を連結可能匿名化した後
適応外申請 治験審査委員会 Institutional Review Board (IRB)
 治験審査委員会 Institutional Review Board (IRB) 適応外使用の申請書類作成の手引き 治験審査委員会 先端医療 臨床研究支援センター 緊急で IRB の承認が必要な場合は 先端医療 臨床研究支援センター IRB 事務 ( 内線 :1957 1958) に連絡すること < 提出書類 > Ⅰ. 適応外使用申請書 Ⅱ. 説明文書 Ⅲ. 同意文書 Ⅳ. 選択 除外基準 ( 不特定多数の患者に使用する場合
治験審査委員会 Institutional Review Board (IRB) 適応外使用の申請書類作成の手引き 治験審査委員会 先端医療 臨床研究支援センター 緊急で IRB の承認が必要な場合は 先端医療 臨床研究支援センター IRB 事務 ( 内線 :1957 1958) に連絡すること < 提出書類 > Ⅰ. 適応外使用申請書 Ⅱ. 説明文書 Ⅲ. 同意文書 Ⅳ. 選択 除外基準 ( 不特定多数の患者に使用する場合
診療情報を利用した臨床研究について 虎の門病院肝臓内科では 以下の臨床研究を実施しております この研究は 通常の診療で得られた記録をまとめるものです この案内をお読みになり ご自身がこの研究の対象者にあたると思われる方の中で ご質問がある場合 またはこの研究に 自分の診療情報を使ってほしくない とお
 診療情報を利用した臨床研究について 虎の門病院肝臓内科では 以下の臨床研究を実施しております この研究は 通常の診療で得られた記録をまとめるものです この案内をお読みになり ご自身がこの研究の対象者にあたると思われる方の中で ご質問がある場合 またはこの研究に 自分の診療情報を使ってほしくない とお思いになりましたら 遠慮なく下記の相談窓口までご連絡ください 対象となる方 1982 年 9 月 2016
診療情報を利用した臨床研究について 虎の門病院肝臓内科では 以下の臨床研究を実施しております この研究は 通常の診療で得られた記録をまとめるものです この案内をお読みになり ご自身がこの研究の対象者にあたると思われる方の中で ご質問がある場合 またはこの研究に 自分の診療情報を使ってほしくない とお思いになりましたら 遠慮なく下記の相談窓口までご連絡ください 対象となる方 1982 年 9 月 2016
倫理審査電子申請システム
 山梨大学医学部 倫理審査電子申請システム 利用ガイド 平成 27 年 11 月版 目 次 1 システムの利用準備 1.1 システムの起動 2 1.2 ユーザー登録 3 1.3 ログイン 4 1.4 個人設定の変更 5 1.5 ログアウト 6 2 新規申請 2.1 新規申請書の作成及び提出 7 2.2 利益相反自己申告書の作成及び提出 13 2.3 審査結果の表示 18 2.4 申請内容の修正及び提出
山梨大学医学部 倫理審査電子申請システム 利用ガイド 平成 27 年 11 月版 目 次 1 システムの利用準備 1.1 システムの起動 2 1.2 ユーザー登録 3 1.3 ログイン 4 1.4 個人設定の変更 5 1.5 ログアウト 6 2 新規申請 2.1 新規申請書の作成及び提出 7 2.2 利益相反自己申告書の作成及び提出 13 2.3 審査結果の表示 18 2.4 申請内容の修正及び提出
資料1:「生命倫理に関する研究機関における検討について」(赤林先生資料)
 資料 1 命倫理に関する研究機関における検討について 東京 学医学部医療倫理学分野 林朗 次 医学系研究における法令 指針等 機関の の役割 倫理審査委員会の役割 倫理審査委員会の構成 研究実施にあたっての検討の流れ 医学系研究における法令 指針等 医学系研究に関する法律 医薬品医療機器等法 (2015 年改訂 ) 治験 再 医療等安全性確保法 (2013 年 ) 再 医療研究 医学系研究に関する基本的な指針
資料 1 命倫理に関する研究機関における検討について 東京 学医学部医療倫理学分野 林朗 次 医学系研究における法令 指針等 機関の の役割 倫理審査委員会の役割 倫理審査委員会の構成 研究実施にあたっての検討の流れ 医学系研究における法令 指針等 医学系研究に関する法律 医薬品医療機器等法 (2015 年改訂 ) 治験 再 医療等安全性確保法 (2013 年 ) 再 医療研究 医学系研究に関する基本的な指針
2)HBV の予防 (1)HBV ワクチンプログラム HBV のワクチンの接種歴がなく抗体価が低い職員は アレルギー等の接種するうえでの問題がない場合は HB ワクチンを接種することが推奨される HB ワクチンは 1 クールで 3 回 ( 初回 1 か月後 6 か月後 ) 接種する必要があり 病院の
 Ⅵ. 職業感染対策 1. 針刺し 切創 粘膜曝露 1) 針刺し 切創 粘膜曝露対策および事例発生時の対応 職業感染を防止するためには 針刺し 切創 粘膜曝露を起こさないことが重要ではあ るが もし針刺し 切創 粘膜曝露が発生した場合は 迅速に対処することが必要となる 針刺し 切創 粘膜曝露事例発生時はフローチャートに従い行動する 表 1 感染症別の針刺しによる感染率 問題となるウイルス 感染率 備考
Ⅵ. 職業感染対策 1. 針刺し 切創 粘膜曝露 1) 針刺し 切創 粘膜曝露対策および事例発生時の対応 職業感染を防止するためには 針刺し 切創 粘膜曝露を起こさないことが重要ではあ るが もし針刺し 切創 粘膜曝露が発生した場合は 迅速に対処することが必要となる 針刺し 切創 粘膜曝露事例発生時はフローチャートに従い行動する 表 1 感染症別の針刺しによる感染率 問題となるウイルス 感染率 備考
(3) 倫理学 法律学の専門家等 本法人に所属しない人文 社会科学の有識者若干名 (4) 一般の立場から意見を述べることができる者若干名 (5) 分子生物学 細胞生物学 遺伝学 臨床薬理学 病理学等の専門家若しくは遺伝子治療等臨床研究の対象となる疾患に係る臨床医として 日本医科大学長が推薦した者若干
 学校法人日本医科大学中央倫理委員会規程 ( 平成 28 年 1 月 1 日規程第 3 号 ) ( 目的 ) 第 1 条この規程は 医の倫理に関するヘルシンキ宣言の趣旨を尊重し 人を対象とする医学系研究に関する倫理指針 ヒトゲノム 遺伝子解析研究に関する倫理指針 遺伝子治療臨床研究に関する指針 ヒト受精胚の作成を行う生殖補助医療研究に関する倫理指針 等 国等が示した関係法令及び関係指針 ( 以下すべて併せて
学校法人日本医科大学中央倫理委員会規程 ( 平成 28 年 1 月 1 日規程第 3 号 ) ( 目的 ) 第 1 条この規程は 医の倫理に関するヘルシンキ宣言の趣旨を尊重し 人を対象とする医学系研究に関する倫理指針 ヒトゲノム 遺伝子解析研究に関する倫理指針 遺伝子治療臨床研究に関する指針 ヒト受精胚の作成を行う生殖補助医療研究に関する倫理指針 等 国等が示した関係法令及び関係指針 ( 以下すべて併せて
平成 28 年 4 月版 別紙様式 3 研究に係る利益相反状況申告書 Q&A Q1. 学内研究分担者等の氏名 Q1-1 Q1-2 Q1-3 Q1-4 質問学外の研究分担者名を記載しなくてもよいのですか? 学内研究分担者等 というのは どのような人をいうのですか? モニタリング 監査とはどのようなもの
 別紙様式 3 研究に係る利益相反状況申告書 Q&A Q1. 学内研究分担者等の氏名 Q1-1 Q1-2 Q1-3 Q1-4 質問学外の研究分担者名を記載しなくてもよいのですか? 学内研究分担者等 というのは どのような人をいうのですか? モニタリング 監査とはどのようなものですか? 欄が足りない場合はどうすればよいですか? 回答記載する必要はありません ただし その研究者が本学において研究を実施する場合には記載してください
別紙様式 3 研究に係る利益相反状況申告書 Q&A Q1. 学内研究分担者等の氏名 Q1-1 Q1-2 Q1-3 Q1-4 質問学外の研究分担者名を記載しなくてもよいのですか? 学内研究分担者等 というのは どのような人をいうのですか? モニタリング 監査とはどのようなものですか? 欄が足りない場合はどうすればよいですか? 回答記載する必要はありません ただし その研究者が本学において研究を実施する場合には記載してください
患者さんへの説明書
 難治性 Clostridium difficile 関連下痢症 腸炎に対する糞便細菌叢移植 につきまして 1. はじめに本研究は 臨床試験のなかでも 医師主導臨床試験 に該当する試験になります 医師主導臨床試験とは医療現場でのニーズが高い医薬品や医療機器 治療法を医師が自ら医療機関の倫理委員会などに申請し 承認を受けることにより実施が可能となった試験です 本試験は滋賀医科大学消化器内科が主体となり臨床試験の計画
難治性 Clostridium difficile 関連下痢症 腸炎に対する糞便細菌叢移植 につきまして 1. はじめに本研究は 臨床試験のなかでも 医師主導臨床試験 に該当する試験になります 医師主導臨床試験とは医療現場でのニーズが高い医薬品や医療機器 治療法を医師が自ら医療機関の倫理委員会などに申請し 承認を受けることにより実施が可能となった試験です 本試験は滋賀医科大学消化器内科が主体となり臨床試験の計画
説明文書作成上の留意点
 黄色靭帯骨化症の手術成績に関する研究へのご協力について 黄色靭帯骨化症は脊椎をつなぐ組織である靱帯が骨に変化し 脊髄が圧迫を受けて歩行障害などをおこす病気です 脊髄障害が発生した場合の治療法は手術しかありません しかし 手術によっても症状が良くならない あるいは手術後逆に症状が悪くなる人もいて どのような手術法が最も安全で 効果があるのかが分かっておりません このことを明らかにする目的で 私どもはこの病気で手術をお受けになった患者さんの手術後の結果を調査させていただきたいと思います
黄色靭帯骨化症の手術成績に関する研究へのご協力について 黄色靭帯骨化症は脊椎をつなぐ組織である靱帯が骨に変化し 脊髄が圧迫を受けて歩行障害などをおこす病気です 脊髄障害が発生した場合の治療法は手術しかありません しかし 手術によっても症状が良くならない あるいは手術後逆に症状が悪くなる人もいて どのような手術法が最も安全で 効果があるのかが分かっておりません このことを明らかにする目的で 私どもはこの病気で手術をお受けになった患者さんの手術後の結果を調査させていただきたいと思います
第 2 章 1 診療ガイドライン作成手順およびスケジュール 診療ガイドラインは, 以下の作成手順により作成される 計画にあたっては, 全体を通してどのくらいの時間が必要か, 各手順にどの程度の時間と費用をかけるかを考慮し, 具体的に立案する必要がある 1 作成目的の明確化 2 作成主体の決定 3 事
 第 2 章 1 診療ガイドライン作成手順およびスケジュール 8 2 診療ガイドライン作成主体の決定 8 3 診療ガイドライン作成組織の編成 9 4 診療ガイドライン作成資金 10 5 利益相反 (conflicts of interest;coi) 11 6 診療ガイドライン作成への患者 市民参加 12 第 2 章 1 診療ガイドライン作成手順およびスケジュール 診療ガイドラインは, 以下の作成手順により作成される
第 2 章 1 診療ガイドライン作成手順およびスケジュール 8 2 診療ガイドライン作成主体の決定 8 3 診療ガイドライン作成組織の編成 9 4 診療ガイドライン作成資金 10 5 利益相反 (conflicts of interest;coi) 11 6 診療ガイドライン作成への患者 市民参加 12 第 2 章 1 診療ガイドライン作成手順およびスケジュール 診療ガイドラインは, 以下の作成手順により作成される
<4D F736F F D20322E CA48B8690AC89CA5B90B688E38CA E525D>
 PRESS RELEASE(2017/07/18) 九州大学広報室 819-0395 福岡市西区元岡 744 TEL:092-802-2130 FAX:092-802-2139 MAIL:koho@jimu.kyushu-u.ac.jp URL:http://www.kyushu-u.ac.jp 造血幹細胞の過剰鉄が血液産生を阻害する仕組みを解明 骨髄異形成症候群の新たな治療法開発に期待 - 九州大学生体防御医学研究所の中山敬一主幹教授
PRESS RELEASE(2017/07/18) 九州大学広報室 819-0395 福岡市西区元岡 744 TEL:092-802-2130 FAX:092-802-2139 MAIL:koho@jimu.kyushu-u.ac.jp URL:http://www.kyushu-u.ac.jp 造血幹細胞の過剰鉄が血液産生を阻害する仕組みを解明 骨髄異形成症候群の新たな治療法開発に期待 - 九州大学生体防御医学研究所の中山敬一主幹教授
平成 28 年度 第 6 回倫理 利益相反委員会会議記録概要 日時 : 平成 28 年 9 月 30 日 ( 金 )15:00~17:00 場所 : 第 3 会議室出席者 : 委員長豊嶋英明委員加知輝彦 八谷寛 酒井一 服部一郎 岡村幹吉 村上健次 原口真 原田敦 柳澤勝彦 野上宏美 出席委員数 /
 平成 28 年度 第 6 回倫理 利益相反委員会会議記録概要 日時 : 平成 28 年 9 月 30 日 ( 金 )15:00~17:00 場所 : 第 3 会議室出席者 : 委員長豊嶋英明委員加知輝彦 八谷寛 酒井一 服部一郎 岡村幹吉 村上健次 原口真 原田敦 柳澤勝彦 野上宏美 出席委員数 / 全委員数 : 11 人 /12 人審議事項申請課題数 : 一部変更申請課題 2 件新規申請課題 4
平成 28 年度 第 6 回倫理 利益相反委員会会議記録概要 日時 : 平成 28 年 9 月 30 日 ( 金 )15:00~17:00 場所 : 第 3 会議室出席者 : 委員長豊嶋英明委員加知輝彦 八谷寛 酒井一 服部一郎 岡村幹吉 村上健次 原口真 原田敦 柳澤勝彦 野上宏美 出席委員数 / 全委員数 : 11 人 /12 人審議事項申請課題数 : 一部変更申請課題 2 件新規申請課題 4
Microsoft Word - 5. 説明文書_脳内出血_ docx
 説明文書 同意文書 ~ 脂肪組織由来幹細胞を用いた脳内出血に対する臨床研究 ~ 現在 私たち ( 担当医師 ) は 患者さんの協力を得て 以下に説明す る臨床研究に取り組んでいます 今回 あなたにこの臨床研究の内容について説明させていただきます この説明文書は 私たちの説明をおぎない あなたの理解を深めるためのものですのでよくお読みになり 臨床研究にご協力いただけるかどうかご検討ください なお この臨床研究に参加するかどうかはあなたの自由です
説明文書 同意文書 ~ 脂肪組織由来幹細胞を用いた脳内出血に対する臨床研究 ~ 現在 私たち ( 担当医師 ) は 患者さんの協力を得て 以下に説明す る臨床研究に取り組んでいます 今回 あなたにこの臨床研究の内容について説明させていただきます この説明文書は 私たちの説明をおぎない あなたの理解を深めるためのものですのでよくお読みになり 臨床研究にご協力いただけるかどうかご検討ください なお この臨床研究に参加するかどうかはあなたの自由です
14個人情報の取扱いに関する規程
 個人情報の取扱いに関する規程 第 1 条 ( 目的 ) 第 1 章総則 この規程は 東レ福祉会 ( 以下 本会 という ) における福祉事業に係わる個人情報の適法かつ適正な取扱いの確保に関する基本的事項を定めることにより 個人の権利 利益を保護することを目的とする 第 2 条 ( 定義 ) この規程における各用語の定義は 個人情報の保護に関する法律 ( 以下 個人情報保護法 という ) および個人情報保護委員会の個人情報保護に関するガイドラインによるものとする
個人情報の取扱いに関する規程 第 1 条 ( 目的 ) 第 1 章総則 この規程は 東レ福祉会 ( 以下 本会 という ) における福祉事業に係わる個人情報の適法かつ適正な取扱いの確保に関する基本的事項を定めることにより 個人の権利 利益を保護することを目的とする 第 2 条 ( 定義 ) この規程における各用語の定義は 個人情報の保護に関する法律 ( 以下 個人情報保護法 という ) および個人情報保護委員会の個人情報保護に関するガイドラインによるものとする
説明文書
 説明文書 研究対象施設の皆様へ 全国を対象とした抗菌薬使用動向調査に関する研究 : Japan Antimicrobial Consumption Surveillance (JACS) へのご協力のお願い 研究代表者 : 三重大学医学部附属病院薬剤部 村木優一 研究事務局 : 三重大学医学部附属病院薬剤部村木優一 514-8507 三重県津市江戸橋 2-174 電話 :059-231-7402 FAX:059-232-1201
説明文書 研究対象施設の皆様へ 全国を対象とした抗菌薬使用動向調査に関する研究 : Japan Antimicrobial Consumption Surveillance (JACS) へのご協力のお願い 研究代表者 : 三重大学医学部附属病院薬剤部 村木優一 研究事務局 : 三重大学医学部附属病院薬剤部村木優一 514-8507 三重県津市江戸橋 2-174 電話 :059-231-7402 FAX:059-232-1201
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
針刺し切創発生時の対応
 1. 初期対応 1) 発生直後の対応 (1) 曝露部位 ( 針刺し 切創等の経皮的創傷 粘膜 皮膚など ) を確認する (2) 曝露部位を直ちに洗浄する 1 創傷 粘膜 正常な皮膚 創傷のある皮膚 : 流水 石鹸で十分に洗浄する 2 口腔 : 大量の水でうがいする 3 眼 : 生理食塩水で十分に洗浄する (3) 曝露の程度 ( 深さ 体液注入量 直接接触量 皮膚の状態 ) を確認する (4) 原因鋭利器材の種類
1. 初期対応 1) 発生直後の対応 (1) 曝露部位 ( 針刺し 切創等の経皮的創傷 粘膜 皮膚など ) を確認する (2) 曝露部位を直ちに洗浄する 1 創傷 粘膜 正常な皮膚 創傷のある皮膚 : 流水 石鹸で十分に洗浄する 2 口腔 : 大量の水でうがいする 3 眼 : 生理食塩水で十分に洗浄する (3) 曝露の程度 ( 深さ 体液注入量 直接接触量 皮膚の状態 ) を確認する (4) 原因鋭利器材の種類
後天性血友病アンケート(Homepage用)
 北海道医療大学歯学部倫理審査承認番号第 149 号 研究課題 北海道における後天性血友病診療の実態把握に関する研究 ------------------------------------------------------------------------------------------------------ 本研究に関与する医師および患者様へ 後天性血友病は 各種凝固因子に対する自己抗体により重篤な出血症状を呈する難治性疾患です
北海道医療大学歯学部倫理審査承認番号第 149 号 研究課題 北海道における後天性血友病診療の実態把握に関する研究 ------------------------------------------------------------------------------------------------------ 本研究に関与する医師および患者様へ 後天性血友病は 各種凝固因子に対する自己抗体により重篤な出血症状を呈する難治性疾患です
1 版 研究分担者研究者番号機関番号部局番号職番号研究者番号機関番号部局番号職番号氏名所属研究機関 部局 職氏名所属研究機関 部局 職補助事業期間を通じた支出済みの分担金 ( 事実発生日までの支出済みの額 ) を入力すること 大学 学部 准教授削
 変更前 ( 旧 ) 変更後 ( 新 ) 研究代表者研究分担者の変更に伴って直接究分担者1 版 様式 F-9-1 記入例 ( 電子申請システム対応用 ) 科学研究費助成事業 ( 学術研究助成基金助成金 ) 研究分担者変更承認申請書平成 30 年 3 月 1 日独立行政法人日本学術振興会理事長殿 大学 研究科 教授 印 科学研究費助成事業 ( 学術研究助成基金助成金 )( 基盤研究 (C)( 一般 ))
変更前 ( 旧 ) 変更後 ( 新 ) 研究代表者研究分担者の変更に伴って直接究分担者1 版 様式 F-9-1 記入例 ( 電子申請システム対応用 ) 科学研究費助成事業 ( 学術研究助成基金助成金 ) 研究分担者変更承認申請書平成 30 年 3 月 1 日独立行政法人日本学術振興会理事長殿 大学 研究科 教授 印 科学研究費助成事業 ( 学術研究助成基金助成金 )( 基盤研究 (C)( 一般 ))
解禁日時 :2019 年 2 月 4 日 ( 月 ) 午後 7 時 ( 日本時間 ) プレス通知資料 ( 研究成果 ) 報道関係各位 2019 年 2 月 1 日 国立大学法人東京医科歯科大学 国立研究開発法人日本医療研究開発機構 IL13Rα2 が血管新生を介して悪性黒色腫 ( メラノーマ ) を
 解禁日時 :2019 年 2 月 4 日 ( 月 ) 午後 7 時 ( 日本時間 ) プレス通知資料 ( 研究成果 ) 報道関係各位 2019 年 2 月 1 日 国立大学法人東京医科歯科大学 国立研究開発法人日本医療研究開発機構 IL13Rα2 が血管新生を介して悪性黒色腫 ( メラノーマ ) を進展させるしくみを解明 難治がんである悪性黒色腫の新規分子標的治療法の開発に期待 ポイント 難治がんの一つである悪性黒色腫
解禁日時 :2019 年 2 月 4 日 ( 月 ) 午後 7 時 ( 日本時間 ) プレス通知資料 ( 研究成果 ) 報道関係各位 2019 年 2 月 1 日 国立大学法人東京医科歯科大学 国立研究開発法人日本医療研究開発機構 IL13Rα2 が血管新生を介して悪性黒色腫 ( メラノーマ ) を進展させるしくみを解明 難治がんである悪性黒色腫の新規分子標的治療法の開発に期待 ポイント 難治がんの一つである悪性黒色腫
6. 研究対象者として選定された理由 当科を受診された各種慢性肝疾患の方が研究対象者に含まれます 7. 研究対象者に生じる利益 負担および予想されるリスクノベルジン錠の国内臨床試験に置ける安全性評価対象例 74 例中 23 例 (31.1%) に副作用が認められ 主な自覚症状では悪心 4 例 (5.
 参加者の方 ( 患者さん ) への説明文書 1. 研究課題名慢性肝疾患における 微量元素と肝障害パラメーターとの相関及び 亜鉛投与によるその臨床的意義についての検討 本研究は本学倫理委員会の承認 及び学長の許可を得て行うものです 2. 実施責任者 産業医科大学第 3 内科学教授原田大 3. 研究期間 平成 29 年 8 月から平成 32 年 4 月まで 4. 研究の背景 目的 意義亜鉛は生体組織内に広く分布し
参加者の方 ( 患者さん ) への説明文書 1. 研究課題名慢性肝疾患における 微量元素と肝障害パラメーターとの相関及び 亜鉛投与によるその臨床的意義についての検討 本研究は本学倫理委員会の承認 及び学長の許可を得て行うものです 2. 実施責任者 産業医科大学第 3 内科学教授原田大 3. 研究期間 平成 29 年 8 月から平成 32 年 4 月まで 4. 研究の背景 目的 意義亜鉛は生体組織内に広く分布し
( 様式 1-1) 日本専門医機構認定形成外科専門医資格更新申請書 20 年月日フリガナ 氏 名 生年月日年月日 所属施設 ( 病院 医院 ) 名 勤務先住所 連絡先 ( 電話 : - - ) ( FAX : - - ) アドレス 1: アドレス 2: 専門医登録番号 - 医籍登録番号
 形成外科領域専門医更新様式等一覧 様式 1-1 日本専門医機構認定形成外科専門医資格更新申請書 1-2 単位集計表 様式 2 勤務実態の自己申告書 様式 3 形成外科診療実績記録 ( 過去 5 年間 ) 様式 4 手術症例一覧表 (4-1~4-5) 様式 5 症例一覧表 (5-1~5-5) 様式 6-1 専門医共通講習受講実績記録 6-2 専門医共通講習受講証明書類貼付台紙 様式 7 形成外科領域講習受講実績記録
形成外科領域専門医更新様式等一覧 様式 1-1 日本専門医機構認定形成外科専門医資格更新申請書 1-2 単位集計表 様式 2 勤務実態の自己申告書 様式 3 形成外科診療実績記録 ( 過去 5 年間 ) 様式 4 手術症例一覧表 (4-1~4-5) 様式 5 症例一覧表 (5-1~5-5) 様式 6-1 専門医共通講習受講実績記録 6-2 専門医共通講習受講証明書類貼付台紙 様式 7 形成外科領域講習受講実績記録
がん登録実務について
 平成 28 年度東京都がん登録説明会資料 2-1 がん登録届出実務について (1) 1. 届出対象 2. 届出候補見つけ出し 3. 診断日 4. 届出票の作成例示 東京都地域がん登録室 1 1. 届出対象 1 原発部位で届出 2 入院 外来を問わず 当該腫瘍に対して 自施設を初診し 診断あるいは治療の対象 ( 経過観察を含む ) となった腫瘍を届出 3 届出対象となった腫瘍を 1 腫瘍 1 届出の形で届出
平成 28 年度東京都がん登録説明会資料 2-1 がん登録届出実務について (1) 1. 届出対象 2. 届出候補見つけ出し 3. 診断日 4. 届出票の作成例示 東京都地域がん登録室 1 1. 届出対象 1 原発部位で届出 2 入院 外来を問わず 当該腫瘍に対して 自施設を初診し 診断あるいは治療の対象 ( 経過観察を含む ) となった腫瘍を届出 3 届出対象となった腫瘍を 1 腫瘍 1 届出の形で届出
Microsoft PowerPoint - 【資料3】届出マニュアル改訂について
 国立がん研究センターがん対策情報センター National Cancer Center Center for Cancer Control and Information Services 全国がん登録届出マニュアル 2016 2017 改訂版の発行について 国立研究開発法人国立がん研究センター がん対策情報センターがん登録センター 柴田亜希子 1 国立がん研究センターがん対策情報センター National
国立がん研究センターがん対策情報センター National Cancer Center Center for Cancer Control and Information Services 全国がん登録届出マニュアル 2016 2017 改訂版の発行について 国立研究開発法人国立がん研究センター がん対策情報センターがん登録センター 柴田亜希子 1 国立がん研究センターがん対策情報センター National
<4D F736F F D208EA18CB182C98AD682B782E995578F808BC696B18EE88F878F E38E748EE593B1816A E7B8D732E646F637
 治験に関する標準業務手順書 ( 医師主導治験 ) 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医師主導治験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 (
治験に関する標準業務手順書 ( 医師主導治験 ) 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医師主導治験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 (
国立病院機構大阪医療センター受託研究取扱細則
 国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
研究報告書レイアウト例(当該年度が最終年度ではない研究班の場合)
 長寿医療研究開発費平成 29 年度総括研究報告 治験関連情報の一元管理を可能とする治験管理システムの開発 (29-44) 主任研究者平島学国立長寿医療研究センター 治験 臨床研究推進センター ( 治験 臨床研究主任薬剤師 ) 研究要旨治験には 症例実施時に発生する費用があり 治験薬の投与期間や治験の進捗状況に応じて依頼者毎で請求時期が異なっている 現状では 契約 進捗 請求の情報が 別々の情報として管理されているため
長寿医療研究開発費平成 29 年度総括研究報告 治験関連情報の一元管理を可能とする治験管理システムの開発 (29-44) 主任研究者平島学国立長寿医療研究センター 治験 臨床研究推進センター ( 治験 臨床研究主任薬剤師 ) 研究要旨治験には 症例実施時に発生する費用があり 治験薬の投与期間や治験の進捗状況に応じて依頼者毎で請求時期が異なっている 現状では 契約 進捗 請求の情報が 別々の情報として管理されているため
<4D F736F F F696E74202D2090BB91A294CC94848CE392B28DB CC905C90BF82C982C282A282C45F F566F6C2E33>
 この冊 における製造販売後調査等とは 使 成績調査 特定使 成績調査 副作 感染症報告 です 1/Mar/2016 Vol.3 1 ホームページのご案内 1 当院ホームページに手続き内容や 必要書類等を UP しています 2 依頼者のページ 3 製造販売後調査について 1 治験のお知らせ 2 ホームページのご案内 2 当院ホームページに手続き内容や 必要書類等を UP しています 申請の内容に応じて
この冊 における製造販売後調査等とは 使 成績調査 特定使 成績調査 副作 感染症報告 です 1/Mar/2016 Vol.3 1 ホームページのご案内 1 当院ホームページに手続き内容や 必要書類等を UP しています 2 依頼者のページ 3 製造販売後調査について 1 治験のお知らせ 2 ホームページのご案内 2 当院ホームページに手続き内容や 必要書類等を UP しています 申請の内容に応じて
製造販売後調査事務手続き等 について
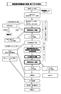 製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
二国間交流事業セミナー報告書 ( 様式 5) 20XX 年 11 月 15 日 独立行政法人日本学術振興会理事長殿 セミナー終了 ( 整理会を行う場合は整理会終了後 ) の翌月末 または平成 31 年 4 月末日のいずれか早い方の日までに提出 する必要があり 期限内の日付で作成してください セミナー
 二国間交流事業セミナー報告書 ( 様式 5) 20XX 年 11 月 15 日 独立行政法人日本学術振興会理事長殿 セミナー終了 ( 整理会を行う場合は整理会終了後 ) の翌月末 または平成 31 年 4 月末日のいずれか早い方の日までに提出 する必要があり 期限内の日付で作成してください セミナー代表者所属 部局 大学 研究科研究課題名や研究代表者所属 部局 職 氏名などは 実施計画書と整合性 (
二国間交流事業セミナー報告書 ( 様式 5) 20XX 年 11 月 15 日 独立行政法人日本学術振興会理事長殿 セミナー終了 ( 整理会を行う場合は整理会終了後 ) の翌月末 または平成 31 年 4 月末日のいずれか早い方の日までに提出 する必要があり 期限内の日付で作成してください セミナー代表者所属 部局 大学 研究科研究課題名や研究代表者所属 部局 職 氏名などは 実施計画書と整合性 (
07案3団体あて臨床研究法COI通知
 様式 A 利益相反管理基準 ver.3.0 日付所属機関立場氏名利用基準 研究課題 : 基準 1 基準 2 研究責任医師は 次に掲げる事項について 研究計画書及び説明文書に記載し 研究結果の公表時に開示すること 研究責任医師以外の者が研究成果を公表する場合も 同様に開示すること 1 規則第 21 条第 1 項第 1 号に規定する関与 ( 研究に対する関与 ) として 次に掲げる関与が有る場合には その内容ア医薬品等製造販売業者
様式 A 利益相反管理基準 ver.3.0 日付所属機関立場氏名利用基準 研究課題 : 基準 1 基準 2 研究責任医師は 次に掲げる事項について 研究計画書及び説明文書に記載し 研究結果の公表時に開示すること 研究責任医師以外の者が研究成果を公表する場合も 同様に開示すること 1 規則第 21 条第 1 項第 1 号に規定する関与 ( 研究に対する関与 ) として 次に掲げる関与が有る場合には その内容ア医薬品等製造販売業者
<4D F736F F D20288CF68A4A BD90AC E937891E63589F193BF938791E58A7797D58FB08CA48B DB888CF88F589EF8B638E E7C>
 平成 30 年度第 5 回徳島大学臨床研究審査委員会議事要旨 開催日時 : 平成 30 年 10 月 31 日 ( 水 )16:30~18:00 開催場所 : 医学基礎 A 棟 1 階医学部第 2 会議室出席者 : 橋本委員長 高山委員 野間口委員 邉見委員 小巻委員 永本委員 平野委員 香留委員 池田委員欠席者 : なし陪席者 : 臨床試験管理センター 楊河センター部長 軒原特任講師 武智特任助教
平成 30 年度第 5 回徳島大学臨床研究審査委員会議事要旨 開催日時 : 平成 30 年 10 月 31 日 ( 水 )16:30~18:00 開催場所 : 医学基礎 A 棟 1 階医学部第 2 会議室出席者 : 橋本委員長 高山委員 野間口委員 邉見委員 小巻委員 永本委員 平野委員 香留委員 池田委員欠席者 : なし陪席者 : 臨床試験管理センター 楊河センター部長 軒原特任講師 武智特任助教
独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版
 独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版 第 1 章総則 1. 目的と適用範囲この標準業務手順書は 独立行政法人国立病院機構仙台医療センターにおける医薬品の再審査申請 再評価申請の際に提出すべき資料の収集のための 使用成績調査 及び 特定使用成績調査
独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版 第 1 章総則 1. 目的と適用範囲この標準業務手順書は 独立行政法人国立病院機構仙台医療センターにおける医薬品の再審査申請 再評価申請の際に提出すべき資料の収集のための 使用成績調査 及び 特定使用成績調査
 気軽に声をかけてください 乳がんのホルモン療法は長期に わたります わからないことや アナストロゾールまたは レトロゾールを 服用される患者さんへ 安心してホルモン療法を続けていただくために 不安なことがあればどんなこと で も 気 軽 に 主 治 医 や 薬 剤 師 看護師などに相談してください 貴女の治療に関わる医療スタッフ とともに あせらず 気 長に取り 組んでいきましょう かかりつけの病院情報
気軽に声をかけてください 乳がんのホルモン療法は長期に わたります わからないことや アナストロゾールまたは レトロゾールを 服用される患者さんへ 安心してホルモン療法を続けていただくために 不安なことがあればどんなこと で も 気 軽 に 主 治 医 や 薬 剤 師 看護師などに相談してください 貴女の治療に関わる医療スタッフ とともに あせらず 気 長に取り 組んでいきましょう かかりつけの病院情報
Microsoft PowerPoint - 運用 [互換モード]
![Microsoft PowerPoint - 運用 [互換モード] Microsoft PowerPoint - 運用 [互換モード]](/thumbs/91/105850431.jpg) 押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
IRB の 4 週間前までに事前確認に必要な資料をご提出ください 必要時にはヒアリングも実施いたします IRB 審議用確認資料 電子 ( メール ) にてご提出ください 製造販売後調査申請書 ( 様式 1) 1 部 審査用資料 1 薬品概要書 ( 添付文書でも可 ) 1 部 2 調査実施計画書 (
 国立大学法人信州大学医学部附属病院製造販売後調査実施に係わる手続き要領 2018 年 4 月 はじめにご確認ください 本要領の対象となる調査は 再審査 再評価のために GPSP で規定された日常診療下で実施される調査です 製薬会社が独自で行う調査 (= 観察研究 ) は対象外です 独自に実施する調査は 臨床研究として信州大学医学部医倫理委員会で審議となります 各種手続きについて担当医師又は信州大学医学部庶務係
国立大学法人信州大学医学部附属病院製造販売後調査実施に係わる手続き要領 2018 年 4 月 はじめにご確認ください 本要領の対象となる調査は 再審査 再評価のために GPSP で規定された日常診療下で実施される調査です 製薬会社が独自で行う調査 (= 観察研究 ) は対象外です 独自に実施する調査は 臨床研究として信州大学医学部医倫理委員会で審議となります 各種手続きについて担当医師又は信州大学医学部庶務係
目次 1. はじめに ( 臨床研究とは ) 今回の研究について 目的 方法 対象となる患者さん 研究方法 スケジュール 研究参加期間 研究参加予定人数.
 患者さんへ 粘膜免疫誘導による感染防御 発症予防効果の POC 評価値 の検討 臨床研究についての説明文書 2016 年 10 月 18 日作成第 1.0 版 研究責任者 : 国立病院機構三重病院院長藤澤隆夫 目次 1. はじめに ( 臨床研究とは )... 1 2. 今回の研究について... 1 3. 目的... 1 4. 方法... 1 4-1. 対象となる患者さん... 1 4-2. 研究方法...
患者さんへ 粘膜免疫誘導による感染防御 発症予防効果の POC 評価値 の検討 臨床研究についての説明文書 2016 年 10 月 18 日作成第 1.0 版 研究責任者 : 国立病院機構三重病院院長藤澤隆夫 目次 1. はじめに ( 臨床研究とは )... 1 2. 今回の研究について... 1 3. 目的... 1 4. 方法... 1 4-1. 対象となる患者さん... 1 4-2. 研究方法...
大学院博士課程共通科目ベーシックプログラム
 平成 30 年度医科学専攻共通科目 共通基礎科目実習 ( 旧コア実習 ) 概要 1 ). 大学院生が所属する教育研究分野における実習により単位認定可能な実習項目 ( コア実習項目 ) 1. 組換え DNA 技術実習 2. 生体物質の調製と解析実習 3. 薬理学実習 4. ウイルス学実習 5. 免疫学実習 6. 顕微鏡試料作成法実習 7. ゲノム医学実習 8. 共焦点レーザー顕微鏡実習 2 ). 実習を担当する教育研究分野においてのみ単位認定可能な実習項目
平成 30 年度医科学専攻共通科目 共通基礎科目実習 ( 旧コア実習 ) 概要 1 ). 大学院生が所属する教育研究分野における実習により単位認定可能な実習項目 ( コア実習項目 ) 1. 組換え DNA 技術実習 2. 生体物質の調製と解析実習 3. 薬理学実習 4. ウイルス学実習 5. 免疫学実習 6. 顕微鏡試料作成法実習 7. ゲノム医学実習 8. 共焦点レーザー顕微鏡実習 2 ). 実習を担当する教育研究分野においてのみ単位認定可能な実習項目
診療科 血液内科 ( 専門医取得コース ) 到達目標 血液悪性腫瘍 出血性疾患 凝固異常症の診断から治療管理を含めた血液疾患一般臨床を豊富に経験し 血液専門医取得を目指す 研修日数 週 4 日 6 ヶ月 ~12 ヶ月 期間定員対象評価実技診療知識 1 年若干名専門医取得前の医師業務内容やサマリの確認
 血液内科 ( 専門医取得コース ) 血液悪性腫瘍 出血性疾患 凝固異常症の診断から治療管理を含めた血液疾患一般臨床を豊富に経験し 血液専門医取得を目指す 週 4 日 6 ヶ月 ~12 ヶ月 1 年若干名専門医取得前の医師業務内容やサマリの確認骨髄穿刺 腰椎穿刺など外来 講義 研究会発表 症例検討 教授回診骨髄採取手術 外来 17:00~ 17:30~ 移植カンファレンス カンファレンス 抄読会 骨髄スメア検鏡会
血液内科 ( 専門医取得コース ) 血液悪性腫瘍 出血性疾患 凝固異常症の診断から治療管理を含めた血液疾患一般臨床を豊富に経験し 血液専門医取得を目指す 週 4 日 6 ヶ月 ~12 ヶ月 1 年若干名専門医取得前の医師業務内容やサマリの確認骨髄穿刺 腰椎穿刺など外来 講義 研究会発表 症例検討 教授回診骨髄採取手術 外来 17:00~ 17:30~ 移植カンファレンス カンファレンス 抄読会 骨髄スメア検鏡会
ICH-GCPとJ-GCPとの比較表
 参考資料 10 我が国の GCP と ICH-GCP の主な 1 治験の契約に関する規定 1-1 契約者に関する規定 1-2 実施医療機関の長との契約を規定したことに伴う規定 2 治験審査委員会 (IRB) に関する規定 2-1 IRB の設置に関する規定 2-2 IRB への審議依頼に関する規定 1/11 1. 治験の契約に関する規定 1-1. 契約者に関する規定 ICH-GCP 1.17( 用語の定義
参考資料 10 我が国の GCP と ICH-GCP の主な 1 治験の契約に関する規定 1-1 契約者に関する規定 1-2 実施医療機関の長との契約を規定したことに伴う規定 2 治験審査委員会 (IRB) に関する規定 2-1 IRB の設置に関する規定 2-2 IRB への審議依頼に関する規定 1/11 1. 治験の契約に関する規定 1-1. 契約者に関する規定 ICH-GCP 1.17( 用語の定義
1998
 新潟県立中央病院医療機器製造販売後調査及び臨床研究取扱い要領 2012.7.5 (1) 製造販売後調査及び臨床研究の対象医療機器は 当院採用の医療機器に限るものとする 当該医療機器は保険適用内で使用し 医薬品の市販後調査の基準に関する省令 ( 平成 9 年 3 月 10 日厚生省令第 10 号 :GPMSP 省令 (Good Post-marketing Surveillance Practice)
新潟県立中央病院医療機器製造販売後調査及び臨床研究取扱い要領 2012.7.5 (1) 製造販売後調査及び臨床研究の対象医療機器は 当院採用の医療機器に限るものとする 当該医療機器は保険適用内で使用し 医薬品の市販後調査の基準に関する省令 ( 平成 9 年 3 月 10 日厚生省令第 10 号 :GPMSP 省令 (Good Post-marketing Surveillance Practice)
前立腺癌は男性特有の癌で 米国においては癌死亡者数の第 2 位 ( 約 20%) を占めてい ます 日本でも前立腺癌の罹患率 死亡者数は急激に上昇しており 現在は重篤な男性悪性腫瘍疾患の1つとなって図 1 います 図 1 初期段階の前立腺癌は男性ホルモン ( アンドロゲン ) に反応し増殖します そ
 再発した前立腺癌の増殖を制御する新たな分子メカニズムの発見乳癌治療薬が効果的 発表者筑波大学先端領域学際研究センター教授柳澤純 (junny@agbi.tsukuba.ac.jp TEL: 029-853-7320) ポイント 女性ホルモンが制御する新たな前立腺癌の増殖 細胞死メカニズムを発見 女性ホルモン及び女性ホルモン抑制剤は ERβ 及び KLF5 を通じ FOXO1 の発現量を変化することで前立腺癌の増殖
再発した前立腺癌の増殖を制御する新たな分子メカニズムの発見乳癌治療薬が効果的 発表者筑波大学先端領域学際研究センター教授柳澤純 (junny@agbi.tsukuba.ac.jp TEL: 029-853-7320) ポイント 女性ホルモンが制御する新たな前立腺癌の増殖 細胞死メカニズムを発見 女性ホルモン及び女性ホルモン抑制剤は ERβ 及び KLF5 を通じ FOXO1 の発現量を変化することで前立腺癌の増殖
2017 年 12 月 15 日 報道機関各位 国立大学法人東北大学大学院医学系研究科国立大学法人九州大学生体防御医学研究所国立研究開発法人日本医療研究開発機構 ヒト胎盤幹細胞の樹立に世界で初めて成功 - 生殖医療 再生医療への貢献が期待 - 研究のポイント 注 胎盤幹細胞 (TS 細胞 ) 1 は
 2017 年 12 月 15 日 報道機関各位 国立大学法人東北大学大学院医学系研究科国立大学法人九州大学生体防御医学研究所国立研究開発法人日本医療研究開発機構 ヒト胎盤幹細胞の樹立に世界で初めて成功 - 生殖医療 再生医療への貢献が期待 - 研究のポイント 注 胎盤幹細胞 (TS 細胞 ) 1 は 自己複製能と胎盤の細胞に分化する能力を持った胎盤由来の特殊な細胞である 本研究において ヒト胎盤の細胞
2017 年 12 月 15 日 報道機関各位 国立大学法人東北大学大学院医学系研究科国立大学法人九州大学生体防御医学研究所国立研究開発法人日本医療研究開発機構 ヒト胎盤幹細胞の樹立に世界で初めて成功 - 生殖医療 再生医療への貢献が期待 - 研究のポイント 注 胎盤幹細胞 (TS 細胞 ) 1 は 自己複製能と胎盤の細胞に分化する能力を持った胎盤由来の特殊な細胞である 本研究において ヒト胎盤の細胞
5. 診療科名他の情報と診療科名を照合することにより患者が特定され得る場合, 診療科名は記載しない. 6. 患者が診断 治療を受けた施設名等既に他院などで診断 治療を受けている場合, その施設名ならびに所在地を記載しない. 但し, 救急医療などで搬送元の記載が不可欠の場合はこの限りではない. 7.
 症例報告を含む論文および学会 研究会発表における患者のプライバシー保護に関する指針 医療の実施に当たって患者のプライバシーを保護することは従来から薬剤師および医療従事者に求められてきた重要な倫理的 法的義務である. 一方, 薬学研究において症例報告は薬学 医療の進歩と発展に大いに寄与するものであり, 国民の健康および福祉の向上に重要な役割を果たしている. そのような症例報告においても, 医療の場合と同様に,
症例報告を含む論文および学会 研究会発表における患者のプライバシー保護に関する指針 医療の実施に当たって患者のプライバシーを保護することは従来から薬剤師および医療従事者に求められてきた重要な倫理的 法的義務である. 一方, 薬学研究において症例報告は薬学 医療の進歩と発展に大いに寄与するものであり, 国民の健康および福祉の向上に重要な役割を果たしている. そのような症例報告においても, 医療の場合と同様に,
蘇生をしない指示(DNR)に関する指針
 蘇生術を行わない (DNR) 指示に関する指針 008 年 月 0 日坂総合病院管理部 DNR(Do Not Resuscitate) とは 終末期状態の患者 ( 癌の末期 老衰 救命の可能性がない患者など ) で 心肺停止時に蘇生術を行わないことをいう DNR を医師が指示することを DNR 指示 という 本指針でいう心肺停止時の蘇生術とは 心臓マッサージ 電気的除細動 気管内挿管 人工呼吸器の装着
蘇生術を行わない (DNR) 指示に関する指針 008 年 月 0 日坂総合病院管理部 DNR(Do Not Resuscitate) とは 終末期状態の患者 ( 癌の末期 老衰 救命の可能性がない患者など ) で 心肺停止時に蘇生術を行わないことをいう DNR を医師が指示することを DNR 指示 という 本指針でいう心肺停止時の蘇生術とは 心臓マッサージ 電気的除細動 気管内挿管 人工呼吸器の装着
