PowerPoint プレゼンテーション
|
|
|
- あゆみ おおはし
- 5 years ago
- Views:
Transcription
1 第 23 回日本輸血 細胞治療学会秋季シンポジウム ( 金沢商工会議所会館 ) 遺伝子治療と関連法規 金沢工業大学山口照英 8/10/2016 遺伝子治療開発とベクター 遺伝子治療臨床研究と治験による開発 遺伝子治療指針の改定と承認制度 1
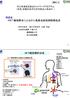
2 2017/9/13 遺伝子治療用製品の種類と遺伝子治療の方法 遺伝子治療用ベクター製品 (in vivo遺伝子治療) 遺伝子導入細胞製品 (ex vivo遺伝子治療) ベクターの 直接投与 ベクターの例 (自己 同種) ウイルスベクター 造血幹細胞 T細胞 等 標的細胞を取り出す 培養 増幅 遺伝子導入 Retrovirus Lentivirus Adenovirus AAV etc. プラスミドベクター Naked DNA Lipofection 腫瘍内 筋 肉内眼内 脳内 皮内 等 培養 増幅 輸 注 腫瘍溶解性ウイルス Herpesvirus Adenovirus etc. 増殖性細菌ベクター Listeria Clostridium etc. 遺伝子治療の代表的な対象 疾患と導入遺伝子の例 遺伝性疾患 欠損遺伝子 がん キメラ抗原受容体 CAR) 抗原特異的T細胞受容体 がん抗原 サイトカイン 等 遺伝子導入 細胞 TALENやCRISPR-Cas等の ゲノム編集技術を用いた より安全性の高い治療 が期待されている 遺伝子治療ベクターと臨床適用 遺伝子治療ベクターとして用いられるもの ウイルスベクター 非増殖性 増殖性ベクター 腫瘍溶解性ウイルス等 プラスミド バクテリアベクター 腫瘍溶解性組換えバクテリ ア ベクターとしての特徴 染色体への挿入 インテグラーゼ活性をもつ 核内での遺伝子発現 アデノウイルスベクター プ ラスミド 核外での遺伝子発現 センダイウイルスベクター Ex vivo遺伝子導入 ヒトへの直接投与 2
3 ウイルスベクターの特徴 アデノウイルスベクター 一過性 大量発現 全長 36Kb であり長い遺伝子が搭載可能 受容体 :CAR ヒトの方がマウスより入りやすい 免疫原性 造血細胞へは入りにくい. 非エンベロープウイルス 正 20 面体 アデノ随伴ウイルス (AAV) ベクター ゲノムに組込まれない 長期安定性 搭載可能な遺伝子の大きさが限定 ( 全長 4.7Kb) レトロウイルスベクター ゲノムに組み込まれる 長期間安定 により望ましくない宿主遺伝子の発現の可能性 レンチウイルスベクター (HIV ベクターやサル免疫不全ウイルス (SIV) ベクター ) ゲノムに組込まれ 長期間安定発現 高い造血幹細胞への導入 非増殖細胞へ導入可能 センダイウイルスベクター 細胞質でのみ遺伝子発現 高い免疫反応性 挿入変異が無い 長い遺伝子 + 複数の遺伝子の搭載が可能. 主な遺伝子治療用ベクターの構造 ( 例 ) レトロウイルスベクター カプシド ウイルスゲノム エンベロープ エンベロープタンパク質 アデノウイルスベクター ウイルスゲノムの構造 野生性レトロウイルス 非増殖性 レトロウイルスベクター ψ gag pol env ψ フ ロモーター目的遺伝子 野生型アデノウイルス 非増殖性アデノウイルスベクター ITR ITR E1 領域 DE1 約 36kb DE3 E3 領域 ITR ITR アデノ随伴ウイルス (AAV) ベクター フ ロモーター目的遺伝子プラスミドベクター複製起点 : Long Terminal Repeat ψ: パッケージングシグナル ITR: Inverted Terminal Repeat プロモーター 野生型 AAV AAV ベクター ITR ITR Rep フ ロモーター目的遺伝子約 4.7kb ITR ITR 選択マーカー遺伝子 poly A 付加シグナル プラスミド DNA 目的遺伝子 3
4 遺伝子治療開発とベクター 遺伝子治療臨床研究と治験による開発 遺伝子治療指針の改定と承認制度 遺伝子治療の実用化への動きと安全性等の動向 遺伝子治療開発がスタートして 20 年以上が経過 有効性や安全性に関する様々な情報が蓄積 この間に得られた情報に基づいてガイドライン等の整備が行われてきた エポックメイキングな出来事と規制当局の動きを振り返ってみる ICH 活動等を通じた規制の国際調和 我が国の指針改定への反映 4
5 遺伝子治療の成功例と副作用 成功例 アデノシンデアミナーゼ欠損症 (ADA-SCID) X 連鎖重症複合免疫不全症 (X-SCID) 慢性肉芽腫症 (CGD) パーキンソン病 レーバー先天性黒内障 (LCA) 10 名全員が視力 ( 光感受性 ) 回復 (2009) 副腎白質ジストロフィー (ALD) 2 名とも症状の進行停止 (2009) β サラセミア (2010) 重篤な副作用 アデノウイルスベクターの投与による異常免疫反応により死亡 ( 米 1999 年 ) X-SCID 遺伝子治療でレトロウイルスベクターによる遺伝子の染色体挿入により 20 名中 5 名に T 細胞白血病様症状発症 ( 仏英 2002 年 ~) 単一遺伝子疾患では目覚ましい成果が得られているが がんなどの非遺伝的疾患に対する効果は限定的 ( がんに対しても著効を示す事例が出始めている ) 予想外の重篤な副作用も生じるなど 遺伝子治療はまだ医療として十分確立されたものではないが 安全性 有効性を高めるための研究が進められている 承認年実施機関 ( 付属病院 ) 対象疾患 導入方法 ( 導入細胞 ) 導入遺伝子 実施状況 ( 症例数 ) 1995 北海道大 ADA 欠損症レトロ (T cell) ADA 終了 (1) 1998 東大医科学研究所腎細胞がんレトロ ( がん細胞 ) GM-CSF 終了 (4) 岡山大, 東京医大 慈恵医大 東北大 / RPR ジェンセル 非小細胞肺がんアデノ p53 治験 臨床研究終了 ( 計 15) # 癌研究会乳がんレトロ (HSC) MDR1 継続 (3) 2000 名古屋大悪性グリオーマリポソーム IFN-b 終了 (5) 2000 岡山大前立腺がんアデノ HSV-tk 終了 (9) 2001 大阪大閉塞性動脈硬化症プラスミド HGF 終了 (22) 2002 筑波大 再発白血病 (GVHD 防止 ) レトロ (T cell) HSV-tk / DLNGFR 継続 (5) 2002 北海道大 ADA 欠損症レトロ (HSC) ADA 継続 (2) 2003 神戸大前立腺がんアデノ HSV-tk 終了 (6) 2003 信州大悪性黒色腫リポソーム IFN-b 終了 (5) 2006 九州大閉塞性動脈硬化症センダイウイルス FGF-2 終了 (12) 2006 自治医大 日本の遺伝子治療臨床研究 1 進行期パーキンソン病 AAV AADC 終了 (6) 2007 北里大前立腺がんアデノ HSV-tk 終了 (5) 5
6 日本の遺伝子治療臨床研究 2 承認年 実施機関 ( 付属病院 ) 対象疾患導入方法 ( 導入細胞 ) 導入遺伝子 実施状況 ( 症例数 ) 2008 岡山大前立腺がんアデノ IL-12 実施中 2009 東京大 / 東大医科研進行性膠芽腫腫瘍溶解性 HSV-1 (HSV1 G47Δ) 実施中 2009 国立がんセンター白血病 (GVHD 防止 ) レトロ (T cell) HSV-tk/DLNGFR 実施中 2009 三重大食道がんレトロ (T cell) MAGE-A4 特異的 TCR 終了 (15) 2009 京都府立医大腎細胞がんリポソーム IFN-b 実施中 2011 岡山大前立腺がんアデノ 2012 成育医療研究センター がん抑制遺伝子 REIC/Dkk-3 実施中 慢性肉芽腫症レトロ (HSC) gp91phox 実施中 2012 東京大前立腺がん腫瘍溶解性 HSV-1 (HSV1 G47Δ) 実施中 2012 九州大網膜色素変性サル免疫不全ウイルス 色素上皮由来因子 hpedf 2012 岡山大頭頸部 胸部悪性腫瘍腫瘍溶解性アデノ (Telomelysin) 実施中 2013 三重大愛媛大藤田保健大名古屋大 終了 急性骨髄性白血病レトロ (T cell) WT1 特異的 TCR 実施中 2013 三重大食道がんレトロ (T cell) MAGE-A4 特異的 TCR 実施中 日本の遺伝子治療臨床研究 3 承認年 実施機関 ( 付属病院 ) 2013 千葉大 対象疾患導入方法 ( 導入細胞 ) 導入遺伝子実施状況 家族性レシチンコレステロールアシルトランスフェラーゼ (LCAT) 欠損症 レトロ ( 前脂肪細胞 ) LCAT 実施中 2013 千葉大悪性胸膜中皮腫アデノ NK4 実施中 2013 東大医科研進行性嗅神経芽細胞腫腫瘍溶解性 HSV-1 (HSV1 G47Δ) 実施中 2014 自治医大難治性 B 細胞リンパ腫レトロ (T cell) CD19 特異的 CAR 実施中 2014 岡山大悪性胸膜中皮腫アデノ 2014/ 2015 大阪大神戸大佐賀大新潟大徳島大愛媛大 閉塞性動脈硬化症 バージャー病 がん抑制遺伝子 REIC/Dkk-3 実施中 プラスミド HGF 実施中 2015 自治医大パーキンソン病 AAV AADC 実施中 2015 自治医大 AADC 欠損症 AAV AADC 実施中 6
7 がん遺伝子治療の最新動向遺伝子導入 T 細胞療法 がん抗原を認識するT 細胞受容体遺伝子や がん抗原特異抗体の抗原認識部位とT 細胞活性化領域を結合したキメラ受容体遺伝子を導入した自己 T 細胞を用いる養子免疫遺伝子治療が増加キメラ抗原受容体 (CART19) 遺伝子治療 三重大等で実施中の T 細胞受容体 (TCR) 遺伝子治療の例 抗原認識部位 T 細胞 がん抗原特異抗体 がん抗原 高い有効性の一方でサイトカインストームなど重篤な副作用も認められている ( 三重大 HP より ) キメラ受容体 腫瘍表面抗原の認識 /T 細胞活性化 がん細胞 副作用が認められた場合の素早い対応が必要 品質 安全性 ( 別表を含む ): 薬事法に基づく開発との整合性 臨床研究で得られた成果を薬事法での開発に活用 研究開発プロセス 基礎研究 薬事戦略相談 基礎研究 再生医療等製品の条件 期限付早期承認 究非臨床研 非臨床研究 製薬企業 アカデミア等 治験届 アカデミア 再生医療等評価部会 PMDA 30 日調査 臨床研究 特定の医療機関で実施 ( 第治一験相 ) 臨床研究から治験へのスムーズな移行 有効性の推定 安全性の確認 アウトプット 付条承件認期限 ( 治第験二相 ) を性市検安販証全有 ) 性効 ( 第治三験相 ) 製法確立 品質評価法の確立 有効性 安全性の確認 論文発表等 先進医療等 ( 患者申出療養 再度承認申請 付承承認認又失は効期限 申請と承認 製薬企業 市販 市販 同一 ( 同等 ) の遺伝子治療製品を全ての医療機関で利用可能に 7
8 臨床研究から治験への移行例 ベクター等対象疾患臨床研究治験 HGF 発現プラスミドコラテジェン 重症虚血肢 大阪大 ( ) アンジェス MG (2003-) hfgf2 発現センダイウイルス 高度間歇性跛行 九大 ( ) 九大 (2014-) 腫瘍溶解性ヘルペスウイルス G47Δ 先駆け審査指定 MAGE-A4 抗原特異的 TCR 遺伝子導入 T リンパ球 * REIC/Dkk-3 発現アデノウイルス * 進行性膠芽腫 固形癌 悪性胸膜中皮腫 東大 / 東大医科研 (2009-) 三重大 ( ) 岡山大 (2014-) 東大医科研 (2014-) 第一三共 三重大 (2014-) 杏林製薬 (2015-) *: 臨床研究と治験で変更あり 日本では治験に先だち臨床研究が実施されることが多い 遺伝子治療開発とベクター 遺伝子治療臨床研究と治験による開発 遺伝子治療指針の改定と承認制度 8
9 日本の遺伝子治療関連指針 臨床研究遺伝子治療臨床研究に関する指針 2002 年 3 月 27 日文部科学省 厚生労働省告示第 1 号 2004 年 12 月 28 日文部科学省 厚生労働省告示第 2 号 ( 全部改正 ) 治験遺伝子治療用医薬品の品質及び安全性の確保に関する指針 1995 年 11 月 15 日厚生省薬務局長通知薬発第 1062 号 2013 年 7 月 1 日医薬食品局審査管理課長通知 : 確認申請制度の廃止に伴う改正 主な論点 臨床研究指針 : 定義 ( 予防?) 適用範囲 対象疾患の見直しの必要性 計画書に記載すべき品質 安全性確保項目の具体的な説明がない 医薬品指針 : 品質 安全性確保に関する内容は 20 年近く見直しが行われていない 治験開始前の要件と承認申請の要件が区別されていない この間の科学技術の進歩や臨床試験の経験の反映 海外の規制の動向を取り込む必要性 遺伝子治療の法規制の変化 薬事法の改正 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 医薬品医療機器等法 / 薬機法 ) ( 平成 25 年 11 月 27 日公布 26 年 11 月 25 日施行 ) 医薬品 医療機器 とは別に 再生医療等製品 という区分を新たに定義 遺伝子治療を目的として 人の細胞に導入して使用するもの は 再生医療等製品 に分類 ( 遺伝子治療用医薬品ではなく遺伝子治療用製品 ) 再生医療等製品 の条件 期限付承認制度の創設による早期実用化 再生医療等の安全性の確保等に関する法律 ( 26 年 11 月 25 日施行 ) ex vivo 遺伝子治療は遺伝子導入細胞を用いた臨床研究となり 再生医療新法の 高リスク 第一種再生医療等として特定認定再生医療等委員会により審査を受ける (ex vivo と in vivo 遺伝子治療が異なる組織で審査を受ける ) 遺伝子治療臨床研究に関する指針 の一部改正について :ex vivo 遺伝子治療の除外と薬事法の名称変更に伴う改正 9
10 遺伝子治療関連指針改正の動き 遺伝子治療用医薬品の品質及び安全性の確保に関する指針 2012 年度より 革新的医薬品 医療機器 再生医療製品実用化促進事業 の研究班で品質 非臨床試験を中心に指針改正案を作成 2014 年 12 月に改正案を厚生労働省 PMDA に提案 2015 年 3-4 月に専門家 ( 遺伝子治療学会 ) 及び産業界 ( 製薬協 ) に意見を求めた 意見を参考に修正した最終案と Q&A を 2015 年 10 月に厚生労働省に提出 遺伝子治療臨床研究に関する指針 厚生科学審議会の科学技術部会の下に遺伝子治療臨床研究に関する指針の見直しに関する専門委員会を設置 2013 年 6 月 4 日 ( 第 1 回 ) から 2014 年 8 月 29 日 ( 第 8 回 ) 品質 安全性に関する評価項目の詳細に関しては専門委員会の下にサブグループを設置して議論 ( 治験指針の改正案との整合性 ) 遺伝子治療臨床研究に関する指針改正案の意見募集 ( 平成 26 年 12 月 23 日 ~ 平成 27 年 1 月 21 日 ) 遺伝子治療等臨床研究に関する指針 告示 ( ) 遺伝子治療臨床研究指針の改定と遺伝子治療製品指針との整合性 再生医療新法 遺伝子治療薬指針の改正 10
11 遺伝子治療等臨床研究に関する指針 の構成 指針本体 ( 大臣告示 ) 第一章総則 第一目的 第二用語の定義 第三適用範囲 第四遺伝子治療等臨床研究の対象の要件 第五有効性及び安全性 第六品質等の確認 第七生殖細胞等の遺伝的改変の禁止 第八適切な説明に基づくインフォームド コンセントの確保 第九公衆衛生上の安全の確保 第十情報の公開 第十一被験者の選定 第二章研究者等の責務等 第三章研究計画書 第四章倫理審査委員会 第五章インフォームド コンセント等 第六章厚生労働大臣の意見等 第七章個人情報等 第八章重篤な有害事象への対応 第九章研究の信頼性確保 第十章雑則 研究計画書 ( 課長通知別表 1) 1. 遺伝子治療等臨床研究の名称 2. 研究責任者及びその他の研究者の氏名並びに当該遺伝子治療等臨床研究において果たす役割 3. 研究機関 共同研究機関の名称及びその所在地 4. 遺伝子治療等臨床研究の目的 意義 5. 遺伝子治療等臨床研究の実施方法及び期間 6. 対象疾患及びその選定理由 7. 被験者の選定方針 8. 導入する遺伝子及び遺伝子の導入方法 (1) 開発の経緯 (2) 導入する遺伝子 (3) 遺伝子の導入方法 (4) 被験者に投与する最終産物の組成 必要とされるデータの整理 ( 科学的合理性 ) 課長通知別表 1 の別添 遺伝子治療等臨床研究計画書に係る品質及び安全性に関する評価項目の記載における留意事項について 8 導入する遺伝子及び遺伝子の導入方法 の項について (1) 開発の経緯 の項について 遺伝子治療臨床研究の申請に当たっては 当該ベクターを用いることにより目的とする疾患を治療することができることを ベクターの特性 治療効果を発揮するためにベクターに導入された目的遺伝子 ( 導入遺伝子 ) 及び遺伝子導入方法の観点から説明するとともに ベクターの特性から見た安全性等の情報について記載する 増殖性 選択的増殖性を示すウイルスベクターを使用する場合は その理論的根拠と臨床使用の妥当性について説明する 同一又は類似のベクターを用いた人への臨床試験が海外で既に行われている場合には 対象疾患を含めその概要 成果及び予定している臨床研究との相違点を説明すること 治験の指針との整合性品質試験や安全性確保の明確化 8 導入する遺伝子及び遺伝子の導入方法 ( 別表 1の別添 ) (1) 開発の経緯 (2) 導入する遺伝子 1) 遺伝子治療用ベクターの遺伝子構造 2) 導入遺伝子の由来及び構造と機能 3) 発現調節エレメントの構造と機能 4) 導入遺伝子からの発現産物の構造と機能 5) その他のエレメント及び翻訳可能領域の配置と機能 (3) 遺伝子の導入方法 1) ウイルスベクターを用いて遺伝子導入を行う場合イ ウイルスベクターの由来 粒子構造と機能 ロ ウイルスベクターの製造方法 1 製造に用いる原材料 2 ウイルスベクターの構築方法及びバンクシステム 3 ウイルスベクターの製造工程と工程管理 2) ウイルスベクター以外の方法を用いて遺伝子導入を行う場合イ 遺伝子導入方法 ロ プラスミドベクター及びキャリアーの作製方法 1 製造に用いる原材料 2 プラスミドベクターの構築方法及びバンクシステム 3 キャリアーの構造又は組成( キャリアーを用いて遺伝子導入する場合 ) 4 プラスミドベクターの製造工程と工程管理 3) 体外で目的細胞に遺伝子導入を行う場合 ( 参考 ) イ 標的とする細胞の種類 採取法及び加工方法 ロ ドナーの適格性 ハ 遺伝子導入細胞の加工方法( 遺伝子導入操作及び細胞培養 ) (4) 被験者に投与する最終産物の組成 11
12 レトロウイルスベクターの製造スキーム ψ gag Recombinant retrovirus vector plasmid pgp pol hhcv promotor Co-transfection pe-eco 生産培養 遺伝子治療用ベクターの遺伝子構造を明らかにすると共に ベクター製造工程を明らかにする必要がある ベクターの安全性や有効性は製造方法に依存している Retoro ウイルスベクターの製造スキーム ψ gag Recombinant retrovirus vector plasmid pgp pol hhcv promotor 製造工程において遺伝的変異が起きる可能性 ベクターの遺伝子配列解析製造に用いる生産細胞がウイルスに汚染されている可能性製造工程中に外来性ウイルスが迷入する可能性 ウイルス試験 pe-eco 増殖性ウイルスベクターを用いる場合には目的とするウイルスベクター Co-transfection がウイルス試験を妨害する可能性 目的ウイルスに対する中和抗体を使用 してウイルス試験を実施相同組換えにより増殖性ウイルスが出現する可能性 増殖性ウイルス試験 生産培養 遺伝子治療用ベクターの遺伝子構造を明らかにすると共に ベクター製造工程を明らかにする必要がある ベクターの安全性や有効性は製造方法に依存している 12
13 ウイルスベクターに混入する増殖性ウイルスの検出法 :CPE による検出と感染性 PCR 法 < 従来法 / 感染性試験 > レトロウイルスベクター増殖性ウイルス感染感受性細胞 1-9 日 < 感染性 PCR> 培養上清または細胞 3,4 日 継代 x 5 ウイルス濃縮 4 週間 1 日 感染 培養上清, 細胞可溶化液 指標細胞 ウイルス核酸の抽出 7 日 定量的 PCR によりウイルス核酸を定量 細胞変性効果 フォーカス形成等で判定 長期間の培養が必要 非定量的 迅速 高感度 定量的 製造工程と遺伝子治療ベクターの安全性 製造に用いたプラスミド ( ) がウイルスベクターのパッケージングに際してウイルス粒子内あるいはウイルスベクター外に混入してくる可能性がある ウイルスベクターの目的遺伝子のみならずプラスミドにコードされた遺伝子が発現される可能性 13
14 (1) ウイルスベクターや非ウイルスベクターの特性解析と品質試験 1) 特性解析 2) 感染性因子に関する試験 1 無菌試験( 細菌及びカビの試験 ) 9 特性解析と品質試験 2 マイコプラズマ否定試験 3 迷入感染性因子( ウイルス ) 試験 4 増殖性ウイルス試験( ウイルスベクターの場合 ) 3) 純度試験( 不純物試験 ) 4) 力価 生物活性( 導入遺伝子の活性を含む ) 5) 含量( 投与における物理量等 ) 6) 製品の特性に応じて実施する試験 7) 安定性 (2) 遺伝子導入細胞の特性解析と品質試験 1) 特性解析 2) 感染性因子に関する試験 1 無菌試験( 細菌及びカビの試験 ) 2 マイコプラズマ否定試験 3 迷入感染性因子( ウイルス ) 試験 4 増殖性ウイルス試験( ウイルスベクターの場合 ) 3) 純度試験( 不純物試験 ) 4) 細胞数 5) 生存率 6) 力価 生物活性 7) 安定性 ウイルスベクターによる細胞の遺伝子改変 Target Cells 非増殖性 レトロウイルスベクター ψ フ ロモーター Transfection 目的遺伝子 逆転写酵素による DNA 合成 Integration Replicated DNA mrna Protein of Interest 遺伝子治療としての効果発現 14
15 Ex vivo 遺伝子治療等臨床研究で用いる遺伝子導入細胞の品質 安全性について Ex vivo 遺伝子治療等臨床研究は総則以外は 遺伝子治療等臨床研究に関する指針 は適用外 通知の別表 1 の別添 遺伝子治療等臨床研究計画書に係る品質及び安全性に関する評価項目の記載における留意事項について には ex vivo 遺伝子治療等臨床研究の品質及び安全性に関する評価項目も参考として示されており 当該研究計画書の作成の際にも参照することが望ましい 遺伝子導入細胞の調製に用いるベクターの品質 安全性 体外で目的細胞に遺伝子導入を行う場合 遺伝子導入細胞の特性解析と品質試験 11 非臨床試験における安全性及び有効性の評価 (1) 臨床的有効性を予測するための試験 (2) 生体内分布 (3) 非臨床試験における安全性の評価 1) 一般毒性 2) その他 1 免疫原性 2 造腫瘍性 3 生殖細胞への意図しない組込みリスク 4 併用療法における安全性評価 (4) 非臨床試験の成績の総括 10 被験者への投与に用いられる特殊な機器や医療材料 15
16 遺伝子治療等臨床研究指針の改正のポイント 遺伝子治療の適用範囲 : 治療のみならず予防も含める 対象疾患等 : 治療 予防効果が 現在可能な他の方法と比較して同等以上であることが十分に予測されるものであること ( 重篤な疾患という制限を撤廃 ) 多施設共同研究への対応 臨床研究統合指針との整合性 研究に係る試料及び情報等の保管 研究に関する登録 公表 品質 安全性 ( 別表を含む ): 薬事法に基づく開発との整合性 臨床研究で得られた成果を薬事法での開発に活用 Ex vivo 遺伝子治療は総則以外適用外 ( 別表 1 別添の品質及び安全性に関する評価項目には ex vivo を残した ) 遺伝子治療等臨床研究指針の適用範囲 治療 予防効果が 現在可能な他の方法と比較して同等以上であることが十分に予測されるもの. 予防を目的とする場合には 利益が不利益を大きく上回ることが十分予測されるものであること DNA ワクチン 組換え生ワクチン ( 薬機法の遺伝子治療用製品は予防を対象外としている ) 腫瘍溶解性ウイルス ( 組換えタイプ ) ただし野生型あるいは非組換え腫瘍溶解性ウイルスは適用されないが実施施設の要望に応じて審査を実施 ゲノム編集技術を用いる場合にはケースバイケースで判断 16
17 研究に係る試料及び情報等の保管 最終産物を投与する前後の血清等の試料及び情報等について 総括報告書を研究機関の長及び総括責任者に提出した時点から少なくとも 10 年以上 再生医療等提供機関における記録 / 保存 一部の特定細胞加工物にあっては 30 年間 上記以外の特衛細胞加工物では 10 年間 目的と課題 遅発性の感染症等の原因究明 長期保管における管理 レトロウイルスベクターの挿入変異によるがん化 X-SCID 遺伝子治療 : 造血幹細胞を使用した理想的な遺伝子治療 CD34 陽性細胞 retroviral vector After his gene therapy, he was running around at home - He is a normal little boy now - (science, 2000) LMO-2 ( がん原遺伝子 ) Pt 5 LMO-2 遺伝子座への挿入による白血病の発症 SD SA gc cdna Ex.1 Pt 4 gc cdna SD SA (science 302, 415, 2003) Ex.2 17
18 FDA の遺伝子治療長期フォローアップ GL ベクターごとのリスクに応じたフォローアップ対策 基本的なフォローアップ期間としては 15 年 最初の 5 年間は毎年の検査を実施し 残り 10 年間は定期的な問診を行う 造血幹細胞にレトロウイルスで目的遺伝子を挿入する場合はより多くの検査が必要 長期に渡る遅発性有害事象に関しては 全ての遺伝子治療薬が同じリスクを持つわけではない 極めて予後の悪い患者 病状の重い患者 発ガン性のある治療薬を投与されている患者などに同様のフォローアップを適用することは困難 それぞれの遺伝子治療薬の特性に応じたフォローアップを行う必要がある 遅発性有害事象のリスクが極めて低いケースでは長期フォローアップを求めないモニタリング対象 レトロウイルスベクターによる発癌 De novo 由来がんの発症の有無 神経疾患の発症の有無 リウマチ性疾患の発症の有無 免疫性疾患 / 血液疾患の発症の有無等を含める FDA の遺伝子治療長期フォローアップ GL ベクターごとのリスクに応じたフォローアップ対策 基本的なフォローアップ期間としては 15 年 最初の 5 年間は毎年の検査を実施し 残り 10 年間は定期的な問診を行う 造血幹細胞にレトロウイルスで目的遺伝子を挿入する場合はより多くの検査が必要 長期に渡る遅発性有害事象に関しては 全ての遺伝子治療薬が同じリスクを持つわけではない 極めて予後の悪い患者 病状の重い患者 発ガン性のある治療薬を投与されている患者などに 同様のフォローアップを適用することは困難 それぞれの遺伝子治療薬の特性に応じたフォローアップを行う必要がある 遅発性有害事象のリスクが極めて低いケースでは長期フォローアップを求めない レトロウイルスベクターによる発癌 De novo 由来がんの発症の有無 神経疾患の発症の有無 リウマチ性疾患の発症の有無 我が国の指針 レトロウイルス等による挿入変異モニタリング対象 感染症の発症 免疫性疾患 / 血液疾患の発症の有無等を含める 18
19 特定認定委員会 (ex vivo 遺伝子治療 ) と遺伝子治療審査委員会での審査と再生医療等評価部会 再生医療等の安全性の確保等に関する法律の概要 趣旨再 医療等の迅速かつ安全な提供等を図るため 再 医療等を提供しようとする者が講ずべき措置を明らかにするとともに 特定細胞加 物の製造の許可等の制度等を定める 1. 再 医療等の分類 再 医療等について の 命及び健康に与える影響の程度に応じ 第 1 種再 医療等 第 2 種再 医療等 第 3 種再 医療等 に 3 分類して それぞれ必要な 続を定める 2. 再 医療等の提供に係る 続 第 1 種再 医療等提供計画について 特定認定再 医療等委員会の意 を聴いた上で 厚 労働 に提出して実施 一定期間の実施制限期間を設け その期間内に 厚 労働 が厚 科学審議会の意 を聴いて安全性等について確認 安全性等の基準に適合していないときは 計画の変更を命令 第 2 種再 医療等提供計画について 特定認定再 医療等委員会の意 を聴いた上で 厚 労働 に提出して実施 第 3 種再 医療等提供計画について 認定再 医療等委員会の意 を聴いた上で 厚 労働 に提出して実施 3. 適正な提供のための措置等 インフォームド コンセント 個人情報保護のための措置等について定める 疾病等の発 は 厚 労働 へ報告 厚 労働 は 厚 科学審議会の意 を聴いて 必要な措置をとる 安全性確保等のため必要なときは 改善命令を実施 改善命令違反の場合は再 医療等の提供を制限 保健衛 上の危害の発 拡 防 のため必要なときは 再 医療等の提供の 時停 など応急措置を命令 4. 特定細胞加工物の製造の許可等 内容 特定細胞加 物の製造を許可制 ( 医療機関等の場合には届出 ) とし 医療機関が特定細胞加 物の製造を委託する場合には 許可等を受けた者又は届出をした者に委託しなければならないこととする 19
20 第 1 種 第 2 種 第 3 種再生医療等技術のリスク分類 政令で除外した技術 No 人の胚性幹細胞 / 人 ips/ips 様細胞 No 遺伝子を導入する操作を行った細胞 No 動物細胞 No 投与を受ける者以外の人の細胞 ( 同種 ) No ( 体性 ) 幹細胞を利用している No 人の身体の構造又は機能の再建 修復又は形成を目的としているか No 相同利用 Yes 第 3 種 No 第 2 種 自己由来 CTL 細胞が該当? 法の対象外 ( 造血幹細胞移植等 ) Ex vivo 遺伝子治療 Yes Yes 膵島細胞が該当 培養を行っているか No 相同利用 Yes 第 3 種 培養を行っているか No 相同利用 Yes 第 3 種 Yes Yes Yes Yes Yes No Yes No 第 1 種第 1 種第 1 種第 1 種第 2 種第 2 種第 2 種第 2 種 レトロウイルスベクターの安全性に関する遺伝子治療臨床研究作業委員会の見解 (2012) 現状 レトロウイルスベクターは 300 以上の臨床プロトコールで使用 先天性免疫不全症に対して行われた造血幹細胞を標的とする遺伝子治療では 有効性が確認されている一方 82 人中 9 人が白血病などの造血型異常を発症 染色体に組み込まれたベクターによる近傍の癌原遺伝子の活性化が主な原因 白血病発症は造血幹細胞を標的とした場合に限られ T 細胞では認められない 特定の対象疾患 (X-SCID,Wiscott-Aldrich 症候群 ) または発現効率の高いレトロウイルス (SFFV 由来 ) を使用した場合に限られる 白血病を発症した患者は 1 名を除き白血病も免疫不全も治療されている 骨髄移植が実施できない重篤な先天性免疫不全症に対しては 造血幹細胞遺伝子治療は重要な選択肢であり リスク ベネフィットの観点からも有益 20
21 レトロウイルスベクターの安全性に関する遺伝子治療臨床研究作業委員会の見解 (2012) 安全性確保策 投与細胞数の低減 細胞あたりの遺伝子導入数の低減 ( 細胞あたり 1 コピー以下 ) より安全性の高いベクターの使用 ウイルスのプロモーターを除去した自己不活化ベクターの利用 ( 挿入部位近傍の遺伝子発現に影響を与えない ) レンチウイルスベクターの利用 ( レトロウイルスとは挿入部位が異なりこれまで挿入変異によるがん化は認められていない ) 遺伝子治療後の患者の長期フォローアップの実施 : がん化の早期診断 治療 十分なインフォームド コンセントを行う 遺伝子組換え生物に関する規制 21
22 遺伝子組換え生物等の使用等に規制による生物の多様性確保に関する法律の概要 遺伝子治療にも適用 目的国際的に協力して生物の多様性の確保を図るために 遺伝子組換え生物等の使用等の規制に関する措置を講ずることにより 生物多様性条約カルタヘナ議定書の的確かつ円滑な実施を確保 主務大臣による基本的事項の公表国際的に協力して生物の多様性の確保を図るために 遺伝子組換え生物等の使用等の規制に関する措置を講ずることにより 生物多様性条約カルタヘナ議定書の的確かつ円滑な実施を確保 目的 遺伝子組換え生物等の使用に先立ち, 使用形態に応じた措置を実施 第一種使用等 環境中への拡散を防止しないで行う使用等 新規の遺伝子組換え生物等の環境中での使用等をしようする者 ( 開発者 輸入業者等 ) は事前に使用規定を定め 生物多様性影響評価書等を添付し 主務大臣の承認を受ける義務 第二種使用等 環境中への拡散を防止しつつ行う使用等施設の態様等拡散防止措置が主務省令で定められている場合は 当該措置をとる義務 定められていない場合は あらかじめ主務大臣の確認を受けた拡散防止措置をとる義務 未承認の遺伝子組換え生物等の輸入の有無を検査する仕組み 輸出の際の相手国への情報提供 科学的知見の充実のための措置 国民の意見の聴取 違反者への措置命令 罰則等 遺伝子組換えに対する規制の流れ 国際的な規制 日本の対応状況 1970 s NIH 組換えDNA 実験ガイドライン ( 文部省 ) 大学等にお ける組換えDNA 実験指 針 ( 科学技術庁 ) 組換え DNA 実験指針 ( 大学等以外 ) 1980 s OECD 組換え DNA 技術の安全性に関する考察 1990 s バイオテクノロジーに関する安全性に関する考察生物の多様性に対する条約 上記指針の改定 (10~11 回 ) 2000~ 生物の多様性に関する条約のバイオセーフティに関するカルタヘナ議定書発効 [2003 年 9 月 ] 環境影響評価 ウイルス排出 ( 文科省 ) 組換え DNA 実験指針 [2002 年 1 月 ] 研究機関 高等学校等 ( 関係 6 省 ) カルタヘナ法遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律 [2004 年 2 月施行 ] 22
23 生物の多様性に関するバイオセーフティに関するカルタヘナ議定書 目的 この議定書は 環境及び開発に関するリオ宣言の原則 15 に規定する予防的な取組方法に従い 特に国境を越える移動に焦点を合わせて 現代のバイオテクノロジーにより改変された生物であって生物の多様性の保全及び持続可能な利用に悪影響 ( 人の健康に対する危険も考慮したもの ) を及ぼす可能性のあるものの安全な移送 取扱い及び利用の分野において十分な水準の保護を確保することに寄与することを目的とする 実際の措置 : 遺伝子組換え生物等の使用形態を2つに分け 講ずるべき措置を規定プラスミドで細 第一種使用等拡散を防止しないで行う胞を改変した 第二種使用等拡散を防止しつつ行う 罰則あり場合は非適用 生物 を用いなければ対象外 ( プラスミドそのものは生物でない ) ヒトは生物でない から対象外 組換えウイルスを用いた遺伝子治療は対象 in vivo 投与は第一種使用等 ex vivo 遺伝子導入は第二種使用等 ( ウイルスが残存していない場合 ) ウイルスが残存している場合には第一種使用組換えウイルス製造等 全て第二種使用 第一種使用等と第二種使用等 第一種使用等 : 環境中への遺伝子組換え生物等の拡散を防止しないで行う使用等 ( 遺伝子治療を含む ) すべて大臣の承認が必要 第二種使用等 : 環境中への遺伝子組換え生物等の拡散を防止しつつ行う使用等であって そのことを明示する等の措置を執って行うもの 拡散防止措置が省令によって定められており その措置を行うことが義務付けられているもの ( 機関承認又は GILSP 該当 ) 省令に定められていない実験 産業利用など 主務大臣に確認の手続きを行わなくてはならないもの ( 大臣確認 ) 第二種使用等の例 培養施設での遺伝子組換え微生物の培養 ( 組換えウイルスベクターの製造 ) 遺伝子組換え生物等の保管 運搬 CPC 等における遺伝子組換え生物等の使用等 (ex vivo で患者細胞に遺伝子を導入 ) 実験動物施設における遺伝子組換え動物の繁殖 飼育 特定の措置を講じている網室における遺伝子組換え植物の栽培 23
24 第一種使用等に関する手続き 第一種使用等は 環境中で遺伝子組換え生物等の使用等をするもので 使用する生物等の種類や受容環境ごとに 生じる可能性のある生物多様性影響 防止措置が異なると考えられる 第一種使用規程を策定し 大臣の承認を受けなくてはならない 手続の簡素化のために ウイルスが残存していなければ第一種使用規程承認申請不要 第一種使用使用規程に汎用性を持たせる 患者の個室管理期間を変更できるような第一種使用規程も認める 遺伝子導入細胞の製造に用いられた非増殖性遺伝子組換えウイルスの残存に関する考え方平成 25 年 12 月 16 日 1 遺伝子組換えウイルスについて 1 レトロウイルス科ウイルス ( ガンマレトロウイルス属 レンチウイルス属等 ) であること 2 非増殖性のコンストラクトになっており 製造において増殖性ウイルス ( 以下 RCV という ) が容易に出現しないようにデザインされた遺伝子改変がなされていること 3 製造された遺伝子組換えウイルスについて RCV が検出限界以下であること 2 遺伝子導入細胞の製造方法について細胞外液中の遺伝子組換えウイルスが適切に失活 / 希釈除去されていることが見込まれること 遺伝子導入以降に ウイルスの感染能の半減期に比して十分に長く培養されること 遺伝子導入工程以降で複数回の洗浄操作がなされていること 3 遺伝子導入細胞について適切にバリデートされ 又は試験法の妥当性が広く支持されている検出系により 用いた遺伝子組換えウイルス及び RCV が検出限界以下であることを確認していること なお 遺伝子導入細胞の複数ロット ( ロットを形成しないものにおいては 個別に調製した由来の異なる複数の検体 ) において確認することが望ましい 4 同一製品又は類似製品での知見について同一製品又は同種のウイルスを用いて製造された類似製品について 海外臨床試験や国内遺伝子治療臨床研究等で臨床使用実績がある場合には それらの試験等において遺伝子組換えウイルスの残存や顕在化を疑わせるような知見が得られていないこと 24
25 遺伝子治療等臨床研究の申請及び審査の流れ 医療機関 遺伝子治療等臨床研究に関する指針 研究責任者 IRB in vivo in vivo 遺伝子治療 : 研究計画書 ex vivo カルタヘナ申請 ( 第一種 ) ex vivo 遺伝子治療 : 再生医療等提供計画 再生医療等安全性確保法 特定認定再生医療等委員会 意見書の提出 ( 厚生労働省外 ) 厚生労働省 遺伝子治療等臨床研究に関する審査委員会 厚生科学審議会再生医療等評価部会 厚生労働大臣 遺伝子治療臨床研究指針の改定と遺伝子治療製品指針との整合性 再生医療新法 遺伝子治療薬指針の改正 25
26 革新的医薬品 医療機器 再生医療製品実用化促進事業遺伝性難病に対する遺伝子治療薬の臨床開発にむけた安全性 有効性評価法の確立 ガイドライン作成 人材育成 事業概要 申請機関 : 国立成育医療研究センター 病院申請者 : 五十嵐隆 ( 総長 ) ガイドライン : 遺伝子治療用医薬品の品質及び安全性の確保に関する指針医薬品等 : 医薬品分野 遺伝性難病に対する遺伝子治療薬の臨床開発に向けた安全性 有効性評価の確立 ガイドライン作成 人材交流 総括研究代表者 : 小野寺雅史 ( 国立成育医療研究 C) 副総括研究代表者 : 島田 隆 ( 日本医科大学 ) 研究者 : 岡田 尚巳 ( 日本医科大学 ) PMDA 人材交流 : 土田 尚 ( 国立成育医療研究 C) PMDA 人材交流 : 川本 恵 ( 国立成育医療研究 C) NIHS 人材派遣 : 五十嵐友香 ( 国立成育医療研究 C) NIHS 人材派遣 : 伴野 太郎 ( 国立成育医療研究 C) PO: 小澤敬也山口照英 NIHS 担当者 : 内田 恵理子 (NIHS) PMDA 担当者 : 石塚 量見 (PMDA) 治験指針 ( 案 ) と臨床研究指針品質安全性評価項目の全体構成 治験指針 ( 案 ) 臨床研究指針 ( 通知別表 1 別添 ) 第 1 章総則第 2 章開発の経緯及びこれまでの臨床試験の実施状況第 3 章製造方法 1. 遺伝子発現構成体 2. 遺伝子導入方法及びベクターの特性 1) ウイルスベクター 2) 非ウイルスベクター 3. 標的細胞 (ex vivo in vivo) 第 4 章品質管理 第 5 章安定性試験 ( 治験開始時と承認申請時との書き分け ) 第 6 章非臨床試験第 7 章治験の実施が可能であるとした理由 第 8 章治験の概要 第 9 章倫理性への配慮 8. 導入する遺伝子及び遺伝子の導入方法 (1) 開発の経緯 (2) 導入する遺伝子 (3) 遺伝子の導入方法 1) ウイルスベクター 2) ウイルスベクター以外の方法 3) 体外で目的細胞に遺伝子導入を行う場合 (4) 被験者に投与する最終産物の組成 9. 特性解析と品質試験 10. 遺伝子治療等臨床研究で投与に用いられる特殊な機器や医療材料 11. 非臨床における安全性及び有効性の評価 臨床研究と薬事法での開発の整合性を目指した 26
27 治験指針 ( 案 ) と臨床研究指針品質安全性評価項目の全体構成 治験指針 ( 案 ) 臨床研究指針 ( 通知別表 1 別添 ) 第 1 章総則第 2 章開発の経緯及びこれまでの臨床試験の実施状況第 3 章製造方法 1. 遺伝子発現構成体 2. 遺伝子導入方法及びベクターの特性 1) ウイルスベクター 2) 非ウイルスベクター 3. 標的細胞 (ex vivo in vivo) 第 4 章品質管理 第 5 章安定性試験 ( 治験開始時と承認申請時との書き分け ) 8. 導入する遺伝子及び遺伝子の導入方法 (1) 開発の経緯 (2) 導入する遺伝子 (3) 遺伝子の導入方法 1) ウイルスベクター 2) ウイルスベクター以外の方法 3) 体外で目的細胞に遺伝子導入を行う場合 (4) 被験者に投与する最終産物の組成 遺伝子治療製品の品質や安全性に関連する事項に関しては 9. 特性解析と品質試験遺伝子治療臨床研究指針と基本的に同様のスタンスで記載 第 6 章非臨床試験第 7 章治験の実施が可能であるとした理由 第 8 章治験の概要 第 9 章倫理性への配慮 10. 遺伝子治療等臨床研究で投与に用いられる特殊な機器や医療材料 11. 非臨床における安全性及び有効性の評価 臨床研究と薬事法での開発の整合性を目指した 改正案第 6 章非臨床試験 旧指針別記治験指針 ( 案 ) 臨床研究指針 V. 非臨床安全性試験 (1) 増殖性ウイルス出現 の可能性 (2) 細胞傷害性 (3) 染色体への遺伝子 組込み (4) 発現産物の異常発 現に起因する安全性 (5) がん原性 (6) 免疫原性 (7) 一般毒性試験 Ⅵ 効能試験 Ⅶ 体内動態等 Ⅷ 非臨床試験結果等の総括 第 6 章非臨床試験 1. ヒトでの有効性を示唆するための試験 2. 生体内分布 3. 非臨床安全性試験 (1) 一般毒性評価 1) 動物種の選択 2) 試験デザイン (2) 遺伝子組込み評価 (3) 腫瘍形成及びがん化の可能性の評価 (4) 生殖発生毒性評価 (5) ベクターに関する考慮事項 ( 免疫原性と免疫毒性評価 ) (8) 増殖性ウイルス出現の可能性 非臨床における安全性及び有効性の評価 (1) 臨床的有効性を予測するための試験 (2) 生体内分布 (3) 非臨床試験における安全性の評価 1) 一般毒性 2) その他 1 免疫原性 2 造腫瘍性 ( 遺伝子導入細胞 ) 3 生殖細胞への意図しない組込みリスク 4 併用療法における安全性評価 Ⅵ. 非臨床試験結果等の総括 (4) 非臨床試験の総括 ほとんど項目名のみ FIH に入るための非臨床試験要件 特に新規ベクターを用いる場合に求められるデータを明確に示す 臨床研究指針との整合 27
28 動物種の選択 POC や安全性試験における動物種の選択 POC において適切な動物種が存在しない場合 ベクターに被検動物の相同遺伝子を導入した試験も一案 その場合には定量的評価は困難 安全性試験 非げっ歯類 げっ歯類の 2 種の動物を用いることは必須ではない 投与法による安全性などの評価には適切な大動物が必要な場合もある ( 脳内投与や心筋内投与 ) GLP 試験の実施が困難な場合も考えられる (P2 対応等 ) できるだけ GLP に沿うように試験を実施すること 生体内分布試験 遺伝子治療用製品で特に求められる試験 qpcr 等 ( 或は発現タンパク質の検出 ) の手法を用いて解析 検出感度の妥当性 発現の確認とその持続性の確認 有効性の評価 ( ターゲット細胞 組織への分布の確認 ) 安全性評価 ( 生殖細胞への分布 目的外細胞 組織への分布 ) 発現タンパク質の生体への影響 コアバッテリー組織への影響 生体内分布がない組織でも安全性上のターゲットとしなくてよいわけではない 28
29 造腫瘍性試験と遺伝毒性試験 遺伝子治療用製品では挿入変異による造腫瘍性の評価が求められる ただし 評価をする ということは試験の実施を必ずしも求めているわけではない 発現タンパク質が増殖因子等の場合には内在している腫瘍の増殖を促進したり 細胞の異常増殖を引き起こす可能性がある 重篤な疾患を対象とする場合には 挿入変異や造腫瘍性の評価を行わなくてもよい可能性がある 非ウイルスベクターに用いられる薬剤によっては遺伝毒性試験が必要となる場合もある 改正案の構成と改正ポイント : 第 8 章治験の概要 (1) 適応症として選択した疾患 (2) 治験計画 (3) 治験実施の正当性 (4) 被験者の選択基準及び除外基準 (5) 被験者の同意の取得方法 (6) 目標症例数及び実施期間 (7) 実施方法 (8) 被験者フォロー予定 (9) 治験における考慮事項 (10) 遺伝子治療用製品等の患者以外への遺伝子導入の可能性及び環境に与える影響について 非臨床試験から得られたデータや公知情報から 治験において注意すべき懸念点を追記 海外の規制動向を踏まえて具体的に記載海外規制当局での要求事項追跡期間 : ベクターの種類による適切な期間 染色体組込型ベクター 最低年に一度の観察 目的遺伝子の持続性 遺伝子導入細胞のクローナリティーの評価 カルタヘナ法に基づく適切な使用に関する記載 29
30 まとめ 欧米の規制当局は遺伝子治療薬の進歩に対応するためにガイドラインの改定や個別課題に関する考え方などを提示 近年 遺伝子治療により画期的な臨床効果が確認されるようになり 複数の製品が承認されるようになった このような背景もあり 遺伝子治療等臨床研究や遺伝子治療用製品の指針の改定が進む 遺伝子治療臨床研究から薬機法 ( 旧薬事法 ) での開発を目指す動きがあり 臨床研究での指針と薬機法での指針の整合性が求められた 遺伝子治療に関しては生物多様性評価 ( カルタヘナ法 ) の順守が重要 再生医療新法による規制と迅速な審査や科学的合理性の規制が求められている ご静聴ありがとうございました ご質問がございましたら 30
遺伝子治療用ベクターの定義と適用範囲
 第 3 回遺伝子治療臨床研究に関する指針の見直しに関する専門委員会 平成 25 年 8 月 30 日 参考資料 1 遺伝子治療用ベクターの定義と 適用範囲 国立医薬品食品衛生研究所内田恵理子 第 3 回遺伝子治療臨床研究に関する指針の見直しに関する専門委員会 2013.8.30 1 本日の内容 遺伝子治療の定義 遺伝子治療用ベクターの種類と特徴 遺伝子治療の適用範囲 海外の指針との比較 遺伝子治療用プラスミドと
第 3 回遺伝子治療臨床研究に関する指針の見直しに関する専門委員会 平成 25 年 8 月 30 日 参考資料 1 遺伝子治療用ベクターの定義と 適用範囲 国立医薬品食品衛生研究所内田恵理子 第 3 回遺伝子治療臨床研究に関する指針の見直しに関する専門委員会 2013.8.30 1 本日の内容 遺伝子治療の定義 遺伝子治療用ベクターの種類と特徴 遺伝子治療の適用範囲 海外の指針との比較 遺伝子治療用プラスミドと
<4D F736F F F696E74202D2097D58FB08E8E8CB1838F815B834E F197D58FB E96D8816A66696E616C CF68A4A2E >
 再生医療等製品の非臨床安全性評価の考え方 ex vivo 遺伝子治療を中心に 独立行政法人医薬品医療機器総合機構 (PMDA) 再生医療製品等審査部 真木一茂 様式 1-B 第 24 回日本遺伝子細胞治療学会学術集会 CO I 開示 発表者名 : 真木一茂 演題発表に関連し 開示すべき CO I 関係にある企業などはありません 2 1 本日の話 1.Ex vivo 遺伝子治療について 2. 治験開始に必要な非臨床試験
再生医療等製品の非臨床安全性評価の考え方 ex vivo 遺伝子治療を中心に 独立行政法人医薬品医療機器総合機構 (PMDA) 再生医療製品等審査部 真木一茂 様式 1-B 第 24 回日本遺伝子細胞治療学会学術集会 CO I 開示 発表者名 : 真木一茂 演題発表に関連し 開示すべき CO I 関係にある企業などはありません 2 1 本日の話 1.Ex vivo 遺伝子治療について 2. 治験開始に必要な非臨床試験
遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律の概要 目的国際的に協力して生物の多様性の確保を図るため 遺伝子組換え生物等の使用等の規制に関する措置を講ずることにより 生物多様性条約カルタヘナ議定書 ( 略称 ) 等の的確かつ円滑な実施を確保 主務大臣による基本的事項の公表 遺
 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律の概要 目的国際的に協力して生物の多様性の確保を図るため 遺伝子組換え生物等の使用等の規制に関する措置を講ずることにより 生物多様性条約カルタヘナ議定書 ( 略称 ) 等の的確かつ円滑な実施を確保 主務大臣による基本的事項の公表 遺伝子組換え生物等の使用等による生物多様性影響を防止するための施策 の実施に関する基本的な事項等を定め
遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律の概要 目的国際的に協力して生物の多様性の確保を図るため 遺伝子組換え生物等の使用等の規制に関する措置を講ずることにより 生物多様性条約カルタヘナ議定書 ( 略称 ) 等の的確かつ円滑な実施を確保 主務大臣による基本的事項の公表 遺伝子組換え生物等の使用等による生物多様性影響を防止するための施策 の実施に関する基本的な事項等を定め
生命倫理88_資料6
 厚 科学審議会90 の提供制限期間( 参考 ) 再生医療等安全性確保法 に基づく提供計画に係る提出の流れ 第 1 種再 医療等 ヒトに未実施など リスク (ES 細胞 ips 細胞等 ) 医療機関での提供計画の作成 第 2 種再 医療等 現在実施中など中リスク ( 体性幹細胞等 ) 医療機関での提供計画の作成 第 3 種再 医療等 リスクの低いもの ( 体細胞を加 等 ) 医療機関での提供計画の作成
厚 科学審議会90 の提供制限期間( 参考 ) 再生医療等安全性確保法 に基づく提供計画に係る提出の流れ 第 1 種再 医療等 ヒトに未実施など リスク (ES 細胞 ips 細胞等 ) 医療機関での提供計画の作成 第 2 種再 医療等 現在実施中など中リスク ( 体性幹細胞等 ) 医療機関での提供計画の作成 第 3 種再 医療等 リスクの低いもの ( 体細胞を加 等 ) 医療機関での提供計画の作成
発表者 久米晃啓 本発表は 発表者の個人的見解に基づくもの であり 独立行政法人医薬品医療機器総合機 構の公式見解を示すものではありません 演題発表に関連し 開示すべきCOI関係にあ る企業などはありません 2
 カルタヘナ法とその対応 独立行政法人医薬品医療機器総合機構 再生医療製品等審査部 久米 晃啓 遺伝子治療臨床試験トレーニングコース 2015年7月23日 大阪 1 発表者 久米晃啓 本発表は 発表者の個人的見解に基づくもの であり 独立行政法人医薬品医療機器総合機 構の公式見解を示すものではありません 演題発表に関連し 開示すべきCOI関係にあ る企業などはありません 2 カルタヘナ って 遺伝子組換え実験に対する規制の流れ
カルタヘナ法とその対応 独立行政法人医薬品医療機器総合機構 再生医療製品等審査部 久米 晃啓 遺伝子治療臨床試験トレーニングコース 2015年7月23日 大阪 1 発表者 久米晃啓 本発表は 発表者の個人的見解に基づくもの であり 独立行政法人医薬品医療機器総合機 構の公式見解を示すものではありません 演題発表に関連し 開示すべきCOI関係にあ る企業などはありません 2 カルタヘナ って 遺伝子組換え実験に対する規制の流れ
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
1 遺伝子導入法の選択理由及びその特徴 2 非ウイルスベクターの構成 3 遺伝子構造 2) 非ウイルスベクターの由来及び性質 3) 非ウイルスベクターの構築及び作製に用いる細胞 1 非ウイルスベクターの製造に用いるプラスミド等の構築 2 非ウイルスベクターの製造に用いる微生物等 3バンクシステム 4
 遺伝子治療用製品等の品質及び安全性の確保に関する指針 ( 改正案 ) 目次第 1 章総則 1. 目的 2. 適用範囲 3. 定義 第 2 章遺伝子治療用製品等の概要及び開発の経緯等 1. これまでの開発の経緯 2. これまでの臨床試験の実施状況 第 3 章品質 1. 遺伝子発現構成体 (1) 遺伝子発現構成体の構造 (2) 遺伝子発現構成体の構築 (3) 目的遺伝子の機能的特性 (4) 発現調節要素の構造及び機能的特性
遺伝子治療用製品等の品質及び安全性の確保に関する指針 ( 改正案 ) 目次第 1 章総則 1. 目的 2. 適用範囲 3. 定義 第 2 章遺伝子治療用製品等の概要及び開発の経緯等 1. これまでの開発の経緯 2. これまでの臨床試験の実施状況 第 3 章品質 1. 遺伝子発現構成体 (1) 遺伝子発現構成体の構造 (2) 遺伝子発現構成体の構築 (3) 目的遺伝子の機能的特性 (4) 発現調節要素の構造及び機能的特性
<4D F736F F D A835E838A F8B7982D18AC48DB85F20534F A68CEB8E9A E9A8F4390B38DCF2
 自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
再生医療の制度的な対応の検討について 薬事法等制度改正についてのとりまとめ平成 24 年 1 月 24 日厚生科学審議会医薬品制度改正部会 1 再生医療製品については 今後も 臓器機能の再生等を通じて 重篤で生命を脅かす疾患等の治療等に ますます重要な役割を果たすことが期待される 特に ips 細胞
 薬事戦略相談について ( 事業の概要等 ) 日本発の革新的な医薬品 医療機器の創出に向け 有望なシーズを持つ大学 研究機関 ベンチャー企業を主な対象として 開発初期から必要な試験 治験に関する指導 助言を実施するものとして 平成 23 年 7 月 1 日より開始した 基礎研究から実用化に向けては様々な課題があり 課題解決に向けた審査当局との早期相談が重要である 例えば 品質のデータや毒性データ等を適切に実施していない場合
薬事戦略相談について ( 事業の概要等 ) 日本発の革新的な医薬品 医療機器の創出に向け 有望なシーズを持つ大学 研究機関 ベンチャー企業を主な対象として 開発初期から必要な試験 治験に関する指導 助言を実施するものとして 平成 23 年 7 月 1 日より開始した 基礎研究から実用化に向けては様々な課題があり 課題解決に向けた審査当局との早期相談が重要である 例えば 品質のデータや毒性データ等を適切に実施していない場合
法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品 医療機器等の品質
 医療機器クラス分類表 ( 平成 30 年 10 月 19 日現在 ) 香川県健康福祉部薬務感染症対策課薬事指導グループ 法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品
医療機器クラス分類表 ( 平成 30 年 10 月 19 日現在 ) 香川県健康福祉部薬務感染症対策課薬事指導グループ 法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品
中医協総 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適
 中医協総 - 3 3 1. 3. 2 7 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適用に係る今後の対応について 再生医療等製品の保険適用に関する当面の間の対応 薬事法改正後に承認 ( 条件
中医協総 - 3 3 1. 3. 2 7 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適用に係る今後の対応について 再生医療等製品の保険適用に関する当面の間の対応 薬事法改正後に承認 ( 条件
Microsoft PowerPoint - 4_河邊先生_改.ppt
 組換え酵素を用いた配列部位 特異的逐次遺伝子導入方法 Accumulative gene integration system using recombinase 工学研究院化学工学部門河邉佳典 2009 年 2 月 27 日 < 研究背景 > 1 染色体上での遺伝子増幅の有用性 動物細胞での場合 新鮮培地 空気 + 炭酸ガス 使用済み培地 医薬品タンパク質を生産する遺伝子を導入 目的遺伝子の多重化
組換え酵素を用いた配列部位 特異的逐次遺伝子導入方法 Accumulative gene integration system using recombinase 工学研究院化学工学部門河邉佳典 2009 年 2 月 27 日 < 研究背景 > 1 染色体上での遺伝子増幅の有用性 動物細胞での場合 新鮮培地 空気 + 炭酸ガス 使用済み培地 医薬品タンパク質を生産する遺伝子を導入 目的遺伝子の多重化
る として 平成 20 年 12 月に公表された 規制改革推進のための第 3 次答申 において 医療機器開発の円滑化の観点から 薬事法の適用範囲の明確化を図るためのガイドラインを作成すべきであると提言したところである 今般 薬事法の適用に関する判断の透明性 予見可能性の向上を図るため 臨床研究におい
 都道府県知事 各保健所設置市長殿 特別区長 薬食発 0331 第 7 号 平成 22 年 3 月 31 日 厚生労働省医薬食品局長 臨床研究において用いられる未承認医療機器の提供等に係る 薬事法の適用について 薬事法 ( 昭和 35 年法律第 145 号 ) は 医療機器について品質 有効性及び安全性の確保がなされた製品のみが流通するよう種々の規制を設けているが 薬事法第 14 条第 1 項の承認を受けていない医療機器
都道府県知事 各保健所設置市長殿 特別区長 薬食発 0331 第 7 号 平成 22 年 3 月 31 日 厚生労働省医薬食品局長 臨床研究において用いられる未承認医療機器の提供等に係る 薬事法の適用について 薬事法 ( 昭和 35 年法律第 145 号 ) は 医療機器について品質 有効性及び安全性の確保がなされた製品のみが流通するよう種々の規制を設けているが 薬事法第 14 条第 1 項の承認を受けていない医療機器
Microsoft PowerPoint - 資料6-1_高橋委員(公開用修正).pptx
 第 1 回遺伝子治療等臨床研究に関する指針の見直しに関する専門委員会 平成 29 年 4 月 12 日 ( 水 ) 資料 6-1 ゲノム編集技術の概要と問題点 筑波大学生命科学動物資源センター筑波大学医学医療系解剖学発生学研究室 WPI-IIIS 筑波大学国際睡眠医科学研究機構筑波大学生命領域学際研究 (TARA) センター 高橋智 ゲノム編集技術の概要と問題点 ゲノム編集とは? なぜゲノム編集は遺伝子改変に有効?
第 1 回遺伝子治療等臨床研究に関する指針の見直しに関する専門委員会 平成 29 年 4 月 12 日 ( 水 ) 資料 6-1 ゲノム編集技術の概要と問題点 筑波大学生命科学動物資源センター筑波大学医学医療系解剖学発生学研究室 WPI-IIIS 筑波大学国際睡眠医科学研究機構筑波大学生命領域学際研究 (TARA) センター 高橋智 ゲノム編集技術の概要と問題点 ゲノム編集とは? なぜゲノム編集は遺伝子改変に有効?
【発出】ICH見解「腫瘍溶解性ウイルス」について
 事務連絡 平成 27 年 6 月 23 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬食品局審査管理課 厚生労働省医薬食品局 医療機器 再生医療等製品担当参事官室 ICH 見解 腫瘍溶解性ウイルス について 日米 EU 医薬品規制調和国際会議 ( 以下 ICH という ) が組織され 品質 安全性及び有効性の各分野で ハーモナイゼーションの促進を図るための活動が行われているところです
事務連絡 平成 27 年 6 月 23 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬食品局審査管理課 厚生労働省医薬食品局 医療機器 再生医療等製品担当参事官室 ICH 見解 腫瘍溶解性ウイルス について 日米 EU 医薬品規制調和国際会議 ( 以下 ICH という ) が組織され 品質 安全性及び有効性の各分野で ハーモナイゼーションの促進を図るための活動が行われているところです
安全教育2010
 遺伝子組換え生物等 (LMO) の使用による 生物の多様性及び持続可能な利用に悪影響を及ぼ す可能性を考慮して バイオセーフティーに関するカルタヘナ議定書 が国際的に採択されま した 我国も 議定書を締結 国内法 カルタヘナ法 が制定 施行されています カルタヘナ 法の規制対象になる実験を行う場合は 実験計画申請書の提出が必要になります その他 保管 運搬 健康管理 記録保管 情報提供 輸出入に関する措置が定められており
遺伝子組換え生物等 (LMO) の使用による 生物の多様性及び持続可能な利用に悪影響を及ぼ す可能性を考慮して バイオセーフティーに関するカルタヘナ議定書 が国際的に採択されま した 我国も 議定書を締結 国内法 カルタヘナ法 が制定 施行されています カルタヘナ 法の規制対象になる実験を行う場合は 実験計画申請書の提出が必要になります その他 保管 運搬 健康管理 記録保管 情報提供 輸出入に関する措置が定められており
Taro-再製造単回使用医療機器基準
 厚生労働省告示第二百六十一号医薬品医療機器等の品質有効性及び安全性の確保等に関する法律 ( 昭和三十五年法律第百四十 五号 ) 第四十二条第二項の規定に基づき再製造単回使用医療機器基準を次のように定め平成二十 九年七月三十一日から適用す る平成二十九年七月三十一日厚生労働大臣塩崎恭久再製造単回使用医療機器基準第 1 定義 1 再生部品 とは 医療機関において使用された単回使用の医療機器の全部又は一部であって
厚生労働省告示第二百六十一号医薬品医療機器等の品質有効性及び安全性の確保等に関する法律 ( 昭和三十五年法律第百四十 五号 ) 第四十二条第二項の規定に基づき再製造単回使用医療機器基準を次のように定め平成二十 九年七月三十一日から適用す る平成二十九年七月三十一日厚生労働大臣塩崎恭久再製造単回使用医療機器基準第 1 定義 1 再生部品 とは 医療機関において使用された単回使用の医療機器の全部又は一部であって
PowerPoint プレゼンテーション
 2015JSGT 臨床試験トレーニングコース 非臨床安全性試験 GLP 独立行政法人医薬品医療機器総合機構 (PMDA) 再生医療製品等審査部 角田聡 真木一茂 西村拓也 笛木修 1 2015JSGT 臨床試験トレーニングコース COI 開示 発表者名 : 角田聡 演題発表に関連し 開示すべき COI 関係にある企業等はありません 本発表は演者の個人的見解を示すものであり 所属する組織の公式な見解ではないことをご留意ください
2015JSGT 臨床試験トレーニングコース 非臨床安全性試験 GLP 独立行政法人医薬品医療機器総合機構 (PMDA) 再生医療製品等審査部 角田聡 真木一茂 西村拓也 笛木修 1 2015JSGT 臨床試験トレーニングコース COI 開示 発表者名 : 角田聡 演題発表に関連し 開示すべき COI 関係にある企業等はありません 本発表は演者の個人的見解を示すものであり 所属する組織の公式な見解ではないことをご留意ください
Microsoft PowerPoint - 01 法案説明.pptx
 資料 1 再生医療等の安全性の確保等に関する法律案及び薬事法等の一部を改正する法律案説明資料 1 再生医療の現状について 再生医療の特性を踏まえ 迅速に実用化を進めるルールが必要 臨床研究から自由診療まで多様なものが混在する中 良質な再生医療の研究開発が進むよう 再生医療の安全面のルール化が課題 ( 山中教授はじめ 再生医療学会もルール化を強く要請 ) 自由診療 ( ルール無し ) 臨床研究 ( ガイドライン
資料 1 再生医療等の安全性の確保等に関する法律案及び薬事法等の一部を改正する法律案説明資料 1 再生医療の現状について 再生医療の特性を踏まえ 迅速に実用化を進めるルールが必要 臨床研究から自由診療まで多様なものが混在する中 良質な再生医療の研究開発が進むよう 再生医療の安全面のルール化が課題 ( 山中教授はじめ 再生医療学会もルール化を強く要請 ) 自由診療 ( ルール無し ) 臨床研究 ( ガイドライン
アレルギー疾患対策基本法 ( 平成二十六年六月二十七日法律第九十八号 ) 最終改正 : 平成二六年六月一三日法律第六七号 第一章総則 ( 第一条 第十条 ) 第二章アレルギー疾患対策基本指針等 ( 第十一条 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条
 アレルギー疾患対策基本法 ( 平成二十六年六月二十七日法律第九十八号 ) 最終改正 : 平成二六年六月一三日法律第六七号 第一章総則 ( 第一条 第十条 ) 第二章アレルギー疾患対策基本指針等 ( 第十一条 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条 第十五条 ) 第二節アレルギー疾患医療の均てん化の促進等 ( 第十六条 第十七条 ) 第三節アレルギー疾患を有する者の生活の質の維持向上
アレルギー疾患対策基本法 ( 平成二十六年六月二十七日法律第九十八号 ) 最終改正 : 平成二六年六月一三日法律第六七号 第一章総則 ( 第一条 第十条 ) 第二章アレルギー疾患対策基本指針等 ( 第十一条 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条 第十五条 ) 第二節アレルギー疾患医療の均てん化の促進等 ( 第十六条 第十七条 ) 第三節アレルギー疾患を有する者の生活の質の維持向上
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
本日の話題 1. 遺伝子治療 1 総論 ( 現状と課題 ) 2 日本の動向 ( 現状と課題 ) 2. ゲノム編集 1 総論 ( 現状と課題 ) 2 日本の動向 ( 現状と課題 ) 2
 資料 4-1 NIHS Since 1874 遺伝子治療とゲノム編集治療の 研究開発の現状と課題 国立医薬品食品衛生研究所遺伝子医薬部第 1 室 ( 遺伝子治療担当室 ) 内田恵理子 1 本日の話題 1. 遺伝子治療 1 総論 ( 現状と課題 ) 2 日本の動向 ( 現状と課題 ) 2. ゲノム編集 1 総論 ( 現状と課題 ) 2 日本の動向 ( 現状と課題 ) 2 本日の話題 1. 遺伝子治療
資料 4-1 NIHS Since 1874 遺伝子治療とゲノム編集治療の 研究開発の現状と課題 国立医薬品食品衛生研究所遺伝子医薬部第 1 室 ( 遺伝子治療担当室 ) 内田恵理子 1 本日の話題 1. 遺伝子治療 1 総論 ( 現状と課題 ) 2 日本の動向 ( 現状と課題 ) 2. ゲノム編集 1 総論 ( 現状と課題 ) 2 日本の動向 ( 現状と課題 ) 2 本日の話題 1. 遺伝子治療
料 情報の提供に関する記録 を作成する方法 ( 作成する時期 記録の媒体 作成する研究者等の氏名 別に作成する書類による代用の有無等 ) 及び保管する方法 ( 場所 第 12 の1⑴の解説 5に規定する提供元の機関における義務 8 個人情報等の取扱い ( 匿名化する場合にはその方法等を含む ) 9
 北里研究所病院研究倫理委員会研究申請時確認シート ( 補助資料 ) 20170425 Ver.2.0 < 研究計画書の確認 > 記載項目 1 研究の名称 2 研究の実施体制 ( 研究機関の名称及び研究者等の氏名を含む ) 3 研究の目的及び意義 4 研究の方法及び期間 5 研究対象者の選定方針 6 研究の科学的合理性の根拠 7インフォームド コンセントを受ける手続等 ( インフォームド コンセントを受ける場合には
北里研究所病院研究倫理委員会研究申請時確認シート ( 補助資料 ) 20170425 Ver.2.0 < 研究計画書の確認 > 記載項目 1 研究の名称 2 研究の実施体制 ( 研究機関の名称及び研究者等の氏名を含む ) 3 研究の目的及び意義 4 研究の方法及び期間 5 研究対象者の選定方針 6 研究の科学的合理性の根拠 7インフォームド コンセントを受ける手続等 ( インフォームド コンセントを受ける場合には
九州大学病院の遺伝子治療臨床研究実施計画(慢性重症虚血肢(閉塞
 平成 23 年 2 月 7 日 東京大学医科学研究所附属病院から申請のあったヒト幹細胞臨床研究実施計画に係る意見について ヒト幹細胞臨床研究に関する審査委員会委員長永井良三 東京大学医科学研究所附属病院から申請のあった下記のヒト幹細胞臨床研究実施計画について 本審査委員会で検討を行い その結果を別紙のとおりとりまとめたので報告いたします 記 1. 自己骨髄由来培養骨芽細胞様細胞を用いた歯槽骨再生法の検討
平成 23 年 2 月 7 日 東京大学医科学研究所附属病院から申請のあったヒト幹細胞臨床研究実施計画に係る意見について ヒト幹細胞臨床研究に関する審査委員会委員長永井良三 東京大学医科学研究所附属病院から申請のあった下記のヒト幹細胞臨床研究実施計画について 本審査委員会で検討を行い その結果を別紙のとおりとりまとめたので報告いたします 記 1. 自己骨髄由来培養骨芽細胞様細胞を用いた歯槽骨再生法の検討
一について第一に 感染症の予防及び感染症の患者に対する医療に関する法律(平成十年法律第百十四号 以下 感染症法 という )第十二条の規定に基づき 後天性免疫不全症候群(以下 エイズという )の患者及びその病原体を保有している者であって無症状のもの(以下 HIV感染者 という )(以下 エイズの患者等
 平成十一年八月十日受領答弁第三七号衆議院議員家西悟君提出血液製剤による感染被害の救済に関する質問に対し 別紙答弁書を送付する 内閣衆質一四五第三七号平成十一年八月十日衆議院議長伊宗一郎殿内閣総理大臣小渕恵三 一について第一に 感染症の予防及び感染症の患者に対する医療に関する法律(平成十年法律第百十四号 以下 感染症法 という )第十二条の規定に基づき 後天性免疫不全症候群(以下 エイズという )の患者及びその病原体を保有している者であって無症状のもの(以下
平成十一年八月十日受領答弁第三七号衆議院議員家西悟君提出血液製剤による感染被害の救済に関する質問に対し 別紙答弁書を送付する 内閣衆質一四五第三七号平成十一年八月十日衆議院議長伊宗一郎殿内閣総理大臣小渕恵三 一について第一に 感染症の予防及び感染症の患者に対する医療に関する法律(平成十年法律第百十四号 以下 感染症法 という )第十二条の規定に基づき 後天性免疫不全症候群(以下 エイズという )の患者及びその病原体を保有している者であって無症状のもの(以下
「組換えDNA技術応用食品及び添加物の安全性審査の手続」の一部改正について
 食安基発 0627 第 3 号 平成 26 年 6 月 27 日 各検疫所長殿 医薬食品局食品安全部基準審査課長 ( 公印省略 ) 最終的に宿主に導入されたDNAが 当該宿主と分類学上同一の種に属する微生物のDNAのみである場合又は組換え体が自然界に存在する微生物と同等の遺伝子構成である場合のいずれかに該当することが明らかであると判断する基準に係る留意事項について 食品 添加物等の規格基準 ( 昭和
食安基発 0627 第 3 号 平成 26 年 6 月 27 日 各検疫所長殿 医薬食品局食品安全部基準審査課長 ( 公印省略 ) 最終的に宿主に導入されたDNAが 当該宿主と分類学上同一の種に属する微生物のDNAのみである場合又は組換え体が自然界に存在する微生物と同等の遺伝子構成である場合のいずれかに該当することが明らかであると判断する基準に係る留意事項について 食品 添加物等の規格基準 ( 昭和
Microsoft Word - (発番)医療機器の製造販売承認申請について
 薬食発 1120 第 5 号 平成 26 年 11 月 20 日 各都道府県知事殿 厚生労働省医薬食品局長 ( 公印省略 ) 医療機器の製造販売承認申請について 医療機器の製造販売承認申請の取扱いについては 医療機器の製造販売承認申請について ( 平成 17 年 2 月 16 日付け薬食発第 0216002 号厚生労働省医薬食品局長通知 以下 旧通知 という ) 等により実施してきたところです 先般
薬食発 1120 第 5 号 平成 26 年 11 月 20 日 各都道府県知事殿 厚生労働省医薬食品局長 ( 公印省略 ) 医療機器の製造販売承認申請について 医療機器の製造販売承認申請の取扱いについては 医療機器の製造販売承認申請について ( 平成 17 年 2 月 16 日付け薬食発第 0216002 号厚生労働省医薬食品局長通知 以下 旧通知 という ) 等により実施してきたところです 先般
3 治験実施計画書目的 当該治験について 治験実施計画書が手順書に従い適切に作成及び改訂されていることを確認する 次の事項を調べる (1) 治験実施計画書の記載項目 ( 再生医療等製品 GCP 省令第 7 条第 1 項に規定する項目 ) (2) 治験実施計画書の作成 改訂の手順と日付 (3) 治験計
 別添 10 再生医療等製品 GCP 省令チェックリスト Ⅰ 治験依頼者 ( 受託機関を含む ) 用 1 組織及び体制目的 治験の依頼及び管理に当たって 再生医療等製品 GCP 省令に沿った業務を行うために適切にして十分な人材を有し かつ 組織及び体制が確立していることを確認する 1 治験依頼者の組織 ( 当該被験機器の開発組織を含む ) と再生医療等製品 G CP 省令に係わる組織との関係 2 治験の依頼及び管理の業務に従事する者の氏名
別添 10 再生医療等製品 GCP 省令チェックリスト Ⅰ 治験依頼者 ( 受託機関を含む ) 用 1 組織及び体制目的 治験の依頼及び管理に当たって 再生医療等製品 GCP 省令に沿った業務を行うために適切にして十分な人材を有し かつ 組織及び体制が確立していることを確認する 1 治験依頼者の組織 ( 当該被験機器の開発組織を含む ) と再生医療等製品 G CP 省令に係わる組織との関係 2 治験の依頼及び管理の業務に従事する者の氏名
ポイント 急性リンパ性白血病の免疫療法が更に進展! -CAR-T 細胞療法の安全性評価のための新システム開発と名大発の CAR-T 細胞療法の安全性評価 - 〇 CAR-T 細胞の安全性を評価する新たな方法として これまでの方法よりも短時間で正確に解 析ができる tagmentation-assis
 平成 30 年 8 月 20 日 急性リンパ性白血病の免疫療法が更に進展! -CAR-T 細胞療法の安全性評価のための新システム開発と名大発の CAR-T 細胞療法の安全性評価 - 名古屋大学大学院医学系研究科 ( 研究科長 門松健治 ) 小児科学の髙橋義行 ( たかはしよしゆき ) 教授 村松秀城 ( むらまつひでき ) 講師 濱田太立 ( はまだもとはる ) 大学院生 同医学部附属病院先端医療開発部先端医療
平成 30 年 8 月 20 日 急性リンパ性白血病の免疫療法が更に進展! -CAR-T 細胞療法の安全性評価のための新システム開発と名大発の CAR-T 細胞療法の安全性評価 - 名古屋大学大学院医学系研究科 ( 研究科長 門松健治 ) 小児科学の髙橋義行 ( たかはしよしゆき ) 教授 村松秀城 ( むらまつひでき ) 講師 濱田太立 ( はまだもとはる ) 大学院生 同医学部附属病院先端医療開発部先端医療
豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株
 豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚繁殖 呼吸障害症候群ウイルス JJ1882 株又はこれと同等と認められた株 2.1.2
豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚繁殖 呼吸障害症候群ウイルス JJ1882 株又はこれと同等と認められた株 2.1.2
Microsoft Word - 【発送版】製造所の登録通知
 薬食機参発 1003 第 1 号 平成 26 年 10 月 3 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いについて 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業は登録制に移行され
薬食機参発 1003 第 1 号 平成 26 年 10 月 3 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いについて 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業は登録制に移行され
薬事法等の一部改正に伴う特許法施行令改正に係る事前評価書
 薬事法等の一部改正に伴う特許法施行令改正に係る事前評価書 1. 政策の名称 薬事法改正に伴い新たに定義される再生医療等製品に係る製造販売の承認を特許権 の存続期間の延長登録の理由となる処分に追加するべく措置を講じる政策 2. 担当部局 経済産業省特許庁審査第一部調整課審査基準室長滝口尚良 電話番号 : 03-3501-0046 e-mail: PA2A10@jpo.go.jp 3. 評価実施時期 平成
薬事法等の一部改正に伴う特許法施行令改正に係る事前評価書 1. 政策の名称 薬事法改正に伴い新たに定義される再生医療等製品に係る製造販売の承認を特許権 の存続期間の延長登録の理由となる処分に追加するべく措置を講じる政策 2. 担当部局 経済産業省特許庁審査第一部調整課審査基準室長滝口尚良 電話番号 : 03-3501-0046 e-mail: PA2A10@jpo.go.jp 3. 評価実施時期 平成
 遺伝子治療用医薬品の品質及び安全性の確保に関する指針について ( 平成七年一一月一五日 ) ( 薬発第一〇六二号 ) ( 各都道府県知事あて厚生省薬務局長通知 ) 標記について 今般 別添のとおり 遺伝子治療用医薬品の安全性及び品質の確保に関する指針 ( 以下 指針 という ) を作成し 左記のとおり その取扱いを定めたので 貴管下関係者に対する周知徹底方よろしく御指導願いたい なお 本通知における用語については
遺伝子治療用医薬品の品質及び安全性の確保に関する指針について ( 平成七年一一月一五日 ) ( 薬発第一〇六二号 ) ( 各都道府県知事あて厚生省薬務局長通知 ) 標記について 今般 別添のとおり 遺伝子治療用医薬品の安全性及び品質の確保に関する指針 ( 以下 指針 という ) を作成し 左記のとおり その取扱いを定めたので 貴管下関係者に対する周知徹底方よろしく御指導願いたい なお 本通知における用語については
する 研究実施施設の環境 ( プライバシーの保護状態 ) について記載する < 実施方法 > どのような手順で研究を実施するのかを具体的に記載する アンケート等を用いる場合は 事前にそれらに要する時間を測定し 調査による患者への負担の度合いがわかるように記載する 調査手順で担当が複数名いる場合には
 参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
手順書03
 杏林大学医学部倫理委員会 人を対象とする医学系研究に関する業務手順書 ➂ 研究計画書の作成等に関する手続等 1 はじめに本手順書は 杏林大学医学部倫理委員会規程に基づき 杏林大学医学部及び医学部付属病院の専任教職員が行う人を対象とした医学系研究について 医の倫理に関するヘルシンキ宣言の趣旨に添い 人を対象とする医学系研究に関する倫理指針及び その他関連通知に基づいて適正かつ円滑に行われるよう これらの研究等に係る必要な手順を定めるものである
杏林大学医学部倫理委員会 人を対象とする医学系研究に関する業務手順書 ➂ 研究計画書の作成等に関する手続等 1 はじめに本手順書は 杏林大学医学部倫理委員会規程に基づき 杏林大学医学部及び医学部付属病院の専任教職員が行う人を対象とした医学系研究について 医の倫理に関するヘルシンキ宣言の趣旨に添い 人を対象とする医学系研究に関する倫理指針及び その他関連通知に基づいて適正かつ円滑に行われるよう これらの研究等に係る必要な手順を定めるものである
子宮頸がん予防措置の実施の推進に関する法律案要綱
 第一総則 子宮頸がん予防措置の実施の推進に関する法律案要綱 一目的 けいりこの法律は 子宮頸がんの罹患が女性の生活の質に多大な影響を与えるものであり 近年の子宮頸が んの罹患の若年化の進行が当該影響を一層深刻なものとしている状況及びその罹患による死亡率が高い 状況にあること並びに大部分の子宮頸がんにヒトパピローマウイルスが関与しており 予防ワクチンの 接種及び子宮頸部の前がん病変 ( 子宮頸がんに係る子宮頸部の異形成その他の子宮頸がんの発症前にお
第一総則 子宮頸がん予防措置の実施の推進に関する法律案要綱 一目的 けいりこの法律は 子宮頸がんの罹患が女性の生活の質に多大な影響を与えるものであり 近年の子宮頸が んの罹患の若年化の進行が当該影響を一層深刻なものとしている状況及びその罹患による死亡率が高い 状況にあること並びに大部分の子宮頸がんにヒトパピローマウイルスが関与しており 予防ワクチンの 接種及び子宮頸部の前がん病変 ( 子宮頸がんに係る子宮頸部の異形成その他の子宮頸がんの発症前にお
本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制 3. 遺伝子パネルを用いた NGS コンパニオン診断システム 1 2 規制上の取扱い 評価の考え方 2
 わが国での NGS 診断パネル承認の考え方 独立行政法人医薬品医療機器総合機構上席審議役 ( 機器審査等担当 ) 佐藤岳幸 本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制 3. 遺伝子パネルを用いた NGS コンパニオン診断システム 1 2 規制上の取扱い 評価の考え方 2 本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制
わが国での NGS 診断パネル承認の考え方 独立行政法人医薬品医療機器総合機構上席審議役 ( 機器審査等担当 ) 佐藤岳幸 本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制 3. 遺伝子パネルを用いた NGS コンパニオン診断システム 1 2 規制上の取扱い 評価の考え方 2 本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制
PSP 省令 と それぞれ略称する 記 1. 改正施行規則について希少疾病用医療機器その他の医療上特にその必要性が高いと認められる医療機器であり かつ 当該医療機器についての臨床試験の実施に特に長期間を要すると認められるものに係る承認申請をする場合においては 改正 GVP 省令第 9 条の3 第 1
 薬生発 07 31 第 4 号 平成 29 年 7 月 31 日 各都道府県知事殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則の一部を改正する省令 医薬品 医薬部外品 化粧品 医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令の一部を改正する省令 及び 医療機器の製造販売後の調査及び試験の実施の基準に関する省令の一部を改正する省令
薬生発 07 31 第 4 号 平成 29 年 7 月 31 日 各都道府県知事殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則の一部を改正する省令 医薬品 医薬部外品 化粧品 医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令の一部を改正する省令 及び 医療機器の製造販売後の調査及び試験の実施の基準に関する省令の一部を改正する省令
記載例 : 大腸菌 ウイルス ( 培養細胞 ) ( 注 )Web システム上で承認された実験計画の変更申請については 様式 A 中央の これまでの変更 申請を選択し 承認番号を入力すると過去の申請内容が反映されます さきに内容を呼び出してから入力を始めてください 加齢医学研究所 分野東北太郎教授 ヒ
 記載例 : 大腸菌 ウイルス ( 培養細胞 ) ( 注 )Web システム上で承認された実験計画の変更申請については 様式 A 中央の これまでの変更 申請を選択し 承認番号を入力すると過去の申請内容が反映されます さきに内容を呼び出してから入力を始めてください 加齢医学研究所 分野東北太郎教授 ヒト HSP90 cdna 発現アデノウイルスの作製 および哺乳動物細胞への組換えウイルス感染実験 2012
記載例 : 大腸菌 ウイルス ( 培養細胞 ) ( 注 )Web システム上で承認された実験計画の変更申請については 様式 A 中央の これまでの変更 申請を選択し 承認番号を入力すると過去の申請内容が反映されます さきに内容を呼び出してから入力を始めてください 加齢医学研究所 分野東北太郎教授 ヒト HSP90 cdna 発現アデノウイルスの作製 および哺乳動物細胞への組換えウイルス感染実験 2012
「組換えDNA技術応用食品及び添加物の安全性審査の手続」の一部改正について
 ( 別添 ) 最終的に宿主に導入された DNA が 当該宿主と分類学上同一の種に属する微生物の DNA のみである場合又は組換え体が自然界に存在する微生物と同等の遺伝子構成である場合のいずれかに該当することが明らかであると判断する基準に係る留意事項 最終的に宿主に導入されたDNAが 当該宿主と分類学上同一の種に属する微生物のDNAのみである場合又は組換え体が自然界に存在する微生物と同等の遺伝子構成である場合のいずれかに該当することが明らかであると判断する基準
( 別添 ) 最終的に宿主に導入された DNA が 当該宿主と分類学上同一の種に属する微生物の DNA のみである場合又は組換え体が自然界に存在する微生物と同等の遺伝子構成である場合のいずれかに該当することが明らかであると判断する基準に係る留意事項 最終的に宿主に導入されたDNAが 当該宿主と分類学上同一の種に属する微生物のDNAのみである場合又は組換え体が自然界に存在する微生物と同等の遺伝子構成である場合のいずれかに該当することが明らかであると判断する基準
公募情報 平成 28 年度日本医療研究開発機構 (AMED) 成育疾患克服等総合研究事業 ( 平成 28 年度 ) 公募について 平成 27 年 12 月 1 日 信濃町地区研究者各位 信濃町キャンパス学術研究支援課 公募情報 平成 28 年度日本医療研究開発機構 (AMED) 成育疾患克服等総合研
 公募情報 平成 28 年度日本医療研究開発機構 (AMED) 成育疾患克服等総合研究事業 ( 平成 28 年度 ) 公募について 平成 27 年 12 月 1 日 信濃町地区研究者各位 信濃町キャンパス学術研究支援課 公募情報 平成 28 年度日本医療研究開発機構 (AMED) 成育疾患克服等総合研究事業 ( 平成 28 年度 ) 公募について 11 月 27 日付で平成 28 年度 成育疾患克服等総合研究事業
公募情報 平成 28 年度日本医療研究開発機構 (AMED) 成育疾患克服等総合研究事業 ( 平成 28 年度 ) 公募について 平成 27 年 12 月 1 日 信濃町地区研究者各位 信濃町キャンパス学術研究支援課 公募情報 平成 28 年度日本医療研究開発機構 (AMED) 成育疾患克服等総合研究事業 ( 平成 28 年度 ) 公募について 11 月 27 日付で平成 28 年度 成育疾患克服等総合研究事業
バリデーション基準 1. 医薬品 医薬部外品 GMP 省令に規定するバリデーションについては 品質リスクを考慮し 以下の バリデーション基準 に基づいて実施すること 2. バリデーション基準 (1) バリデーションの目的バリデーションは 製造所の構造設備並びに手順 工程その他の製造管理及び品質管理の
 バリデーション基準 1. 医薬品 医薬部外品 GMP 省令に規定するバリデーションについては 品質リスクを考慮し 以下の バリデーション基準 に基づいて実施すること 2. バリデーション基準 (1) バリデーションの目的バリデーションは 製造所の構造設備並びに手順 工程その他の製造管理及び品質管理の方法 ( 以下この基準において 製造手順等 という ) が期待される結果を与えることを検証し これを文書とすることによって
バリデーション基準 1. 医薬品 医薬部外品 GMP 省令に規定するバリデーションについては 品質リスクを考慮し 以下の バリデーション基準 に基づいて実施すること 2. バリデーション基準 (1) バリデーションの目的バリデーションは 製造所の構造設備並びに手順 工程その他の製造管理及び品質管理の方法 ( 以下この基準において 製造手順等 という ) が期待される結果を与えることを検証し これを文書とすることによって
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
標準業務手順 目次
 浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
国立感染症研究所血液 安全性研究部 HBV-DNA 国内標準品及び HIV-RNA 国内標準品の力価の再評価のための共同研究 1. 背景と目的血液製剤のウイルス安全性の確保対策として実施されている原料血漿と輸血用血液のウイルス核酸増幅試験 (NAT) のための HCV HBV 及び HIV の国内標
 血液事業部会安全技術調査会 平成 28 年 8 月 日国立感染症研究所血液 安全性研究部 HBV-DNA 国内標準品及び HIV-RNA 国内標準品の力価の再評価 血液製剤のウイルス安全性の確保対策として実施されている原料血漿と輸血用血液のウイルス核酸増幅試験 (NAT) のための HCV HBV 及び HIV の国内標準品が製造されてから 10 年以上が経過した これらの国内標準品は当時の WHO
血液事業部会安全技術調査会 平成 28 年 8 月 日国立感染症研究所血液 安全性研究部 HBV-DNA 国内標準品及び HIV-RNA 国内標準品の力価の再評価 血液製剤のウイルス安全性の確保対策として実施されている原料血漿と輸血用血液のウイルス核酸増幅試験 (NAT) のための HCV HBV 及び HIV の国内標準品が製造されてから 10 年以上が経過した これらの国内標準品は当時の WHO
PowerPoint プレゼンテーション
 第 2 回遺伝子治療等臨床研究に関する指針の見直しに関する専門委員会 平成 29 年 5 月 15 日 ( 月 ) 資料 3-2 遺伝子治療とゲノム編集の臨床研究に関する日本と欧米の規制の現状 国立医薬品食品衛生研究所遺伝子医薬部内田恵理子 第 2 回遺伝子治療等臨床研究に関する指針の 見直しに関する専門委員会 2017.5.15 遺伝子治療等臨床研究に関する指針 とゲノム編集技術 米国の遺伝子治療関連ガイドラインとゲノム編集技術への対応
第 2 回遺伝子治療等臨床研究に関する指針の見直しに関する専門委員会 平成 29 年 5 月 15 日 ( 月 ) 資料 3-2 遺伝子治療とゲノム編集の臨床研究に関する日本と欧米の規制の現状 国立医薬品食品衛生研究所遺伝子医薬部内田恵理子 第 2 回遺伝子治療等臨床研究に関する指針の 見直しに関する専門委員会 2017.5.15 遺伝子治療等臨床研究に関する指針 とゲノム編集技術 米国の遺伝子治療関連ガイドラインとゲノム編集技術への対応
Microsoft Word - 【プレスリリース・J】毛包再生非臨床 説明文 最終版.docx
 2018 年 6 月 4 日 毛包器官再生医療に向けた非臨床試験開始について 株式会社オーガンテクノロジーズ ( 代表取締役 : 杉村泰宏以下 オーガンテクノロジーズ ) 並びに国立研究開発法人理化学研究所 ( 理事長 : 松本紘以下 理研 ) は 再生医療分野である 毛包器官再生による脱毛症の治療 に向けた臨床研究の前段階である非臨床試験を開始することといたしましたのでお知らせいたします 1. 脱毛症とその治療
2018 年 6 月 4 日 毛包器官再生医療に向けた非臨床試験開始について 株式会社オーガンテクノロジーズ ( 代表取締役 : 杉村泰宏以下 オーガンテクノロジーズ ) 並びに国立研究開発法人理化学研究所 ( 理事長 : 松本紘以下 理研 ) は 再生医療分野である 毛包器官再生による脱毛症の治療 に向けた臨床研究の前段階である非臨床試験を開始することといたしましたのでお知らせいたします 1. 脱毛症とその治療
DVDを見た後で、次の問いに答えてください
 ( 実験責任者 実験従事者兼用 ) 理解度テスト問題 動画を視聴した後に この問題を見ながら設問に答えてください ( 二択もしくは複数選択問題です 正しいものを全て選んでください ) 問題 1 HIV-1 の病原性に関与しない rev 遺伝子を pcdna3.1 と pet28a プラスミド ( 図 1 参照 ) に挿入し COS 細胞および大腸菌で発現させる実験を計画した Step 1. Step
( 実験責任者 実験従事者兼用 ) 理解度テスト問題 動画を視聴した後に この問題を見ながら設問に答えてください ( 二択もしくは複数選択問題です 正しいものを全て選んでください ) 問題 1 HIV-1 の病原性に関与しない rev 遺伝子を pcdna3.1 と pet28a プラスミド ( 図 1 参照 ) に挿入し COS 細胞および大腸菌で発現させる実験を計画した Step 1. Step
<4D F736F F D20819B8CA48B868C7689E68F D A8CA9967B5F E646F63>
 研究計画書 本委員会ではゲノム解析研究を審査対象としている 臨床試験などは対象とならないため, 試験計画 ではない 以下, 計画書では 研究 を使用する 委員には, 医学の専門外の方もいます 研究計画は専門外の者にも理解しやすいように, 平易な表現で分かり易く記載する 研究課題名 : 1. 提供者を選ぶ方針 申請者氏名 ( 所属 職名 ): 合理的に選択していることが分かる具体的な方法を記載する 提供者が疾病や薬剤反応性異常を有する場合等にあっては,
研究計画書 本委員会ではゲノム解析研究を審査対象としている 臨床試験などは対象とならないため, 試験計画 ではない 以下, 計画書では 研究 を使用する 委員には, 医学の専門外の方もいます 研究計画は専門外の者にも理解しやすいように, 平易な表現で分かり易く記載する 研究課題名 : 1. 提供者を選ぶ方針 申請者氏名 ( 所属 職名 ): 合理的に選択していることが分かる具体的な方法を記載する 提供者が疾病や薬剤反応性異常を有する場合等にあっては,
Microsoft Word - 奈良県GQP-GVPガイドライン doc
 三. 安全確保措置の実施に関する手順 1. 目的安全確保措置の実施に関する手順の目的を記載する < 記載例 > 本手順は GVP 省令の第 9 条に基づき 安全確保措置の実施を適正かつ円滑に行うために必要な手順を定めるものである 2. 適用範囲安全確保措置の実施に関する手順の適用範囲を記載する < 記載例 > 本手順書は 二. 安全管理情報の検討及びその結果に基づく安全確保措置の立案に関する手順 で立案された安全確保措置の決定
三. 安全確保措置の実施に関する手順 1. 目的安全確保措置の実施に関する手順の目的を記載する < 記載例 > 本手順は GVP 省令の第 9 条に基づき 安全確保措置の実施を適正かつ円滑に行うために必要な手順を定めるものである 2. 適用範囲安全確保措置の実施に関する手順の適用範囲を記載する < 記載例 > 本手順書は 二. 安全管理情報の検討及びその結果に基づく安全確保措置の立案に関する手順 で立案された安全確保措置の決定
臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美
 臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美 本日の Agenda 1. 臨床評価とは 2. 医療機器の特性を踏まえた有効性 安全性評価 3. 各国の規制の違い 4. 臨床評価報告書について 5. 臨床評価報告書の概念 6. 臨床研究と治験の違いは? 7. 文献評価の問題点 8. 治験活性化にむけて 臨床評価 とは そのものの有効性と安全性をヒトで評価すること 自己認証の欧州から出てきた概念
臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美 本日の Agenda 1. 臨床評価とは 2. 医療機器の特性を踏まえた有効性 安全性評価 3. 各国の規制の違い 4. 臨床評価報告書について 5. 臨床評価報告書の概念 6. 臨床研究と治験の違いは? 7. 文献評価の問題点 8. 治験活性化にむけて 臨床評価 とは そのものの有効性と安全性をヒトで評価すること 自己認証の欧州から出てきた概念
医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など ) 医薬品候補物質のスクリーニン
 特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下
 北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
12_モニタリングの実施に関する手順書
 12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
ごあいさつ バイオシミラーの課題 バイオ医薬品は 20 世紀後半に開発されて以来 癌や血液疾患 自己免疫疾患等多くの難治性疾患に卓抜した治療効果を示し また一般にベネフィット リスク評価が高いと言われています しかしその一方で しばしば高額となる薬剤費用が 患者の経済的負担や社会保障費の増大に繋がる
 ごあいさつ バイオシミラーの課題 バイオ医薬品は 20 世紀後半に開発されて以来 癌や血液疾患 自己免疫疾患等多くの難治性疾患に卓抜した治療効果を示し また一般にベネフィット リスク評価が高いと言われています しかしその一方で しばしば高額となる薬剤費用が 患者の経済的負担や社会保障費の増大に繋がると指摘されています こうした中 バイオシミラーの普及は 拡大する医療費の抑制に貢献するとともに 経済的な理由でバイオ医薬品による治療を躊躇されている患者に対する治療アクセスの改善を約束します
ごあいさつ バイオシミラーの課題 バイオ医薬品は 20 世紀後半に開発されて以来 癌や血液疾患 自己免疫疾患等多くの難治性疾患に卓抜した治療効果を示し また一般にベネフィット リスク評価が高いと言われています しかしその一方で しばしば高額となる薬剤費用が 患者の経済的負担や社会保障費の増大に繋がると指摘されています こうした中 バイオシミラーの普及は 拡大する医療費の抑制に貢献するとともに 経済的な理由でバイオ医薬品による治療を躊躇されている患者に対する治療アクセスの改善を約束します
目次 ( 用語の定義 ) 背景 ガイドラインの対象 がん治療用ウイルスの選択 初期段階での確認事項 ウイルス選択の理由 腫瘍選択性 ウイルスの分子変異の確認 規格 製造
 実践に基づくウイルス療法開発のガイドライン策定と人材育成 がん治療用ウイルス製造及び非臨床試験に関するガイドライン 総論編 ドラフト 東京大学医科学研究所 1 目次 ( 用語の定義 )... 5 1 背景 ガイドラインの対象... 6 1.1 がん治療用ウイルスの選択 初期段階での確認事項... 7 1.1.1 ウイルス選択の理由... 7 1.1.2 腫瘍選択性.....7 1.1.3 ウイルスの分子変異の確認...
実践に基づくウイルス療法開発のガイドライン策定と人材育成 がん治療用ウイルス製造及び非臨床試験に関するガイドライン 総論編 ドラフト 東京大学医科学研究所 1 目次 ( 用語の定義 )... 5 1 背景 ガイドラインの対象... 6 1.1 がん治療用ウイルスの選択 初期段階での確認事項... 7 1.1.1 ウイルス選択の理由... 7 1.1.2 腫瘍選択性.....7 1.1.3 ウイルスの分子変異の確認...
日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 名称日本脳炎ウイル
 日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 2.1.1 名称日本脳炎ウイルス中山株薬検系又はこれと同等と認められた株 2.1.2 性状豚腎初代細胞で増殖し がちょう 鶏初生ひな及びはとの赤血球を凝集する
日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 2.1.1 名称日本脳炎ウイルス中山株薬検系又はこれと同等と認められた株 2.1.2 性状豚腎初代細胞で増殖し がちょう 鶏初生ひな及びはとの赤血球を凝集する
Microsoft Word - 表紙
 第 1 回再生医療等評価部会 平成 27 年 3 月 2 日 参考資料 10 遺伝子治療臨床研究実施計画の申請及び遺伝子治療臨床研究に係る生物多様性影響評価に関する参考資料 遺伝子治療の概要及び審査体制... P1 我が国で実施されている遺伝子治療臨床研究の一覧... P3 遺伝子治療臨床研究に関する指針 に基づく審査の流れ... P5 遺伝子治療臨床研究に関する指針 ( 平成 14 年文部科学省
第 1 回再生医療等評価部会 平成 27 年 3 月 2 日 参考資料 10 遺伝子治療臨床研究実施計画の申請及び遺伝子治療臨床研究に係る生物多様性影響評価に関する参考資料 遺伝子治療の概要及び審査体制... P1 我が国で実施されている遺伝子治療臨床研究の一覧... P3 遺伝子治療臨床研究に関する指針 に基づく審査の流れ... P5 遺伝子治療臨床研究に関する指針 ( 平成 14 年文部科学省
最近の薬務行政について
 平成 25 年 7 月 26 日現在 薬事法改正について 厚生労働省医薬食品局審査管理課 医療機器審査管理室 これらの内容には現段階で検討中の内容が含まれており 今後変更する可能性があります 薬事法改正法案及び再生医療等安全性確保法案の概要について 現在 国民が受ける医療の質の向上を図るため 革新的な医薬品 医療機器の創出や再生医療の研究開発及び実用化を促進していくことが喫緊の課題となっている 併せて
平成 25 年 7 月 26 日現在 薬事法改正について 厚生労働省医薬食品局審査管理課 医療機器審査管理室 これらの内容には現段階で検討中の内容が含まれており 今後変更する可能性があります 薬事法改正法案及び再生医療等安全性確保法案の概要について 現在 国民が受ける医療の質の向上を図るため 革新的な医薬品 医療機器の創出や再生医療の研究開発及び実用化を促進していくことが喫緊の課題となっている 併せて
<945F96F B3816A2E786264>
 Q-14 食品衛生法 ( 昭和 22 年法律第 233 号 ) とは 1 食品衛生法について 食品衛生法とは食品の安全性の確保のために公衆衛生の見地から必要な規制その他の措置を講ずることにより 飲食に起因する衛生上の危害の発生を防止し もつて国民の健康の保護を図ることを目的として 食品の規格等の設定 検査の実施 健康を損なうおそれのある食品の販売の禁止などの事項を規定しています 適用範囲食品衛生法の中で
Q-14 食品衛生法 ( 昭和 22 年法律第 233 号 ) とは 1 食品衛生法について 食品衛生法とは食品の安全性の確保のために公衆衛生の見地から必要な規制その他の措置を講ずることにより 飲食に起因する衛生上の危害の発生を防止し もつて国民の健康の保護を図ることを目的として 食品の規格等の設定 検査の実施 健康を損なうおそれのある食品の販売の禁止などの事項を規定しています 適用範囲食品衛生法の中で
資料2_ヒト幹同等性
 資料 2 文科省指針とヒト幹指針の倫理的事項における同等性について 樹立の要件において既に同等性が担保されている事項 1 ヒト ES 細胞の樹立に用いるヒト受精胚の要件は両指針とも同じ ( 無償提供 余剰胚 IC 凍結保存 受精後 14 日以内 ) 2 ヒト受精胚の提供者の同意撤回に関する要件も同じ (30 日の撤回期間確保 ) 樹立の要件が異なっており同等性を確認すべき事項 3 ヒト幹指針では 余剰胚の提供者の個人情報を連結可能匿名化した後
資料 2 文科省指針とヒト幹指針の倫理的事項における同等性について 樹立の要件において既に同等性が担保されている事項 1 ヒト ES 細胞の樹立に用いるヒト受精胚の要件は両指針とも同じ ( 無償提供 余剰胚 IC 凍結保存 受精後 14 日以内 ) 2 ヒト受精胚の提供者の同意撤回に関する要件も同じ (30 日の撤回期間確保 ) 樹立の要件が異なっており同等性を確認すべき事項 3 ヒト幹指針では 余剰胚の提供者の個人情報を連結可能匿名化した後
岩手医科大学医学部及び附属病院における人を対象とする医学系研究に係るモニタリング及び監査の実施に関する標準業務手順書 岩手医科大学医学部及び附属病院における 人を対象とする医学系研究に係る モニタリング及び監査の実施に関する標準業務手順書 岩手医科大学 第 1.0 版平成 29 年 10 月 1 日
 岩手医科大学医学部及び附属病院における 人を対象とする医学系研究に係る モニタリング及び監査の実施に関する標準業務手順書 岩手医科大学 第 1.0 版平成 29 年 10 月 1 日施行 目次 1. 目的...1 2. 研究機関の長の責務...1 3. 研究責任者の責務...1 4. モニタリング担当者の責務...1 5. 監査担当者の責務...2 6. 多施設共同研究におけるモニタリング及び監査の実施について...2
岩手医科大学医学部及び附属病院における 人を対象とする医学系研究に係る モニタリング及び監査の実施に関する標準業務手順書 岩手医科大学 第 1.0 版平成 29 年 10 月 1 日施行 目次 1. 目的...1 2. 研究機関の長の責務...1 3. 研究責任者の責務...1 4. モニタリング担当者の責務...1 5. 監査担当者の責務...2 6. 多施設共同研究におけるモニタリング及び監査の実施について...2
員長及び医薬品医療機器等法登録認証機関協議会代表幹事宛て送付するこ ととしていることを申し添えます 記 1. 基本要件基準第 13 条第 5 項及び第 6 項への適合性確認の基本的な考え方について (1)2023 年 ( 平成 35 年 )2 月 28 日 ( 以下 経過措置期間終了日 という )
 薬生機審発 0301 第 1 号 平成 30 年 3 月 1 日 各都道府県薬務主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医療機器審査管理課長 ( 公印省略 ) 医療機器の電磁両立性に関する日本工業規格の改正の取扱いについて すべての能動型医療機器は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第四十一条第三項の規定により厚生労働大臣が定める医療機器の基準 ( 平成 17
薬生機審発 0301 第 1 号 平成 30 年 3 月 1 日 各都道府県薬務主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医療機器審査管理課長 ( 公印省略 ) 医療機器の電磁両立性に関する日本工業規格の改正の取扱いについて すべての能動型医療機器は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第四十一条第三項の規定により厚生労働大臣が定める医療機器の基準 ( 平成 17
遺伝 治療の課題と 策 平成 30 年 3 月 1 日 経済産業省商務 サービスグループ生物化学産業課 0
 遺伝 治療の課題と 策 平成 30 年 3 月 1 日 経済産業省商務 サービスグループ生物化学産業課 0 遺伝 治療とは 再 医療 遺伝 治療 スキャフォールド治療 1 組織移植 3 細胞治療 2 細胞移植 2ʼ Ex vivo 遺伝 治療 5 4 遺伝 発現 編集 ウイルス治療 ( 腫瘍溶解ウイルス ) 4 的遺伝 を搭載した遺伝 治療薬の投与 () 1) 的遺伝 を搭載した遺伝 治療薬を直接投与
遺伝 治療の課題と 策 平成 30 年 3 月 1 日 経済産業省商務 サービスグループ生物化学産業課 0 遺伝 治療とは 再 医療 遺伝 治療 スキャフォールド治療 1 組織移植 3 細胞治療 2 細胞移植 2ʼ Ex vivo 遺伝 治療 5 4 遺伝 発現 編集 ウイルス治療 ( 腫瘍溶解ウイルス ) 4 的遺伝 を搭載した遺伝 治療薬の投与 () 1) 的遺伝 を搭載した遺伝 治療薬を直接投与
特定個人情報の取扱いの対応について
 平成 27 年 5 月 19 日平成 28 年 2 月 12 日一部改正平成 30 年 9 月 12 日改正 一般財団法人日本情報経済社会推進協会 (JIPDEC) プライバシーマーク推進センター 特定個人情報の取扱いの対応について 行政手続における特定の個人を識別するための番号の利用等に関する法律 ( 以下 番号法 という )( 平成 25 年 5 月 31 日公布 ) に基づく社会保障 税番号制度により
平成 27 年 5 月 19 日平成 28 年 2 月 12 日一部改正平成 30 年 9 月 12 日改正 一般財団法人日本情報経済社会推進協会 (JIPDEC) プライバシーマーク推進センター 特定個人情報の取扱いの対応について 行政手続における特定の個人を識別するための番号の利用等に関する法律 ( 以下 番号法 という )( 平成 25 年 5 月 31 日公布 ) に基づく社会保障 税番号制度により
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
大学院博士課程共通科目ベーシックプログラム
 平成 30 年度医科学専攻共通科目 共通基礎科目実習 ( 旧コア実習 ) 概要 1 ). 大学院生が所属する教育研究分野における実習により単位認定可能な実習項目 ( コア実習項目 ) 1. 組換え DNA 技術実習 2. 生体物質の調製と解析実習 3. 薬理学実習 4. ウイルス学実習 5. 免疫学実習 6. 顕微鏡試料作成法実習 7. ゲノム医学実習 8. 共焦点レーザー顕微鏡実習 2 ). 実習を担当する教育研究分野においてのみ単位認定可能な実習項目
平成 30 年度医科学専攻共通科目 共通基礎科目実習 ( 旧コア実習 ) 概要 1 ). 大学院生が所属する教育研究分野における実習により単位認定可能な実習項目 ( コア実習項目 ) 1. 組換え DNA 技術実習 2. 生体物質の調製と解析実習 3. 薬理学実習 4. ウイルス学実習 5. 免疫学実習 6. 顕微鏡試料作成法実習 7. ゲノム医学実習 8. 共焦点レーザー顕微鏡実習 2 ). 実習を担当する教育研究分野においてのみ単位認定可能な実習項目
資料1:「生命倫理に関する研究機関における検討について」(赤林先生資料)
 資料 1 命倫理に関する研究機関における検討について 東京 学医学部医療倫理学分野 林朗 次 医学系研究における法令 指針等 機関の の役割 倫理審査委員会の役割 倫理審査委員会の構成 研究実施にあたっての検討の流れ 医学系研究における法令 指針等 医学系研究に関する法律 医薬品医療機器等法 (2015 年改訂 ) 治験 再 医療等安全性確保法 (2013 年 ) 再 医療研究 医学系研究に関する基本的な指針
資料 1 命倫理に関する研究機関における検討について 東京 学医学部医療倫理学分野 林朗 次 医学系研究における法令 指針等 機関の の役割 倫理審査委員会の役割 倫理審査委員会の構成 研究実施にあたっての検討の流れ 医学系研究における法令 指針等 医学系研究に関する法律 医薬品医療機器等法 (2015 年改訂 ) 治験 再 医療等安全性確保法 (2013 年 ) 再 医療研究 医学系研究に関する基本的な指針
ともに 申請者が承認審査のスケジュールに沿って法令上求められる製造体制を整備することや承認後円滑に医療現場に提供するための対応が十分になされることで 更なる迅速な実用化を促すものである この制度では 原則として新規原理 新規作用機序等により 生命に重大な影響がある重篤な疾患等に対して 極めて高い有効
 ともに 申請者が承認審査のスケジュールに沿って法令上求められる製造体制を整備することや承認後円滑に医療現場に提供するための対応が十分になされることで 更なる迅速な実用化を促すものである この制度では 原則として新規原理 新規作用機序等により 生命に重大な影響がある重篤な疾患等に対して 極めて高い有効性が期待される医療機器 体外診断用医薬品 再生医療等製品を指定することとする また 本制度では PMDA
ともに 申請者が承認審査のスケジュールに沿って法令上求められる製造体制を整備することや承認後円滑に医療現場に提供するための対応が十分になされることで 更なる迅速な実用化を促すものである この制度では 原則として新規原理 新規作用機序等により 生命に重大な影響がある重篤な疾患等に対して 極めて高い有効性が期待される医療機器 体外診断用医薬品 再生医療等製品を指定することとする また 本制度では PMDA
がんのウイルス療法とは がんのウイルス療法とは がん細胞のみで増えることができるウイルスを感染させ ウイルスが直接がん細胞を破壊する治療法です ウイルス療法では 遺伝子工学技術を用いてウイルスゲノムを 設計 して がん細胞ではよく増えても正常細胞では全く増えないウイルスを人工的に造って臨床に応用しま
 [PRESS RELEASE] 2018 年 8 月 2 日 東京大学医科学研究所附属病院 悪性胸膜中皮腫のウイルス療法を開始 ~ 抗がんウイルス G47Δ を用いた初の胸腔内投与 ~ 東京大学医科学研究所附属病院では 脳腫瘍外科教授藤堂具紀を総括責任者として 悪性胸膜中皮腫に対するウイルス療法の臨床試験を開始します ウイルス療法とは がん細胞だけで増殖するように人工的に改変したウイルスを使う新しいがん治療法で
[PRESS RELEASE] 2018 年 8 月 2 日 東京大学医科学研究所附属病院 悪性胸膜中皮腫のウイルス療法を開始 ~ 抗がんウイルス G47Δ を用いた初の胸腔内投与 ~ 東京大学医科学研究所附属病院では 脳腫瘍外科教授藤堂具紀を総括責任者として 悪性胸膜中皮腫に対するウイルス療法の臨床試験を開始します ウイルス療法とは がん細胞だけで増殖するように人工的に改変したウイルスを使う新しいがん治療法で
資料2 ゲノム医療をめぐる現状と課題(確定版)
 第 1 回ゲノム医療等実用化推進 TF 平成 27 年 11 月 17 日 資料 2 ゲノム医療等をめぐる現状と課題 ゲノム情報の特性 日本医学会の指摘する 遺伝学的検査 診断を実施する際に考慮すべき遺伝情報の特性 遺伝情報には次のような特性があり 遺伝学的検査およびその結果に基づいてなされる診断を行う際にはこれらの特性を十分考慮する必要がある 生涯変化しないこと 血縁者間で一部共有されていること
第 1 回ゲノム医療等実用化推進 TF 平成 27 年 11 月 17 日 資料 2 ゲノム医療等をめぐる現状と課題 ゲノム情報の特性 日本医学会の指摘する 遺伝学的検査 診断を実施する際に考慮すべき遺伝情報の特性 遺伝情報には次のような特性があり 遺伝学的検査およびその結果に基づいてなされる診断を行う際にはこれらの特性を十分考慮する必要がある 生涯変化しないこと 血縁者間で一部共有されていること
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
PowerPoint プレゼンテーション
 コンパニオン診断の現状 ~ 肺がんを例に ~ 2017 年 7 月 29 日 個別化医療に必要なコンパニオン診断薬 コンパニオン診断薬 ~ 肺癌治療を例に ~ NGS によるコンパニオン診断システム 個別化医療の概念 効果と安全性の両面で優れた治療法として世界的に関心が高まっており 特にがん治療などにおいて 今後の中心的役割を担うものと考えられています 薬剤投与前にバイオマーカーと呼ばれる特定の分子や遺伝子を診断し
コンパニオン診断の現状 ~ 肺がんを例に ~ 2017 年 7 月 29 日 個別化医療に必要なコンパニオン診断薬 コンパニオン診断薬 ~ 肺癌治療を例に ~ NGS によるコンパニオン診断システム 個別化医療の概念 効果と安全性の両面で優れた治療法として世界的に関心が高まっており 特にがん治療などにおいて 今後の中心的役割を担うものと考えられています 薬剤投与前にバイオマーカーと呼ばれる特定の分子や遺伝子を診断し
Microsoft PowerPoint - 規制基準委員会勉強会資料 final
 遺伝子治療の動向と課題 国立医薬品食品衛生研究所遺伝子細胞医薬部内田恵理子 ヒューマンサイエンス振興財団規制基準委員会勉強会 2011.6.22 遺伝子治療の現状と最新動向 日本の遺伝子治療の現状と規制 海外の規制とICH 遺伝子治療専門家会議 今後の課題 遺伝子治療とは 疾病の治療を目的として遺伝子又は遺伝子を導入した細胞を人の体内に投与すること ( 遺伝子治療臨床研究指針 ) 遺伝子治療薬 (
遺伝子治療の動向と課題 国立医薬品食品衛生研究所遺伝子細胞医薬部内田恵理子 ヒューマンサイエンス振興財団規制基準委員会勉強会 2011.6.22 遺伝子治療の現状と最新動向 日本の遺伝子治療の現状と規制 海外の規制とICH 遺伝子治療専門家会議 今後の課題 遺伝子治療とは 疾病の治療を目的として遺伝子又は遺伝子を導入した細胞を人の体内に投与すること ( 遺伝子治療臨床研究指針 ) 遺伝子治療薬 (
中医協総 医薬品及び医療機器の費用対効果評価に関する取扱いについて 1 既収載品に係る費用対効果評価の手続き (1) 対象品目の指定中央社会保険医療協議会の定める以下の選定基準に基づき 費用対効果評価専門部会において指定 公表されたものとする 次の全ての要件を満たす品
 中医協総 - 5 2 8. 2. 1 0 医薬品及び医療機器の費用対効果評価に関する取扱いについて 1 既収載品に係る費用対効果評価の手続き (1) 対象品目の指定中央社会保険医療協議会の定める以下の選定基準に基づき 費用対効果評価専門部会において指定 公表されたものとする 次の全ての要件を満たす品目を対象とする なお 2においてイのⅰ イのⅱ ロのⅰ 及びロのⅱは それぞれ1 品目が該当するものとし
中医協総 - 5 2 8. 2. 1 0 医薬品及び医療機器の費用対効果評価に関する取扱いについて 1 既収載品に係る費用対効果評価の手続き (1) 対象品目の指定中央社会保険医療協議会の定める以下の選定基準に基づき 費用対効果評価専門部会において指定 公表されたものとする 次の全ての要件を満たす品目を対象とする なお 2においてイのⅰ イのⅱ ロのⅰ 及びロのⅱは それぞれ1 品目が該当するものとし
2. 検討 ~ 医療に関する事故の特殊性など (1) 医師等による医療行為における事故 医師等が患者に対してどのような医療行為を施すべきかという判断は 医師等の医学的な専門知識 技能に加え 医師等の経験 患者の体質 その時の患者の容態 使用可能な医療機器等の設備等に基づきなされるものである ( 個別
 資料 1 消費者安全調査委員会による事故等原因調査等の進め方について ( 議論のたたき台 ) ~ 医療に関する事故の考え方 ~ 1. 前提 消費者安全調査委員会の調査対象医療に関する事故については 消費者安全法に規定する生命又は身体の被害に係る消費者事故等に当たり得ることから その場合は 消費者安全調査委員会が行う事故等原因調査等の対象になる 消費者安全調査委員会の役割生命又は身体の被害に係る消費者事故等の原因を究明し
資料 1 消費者安全調査委員会による事故等原因調査等の進め方について ( 議論のたたき台 ) ~ 医療に関する事故の考え方 ~ 1. 前提 消費者安全調査委員会の調査対象医療に関する事故については 消費者安全法に規定する生命又は身体の被害に係る消費者事故等に当たり得ることから その場合は 消費者安全調査委員会が行う事故等原因調査等の対象になる 消費者安全調査委員会の役割生命又は身体の被害に係る消費者事故等の原因を究明し
Microsoft Word - 2-① 補償ガイドライン平成27年版(本文)Ver3.1.1.do
 1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
1. Caov-3 細胞株 A2780 細胞株においてシスプラチン単剤 シスプラチンとトポテカン併用添加での殺細胞効果を MTS assay を用い検討した 2. Caov-3 細胞株においてシスプラチンによって誘導される Akt の活性化に対し トポテカンが影響するか否かを調べるために シスプラチ
 ( 様式甲 5) 学位論文内容の要旨 論文提出者氏名 論文審査担当者 主査 朝日通雄 恒遠啓示 副査副査 瀧内比呂也谷川允彦 副査 勝岡洋治 主論文題名 Topotecan as a molecular targeting agent which blocks the Akt and VEGF cascade in platinum-resistant ovarian cancers ( 白金製剤耐性卵巣癌における
( 様式甲 5) 学位論文内容の要旨 論文提出者氏名 論文審査担当者 主査 朝日通雄 恒遠啓示 副査副査 瀧内比呂也谷川允彦 副査 勝岡洋治 主論文題名 Topotecan as a molecular targeting agent which blocks the Akt and VEGF cascade in platinum-resistant ovarian cancers ( 白金製剤耐性卵巣癌における
< F2D8E9197BF A836F815B2E6A7464>
 ( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
PSP 省令 と それぞれ略称する 記 1. 改正施行規則について希少疾病用医療機器その他の医療上特にその必要性が高いと認められる医療機器であり かつ 当該医療機器についての臨床試験の実施に特に長期間を要すると認められるものに係る承認申請をする場合においては 改正 GVP 省令第 9 条の3 第 1
 PSP 省令 と それぞれ略称する 記 1. 改正施行規則について希少疾病用医療機器その他の医療上特にその必要性が高いと認められる医療機器であり かつ 当該医療機器についての臨床試験の実施に特に長期間を要すると認められるものに係る承認申請をする場合においては 改正 GVP 省令第 9 条の3 第 1 項第 1 号に定める医療機器リスク管理計画書をもって 承認申請資料のうち臨床試験の試験成績に関する資料又はこれに代替するものとして厚生労働大臣が認める資料の一部に代えることができることとしたこと
PSP 省令 と それぞれ略称する 記 1. 改正施行規則について希少疾病用医療機器その他の医療上特にその必要性が高いと認められる医療機器であり かつ 当該医療機器についての臨床試験の実施に特に長期間を要すると認められるものに係る承認申請をする場合においては 改正 GVP 省令第 9 条の3 第 1 項第 1 号に定める医療機器リスク管理計画書をもって 承認申請資料のうち臨床試験の試験成績に関する資料又はこれに代替するものとして厚生労働大臣が認める資料の一部に代えることができることとしたこと
一次サンプル採取マニュアル PM 共通 0001 Department of Clinical Laboratory, Kyoto University Hospital その他の検体検査 >> 8C. 遺伝子関連検査受託終了項目 23th May EGFR 遺伝子変異検
 Department of Clinical Laboratory, Kyoto University Hospital 6459 8. その他の検体検査 >> 8C. 遺伝子関連検査受託終了項目 23th May. 2017 EGFR 遺伝子変異検査 ( 院内測定 ) c-erbb/egfr [tissues] 基本情報 8C051 c-erbb/egfr JLAC10 診療報酬 分析物 識別材料測定法
Department of Clinical Laboratory, Kyoto University Hospital 6459 8. その他の検体検査 >> 8C. 遺伝子関連検査受託終了項目 23th May. 2017 EGFR 遺伝子変異検査 ( 院内測定 ) c-erbb/egfr [tissues] 基本情報 8C051 c-erbb/egfr JLAC10 診療報酬 分析物 識別材料測定法
別紙様式 (Ⅴ)-1-3で補足説明している 掲載雑誌は 著者等との間に利益相反による問題が否定できる 最終製品に関する研究レビュー 機能性関与成分に関する研究レビュー ( サプリメント形状の加工食品の場合 ) 摂取量を踏まえた臨床試験で肯定的な結果が得られている ( その他加工食品及び生鮮食品の場合
 別紙様式 (Ⅴ)-1 機能性の科学的根拠に関する点検表 1. 製品概要商品名アサヒ凹茶 ( ぼこちゃ ) 機能性関与成分名りんごポリフェノール ( りんご由来プロシアニジンとして ) 表示しようとする本品には りんごポリフェノール ( りんご由来プロシア機能性ニジンとして ) が含まれるので 体脂肪が気になる方のお腹の脂肪を減らす機能があります 2. 科学的根拠 臨床試験及び研究レビュー共通事項 (
別紙様式 (Ⅴ)-1 機能性の科学的根拠に関する点検表 1. 製品概要商品名アサヒ凹茶 ( ぼこちゃ ) 機能性関与成分名りんごポリフェノール ( りんご由来プロシアニジンとして ) 表示しようとする本品には りんごポリフェノール ( りんご由来プロシア機能性ニジンとして ) が含まれるので 体脂肪が気になる方のお腹の脂肪を減らす機能があります 2. 科学的根拠 臨床試験及び研究レビュー共通事項 (
バイオ医薬品は生物を用いて製造されます 通常 細菌や動物細胞などの生体の中で目的とするタンパク質を産生させます バイオ医薬品の特性は製造プロセスの状態に依存するところが大きく しばしば プロセスが製品 と喩えられます 事実 製造プロセスにおける小さな変更でも 最終製品の違いにつながる可能性があります
 バイオ医薬品とバイオシミラー ( バイオ後続品 ) に関する Q&A 1. バイオテクノロジーとは そしてバイオ医薬品の役割とはどのようなものでしょうか? バイオテクノロジーとは 製品やサービスを生み出するために生物やその一部による修飾を用いた一連の方法やプロセスです 1970 年代のいわゆる 組換えDNA 技術 の発展 展開により 分子レベル でのバイオテクノロジーという新たな時代が幕を開け 様々な分野で知識革命を引き起こしました
バイオ医薬品とバイオシミラー ( バイオ後続品 ) に関する Q&A 1. バイオテクノロジーとは そしてバイオ医薬品の役割とはどのようなものでしょうか? バイオテクノロジーとは 製品やサービスを生み出するために生物やその一部による修飾を用いた一連の方法やプロセスです 1970 年代のいわゆる 組換えDNA 技術 の発展 展開により 分子レベル でのバイオテクノロジーという新たな時代が幕を開け 様々な分野で知識革命を引き起こしました
検討課題の整理 1 第 1 回合同会議での意見及びその後委員から提出された意見を 第 1 回合同会議の 検討の進め方 ( 下記参照 ) に沿って分類 第 1 回合同会議資料 合同会議における検討の進め方 の抜粋 合同会議においては 以下の順で検討を進める (1) ゲノム指針と医学系指針との条文の整合
 第 1 回医学研究等に係る倫理指針の見直しに関する合同会議 TF 平成 30 年 10 月 29 日 参考資料 1 合同会議における委員コメント ( 追記版 ) 検討課題の整理 1 第 1 回合同会議での意見及びその後委員から提出された意見を 第 1 回合同会議の 検討の進め方 ( 下記参照 ) に沿って分類 第 1 回合同会議資料 合同会議における検討の進め方 の抜粋 合同会議においては 以下の順で検討を進める
第 1 回医学研究等に係る倫理指針の見直しに関する合同会議 TF 平成 30 年 10 月 29 日 参考資料 1 合同会議における委員コメント ( 追記版 ) 検討課題の整理 1 第 1 回合同会議での意見及びその後委員から提出された意見を 第 1 回合同会議の 検討の進め方 ( 下記参照 ) に沿って分類 第 1 回合同会議資料 合同会議における検討の進め方 の抜粋 合同会議においては 以下の順で検討を進める
●子宮頸がん予防措置の実施の推進に関する法律案
 第一七四回 参第一二号 目次 子宮頸がん予防措置の実施の推進に関する法律案 第一章総則 ( 第一条 第二条 ) 第二章子宮頸がん予防方針等 ( 第三条 - 第六条 ) 第三章子宮頸がん予防措置の実施の推進に関する具体的な施策 附則 第一節子宮頸がん及び子宮頸がんの予防に関する正しい知識の普及等 ( 第七条 第 八条 ) 第二節子宮頸がん予防ワクチン接種の実施の推進 ( 第九条 - 第十四条 ) 第三節子宮頸がん予防検診の実施の推進
第一七四回 参第一二号 目次 子宮頸がん予防措置の実施の推進に関する法律案 第一章総則 ( 第一条 第二条 ) 第二章子宮頸がん予防方針等 ( 第三条 - 第六条 ) 第三章子宮頸がん予防措置の実施の推進に関する具体的な施策 附則 第一節子宮頸がん及び子宮頸がんの予防に関する正しい知識の普及等 ( 第七条 第 八条 ) 第二節子宮頸がん予防ワクチン接種の実施の推進 ( 第九条 - 第十四条 ) 第三節子宮頸がん予防検診の実施の推進
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果
 2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
資料110-4-1 核置換(ヒト胚核移植胚)に関する規制の状況について
 第 110 回特定胚等研究専門委員会平成 31 年 4 月 9 日 資料 110-4-1 核置換 ( 胚 ) に関する規制の状況について 核置換 ( ミトコンドリア置換 ) 技術について 受精胚核置換 ( 胚 ) 受精卵の核を別の除核卵に移植 人の胎内に移植した場合 精子 卵 体外受精 ( 有性生殖 ) 胚 核正常ミトコンドリア異常ミトコンドリア 核 DNA はカップル由来 ミトコンドリア DNA
第 110 回特定胚等研究専門委員会平成 31 年 4 月 9 日 資料 110-4-1 核置換 ( 胚 ) に関する規制の状況について 核置換 ( ミトコンドリア置換 ) 技術について 受精胚核置換 ( 胚 ) 受精卵の核を別の除核卵に移植 人の胎内に移植した場合 精子 卵 体外受精 ( 有性生殖 ) 胚 核正常ミトコンドリア異常ミトコンドリア 核 DNA はカップル由来 ミトコンドリア DNA
動物用医薬品(医薬部外品)製造販売承認事項変更承認申請書
 別記様式 1 ( 一 ) 生ウイルス + 株化細胞ワクチン 動物用医薬品製造販売承認事項変更承認申請書 ( 例 ) SL 年月日 農林水産大臣 殿 住所 氏名 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第 14 条第 9 項の規定により動物用医薬品製造販売承認事項の変更の承認を受けたいので 下記により申請します 記承認年月日及び承認番号 1 製造業者又は認定外国製造業者の氏名又は名称及び住所既承認内容を記載
別記様式 1 ( 一 ) 生ウイルス + 株化細胞ワクチン 動物用医薬品製造販売承認事項変更承認申請書 ( 例 ) SL 年月日 農林水産大臣 殿 住所 氏名 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第 14 条第 9 項の規定により動物用医薬品製造販売承認事項の変更の承認を受けたいので 下記により申請します 記承認年月日及び承認番号 1 製造業者又は認定外国製造業者の氏名又は名称及び住所既承認内容を記載
検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 P EDTA-2Na( 薄紫 ) 血液 7 ml RNA 検体ラベル ( 単項目オーダー時 ) ホンハ ンテスト 注 外 N60 氷 MINテイリョウ. 採取容器について 0
 0868010 8. その他の検体検査 >> 8C. 遺伝子関連検査 >> minor bcr-abl, mrna quantitative 連絡先 : 3664 基本情報 8C127 minor bcr-abl 分析物 JLAC10 診療報酬 識別 9962 mrna 定量 材料 019 全血 ( 添加物入り ) 測定法 875 リアルタイムRT-PCR 法 結果識別 第 2 章 特掲診療料 D006-2
0868010 8. その他の検体検査 >> 8C. 遺伝子関連検査 >> minor bcr-abl, mrna quantitative 連絡先 : 3664 基本情報 8C127 minor bcr-abl 分析物 JLAC10 診療報酬 識別 9962 mrna 定量 材料 019 全血 ( 添加物入り ) 測定法 875 リアルタイムRT-PCR 法 結果識別 第 2 章 特掲診療料 D006-2
Microsoft Word - all_ jp.docx
 平成 28 年 11 月 18 日 小児急性リンパ性白血病における超高感度な微小残存病変の検査法を確立 名古屋大学大学院医学系研究科 ( 研究科長 髙橋雅英 ) 小児科学の小島勢二 ( こじませいじ ) 名誉教授 村松秀城 ( むらまつひでき ) 助教 関屋由子 ( せきやゆうこ ) 大学院生らの研究グループは 小児急性リンパ性白血病 (acute lymphoblastic leukemia; ALL)
平成 28 年 11 月 18 日 小児急性リンパ性白血病における超高感度な微小残存病変の検査法を確立 名古屋大学大学院医学系研究科 ( 研究科長 髙橋雅英 ) 小児科学の小島勢二 ( こじませいじ ) 名誉教授 村松秀城 ( むらまつひでき ) 助教 関屋由子 ( せきやゆうこ ) 大学院生らの研究グループは 小児急性リンパ性白血病 (acute lymphoblastic leukemia; ALL)
イルスが存在しており このウイルスの存在を確認することが診断につながります ウ イルス性発疹症 についての詳細は他稿を参照していただき 今回は 局所感染疾患 と 腫瘍性疾患 のウイルス感染検査と読み方について解説します 皮膚病変におけるウイルス感染検査 ( 図 2, 表 ) 表 皮膚病変におけるウイ
 2012 年 12 月 13 日放送 第 111 回日本皮膚科学会総会 6 教育講演 26-3 皮膚病変におけるウイルス感染検査と読み方 川崎医科大学皮膚科 講師山本剛伸 はじめにウイルス性皮膚疾患は 臨床症状から視診のみで診断がつく例もありますが ウイルス感染検査が必要となる症例も日常多く遭遇します ウイルス感染検査法は多種類存在し それぞれに利点 欠点があります 今回は それぞれのウイルス感染検査について
2012 年 12 月 13 日放送 第 111 回日本皮膚科学会総会 6 教育講演 26-3 皮膚病変におけるウイルス感染検査と読み方 川崎医科大学皮膚科 講師山本剛伸 はじめにウイルス性皮膚疾患は 臨床症状から視診のみで診断がつく例もありますが ウイルス感染検査が必要となる症例も日常多く遭遇します ウイルス感染検査法は多種類存在し それぞれに利点 欠点があります 今回は それぞれのウイルス感染検査について
Microsoft PowerPoint - 資料3-8_(B理研・古関)拠点B理研古関120613
 再生医療実現拠点ネットワークプログラム 疾患 組織別実用化研究拠点 ( 拠点 B) 資料 3-8 課題名 : NKT 細胞再生によるがん免疫治療技術開発拠点 研究代表者 : 理化学研究所古関明彦分担研究機関 : 千葉大学慶應義塾大学国立病院機構 1 NKT 細胞標的治療の抗腫瘍効果 B16 マウスメラノーマ細胞 agalcer/dcs (3 x 10 6 ) 7d 14d NKT 細胞標的治療 agalcer/dcs
再生医療実現拠点ネットワークプログラム 疾患 組織別実用化研究拠点 ( 拠点 B) 資料 3-8 課題名 : NKT 細胞再生によるがん免疫治療技術開発拠点 研究代表者 : 理化学研究所古関明彦分担研究機関 : 千葉大学慶應義塾大学国立病院機構 1 NKT 細胞標的治療の抗腫瘍効果 B16 マウスメラノーマ細胞 agalcer/dcs (3 x 10 6 ) 7d 14d NKT 細胞標的治療 agalcer/dcs
Untitled
 上原記念生命科学財団研究報告集, 23(2009) 149. サルエイズウイルスのヒトへの感染伝播を規定する宿主制御因子の解明 武内寛明 Key words: エイズウイルス, 異種間感染, 感染症, 人畜共通感染症, 新興感染症 東京大学医科学研究所感染症国際研究センター微生物学分野 緒言ヒト後天性免疫不全症候群 ( ヒトエイズ ) は, ヒト免疫不全ウイルス (HIV) によって引き起こされる慢性持続感染症である.
上原記念生命科学財団研究報告集, 23(2009) 149. サルエイズウイルスのヒトへの感染伝播を規定する宿主制御因子の解明 武内寛明 Key words: エイズウイルス, 異種間感染, 感染症, 人畜共通感染症, 新興感染症 東京大学医科学研究所感染症国際研究センター微生物学分野 緒言ヒト後天性免疫不全症候群 ( ヒトエイズ ) は, ヒト免疫不全ウイルス (HIV) によって引き起こされる慢性持続感染症である.
Microsoft Word - ①【修正】B型肝炎 ワクチンにおける副反応の報告基準について
 資料 1 B 型肝炎ワクチンの副反応報告基準について 予防接種法における副反応報告制度について 制度の趣旨副反応報告制度は 予防接種後に生じる種々の身体的反応や副反応が疑われる症状等について情報を収集し ワクチンの安全性について管理 検討を行うことで 広く国民に情報を提供すること及び今後の予防接種行政の推進に資することを目的としている 報告の義務 予防接種法第 12 条 1 項 ( 参考資料 1)
資料 1 B 型肝炎ワクチンの副反応報告基準について 予防接種法における副反応報告制度について 制度の趣旨副反応報告制度は 予防接種後に生じる種々の身体的反応や副反応が疑われる症状等について情報を収集し ワクチンの安全性について管理 検討を行うことで 広く国民に情報を提供すること及び今後の予防接種行政の推進に資することを目的としている 報告の義務 予防接種法第 12 条 1 項 ( 参考資料 1)
はじめて医療機器を製造販売または製造される方へ
 を製造 ( 輸入 ) 販売するには 国内で必要な許可等について を製造販売 製造 ( 輸入 ) するためには 医薬品 等の品質 有効性及び安全性の確保等に関する法律 ( 以下 薬機法という ) の許可等 ( 製造販売業許可 製造業登録 ) が必要になります 製品を市場に出荷するために必要な許可 販売する製品に対して最終責製造販売業任を持ち 自社の名前で市場へ出荷する この許可では製造することはできません
を製造 ( 輸入 ) 販売するには 国内で必要な許可等について を製造販売 製造 ( 輸入 ) するためには 医薬品 等の品質 有効性及び安全性の確保等に関する法律 ( 以下 薬機法という ) の許可等 ( 製造販売業許可 製造業登録 ) が必要になります 製品を市場に出荷するために必要な許可 販売する製品に対して最終責製造販売業任を持ち 自社の名前で市場へ出荷する この許可では製造することはできません
< F2D816994D48D FA957493FC816A >
 -1- 厚生労働省 告示第二号農林水産省カネミ油症患者に関する施策の総合的な推進に関する法律(平成二十四年法律第八十二号)第八条第一項の規定に基づき カネミ油症患者に関する施策の推進に関する基本的な指針を次のように策定したので 同条第四項の規定により告示する 平成二十四年十一月三十日厚生労働大臣三井辨雄農林水産大臣郡司彰カネミ油症患者に関する施策の推進に関する基本的な指針カネミ油症(カネミ油症患者に関する施策の総合的な推進に関する法律(平成二十四年法律第八十二号
-1- 厚生労働省 告示第二号農林水産省カネミ油症患者に関する施策の総合的な推進に関する法律(平成二十四年法律第八十二号)第八条第一項の規定に基づき カネミ油症患者に関する施策の推進に関する基本的な指針を次のように策定したので 同条第四項の規定により告示する 平成二十四年十一月三十日厚生労働大臣三井辨雄農林水産大臣郡司彰カネミ油症患者に関する施策の推進に関する基本的な指針カネミ油症(カネミ油症患者に関する施策の総合的な推進に関する法律(平成二十四年法律第八十二号
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
革新的がん治療薬の実用化を目指した非臨床研究 ( 厚生労働科学研究 ) に採択 大学院医歯学総合研究科遺伝子治療 再生医学分野の小戝健一郎教授の 難治癌を標的治療できる完全オリジナルのウイルス遺伝子医薬の実用化のための前臨床研究 が 平成 24 年度の厚生労働科学研究費補助金 ( 難病 がん等の疾患
 革新的がん治療薬の実用化を目指した非臨床研究 ( 厚生労働科学研究 ) に採択 大学院医歯学総合研究科遺伝子治療 再生医学分野の小戝健一郎教授の 難治癌を標的治療できる完全オリジナルのウイルス遺伝子医薬の実用化のための前臨床研究 が 平成 24 年度の厚生労働科学研究費補助金 ( 難病 がん等の疾患分野の医療の実用化研究事業 がん関係研究分野 ) に採択されました 厚生労働科学研究の背景と本研究事業の概要がんは我が国の死亡原因の第
革新的がん治療薬の実用化を目指した非臨床研究 ( 厚生労働科学研究 ) に採択 大学院医歯学総合研究科遺伝子治療 再生医学分野の小戝健一郎教授の 難治癌を標的治療できる完全オリジナルのウイルス遺伝子医薬の実用化のための前臨床研究 が 平成 24 年度の厚生労働科学研究費補助金 ( 難病 がん等の疾患分野の医療の実用化研究事業 がん関係研究分野 ) に採択されました 厚生労働科学研究の背景と本研究事業の概要がんは我が国の死亡原因の第
 新しい概念に基づく第 3 世代のがん免疫治療 inkt がん治療 inkt Cancer Therapy 監修 : 谷口克先生株式会社アンビシオン inktがん治療 これまでのがん治療の最大の問題であるがんの進行 再発 転移 この問題を克服することを 目指し 新しい概念に基づく第3世代のがん免疫治療である inktがん治療 が開発されました inktがん治療 は 患者末梢血細胞を加工して作った オーダーメイドがんワクチン
新しい概念に基づく第 3 世代のがん免疫治療 inkt がん治療 inkt Cancer Therapy 監修 : 谷口克先生株式会社アンビシオン inktがん治療 これまでのがん治療の最大の問題であるがんの進行 再発 転移 この問題を克服することを 目指し 新しい概念に基づく第3世代のがん免疫治療である inktがん治療 が開発されました inktがん治療 は 患者末梢血細胞を加工して作った オーダーメイドがんワクチン
