将来見通し 本プレゼンテーションには 中外製薬の事業及び展望に関する将来見通しが含まれていますが いずれも 既存の情報や様々な動向についての中外製薬による現時点での分析を反映しています 実際の業績は 事業に及ぼすリスクや不確定な事柄により現在の見通しと異なることもあります 本プレゼンテーションには
|
|
|
- まれあ たにしき
- 5 years ago
- Views:
Transcription
1 ヘムライブラ 皮下注 30, 60, 90, 105, 150mg 製品概要 中外製薬株式会社 ヘムライブラライフサイクルリーダー 茂木洋
2 将来見通し 本プレゼンテーションには 中外製薬の事業及び展望に関する将来見通しが含まれていますが いずれも 既存の情報や様々な動向についての中外製薬による現時点での分析を反映しています 実際の業績は 事業に及ぼすリスクや不確定な事柄により現在の見通しと異なることもあります 本プレゼンテーションには 医薬品 ( 開発品を含む ) に関する情報が含まれていますが それらは宣伝 広告や医学的なアドバイスを目的とするものではありません また 投資家 報道関係者向けの 血友病 A 治療薬ヘムライブラ説明会 (2018 年 6 月 1 日実施 ) 用に作成したものであり 広く一般向けに作成したものではありません 本資料の転送 コピーなどはお控えください 1
3 製品概要 薬効分類名 : 製品名 / 一般名 包装 2
4 ヘムライブラの特性 中外製薬創製の二重特異性 ( バイスペシフィック ) 抗体製剤 活性型血液凝固第 IX 因子 (FIXa) と血液凝固第 X 因子 (FX) の双方に結合して リン脂質膜上で両因子を適切な位置関係に保持することで FVIIIa の補因子機能を代替し その下流の血液凝固反応を促進すると考えられます FVllla 及びヘムライブラの補因子活性 ( イメージ図 ) FVllla ヘムライブラ EGF2 EGF1 Gla FX A1 A2 A3 C2 C1 FIXa EGF2 EGF1 Gla FX FIXa PS 露出リン脂質膜 FXa FXa 北沢剛久, 他 : 生化学 89(3):325-32, 2017 ( 本論文の著者のうち1 名は中外製薬株式会社の社員です ) 3
5 ヘムライブラが目指す治療への貢献 インヒビター保有の血友病 A におけるアンメットメディカルニーズに対応 有効性 ( 出血抑制効果 ) 出血抑制効果の向上 投与手技 ( 静脈内投与 ) 皮下投与 頻回投与による時間 手間等 週 1 回投与 4
6 ヘムライブラ : 開発の経緯 1 リード抗体の同定 富士御殿場研究所での創製 200 種類の抗 FIXa 抗体を作製 抗体の多面的最適化 FIXa 結合領域 結合 FVIIIa 機能代替活性の向上 体内動態の改善 ( 血中半減期の延長 ) 物理化学的特性の改良 免疫原性の低減 抗体の生産効率の向上 FX 結合領域 200 種類の抗 FX 抗体を作製 約 4 万のバイスペシフィック抗体のスクリーニングを行い リード抗体を取得 2,000 以上の改変抗体を検討 Sampei et al. PLoS One 8 e57479 (2013) ヘムライブラの同定 : ヒト化抗 FIXa / X asymmetric バイスペシフィック IgG 4 5
7 ヘムライブラ : 開発の経緯 2 富士御殿場研究所での研究 創製 (2001 年 ~) 国内臨床開発推進 (2012 年 ~):FIH から PoC 取得まで (Ph1 Ph1/2) 国内 Ph1 試験結果に基づく米国 BTD 取得 (2015 年 9 月 ) ロシュ社と共同でグローバル開発開始 (2014 年 7 月 ~) グローバル Ph3 試験 (HAVEN 1~HAVEN 4) 実施 欧 米 日でインヒビター保有血友病 A 同時期申請実施 (2017 年 6~7 月 ) 米国 ( 優先審査 ) EU( 迅速審査 ) 日本 ( 希少疾病用医薬品指定下で優先審査 ) 承認 : 米国 (2017 年 11 月 ) 欧州 (2018 年 2 月 ) 日本 (2018 年 3 月承認 5 月発売 ) *FIH:first in human, PoC: proof of concept, BTD: breakthrough therapy designation 6
8 ヘムライブラの効能 効果 用法 用量 効能 効果 血液凝固第 VIII 因子に対するインヒビターを保有する先天性血液凝固第 VIII 因子欠乏患者における出血傾向の抑制 用法 用量 通常 エミシズマブ ( 遺伝子組換え ) として 1 回 3mg/kg( 体重 ) を 1 週間の間隔で 4 回皮下投与し 以降は 1 回 1.5mg/kg( 体重 ) を 1 週間の間隔で皮下投与する < 用法 用量に関連する使用上の注意 > 本剤は 出血傾向の抑制を目的とした定期的な投与のみに使用し 出血時の止血を目的とした投与は行わないこと 出典 : へムライブラ添付文書 (2018 年 5 月改訂第 3 版 ) 7
9 ヘムライブラ投与スケジュールと投与量 ヘムライブラ投与スケジュールのイメージ 体重 1 kgあたり 3.0 mg 体重 1 kgあたり 1.5 mg ヘムライブラ投与開始前日までにバイパス止血製剤による定期輸注は中止してください 1 回目 2 回目 3 回目 4 回目 5 回目 6 回目 7 回目 8 回目 ヘムライブラの投与を中止した場合 中止後 6 カ月間はバイパス止血製剤による定期輸注を行わないでください ( 週 ) 血中濃度が定常状態となる投与開始 4 回目まではヘムライブラ導入施設における投与が望ましい 医療機関にてトレーニング後 在宅自己注射へ移行 出典 : ヘムライブラ皮下注適正使用ガイド ( 2018年 5月改訂 ) 8
10 承認条件 1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 日本人での投与経験が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全症例を対象に使用成績調査を実施することにより 本剤の使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを早期に収集し 本剤の適正使用に必要な措置を講じること 3. 市販直後調査を実施すること 出典 : 承認書 へムライブラ添付文書 (2018 年 5 月改訂第 3 版 ) 9
11 ヘムライブラ医薬品リスク管理計画書 (RMP) 概要 ヘムライブラ 30mg, 60mg, 90mg, 105mg, 150mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名ヘムライブラ皮下注有効成分エミシズマブ ( 遺伝子組換え ) 製造販売業者中外製薬株式会社薬効分類 安全性検討事項 重要な特定されたリスク 重要な潜在的リスク 重要な不足情報 血栓塞栓症 血栓塞栓症 該当なし (apccとの併用時) (FVIIa/FXとの併用時) 血栓性微小血管症 (apcc との併用時 ) 1.2. 有効性に関する検討事項 血栓性微小血管症 (FVIIa/FX との併用時 ) 本剤の血液凝固検査結果への影響に起因する不適切な止血管理に伴う重大な出血 ショック アナフィラキシー 免疫原性 インヒビター保有血友病 A 患者を対象に本剤を長期投与した際の出血抑制効果 左記に基づく安全性監視のための活動 2. 医薬品安全性監視計画の概要 通常の医薬品安全性監視活動 個別症例の収集 評価 研究報告 : 文献等収集及び評価 外国措置報告 : 海外における措置情報の収集及び評価有害事象 ( 死亡を含む ) のデータマイニング手法等によるシグナル検出及び評価 追加の医薬品安全性監視活動 市販直後調査 インヒビター保有血友病 A 患者を対象とした製造販売後臨床試験 (ACE002JP BH29884 BH29992) 一般使用成績調査 3. 有効性に関する調査 試験の計画の概要 インヒビター保有血友病 A 患者を対象とした製造販売後臨床試験 (ACE002JP) 左記に基づくリスク最小化のための活動 4. リスク最小化計画の概要通常のリスク最小化活動添付文書の作成患者向医薬品ガイド追加のリスク最小化活動市販直後調査による情報提供使用条件の設定医療関係者への情報提供 ( 適正使用ガイド ) 患者への情報提供 ( 患者ハンドブック等 ) 上記 RMP 概要中の略称について apcc: 活性型プロトロンビン複合体 ( 乾燥人血液凝固因子抗体迂回活性複合体 ) 製剤 FVIIa/FX: 乾燥濃縮人血液凝固第 X 因子加活性化第 VII 因子製剤 出典 : ヘムライブラ皮下注適正使用ガイド ( 2018年 5月改訂 ) 10
12 ヘムライブラ適正使用推進に向けた体制 全国にヘムライブラの専門 MR を配置し 安全性専門担当 (Safety Expert) メディカル担当 (Medical Science Liaison) との連携により 安全性確保のための体制を設けています 血友病 A の方々 ご家族 ヘムライブラの導入 日常診療対応 フォロー施設の紹介 ヘムライブラ導入施設 止血治療に関する相談 フォロー施設 安全性専門担当 専門 MR+ ゼネラル MR メディカル担当 11
13 血友病治療の現状とヘムライブラへの期待 奈良県立医科大学小児科学教室教授嶋緑倫
14 利益相反状態の開示 演者氏名 : 嶋緑倫 所属 : 公立大学法人奈良県立医科大学 講演料などロシュ 中外製薬 バイエル薬品 バイオベラティブ ジャパン CSL ベーリング ノボノルディスク バクスアルタ ファイザー 研究費中外製薬 バイエル薬品 CSL ベーリング ノボノルディスク バクスアルタ ファイザー 13
15 血友病に関する最古の記載 ユダヤ教の聖典 Talmud もし 最初の男の子が割礼により出血し 第 2 子も同様であれば 第 3 子の割礼は行ってはいけない Nashim( 結婚と離婚 誓約に対する作法 ) 14
16 わが国における先天性凝固障害症の生存患者数 遺伝形式 疾患名患者数遺伝形式 血友病 A 血友病 B 血友病 AB von Willebrand 病先天性フィブリノゲン欠乏 低下 / 異常症先天性プロトロンビン欠乏 低下 / 異常症先天性第 V 因子欠乏 低下 / 異常症先天性第 VII 因子欠乏 低下 / 異常症先天性第 X 因子欠乏 低下 / 異常症先天性第 XI 因子欠乏 低下 / 異常症先天性第 XII 因子欠乏 低下 / 異常症 5,326 1, , XLR XLR XLR AD, AR AD, AR AR AR AR AR AR AR 先天性第 XIII 因子欠乏 低下 / 異常症 72 AR 先天性第 V VIII 因子欠乏 低下 / 異常症 7 AR XLR:X 連鎖劣性遺伝,AD: 常染色体性優性遺伝,AR: 常染色体性劣性遺伝出典 : 厚生労働省委託事業平成 29 年度 (2017 年度 ) 血液凝固異常症全国調査報告書公益財団法人エイズ予防財団発行 15
17 第 VIII 因子の活性の違いと出血回数 FVIII, FIX 活性 分類 重症 中等症 軽症 <1% 重症 1 5% 中等症 >5% 30% 軽症 Uijl et al. Haemophilia
18 治療を要する血友病の出血部位別の出血回数 出血の種類関節出血筋肉出血皮下出血鼻出血血尿口腔内出血消化管出血その他不明計 出血回数 1,776(60.8%) 446(15.3%) 328(11.2%) 68(2.3%) 45(1.5%) 41(1.4%) 8(0.3%) 159(5.4%) 18(0.6%) 2,920(100%) 出典 : コージネイトインタビューフォーム より一部改変 17
19 関節出血と血友病性関節症 疼痛 z 腫脹 熱感 浸潤腫れ筋肉萎縮朝のこわばり慢性疼痛可動域の制限 18
20 血友病の重篤な出血 頭蓋内頚部腹腔内 ( 消化管内 ) 脊髄 19
21 血友病の止血治療と製剤 補充療法 血友病 A: 第 VIII 因子製剤遺伝子組換え型製剤血漿由来製剤 血友病 B: 第 IX 因子製剤遺伝子組換え型製剤血漿由来製剤 その他の止血治療 酢酸デスモプレシン (DDAVP) トラネキサム酸 20
22 血友病治療の進歩 治療の進歩 定期補充療法 半減期延長型遺伝子組換え第 Ⅷ 因子製剤 (2015) 半減期延長型遺伝子組換え第 Ⅸ 因子製剤 (2014) 2007 遺伝子組換え第 Ⅸ 因子製剤 (2010) 遺伝子組換え第 Ⅷ 因子製剤 (1993) モノクローナル精製製剤 (1988) HIV and HCV 感染 (80s 初頭 ) 血漿由来濃縮製剤 (70s) クリオプレシピテート (1964) 全血または新鮮凍結血漿 (40s-50s) 製剤の進歩 1. Wong T, Recht M. Drugs. 2011: 71: Franchini & Manucci. Orphanet Journal of Rare Diseases. 2012: 7: 24 21
23 血友病治療の原則 出血時の補充療法 定期補充療法 重症を中等症に変換する Uijl et al. Haemophilia
24 定期補充療法の種類 1 次定期補充療法 <2 歳または > 関節内出血 1 回 原則重症 単位 /kg, 3 回 / 週または隔日 2 次定期補充療法 23
25 ハンドボール頭部打撲定期補充療法の種類 症例 MS 重症血友病 A 開始年齢 6 歳 回 ) 単位 / 回週 2 回 250 単位 / 回週 3 回 5 4 頭マ頭部ラ部3 打ソ打2 ン撲1 撲体重 18kg 体重 20kg 頭部打撲1 年目 2 年目 当症例は臨床例の一部を紹介したもので すべての症例が同様の結果を示すものではありません 24
26 実施率25 重症血友病患者における定期補充療法実施率の推移 (%) 重症血友病 A 重症血友病 B (n=)(1,464) (262)(1,524)(266) (1,518)(268) (1,664)(288)(1,681)(302) (1,537)(273) 出典 : 厚生労働省委託事業 : 血液凝固異常症全国調査平成 24 年 ~29 年度報告書
27 血友病治療におけるアンメットニーズ 頻回の静脈注射の必要性 インヒビター ( 抗 FVIII,IX 同種抗体 ) の問題 血友病性関節症の進行 微小出血の防御 より高い活動性 ( より高いトラフ ) 医療経済のストレス 26
28 第 VIII 因子レベルの変化 : 凝固因子製剤 (25IU/kg 週 3 回 ) 投与症例 半減期 10 時間 : 凝固因子製剤の投与 51.6% 上 50% 昇値(1.6% 1.6% %)51.6% 1.6% 半減期 6 時間 月火水木金土日月 上 昇 50% 50.2% 50.2% 値(%)0% 0% 0% 0% 月 火 水 木 金 土 日 月 出典 : 奈良県立医科大学小児科学教室症例当症例は臨床例の一部を紹介したもので すべての症例が同様の結果を示すものではありません 27
29 血友病 A インヒビターの問題 同種抗体 : 製剤中の第 VIII 因子や第 IX 因子を非自己と認識して抗体が産生 インヒビターの力価高力価 : 5BU/ml 低力価 :<5BU/ml インヒビターの反応性 low responder high responder 一過性 28
30 インヒビターが出現するとなぜ困るか? 標準治療である第 VIII 因子製剤の効果低下 / 喪失 出血の増加 標的関節の増加 関節症の急速な進行 身体活動性の低下 生活の質の低下 病態の悪化により患者さんの生活に大きな影響を与える 治療も益々困難になる 29
31 インヒビター保有血友病に対する治療 急性出血時もしくは手術時の止血療法 インヒビター中和療法 : 補充療法製剤 バイパス止血療法 : 活性型プロトロンビン複合体製剤遺伝子組換え型活性型第 VII 因子 出血予防を目的とした治療 インヒビター消失を目的とした治療 免疫寛容導入 (ITI) 療法 免疫寛容療法の成功率はgood risk 群で約 7 割 * Bad risk 群のインヒビターには有効な治療手段がない 呼吸困難を呈した頚部出血の例 * 出典 : 公益財団法人血液製剤調査機構 血友病インヒビター保有例に対する免疫寛容療法の実態に関する調査研究 57 施設 (2000 年以降 ) 30
32 血友病の医療費の課題 血友病 A インヒビター非保有 1000 単位 (7 万 4 千円 / 本 ) 3 回 / 週 : 約 1,000 万円 / 年 3.5 回 / 週 : 約 1,200 万円 / 年 2000 単位 3 回 / 週 : 約 2,100 万円 / 年 3.5 回 / 週 : 約 2,500 万円 / 年 インヒビター保有約 6,000 万 ~1 億円 / 年 31
33 7/31 8/4 8/16 8/20 8/31 11,780,000 yen 手術 120,000,000 yen apcc (95.7U/kg) rfviia (102ug/kg) インヒビターハイレスポンダーにおける 6 つの外傷性骨折 出典 : 奈良県立医科大学小児科学教室症例当症例は臨床例の一部を紹介したもので すべての症例が同様の結果を示すものではありません 32
34 2016 年度高額医療費ベスト 10 順位 主傷病名 医療費 / 月 1 フォンウィルブランド病 106,941,690 2 血友病 A 102,379,460 3 血友病 A 70,229,710 4 血友病 A 50,427,470 5 血友病 A 49,941,080 6 血友病 A 45,902,330 7 血友病 A 41,049,330 8 血友病 A 41,049,330 9 血友病 A 40,780, 血友病 A 37,268,590 上位 100 位 : 血友病 A 23 件 血友病 B 6 件 心疾患 47 件 出典 : 平成 28 年度高額レセプト上位の概要健保連合組合 33
35 第 VIII 因子製剤総費用 (2013 年 ~2017 年 ) ( 百万 ) 70,000 血漿由来 FVIII 遺伝子組換え FVIII 合計 63,404 60,000 55,319 57,946 50,000 49,996 40,000 30,000 35,329 29,877 40,119 34,580 37,688 32, 億円 / 年 +α 20,000 10,000 5,452 5,539 5,540 5,323 5, 平成 24 年度 - 平成 28 年度の血液製剤の安定供給に関する計画 ( 案 ) より作表 34
36 血液凝固のカスケード 内因系 外因系 細胞表面接触 組織因子 FXII FXIIa FVII FVIIa FXI FXIa FIX FIXa FVIIIa Ca 2+ 反応速度を 20 万倍増強 FX FXa 第 VIII 因子機能発現の機序は? FII FIIa ( トロンビン ) FXIII FXIIIa フィブリノゲンフィブリン 出典 : 和田英夫 : 止血機構総論. 止血機構. 病気がみえる vol.5 血液第 2 版. メディックメディア, 東京,2017,pp より一部改変 35
37 第 VIII 因子 (FVIIIa) の機能と FVIIIa 代替 バイスペシフィック抗体のコンセプト K D = 0.3 µm FVIIIa K D = 1~3 µm FIXa HEMLIBRA emicizumab FX µm 0.1 µm 0.2 µm K D = 1.52 µm K D = 1.85 µm イメージ図 イメージ図 FVIIIa 代替バイスペシフィック抗体のメリット 皮下投与が可能 長時間作用 インヒビター保有例にも有効 第 VIII 因子に対するインヒビターの発生はない Kitazawa T, Shima M et al. Thromb Haemost 2017; 117 (7): ; Fay PJ, Koshibu K. J Biol Chem 1998; 273 (30): ; Lenting P et al. J Biol Chem 1996; 271 (41): ; Soeda T, Shima M et al. J Biol Chem 2009; 284 (6): ; Lapan KA, Fay PJ. J Biol Chem 1997; 272 (4): ; Takeyama M et al. Biochemistry 2012; 51 (3):
38 へムライブラの開発 ( インヒビター保有血友病 A) 中外製薬抗体改変技術 2003 年 奈良県立医科大学 FⅧ 機能代替血友病治療臨床試験経験 2012 年 Phase 1: 健康人 ( 日本 中外製薬 ) 2013 年 Phase1/2: 血友病 A 患者 ( 日本 中外製薬 ) 2015 年 FDA による画期的治療薬指定 2015 年 Phase 3( 国際共同治験 : ロシュ ジェネンテック 中外製薬 ) 2017 年 11 月 16 日米国での承認 2018 年 2 月 27 日欧州での承認 2018 年 3 月 23 日日本での承認 37
39 ヘムライブラの臨床開発 Phase 1: 健康人 患者 Phase 1/2 ( 継続試験 ): 患者 非介入試験 : 患者 ( 主な目的 : 治療実態の把握 ) 一部患者の移行 HAVEN 1 Phase 3: 成人 青年期インヒビター保有患者週 1 回投与 HAVEN 2 Phase 3: 小児インヒビター保有患者週 1 回投与 HAVEN 3 Phase 3: インヒビター非保有患者週 1 回または 2 週 1 回投与 18 年 3 月国内承認 18 年 3 月国内承認 米国 BTD 取得国内申請中 Phase1,1/2 は国内試験その他はロシュとの国際共同治験 HAVEN 4 Phase 3: インヒビター保有 / 非保有患者 4 週 1 回投与 国内申請中 38
40 HAVEN 1 試験 : 試験デザイン 試験前のバイパス止血製剤の使用状況に応じて A 群 ~C 群に登録され これらに登録できなかった患者を D 群に登録 A 群 主要有効性観察期間 24 週間 本試験前にバイパス止血製剤による出血時止血療法を受けていた群 n=53 12 歳以上のインヒビター保有血友病 A 患者 ランダム割付 1 2:1 B 群 C 群 ヘムライブラ定期投与 (n=35) 定期投与非実施 (n=18) ヘムライブラ定期投与 ヘムライブラ定期投与 本試験前にバイパス止血製剤の定期輸注を受けていた群 n=49 ヘムライブラ定期投与 (n=49) 非介入試験参加のインヒビター保有血友病 A 患者 2 D 群 ヘムライブラ定期投与 ヘムライブラ定期投与 (n=7) 1 割付因子 ( 登録前 24 週間の出血回数 :9 回未満 9 回以上 ) 2 登録締切前に A 群 B 群または C 群に登録できなかった患者を 有効性 安全性 薬物動態及び薬力学の追加データを得るため 別途設けた治療群 (D 群 ) に登録出血時にはヘムライブラ投与の有無にかかわらず バイパス止血製剤を投与した 出典 : 承認時評価資料国際共同第 III 相臨床試験 (BH29884 試験 ) 39
41 HAVEN 1 試験 : 治療を要した出血ヘムライブラ定期投与 (A 群 ) vs 定期投与非実施 (B 群 ) 治療を要した出血の年間出血率 治療を要した出血ゼロの割合 ( 回 / 年 ) 25 ABR 比 0.13 [95%CI: ] p< 観察期間の中央値 ( 範囲 ) 29.3 週 24.1 週 (0.1~48.9 週 ) (23.0~26.0 週 ) % % 0 A 群 (35 例 ) ヘムライブラ定期投与 B 群 (18 例 ) 定期投与非実施 0 A 群 (35 例 ) ヘムライブラ定期投与 B 群 (18 例 ) 定期投与非実施 出典 : 承認時評価資料国際共同第 III 相臨床試験 (BH29884 試験 ) 40
42 HAVEN 1 試験 : 治療を要した出血バイパス止血製剤の出血予防 ( 定期輸注 ) 時との患者内比較 (C 群 ) 治療を要した出血の年間出血率 ( 回 / 年 ) ( 回 / 年 ) すべての出血の年間出血率 40 ABR 比 ABR 比 [95%CI: ] [95%CI: ] 35 p= p< ヘムライブラ投与前 (24 例 ) ヘムライブラ定期投与時 (24 例 ) 0 ヘムライブラ投与前 (24 例 ) ヘムライブラ定期投与時 (24 例 ) 出典 : 承認時評価資料国際共同第 III 相臨床試験 (BH29884 試験 ) 41
43 HAVEN 1 試験 : 安全性成績ヘムライブラを投与した全患者 合計症例数 (N=103) 有害事象 (AE) の総数 件以上の AE を発現した患者数 (%) 73 (70.9) 重篤な AE* 9 ( 8.7) 血栓性微小血管症 (TMA)** 3 ( 2.9) 血栓性事象 2 ( 1.9) 死亡 ** 1 (<1) 治療中止に至った AE 2 ( 1.9) Grade 3 以上の AE 8 ( 7.8) 治験薬に関連した AE 23 (22.3) 局所注射部位反応 15 (14.6) **3 件目の TMA は主要解析のデータカットオフ後に発生 この患者は致死的な直腸出血も発現した 血栓性事象は 皮膚壊死 / 表在性血栓性静脈炎が 1 例, 海綿静脈洞血栓症が 1 例 抗薬物抗体陽性例なし * その他の重篤な AE( 各 1 例 ) は 鉄欠乏性貧血 敗血症 出血性関節症 筋肉内出血 出血性胃潰瘍 頭痛 血尿 他に 2 例が AE と無関係に試験を中止 (1 例は患者の意思 もう 1 例は医師の判断による ) 出典 :Johannes Oldenburg et al. ISTH
44 HAVEN 2 試験 : 試験デザイン 本試験の登録目標は 例で主要有効性観察期間は 52 週間本中間集計では 20 例の結果について検討 中間集計 主要有効性観察期間 52 週間 12 歳未満 1 の インヒビター保有 血友病 A 患者 2 スクリーニング (n=20-60) ヘムライブラ定期投与 (n=20) 3 ヘムライブラ定期投与 ( または 24 週間の観察期間 ) 1: 年齢カテゴリーごとに段階的な登録を行ったため 2 歳未満の患者は中間集計のデータには含まれていない 2: 体重が 40kg 未満の 12~17 歳の患者も登録可とした 3: 中間集計時点での登録例出血時にはヘムライブラ投与の有無にかかわらず バイパス止血製剤を投与した 出典 : 承認時評価資料国際共同第 III 相臨床試験 (BH29992 試験 ) 43
45 HAVEN 2 試験 : バイパス止血製剤の出血予防との患者内比較 Prior episodic BPAs Prior prophylactic BPAs HAVEN 2 Calculated ABR (treated bleeds) Patient 治療を要した出血 :2 (13 例中 2 例で各 1 回 ) 観察期間の範囲 日 治療を要した年間出血回数は 99% 減少した Data sorted by emicizumab ABR in descending order and then by descending efficacy period duration. Intraindividual comparison performed for 13 NIS patients on HAVEN 2 study for 12 weeks. Young et al. ASH
46 HAVEN 2 試験 : 安全性成績 有害事象数 (%) ヘムライブラ 1.5 mg/kg/ 週 (N=20) 有害事象 (AE) の総数 43 1 件以上の AE を発現した患者数 (%) 14 (70.0) 重篤な AE 3 (15.0) Grade 3 以上の AE 3 (15.0) 治験薬に関連した AE 3 (15.0) 局所注射部位反応 3 (15.0) 重篤な AE: 口腔内出血, 虫垂炎, カテーテル留置部位感染 治験薬に関連した AE はいずれも軽度の注射部位反応 (3 例 ;9 件 ) 血栓塞栓症, 血栓性微小血管症は認められていない 抗薬物抗体陽性例なし 出典 :Guy Young et al. ISTH
47 インヒビター非保有の血友病 A に対するヘムライブラ第 3 相試験の実施状況 対象投与間隔開始症例数 HAVEN 3 12 歳以上, インヒビター非保有 週 1 回 2 週 1 回 2016 年 9 月 152 人 HAVEN 4 12 歳以上, インヒビター保有 / インヒビター非保有 4 週 1 回 2017 年 1 月 48 人 HOHOEMI 12 歳未満インヒビター非保有 (PUPs を含む ) 2 週 1 回 4 週 1 回 2017 年 10 月 13 人 PUPs: previously untreated patients 未治療患者 出典 :NCT , NCT , JapicCTI
48 早期にヘムライブラを定期投与するコンセプト 診断 FVIII 突発的出血 FVIII ヘムライブラの定期投与 高いトラフ濃度を維持 出血ゼロ 活動量の増加 関節障害なし 無症候性出血の予防 頭蓋内出血の予防 第 VIII 因子インヒビターを誘導しない 免疫寛容療法の不要化 47
49 血友病治療 A 治療のパラダイムシフト 関節内出血ゼロ 関節障害なし 高い活動性 48
50 謝辞 奈良県立医科大学小児科 野上恵嗣武山雅弘志田泰明荻原健一矢田弘史古川晶子南博明矢追博章越智聡史松本智子笹井香那竹中亜里沙河村武 奈良県立医科大学臨床研究センター 笠原正登 中外製薬 服部有宏斎藤浩之北沢剛久武藤厚添田哲弘 ご清聴ありがとうございました 49
51 お問い合わせ先 : 広報 IR 部 報道関係者の皆様 : メディアリレーションズグループ Tel : pr@chugai-pharm.co.jp 担当 : 清水 荒木 三義 山田 投資家の皆様 : インベスターリレーションズグループ Tel : ir@chugai-pharm.co.jp 担当 : 笹井 櫻井 島村 吉村
試験デザイン :n=152 試験開始前に第 VIII 因子製剤による出血時止血療法を受けていた患者群を 以下のい ずれかの群に 2:2:1 でランダム化 A 群 (n=36) (n=35) C 群 (n=18) ヘムライブラ 3 mg/kg を週 1 回 4 週間定期投与し その後 1.5 mg/k
 各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
世界血友病連盟 (WFH) 発行 World Federation of Hemophilia 2009 年 世界血友病連盟 (WFH) は 非営利の血友病 / 出血性疾患団体による教育目的の WFH 出版物の再配布を推奨しています 本出版物の再印刷 再配布 翻訳の許可を取得するには 下記の広報部の
 インヒビター とは 世界血友病連盟 (WFH) 発行 World Federation of Hemophilia 2009 年 世界血友病連盟 (WFH) は 非営利の血友病 / 出血性疾患団体による教育目的の WFH 出版物の再配布を推奨しています 本出版物の再印刷 再配布 翻訳の許可を取得するには 下記の広報部の住所までご連絡ください 本出版物の PDF ファイルは WFH のホームページ www.wfh.org.
インヒビター とは 世界血友病連盟 (WFH) 発行 World Federation of Hemophilia 2009 年 世界血友病連盟 (WFH) は 非営利の血友病 / 出血性疾患団体による教育目的の WFH 出版物の再配布を推奨しています 本出版物の再印刷 再配布 翻訳の許可を取得するには 下記の広報部の住所までご連絡ください 本出版物の PDF ファイルは WFH のホームページ www.wfh.org.
販売名 製造販売業者 レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 (RMP) の概要 レフィキシア静注用 500/1000/2000 ノボノルディスクファーマ株式会社提出年月 ( 別紙様式 ) 有効成分ノナコグベータペゴル ( 遺伝子組換え ) 薬効分類 6343
 レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はノボノルディスクファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ノボノルディスクファーマ株式会社 販売名 製造販売業者 レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 (RMP) の概要 レフィキシア静注用
レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はノボノルディスクファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ノボノルディスクファーマ株式会社 販売名 製造販売業者 レフィキシア静注用 500/1000/2000 に係る医薬品リスク管理計画書 (RMP) の概要 レフィキシア静注用
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
緒言
 CERA 2.2 緒言 Page 1 ミルセラ注シリンジ25 μg ミルセラ注シリンジ50 μg ミルセラ注シリンジ75 μg ミルセラ注シリンジ100 μg ミルセラ注シリンジ150 μg ミルセラ注シリンジ200 μg ミルセラ注シリンジ250 μg [ 腎性貧血 ] 第 2 部 CTD の概要 ( サマリー ) 2.2 緒言 中外製薬株式会社 CERA 2.2 緒言 Page 2 目次頁 2.2
CERA 2.2 緒言 Page 1 ミルセラ注シリンジ25 μg ミルセラ注シリンジ50 μg ミルセラ注シリンジ75 μg ミルセラ注シリンジ100 μg ミルセラ注シリンジ150 μg ミルセラ注シリンジ200 μg ミルセラ注シリンジ250 μg [ 腎性貧血 ] 第 2 部 CTD の概要 ( サマリー ) 2.2 緒言 中外製薬株式会社 CERA 2.2 緒言 Page 2 目次頁 2.2
リクスビス使用上の注意解説_ pdf
 2017 年 1 月作成 ( 第 3 版 ) 医薬品の適正使用に欠かせない情報です 使用前に必ずお読みください 新医薬品の の解説 生物由来製品 ) 処方箋医薬品注 遺伝子組換え血液凝固第 Ⅸ 因子製剤 ノナコグガンマ ( 遺伝子組換え ) 製造販売元 ( 輸入元 ) バクスアルタ株式会社東京都港区虎ノ門一丁目 23 番 1 号 注 ) 注意 医師等の処方箋により使用すること はじめに リクスビス静注用
2017 年 1 月作成 ( 第 3 版 ) 医薬品の適正使用に欠かせない情報です 使用前に必ずお読みください 新医薬品の の解説 生物由来製品 ) 処方箋医薬品注 遺伝子組換え血液凝固第 Ⅸ 因子製剤 ノナコグガンマ ( 遺伝子組換え ) 製造販売元 ( 輸入元 ) バクスアルタ株式会社東京都港区虎ノ門一丁目 23 番 1 号 注 ) 注意 医師等の処方箋により使用すること はじめに リクスビス静注用
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
DRAFT#9 2011
 報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14 回 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 29 年 10 月 1.1. 安全性検討事項 重要な特
 レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
シダキュアスギ舌下錠 2,000JAU 5,000JAU に係る医薬品リスク管理計画書 (RMP) の概要 販売名 シダキュアスギ舌下錠 2,000JAU,5,000JAU 有効成分 スギ花粉エキス原末 承認取得者名 鳥居薬品株式会社 薬効分類 提出年月 平成 30 年 8 月 1.1.
 シダキュアスギ舌下錠 2,000JAU シダキュアスギ舌下錠 5,000JAU に係る医薬品リスク管理計画書 本資料に記載された情報に関する権利及び内容についての責任は 鳥居薬品株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 鳥居薬品株式会社 1 シダキュアスギ舌下錠 2,000JAU 5,000JAU に係る医薬品リスク管理計画書 (RMP) の概要 販売名 シダキュアスギ舌下錠
シダキュアスギ舌下錠 2,000JAU シダキュアスギ舌下錠 5,000JAU に係る医薬品リスク管理計画書 本資料に記載された情報に関する権利及び内容についての責任は 鳥居薬品株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 鳥居薬品株式会社 1 シダキュアスギ舌下錠 2,000JAU 5,000JAU に係る医薬品リスク管理計画書 (RMP) の概要 販売名 シダキュアスギ舌下錠
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
ケブザラ皮下注 150mg/200mg シリンジ ケブザラ皮下注 150mg/200mg オートインジェクターに係る医薬品リスク管理計画書 (RMP) の概要 販売名 製造販売業者 1 ケブザラ皮下注 150mg シリンジ 2 ケブザラ皮下注 200mg シリンジ 3 ケブザラ皮下注 150mg オ
 ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジケブザラ皮下注 150mgオートインジェクターケブザラ皮下注 200mgオートインジェクターに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジ
ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジケブザラ皮下注 150mgオートインジェクターケブザラ皮下注 200mgオートインジェクターに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジ
要望番号 ;Ⅱ 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望 者 ( 該当するものにチェックする ) 優先順位 学会 ( 学会名 ; 日本ペインクリニック学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 2 位 ( 全 4 要望中 )
 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望 者 ( 該当するものにチェックする ) 優先順位 学会 ( 学会名 ; 日本ペインクリニック学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 2 位 ( 全 4 要望中 ) 成分名 ( 一般名 ) 塩酸リドカイン 販売名 0.5%/1%/2% キシロカイン 要望する医薬品要望内容 会社名 国内関連学会
未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望 者 ( 該当するものにチェックする ) 優先順位 学会 ( 学会名 ; 日本ペインクリニック学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 2 位 ( 全 4 要望中 ) 成分名 ( 一般名 ) 塩酸リドカイン 販売名 0.5%/1%/2% キシロカイン 要望する医薬品要望内容 会社名 国内関連学会
ケブザラ皮下注 150mg/200mg シリンジに係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 ケブザラ皮下注 150mg シリンジ 2 ケブザラ皮下注 200mg シリンジ 有効成分 サリルマブ ( 遺伝子組換え ) 製造販売業者 サノフィ株式会社 薬効分類 399 提出年月 平成
 ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジに係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 ケブザラ皮下注 150mg シリンジ
ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジに係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 ケブザラ皮下注 150mg シリンジ
審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]
![審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ] 審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]](/thumbs/91/105024304.jpg) 審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
ヒアルロン酸ナトリウム架橋体製剤 特定使用成績調査
 ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
(Microsoft PowerPoint - .pptx)
 症例 2 82 歳 女性主訴 : 膝関節疼痛現病歴 : 2008 年 4 月当院にて関節リウマチと診断される (4/11 PT,APTT,Fib 正常 ) 2008 年 12 月頃鼻出血が生じるようになった 2009 年 12 月 15 日左膝の疼痛で近医受診 両膝関節穿刺で血腫確認 2009 年 12 月 16 日血腫拡大と疼痛で歩行困難となり 近医入院 疼痛は軽快したが鼻出血 耳出血 四肢の紫斑を繰り返した
症例 2 82 歳 女性主訴 : 膝関節疼痛現病歴 : 2008 年 4 月当院にて関節リウマチと診断される (4/11 PT,APTT,Fib 正常 ) 2008 年 12 月頃鼻出血が生じるようになった 2009 年 12 月 15 日左膝の疼痛で近医受診 両膝関節穿刺で血腫確認 2009 年 12 月 16 日血腫拡大と疼痛で歩行困難となり 近医入院 疼痛は軽快したが鼻出血 耳出血 四肢の紫斑を繰り返した
販売名 製造販売業者 ジャクスタピッドカプセル 5mg 10mg 20mg に係る医薬品リスク管理計画書 (RMP) の概要 ジャクスタピッドカプセル 5mg 10mg 20mg AEGERION PHARMACEUTICALS 株式会社提出年月 有効成分 ロミタピドメシル酸塩 薬効分類 87218
 ジャクスタピッドカプセル 5mg ジャクスタピッドカプセル 10mg ジャクスタピッドカプセル 20mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は AEGERION PHARMACEUTICALS 株式 会社にあります 当該情報を適正使用以外の営利目的に利用することはできません AEGERION PHARMACEUTICALS 株式会社 販売名 製造販売業者
ジャクスタピッドカプセル 5mg ジャクスタピッドカプセル 10mg ジャクスタピッドカプセル 20mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は AEGERION PHARMACEUTICALS 株式 会社にあります 当該情報を適正使用以外の営利目的に利用することはできません AEGERION PHARMACEUTICALS 株式会社 販売名 製造販売業者
医療
 医療 1 障害者自立支援医療費 ( 更生医療 ) の支給 対象者 18 歳以上の身体障害者手帳が交付されている人 内 容 障害の状態の軽減を図り 自立した日常生活上または社会生活を営むために必要な医療 ( 角膜手術 関節形成手術 外耳形成手術 心臓手術 血液透析療法 腎移植術 肝臓移植など ) を 指定医療機関 ( 都道府県等で指定 ) で受ける際の医療費について負担が軽減されます 利用者負担は 原則としてかかる費用の1
医療 1 障害者自立支援医療費 ( 更生医療 ) の支給 対象者 18 歳以上の身体障害者手帳が交付されている人 内 容 障害の状態の軽減を図り 自立した日常生活上または社会生活を営むために必要な医療 ( 角膜手術 関節形成手術 外耳形成手術 心臓手術 血液透析療法 腎移植術 肝臓移植など ) を 指定医療機関 ( 都道府県等で指定 ) で受ける際の医療費について負担が軽減されます 利用者負担は 原則としてかかる費用の1
 今後の改訂予定について 編集の独立性について 利益相反と普遍性の確保について ガイドライン作成委員会 委員会 中間報告会など開催記録 評価委員会総括 評価委員会 開催記録 外部評価委員会 利益相反情報について 利益相反情報についての開示 1) 腎性貧血とは, 腎臓においてヘモグロビンの低下に見合った十分量のエリスロポエチン (EPO) が産 生されないことによってひき起こされる貧血であり,
今後の改訂予定について 編集の独立性について 利益相反と普遍性の確保について ガイドライン作成委員会 委員会 中間報告会など開催記録 評価委員会総括 評価委員会 開催記録 外部評価委員会 利益相反情報について 利益相反情報についての開示 1) 腎性貧血とは, 腎臓においてヘモグロビンの低下に見合った十分量のエリスロポエチン (EPO) が産 生されないことによってひき起こされる貧血であり,
DRAFT#9 2011
 報道関係各位 2019 年 3 月 25 日 ユーシービージャパン株式会社 第一三共株式会社 抗てんかん剤 ビムパット 点滴静注 200mg 新発売のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン ユーシービーグループを総称して以下 ユーシービー ) と第一三共株式会社 ( 本社 : 東京都中央区 代表取締役社長 : 眞鍋淳
報道関係各位 2019 年 3 月 25 日 ユーシービージャパン株式会社 第一三共株式会社 抗てんかん剤 ビムパット 点滴静注 200mg 新発売のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン ユーシービーグループを総称して以下 ユーシービー ) と第一三共株式会社 ( 本社 : 東京都中央区 代表取締役社長 : 眞鍋淳
(別添様式)
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など ) 医薬品候補物質のスクリーニン
 特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
FACTSHEET
 厚生労働科学研究事業 血友病の治療とその合併症の克服に関する研究 分担研究 血友病ファクトシート 編著 薬害 HIV 感染被害者 家族等の現状からみた 血友病に係る今後の課題及び課題克服への支援研究 ( 分担研究者 ) 柿沼章子血友病ファクトシート製作チーム 目次 1. 血友病とは 2. 血友病の疫学 3. 血友病の症状 4. 血友病の治療 5. 留意点 ( 副作用 インヒビター ) 6. 血友病における遺伝
厚生労働科学研究事業 血友病の治療とその合併症の克服に関する研究 分担研究 血友病ファクトシート 編著 薬害 HIV 感染被害者 家族等の現状からみた 血友病に係る今後の課題及び課題克服への支援研究 ( 分担研究者 ) 柿沼章子血友病ファクトシート製作チーム 目次 1. 血友病とは 2. 血友病の疫学 3. 血友病の症状 4. 血友病の治療 5. 留意点 ( 副作用 インヒビター ) 6. 血友病における遺伝
1. 今回の変更に関する整理 効能 効果及び用法 用量 ( 添付文書より転載 ) 従来製剤 ( バイアル製剤 ) と製法変更製剤 ( シリンジ製剤 ) で変更はない 効能 効果 用法 容量 B 型肝炎の予防通常 0.5mL ずつ4 週間隔で2 回 更に 20~24 週を経過した後に1 回 0.5mL
 資料 6 MSD 社の製造する B 型肝炎単抗原ワクチンについて 経緯 1986 年米国メルク社製 B 型肝炎ワクチン ( 酵母由来 ) が米国で承認 1988 年 MSD 社製 B 型肝炎ワクチン ( 酵母由来 ) が日本で承認 2000 年欧州で HEXAVAC( ジフテリア 破傷風 百日咳 B 型肝炎 不活化ポリオ Hib 感染症を予防する 6 種混合ワクチン ) 承認 2001 年欧州で HEXAVAC
資料 6 MSD 社の製造する B 型肝炎単抗原ワクチンについて 経緯 1986 年米国メルク社製 B 型肝炎ワクチン ( 酵母由来 ) が米国で承認 1988 年 MSD 社製 B 型肝炎ワクチン ( 酵母由来 ) が日本で承認 2000 年欧州で HEXAVAC( ジフテリア 破傷風 百日咳 B 型肝炎 不活化ポリオ Hib 感染症を予防する 6 種混合ワクチン ) 承認 2001 年欧州で HEXAVAC
ハイゼントラ20%皮下注1g/5mL・2g/10mL・4g/20mL
 CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
未承認の医薬品又は適応の承認要望に関する意見募集について
 ( 別添様式 1-1) 未承認薬の要望 要望者 日本てんかん学会 優先順位 2 位 ( 全 12 要望中 ) 医薬品名 成分名 ルフィナマイド 販売名 Inovelon( 欧州 ) Banzel( 米国 ) 会社名 エーザイ 承認国 欧州 29 カ国 ( 英国 独国 仏国を含む ) 米国 効能 効果 レノックス ガストー症候群 (4 歳以上 ) に伴う発作に対する併用 療法 用法 用量 欧州 小児患者
( 別添様式 1-1) 未承認薬の要望 要望者 日本てんかん学会 優先順位 2 位 ( 全 12 要望中 ) 医薬品名 成分名 ルフィナマイド 販売名 Inovelon( 欧州 ) Banzel( 米国 ) 会社名 エーザイ 承認国 欧州 29 カ国 ( 英国 独国 仏国を含む ) 米国 効能 効果 レノックス ガストー症候群 (4 歳以上 ) に伴う発作に対する併用 療法 用法 用量 欧州 小児患者
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能
 医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
<4D F736F F D DC58F4994C5817A54524D5F8AB38ED28CFC88E396F B CF8945C8CF889CA92C789C1816A5F3294C52E646
 患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
10038 W36-1 ワークショップ 36 関節リウマチの病因 病態 2 4 月 27 日 ( 金 ) 15:10-16:10 1 第 5 会場ホール棟 5 階 ホール B5(2) P2-203 ポスタービューイング 2 多発性筋炎 皮膚筋炎 2 4 月 27 日 ( 金 ) 12:4
 10001 P1-089 ポスタービューイング 1 関節リウマチの治療 :DMARDs NSAIDs 4 月 26 日 ( 木 ) 13:20-14:40 - ポスター 展示会場ホール E B2 階 ホール E 10002 P2-041 ポスタービューイング 2 関節リウマチの治療評価と予測 2 4 月 27 日 ( 金 ) 12:40-14:00 - ポスター 展示会場ホール E B2 階 ホール
10001 P1-089 ポスタービューイング 1 関節リウマチの治療 :DMARDs NSAIDs 4 月 26 日 ( 木 ) 13:20-14:40 - ポスター 展示会場ホール E B2 階 ホール E 10002 P2-041 ポスタービューイング 2 関節リウマチの治療評価と予測 2 4 月 27 日 ( 金 ) 12:40-14:00 - ポスター 展示会場ホール E B2 階 ホール
Interview Zero bleedingeding -- ここ 10 年を振り返っても 血友病の治療は大きく進歩していますね 最も大きな進歩は 遺伝子組換え凝固因子製剤が普及したことでしょう これにより 安全性や安定供給に関する心配が大きく減りました そして昨年には 従来の製剤に比べて長時間作
 Science Matters because Patients Matter - サイエンスは患者さんのためにある - No.2 2017 FOCUS 血友病治療の明日 Interview Report Interview Zero bleedingeding -- ここ 10 年を振り返っても 血友病の治療は大きく進歩していますね 最も大きな進歩は 遺伝子組換え凝固因子製剤が普及したことでしょう
Science Matters because Patients Matter - サイエンスは患者さんのためにある - No.2 2017 FOCUS 血友病治療の明日 Interview Report Interview Zero bleedingeding -- ここ 10 年を振り返っても 血友病の治療は大きく進歩していますね 最も大きな進歩は 遺伝子組換え凝固因子製剤が普及したことでしょう
 一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
Microsoft Word - ①【修正】B型肝炎 ワクチンにおける副反応の報告基準について
 資料 1 B 型肝炎ワクチンの副反応報告基準について 予防接種法における副反応報告制度について 制度の趣旨副反応報告制度は 予防接種後に生じる種々の身体的反応や副反応が疑われる症状等について情報を収集し ワクチンの安全性について管理 検討を行うことで 広く国民に情報を提供すること及び今後の予防接種行政の推進に資することを目的としている 報告の義務 予防接種法第 12 条 1 項 ( 参考資料 1)
資料 1 B 型肝炎ワクチンの副反応報告基準について 予防接種法における副反応報告制度について 制度の趣旨副反応報告制度は 予防接種後に生じる種々の身体的反応や副反応が疑われる症状等について情報を収集し ワクチンの安全性について管理 検討を行うことで 広く国民に情報を提供すること及び今後の予防接種行政の推進に資することを目的としている 報告の義務 予防接種法第 12 条 1 項 ( 参考資料 1)
要望番号 ;Ⅱ-286 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
血液学的検査 >> 2B. 凝固 線溶関連検査 >> 2B380. 検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 B 3.2% クエン酸ナトリウム ( 黒 ) 血液 2 ml 血漿 検体ラベル ( 単項目オーダー時
 6233 2. 血液学的検査 >> 2B. 凝固 線溶関連検査 >> 2B380. coagulation factor 7 連絡先 : 3764 基本情報 2B380 分析物 JLAC10 診療報酬 識別材料 022 血漿 測定法 311 凝固時間測定 結果識別 第 2 章 特掲診療料 D006 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 血液学的検査 ) 29 凝固因子
6233 2. 血液学的検査 >> 2B. 凝固 線溶関連検査 >> 2B380. coagulation factor 7 連絡先 : 3764 基本情報 2B380 分析物 JLAC10 診療報酬 識別材料 022 血漿 測定法 311 凝固時間測定 結果識別 第 2 章 特掲診療料 D006 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 血液学的検査 ) 29 凝固因子
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
用法 用量 発作性夜間ヘモグロビン尿症における溶血抑制 mg mg mg mg kg 30kg 40kg 20kg 30kg 10kg 20kg 5kg 10kg 1900mg mg mg mg
 C EculizumabGenetical Recombination AMX 警告 1 2 禁忌 ( 次の患者には投与しないこと ) 1 2 組成 性状 ml mg mg mg mg mg ph ph mgml 効能 効果 発作性夜間ヘモグロビン尿症における溶血抑制 < 効能 効果に関連する使用上の注意 > 共通 1C5 C5b-9 b 発作性夜間ヘモグロビン尿症における溶血抑制 1 2 3 4
C EculizumabGenetical Recombination AMX 警告 1 2 禁忌 ( 次の患者には投与しないこと ) 1 2 組成 性状 ml mg mg mg mg mg ph ph mgml 効能 効果 発作性夜間ヘモグロビン尿症における溶血抑制 < 効能 効果に関連する使用上の注意 > 共通 1C5 C5b-9 b 発作性夜間ヘモグロビン尿症における溶血抑制 1 2 3 4
審議結果報告書 平成 29 年 3 月 10 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] ケイセントラ静注用 500 同静注用 1000 [ 一 般 名 ] 乾燥濃縮人プロトロンビン複合体 [ 申請者名 ] CSLベーリング株式会社 [ 申請年月日 ] 平成 28 年 8 月 25 日
![審議結果報告書 平成 29 年 3 月 10 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] ケイセントラ静注用 500 同静注用 1000 [ 一 般 名 ] 乾燥濃縮人プロトロンビン複合体 [ 申請者名 ] CSLベーリング株式会社 [ 申請年月日 ] 平成 28 年 8 月 25 日 審議結果報告書 平成 29 年 3 月 10 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] ケイセントラ静注用 500 同静注用 1000 [ 一 般 名 ] 乾燥濃縮人プロトロンビン複合体 [ 申請者名 ] CSLベーリング株式会社 [ 申請年月日 ] 平成 28 年 8 月 25 日](/thumbs/97/131569560.jpg) 審議結果報告書 平成 29 年 3 月 10 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] ケイセントラ静注用 500 同静注用 1000 [ 一 般 名 ] 乾燥濃縮人プロトロンビン複合体 [ 申請者名 ] CSLベーリング株式会社 [ 申請年月日 ] 平成 28 年 8 月 25 日 [ 審議結果 ] 平成 29 年 3 月 3 日に開催された医薬品第二部会において 本品目を承認して差し支えないとされ
審議結果報告書 平成 29 年 3 月 10 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] ケイセントラ静注用 500 同静注用 1000 [ 一 般 名 ] 乾燥濃縮人プロトロンビン複合体 [ 申請者名 ] CSLベーリング株式会社 [ 申請年月日 ] 平成 28 年 8 月 25 日 [ 審議結果 ] 平成 29 年 3 月 3 日に開催された医薬品第二部会において 本品目を承認して差し支えないとされ
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
恩賜第 42 回社会福祉法人財団済生会中央治験審査委員会 会議の記録の概要 開催日時 平成 28 年 1 月 13 日 ( 水 )15:30~17:17 開催場所 出席委員名 東京都港区三田 三田国際ビル 21 階 社会福祉法人 恩賜財団済生会本部事務局中会議室 豊島
 恩賜第 42 回社会福祉法人財団済生会中央治験審査委員会 会議の記録の概要 開催日時 平成 28 年 1 月 13 日 ( 水 )15:30~17:17 開催場所 出席委員名 108-0073 東京都港区三田 1-4-28 三田国際ビル 21 階 社会福祉法人 恩賜財団済生会本部事務局中会議室 豊島聰 ( 出席 ) 委員長林茂樹 ( 出席 ) 副委員長 市場みすゞ ( 出席 ) 漆原尚巳 ( 出席
恩賜第 42 回社会福祉法人財団済生会中央治験審査委員会 会議の記録の概要 開催日時 平成 28 年 1 月 13 日 ( 水 )15:30~17:17 開催場所 出席委員名 108-0073 東京都港区三田 1-4-28 三田国際ビル 21 階 社会福祉法人 恩賜財団済生会本部事務局中会議室 豊島聰 ( 出席 ) 委員長林茂樹 ( 出席 ) 副委員長 市場みすゞ ( 出席 ) 漆原尚巳 ( 出席
要望番号 ;Ⅱ-183 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者学会 ( 該当する ( 学会名 ; 日本感染症学会 ) ものにチェックする ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 8 要望中 ) 要望する医薬品
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者学会 ( 該当する ( 学会名 ; 日本感染症学会 ) ものにチェックする ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 8 要望中 ) 要望する医薬品 要望内容 成分名 ( 一般名 ) 販売名 会社名 国内関連学会 未承認薬 適応 外薬の分類 ( 該当するものにチェックする )
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者学会 ( 該当する ( 学会名 ; 日本感染症学会 ) ものにチェックする ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 8 要望中 ) 要望する医薬品 要望内容 成分名 ( 一般名 ) 販売名 会社名 国内関連学会 未承認薬 適応 外薬の分類 ( 該当するものにチェックする )
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん
 米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
<4D F736F F D DC58F4994C5817A53544C2094E789BA928D5F8AB38ED28CFC834B F94CC94848CB392C78B4C C5292E646F63>
 ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
1. Caov-3 細胞株 A2780 細胞株においてシスプラチン単剤 シスプラチンとトポテカン併用添加での殺細胞効果を MTS assay を用い検討した 2. Caov-3 細胞株においてシスプラチンによって誘導される Akt の活性化に対し トポテカンが影響するか否かを調べるために シスプラチ
 ( 様式甲 5) 学位論文内容の要旨 論文提出者氏名 論文審査担当者 主査 朝日通雄 恒遠啓示 副査副査 瀧内比呂也谷川允彦 副査 勝岡洋治 主論文題名 Topotecan as a molecular targeting agent which blocks the Akt and VEGF cascade in platinum-resistant ovarian cancers ( 白金製剤耐性卵巣癌における
( 様式甲 5) 学位論文内容の要旨 論文提出者氏名 論文審査担当者 主査 朝日通雄 恒遠啓示 副査副査 瀧内比呂也谷川允彦 副査 勝岡洋治 主論文題名 Topotecan as a molecular targeting agent which blocks the Akt and VEGF cascade in platinum-resistant ovarian cancers ( 白金製剤耐性卵巣癌における
Microsoft Word - LIA RMP_概要ver2.docx
 リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
後天性血友病アンケート(Homepage用)
 北海道医療大学歯学部倫理審査承認番号第 149 号 研究課題 北海道における後天性血友病診療の実態把握に関する研究 ------------------------------------------------------------------------------------------------------ 本研究に関与する医師および患者様へ 後天性血友病は 各種凝固因子に対する自己抗体により重篤な出血症状を呈する難治性疾患です
北海道医療大学歯学部倫理審査承認番号第 149 号 研究課題 北海道における後天性血友病診療の実態把握に関する研究 ------------------------------------------------------------------------------------------------------ 本研究に関与する医師および患者様へ 後天性血友病は 各種凝固因子に対する自己抗体により重篤な出血症状を呈する難治性疾患です
2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び
![2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び 2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び](/thumbs/91/105459093.jpg) - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
301128_課_薬生薬審発1128第1号_ニボルマブ(遺伝子組換え)製剤の最適使用推進ガイドラインの一部改正について
 薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
<4D F736F F D2089BB8A7797C C B B835888E790AC8C7689E6>
 2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
BA_kanen_QA_zenpan_kani_univers.indd
 その他 B 型肝炎 15% C 型肝炎 68% 41 706 168 66 19 12 肝 には の か 脂肪肝 の で る () という も りま の く い 肝 の肝細胞のなかに 脂肪の く がこ なにたまっ いま 類洞 正常な肝臓 腸管からの栄養や不要物が流れていく 肝細胞 正常な肝臓 脂肪肝の始まり 類洞 腸管からの栄養や不要物が流れていく 類洞 過剰な脂質 糖質の流入 肝細胞 肝細胞のなかに中性脂肪がたまり始める
その他 B 型肝炎 15% C 型肝炎 68% 41 706 168 66 19 12 肝 には の か 脂肪肝 の で る () という も りま の く い 肝 の肝細胞のなかに 脂肪の く がこ なにたまっ いま 類洞 正常な肝臓 腸管からの栄養や不要物が流れていく 肝細胞 正常な肝臓 脂肪肝の始まり 類洞 腸管からの栄養や不要物が流れていく 類洞 過剰な脂質 糖質の流入 肝細胞 肝細胞のなかに中性脂肪がたまり始める
審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7
![審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7 審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7](/thumbs/92/110490968.jpg) 審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
検査項目情報 von Willebrand 因子 ( フォン ウィルレブランド因子 ) Department of Clinical Laboratory, Kyoto University Hospital 一次サンプル採取マニュアル 血液学的検査 >> 2B. 凝固 線溶関連検査
 6535 2. 血液学的検査 >> 2B. 凝固 線溶関連検査 >> 2B480. Ver.5 von Willebrand factor 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 2B480 特掲診療料 >> 検査 >> 検体検査料 >> 検体検査実施料 >> ( 血液学的検査 ) 分析物 D006 16
6535 2. 血液学的検査 >> 2B. 凝固 線溶関連検査 >> 2B480. Ver.5 von Willebrand factor 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 2B480 特掲診療料 >> 検査 >> 検体検査料 >> 検体検査実施料 >> ( 血液学的検査 ) 分析物 D006 16
TTP 治療ガイド ( 第二版 ) 作成厚生労働科学研究費補助金難治性疾患政策研究事業 血液凝固異常症等に関する研究班 ( 主任研究者村田満 ) 血栓性血小板減少性紫斑病 (thrombotic thrombocytopenic purpura:ttp) は 緊急に治療を必要とする致死的疾患である
 TTP 治療ガイド ( 第二版 ) 作成厚生労働科学研究費補助金難治性疾患政策研究事業 血液凝固異常症等に関する研究班 ( 主任研究者村田満 ) 血栓性血小板減少性紫斑病 (thrombotic thrombocytopenic purpura:ttp) は 緊急に治療を必要とする致死的疾患である 原因不明の血小板減少と溶血性貧血を認めた場合に本疾患を疑うことが重要である 指定難病の診断基準では ADAMTS13
TTP 治療ガイド ( 第二版 ) 作成厚生労働科学研究費補助金難治性疾患政策研究事業 血液凝固異常症等に関する研究班 ( 主任研究者村田満 ) 血栓性血小板減少性紫斑病 (thrombotic thrombocytopenic purpura:ttp) は 緊急に治療を必要とする致死的疾患である 原因不明の血小板減少と溶血性貧血を認めた場合に本疾患を疑うことが重要である 指定難病の診断基準では ADAMTS13
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
膿疱性乾癬の効能追加 ( 承認事項の 部変更承認 ) に伴う改訂 改訂内容 ( 該当部のみ抜粋 ) 警告 1.~3. 4. 関節リウマチ患者では, 本剤の治療を行う前に, 少なくとも 1 剤の抗リウマチ薬等の使用を十分勘案すること. また, 本剤についての十分な知識とリウマチ治療の経験をもつ医師が使
 - 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
- 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
PowerPoint プレゼンテーション
 一次止血異常による出血性疾患 - von Willebrand 病と先天性血小板機能異常症 - 赤血球血小板白血球 第 19 回 血液学を学ぼう! 2015.9.14 Wikipedia から 本日の目次 出血を止める方法 血小板とは 血小板の働き 出血する3つの先天性疾患 メインはvon Willebrand 病 転んで出血すると 1 血小板の粘着 凝集 ( 一次止血 ) 血小板 血管内皮細胞 障害血管壁
一次止血異常による出血性疾患 - von Willebrand 病と先天性血小板機能異常症 - 赤血球血小板白血球 第 19 回 血液学を学ぼう! 2015.9.14 Wikipedia から 本日の目次 出血を止める方法 血小板とは 血小板の働き 出血する3つの先天性疾患 メインはvon Willebrand 病 転んで出血すると 1 血小板の粘着 凝集 ( 一次止血 ) 血小板 血管内皮細胞 障害血管壁
中医協総 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適
 中医協総 - 3 3 1. 3. 2 7 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適用に係る今後の対応について 再生医療等製品の保険適用に関する当面の間の対応 薬事法改正後に承認 ( 条件
中医協総 - 3 3 1. 3. 2 7 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適用に係る今後の対応について 再生医療等製品の保険適用に関する当面の間の対応 薬事法改正後に承認 ( 条件
Microsoft Word - 2-① 補償ガイドライン平成27年版(本文)Ver3.1.1.do
 1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
あった AUCtはで ± ng hr/ml で ± ng hr/ml であった 2. バイオアベイラビリティの比較およびの薬物動態パラメータにおける分散分析の結果を Table 4 に示した また 得られた AUCtおよび Cmaxについてとの対数値
 モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
第1回肝炎診療ガイドライン作成委員会議事要旨(案)
 資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
改訂後改訂前 << 効能 効果に関連する使用上の注意 >> 関節リウマチ 1. 過去の治療において 少なくとも1 剤の抗リウマチ薬 ( 生物製剤を除く ) 等による適切な治療を行っても 疾患に起因する明らかな症状が残る場合に投与すること 2. 本剤とアバタセプト ( 遺伝子組換え ) の併用は行わな
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
を確認しました 本装置を用いて 血栓形成には血液中のどのような成分 ( 白血球 赤血球 血小板など ) が関与しているかを調べ 血液の凝固を引き起こす トリガー が何であるかをレオロジー ( 流れと変形に関わるサイエンス ) 的および生化学的に明らかにすることとしました 2. 研究手法と成果 1)
 報道発表資料 2001 年 10 月 30 日 独立行政法人理化学研究所 血流停滞による血栓形成のメカニズムを解明 - " エコノミークラス症候群 " 予防につながる新知見 - 理化学研究所 ( 小林俊一理事長 ) は 血液の流れが停滞することによって血栓が形成されるメカニズムを世界で初めて明らかにしました 理研超分子科学研究室 ( 和田達夫主任研究員 ) の貝原真副主任研究員 岩田宏紀研究協力員
報道発表資料 2001 年 10 月 30 日 独立行政法人理化学研究所 血流停滞による血栓形成のメカニズムを解明 - " エコノミークラス症候群 " 予防につながる新知見 - 理化学研究所 ( 小林俊一理事長 ) は 血液の流れが停滞することによって血栓が形成されるメカニズムを世界で初めて明らかにしました 理研超分子科学研究室 ( 和田達夫主任研究員 ) の貝原真副主任研究員 岩田宏紀研究協力員
第 66 回厚生連病院共同治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名 議題及び審議結果を含む主な議論の概要 2018 年 09 月 19 日 18 時 00 分 ~18 時 20 分日本文化厚生農業協同組合連合会 8 階中会議室高瀬浩造 西田博 板井勉 田中克巳 江口善美 山崎きよ
 第 66 回厚生連病院共同治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名 議題及び審議結果を含む主な議論の概要 2018 年 09 月 19 日 18 時 00 分 ~18 時 20 分日本文化厚生農業協同組合連合会 8 階中会議室高瀬浩造 西田博 板井勉 田中克巳 江口善美 山崎きよ子 松本恵美子 山田尚之議題 1. アステラス製薬株式会社の依頼によるリウマチ患者を対象としたASP015K
第 66 回厚生連病院共同治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名 議題及び審議結果を含む主な議論の概要 2018 年 09 月 19 日 18 時 00 分 ~18 時 20 分日本文化厚生農業協同組合連合会 8 階中会議室高瀬浩造 西田博 板井勉 田中克巳 江口善美 山崎きよ子 松本恵美子 山田尚之議題 1. アステラス製薬株式会社の依頼によるリウマチ患者を対象としたASP015K
血液学的検査 >> 2B. 凝固 線溶関連検査 >> 2B400. 検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 B 3.2% クエン酸ナトリウム ( 黒 ) 血液 2 ml 血漿 検体ラベル ( 単項目オーダー時
 6235 2. 血液学的検査 >> 2B. 凝固 線溶関連検査 >> 2B400. coagulation factor 9 連絡先 : 3764 基本情報 2B400 分析物 JLAC10 診療報酬 識別材料 022 血漿 測定法 311 凝固時間測定 結果識別 第 2 章 特掲診療料 D006 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 血液学的検査 ) 29 凝固因子
6235 2. 血液学的検査 >> 2B. 凝固 線溶関連検査 >> 2B400. coagulation factor 9 連絡先 : 3764 基本情報 2B400 分析物 JLAC10 診療報酬 識別材料 022 血漿 測定法 311 凝固時間測定 結果識別 第 2 章 特掲診療料 D006 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 血液学的検査 ) 29 凝固因子
抗菌薬の殺菌作用抗菌薬の殺菌作用には濃度依存性と時間依存性の 2 種類があり 抗菌薬の効果および用法 用量の設定に大きな影響を与えます 濃度依存性タイプでは 濃度を高めると濃度依存的に殺菌作用を示します 濃度依存性タイプの抗菌薬としては キノロン系薬やアミノ配糖体系薬が挙げられます 一方 時間依存性
 2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
医療法人原土井病院治験審査委員会
 社会医療法人原土井病院治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名議題及び審議結果を含む主な議論の概要 平成 29 年 2 月 21 日 ( 火曜日 )16 時 12 分から 16 時 59 分社会医療法人原土井病院第 1 会議室朔元則 上﨑典雄 毛戸彰 真名子佐喜子 境一成 関成人 廣瀬禎子 高橋富美 奥田安孝議題 1 1 施設からの審査依頼により 日本ベーリンガーインゲルハイム株式会社の依頼による中等症
社会医療法人原土井病院治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名議題及び審議結果を含む主な議論の概要 平成 29 年 2 月 21 日 ( 火曜日 )16 時 12 分から 16 時 59 分社会医療法人原土井病院第 1 会議室朔元則 上﨑典雄 毛戸彰 真名子佐喜子 境一成 関成人 廣瀬禎子 高橋富美 奥田安孝議題 1 1 施設からの審査依頼により 日本ベーリンガーインゲルハイム株式会社の依頼による中等症
の状態により適宜減量する 成人 A 法 : 他の抗悪性腫瘍剤との併用において ブスルファンとして 1 回 0.8 mg/kg を生理食塩液又は 5% ブドウ糖液に混和 調製して 2 時間かけて点滴静注する 本剤は 6 時間毎に 1 日 4 回 4 日間投与する なお 年齢 患者の状態により適宜減量す
 審査報告書 平成 30 年 8 月 2 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ブスルフェクス点滴静注用 60 mg [ 一般名 ] ブスルファン [ 申請者 ] 大塚製薬株式会社 [ 申請年月日 ] 平成 30 年 5 月 28 日 [ 剤形 含量 ] 1 バイアル (10 ml)
審査報告書 平成 30 年 8 月 2 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ブスルフェクス点滴静注用 60 mg [ 一般名 ] ブスルファン [ 申請者 ] 大塚製薬株式会社 [ 申請年月日 ] 平成 30 年 5 月 28 日 [ 剤形 含量 ] 1 バイアル (10 ml)
C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法 の有効性 安全性等について 肝炎治療戦略会議報告書平成 23 年 11 月 28 日
 C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法 の有効性 安全性等について 肝炎治療戦略会議報告書平成 23 年 11 月 28 日 C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法の 有効性 安全性等について 1. 有効性及び対象について セログループ 1 のC 型慢性肝炎に対する ペグインターフェロン リバビリン及びテラプレビル3 剤併用療法 ( 以下単に 3 剤併用療法 という
C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法 の有効性 安全性等について 肝炎治療戦略会議報告書平成 23 年 11 月 28 日 C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法の 有効性 安全性等について 1. 有効性及び対象について セログループ 1 のC 型慢性肝炎に対する ペグインターフェロン リバビリン及びテラプレビル3 剤併用療法 ( 以下単に 3 剤併用療法 という
アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全性検討事項 重要な特定されたリスク 頁 重要な潜在
 アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
平成10年度高額レセプト上位の概要
 平成 29 年度高額レセプト上位の概要 健保連では 高額な医療費の発生が個々の健康保険組合財政に及ぼす影響を全組合拠出の財源により緩和するため 健 康保険法附則第 2 条に基づき 高額医療交付金交付事業 を実施している 平成 29 年度 (29 年 1 月 16 日から30 年 1 月 15 日 ) に申請された医療費のうち 1ヵ月の医療費が1,000 万円以上の件数は 前年度より48 件増加 (
平成 29 年度高額レセプト上位の概要 健保連では 高額な医療費の発生が個々の健康保険組合財政に及ぼす影響を全組合拠出の財源により緩和するため 健 康保険法附則第 2 条に基づき 高額医療交付金交付事業 を実施している 平成 29 年度 (29 年 1 月 16 日から30 年 1 月 15 日 ) に申請された医療費のうち 1ヵ月の医療費が1,000 万円以上の件数は 前年度より48 件増加 (
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ
![審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ 審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ](/thumbs/92/110667825.jpg) 審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
医薬品リスク管理計画書(本文)
 ジェブタナ点滴静注 60mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません サノフィ株式会社 ジェブタナ点滴静注 60mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 ジェブタナ点滴静注 60mg 有効成分 カバジタキセルアセトン付加物 製造販売業者 サノフィ株式会社
ジェブタナ点滴静注 60mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません サノフィ株式会社 ジェブタナ点滴静注 60mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 ジェブタナ点滴静注 60mg 有効成分 カバジタキセルアセトン付加物 製造販売業者 サノフィ株式会社
Microsoft Word _2180AMY10104_K104_1.doc
 アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
< F2D CF6926D905C90BF82C98C5782E992CA926D88C4>
 保医発 1031 第 1 号平成 24 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において 別添 1の7
保医発 1031 第 1 号平成 24 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において 別添 1の7
環境変化への業界側取組 ~CU制度に係るパイロット試験での経験から~
 環境変化への業界側取組 ~CU 制度に係るパイロット試験での経験から ~ 中外製薬株式会社オンコロジーライフサイクルマネジメント部水井啓広 2015.6.20 本日の内容 ベムラフェニブについて CU制度に係るパイロット試験 Expand Access Program : EAP EAP概略 EAP実施における製薬会社側の課題 今後に向けて 製薬会社への影響 当局やアカデミアとの連携の重要性 1 ベムラフェニブとは
環境変化への業界側取組 ~CU 制度に係るパイロット試験での経験から ~ 中外製薬株式会社オンコロジーライフサイクルマネジメント部水井啓広 2015.6.20 本日の内容 ベムラフェニブについて CU制度に係るパイロット試験 Expand Access Program : EAP EAP概略 EAP実施における製薬会社側の課題 今後に向けて 製薬会社への影響 当局やアカデミアとの連携の重要性 1 ベムラフェニブとは
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに
 ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開
![審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開 審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開](/thumbs/53/31072016.jpg) 審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
( 別紙様式 ) タシグナカプセル 200mg, 150mg, 50mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 タシグナカプセル 200 mg 2 タシグナカプセル 150 mg 有効成分 ニロチニブ塩酸塩水和物 3 タシグナカプセル 50 mg 製造販売業者 ノバルティスフ
 タシグナカプセル 200 mg,150mg,50mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はノバルティスファーマ株式会社にあります 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません ノバルティスファーマ株式会社 ( 別紙様式 ) タシグナカプセル 200mg, 150mg, 50mg に係る医薬品リスク管理計画書 (RMP)
タシグナカプセル 200 mg,150mg,50mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はノバルティスファーマ株式会社にあります 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません ノバルティスファーマ株式会社 ( 別紙様式 ) タシグナカプセル 200mg, 150mg, 50mg に係る医薬品リスク管理計画書 (RMP)
医療法人原土井病院治験審査委員会
 社会医療法人原土井病院治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名議題及び審議結果を含む主な議論の概要 平成 29 年 6 月 6 日 ( 火曜日 )16 時 03 分から 16 時 52 分社会医療法人原土井病院第 1 会議室朔元則 上﨑典雄 真名子佐喜子 林信至 本松重盛 関成人 境一成 廣瀬禎子 奥田安孝議題 1 1 施設からの審査依頼により YLバイオロジクス株式会社の依頼による関節リウマチ患者を対象とした
社会医療法人原土井病院治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名議題及び審議結果を含む主な議論の概要 平成 29 年 6 月 6 日 ( 火曜日 )16 時 03 分から 16 時 52 分社会医療法人原土井病院第 1 会議室朔元則 上﨑典雄 真名子佐喜子 林信至 本松重盛 関成人 境一成 廣瀬禎子 奥田安孝議題 1 1 施設からの審査依頼により YLバイオロジクス株式会社の依頼による関節リウマチ患者を対象とした
日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI 関連の企業などはありません
 医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
レキサルティに係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) レキサルティ錠 1mg 販売名有効成分ブレクスピプラゾールレキサルティ錠 2mg 製造販売業者大塚製薬株式会社薬効分類 安全性検討事項 提出年月 重要な特定されたリスク 平成 30 年 5 月 錐
 レキサルティ錠 1 mgレキサルティ錠 2 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は大塚製薬株式会社にありま す 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません 大塚製薬株式会社 レキサルティに係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) レキサルティ錠 1mg 販売名有効成分ブレクスピプラゾールレキサルティ錠
レキサルティ錠 1 mgレキサルティ錠 2 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は大塚製薬株式会社にありま す 当該製品の適正使用に利用する以外の営利目的に本資料を利用することはできません 大塚製薬株式会社 レキサルティに係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) レキサルティ錠 1mg 販売名有効成分ブレクスピプラゾールレキサルティ錠
70 頭頸部放射線療法 放射線化学療法
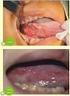 頭頸部放射線療法 放射線化学療法の患者への歯科治療 口腔ケア (1) 総論 1) 頭頸部の放射線 化学放射線療法の特徴 2) 頭頸部がん放射線療法による口腔への影響 3) 頭頸部放射線療法における歯科の役割 (2) 放射線治療による口腔合併症 ( 有害事象 ) と対処 1) 局所療法と急性 晩期障害 2) 口腔粘膜炎 3) 口腔乾燥症 4) 歯性感染症 カンジダ性口内炎 5) 味覚異常 6) 放射線性骨髄炎
頭頸部放射線療法 放射線化学療法の患者への歯科治療 口腔ケア (1) 総論 1) 頭頸部の放射線 化学放射線療法の特徴 2) 頭頸部がん放射線療法による口腔への影響 3) 頭頸部放射線療法における歯科の役割 (2) 放射線治療による口腔合併症 ( 有害事象 ) と対処 1) 局所療法と急性 晩期障害 2) 口腔粘膜炎 3) 口腔乾燥症 4) 歯性感染症 カンジダ性口内炎 5) 味覚異常 6) 放射線性骨髄炎
