2 対象疾患と病期初期放射線治療にもかかわらず再増大または進行する膠芽腫の患者 東京大学医学部附属病院の受診患者 ( 紹介患者を含む ) の中で本試験を希望し 臨床研究プロトコルに詳述の選択基準を全て満たし かつ除外基準のいずれにも該当しない者を対象とする 3 試験のデザイン本試験は無作為化を行わな
|
|
|
- きみお うすい
- 5 years ago
- Views:
Transcription
1 2 対象疾患と病期初期放射線治療にもかかわらず再増大または進行する膠芽腫の患者 東京大学医学部附属病院の受診患者 ( 紹介患者を含む ) の中で本試験を希望し 臨床研究プロトコルに詳述の選択基準を全て満たし かつ除外基準のいずれにも該当しない者を対象とする 3 試験のデザイン本試験は無作為化を行わないオープンラベルによる G47Δの段階的用量増加試験である 再発または進行性膠芽腫の患者を対象とし 定位的に腫瘍内に G47Δを投与する 5 日以上 14 日以内 ( 各コホート 1 例目は 7 日以上 14 日以内 ) に同じ部位に同量の G47Δの2 回目の投与を行う 3 段階 3 例ずつの用量増加を行い 安全性が確認されたら 最大用量で更に 12 例に投与する 安全性の評価すなわち有害事象の種類と発生頻度の調査を主目的とし 副次目的として 画像上の腫瘍縮小効果や全生存期間 無増悪生存期間により G47Δの効果を評価する (2) 被験者の選択基準および除外基準 1. 選択基準病理学的に膠芽腫との診断が確定していること かつ放射線治療に不反応となったもの すなわち 放射線治療後に再発あるいは進行したもの あるいは放射線治療中に腫瘍が増大しつつあるもの 腫瘍の存在部位が除外基準に記されたものでないこと G47Δ 投与前 14 日以内の MRI にて増影される病変が 1.0cm 以上あること 化学療法の施行歴の有無は問わない Karnofsky Performance Scale (KPS) 70% 年齢 18 歳以上 ステロイド投与は支障ないが 投与量が G47Δ 投与前の1 週間以内は一定であること G47Δ 投与後少なくとも 6 ヶ月間はバリア型避妊を実行する意志があること 3 か月以上の生存が見込まれること 主要臓器の機能が正常であること ( 除外基準参照 ) 文書でインフォームドコンセントを行う能力と意志があること 2. 除外基準既往歴治癒可能な子宮頚部の in situ 癌および皮膚の基底細胞癌または扁平上皮癌を除く 他の癌の既往または併存 23 P51
2 脳炎 多発性硬化症 または他の中枢神経感染症の既往 HIV 陽性またはその既往 アルコールまたは他の薬物中毒の既往または併存 MRI 検査 ( 造影剤使用 ) が禁忌の場合 例えば ペースメーカー 持続注入ポンプの体内留置 MRI 造影剤アレルギー その他 医学的あるいは精神的異常のため プロトコル治療を遵守することが困難であると思われる場合 腫瘍の存在部位脳外転移の存在 頭蓋内に複数の (2 か所以上の ) 悪性グリオーマ病変の存在 脳室 脳幹 あるいは後頭蓋窩に投与しなければならない場合 あるいは脳室経由で到達しなくてはならない場合 上衣下 くも膜下播種の存在 臨床検査値白血球 2.0 x 10 3 /mm 3 好中球 1.0 x 10 3 /mm 3 血小板 100,000/mm 3 Hb 9.0 g/dl INR or PTT> 正常値の 1.3 倍 血清クレアチニン 1.7mg/dl 肝トランスアミナーゼ (AST または ALT) > 正常値の 4 倍 総ビリルビンまたは直接ビリルビン > 1.5mg/dl 併存疾患活動性のヘルペスウイルス感染の存在 臨床試験開始時に HSV 対する抗ウイルス薬 ( アシクロビル バラシクロビル ) 治療を必要とする場合 手術の適応外となるような 活動性でコントロールされていない感染症の存在 コントロール不良または重度の心不全 糖尿病 高血圧 間質性肺炎 腎不全 自己免疫疾患など アレルギー歴抗 HSV 薬 ( アシクロビル ) に対するアレルギーの存在 併用薬 併用療法 G47Δの投与に先立ち 30 日以内の他の臨床試験薬の投与 G47Δ 投与前 6 週間以内に免疫療法 ( インターフェロンなど ) を行っていること G47Δ 投与前 30 日以内の何らかのワクチン投与 G47Δ 投与前 30 日以内の脳腫瘍切除術 遺伝子治療または G47Δ 以外のウイルス療法の既往 G47Δウイルス療法の既往または既登録者 妊娠に関する事項 24 P52
3 その他 妊娠中または授乳中の女性 その他 担当医師が不適切と判断する場合 (3) 被験者の同意の取得方法 1. 同意説明文書の作成と改訂 1) 本研究では 施設で定められた様式に従って同意説明文書を作成する 2) 同意説明文書は遺伝子治療臨床研究審査委員会の承認を受ける 3) 同意説明文書を大きく変更する改訂は 遺伝子治療臨床研究審査委員会の審査と承認を受けて行う 2. 患者への説明登録に先立って 担当医は患者本人に施設の遺伝子治療臨床研究審査委員会の承認を得た説明文書を患者本人に渡し 臨床試験コーディネーター (Clinical Research Coordinator: CRC) 同席のもとで以下の内容を口頭で詳しく説明する 1) 病名と病状に関する説明 2) 本研究が臨床研究であること 3) 臨床研究と一般診療との違い 4) 本研究のデザインおよび意義 5) プロトコル治療の内容 治療法 プロトコル治療全体の期間など 6) プロトコル治療により期待される効果延命効果 腫瘍縮小効果など 7) 予想される有害事象 合併症 後遺症とその対処法について合併症 後遺症 治療関連死を含む予期される有害事象の程度と頻度 及びそれらが生じた際の対処法について 8) 費用負担と補償健康被害が生じた場合担当医師が適切な治療を行うが 健康被害に対する補償はないことなどの説明 9) 代替治療法現在の一般的治療法 ( 緩和医療も含む ) や標準治療法の内容 効果 副作用など 代替治療を選択した場合の利益と不利益 10) 試験に参加することで患者に予想される利益と可能性のある不利益試験に参加することによって享受できると思われる利益と被る可能性のある不利益 11) 病歴の直接閲覧について 25 P53
4 必要に応じて独立データモニタリング委員などの関係者が医療機関の施設長の許可を得て病歴などを直接閲覧する可能性に関する説明 12) 同意拒否と同意撤回試験参加に先立っての同意拒否が自由であることや いったん同意した後の同意の撤回も自由であり それにより不当な診療上の不利益を受けないこと 13) 人権保護氏名や個人情報は守秘されるための最大限の努力が払われること 14) 質問の自由担当医の連絡先および総括責任者の連絡先を文書で知らせ 試験や治療内容について自由に質問できること 3. 同意 1) 同意の方法試験についての説明を行った翌日以降に 被験者が試験の内容をよく理解したことを確認した上で 試験への参加について依頼する 被験者本人が試験参加に同意した場合 付表の同意書を用い 説明をした医師名 説明を受け同意した被験者名 同意を得た日付を記載し 医師 被験者各々が署名する 2) 代筆者の署名に関する規定神経症状 ( 麻痺 振戦など ) によって被験者本人の署名が困難である場合は 被験者名を代筆者が署名しても良い ( ただし 同意そのものは本人の意思に限る ) 代筆者は以下の者から被験者本人が指名する: 被験者の配偶者 成人の子 父母 成人の兄弟姉妹若しくは孫 祖父母 同居の親族又はそれらの近親者に準ずると考えられる者 3) 同意文書の部数同意書は 3 部作成し 1 部は被験者本人に手渡し 1 部はデータセンターが保管する 1 部はカルテに保管する 4) 同意書の改訂と再同意被験者の同意に影響を及ぼすと考えられる有効性や安全性等の情報が得られたときや 被験者の同意に影響を及ぼすような実施計画等の変更が行われるときは 速やかに被験者に情報提供し 試験等に参加するか否かについて被験者の意思を改めて確認するとともに 遺伝子治療臨床研究審査委員会の承認を得て同意説明文書等の改訂を行い 被験者の再同意を得る 同意承諾を得て臨床試験が開始された後に 病状の増悪などにより本人に同意承諾能力がなくなったと判断される場合には 代諾者による再同意の判断を可能とする 26 P54
5 5) 同意の撤回被験者はどの時点においても またいかなる理由でも同意を撤回することができる 病状の増悪などにより被験者本人に同意撤回能力がなくなったと判断される場合には 代諾者による同意撤回の判断を可能とする 4. 登録の手順 1) 試験担当医師は 候補となる患者に説明を行い同意取得の後 所定の検査を実施して適格性の判断に必要な情報を収集する 2) 試験担当医師は 各選択基準および除外基準に関する情報を症例登録用紙に記載した後 施設内の適格性判定委員会に症例を提示し 対象患者が選択基準を全て満たし 除外基準のいずれにも該当しないことを確認する その後に 独立データモニタリング委員会により適格性判定委員会の判定の確認を受ける 3) 記載した症例登録用紙をデータセンターに送付する 4) データセンターは 受領した内容を確認した上で登録番号を付与し 試験の進行段階に応じて G47Δ 投与量の指定を行なう その後 登録確認書を作成し 試験担当医師に送付する 受領した登録用紙の内容に不備が認められた場合 データセンターは試験担当医師に問い合わせ 不備を解決する (4) 実施期間および目標症例数 1. 実施期間目標登録期間を約 1 年とする 観察期間を G47Δ 投与完了後 90 日間とする G47Δ 治療後 2 年間 全生存期間と無増悪生存期間について追跡する 観察項目の詳細は (5) 遺伝子治療臨床研究の実施方法 4 臨床検査項目ならびに 観察項目 に記載する サルを用いた G207 脳内投与の非臨床安全性試験 29) ならび に G207 の第 I 相臨床試験 30) において ウイルスの排泄 (shedding) は投与後のどの時点でも認められておらず shedding に関する検査は第二回投与後 7 日間とする 2. 目標症例数 21 人 ( 最大 30 人 ) Grade 3 以上の G47Δに起因する有害事象が見られない場合 用量増加段階で 9 人 最大用量でさらに 12 人 合計 21 人の治療を行う G47Δに起因する grade 3 以上の有害事象が出現し症例数の追加を行う場合の最大症例数は 30 人である (5) 遺伝子治療臨床研究の実施方法 1. 対照群の設定方法この臨床研究はオープンラベルであり 盲検化は行わず 対照群も設けない 2. 遺伝子導入方法 ( 安全性および有効性に関する事項を除く ) 説明と同意の後 適格性判断のための検査を行い 臨床研究被験者として登録 27 P55
6 を行う 前治療に関する規定 ( 選択 除外基準を一部再掲 ) 初発時または再発時に手術 ( 定位的生検または開頭による切除術 ) が行われ 膠芽腫の病理診断が得られていること 術後 30 日以上を経ていること 放射線治療が行われていること 照射方法および量 治療完了の有無 および治療後の経過期間は問わない 化学療法の施行歴の有無および治療後の経過期間は問わない 症例登録から第 1 回 G47Δ 投与までの期間は 30 日以内とする 31 日以上になった場合は その理由を症例報告書に記載する G47 の投与は入院の上 手術室にて行う 投与に際しては レクセル型の定位手術装置を使用し 局所麻酔または全身麻酔下に穿頭手術のうえ MRI 画像のガイド下に腫瘍の造影部位に定位的に投与する 10% グリセリン / 燐酸緩衝生理食塩水 (PBS) で総量 1ml となるよう希釈した G47 を 2-5 箇所の標的部位へ 生検の後に緩徐に注入する 第 1 回投与後 5 日以上 14 日以内 ( 各コホート1 例目は 7 日以上 14 日以内 ) に 再度同じ穿頭部位から第 2 回の投与を同様に行う 被験者の負担と安全性を考慮し各コホート1 例目は 7 日以上 2 例目以降は 5 日以上の間隔をおき 同じ手術創を用いて投与が可能で かつ腫瘍の状態の変化により同一部位への投与が困難とならないよう 14 日以内の投与間隔とする マウスの皮下腫瘍モデルを用いた非臨床試験では 1 x 10 7 pfu の G207 の単回投与と その十分の一量 (1 x 10 6 pfu) の6 回投与 (2 回 / 週 ) が比較され 後者では 75%(6/8) が治癒したのに対し前者では治癒が見られなかったことから (0/8) 複数回投与の方が単回投与より治療効果が高いことが示されている 31) また G207 の第 Ib 相臨床試験では脳腫瘍内 2 回投与 (7 日以内 ) が実施された これらより 本研究では 2 回投与を採択した また 腫瘍組織内へ G47Δを分布させるためと G207 の第 I 相臨床試験で脳腫瘍内 5 箇所へ定位的投与されたことがあることから 本研究では腫瘍内 2-5 箇所への投与を採択した 生検で得た検体は その場で分割し 一部は病理診断のため病理部へ送付する 一部は本臨床研究に関連する検査のため 脳神経外科研究室へ送付する 試験担当医師が退院可能と判断するまでを入院期間とする 用量増加 28 P56
7 1 群 3 例ずつ 3 群にわたって用量を増加する 1 回あたり 3.0x10 8 pfu 1.0x10 9 pfu または 3.0x10 9 pfu を 2 回投与 すなわち一人あたり合計 6.0x10 8 pfu 2.0x10 9 pfu または 6.0x10 9 pfu を投与する 各群のそれぞれ 1 例目については 第 1 回の投与後 6 日間の観察期間をおいた後に 第 2 回の投与を行う また 同群の次の被験者の治療を開始するまでには 直前の被験者への第 2 回投与後 最低 6 日間の観察期間をおく 次のコホートへの移行は 直前のコホートの最後の被験者への第 2 回投与後 投与日を含めて最低 14 日間の観察期間をおき 独立データモニタリング委員会の承認を得て行なう 1つのコホートで G47Δに起因する grade 3 以上の有害事象が1 例もみられない場合は 次のコホートに進む 第 3コホートで G47Δに起因する grade 3 以上の有害事象が全く見られない場合には 6.0x10 9 pfu を最大用量とする ある用量で 1 人に G47Δに起因する grade 3 以上の有害事象が見られた場合には そのコホートに被験者を3 例追加する 追加 3 例に G47Δに起因する grade 3 以上の有害事象が見られない場合は 次のコホートに進む 第 3コホートで被験者を追加した結果 G47Δに起因する grade 3 以上の有害事象が6 例中 1 例以下の場合 6.0x10 9 pfu を最大用量とする ある用量で 2 人以上に G47Δに起因する grade 3 以上の有害事象が見られた場合には その時点でそれより 1 段階低い用量を仮の最大耐用量とする 仮の最大耐用量が設定された場合 そのコホートでの被験者を追加し 合計 6 例する その用量で G47Δに起因する grade 3 以上の有害事象の見られる被験者が 1 例以下の場合 その用量を最大耐用量と決定する 2 人以上に G47Δに起因する grade 3 以上の有害事象が見られた場合には その時点で更に 1 段階低い用量を仮の最大耐用量とし その用量で合計 6 例となるまで被験者を追加する 最小用量のコホートにおいて 2 人以上の被験者に G47Δに起因する grade 3 以上の有害事象が見られた場合には この臨床研究は終了となる 最大用量または最大耐用量が定められたのちは その量においてさらに 12 例の治療を行う なお この 12 例の治療中にこの用量での 3 分の 1 以上の被験者に G47Δに起因する grade 3 以上の有害事象が見られた場合には 試験を中断し 独立データモニタリング委員会で試験の中止 継続を検討する 用量設定の根拠 HSV-1 に感受性の高い A/J マウスを用いた非臨床安全性試験で G47 単回投与は G207 単回投与と同等以上の安全性を有していることが確認された G207 の第 I 相臨床試験では 1 x 10 6 pfu 単回投与から開始し最高用量の 3 x 10 9 pfu 単回投与まで 脳腫瘍内投与にて grade 3 以上の有害事象が観察されなかった その際 最高用量 3 x 10 9 pfu は 総容量 1ml を 5 箇所に分割して投与された 本研究では 29 P57
8 非臨床試験で G47 が G207 と同等以上の安全性を有しているとされるものの G207 より高い抗腫瘍作用を持つことと 力価の測定法の違いを考慮し 開始一回投与量を G207 第 I 相試験最高用量の 10 分の一から開始することにし 一回投与総容量を 1ml 分割投与を 2 ないし 5 箇所と設定した 用量 スケジュール変更基準 有害事象に応じた個別の用量の変更 延期 減量は行わない ( 次項 中止 を 参照 ) プロトコル治療の中止以下のいずれかの場合 プロトコル治療を中止する 治療開始後の中止の場合 観察項目の記録は継続する プロトコル治療中止 / 終了日は プロトコル治療中の死亡の場合は死亡日 それ以外の中止の場合はプロトコル治療中止と判断した日とする プロトコル治療の中止基準を患者経過記録用紙 (CRF) に記載する 1 治療開始後に原病の増悪が認められた場合原病の増悪とは 画像所見による PD と明らかな原病の臨床的増悪の両方を含む 原病の増悪の場合 後療法は規定しない 2 有害事象によりプロトコル治療が継続できない場合 i) G47Δに起因する Grade 4 の非血液毒性が認められた場合 ( 非血液毒性 :NCI-CTC 血液/ 骨髄 区分以外の有害事象 ) ii) 手術中の有害事象により G47Δ 投与が中止された場合 iii) 有害事象により 担当医が中止が必要と判断した場合 3 有害事象との関連が否定できない理由により 被験者がプロトコル治療の中止を申し出た場合や同意を撤回した場合 ( 有害事象との関連が否定できない場合はこの分類を用いる ) 4 有害事象との関連が否定できる理由により 被験者がプロトコル治療の中止を申し出た場合 ( 本人や家人の転居等 有害事象との関連がほぼ確実に否定できる場合のみこの分類を用いる ) 5 プロトコル治療中の死亡 6 その他 登録後治療開始前の増悪 ( 急速な増悪によりプロトコル治療が開始できなかった ) プロトコル違反の判明 登録後の病理診断変更などによる不適格性の判明 併存疾患の増悪などにより検査結果等が選択基準値を満たさなくなった場合や 併用禁止療法を行う必要が生じた場合 7 その他 試験担当医師が中止が適切と判断した場合 30 P58
9 3. 前処置および併用療法の有無 1) 前処置前処置はない 2) 併用療法 1 ステロイドは併用可である ただし 適格性判定の 7 日前から第 2 回 G47Δ 投与後 7 日後までの投与量は一定とする 臨床上の必要から投与量を変更する場合は 理由を患者経過記録用紙 (CRF) に記載する 2 浸透圧利尿薬および抗痙攣薬に関しては制限を設けない 3 手術中および術後は原則として抗生物質の投与を行う その内容には制限を設けない 4 アシクロビル バラシクロビルなどの抗 HSV 薬 ( ただし G47Δ 投与後の HSV-1 感染症 - 疑い例を含む-に対する投与を除く ) ステロイド以外の免疫抑制薬 あるいはインターフェロンなどの免疫療法薬は併用することができない 5 併用薬剤は 市販薬やワクチン および併用禁止薬剤も含めて 薬剤名 量 回数 投薬経路 日付 および投与理由を患者経過記録用紙 (CRF) に記載する 3) 支持療法 1 HSV-1 感染に伴う脳炎 G47Δ 投与後に 発熱の持続や 痙攣 筋力低下 失語 意識障害 その他原病で説明困難な神経症状悪化の出現 および画像診断にて出血を伴う炎症や腫瘍周囲の浮腫の増大が見られた場合には HSV-1 感染に伴う脳炎を疑い 髄液 ( 脳圧亢進がない場合 ) や血液の PCR 検査やウイルス培養の検査 さらに必要な場合には脳生検を行なう HSV-1 感染に伴う脳炎である場合には 通常のヘルペス脳炎治療に準じて アシクロビルなどの抗 HSV 薬を用いた治療を速やかに開始する 2 その他の有害事象その他の有害事象に関しては 現行の医学水準に基づく適切な支持療法を行う 4) 後治療 1 第 2 回 G47Δ 投与完了後は 増悪や再発を認めるまでの期間もしくは 90 日間のいずれか早い方の期間 他の抗腫瘍治療は行わないで観察する 2 プロトコル治療中止後および 90 日の観察期間後の治療は規定しない 4. 臨床検査項目ならびに観察項目 1) 同意説明後の適格性評価時 31 P59
10 1 現病歴 既往歴 手術歴 2 理学所見 身長 体重 3 神経学的所見 4 バイタルサイン 5 KPS 6 薬剤服用歴 7 血算 ( 白血球分画および血小板数を含む ) 8 血液生化学検査肝機能 ( 総ビリルビン Al-P LDH γgtp AST ALT) 腎機能 ( クレアチニン ) 電解質 (Na K) 9 凝固系 (PT INR および PTT) 10 心電図 11 胸部 X 線 12 頭部造影 MRI 2) 登録後第 1 回 G47Δ 投与前日まで 1 リンパ球 CD4/CD8 数および比 2 HSV 抗体価 (ELISA) を含む血清学的検査 3 遅延型皮膚過敏反応 3) 第 1 回 G47Δ 投与前日 1 神経学的所見 2 バイタルサイン 3 KPS 4 血算 ( 白血球分画および血小板数を含む ) 5 血液生化学検査肝機能 ( 総ビリルビン Al-P LDH γgtp AST ALT) 腎機能 ( クレアチニン ) 電解質 (Na K) 6 凝固系 (PT INR および PTT) 7 併用薬剤 8 有害事象評価 4) 第 1 回 G47Δ 投与当日の投与前 1 頭部造影 MRI 5) 第 1 回 G47Δ 投与当日の投与中 1 腫瘍組織採取 6) 第 1 回 G47Δ 投与当日の投与後 32 P60
11 1 頭部単純 CT 2 神経学的所見 3 バイタルサイン 4 KPS 5 併用薬剤 6 有害事象の評価 7) 第 1 回 G47Δ 投与翌日 1 頭部単純 CT 2 神経学的所見 3 バイタルサイン 4 KPS 5 併用薬剤 6 血液生化学検査肝機能 ( 総ビリルビン Al-P LDH γgtp AST ALT) 腎機能 ( クレアチニン ) 電解質 (Na K) 7 HSV の排出 ( 唾液 尿の PCR 陽性の場合は定量的 PCR も ) 8 血清の PCR およびウイルス培養 9 有害事象の評価 8) 第 2 回 G47Δ 投与前日 1 神経学的所見 2 バイタルサイン 3 KPS 4 血算 ( 白血球分画および血小板数を含む ) 5 血液生化学検査肝機能 ( 総ビリルビン Al-P LDH γgtp AST ALT) 腎機能 ( クレアチニン ) 電解質 (Na K) 6 凝固系 (PT INR および PTT) 7 併用薬剤 8 有害事象の評価 9) 第 2 回 G47Δ 投与当日の投与前 1 頭部造影 MRI 10) 第 2 回 G47Δ 投与当日の投与中 1 腫瘍組織採取 11) 第 2 回 G47Δ 投与当日の投与後 33 P61
12 1 頭部単純 CT 2 神経学的所見 3 バイタルサイン 4 KPS 5 併用薬剤 6 有害事象の評価 12) 第 2 回 G47Δ 投与翌日 1 頭部単純 CT 2 神経学的所見 3 バイタルサイン 4 KPS 5 併用薬剤 6 血算 ( 白血球分画および血小板数を含む ) 7 血液生化学検査肝機能 ( 総ビリルビン Al-P LDH γgtp AST ALT) 腎機能 ( クレアチニン ) 電解質 (Na K) 8 HSV の排出 ( 唾液 尿の PCR 陽性の場合は定量的 PCR も ) 9 血清の PCR およびウイルス培養 10 有害事象の評価 13) 第 2 回 G47Δ 投与 7 日後 +2 日 1 神経学的所見 2 バイタルサイン 3 KPS 4 血算 ( 白血球分画および血小板数を含む ) 5 血液生化学検査肝機能 ( 総ビリルビン Al-P LDH γgtp AST ALT) 腎機能 ( クレアチニン ) 電解質 (Na K) 6 凝固系 (PT INR および PTT) 7 HSV の排出 ( 唾液 尿の PCR 陽性の場合は定量的 PCR も ) 8 血清の PCR およびウイルス培養 9 頭部造影 MRI 10 併用薬剤 11 有害事象の評価 14) 第 2 回 G47Δ 投与 28 日後 +4 日 34 P62
13 1 理学所見 体重 2 神経学的所見 3 バイタルサイン 4 KPS 5 血算 ( 白血球分画および血小板数を含む ) 6 血液生化学検査肝機能 ( 総ビリルビン Al-P LDH γgtp AST ALT) 腎機能 ( クレアチニン ) 電解質 (Na K) 7 凝固系 (PT INR および PTT) 8 リンパ球 CD4/CD8 数および比 9 HSV 抗体価 (ELISA) を含む血清学的検査 10 遅延型皮膚過敏反応 11 頭部造影 MRI 12 併用薬剤 13 有害事象の評価 15) 第 2 回 G47Δ 投与 2 ヵ月後 +7 日 1 理学所見 体重 2 神経学的所見 3 バイタルサイン 4 KPS 5 血算 ( 白血球分画および血小板数を含む ) 6 頭部造影 MRI 7 併用薬剤 8 有害事象の評価 16) 第 2 回 G47Δ 投与 3 ヵ月後 +7 日 1 理学所見 体重 2 神経学的所見 3 バイタルサイン 4 KPS 5 血算 ( 白血球分画および血小板数を含む ) 6 リンパ球 CD4/CD8 数および比 7 遅延型皮膚過敏反応 8 HSV 抗体価 (ELISA) を含む血清学的検査 9 頭部造影 MRI 10 併用薬剤 35 P63
14 11 有害事象の評価 36 P64
れない場合は 次のコホートに進む 第 3 コホートで被験者を追加した結果 G47Δ に起因する grade 3 以上の有害事象が 6 例中 1 例以下の場合 6.0x10 9 pfu を最大用量とする ある用量で 2 人以上に G47Δ に起因する grade 3 以上の有害事象が見られた場合には
 に被験者に情報提供し 試験等に参加するか否かについて被験者の意思を改めて確認するとともに 遺伝子治療臨床研究審査委員会の承認を得て同意説明文書等の改訂を行い 被験者の再同意を得る 同意承諾を得て臨床研究が開始された後に 病状の増悪などにより本人に同意承諾能力がなくなったと判断される場合には 代諾者による再同意の判断を可能とする v) 同意の撤回被験者はどの時点においても またいかなる理由でも同意を撤回することができる
に被験者に情報提供し 試験等に参加するか否かについて被験者の意思を改めて確認するとともに 遺伝子治療臨床研究審査委員会の承認を得て同意説明文書等の改訂を行い 被験者の再同意を得る 同意承諾を得て臨床研究が開始された後に 病状の増悪などにより本人に同意承諾能力がなくなったと判断される場合には 代諾者による再同意の判断を可能とする v) 同意の撤回被験者はどの時点においても またいかなる理由でも同意を撤回することができる
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生年月日 住所 M T S H 西暦 電話番号 年月日 ( ) - 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 ( ) - 家族構成 ( ) - ( ) - ( ) - ( ) - 担当医情報 医
 佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
症例報告書の記入における注意点 1 必須ではない項目 データ 斜線を引くこと 未取得 / 未測定の項目 2 血圧平均値 小数点以下は切り捨てとする 3 治験薬服薬状況 前回来院 今回来院までの服薬状況を記載する服薬無しの場合は 1 日投与量を 0 錠 とし 0 錠となった日付を特定すること < 演習
 ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
9 中止基準 ( 研究対象者の中止 研究全体の中止について ) 10 研究対象者への研究実施後の医療提供に関する対応 通常の診療を超える医療行為 を伴う研究を実施した場合 研究実施後において 研究対象者が研究の結果より得られた利用可能な最善の予防 診断及び治療が受けられるように努めること 11 研究
 倫理審査書類 ( 研究計画書 ) チェックシート 研究計画書には 原則として以下の項目を含めてください 申請時 提出は不要です 2017.5.2 1 研究の名称 ( 標題 ) 2 研究の実施体制 ( 研究組織 ) 多施設共同研究の場合 共同研究機関の研究者名 役割も詳細に記載 3 研究の背景及び意義 研究を実施する意義 必要性に関して 文献等を用いて研究の 科学的合理性の根拠 と 本研究で得られる成果
倫理審査書類 ( 研究計画書 ) チェックシート 研究計画書には 原則として以下の項目を含めてください 申請時 提出は不要です 2017.5.2 1 研究の名称 ( 標題 ) 2 研究の実施体制 ( 研究組織 ) 多施設共同研究の場合 共同研究機関の研究者名 役割も詳細に記載 3 研究の背景及び意義 研究を実施する意義 必要性に関して 文献等を用いて研究の 科学的合理性の根拠 と 本研究で得られる成果
針刺し切創発生時の対応
 1. 初期対応 1) 発生直後の対応 (1) 曝露部位 ( 針刺し 切創等の経皮的創傷 粘膜 皮膚など ) を確認する (2) 曝露部位を直ちに洗浄する 1 創傷 粘膜 正常な皮膚 創傷のある皮膚 : 流水 石鹸で十分に洗浄する 2 口腔 : 大量の水でうがいする 3 眼 : 生理食塩水で十分に洗浄する (3) 曝露の程度 ( 深さ 体液注入量 直接接触量 皮膚の状態 ) を確認する (4) 原因鋭利器材の種類
1. 初期対応 1) 発生直後の対応 (1) 曝露部位 ( 針刺し 切創等の経皮的創傷 粘膜 皮膚など ) を確認する (2) 曝露部位を直ちに洗浄する 1 創傷 粘膜 正常な皮膚 創傷のある皮膚 : 流水 石鹸で十分に洗浄する 2 口腔 : 大量の水でうがいする 3 眼 : 生理食塩水で十分に洗浄する (3) 曝露の程度 ( 深さ 体液注入量 直接接触量 皮膚の状態 ) を確認する (4) 原因鋭利器材の種類
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
「 」 説明および同意書
 EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2013/6/17 受付番号 診療科名 脳神経外科 がん腫 ( コード ) 診療科長名 申請医師名 レジメン登録ナンバー 登録申請日 審査区分 ( 下記をチェックしてください ) 登
 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2013/6/17 受付番号 診療科名 脳神経外科 がん腫 ( コード ) 診療科長名 申請医師名 レジメン登録ナンバー 登録申請日 審査区分 ( 下記をチェックしてください ) 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります
がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2013/6/17 受付番号 診療科名 脳神経外科 がん腫 ( コード ) 診療科長名 申請医師名 レジメン登録ナンバー 登録申請日 審査区分 ( 下記をチェックしてください ) 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります
33 NCCN Guidelines Version NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) 非ホジキンリンパ腫 2015 年第 2 版 NCCN.or
 33 NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) 2015 年第 2 版 NCCN.org NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) の Lugano
33 NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) 2015 年第 2 版 NCCN.org NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) の Lugano
する 研究実施施設の環境 ( プライバシーの保護状態 ) について記載する < 実施方法 > どのような手順で研究を実施するのかを具体的に記載する アンケート等を用いる場合は 事前にそれらに要する時間を測定し 調査による患者への負担の度合いがわかるように記載する 調査手順で担当が複数名いる場合には
 参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後 予測因子および副作用発現の危険因子についての探索的研究 (JACCRO GC-07AR) という臨床研究について説明したものです この文書と私の説明のな かで わかりにくいと
 StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下
 北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
1)表紙14年v0
 NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 に関する説明書 一般財団法人脳神経疾患研究所先端医療研究センター 所属長衞藤義勝 この説明書は 血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 の内容について説明したものです この研究についてご理解 ご賛同いただける場合は, 被
 血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 に関する説明書 一般財団法人脳神経疾患研究所先端医療研究センター 所属長衞藤義勝 この説明書は 血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 の内容について説明したものです この研究についてご理解 ご賛同いただける場合は, 被験者 ( 研究の対象者 ) として研究にご参加くださいますようお願い申し上げます この研究に参加されない場合でも,
血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 に関する説明書 一般財団法人脳神経疾患研究所先端医療研究センター 所属長衞藤義勝 この説明書は 血液 尿を用いたライソゾーム病のスクリーニング検査法の検討 の内容について説明したものです この研究についてご理解 ご賛同いただける場合は, 被験者 ( 研究の対象者 ) として研究にご参加くださいますようお願い申し上げます この研究に参加されない場合でも,
がん登録実務について
 平成 28 年度東京都がん登録説明会資料 2-1 がん登録届出実務について (1) 1. 届出対象 2. 届出候補見つけ出し 3. 診断日 4. 届出票の作成例示 東京都地域がん登録室 1 1. 届出対象 1 原発部位で届出 2 入院 外来を問わず 当該腫瘍に対して 自施設を初診し 診断あるいは治療の対象 ( 経過観察を含む ) となった腫瘍を届出 3 届出対象となった腫瘍を 1 腫瘍 1 届出の形で届出
平成 28 年度東京都がん登録説明会資料 2-1 がん登録届出実務について (1) 1. 届出対象 2. 届出候補見つけ出し 3. 診断日 4. 届出票の作成例示 東京都地域がん登録室 1 1. 届出対象 1 原発部位で届出 2 入院 外来を問わず 当該腫瘍に対して 自施設を初診し 診断あるいは治療の対象 ( 経過観察を含む ) となった腫瘍を届出 3 届出対象となった腫瘍を 1 腫瘍 1 届出の形で届出
糖尿病経口薬 QOL 研究会研究 1 症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12
 症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12 患者背景同意取得時から試験開始までの状況について記入 性別 男 女 年齢生年月日 歳 西暦年月日 身長. cm 体重. kg 腹囲. cm 糖尿病罹病期間 西暦年月 ~ 現在 喫煙 合併症 あり なし飲酒 あり
症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12 患者背景同意取得時から試験開始までの状況について記入 性別 男 女 年齢生年月日 歳 西暦年月日 身長. cm 体重. kg 腹囲. cm 糖尿病罹病期間 西暦年月 ~ 現在 喫煙 合併症 あり なし飲酒 あり
はじめに この 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 は を服用される患者さんが 服用状況 体調の変化 検査結果の経過などを記録するための冊子です は 催奇形性があり サリドマイドの同類薬です は 胎児 ( お腹の赤ちゃん ) に障害を起こす可能性があります 生まれてくる赤ちゃんに
 を服用される方へ 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 使用開始日年月日 ( 冊目 ) はじめに この 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 は を服用される患者さんが 服用状況 体調の変化 検査結果の経過などを記録するための冊子です は 催奇形性があり サリドマイドの同類薬です は 胎児 ( お腹の赤ちゃん ) に障害を起こす可能性があります 生まれてくる赤ちゃんに被害を及ぼすことがないよう
を服用される方へ 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 使用開始日年月日 ( 冊目 ) はじめに この 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 は を服用される患者さんが 服用状況 体調の変化 検査結果の経過などを記録するための冊子です は 催奇形性があり サリドマイドの同類薬です は 胎児 ( お腹の赤ちゃん ) に障害を起こす可能性があります 生まれてくる赤ちゃんに被害を及ぼすことがないよう
同意説明文書(見本)
 同意説明文書 患者さんへ 膠原病の皮膚症状と血管障害の関連性について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者群馬大学大学院医学系研究科皮膚科学講師茂木精一郎 臨床研究責任医師群馬大学大学院医学系研究科皮膚科学講師茂木精一郎
同意説明文書 患者さんへ 膠原病の皮膚症状と血管障害の関連性について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者群馬大学大学院医学系研究科皮膚科学講師茂木精一郎 臨床研究責任医師群馬大学大学院医学系研究科皮膚科学講師茂木精一郎
頭頚部がん1部[ ].indd
![頭頚部がん1部[ ].indd 頭頚部がん1部[ ].indd](/thumbs/92/108881798.jpg) 1 1 がん化学療法を始める前に がん化学療法を行うときは, その目的を伝え なぜ, 化学療法を行うか について患者の理解と同意を得ること ( インフォームド コンセント ) が必要である. 病理組織, 病期が決定したら治療計画を立てるが, がん化学療法を治療計画に含める場合は以下の場合である. 切除可能であるが, 何らかの理由で手術を行わない場合. これには, 導入として行う場合と放射線療法との併用で化学療法を施行する場合がある.
1 1 がん化学療法を始める前に がん化学療法を行うときは, その目的を伝え なぜ, 化学療法を行うか について患者の理解と同意を得ること ( インフォームド コンセント ) が必要である. 病理組織, 病期が決定したら治療計画を立てるが, がん化学療法を治療計画に含める場合は以下の場合である. 切除可能であるが, 何らかの理由で手術を行わない場合. これには, 導入として行う場合と放射線療法との併用で化学療法を施行する場合がある.
試験デザイン :n=152 試験開始前に第 VIII 因子製剤による出血時止血療法を受けていた患者群を 以下のい ずれかの群に 2:2:1 でランダム化 A 群 (n=36) (n=35) C 群 (n=18) ヘムライブラ 3 mg/kg を週 1 回 4 週間定期投与し その後 1.5 mg/k
 各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
がん化学(放射線)療法レジメン申請書
 申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名呼吸器外科がん腫 ( コード ) 診療科長名 申請医師名 審査区分 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区分使用分類適応分類
申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名呼吸器外科がん腫 ( コード ) 診療科長名 申請医師名 審査区分 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区分使用分類適応分類
 一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
一次サンプル採取マニュアル PM 共通 0001 Department of Clinical Laboratory, Kyoto University Hospital その他の検体検査 >> 8C. 遺伝子関連検査受託終了項目 23th May EGFR 遺伝子変異検
 Department of Clinical Laboratory, Kyoto University Hospital 6459 8. その他の検体検査 >> 8C. 遺伝子関連検査受託終了項目 23th May. 2017 EGFR 遺伝子変異検査 ( 院内測定 ) c-erbb/egfr [tissues] 基本情報 8C051 c-erbb/egfr JLAC10 診療報酬 分析物 識別材料測定法
Department of Clinical Laboratory, Kyoto University Hospital 6459 8. その他の検体検査 >> 8C. 遺伝子関連検査受託終了項目 23th May. 2017 EGFR 遺伝子変異検査 ( 院内測定 ) c-erbb/egfr [tissues] 基本情報 8C051 c-erbb/egfr JLAC10 診療報酬 分析物 識別材料測定法
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1
 医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1 顆粒球コロニー刺激因子 (Granulocyte Colony-Stimulating Factor: G-CSF) 一般名 : フィルグラスチム 調達法 国内企業より無償提供 製造元または供給元の名称協和発酵キリン
医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1 顆粒球コロニー刺激因子 (Granulocyte Colony-Stimulating Factor: G-CSF) 一般名 : フィルグラスチム 調達法 国内企業より無償提供 製造元または供給元の名称協和発酵キリン
配偶子凍結終了時 妊孕能温存施設より直接 妊孕能温存支援施設 ( がん治療施設 ) へ連絡がん治療担当医の先生へ妊孕能温存施設より妊孕能温存治療の終了報告 治療内容をご連絡します 次回がん治療の為の患者受診日が未定の場合は受診日を御指示下さい 原疾患治療期間中 妊孕能温存施設より患者の方々へ連絡 定
 - がん治療を担当される妊孕性温存支援施設の医療者の方々へ - 患者が妊孕能温存を希望する時 適応の確認担当されている患者の妊孕能温存の適応を確認して下さい ( ホームページ内 男性の皆様へ 女性の皆様へ にあります男性 女性各々の化学療法および放射線療法の性腺毒性によるリスク分類を参照 ) 妊孕能温存施設への紹介 1. 妊孕能温存施設 ( 生殖医療施設 ) へ直接紹介することを希望する場合ホームページ内
- がん治療を担当される妊孕性温存支援施設の医療者の方々へ - 患者が妊孕能温存を希望する時 適応の確認担当されている患者の妊孕能温存の適応を確認して下さい ( ホームページ内 男性の皆様へ 女性の皆様へ にあります男性 女性各々の化学療法および放射線療法の性腺毒性によるリスク分類を参照 ) 妊孕能温存施設への紹介 1. 妊孕能温存施設 ( 生殖医療施設 ) へ直接紹介することを希望する場合ホームページ内
2013 年 4 月 8 日 ver 改訂 JCOG 効果 安全性評価委員会承認 4 月 8 日発効 2013 年 8 月 2 日 ver 改訂 JCOG 効果 安全性評価委員会承認 8 月 2 日発効 2014 年 8 月 13 日 ver. 1.1 改訂 JCOG 効果
 Japan Clinical Oncology Group( 日本臨床腫瘍研究グループ ) 脳腫瘍グループ日本医療研究開発機構委託研究開発費革新的がん医療実用化研究事業 17ck0106341h0001 中枢神経系原発悪性リンパ腫に対するテモゾロミドを用いた標準治療確立に関する研究 班国立がん研究センター研究開発費 29-A-3 成人固形がんに対する標準治療確立のための基盤研究(JCOG) 班 JCOG1114C
Japan Clinical Oncology Group( 日本臨床腫瘍研究グループ ) 脳腫瘍グループ日本医療研究開発機構委託研究開発費革新的がん医療実用化研究事業 17ck0106341h0001 中枢神経系原発悪性リンパ腫に対するテモゾロミドを用いた標準治療確立に関する研究 班国立がん研究センター研究開発費 29-A-3 成人固形がんに対する標準治療確立のための基盤研究(JCOG) 班 JCOG1114C
 ~ 副腎に腫瘍がある といわれたら ~ 副腎腫瘍? そもそも 副腎って何? 小さいけれど働き者の 副腎 副腎は 左右の腎臓の上にある臓器です 副腎皮質ホルモンやカテコラミンと呼ばれる 生命や血圧を維持するために欠かせない 重要なホルモンを分泌している大切な臓器です 副腎 副腎 NEXT ホルモンって 何? 全身を調整する大切な ホルモン 特定の臓器 ( 内分泌臓器 ) から血液の中に出てくる物質をホルモンと呼びます
~ 副腎に腫瘍がある といわれたら ~ 副腎腫瘍? そもそも 副腎って何? 小さいけれど働き者の 副腎 副腎は 左右の腎臓の上にある臓器です 副腎皮質ホルモンやカテコラミンと呼ばれる 生命や血圧を維持するために欠かせない 重要なホルモンを分泌している大切な臓器です 副腎 副腎 NEXT ホルモンって 何? 全身を調整する大切な ホルモン 特定の臓器 ( 内分泌臓器 ) から血液の中に出てくる物質をホルモンと呼びます
1 8 ぜ 表2 入院時検査成績 2 諺齢 APTT ALP 1471U I Fib 274 LDH 2971U 1 AT3 FDP alb 4 2 BUN 16 Cr K4 O Cl g dl O DLST 許 皇磯 二 図1 入院時胸骨骨髄像 低形成で 異常細胞は認め
 1 8 ぜ 表2 入院時検査成績 2 諺齢 APTT ALP 1471U I Fib 274 LDH 2971U 1 AT3 FDP 125 6 7 alb 4 2 BUN 16 Cr K4 O Cl g dl O 7 137 DLST 許 皇磯 二 図1 入院時胸骨骨髄像 低形成で 異常細胞は認められない PAIgG 177 3ng 107 cell meq 1 砂糖水試験 一 Fe 236 μg
1 8 ぜ 表2 入院時検査成績 2 諺齢 APTT ALP 1471U I Fib 274 LDH 2971U 1 AT3 FDP 125 6 7 alb 4 2 BUN 16 Cr K4 O Cl g dl O 7 137 DLST 許 皇磯 二 図1 入院時胸骨骨髄像 低形成で 異常細胞は認められない PAIgG 177 3ng 107 cell meq 1 砂糖水試験 一 Fe 236 μg
12_モニタリングの実施に関する手順書
 12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
10,000 L 30,000 50,000 L 30,000 50,000 L 図 1 白血球増加の主な初期対応 表 1 好中球増加 ( 好中球 >8,000/μL) の疾患 1 CML 2 / G CSF 太字は頻度の高い疾患 32
 白血球増加の初期対応 白血球増加が 30,000~50,000/μL 以上と著明であれば, 白血病の可能性が高い すぐに専門施設 ( ) に紹介しよう ( 図 1) 白血球増加があれば, まず発熱など感染症を疑う症状 所見に注目しよう ( 図 1) 白血球増加があれば, 白血球分画を必ずチェックしよう 成熟好中球 ( 分葉核球や桿状核球 ) 主体の増加なら, 反応性好中球増加として対応しよう ( 図
白血球増加の初期対応 白血球増加が 30,000~50,000/μL 以上と著明であれば, 白血病の可能性が高い すぐに専門施設 ( ) に紹介しよう ( 図 1) 白血球増加があれば, まず発熱など感染症を疑う症状 所見に注目しよう ( 図 1) 白血球増加があれば, 白血球分画を必ずチェックしよう 成熟好中球 ( 分葉核球や桿状核球 ) 主体の増加なら, 反応性好中球増加として対応しよう ( 図
研究課題名 臨床研究実施計画書 研究責任者 : 独立行政法人地域医療推進機構群馬中央病院 群馬県前橋市紅雲町 1 丁目 7 番 13 号 Tel: ( 内線 )Fax: 臨床研究期間 : 年月 ~ 年月 作成日 : 年月日 ( 第 版
 臨床研究実施計画書ひな型 第 1.1 版平成 28 年 4 月 28 日 黒字 : テンプレート部分 ( ほぼそのまま使用できるもの ) 赤字 : 解説部分 ( 手引きとしての説明であり 研究実施計画書完成時には削除されるもの ) 青字 : 記載例 ( 文章や表の例であり 修飾して使用が可能なもの ) 研究課題名 臨床研究実施計画書 研究責任者 : 独立行政法人地域医療推進機構群馬中央病院 370-0025
臨床研究実施計画書ひな型 第 1.1 版平成 28 年 4 月 28 日 黒字 : テンプレート部分 ( ほぼそのまま使用できるもの ) 赤字 : 解説部分 ( 手引きとしての説明であり 研究実施計画書完成時には削除されるもの ) 青字 : 記載例 ( 文章や表の例であり 修飾して使用が可能なもの ) 研究課題名 臨床研究実施計画書 研究責任者 : 独立行政法人地域医療推進機構群馬中央病院 370-0025
岸和田徳洲会病院 当院では以下の研究に協力し情報を提供しております この研究は 国が定めた指針に基づき 対象となる患者さまのお一人ずつから直接同意を得るかわりに 研究の目的を含む研究の実施についての情報を公開しています 研究結果は学会等で発表されることがありますが その際も個人を特定する情報は公表し
 当院では以下の研究に協力し情報を提供しております この研究は 国が定めた指針に基づき 対象となる患者さまのお一人ずつから直接同意を得るかわりに 研究の目的を含む研究の実施についての情報を公開しています 研究結果は学会等で発表されることがありますが その際も個人を特定する情報は公表しません 一般社団法人日本脳神経外科学会データベース研究事業に関する研究 (JND: Japan NeurosurgicalDatabase)
当院では以下の研究に協力し情報を提供しております この研究は 国が定めた指針に基づき 対象となる患者さまのお一人ずつから直接同意を得るかわりに 研究の目的を含む研究の実施についての情報を公開しています 研究結果は学会等で発表されることがありますが その際も個人を特定する情報は公表しません 一般社団法人日本脳神経外科学会データベース研究事業に関する研究 (JND: Japan NeurosurgicalDatabase)
1-0 治験実施計画書の要約
 SGSG-005 子宮頸部非扁平上皮癌 (Ib2- II 期 ) に対する術前化学療法としての Docetaxel + Carboplatin 併用療法の有効性及び安全性に関する検討 ( 第 Ⅱ 相試験 ) 説明文書 同意書 三海婦人科スタディグループ SGSG 1) 試験目的この臨床試験の目的はドセタキセルとカルボプラチンを併用する治療法 ( 化学療法 ) の治療効果と副作用を検討することです 2)
SGSG-005 子宮頸部非扁平上皮癌 (Ib2- II 期 ) に対する術前化学療法としての Docetaxel + Carboplatin 併用療法の有効性及び安全性に関する検討 ( 第 Ⅱ 相試験 ) 説明文書 同意書 三海婦人科スタディグループ SGSG 1) 試験目的この臨床試験の目的はドセタキセルとカルボプラチンを併用する治療法 ( 化学療法 ) の治療効果と副作用を検討することです 2)
Microsoft Word - 2-① 補償ガイドライン平成27年版(本文)Ver3.1.1.do
 1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
【1
 輸血拒否患者に対するマニュアル はじめに 2008 年 2 月 日本輸血 細胞治療学会 日本麻酔科学会 日本小児科学会 日本産婦人科学会および日本外科学会の輸血治療に関与する 5 学会合同で 宗教的輸血拒否に関するガイドライン が示された 本ガイドラインは過去の宗教的輸血拒否に関係する判例等を考慮しつつ 年齢や医療に対する判断能力等を考慮したものである 特に 15 歳未満または医療に対する判断能力がない場合に
輸血拒否患者に対するマニュアル はじめに 2008 年 2 月 日本輸血 細胞治療学会 日本麻酔科学会 日本小児科学会 日本産婦人科学会および日本外科学会の輸血治療に関与する 5 学会合同で 宗教的輸血拒否に関するガイドライン が示された 本ガイドラインは過去の宗教的輸血拒否に関係する判例等を考慮しつつ 年齢や医療に対する判断能力等を考慮したものである 特に 15 歳未満または医療に対する判断能力がない場合に
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
<303491E592B BC92B08AE02E786C73>
 ( 注意 ) : 複数選択 : 単一選択 * 複数治療がある場合は 別シートをご利用下さい 担癌状態の評価 今回の血清採取時 ( 登録時または追跡調査時 ) に担癌状態 ( がんが存在する状態 ) か ( 医師への確認を はい いいえ 前提として下さい ) はい の場合( 複数回答可 ) 手術前 非根治手術後 手術不能 化学療法または放射線治療中 もしくは治療後 ホルモン療法中もしくは治療後 治療後の再燃
( 注意 ) : 複数選択 : 単一選択 * 複数治療がある場合は 別シートをご利用下さい 担癌状態の評価 今回の血清採取時 ( 登録時または追跡調査時 ) に担癌状態 ( がんが存在する状態 ) か ( 医師への確認を はい いいえ 前提として下さい ) はい の場合( 複数回答可 ) 手術前 非根治手術後 手術不能 化学療法または放射線治療中 もしくは治療後 ホルモン療法中もしくは治療後 治療後の再燃
(目的)
 計画書作成時留意点 計画書は医療関係者以外の方からも審査されます 医療関係者以外の方がみて理解でき るように配慮してください また 各項目は簡潔に記載してください 項目の幅は自由 に広げていただいて結構です 多くの研究は患者様に参加を求めるわけですから あくまで自由意思で参加する環境を 作ることが倫理性を評価するうえで大切になります 研究参加者に加わる危害をいかに 減らすか 最小限にしたときの研究参加者の受ける侵襲と研究から得られる社会的効果
計画書作成時留意点 計画書は医療関係者以外の方からも審査されます 医療関係者以外の方がみて理解でき るように配慮してください また 各項目は簡潔に記載してください 項目の幅は自由 に広げていただいて結構です 多くの研究は患者様に参加を求めるわけですから あくまで自由意思で参加する環境を 作ることが倫理性を評価するうえで大切になります 研究参加者に加わる危害をいかに 減らすか 最小限にしたときの研究参加者の受ける侵襲と研究から得られる社会的効果
第1回肝炎診療ガイドライン作成委員会議事要旨(案)
 資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
Microsoft Word _2180AMY10104_K104_1.doc
 アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
2. 転移するのですか? 悪性ですか? 移行上皮癌は 悪性の腫瘍です 通常はゆっくりと膀胱の内部で進行しますが リンパ節や肺 骨などにも転移します 特に リンパ節転移はよく見られますので 膀胱だけでなく リンパ節の検査も行うことが重要です また 移行上皮癌の細胞は尿中に浮遊していますので 診断材料や
 動物の腫瘍インフォメーション シート 4 犬の膀胱腫瘍 膀胱腫瘍とは 膀胱内貼りの粘膜から発生する腫瘍で 血尿などを起こします 犬の膀胱腫瘍のうちの多くは 移行上皮癌 ( いこうじょうひがん ) とよばれる悪性腫瘍ですが 良性の腫瘍や 慢性の膀胱炎によるポリープなどもみられることがあります 良性のものは 基本的には手術で切除すれば完治可能です ここでは 主に悪性の移行上皮癌について 検査法や治療オプションをご説明します
動物の腫瘍インフォメーション シート 4 犬の膀胱腫瘍 膀胱腫瘍とは 膀胱内貼りの粘膜から発生する腫瘍で 血尿などを起こします 犬の膀胱腫瘍のうちの多くは 移行上皮癌 ( いこうじょうひがん ) とよばれる悪性腫瘍ですが 良性の腫瘍や 慢性の膀胱炎によるポリープなどもみられることがあります 良性のものは 基本的には手術で切除すれば完治可能です ここでは 主に悪性の移行上皮癌について 検査法や治療オプションをご説明します
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
三重大学医学部附属病院臨床研究開発センター
 治験及び臨床研究における 有害事象対応マニュアル Ver 1.0 三重大学医学部附属病院 臨床研究開発センター TEL : 059-231-5246 ( 内線 :5223 6530) FAX : 059-231-5247 目次 1. 有害事象の定義... 1 2. 重篤な有害事象の定義... 1 3. 予期しない重篤な有害事象の定義... 1 4. 有害事象発生時の対応 ( 全ての有害事象 )...
治験及び臨床研究における 有害事象対応マニュアル Ver 1.0 三重大学医学部附属病院 臨床研究開発センター TEL : 059-231-5246 ( 内線 :5223 6530) FAX : 059-231-5247 目次 1. 有害事象の定義... 1 2. 重篤な有害事象の定義... 1 3. 予期しない重篤な有害事象の定義... 1 4. 有害事象発生時の対応 ( 全ての有害事象 )...
要旨 平成 30 年 2 月 21 日新潟県福祉保健部 インターフェロンフリー治療に係る診断書を作成する際の注意事項 インターフェロンフリー治療の助成対象は HCV-RNA 陽性の C 型慢性肝炎又は Child-Pugh 分類 A の C 型代償性肝硬変で 肝がんの合併のない患者です 助成対象とな
 要旨 平成 30 年 2 月 21 日新潟県福祉保健部 インターフェロンフリー治療に係る診断書を作成する際の注意事項 インターフェロンフリー治療の助成対象は HCV-RNA 陽性の C 型慢性肝炎又は Child-Pugh 分類 A の C 型代償性肝硬変で 肝がんの合併のない患者です 助成対象となる薬剤 セログループ ( ジェノタイプ ) 診断名 治療期間は以下のとおりです 薬剤名セログループ (
要旨 平成 30 年 2 月 21 日新潟県福祉保健部 インターフェロンフリー治療に係る診断書を作成する際の注意事項 インターフェロンフリー治療の助成対象は HCV-RNA 陽性の C 型慢性肝炎又は Child-Pugh 分類 A の C 型代償性肝硬変で 肝がんの合併のない患者です 助成対象となる薬剤 セログループ ( ジェノタイプ ) 診断名 治療期間は以下のとおりです 薬剤名セログループ (
Microsoft PowerPoint - 【逸脱半月板】HP募集開始150701 1930 2108 修正反映.pptx
 臨床研究 逸脱を伴う膝半月板損傷の滑膜幹細胞による治癒促進 への参加を希望される患者さんへ 本研究の対象は 半月板の逸脱を伴う膝半月板損傷 です 板の逸脱がない方は対象となりませんので ご注意ください 半月 逸脱した半月板のサイズが小さく セントラリゼーション ( 後述 ) をできない方も対象となりません 本研究の目的は滑膜幹細胞による治療の安全性の確認です この研究で安全性が確認された場合も 今後
臨床研究 逸脱を伴う膝半月板損傷の滑膜幹細胞による治癒促進 への参加を希望される患者さんへ 本研究の対象は 半月板の逸脱を伴う膝半月板損傷 です 板の逸脱がない方は対象となりませんので ご注意ください 半月 逸脱した半月板のサイズが小さく セントラリゼーション ( 後述 ) をできない方も対象となりません 本研究の目的は滑膜幹細胞による治療の安全性の確認です この研究で安全性が確認された場合も 今後
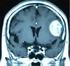
マウス脳内に形成された U87MG ヒトグリオーマや Neuro2a マウス神経芽細胞腫に対し それぞれ 1 x 10 6 pfu 単回および 2 x 10 5 pfu 2 回の腫瘍内投与を行うと G47 は G207 に比べ生存期間を延長した U87MG 対照群の生存期間中央値が 27 日であった
 マウス脳内に形成された U87MG ヒトグリオーマや Neuro2a マウス神経芽細胞腫に対し それぞれ 1 x 10 6 pfu 単回および 2 x 10 5 pfu 2 回の腫瘍内投与を行うと G47 は G207 に比べ生存期間を延長した U87MG 対照群の生存期間中央値が 27 日であったのに対し G207 治療群は 36 日 G47Δ 治療群は 42 日と有意に生存期間を延長した Neuro2a
マウス脳内に形成された U87MG ヒトグリオーマや Neuro2a マウス神経芽細胞腫に対し それぞれ 1 x 10 6 pfu 単回および 2 x 10 5 pfu 2 回の腫瘍内投与を行うと G47 は G207 に比べ生存期間を延長した U87MG 対照群の生存期間中央値が 27 日であったのに対し G207 治療群は 36 日 G47Δ 治療群は 42 日と有意に生存期間を延長した Neuro2a
別紙様式第1
 胃 MALT リンパ腫における API2-MALT1 t(11;18) 転座およびトリソミー 18 テトラソミー 18 症例の特徴に関する研究 へのご協力のお願い - 当院において胃 MALT リンパ腫と診断された方へ - 研究機関名岡山済生会総合病院 責任研究者岡山済生会総合病院消化器内科部長診療部長吉岡正雄 分担医師 岡山済生会総合病院内科医長齊藤俊介 研究主幹機関名 : 岡山大学病院 研究主幹機関責任研究者
胃 MALT リンパ腫における API2-MALT1 t(11;18) 転座およびトリソミー 18 テトラソミー 18 症例の特徴に関する研究 へのご協力のお願い - 当院において胃 MALT リンパ腫と診断された方へ - 研究機関名岡山済生会総合病院 責任研究者岡山済生会総合病院消化器内科部長診療部長吉岡正雄 分担医師 岡山済生会総合病院内科医長齊藤俊介 研究主幹機関名 : 岡山大学病院 研究主幹機関責任研究者
課題名
 急性期重度嚥下障害患者に対する完全側臥位法の有効性 研究責任者氏名長尾恭史 岡崎市民病院リハビリテーション室 副主任 共同研究者脳神経内科小林靖歯科口腔外科長尾徹看護局西嶋久美子 西暦 2017 年 6 月 15 日版数 1 目次 1. 実施計画の経緯 ( 背景 )... 1 2. 目的... 1 3. 研究対象者について... 1 3-1 選択基準... 1 3-2 除外基準... 1 3-3 中止基準...
急性期重度嚥下障害患者に対する完全側臥位法の有効性 研究責任者氏名長尾恭史 岡崎市民病院リハビリテーション室 副主任 共同研究者脳神経内科小林靖歯科口腔外科長尾徹看護局西嶋久美子 西暦 2017 年 6 月 15 日版数 1 目次 1. 実施計画の経緯 ( 背景 )... 1 2. 目的... 1 3. 研究対象者について... 1 3-1 選択基準... 1 3-2 除外基準... 1 3-3 中止基準...
診療科 血液内科 ( 専門医取得コース ) 到達目標 血液悪性腫瘍 出血性疾患 凝固異常症の診断から治療管理を含めた血液疾患一般臨床を豊富に経験し 血液専門医取得を目指す 研修日数 週 4 日 6 ヶ月 ~12 ヶ月 期間定員対象評価実技診療知識 1 年若干名専門医取得前の医師業務内容やサマリの確認
 血液内科 ( 専門医取得コース ) 血液悪性腫瘍 出血性疾患 凝固異常症の診断から治療管理を含めた血液疾患一般臨床を豊富に経験し 血液専門医取得を目指す 週 4 日 6 ヶ月 ~12 ヶ月 1 年若干名専門医取得前の医師業務内容やサマリの確認骨髄穿刺 腰椎穿刺など外来 講義 研究会発表 症例検討 教授回診骨髄採取手術 外来 17:00~ 17:30~ 移植カンファレンス カンファレンス 抄読会 骨髄スメア検鏡会
血液内科 ( 専門医取得コース ) 血液悪性腫瘍 出血性疾患 凝固異常症の診断から治療管理を含めた血液疾患一般臨床を豊富に経験し 血液専門医取得を目指す 週 4 日 6 ヶ月 ~12 ヶ月 1 年若干名専門医取得前の医師業務内容やサマリの確認骨髄穿刺 腰椎穿刺など外来 講義 研究会発表 症例検討 教授回診骨髄採取手術 外来 17:00~ 17:30~ 移植カンファレンス カンファレンス 抄読会 骨髄スメア検鏡会
Microsoft Word - *Xpert Flu検討 患者用説明書 修正.docx
 患者さんへ 自主臨床研究 全自動遺伝子解析装置におけるインフルエンザ試薬の性 能評価 についてのご説明 札幌医科大学附属病院 作成年月日 :2019 年 1 月 25 日 第 3 版 1 1. はじめに 臨床研究により新しい治療法を確立することは大学病院の使命であり 患者さんのご協力により成し遂げることができるものです 今回参加をお願いする臨床研究は 自主臨床研究 と呼ばれるもので 実際の診療に携わる医師が医学的必要性
患者さんへ 自主臨床研究 全自動遺伝子解析装置におけるインフルエンザ試薬の性 能評価 についてのご説明 札幌医科大学附属病院 作成年月日 :2019 年 1 月 25 日 第 3 版 1 1. はじめに 臨床研究により新しい治療法を確立することは大学病院の使命であり 患者さんのご協力により成し遂げることができるものです 今回参加をお願いする臨床研究は 自主臨床研究 と呼ばれるもので 実際の診療に携わる医師が医学的必要性
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
130318_CJLSG1203_●●高齢者CRFrivese
 症例選択基準:4.0. はいいいえ 病理学的に診断され 根治的胸部放射線治療不能である進行または再発非小細胞肺癌患者 初回治療で プラチナ製剤 ( カルボプラチン シスプラチン ) を含む 2 剤または 3 剤併用療法を施行された患者 初回治療開始日の年齢 70 歳以上 2010 年 1 月から 2012 年 6 月末までにプラチナ製剤を含む 2 剤または 3 剤併用療法を開始した患者 1 次治療開始前状況
症例選択基準:4.0. はいいいえ 病理学的に診断され 根治的胸部放射線治療不能である進行または再発非小細胞肺癌患者 初回治療で プラチナ製剤 ( カルボプラチン シスプラチン ) を含む 2 剤または 3 剤併用療法を施行された患者 初回治療開始日の年齢 70 歳以上 2010 年 1 月から 2012 年 6 月末までにプラチナ製剤を含む 2 剤または 3 剤併用療法を開始した患者 1 次治療開始前状況
日産婦誌58巻9号研修コーナー
 α β γ α αヘルペスウイルス単純ヘルペスウイルス 1 型 (HSV1) 性器ヘルペス単純ヘルペスウイルス 2 型 (HSV2) 水痘 帯状疱疹ウイルス (VZV) βヘルペスウイルスサイトメガロウイルス (CMV) ヒトヘルペスウイルス 6 型 (HHV6) ヒトヘルペスウイルス 7 型 (HHV7) γヘルペスウイルス EpsteinBarウイルス (EBV) ヒトヘルペスウイルス 8 型
α β γ α αヘルペスウイルス単純ヘルペスウイルス 1 型 (HSV1) 性器ヘルペス単純ヘルペスウイルス 2 型 (HSV2) 水痘 帯状疱疹ウイルス (VZV) βヘルペスウイルスサイトメガロウイルス (CMV) ヒトヘルペスウイルス 6 型 (HHV6) ヒトヘルペスウイルス 7 型 (HHV7) γヘルペスウイルス EpsteinBarウイルス (EBV) ヒトヘルペスウイルス 8 型
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
Microsoft Word - 5. 説明文書_脳内出血_ docx
 説明文書 同意文書 ~ 脂肪組織由来幹細胞を用いた脳内出血に対する臨床研究 ~ 現在 私たち ( 担当医師 ) は 患者さんの協力を得て 以下に説明す る臨床研究に取り組んでいます 今回 あなたにこの臨床研究の内容について説明させていただきます この説明文書は 私たちの説明をおぎない あなたの理解を深めるためのものですのでよくお読みになり 臨床研究にご協力いただけるかどうかご検討ください なお この臨床研究に参加するかどうかはあなたの自由です
説明文書 同意文書 ~ 脂肪組織由来幹細胞を用いた脳内出血に対する臨床研究 ~ 現在 私たち ( 担当医師 ) は 患者さんの協力を得て 以下に説明す る臨床研究に取り組んでいます 今回 あなたにこの臨床研究の内容について説明させていただきます この説明文書は 私たちの説明をおぎない あなたの理解を深めるためのものですのでよくお読みになり 臨床研究にご協力いただけるかどうかご検討ください なお この臨床研究に参加するかどうかはあなたの自由です
Microsoft Word _ソリリス点滴静注300mg 同意説明文書 aHUS-ICF-1712.docx
 患者様同意説明文書 非典型溶血性尿毒症症候群 (ahus) ソリリスの投与開始前に 医師または医療従事者から ソリリスを投与される方へ (ahus) 及び 患者安全性カード に従ってこの薬の安全性 有効性の説明 髄膜炎菌ワクチン等の接種の必要性及び患者様のデータの取扱いの説明を十分に理解できるまで受け さらにこの 患者様同意説明文書 の記載に従ってご確認ください 担当医師または医療従事者は 患者様にこの薬を投与する場合
患者様同意説明文書 非典型溶血性尿毒症症候群 (ahus) ソリリスの投与開始前に 医師または医療従事者から ソリリスを投与される方へ (ahus) 及び 患者安全性カード に従ってこの薬の安全性 有効性の説明 髄膜炎菌ワクチン等の接種の必要性及び患者様のデータの取扱いの説明を十分に理解できるまで受け さらにこの 患者様同意説明文書 の記載に従ってご確認ください 担当医師または医療従事者は 患者様にこの薬を投与する場合
BA_kanen_QA_zenpan_kani_univers.indd
 その他 B 型肝炎 15% C 型肝炎 68% 41 706 168 66 19 12 肝 には の か 脂肪肝 の で る () という も りま の く い 肝 の肝細胞のなかに 脂肪の く がこ なにたまっ いま 類洞 正常な肝臓 腸管からの栄養や不要物が流れていく 肝細胞 正常な肝臓 脂肪肝の始まり 類洞 腸管からの栄養や不要物が流れていく 類洞 過剰な脂質 糖質の流入 肝細胞 肝細胞のなかに中性脂肪がたまり始める
その他 B 型肝炎 15% C 型肝炎 68% 41 706 168 66 19 12 肝 には の か 脂肪肝 の で る () という も りま の く い 肝 の肝細胞のなかに 脂肪の く がこ なにたまっ いま 類洞 正常な肝臓 腸管からの栄養や不要物が流れていく 肝細胞 正常な肝臓 脂肪肝の始まり 類洞 腸管からの栄養や不要物が流れていく 類洞 過剰な脂質 糖質の流入 肝細胞 肝細胞のなかに中性脂肪がたまり始める
Microsoft PowerPoint - 薬物療法専門薬剤師制度_症例サマリー例_HP掲載用.pptx
 薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
検査項目情報 LDH アイソザイム ( 乳酸脱水素酵素アイソザイム ) Department of Clinical Laboratory, Kyoto University Hospital 一次サンプル採取マニュアル 生化学的検査 >> 3B. 酵素および関連物質 >> 3B05
 lactate dehydrogenase isoenzymes 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 3B055 LDHアイソザイム ( 乳酸脱水素酵素アイソザイム ) 特掲診療料 >> 検査 >> 検体検査料 >> 検体検査実施料 >> ( 生化学的検査 (Ⅰ)) 分析物 D007 15 LDアイソザイム
lactate dehydrogenase isoenzymes 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 3B055 LDHアイソザイム ( 乳酸脱水素酵素アイソザイム ) 特掲診療料 >> 検査 >> 検体検査料 >> 検体検査実施料 >> ( 生化学的検査 (Ⅰ)) 分析物 D007 15 LDアイソザイム
記録ノート(A4単ページ ) indd
 記録ノート プロフィール * 病院で聞かれたり 問診票などに記載することもあるので 事前準備としてまとめておきましょう 家族構成 ( 例を参考に描いてみましょう ) 書き方例 ( 故人 ) 夫 63 歳 ( 会社員 ) 長男 28 歳 ( 会社員 / 遠方 ) 年 月現在義母 73 歳 ( 同居 ) 本人 52 歳 ( パート ) 長女 24 歳 ( 会社員 / 同居 ) 仕事 職種趣味 好きなこと
記録ノート プロフィール * 病院で聞かれたり 問診票などに記載することもあるので 事前準備としてまとめておきましょう 家族構成 ( 例を参考に描いてみましょう ) 書き方例 ( 故人 ) 夫 63 歳 ( 会社員 ) 長男 28 歳 ( 会社員 / 遠方 ) 年 月現在義母 73 歳 ( 同居 ) 本人 52 歳 ( パート ) 長女 24 歳 ( 会社員 / 同居 ) 仕事 職種趣味 好きなこと
6. 研究対象者として選定された理由 当科を受診された各種慢性肝疾患の方が研究対象者に含まれます 7. 研究対象者に生じる利益 負担および予想されるリスクノベルジン錠の国内臨床試験に置ける安全性評価対象例 74 例中 23 例 (31.1%) に副作用が認められ 主な自覚症状では悪心 4 例 (5.
 参加者の方 ( 患者さん ) への説明文書 1. 研究課題名慢性肝疾患における 微量元素と肝障害パラメーターとの相関及び 亜鉛投与によるその臨床的意義についての検討 本研究は本学倫理委員会の承認 及び学長の許可を得て行うものです 2. 実施責任者 産業医科大学第 3 内科学教授原田大 3. 研究期間 平成 29 年 8 月から平成 32 年 4 月まで 4. 研究の背景 目的 意義亜鉛は生体組織内に広く分布し
参加者の方 ( 患者さん ) への説明文書 1. 研究課題名慢性肝疾患における 微量元素と肝障害パラメーターとの相関及び 亜鉛投与によるその臨床的意義についての検討 本研究は本学倫理委員会の承認 及び学長の許可を得て行うものです 2. 実施責任者 産業医科大学第 3 内科学教授原田大 3. 研究期間 平成 29 年 8 月から平成 32 年 4 月まで 4. 研究の背景 目的 意義亜鉛は生体組織内に広く分布し
CQ1: 急性痛風性関節炎の発作 ( 痛風発作 ) に対して第一番目に使用されるお薬 ( 第一選択薬と言います ) としてコルヒチン ステロイド NSAIDs( 消炎鎮痛剤 ) があります しかし どれが最適かについては明らかではないので 検討することが必要と考えられます そこで 急性痛風性関節炎の
 [web 版資料 1 患者意見 1] この度 高尿酸血症 痛風の治療ガイドライン の第 3 回の改訂を行うことになり 鋭意取り組んでおります 診療ガイドライン作成に患者 市民の立場からの参加 ( 関与 ) が重要であることが認識され 診療ガイドライン作成では 患者の価値観 希望の一般的傾向 患者間の多様性を反映させる必要があり 何らかの方法で患者 市民の参加 ( 関与 ) に努めるようになってきております
[web 版資料 1 患者意見 1] この度 高尿酸血症 痛風の治療ガイドライン の第 3 回の改訂を行うことになり 鋭意取り組んでおります 診療ガイドライン作成に患者 市民の立場からの参加 ( 関与 ) が重要であることが認識され 診療ガイドライン作成では 患者の価値観 希望の一般的傾向 患者間の多様性を反映させる必要があり 何らかの方法で患者 市民の参加 ( 関与 ) に努めるようになってきております
<4D F736F F D2089BB8A7797C C B B835888E790AC8C7689E6>
 2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
モニタリング計画書・報告書
 0 ... 2... 2... 2... 3 4.1.... 3 4.1.1.... 3 4.1.2.... 4 4.1.3.... 4 4.1.4.... 5 4.2.... 5 4.3.... 6 4.4.... 6... 6 5.1.... 6 5.1.1.... 7 5.1.2.... 8 5.1.3.... 9 5.1.4.... 9 5.2.... 15 5.2.1.... 15 5.2.2....
0 ... 2... 2... 2... 3 4.1.... 3 4.1.1.... 3 4.1.2.... 4 4.1.3.... 4 4.1.4.... 5 4.2.... 5 4.3.... 6 4.4.... 6... 6 5.1.... 6 5.1.1.... 7 5.1.2.... 8 5.1.3.... 9 5.1.4.... 9 5.2.... 15 5.2.1.... 15 5.2.2....
臨床試験の実施計画書作成の手引き
 臨床試験実施計画書 汗中乳酸測定システムを用いた 組織酸素代謝評価の検討 聖マリアンナ医科大学救急医学 神奈川県川崎市宮前区菅生 2-16-1 電話 :044-977-8111( 医局内線 3931) 医局 FAX:044-979-1522 責任医師森澤健一郎 kmori0079@yahoo.co.jp 臨床試験実施予定期間 : 承認後 ~ 2018 年 6 月 30 日まで 作成日 :2016 年
臨床試験実施計画書 汗中乳酸測定システムを用いた 組織酸素代謝評価の検討 聖マリアンナ医科大学救急医学 神奈川県川崎市宮前区菅生 2-16-1 電話 :044-977-8111( 医局内線 3931) 医局 FAX:044-979-1522 責任医師森澤健一郎 kmori0079@yahoo.co.jp 臨床試験実施予定期間 : 承認後 ~ 2018 年 6 月 30 日まで 作成日 :2016 年
情報提供の例
 145 ヒアルロン酸 2( 肝硬変 ) 平成 22 年 6 月 21 日新規 平成 26 年 9 月 22 日更新 平成 30 年 2 月 26 日更新 取扱い原則として 肝硬変に対するヒアルロン酸は認められない 取扱いを定めた理由 肝硬変 では 既に肝の線維化が認められるものであり ヒアルロン酸の測定は 疾患の経過観察の参考とならない 39 リウマトイド因子 (RF)
145 ヒアルロン酸 2( 肝硬変 ) 平成 22 年 6 月 21 日新規 平成 26 年 9 月 22 日更新 平成 30 年 2 月 26 日更新 取扱い原則として 肝硬変に対するヒアルロン酸は認められない 取扱いを定めた理由 肝硬変 では 既に肝の線維化が認められるものであり ヒアルロン酸の測定は 疾患の経過観察の参考とならない 39 リウマトイド因子 (RF)
豊川市民病院 バースセンターのご案内 バースセンターとは 豊川市民病院にあるバースセンターとは 医療設備のある病院内でのお産と 助産所のような自然なお産という 両方の良さを兼ね備えたお産のシステムです 部屋は バストイレ付きの畳敷きの部屋で 産後はご家族で過ごすことができます 正常経過の妊婦さんを対
 バースセンターはじめます! バースセンターって? バースセンターとは 医療設備のある病院内でのお産と 助産所のような自然なお産という両方の良さを兼ね備えたお産のシステムです 正常経過の妊婦さんを対象に お母さん 赤ちゃん ご家族の意向に沿ったお産ができるよう助産師がサポートしていきます お産に医師の立ち会いや必要以上の医療行為はありませんが 途中で異常となった場合は すぐに産科医師が立ち会います 当院では
バースセンターはじめます! バースセンターって? バースセンターとは 医療設備のある病院内でのお産と 助産所のような自然なお産という両方の良さを兼ね備えたお産のシステムです 正常経過の妊婦さんを対象に お母さん 赤ちゃん ご家族の意向に沿ったお産ができるよう助産師がサポートしていきます お産に医師の立ち会いや必要以上の医療行為はありませんが 途中で異常となった場合は すぐに産科医師が立ち会います 当院では
医療事故防止対策に関するワーキング・グループにおいて、下記の点につき協議検討する
 大阪府立病院機構医療事故公表基準 1 公表の目的この基準は 府立 5 病院における医療事故の公表に関する取り扱いについて必要な事項を定めるものとする 病院職員は 次に掲げる公表の意義を正しく認識し 医療事故防止に努めるものとする (1) 病院職員が事故原因の分析や再発防止への取組みなどの情報を共有化し 医療における安全管理の徹底を図るため 自発的に医療事故を公表していくことが求められていること (2)
大阪府立病院機構医療事故公表基準 1 公表の目的この基準は 府立 5 病院における医療事故の公表に関する取り扱いについて必要な事項を定めるものとする 病院職員は 次に掲げる公表の意義を正しく認識し 医療事故防止に努めるものとする (1) 病院職員が事故原因の分析や再発防止への取組みなどの情報を共有化し 医療における安全管理の徹底を図るため 自発的に医療事故を公表していくことが求められていること (2)
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
CJLSG1202 説明文書 間質性肺炎を合併している化学療法未治療非小細胞肺癌非扁平上皮癌に 対するペメトレキセド + カルボプラチン併用療法の臨床 II 相試験 1. はじめに当院では最新の治療を患者さんに提供するとともに 病気の原因や診断方法 治療方法および予防方法の改善に努力しています この
 説明文書 間質性肺炎を合併している化学療法未治療非小細胞肺癌非扁平上皮癌に 対するペメトレキセド + カルボプラチン併用療法の臨床 II 相試験 1. はじめに当院では最新の治療を患者さんに提供するとともに 病気の原因や診断方法 治療方法および予防方法の改善に努力しています この中には より良い治療効果を示す新しい薬を選び出すことやすでに発売されている薬を他の薬剤とうまく組み合わせて使用する方法を検討することなどがあります
説明文書 間質性肺炎を合併している化学療法未治療非小細胞肺癌非扁平上皮癌に 対するペメトレキセド + カルボプラチン併用療法の臨床 II 相試験 1. はじめに当院では最新の治療を患者さんに提供するとともに 病気の原因や診断方法 治療方法および予防方法の改善に努力しています この中には より良い治療効果を示す新しい薬を選び出すことやすでに発売されている薬を他の薬剤とうまく組み合わせて使用する方法を検討することなどがあります
外来在宅化学療法の実際
 平成20年度第1回高知医療センター 地域がん診療連携拠点病院 公開講座 食道がんの放射線 化学療法について 高知医療センター 腫瘍内科 辻 晃仁 がん薬物療法専門医 がん治療認定医 2008.7.19. 高知市 ウエルサンピア高知 レインボーホール 食道の構造 食道がんの進行 食道の内面の粘膜から発生したがんは 大きくなると粘膜下層に広がり さらにその下の筋層に入り込みます もっと大きくなると食道の壁を貫いて食道の外まで広がっていきます
平成20年度第1回高知医療センター 地域がん診療連携拠点病院 公開講座 食道がんの放射線 化学療法について 高知医療センター 腫瘍内科 辻 晃仁 がん薬物療法専門医 がん治療認定医 2008.7.19. 高知市 ウエルサンピア高知 レインボーホール 食道の構造 食道がんの進行 食道の内面の粘膜から発生したがんは 大きくなると粘膜下層に広がり さらにその下の筋層に入り込みます もっと大きくなると食道の壁を貫いて食道の外まで広がっていきます
患者さんへの説明書
 難治性 Clostridium difficile 関連下痢症 腸炎に対する糞便細菌叢移植 につきまして 1. はじめに本研究は 臨床試験のなかでも 医師主導臨床試験 に該当する試験になります 医師主導臨床試験とは医療現場でのニーズが高い医薬品や医療機器 治療法を医師が自ら医療機関の倫理委員会などに申請し 承認を受けることにより実施が可能となった試験です 本試験は滋賀医科大学消化器内科が主体となり臨床試験の計画
難治性 Clostridium difficile 関連下痢症 腸炎に対する糞便細菌叢移植 につきまして 1. はじめに本研究は 臨床試験のなかでも 医師主導臨床試験 に該当する試験になります 医師主導臨床試験とは医療現場でのニーズが高い医薬品や医療機器 治療法を医師が自ら医療機関の倫理委員会などに申請し 承認を受けることにより実施が可能となった試験です 本試験は滋賀医科大学消化器内科が主体となり臨床試験の計画
臨床研究に参加される研究対象者の方へ 皮膚症状を呈する膠原病における炎症性サイトカインの病態への関与について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さ
 臨床研究に参加される研究対象者の方へ 皮膚症状を呈する膠原病における炎症性サイトカインの病態への関与について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者群馬大学大学院医学系研究科皮膚科学茂木精一郎臨床研究責任医師群馬大学大学院医学系研究科皮膚科学茂木精一郎
臨床研究に参加される研究対象者の方へ 皮膚症状を呈する膠原病における炎症性サイトカインの病態への関与について に関する研究の説明 これは臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうか患者さんご自身の意思でお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者群馬大学大学院医学系研究科皮膚科学茂木精一郎臨床研究責任医師群馬大学大学院医学系研究科皮膚科学茂木精一郎
の主要な治療薬として日本ならびに世界で広く使用されている MTX の使用により 関節リウマチの臨床症状の改善 関節破壊進行抑制 QOL 改善のみならず 生命予後の改善や心血管合併症リスクが軽減されることが示されており 現在の関節リウマチ治療においては必要不可欠な薬剤である 1990 年前後から MT
 多施設共同研究 : 関節リウマチ患者におけるリンパ増殖性疾患に関する研究 についてのお知らせ 刀根山病院では上記の研究を実施しています この研究は代表施設東京女子医科大学附属膠原病リウマチ痛風センターの倫理審査及び当院の臨床研究審査委員会での承認を得て当院病院長の許可を得て実施しています 本研究では 研究対象者に直接文書 口頭で説明 同意をいただく必要は無いと判断していますが 情報を公開することで研究の実施について周知させていただいています
多施設共同研究 : 関節リウマチ患者におけるリンパ増殖性疾患に関する研究 についてのお知らせ 刀根山病院では上記の研究を実施しています この研究は代表施設東京女子医科大学附属膠原病リウマチ痛風センターの倫理審査及び当院の臨床研究審査委員会での承認を得て当院病院長の許可を得て実施しています 本研究では 研究対象者に直接文書 口頭で説明 同意をいただく必要は無いと判断していますが 情報を公開することで研究の実施について周知させていただいています
検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 F 凝固促進剤 + 血清分離剤 ( 青 細 ) 血液 3 ml 血清 H 凝固促進剤 + 血清分離剤 ( ピンク ) 血液 6 ml 血清 I 凝固促進剤 + 血清分離剤 ( 茶色 )
 varicella-zoster virus, viral antibody IgG 連絡先 : 3764 基本情報 5F193 水痘. 帯状ヘルペスウイルス分析物 JLAC10 診療報酬 識別 1431 ウイルス抗体 IgG 材料 023 血清 測定法 結果識別 第 2 章 特掲診療料 D012 38 グロブリンクラス別ウイルス抗体価 (1 項目当たり ) 第 3 部 検査 D012 381 ヘルペスウイルス
varicella-zoster virus, viral antibody IgG 連絡先 : 3764 基本情報 5F193 水痘. 帯状ヘルペスウイルス分析物 JLAC10 診療報酬 識別 1431 ウイルス抗体 IgG 材料 023 血清 測定法 結果識別 第 2 章 特掲診療料 D012 38 グロブリンクラス別ウイルス抗体価 (1 項目当たり ) 第 3 部 検査 D012 381 ヘルペスウイルス
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
岩手医科大学医学部及び附属病院における人を対象とする医学系研究に係るモニタリング及び監査の実施に関する標準業務手順書 岩手医科大学医学部及び附属病院における 人を対象とする医学系研究に係る モニタリング及び監査の実施に関する標準業務手順書 岩手医科大学 第 1.0 版平成 29 年 10 月 1 日
 岩手医科大学医学部及び附属病院における 人を対象とする医学系研究に係る モニタリング及び監査の実施に関する標準業務手順書 岩手医科大学 第 1.0 版平成 29 年 10 月 1 日施行 目次 1. 目的...1 2. 研究機関の長の責務...1 3. 研究責任者の責務...1 4. モニタリング担当者の責務...1 5. 監査担当者の責務...2 6. 多施設共同研究におけるモニタリング及び監査の実施について...2
岩手医科大学医学部及び附属病院における 人を対象とする医学系研究に係る モニタリング及び監査の実施に関する標準業務手順書 岩手医科大学 第 1.0 版平成 29 年 10 月 1 日施行 目次 1. 目的...1 2. 研究機関の長の責務...1 3. 研究責任者の責務...1 4. モニタリング担当者の責務...1 5. 監査担当者の責務...2 6. 多施設共同研究におけるモニタリング及び監査の実施について...2
スライド 1
 大腸がんの治療戦略と緩和医療 新病院外来化学療法室 がん診療推進室 カウンター W C W C W C 倉庫 調剤 拡大キャンサーボード 外来 外来 外来 外来 松山赤十字病院臨床腫瘍科 白石猛 本日の話題 1, 大腸がんの治療戦略 2, 切除不能大腸がんの化学療法の適応 3, 緩和医療 大腸がんの治療戦略 進行度に合わせた治療戦略 ( ガイドライン ) 1, 原発巣の評価 : CF, 注腸検査 (RAS
大腸がんの治療戦略と緩和医療 新病院外来化学療法室 がん診療推進室 カウンター W C W C W C 倉庫 調剤 拡大キャンサーボード 外来 外来 外来 外来 松山赤十字病院臨床腫瘍科 白石猛 本日の話題 1, 大腸がんの治療戦略 2, 切除不能大腸がんの化学療法の適応 3, 緩和医療 大腸がんの治療戦略 進行度に合わせた治療戦略 ( ガイドライン ) 1, 原発巣の評価 : CF, 注腸検査 (RAS
95_財団ニュース.indd
 NO. 95 平成 21 年 7 月 1 日発行 No.95 日本リウマチ財団ニュース 表 1 ACR-EULAR 関節リウマチ診断基準 分類基準 試案 eular 2009, 岡田正人 訳 上を診断とするかはこれから決 score 0 22 34 定され また この項目と点数 0 6 印象も受けるが 時代とともに PIP,MCP,MTP, 手関節 4箇所以上非対称性 4箇所以上対称性 10
NO. 95 平成 21 年 7 月 1 日発行 No.95 日本リウマチ財団ニュース 表 1 ACR-EULAR 関節リウマチ診断基準 分類基準 試案 eular 2009, 岡田正人 訳 上を診断とするかはこれから決 score 0 22 34 定され また この項目と点数 0 6 印象も受けるが 時代とともに PIP,MCP,MTP, 手関節 4箇所以上非対称性 4箇所以上対称性 10
標準業務手順 目次
 浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
130724放射線治療説明書.pptx
 放射線治療について 要約 局所腫瘍の治療効果は 手術 > 放射線治療 > 化学療法 の順です 手術を行うことが難しい場合 放射線治療が候補になります 動物の放射線治療は全身麻酔が必要です 一般に 照射回数を多くした方が腫瘍の制御効果が高いといわれています 症状緩和効果は70~80% で得られます 効果の確実な予測はできません 1ヵ月以内に照射を終える必要があります 欠点として 放射線障害や全身麻酔のリスクを伴います
放射線治療について 要約 局所腫瘍の治療効果は 手術 > 放射線治療 > 化学療法 の順です 手術を行うことが難しい場合 放射線治療が候補になります 動物の放射線治療は全身麻酔が必要です 一般に 照射回数を多くした方が腫瘍の制御効果が高いといわれています 症状緩和効果は70~80% で得られます 効果の確実な予測はできません 1ヵ月以内に照射を終える必要があります 欠点として 放射線障害や全身麻酔のリスクを伴います
日本内科学会雑誌第98巻第12号
 表 1. 喘息の長期管理における重症度対応段階的薬物療法 重症度 長期管理薬 : 連用 : 考慮 発作時 ステップ 1 軽症間欠型 喘息症状がやや多い時 ( 例えば 1 月に 1 ~2 回 ), 血中 喀痰中に好酸球増加のある時は下記のいずれか 1 つの投与を考慮 吸入ステロイド薬 ( 最低用量 ) テオフィリン徐放製剤 ロイコトリエン拮抗薬 抗アレルギー薬 短時間作用性吸入 β2 刺激薬または短時間作用性経口
表 1. 喘息の長期管理における重症度対応段階的薬物療法 重症度 長期管理薬 : 連用 : 考慮 発作時 ステップ 1 軽症間欠型 喘息症状がやや多い時 ( 例えば 1 月に 1 ~2 回 ), 血中 喀痰中に好酸球増加のある時は下記のいずれか 1 つの投与を考慮 吸入ステロイド薬 ( 最低用量 ) テオフィリン徐放製剤 ロイコトリエン拮抗薬 抗アレルギー薬 短時間作用性吸入 β2 刺激薬または短時間作用性経口
第71巻5・6号(12月号)/投稿規定・目次・表2・奥付・背
 μ μ μ μ μ γ 1 4 3 クリゾチニブが奏効した PS 不良 ALK 肺癌の1例 図2 入院時胸部 CT a 左鎖骨上窩 縦隔リンパ節腫大を認めた 矢印 b 左腕頭静脈から上大静脈内まで続く血栓 を認めた 矢印 c 左下葉に腫瘤影を認めた d 右肺に内部に空洞を伴う結節影を多数認めた 矢印 率は蛍光 in situ ハイブリダイゼーション FISH 法で 6 8 1 5 であり ALK 蛋白の免疫組織化学染色
μ μ μ μ μ γ 1 4 3 クリゾチニブが奏効した PS 不良 ALK 肺癌の1例 図2 入院時胸部 CT a 左鎖骨上窩 縦隔リンパ節腫大を認めた 矢印 b 左腕頭静脈から上大静脈内まで続く血栓 を認めた 矢印 c 左下葉に腫瘤影を認めた d 右肺に内部に空洞を伴う結節影を多数認めた 矢印 率は蛍光 in situ ハイブリダイゼーション FISH 法で 6 8 1 5 であり ALK 蛋白の免疫組織化学染色
検査項目情報 6475 ヒト TARC 一次サンプル採取マニュアル 5. 免疫学的検査 >> 5J. サイトカイン >> 5J228. ヒトTARC Department of Clinical Laboratory, Kyoto University Hospital Ver.6 thymus a
 thymus and activation-regulated chemokine 連絡先 : 3764 基本情報 5J228 ヒトTARC 分析物 JLAC10 診療報酬 識別 材料 023 血清 測定法 052 化学 生物発光イムノアッセイ (CLEIA) 結果識別 第 2 章 特掲診療料 D015 19 TARC 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 免疫学的検査
thymus and activation-regulated chemokine 連絡先 : 3764 基本情報 5J228 ヒトTARC 分析物 JLAC10 診療報酬 識別 材料 023 血清 測定法 052 化学 生物発光イムノアッセイ (CLEIA) 結果識別 第 2 章 特掲診療料 D015 19 TARC 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 免疫学的検査
後天性血友病アンケート(Homepage用)
 北海道医療大学歯学部倫理審査承認番号第 149 号 研究課題 北海道における後天性血友病診療の実態把握に関する研究 ------------------------------------------------------------------------------------------------------ 本研究に関与する医師および患者様へ 後天性血友病は 各種凝固因子に対する自己抗体により重篤な出血症状を呈する難治性疾患です
北海道医療大学歯学部倫理審査承認番号第 149 号 研究課題 北海道における後天性血友病診療の実態把握に関する研究 ------------------------------------------------------------------------------------------------------ 本研究に関与する医師および患者様へ 後天性血友病は 各種凝固因子に対する自己抗体により重篤な出血症状を呈する難治性疾患です
がん化学(放射線)療法レジメン申請書
 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2017 年 8 月 17 日受付番号 772 診療科名がん腫 ( コード ) * 診療科長名レジメン登録ナンバー * 申請医師名登録申請日 2017 年 8 月 17 日 審査区 ( 下記をチェックしてください ) 登録確認日 * 通常審査を希望 登録削除日 * 迅速審査を希望 注
がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2017 年 8 月 17 日受付番号 772 診療科名がん腫 ( コード ) * 診療科長名レジメン登録ナンバー * 申請医師名登録申請日 2017 年 8 月 17 日 審査区 ( 下記をチェックしてください ) 登録確認日 * 通常審査を希望 登録削除日 * 迅速審査を希望 注
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
方法について教えてください A 妊娠中の接種に関する有効性および安全性が確立されていないため 3 回接種を完了する前に妊娠していることがわかった場合には一旦接種を中断し 出産後に残りの接種を行うようにしてください 接種が中断しても 最初から接種し直す必要はありません 具体的には 1 回目接種後に妊娠
 子宮予防ワクチン接種にかかる Q アンド A 参考 : HPV : ヒトパピローマウイルスのこと Q1 HPV ワクチンが最も効果的と考えられる対象は誰でしょうか A HPV の主な感染ルートは性的接触であるため 初交前の年代 ( 多くは 10 歳から 14 歳 ) が最も効果的と考えられています 日本産婦人科学会 日本小児科学会 日本婦人科腫瘍学会 日本産婦人科医会などから 11~14 歳の女児での接種が推奨されています
子宮予防ワクチン接種にかかる Q アンド A 参考 : HPV : ヒトパピローマウイルスのこと Q1 HPV ワクチンが最も効果的と考えられる対象は誰でしょうか A HPV の主な感染ルートは性的接触であるため 初交前の年代 ( 多くは 10 歳から 14 歳 ) が最も効果的と考えられています 日本産婦人科学会 日本小児科学会 日本婦人科腫瘍学会 日本産婦人科医会などから 11~14 歳の女児での接種が推奨されています
第2次JMARI報告書
 3 肝胆管系または膵臓の悪性腫瘍 6 5 4 3 2 症例数 : 3 平均在院日数 ( 加重平均 : 29.7 最長入院日数 : 579 変動係数 : 1.134 標準偏差 : 33.5423 症例数 : 155 平均在院日数 ( 加重平均 : 42.8 最長在院日数 : 465 変動係数 : 1.11 標準偏差 : 47.94 症例数 : 平均在院日数 ( 加重平均 : 39.5 最短入院日数 :
3 肝胆管系または膵臓の悪性腫瘍 6 5 4 3 2 症例数 : 3 平均在院日数 ( 加重平均 : 29.7 最長入院日数 : 579 変動係数 : 1.134 標準偏差 : 33.5423 症例数 : 155 平均在院日数 ( 加重平均 : 42.8 最長在院日数 : 465 変動係数 : 1.11 標準偏差 : 47.94 症例数 : 平均在院日数 ( 加重平均 : 39.5 最短入院日数 :
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果
 2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
 新しい概念に基づく第 3 世代のがん免疫治療 inkt がん治療 inkt Cancer Therapy 監修 : 谷口克先生株式会社アンビシオン inktがん治療 これまでのがん治療の最大の問題であるがんの進行 再発 転移 この問題を克服することを 目指し 新しい概念に基づく第3世代のがん免疫治療である inktがん治療 が開発されました inktがん治療 は 患者末梢血細胞を加工して作った オーダーメイドがんワクチン
新しい概念に基づく第 3 世代のがん免疫治療 inkt がん治療 inkt Cancer Therapy 監修 : 谷口克先生株式会社アンビシオン inktがん治療 これまでのがん治療の最大の問題であるがんの進行 再発 転移 この問題を克服することを 目指し 新しい概念に基づく第3世代のがん免疫治療である inktがん治療 が開発されました inktがん治療 は 患者末梢血細胞を加工して作った オーダーメイドがんワクチン
治療を受けられる患者様へのご説明 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) について 仙台画像検診クリニック 宮城県仙台市青葉区五橋 TEL: この説明文書は 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) ( 以下 ハイパ
 治療を受けられる患者様へのご説明 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) について 仙台画像検診クリニック 宮城県仙台市青葉区五橋 2-1-25 TEL:022-211-9877 この説明文書は 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) ( 以下 ハイパー DC 療法 ) による治療を勧められた患者様が この治療法を受けられるに際して 知っておいていただきたいことを文書にしたものです
治療を受けられる患者様へのご説明 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) について 仙台画像検診クリニック 宮城県仙台市青葉区五橋 2-1-25 TEL:022-211-9877 この説明文書は 自家樹状細胞がんワクチン複合療法 ( ハイパー DC 療法 ) ( 以下 ハイパー DC 療法 ) による治療を勧められた患者様が この治療法を受けられるに際して 知っておいていただきたいことを文書にしたものです
臨床研究実施計画書
 心臓超音波検査を用いた臨床研究について 御理解 御協力いただける方へ 心エコー図法による心不全患者の予後予測に 関する研究 に関する説明 これは心臓超音波検査の所見の一部を用いた臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうかお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者 群馬大学医学部附属病院循環器内科
心臓超音波検査を用いた臨床研究について 御理解 御協力いただける方へ 心エコー図法による心不全患者の予後予測に 関する研究 に関する説明 これは心臓超音波検査の所見の一部を用いた臨床研究への参加についての説明文書です 本臨床研究についてわかりやすく説明しますので 内容を十分ご理解されたうえで 参加するかどうかお決め下さい また ご不明な点などがございましたら遠慮なくご質問下さい 臨床研究代表者 群馬大学医学部附属病院循環器内科
Microsoft Word - 03 大腸がんパス(H30.6更新).doc
 地域連携手帳 ( 京都府統一版 ) 名前 ( ふりがな ) ( ) 生 明 大 昭 平 大腸がん地域連携手帳 ( 京都府統一版 ) 目次 地域連携手帳とは 1 連携手帳を用いた診療の流れ 2 連携手帳の使い方について 3 連携手帳使用に係る説明書 同意書 4 わたしのプロフィール 6 氏名 医療機関等 既往歴 アレルギー 内服薬等 手術記録 その他特記事項( 連携時 ) 診察 検査予定表 10 特記事項
地域連携手帳 ( 京都府統一版 ) 名前 ( ふりがな ) ( ) 生 明 大 昭 平 大腸がん地域連携手帳 ( 京都府統一版 ) 目次 地域連携手帳とは 1 連携手帳を用いた診療の流れ 2 連携手帳の使い方について 3 連携手帳使用に係る説明書 同意書 4 わたしのプロフィール 6 氏名 医療機関等 既往歴 アレルギー 内服薬等 手術記録 その他特記事項( 連携時 ) 診察 検査予定表 10 特記事項
2009年8月17日
 医師 2,000 人超の調査結果を多数掲載中です https://www.facebook.com/medpeer 2013 年 8 月 1 日 メドピア株式会社 マイコプラズマ感染症診断における迅速診断キットの使用状況 について 半数以上はキットを使用していない 医師約 6 万人が参加する医師専用サイト MedPeer ( メドピア https://medpeer.jp/) を運営するメドピア 株式会社
医師 2,000 人超の調査結果を多数掲載中です https://www.facebook.com/medpeer 2013 年 8 月 1 日 メドピア株式会社 マイコプラズマ感染症診断における迅速診断キットの使用状況 について 半数以上はキットを使用していない 医師約 6 万人が参加する医師専用サイト MedPeer ( メドピア https://medpeer.jp/) を運営するメドピア 株式会社
<955C8E862E657073>
 メ モ 目次 地域連携クリテイカルパスについて手帳の使い方定期検診の検査と必要性術後の注意患者さん基本情報診療計画表 役割分担表診療経過 ( 連携医情報 ) 診療経過 ( 専門病院情報 ) 2 3 4 5 6 8 12 32 ー 1 ー 地域連携クリテイカルパスについて 地域連携クリテイカルパスは がんの診断 治療 定期的な検査などの診療を 複数の医療機関 ( 専門病院と地域のかかりつけ連携診療所
メ モ 目次 地域連携クリテイカルパスについて手帳の使い方定期検診の検査と必要性術後の注意患者さん基本情報診療計画表 役割分担表診療経過 ( 連携医情報 ) 診療経過 ( 専門病院情報 ) 2 3 4 5 6 8 12 32 ー 1 ー 地域連携クリテイカルパスについて 地域連携クリテイカルパスは がんの診断 治療 定期的な検査などの診療を 複数の医療機関 ( 専門病院と地域のかかりつけ連携診療所
