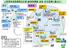
PMDA の概要 セイフティトライアングル 3 つの業務による総合的なリスクマネジメント 3 つの役割を一体として行う世界で唯一の公的機関として レギュラトリーサイエンスに基づき より安全でより品質のよい製品をより早く医療現場に届け 医療水準の向上に貢献する 2
|
|
|
- ひろき このえ
- 5 years ago
- Views:
Transcription
1 PMDA の中期計画と臨床研究中核病院等との 人材交流について 独立行政法人医薬品医療機器総合機構 Pharmaceuticals and Medical Devices Agency ( PMDA ) 理事 ( 技監 ) 北條泰輔 2015 年 3 月 4 日革新的医療技術創出拠点プロジェクト合同会議
2 PMDA の概要 セイフティトライアングル 3 つの業務による総合的なリスクマネジメント 3 つの役割を一体として行う世界で唯一の公的機関として レギュラトリーサイエンスに基づき より安全でより品質のよい製品をより早く医療現場に届け 医療水準の向上に貢献する 2
3 PMDA の人員体制の推移 (1,065) 経済成長戦略大綱 革新的医薬品 医療機器創出のための 5 カ年戦略 319 医療機器の審査迅速化アクションプログラム 薬害肝炎検証検討委員会中間まとめ
4 承認件数と審査期間 新医薬品新医療機器 ( 月 ) ( 件数 ) ( 月 ) ( 件数 ) 年度 22 年度 23 年度 24 年度 25 年度 年度 22 年度 23 年度 24 年度 25 年度 承認件数優先審査品目通常審査品目 承認件数優先審査品目通常審査品目
5 世界第一級の審査 安全対策機関を目指して 主要課題 対応策 ~PMDA 第 3 期中期計画の主な項目 ~ 審査ラグ 0 の実現開発ラグ解消の支援 審査の更なる迅速化 ( 承認の予見性も向上 ) 再生医療等製品の特別な早期承認制度の導入 相談業務の大幅拡充 ( 薬事戦略相談の拡充 ) 事前評価の拡充 ( 承認審査の実質的前倒し ) 有望なシーズの実用化促進 企業向け開発相談の拡充等 安全対策強化 リスク管理計画導入への対応 再生医療製品や埋植型医療機器等のレジストリの構築 医療情報データベースの利活用 欧米と同等の電子申請データを活用した次世代審査体制の構築 日本再興戦略健康 医療戦略などの社会的要請に対応 大前提 : 欧米並の体制と優秀な人材の確保 [751 人 1065 人 ] 参考 医薬品 医療機器規制当局の審査 安全対策関係人員の国際比較注 1) 日本米国欧州 PMDA 注 2) / 厚生労働省 636 人 [2013.4] 革新的な医療機器への審査の重点化 食品医薬品庁 (FDA) 約 5,400 人 [2010] 欧州医薬品庁 (EMA) 約 750 人 [2011] 主なEU 加盟規制当局英国 : 約 900 人ドイツ : 約 1,050 人 注 1) 各組織の所掌範囲は異なるので, 単純比較には限界がある. 注 2) PMDA の全職員数は 708 人 [2013.4]
6 電子申請データを活用した次世代審査体制の構築
7 医療情報データベース基盤整備事業 医療情報データベース拠点を全国 10 カ所の大学病院 グループ病院等に構築 各医療機関へのシステム導入を終了し 現在 データの検証作業を実施中 < 事業への期待 > 安全対策への活用により 迅速で的確な安全対策へ ( 例 : 副作用発生割合把握 リスク評価 安全対策の効果の評価等 ) 協力医療機関 ( 大学及びグループ病院の拠点 10 ヵ所 ) 拠点医療グループ連携医療機関 九州大学佐賀大学 PMDA や研究者による活用 10 医療機関を拠点としてデータの検索 調査を行い 副作用を分析 評価 徳洲会 ( グループ ) 東北大学 NTT 病院 ( グループ ) 東京大学 香川大学 浜松医科大学 千葉大学 北里大学 ( グループ )
8 薬事戦略相談の拡充 ( 医薬品医療機器等法 再生医療新法施行を踏まえた開発ラグ解消支援 ) ドラッグラグ デバイスラグのうち審査ラグは 25 年度までにほぼ解消開発ラグ解消支援として 薬事戦略相談をさらに拡充 開発ロードマップの信頼性向上により アカデミア等の開発を容易に 1 開発全体のロードマップや試験計画の一般的な考え方 進め方に対する助言を開始 アカデミアが主導する臨床試験の促進に寄与 2 アカデミア主導の検証的試験プロトコルへの助言を開始 1 ロードマップへの助言 青 : 現行の範囲赤 : 拡充の範囲 基礎研究 有望なシーズ 品質試験 非臨床試験 シーズから製品へ橋渡し 臨床試験探索的試験 2 検証的試験 実用化 革新的医薬品医療機器再生医療等製品 日本医療研究開発機構と連携しつつ 薬事戦略相談等を通じて PMDA も出口戦略の策定支援等に積極的に関与 8
9 PMDA と創薬支援ネットワークとの連携 創薬支援ネットワーク 日本医療研究開発機構 創薬支援戦略室 連携 PMDA 指揮監督 理化学研究所産業技術総合研究所創薬連携研究機関大学 民間研究機関等 報告 PMDA( 東京 ) PMDA 関西支部 ( 大阪 ) 基礎研究 疾病の本態解明等理論 知識の探求 応用研究 具体的目標 ( 疾患治療等 ) のもと実用化や応用に向けた研究 探索研究最適化研究非臨床試験 開発研究 医師主導治験 申請 審査 薬事承認 保険適用 臨床現場製造販売後調査 創薬支援ネットワーク 1. 基礎 応用研究戦略の策定 助言 2. 有望シーズの収集 評価 選定 3. 共同研究機関 試験実施機関の紹介 4. 応用研究 開発研究の支援 5. 企業 ( 製薬企業 ) への導出 提携 ライセンスアウト支援 PMDA 薬事戦略相談 1. 開発ロードマップの作成 2. 品質に関する助言 3. 非臨床試験に関する助言 4. 臨床試験に関する助言
10 レギュラトリーサイエンスの推進 ips 細胞等の再生医療製品革新的な医薬品最先端の医療機器 開発承認審査製造販売後 最先端技術製品 有望なシーズ 薬事戦略相談有望なシーズを開発の次段階に結びつける支援 革新的医薬品等実用化促進事業アカデミアとの人材交流最先端技術の評価方法の確立を支援 人材を育成 科学委員会国内トップクラスのアカデミアとの連携を強化し 最先端技術への対応を検討 医療情報データベース基盤整備事業 安全対策の充実 連携大学院 PMDA の業務に関連した研究の実施 レギュラトリーサイエンスを推進するために増員等による体制強化が必要 相談 審査等の質向上 開発ラグの短縮 イノベーションの実用化支援 世界に先駆けた最先端医療の実用化
11 革新的医薬品 医療機器 再生医療製品実用化促進事業 ( 平成 24,25 年度厚生労働省予算事業 ) 最先端の技術を研究している大学等におけるレギュラトリーサイエンスを基盤とした安全性と有効性の評価法の確立を支援 大学等と 国立医薬品食品衛生研究所 (NIHS) 医薬品医療機器総合機構 (PMDA) 等との間で人材交流を行い レギュラトリーサイエンスに精通した人材を育成 医薬品医療機器総合機構 国立医薬品食品衛生研究所 革新的技術の習得 審査等の迅速化 質の向上 人材交流による人材育成の推進 審査員の出向 ( 派遣 ) 研究者の受入 研究等の成果 大学等医療機関等研究機関 レギュラトリーサイエンスに精通した人材の育成 適切な研究開発の促進 基準 ガイドライン等の早期作成 革新的な技術の実用化促進 ( ドラッグラグ デバイスラグの解消 ) 医薬品分野 医療機器分野再生医療製品分野平成 25 年度新規採択 大阪大学大学院薬学研究科大阪大学大学院医学系研究科 国立循環器病研究センター 九州大学大学院医学研究院 先端医療振興財団 独立行政法人理化学研究所 北海道大学大学院薬学研究院北海道大学大学院医学研究科 京都大学大学院医学研究科京都大学 ips 細胞研究所 三重大学医学部附属病院 名古屋市立大学大学院薬学研究科 筑波大学医学医療系 東京大学医科学研究所東京大学医学部附属病院東京大学大学院工学系研究科 計 24 研究機関 ( 平成 25 年 5 月現在 ) 東北大学大学院薬学研究科東北大学大学院医工学研究科 国立がん研究センター中央病院国立がん研究センター東病院 千葉大学大学院医学研究院早稲田大学先端生命医科学センター 国立成育医療研究センター病院国立成育医療研究センター
12 連携大学院制度 PMDAの職員が社会人入学の形で大学院生となる又は大学院生が修学職員となり PMDAの業務に従事しつつ PMDA 業務に関連した研究を行うことにより 学位取得を目指す制度 19 大学と協定締結 ( 平成 27 年 2 月 1 日現在 ) 連携教授等の配置 職員又は修学職員 医学系 日本で最初に RS の正式講座を作った大学 平成 22 年 7 月 北海道大学 連携 連携大学院協定等の締結 PMDA 業務に関連した研究 薬学系 工学系 京都薬科大学 岐阜薬科大学 岐阜大学 山形大学 金沢大学 筑波大学 千葉大学 大学院 学位取得 大阪 大学 帝京大学 熊本大学 岡山大学 神戸大学 名古屋大学 名古屋市立大学 武蔵野大学横浜市立大学 就実大学 静岡県立大学 12
13 臨床研究中核病院の承認要件について 概要 医療法第四条の三に規定されている臨床研究中核病院の承認要件について 能力 施設 人員 の観点から検討 実施体制 能力要件 ( 四条の三第一項第一号 ~ 第四号, 第十号 ) 実績 ( 別紙参照 ) ( 参考 ) 法律上の規定 施設要件 ( 四条の三第一項第五号 六号 八号 九号 ) 人員要件 ( 四条の三第一項第七号 ) 不適正事案の防止等のための管理体制の整備 病院管理者の権限及び責任を明記した規程等の整備 病院管理者を補佐するための会議体の設置 取組状況を監査する委員会の設置 * 上記の他 申請時に過去の不適正事案の調査 再発防止策の策定等の義務づけ 以下の体制について担当部門 責任者の設置 手順書の整備等を規定 臨床研究支援体制 データ管理体制 安全管理体制 倫理審査体制 利益相反管理体制 知的財産管理 技術移転体制 国民への普及 啓発及び研究対象者への相談体制 自ら行う特定臨床研究の実施件数 論文数 主導する多施設共同の特定臨床研究の実施件数 他の医療機関が行う特定臨床研究に対する支援件数 特定臨床研究を行う者等への研修会の開催件数 Ⅰ 特定臨床研究に関する計画を立案し実施する能力 Ⅱ 他の医療機関と共同して特定臨床研究を行う場合に主導的な役割を果たす能力 Ⅲ 他の医療機関が行う特定臨床研究の援助を行う能力 Ⅳ 特定臨床研究に関する研修を行う能力 診療科 10 以上 病床数 400 以上 技術能力について外部評価を受けた臨床検査室 特定機能病院の要件を参考に設定 臨床研究支援 管理部門に所属する人員数 医師 歯科医師 薬剤師 看護師 臨床研究コーディネーター データマネージャー 生物統計家 薬事承認審査機関経験者 5 人 10 人 15 人 12 人 3 人 2 人 1 人 平成 23 年度に選定された 5 拠点の整備状況を参考に設定 13
14 具体的業務 PMDA では 医薬品 医療機器等の有効性 安全性 品質に関する承認審査 市販後の安全対策 医薬品による健康被害の救済を三大業務として実施 医薬品 医療機器等の審査相談 GCP 信頼性調査 医薬品副作用の評価 医療機器不具合の評価 医薬品副作用の詳細評価 安全対策の立案
15 出向元機関 ( 最近の例 ) 医師 歯科医師 薬剤師 国立病院機構高﨑総合医療センター 群馬大学 自治医科大学 国立病院機構仙台医療センター 工学系 浜松医科大学 東北大学 金沢大学 大阪大学大阪市立大学 筑波大学 国立病院機構岡山医療センター 国立がん研究センター ( 東 ) 岡山大学 千葉大学 九州大学 広島大学 国立がん研究センター ( 中央 ) 国立国際医療研究センター 熊本大学高知大学 国立病院機構名古屋医療センター名古屋市立大学大学院藤田保健衛生大学病院神戸市立医療センター中央市民病院 横浜市立大学 国立成育医療研究センター国立精神 神経医療研究センター東京医科歯科大学北里大学昭和大学 神戸大学 15
16 採用に関するお問い合わせ先 独立行政法人 医薬品医療機器総合機構総務部人事調整役大澤
再生医療の制度的な対応の検討について 薬事法等制度改正についてのとりまとめ平成 24 年 1 月 24 日厚生科学審議会医薬品制度改正部会 1 再生医療製品については 今後も 臓器機能の再生等を通じて 重篤で生命を脅かす疾患等の治療等に ますます重要な役割を果たすことが期待される 特に ips 細胞
 薬事戦略相談について ( 事業の概要等 ) 日本発の革新的な医薬品 医療機器の創出に向け 有望なシーズを持つ大学 研究機関 ベンチャー企業を主な対象として 開発初期から必要な試験 治験に関する指導 助言を実施するものとして 平成 23 年 7 月 1 日より開始した 基礎研究から実用化に向けては様々な課題があり 課題解決に向けた審査当局との早期相談が重要である 例えば 品質のデータや毒性データ等を適切に実施していない場合
薬事戦略相談について ( 事業の概要等 ) 日本発の革新的な医薬品 医療機器の創出に向け 有望なシーズを持つ大学 研究機関 ベンチャー企業を主な対象として 開発初期から必要な試験 治験に関する指導 助言を実施するものとして 平成 23 年 7 月 1 日より開始した 基礎研究から実用化に向けては様々な課題があり 課題解決に向けた審査当局との早期相談が重要である 例えば 品質のデータや毒性データ等を適切に実施していない場合
医学にとって薬事とは 医療等に提供される医薬品 医療機器等 の品質 有効性 安全性の確保の為の 規制や 新薬 医療機器の研究開発を促 進の為の必要な措置を講ずることにより 保健衛生の向上を図ることにある ここでは 常に信頼性確認が求められる 医療 :Individual Medicine (Heal
 医薬品 医療機器レギュレーション 独立行政法人医薬品医療機器総合機構 Pharmaceuticals and Medical Devices Agency ( PMDA ) 理事長近藤達也 2012 年 12 月 13 日第 4 回レギュラトリーサイエンス学会シンポジウム 医学にとって薬事とは 医療等に提供される医薬品 医療機器等 の品質 有効性 安全性の確保の為の 規制や 新薬 医療機器の研究開発を促
医薬品 医療機器レギュレーション 独立行政法人医薬品医療機器総合機構 Pharmaceuticals and Medical Devices Agency ( PMDA ) 理事長近藤達也 2012 年 12 月 13 日第 4 回レギュラトリーサイエンス学会シンポジウム 医学にとって薬事とは 医療等に提供される医薬品 医療機器等 の品質 有効性 安全性の確保の為の 規制や 新薬 医療機器の研究開発を促
次 Ⅰ. 総論 2 Ⅱ. 重点分野 3 Ⅲ. 人材育成 確保 6 Ⅳ. 情報管理 8 Ⅴ. その他 9 1
 平成 27 年 5 月 27 日第 9 回健康 医療戦略専門調査会提出資料 資料 12-2 医療分野研究開発推進計画 の実行状況に係る助言と今後の対応について 平成 27 年 5 月 27 日内閣官房健康 医療戦略室文部科学省厚生労働省経済産業省 次 Ⅰ. 総論 2 Ⅱ. 重点分野 3 Ⅲ. 人材育成 確保 6 Ⅳ. 情報管理 8 Ⅴ. その他 9 1 Ⅰ. 総論 1. 平成 26 年度の取組状況に関する主な評価
平成 27 年 5 月 27 日第 9 回健康 医療戦略専門調査会提出資料 資料 12-2 医療分野研究開発推進計画 の実行状況に係る助言と今後の対応について 平成 27 年 5 月 27 日内閣官房健康 医療戦略室文部科学省厚生労働省経済産業省 次 Ⅰ. 総論 2 Ⅱ. 重点分野 3 Ⅲ. 人材育成 確保 6 Ⅳ. 情報管理 8 Ⅴ. その他 9 1 Ⅰ. 総論 1. 平成 26 年度の取組状況に関する主な評価
ことを通じて (1) 国民が 世界最先端の医薬品 医療機器 再生医療等製品の恩恵を受けることができるよう これらをより早く安全に医療現場に届けるための審査等業務 (2) 世界最先端の医薬品等が海外での使用経験なく我が国の医療現場で使用される状況を想定し 保健衛生上の危害発生の防止 発生時の的確かつ迅
 資料 6 平成 30 年 10 月 17 日 ( 独 ) 医薬品医療機器総合機構 第 4 期中期計画の方向性について ( 案 ) Ⅰ. 第 4 期中期計画の基本的考え方 当機構は 医薬品の副作用による健康被害を迅速に救済するとともに 医薬品 医療機器等の品質 有効性及び安全性を確保するための審査及び安全対策の体制を拡充強化することを目的として 平成 16 年 4 月に発足した 平成 20 年度には
資料 6 平成 30 年 10 月 17 日 ( 独 ) 医薬品医療機器総合機構 第 4 期中期計画の方向性について ( 案 ) Ⅰ. 第 4 期中期計画の基本的考え方 当機構は 医薬品の副作用による健康被害を迅速に救済するとともに 医薬品 医療機器等の品質 有効性及び安全性を確保するための審査及び安全対策の体制を拡充強化することを目的として 平成 16 年 4 月に発足した 平成 20 年度には
の連携による明確な出口戦略を持って NCを含む臨床研究中核病院などの 拠点 及びそのネットワークが中心となり 拠点外シーズ 拠点外施設も含め all Japan 体制で効率的に研究開発が進められる環境作り ( 1~3) を目指す 1 このような環境が整うことのメリットとしては 我が国における医薬品等
 AMED による橋渡し研究 臨床研究 治験の推進について ( 別紙 ) 臨床研究 治験基盤事業部 1. 基本的考え方 方向性 ( 別添イメージ図参照 ) 〇 AMEDが設立されたことを受け 有望シーズの治験や臨床研究については AMEDとして同一組織となった創薬支援戦略部 戦略推進部 産学連携部 知的財産部と連携しつつ また PMDAともよく連携しながら 橋渡し研究から研究者主導治験等の実施 仲介
AMED による橋渡し研究 臨床研究 治験の推進について ( 別紙 ) 臨床研究 治験基盤事業部 1. 基本的考え方 方向性 ( 別添イメージ図参照 ) 〇 AMEDが設立されたことを受け 有望シーズの治験や臨床研究については AMEDとして同一組織となった創薬支援戦略部 戦略推進部 産学連携部 知的財産部と連携しつつ また PMDAともよく連携しながら 橋渡し研究から研究者主導治験等の実施 仲介
臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美
 臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美 本日の Agenda 1. 臨床評価とは 2. 医療機器の特性を踏まえた有効性 安全性評価 3. 各国の規制の違い 4. 臨床評価報告書について 5. 臨床評価報告書の概念 6. 臨床研究と治験の違いは? 7. 文献評価の問題点 8. 治験活性化にむけて 臨床評価 とは そのものの有効性と安全性をヒトで評価すること 自己認証の欧州から出てきた概念
臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美 本日の Agenda 1. 臨床評価とは 2. 医療機器の特性を踏まえた有効性 安全性評価 3. 各国の規制の違い 4. 臨床評価報告書について 5. 臨床評価報告書の概念 6. 臨床研究と治験の違いは? 7. 文献評価の問題点 8. 治験活性化にむけて 臨床評価 とは そのものの有効性と安全性をヒトで評価すること 自己認証の欧州から出てきた概念
医薬品 医療機器の開発ステージと PMDA 審査関連業務 研究開発 非臨床試験 臨床試験 ( 治験 ) 承認申請 承認 市販 相談業務 薬事戦略相談対面助言 ( 治験相談 ) 審査 承認審査業務 再審査 再評価 GLP 調査 GCP 調査 信頼性保証業務 GPSP 調査 GMP/QMS 調査業務 基
 ~ 薬事戦略相談の活用について ~ 2014 年 11 月 5 日 PMDA 関西支部開設 1 周年記念シンポジウム 薬事戦略相談等の活用による革新的医療技術の実用化促進に向けて ( 独 ) 医薬品医療機器総合機構 ( PMDA ) 関西支部相談課長平田雅一 0 医薬品 医療機器の開発ステージと PMDA 審査関連業務 研究開発 非臨床試験 臨床試験 ( 治験 ) 承認申請 承認 市販 相談業務 薬事戦略相談対面助言
~ 薬事戦略相談の活用について ~ 2014 年 11 月 5 日 PMDA 関西支部開設 1 周年記念シンポジウム 薬事戦略相談等の活用による革新的医療技術の実用化促進に向けて ( 独 ) 医薬品医療機器総合機構 ( PMDA ) 関西支部相談課長平田雅一 0 医薬品 医療機器の開発ステージと PMDA 審査関連業務 研究開発 非臨床試験 臨床試験 ( 治験 ) 承認申請 承認 市販 相談業務 薬事戦略相談対面助言
本の医薬品 医療機器産業の国際競争 強化と い経済成 を実現 基本的考え 現状の課題 本で われる臨床研究に対する 援や制度上の制約が障壁となり 本発のシーズが 新的な医薬品 医療機器の開発につながっていない 企業の治験着 の遅れ 治験の実施や承認審査に時間がかかる等により欧 との間にドラッグ ラグ
 資料 2 医療イノベーションに関する資料 平成 23 年 5 月 19 日厚生労働省 本の医薬品 医療機器産業の国際競争 強化と い経済成 を実現 基本的考え 現状の課題 本で われる臨床研究に対する 援や制度上の制約が障壁となり 本発のシーズが 新的な医薬品 医療機器の開発につながっていない 企業の治験着 の遅れ 治験の実施や承認審査に時間がかかる等により欧 との間にドラッグ ラグ デバイス ラグが
資料 2 医療イノベーションに関する資料 平成 23 年 5 月 19 日厚生労働省 本の医薬品 医療機器産業の国際競争 強化と い経済成 を実現 基本的考え 現状の課題 本で われる臨床研究に対する 援や制度上の制約が障壁となり 本発のシーズが 新的な医薬品 医療機器の開発につながっていない 企業の治験着 の遅れ 治験の実施や承認審査に時間がかかる等により欧 との間にドラッグ ラグ デバイス ラグが
1 検査の背景 国立大学附属病院は 平成 16 年の国立大学の法人化以降 収支の企業的管理が必要 となり 個々の国立大学附属病院がその経営について独自に責任を負うこととなった そして 医療制度改革等では 国立大学附属病院を含めた病院の役割分担による医 療提供体制の再構築が求められている さらに 医療
 国立大学法人が大学に設置する附属病院の運営についての報 告書 ( 要旨 ) 平成 2 8 年 9 月 会計検査院 1 検査の背景 国立大学附属病院は 平成 16 年の国立大学の法人化以降 収支の企業的管理が必要 となり 個々の国立大学附属病院がその経営について独自に責任を負うこととなった そして 医療制度改革等では 国立大学附属病院を含めた病院の役割分担による医 療提供体制の再構築が求められている
国立大学法人が大学に設置する附属病院の運営についての報 告書 ( 要旨 ) 平成 2 8 年 9 月 会計検査院 1 検査の背景 国立大学附属病院は 平成 16 年の国立大学の法人化以降 収支の企業的管理が必要 となり 個々の国立大学附属病院がその経営について独自に責任を負うこととなった そして 医療制度改革等では 国立大学附属病院を含めた病院の役割分担による医 療提供体制の再構築が求められている
率 九州 ( 工 -エネルギー科学) 新潟 ( 工 - 力学 ) 神戸 ( 海事科学 ) 60.0 ( 工 - 化学材料 ) 岡山 ( 工 - 機械システム系 ) 北海道 ( 総合理系 - 化学重点 ) 57.5 名古屋工業 ( 工 - 電気 機械工 ) 首都大学東京
 率 93 東京工業 ( 生命理工 - 生命理工 ) 67.5 東京 ( 理科一類 ) 67.5 90 九州 ( 工 - 機械航空工 ) 67.5 ( 理科二類 ) 67.5 89 九州 ( 工 - 電気情報工 ) 65.0 京都 ( 工 - 情報 ) 65.0 87 筑波 ( 理工 - 工学システム ) 九州 ( 工 - 建築 ) 65.0 86 北海道 ( 工 - 情報エレクトロニクス ) 60.0
率 93 東京工業 ( 生命理工 - 生命理工 ) 67.5 東京 ( 理科一類 ) 67.5 90 九州 ( 工 - 機械航空工 ) 67.5 ( 理科二類 ) 67.5 89 九州 ( 工 - 電気情報工 ) 65.0 京都 ( 工 - 情報 ) 65.0 87 筑波 ( 理工 - 工学システム ) 九州 ( 工 - 建築 ) 65.0 86 北海道 ( 工 - 情報エレクトロニクス ) 60.0
3 4
 1 2 3 4 5 6 7 8 9 10 資料 1 年度計画作成スケジュール 時期各総長室等大学全体企画 経営室関連分 10 月 11 月 年度計画作成方針の検討 ( 企画 経営室会議 ) 年度計画作成方針の決定 ( 役員会 ) 年度計画 ( 一次案 ) の作成 年度計画 ( 一次案 ) の作成 12 月 年度計画 ( 一次案 ) の集約 調 整 1 月 年度計画 ( 二次案 ) の作成 ( 一次案のフィードバック
1 2 3 4 5 6 7 8 9 10 資料 1 年度計画作成スケジュール 時期各総長室等大学全体企画 経営室関連分 10 月 11 月 年度計画作成方針の検討 ( 企画 経営室会議 ) 年度計画作成方針の決定 ( 役員会 ) 年度計画 ( 一次案 ) の作成 年度計画 ( 一次案 ) の作成 12 月 年度計画 ( 一次案 ) の集約 調 整 1 月 年度計画 ( 二次案 ) の作成 ( 一次案のフィードバック
医師主導治験取扱要覧
 15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
医療機器開発マネジメントにおけるチェック項目
 2018 年 11 月作成 医療機器開発マネジメントにおけるチェック項目 1. 各ステージゲートにおけるチェック項目 (1) チェック項目作成の目的従来個々の事業において実施されていた 事前 中間 事後の各ゲートにおける評価項目 Go/no-go の判断を 医療機器開発全期間を通して整理し 共通認識化する 技術的観点及び事業化の観点の双方を意識し 医療機器開発の特性を考慮したチェック項目を設定する
2018 年 11 月作成 医療機器開発マネジメントにおけるチェック項目 1. 各ステージゲートにおけるチェック項目 (1) チェック項目作成の目的従来個々の事業において実施されていた 事前 中間 事後の各ゲートにおける評価項目 Go/no-go の判断を 医療機器開発全期間を通して整理し 共通認識化する 技術的観点及び事業化の観点の双方を意識し 医療機器開発の特性を考慮したチェック項目を設定する
アレルギー疾患対策基本法 ( 平成二十六年六月二十七日法律第九十八号 ) 最終改正 : 平成二六年六月一三日法律第六七号 第一章総則 ( 第一条 第十条 ) 第二章アレルギー疾患対策基本指針等 ( 第十一条 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条
 アレルギー疾患対策基本法 ( 平成二十六年六月二十七日法律第九十八号 ) 最終改正 : 平成二六年六月一三日法律第六七号 第一章総則 ( 第一条 第十条 ) 第二章アレルギー疾患対策基本指針等 ( 第十一条 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条 第十五条 ) 第二節アレルギー疾患医療の均てん化の促進等 ( 第十六条 第十七条 ) 第三節アレルギー疾患を有する者の生活の質の維持向上
アレルギー疾患対策基本法 ( 平成二十六年六月二十七日法律第九十八号 ) 最終改正 : 平成二六年六月一三日法律第六七号 第一章総則 ( 第一条 第十条 ) 第二章アレルギー疾患対策基本指針等 ( 第十一条 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条 第十五条 ) 第二節アレルギー疾患医療の均てん化の促進等 ( 第十六条 第十七条 ) 第三節アレルギー疾患を有する者の生活の質の維持向上
<4D F736F F D D91208D918CF697A791E58A7795CE8DB7926C C F2E646F63>
 全国国公立大学偏差値ランキング 東京大学 [ 理 3 国 東京 ]79 京都大学 [ 医医 国 京都 ]78 東京大学 [ 文 1 国 東京 ]77 大阪大学 [ 医医 国 大阪 ]77 東京大学 [ 文 2 国 東京 ]76 東京大学 [ 文 3 国 東京 ]75 東京医科歯科大学 [ 医医 国 東京 ]74 名古屋大学 [ 医医 国 愛知 ]74 東北大学 [ 医医 国 宮城 ]73 千葉大学
全国国公立大学偏差値ランキング 東京大学 [ 理 3 国 東京 ]79 京都大学 [ 医医 国 京都 ]78 東京大学 [ 文 1 国 東京 ]77 大阪大学 [ 医医 国 大阪 ]77 東京大学 [ 文 2 国 東京 ]76 東京大学 [ 文 3 国 東京 ]75 東京医科歯科大学 [ 医医 国 東京 ]74 名古屋大学 [ 医医 国 愛知 ]74 東北大学 [ 医医 国 宮城 ]73 千葉大学
2. 検討 ~ 医療に関する事故の特殊性など (1) 医師等による医療行為における事故 医師等が患者に対してどのような医療行為を施すべきかという判断は 医師等の医学的な専門知識 技能に加え 医師等の経験 患者の体質 その時の患者の容態 使用可能な医療機器等の設備等に基づきなされるものである ( 個別
 資料 1 消費者安全調査委員会による事故等原因調査等の進め方について ( 議論のたたき台 ) ~ 医療に関する事故の考え方 ~ 1. 前提 消費者安全調査委員会の調査対象医療に関する事故については 消費者安全法に規定する生命又は身体の被害に係る消費者事故等に当たり得ることから その場合は 消費者安全調査委員会が行う事故等原因調査等の対象になる 消費者安全調査委員会の役割生命又は身体の被害に係る消費者事故等の原因を究明し
資料 1 消費者安全調査委員会による事故等原因調査等の進め方について ( 議論のたたき台 ) ~ 医療に関する事故の考え方 ~ 1. 前提 消費者安全調査委員会の調査対象医療に関する事故については 消費者安全法に規定する生命又は身体の被害に係る消費者事故等に当たり得ることから その場合は 消費者安全調査委員会が行う事故等原因調査等の対象になる 消費者安全調査委員会の役割生命又は身体の被害に係る消費者事故等の原因を究明し
平成27年度事業計画書
 平成 27 年度事業計画書 一般社団法人日本医療安全調査機構 ( 以下 当機構 という ) は 医療法 ( 昭和 23 年法律第 205 号 ) 第 6 条の 19 の規定に基づき 同法第 6 条の 18 に掲げる医療事故調査 支援センターが行うこととされている調査等業務 ( 以下 センター業務 という ) について 事業計画を次のとおり定める 平成 27 年 9 月 17 日 一般社団法人日本医療安全調査機構
平成 27 年度事業計画書 一般社団法人日本医療安全調査機構 ( 以下 当機構 という ) は 医療法 ( 昭和 23 年法律第 205 号 ) 第 6 条の 19 の規定に基づき 同法第 6 条の 18 に掲げる医療事故調査 支援センターが行うこととされている調査等業務 ( 以下 センター業務 という ) について 事業計画を次のとおり定める 平成 27 年 9 月 17 日 一般社団法人日本医療安全調査機構
CROCO について
 CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
本日の内容 1. PMDA の業務 2. 薬事戦略相談の事業内容 3. 薬事戦略相談の活用 2
 PMDA 薬事戦略相談の現状と課題 独立行政法人医薬品医療機器総合機構 Pharmaceuticals and Medical Devices Agency (PMDA) 審査マネジメント部長中山智紀 1 本日の内容 1. PMDA の業務 2. 薬事戦略相談の事業内容 3. 薬事戦略相談の活用 2 本日の内容 1. PMDA の業務 2. 薬事戦略相談の事業内容 3. 薬事戦略相談の活用 3 PMDA
PMDA 薬事戦略相談の現状と課題 独立行政法人医薬品医療機器総合機構 Pharmaceuticals and Medical Devices Agency (PMDA) 審査マネジメント部長中山智紀 1 本日の内容 1. PMDA の業務 2. 薬事戦略相談の事業内容 3. 薬事戦略相談の活用 2 本日の内容 1. PMDA の業務 2. 薬事戦略相談の事業内容 3. 薬事戦略相談の活用 3 PMDA
( 様式第 6) 病院の管理及び運営に関する諸記録の閲覧方法に関する書類 病院の管理及び運営に関する諸記録の閲覧方法 計画 現状の別 1. 計画 2. 現状 閲 覧 責 任 者 氏 名 閲 覧 担 当 者 氏 名 閲覧の求めに応じる場所 閲覧の手続の概要 ( 注 ) 既に医療法施行規則第 9 条の
 ( 様式第 6) 病院の管理及び運営に関する諸記録の閲覧方法に関する書類 病院の管理及び運営に関する諸記録の閲覧方法 計画 現状の別 1. 計画 2. 現状 閲 覧 責 任 者 氏 名 閲 覧 担 当 者 氏 名 閲覧の求めに応じる場所 閲覧の手続の概要 ( 注 ) 既に医療法施行規則第 9 条の 20 第 5 号の規定に合致する方法により記録を閲覧させている病院は現状について その他の病院は計画について記載することとし
( 様式第 6) 病院の管理及び運営に関する諸記録の閲覧方法に関する書類 病院の管理及び運営に関する諸記録の閲覧方法 計画 現状の別 1. 計画 2. 現状 閲 覧 責 任 者 氏 名 閲 覧 担 当 者 氏 名 閲覧の求めに応じる場所 閲覧の手続の概要 ( 注 ) 既に医療法施行規則第 9 条の 20 第 5 号の規定に合致する方法により記録を閲覧させている病院は現状について その他の病院は計画について記載することとし
医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など ) 医薬品候補物質のスクリーニン
 特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
【押印あり】日本医学会宛
 別紙 再生医療等製品患者登録システムへの参加協力のお願い 患者登録システムの目的 患者登録システムは 再生医療等製品の市販後の使用状況や患者予後等のデータを収集し 迅速な安全対策や新たな製品開発等を通じて 医療の向上に役立てることを目的としています 患者登録システムは 製品毎に構築 運用されます この患者登録システムは 一般的には レジストリ と呼ばれることもあります 構築形態例 患者登録システムの対象
別紙 再生医療等製品患者登録システムへの参加協力のお願い 患者登録システムの目的 患者登録システムは 再生医療等製品の市販後の使用状況や患者予後等のデータを収集し 迅速な安全対策や新たな製品開発等を通じて 医療の向上に役立てることを目的としています 患者登録システムは 製品毎に構築 運用されます この患者登録システムは 一般的には レジストリ と呼ばれることもあります 構築形態例 患者登録システムの対象
目次 第 1 部総論 経済成長プランの実行に向けた考え方 1 背景 課題 1 2 本提案の目標 2 3 重点施策の 3 つの方向 2 4 規制 制度改革により施策を加速 6 5 ポテンシャル 6 頁 第 2 部提案プロジェクト一覧 8 第 3 部個別の提案プロジェクト Ⅰ 健康 未病産業の創出 1
 健康 未病産業と最先端医療関連産業の創出による経済成長プラン ~ ヘルスケア ニューフロンティアの実現に向けて ~ 平成 25 年 9 月 11 日 ( 抜粋 ) 神奈川県 横浜市 川崎市 目次 第 1 部総論 経済成長プランの実行に向けた考え方 1 背景 課題 1 2 本提案の目標 2 3 重点施策の 3 つの方向 2 4 規制 制度改革により施策を加速 6 5 ポテンシャル 6 頁 第 2 部提案プロジェクト一覧
健康 未病産業と最先端医療関連産業の創出による経済成長プラン ~ ヘルスケア ニューフロンティアの実現に向けて ~ 平成 25 年 9 月 11 日 ( 抜粋 ) 神奈川県 横浜市 川崎市 目次 第 1 部総論 経済成長プランの実行に向けた考え方 1 背景 課題 1 2 本提案の目標 2 3 重点施策の 3 つの方向 2 4 規制 制度改革により施策を加速 6 5 ポテンシャル 6 頁 第 2 部提案プロジェクト一覧
薬事法における病院及び医師に対する主な規制について 特定生物由来製品に係る説明 ( 法第 68 条の 7 平成 14 年改正 ) 特定生物由来製品の特性を踏まえ 製剤のリスクとベネフィットについて患者に説明を行い 理解を得るように努めることを これを取り扱う医師等の医療関係者に義務づけたもの ( 特
 薬事法における病院及び医師に対する主な規制について 情報の提供等 ( 法第 77 条の 3 第 2 項及び第 3 項 第 2 項 : 昭和 54 年改正 第 3 項 : 平成 6 年改正 ) 医薬品の製造販売業者等が行う医薬品又は医療機器の適正な使用のために必要な情報の収集に協力するよう努めることを また 医薬品及び医療機器の適正な使用を確保するため 医薬品の製造販売業者等から提供される情報の活用その他必要な情報の収集
薬事法における病院及び医師に対する主な規制について 情報の提供等 ( 法第 77 条の 3 第 2 項及び第 3 項 第 2 項 : 昭和 54 年改正 第 3 項 : 平成 6 年改正 ) 医薬品の製造販売業者等が行う医薬品又は医療機器の適正な使用のために必要な情報の収集に協力するよう努めることを また 医薬品及び医療機器の適正な使用を確保するため 医薬品の製造販売業者等から提供される情報の活用その他必要な情報の収集
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
4 研修について考慮する事項 1. 研修の対象者 a. 職種横断的な研修か 限定した職種への研修か b. 部署 部門を横断する研修か 部署及び部門別か c. 職種別の研修か 2. 研修内容とプログラム a. 研修の企画においては 対象者や研修内容に応じて開催時刻を考慮する b. 全員への周知が必要な
 新井病院 医療安全管理者の業務指針 新井病院医療安全管理者業務指針 1. はじめに医療機関の管理者は 自ら安全管理体制を確保するとともに 医療安全管理者を配置するにあたっては 必要な権限を委譲し また 必要な資源を付与して その活動を推進することで医療機関内の安全管理につとめなければならない 2. 医療安全管理者の位置づけ医療安全管理者とは 病院管理者 ( 病院長 ) の任命を受け 安全管理のために必要な権限の委譲と
新井病院 医療安全管理者の業務指針 新井病院医療安全管理者業務指針 1. はじめに医療機関の管理者は 自ら安全管理体制を確保するとともに 医療安全管理者を配置するにあたっては 必要な権限を委譲し また 必要な資源を付与して その活動を推進することで医療機関内の安全管理につとめなければならない 2. 医療安全管理者の位置づけ医療安全管理者とは 病院管理者 ( 病院長 ) の任命を受け 安全管理のために必要な権限の委譲と
ともに 申請者が承認審査のスケジュールに沿って法令上求められる製造体制を整備することや承認後円滑に医療現場に提供するための対応が十分になされることで 更なる迅速な実用化を促すものである この制度では 原則として新規原理 新規作用機序等により 生命に重大な影響がある重篤な疾患等に対して 極めて高い有効
 ともに 申請者が承認審査のスケジュールに沿って法令上求められる製造体制を整備することや承認後円滑に医療現場に提供するための対応が十分になされることで 更なる迅速な実用化を促すものである この制度では 原則として新規原理 新規作用機序等により 生命に重大な影響がある重篤な疾患等に対して 極めて高い有効性が期待される医療機器 体外診断用医薬品 再生医療等製品を指定することとする また 本制度では PMDA
ともに 申請者が承認審査のスケジュールに沿って法令上求められる製造体制を整備することや承認後円滑に医療現場に提供するための対応が十分になされることで 更なる迅速な実用化を促すものである この制度では 原則として新規原理 新規作用機序等により 生命に重大な影響がある重篤な疾患等に対して 極めて高い有効性が期待される医療機器 体外診断用医薬品 再生医療等製品を指定することとする また 本制度では PMDA
過去の医薬品等の健康被害から学ぶもの
 新薬による薬害事件を如何に防ぐか - ソリブジン事件とイレッサ事件から学ぶ - 土井脩 ( 医薬品医療機器レギュラトリーサイエンス財団 ) Pharmaceutical and Medical Device Regulatory Science Society of Japan 2019.01.01 ( レギュラトリーサイエンスエキスパート研修会 薬害教育 ) 研修用教材としてまとめたものであり 公式見解などをまとめたものではありません
新薬による薬害事件を如何に防ぐか - ソリブジン事件とイレッサ事件から学ぶ - 土井脩 ( 医薬品医療機器レギュラトリーサイエンス財団 ) Pharmaceutical and Medical Device Regulatory Science Society of Japan 2019.01.01 ( レギュラトリーサイエンスエキスパート研修会 薬害教育 ) 研修用教材としてまとめたものであり 公式見解などをまとめたものではありません
写 薬生発 0131 第 1 号 平成 30 年 1 月 31 日 都道府県知事 殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 関係手数料令の一部を改正する政令の公布について この度 医薬品 医療機器等の品質 有効性及び安全性の確
 薬生発 0131 第 3 号 平成 30 年 1 月 31 日 独立行政法人医薬品医療機器総合機構理事長殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 関係手数料令の一部を改正する政令の公布について 標記につきまして 別添写しのとおり都道府県知事宛てに通知しましたので お 知らせいたします 写 薬生発 0131 第 1 号 平成 30
薬生発 0131 第 3 号 平成 30 年 1 月 31 日 独立行政法人医薬品医療機器総合機構理事長殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 関係手数料令の一部を改正する政令の公布について 標記につきまして 別添写しのとおり都道府県知事宛てに通知しましたので お 知らせいたします 写 薬生発 0131 第 1 号 平成 30
ドラッグラグの現状 日本においては平均して世界初上市から約 4 年遅れて上市されており 最も遅れの少ない米国と比較しておよそ 2.5 年の開きがある * 1,417 (= 約 4 年 ) 約 2.5 年 日本 フランス デン マーク ドイツ ス
 今後の機構の体制について 平成 19 年 6 月 8 日医薬品医療機器総合機構 ドラッグラグの現状 日本においては平均して世界初上市から約 4 年遅れて上市されており 最も遅れの少ない米国と比較しておよそ 2.5 年の開きがある * 1,417 (= 約 4 年 ) 915 757 約 2.5 年 620 583 538 512 505 日本 フランス デン マーク ドイツ スウェーデン スイス英国米国
今後の機構の体制について 平成 19 年 6 月 8 日医薬品医療機器総合機構 ドラッグラグの現状 日本においては平均して世界初上市から約 4 年遅れて上市されており 最も遅れの少ない米国と比較しておよそ 2.5 年の開きがある * 1,417 (= 約 4 年 ) 915 757 約 2.5 年 620 583 538 512 505 日本 フランス デン マーク ドイツ スウェーデン スイス英国米国
平成 28 年 4 月版 別紙様式 3 研究に係る利益相反状況申告書 Q&A Q1. 学内研究分担者等の氏名 Q1-1 Q1-2 Q1-3 Q1-4 質問学外の研究分担者名を記載しなくてもよいのですか? 学内研究分担者等 というのは どのような人をいうのですか? モニタリング 監査とはどのようなもの
 別紙様式 3 研究に係る利益相反状況申告書 Q&A Q1. 学内研究分担者等の氏名 Q1-1 Q1-2 Q1-3 Q1-4 質問学外の研究分担者名を記載しなくてもよいのですか? 学内研究分担者等 というのは どのような人をいうのですか? モニタリング 監査とはどのようなものですか? 欄が足りない場合はどうすればよいですか? 回答記載する必要はありません ただし その研究者が本学において研究を実施する場合には記載してください
別紙様式 3 研究に係る利益相反状況申告書 Q&A Q1. 学内研究分担者等の氏名 Q1-1 Q1-2 Q1-3 Q1-4 質問学外の研究分担者名を記載しなくてもよいのですか? 学内研究分担者等 というのは どのような人をいうのですか? モニタリング 監査とはどのようなものですか? 欄が足りない場合はどうすればよいですか? 回答記載する必要はありません ただし その研究者が本学において研究を実施する場合には記載してください
Microsoft Word - (発番)医療機器の製造販売承認申請について
 薬食発 1120 第 5 号 平成 26 年 11 月 20 日 各都道府県知事殿 厚生労働省医薬食品局長 ( 公印省略 ) 医療機器の製造販売承認申請について 医療機器の製造販売承認申請の取扱いについては 医療機器の製造販売承認申請について ( 平成 17 年 2 月 16 日付け薬食発第 0216002 号厚生労働省医薬食品局長通知 以下 旧通知 という ) 等により実施してきたところです 先般
薬食発 1120 第 5 号 平成 26 年 11 月 20 日 各都道府県知事殿 厚生労働省医薬食品局長 ( 公印省略 ) 医療機器の製造販売承認申請について 医療機器の製造販売承認申請の取扱いについては 医療機器の製造販売承認申請について ( 平成 17 年 2 月 16 日付け薬食発第 0216002 号厚生労働省医薬食品局長通知 以下 旧通知 という ) 等により実施してきたところです 先般
3. 実施時期平成 29 年 4 月 3 日より本件改修後のQMS 調査申請書の作成及び機構受付が可能となります 4. その他 本改修により承認申請書とQMS 調査申請書の同時申請が可能となるのは 両申請書をDW APで作成した場合に限ります (FD 申請ソフトによる申請の場合は同時申請できません
 事務連絡平成 29 年 3 月 17 日 一般社団法人日本医療機器産業連合会御中 独立行政法人医薬品医療機器総合機構審査業務部 承認申請書及び QMS 調査申請書の同時申請にかかる DWAP の改修について 今般 医療機器 WEB 申請プラットフォーム ( 以下 DWAP という ) を活用した医療機器製造販売承認申請書又は外国製造医療機器製造販売承認申請書 ( 一部変更承認申請書を含む 以下 承認申請書
事務連絡平成 29 年 3 月 17 日 一般社団法人日本医療機器産業連合会御中 独立行政法人医薬品医療機器総合機構審査業務部 承認申請書及び QMS 調査申請書の同時申請にかかる DWAP の改修について 今般 医療機器 WEB 申請プラットフォーム ( 以下 DWAP という ) を活用した医療機器製造販売承認申請書又は外国製造医療機器製造販売承認申請書 ( 一部変更承認申請書を含む 以下 承認申請書
再発小児 B 前駆細胞性急性リンパ性白血病におけるキメラ遺伝子の探索 ( この研究は 小児白血病リンパ腫研究グループ (JPLSG)ALL-B12 治療研究の付随研究として行われます ) 研究機関名及び研究責任者氏名 この研究が行われる研究機関と研究責任者は次に示す通りです 研究代表者眞田昌国立病院
 < 小児 B 前駆細胞性急性リンパ性白血病に対する 多施設共同臨床試験 (ALL-B12 研究 ) に参加された方へ > 研究課題 再発小児 B 前駆細胞性急性リンパ性白血病におけるキメラ遺伝子の探索 への保存検体の使用について 日本小児白血病リンパ腫研究グループ (JPLSG) が行っております小児 B 前駆細胞性急性リンパ性白血病に対する多施設共同臨床試験 (ALL-B12 研究 ) に参加された患者さんの中で検体提供への同意を文書で頂いている方につきましては
< 小児 B 前駆細胞性急性リンパ性白血病に対する 多施設共同臨床試験 (ALL-B12 研究 ) に参加された方へ > 研究課題 再発小児 B 前駆細胞性急性リンパ性白血病におけるキメラ遺伝子の探索 への保存検体の使用について 日本小児白血病リンパ腫研究グループ (JPLSG) が行っております小児 B 前駆細胞性急性リンパ性白血病に対する多施設共同臨床試験 (ALL-B12 研究 ) に参加された患者さんの中で検体提供への同意を文書で頂いている方につきましては
<4D F736F F D E598BC68BA CD89EF8B638E9197BF2E646F6378>
 平成 25 年 4 月 23 日 規制改革会議議長 岡 素之 規制改革会議の活動報告 (4 月 -2) 4/17 第 6 回産業競争力会議に報告の内容のうち 以下 2 項目に関し追加 補足する 1. 国際先端テスト 国際先端テストの導入 定着を図るため 本会議の最優先案件 4つのWGの検討項目の中から国際比較をすることが効果的な項目を選定し 個別具体的に実施中 4/17 規制改革会議にて決定された14
平成 25 年 4 月 23 日 規制改革会議議長 岡 素之 規制改革会議の活動報告 (4 月 -2) 4/17 第 6 回産業競争力会議に報告の内容のうち 以下 2 項目に関し追加 補足する 1. 国際先端テスト 国際先端テストの導入 定着を図るため 本会議の最優先案件 4つのWGの検討項目の中から国際比較をすることが効果的な項目を選定し 個別具体的に実施中 4/17 規制改革会議にて決定された14
厚生労働科学研究費補助金(循環器疾患等生活習慣病対策総合研究事業)
 厚生労働科学研究費補助金 ( 循環器疾患 糖尿病等生活習慣病対策総合研究事業 ) 分担研究報告書 健康寿命の全国推移の算定 評価に関する研究 評価方法の作成と適用の試み 研究分担者橋本修二藤田保健衛生大学医学部衛生学講座 教授 研究要旨健康寿命の推移について 平均寿命の増加分を上回る健康寿命の増加 ( 健康日本 21( 第二次 ) の目標 ) の達成状況の評価方法を開発 提案することを目的とした 本年度は
厚生労働科学研究費補助金 ( 循環器疾患 糖尿病等生活習慣病対策総合研究事業 ) 分担研究報告書 健康寿命の全国推移の算定 評価に関する研究 評価方法の作成と適用の試み 研究分担者橋本修二藤田保健衛生大学医学部衛生学講座 教授 研究要旨健康寿命の推移について 平均寿命の増加分を上回る健康寿命の増加 ( 健康日本 21( 第二次 ) の目標 ) の達成状況の評価方法を開発 提案することを目的とした 本年度は
医薬品説明会資料 ジェネリック (後発医薬品)
 17 2 12 13 GMP 14 GVP 2 日医工MPS2010 基本的なジェネリック発売までの流れ 製造販売元A社 管理 開発部門 製造部門 A社 管理 開発 販売部門 A社工場 製造指示 出荷 製造業者 Z 製造委託 承認 製造販売承認の申請 A社 営業部門 医療機関 卸売業者 厚生労働大臣 医薬品医療機器総合機構 9 Z社工場 基本的には 各社で製剤に関する研究 開発を行い 製造に関する申請書の提出
17 2 12 13 GMP 14 GVP 2 日医工MPS2010 基本的なジェネリック発売までの流れ 製造販売元A社 管理 開発部門 製造部門 A社 管理 開発 販売部門 A社工場 製造指示 出荷 製造業者 Z 製造委託 承認 製造販売承認の申請 A社 営業部門 医療機関 卸売業者 厚生労働大臣 医薬品医療機器総合機構 9 Z社工場 基本的には 各社で製剤に関する研究 開発を行い 製造に関する申請書の提出
PowerPoint プレゼンテーション
 背景 クリニカル イノベーション ネットワーク (CIN) の背景と概要 資料 3 新しい医薬品 医療機器等の開発に当たっては 世界的にコストが高騰している 特に 医薬品にあっては タフツ大学の試算によると 1 新薬当たり $2,558 million( 約 3,000 億円 ) 要するといわれている (Nov. 18, 2014, Tufts Center for the Study of Drug
背景 クリニカル イノベーション ネットワーク (CIN) の背景と概要 資料 3 新しい医薬品 医療機器等の開発に当たっては 世界的にコストが高騰している 特に 医薬品にあっては タフツ大学の試算によると 1 新薬当たり $2,558 million( 約 3,000 億円 ) 要するといわれている (Nov. 18, 2014, Tufts Center for the Study of Drug
最近の薬務行政について
 平成 25 年 7 月 26 日現在 薬事法改正について 厚生労働省医薬食品局審査管理課 医療機器審査管理室 これらの内容には現段階で検討中の内容が含まれており 今後変更する可能性があります 薬事法改正法案及び再生医療等安全性確保法案の概要について 現在 国民が受ける医療の質の向上を図るため 革新的な医薬品 医療機器の創出や再生医療の研究開発及び実用化を促進していくことが喫緊の課題となっている 併せて
平成 25 年 7 月 26 日現在 薬事法改正について 厚生労働省医薬食品局審査管理課 医療機器審査管理室 これらの内容には現段階で検討中の内容が含まれており 今後変更する可能性があります 薬事法改正法案及び再生医療等安全性確保法案の概要について 現在 国民が受ける医療の質の向上を図るため 革新的な医薬品 医療機器の創出や再生医療の研究開発及び実用化を促進していくことが喫緊の課題となっている 併せて
員長及び医薬品医療機器等法登録認証機関協議会代表幹事宛て送付するこ ととしていることを申し添えます 記 1. 基本要件基準第 13 条第 5 項及び第 6 項への適合性確認の基本的な考え方について (1)2023 年 ( 平成 35 年 )2 月 28 日 ( 以下 経過措置期間終了日 という )
 薬生機審発 0301 第 1 号 平成 30 年 3 月 1 日 各都道府県薬務主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医療機器審査管理課長 ( 公印省略 ) 医療機器の電磁両立性に関する日本工業規格の改正の取扱いについて すべての能動型医療機器は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第四十一条第三項の規定により厚生労働大臣が定める医療機器の基準 ( 平成 17
薬生機審発 0301 第 1 号 平成 30 年 3 月 1 日 各都道府県薬務主管部 ( 局 ) 長殿 厚生労働省医薬 生活衛生局医療機器審査管理課長 ( 公印省略 ) 医療機器の電磁両立性に関する日本工業規格の改正の取扱いについて すべての能動型医療機器は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第四十一条第三項の規定により厚生労働大臣が定める医療機器の基準 ( 平成 17
 5. 都道府県別 の推移 (19 19~1 年 ) 北海道 1% 17% 1% % 11% 北海道 青森県 3% 3% 31% 3% % 7% 5% 青森県 岩手県 3% 37% 3% 35% 3% 31% 9% 岩手県 宮城県 33% 3% 31% 9% 7% 5% 3% 宮城県 秋田県 1% % % 3% 3% 33% 3% 秋田県 山形県 7% % 7% 5% 3% % 37% 山形県 福島県
5. 都道府県別 の推移 (19 19~1 年 ) 北海道 1% 17% 1% % 11% 北海道 青森県 3% 3% 31% 3% % 7% 5% 青森県 岩手県 3% 37% 3% 35% 3% 31% 9% 岩手県 宮城県 33% 3% 31% 9% 7% 5% 3% 宮城県 秋田県 1% % % 3% 3% 33% 3% 秋田県 山形県 7% % 7% 5% 3% % 37% 山形県 福島県
愛知県アルコール健康障害対策推進計画 の概要 Ⅰ はじめに 1 計画策定の趣旨酒類は私たちの生活に豊かさと潤いを与える一方で 多量の飲酒 未成年者や妊婦の飲酒等の不適切な飲酒は アルコール健康障害の原因となる アルコール健康障害は 本人の健康問題だけでなく 家族への深刻な影響や飲酒運転 自殺等の重大
 愛知県アルコール健康障害対策推進計画 の概要 Ⅰ はじめに 1 計画策定の趣旨酒類は私たちの生活に豊かさと潤いを与える一方で 多量の飲酒 未成年者や妊婦の飲酒の不適切な飲酒は アルコール健康障害の原因となる アルコール健康障害は 本人の健康問題だけでなく 家族への深刻な影響や飲酒運転 自殺の重大な社会問題を生じさせる危険性が高く その対策は極めて重要な課題である 平成 26 年 6 月に施行されたアルコール健康障害対策基本法において
愛知県アルコール健康障害対策推進計画 の概要 Ⅰ はじめに 1 計画策定の趣旨酒類は私たちの生活に豊かさと潤いを与える一方で 多量の飲酒 未成年者や妊婦の飲酒の不適切な飲酒は アルコール健康障害の原因となる アルコール健康障害は 本人の健康問題だけでなく 家族への深刻な影響や飲酒運転 自殺の重大な社会問題を生じさせる危険性が高く その対策は極めて重要な課題である 平成 26 年 6 月に施行されたアルコール健康障害対策基本法において
< F2D8E9197BF A836F815B2E6A7464>
 ( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
PowerPoint プレゼンテーション
 研究開発課題名難病 希少疾患の医薬品開発におけるクリニカルイノベーションネットワーク構想の推進を目指した疾患登録システム ( 患者レジストリ ) の構築 研究開発代表者 国立研究開発法人国立精神 神経医療研究センター 資料 2-3 トランスレーショナルメディカルセンター 臨床研究支援室長 発表内容 本研究の目標 実施体制 Remudy の実績と課題 目指すもの 疾患登録システム レジストリの信頼性について
研究開発課題名難病 希少疾患の医薬品開発におけるクリニカルイノベーションネットワーク構想の推進を目指した疾患登録システム ( 患者レジストリ ) の構築 研究開発代表者 国立研究開発法人国立精神 神経医療研究センター 資料 2-3 トランスレーショナルメディカルセンター 臨床研究支援室長 発表内容 本研究の目標 実施体制 Remudy の実績と課題 目指すもの 疾患登録システム レジストリの信頼性について
●アレルギー疾患対策基本法案
 第一七七回衆第三二号アレルギー疾患対策基本法案目次第一章総則 ( 第一条 - 第十条 ) 第二章アレルギー疾患対策推進基本計画等 ( 第十一条 - 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条 第十五条 ) 第二節アレルギー疾患医療の均てん化の促進等 ( 第十六条 第十七条 ) 第三節アレルギー疾患を有する者の生活の質の維持向上 ( 第十八条 ) 第四節研究の推進等
第一七七回衆第三二号アレルギー疾患対策基本法案目次第一章総則 ( 第一条 - 第十条 ) 第二章アレルギー疾患対策推進基本計画等 ( 第十一条 - 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条 第十五条 ) 第二節アレルギー疾患医療の均てん化の促進等 ( 第十六条 第十七条 ) 第三節アレルギー疾患を有する者の生活の質の維持向上 ( 第十八条 ) 第四節研究の推進等
平成 26 年 3 月 28 日 消防庁 平成 25 年の救急出動件数等 ( 速報 ) の公表 平成 25 年における救急出動件数等の速報を取りまとめましたので公表します 救急出動件数 搬送人員とも過去最多を記録 平成 25 年中の救急自動車による救急出動件数は 591 万 5,956 件 ( 対前
 平成 26 年 3 月 28 日 消防庁 平成 25 年の救急出動件数等 ( 速報 ) の公表 平成 25 年における救急出動件数等の速報を取りまとめましたので公表します 救急出動件数 搬送人員とも過去最多を記録 平成 25 年中の救急自動車による救急出動件数は 591 万 5,956 件 ( 対前年比 11 万 3,501 件増 2.0% 増 ) 搬送人員は 534 万 2,427 人 ( 対前年比
平成 26 年 3 月 28 日 消防庁 平成 25 年の救急出動件数等 ( 速報 ) の公表 平成 25 年における救急出動件数等の速報を取りまとめましたので公表します 救急出動件数 搬送人員とも過去最多を記録 平成 25 年中の救急自動車による救急出動件数は 591 万 5,956 件 ( 対前年比 11 万 3,501 件増 2.0% 増 ) 搬送人員は 534 万 2,427 人 ( 対前年比
山梨県地域医療再生計画 ( 峡南医療圏 : 救急 在宅医療に重点化 ) 現状 社保鰍沢病院 (158 床 ) 常勤医 9 名 実施後 社保鰍沢病院 峡南病院 (40 床 ) 3 名 市川三郷町立病院 (100 床 ) 7 名 峡南病院 救急の重点化 県下で最も過疎 高齢化が進行 飯富病院 (87 床
 山梨県地域医療再生計画 ( 峡南医療圏 : 救急 在宅医療に重点化 ) 現状 社保鰍沢病院 (158 床 ) 常勤医 9 名 実施後 社保鰍沢病院 峡南病院 (40 床 ) 3 名 市川三郷町立病院 (100 床 ) 7 名 峡南病院 救急の重点化 県下で最も過疎 高齢化が進行 飯富病院 (87 床 ) 7 名 身延山病院 (80 床 ) 9 名 脆弱な医療提供体制人口比の医師数は県下最低 しもべ病院
山梨県地域医療再生計画 ( 峡南医療圏 : 救急 在宅医療に重点化 ) 現状 社保鰍沢病院 (158 床 ) 常勤医 9 名 実施後 社保鰍沢病院 峡南病院 (40 床 ) 3 名 市川三郷町立病院 (100 床 ) 7 名 峡南病院 救急の重点化 県下で最も過疎 高齢化が進行 飯富病院 (87 床 ) 7 名 身延山病院 (80 床 ) 9 名 脆弱な医療提供体制人口比の医師数は県下最低 しもべ病院
厚生労働科学研究費補助金 (地域健康危機管理研究事業)
 平成 23 年度厚生労働科学研究費補助金循環器疾患 糖尿病等生活習慣病対策総合研究事業循環器疾患等の救命率向上に資する効果的な救急蘇生法の普及啓発に関する研究 (H21- 心筋 - 一般 -001) ( 研究代表者丸川征四郎 ) 平成 23 年度研究報告 研究課題 A AED の普及状況に係わる研究 研究分担者近藤久禎国立病院機構災害医療センター臨床研究部政策医療企画研究室長 平成 24(2012)
平成 23 年度厚生労働科学研究費補助金循環器疾患 糖尿病等生活習慣病対策総合研究事業循環器疾患等の救命率向上に資する効果的な救急蘇生法の普及啓発に関する研究 (H21- 心筋 - 一般 -001) ( 研究代表者丸川征四郎 ) 平成 23 年度研究報告 研究課題 A AED の普及状況に係わる研究 研究分担者近藤久禎国立病院機構災害医療センター臨床研究部政策医療企画研究室長 平成 24(2012)
Microsoft Word - 【発送版】製造所の登録通知
 薬食機参発 1003 第 1 号 平成 26 年 10 月 3 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いについて 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業は登録制に移行され
薬食機参発 1003 第 1 号 平成 26 年 10 月 3 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いについて 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業は登録制に移行され
目 次 頁 公 1 希少疾病治療薬の開発 創薬技術 戦略に関する研究及びそれらに係る 情報提供活動 ア研究助成事業 ( 公募 ) 1 創薬基盤推進研究事業 1 イ調査研究事業 1 1. 一般事業委員会 1 2. 運営委員会 1 3. 医療ニーズ調査班 2 4. 創薬技術調査班 2 5. 技術移転促進
 平成 30 年度 事業計画書 目 次 頁 公 1 希少疾病治療薬の開発 創薬技術 戦略に関する研究及びそれらに係る 情報提供活動 ア研究助成事業 ( 公募 ) 1 創薬基盤推進研究事業 1 イ調査研究事業 1 1. 一般事業委員会 1 2. 運営委員会 1 3. 医療ニーズ調査班 2 4. 創薬技術調査班 2 5. 技術移転促進ワーキンググループ 3 6. バイオ医薬検討ワーキンググループ 3 ウセミナー等の開催
平成 30 年度 事業計画書 目 次 頁 公 1 希少疾病治療薬の開発 創薬技術 戦略に関する研究及びそれらに係る 情報提供活動 ア研究助成事業 ( 公募 ) 1 創薬基盤推進研究事業 1 イ調査研究事業 1 1. 一般事業委員会 1 2. 運営委員会 1 3. 医療ニーズ調査班 2 4. 創薬技術調査班 2 5. 技術移転促進ワーキンググループ 3 6. バイオ医薬検討ワーキンググループ 3 ウセミナー等の開催
GVPの基礎
 京都府健康福祉部薬務課 平成 29 年 3 月 8 日 医薬品 医薬部外品 化粧品 医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令 (GVP 省令 ) GVP 省令 第一章 ( 総則 ) 第二章 ( 第一種製販の製造販売後安全管理の基準 ) 第三章 ( 第二種製販の製造販売後安全管理の基準 ) 第四章 ( 第三種製販の製造販売後安全管理の基準 ) 第五章 ( 雑則 ) 第一種 ~
京都府健康福祉部薬務課 平成 29 年 3 月 8 日 医薬品 医薬部外品 化粧品 医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令 (GVP 省令 ) GVP 省令 第一章 ( 総則 ) 第二章 ( 第一種製販の製造販売後安全管理の基準 ) 第三章 ( 第二種製販の製造販売後安全管理の基準 ) 第四章 ( 第三種製販の製造販売後安全管理の基準 ) 第五章 ( 雑則 ) 第一種 ~
地域医療構想の概要 1 地域医療構想の位置づけ 平成 25 年 3 月に 医療法に基づき 本県の疾病対策及び医療提供体制の基本方針である第 6 期岐阜県保健医療計画を策定した 平成 27 年 4 月に施行された改正医療法に基づき 保健医療計画の一部として 将来 (2025 年 ) あるべき医療提供体
 地域医療構想の概要 1 地域医療構想の位置づけ 平成 25 年 3 月に 医療法に基づき 本県の疾病対策及び医療提供体制の基本方針である第 6 期岐阜県保健医療計画を策定した 平成 27 年 4 月に施行された改正医療法に基づき 保健医療計画の一部として 将来 (2025 年 ) あるべき医療提供体制を 構想区域 (= 二次医療圏 ) を設定して策定することとされた 策定及び実現に向けての取組を検討する場として
地域医療構想の概要 1 地域医療構想の位置づけ 平成 25 年 3 月に 医療法に基づき 本県の疾病対策及び医療提供体制の基本方針である第 6 期岐阜県保健医療計画を策定した 平成 27 年 4 月に施行された改正医療法に基づき 保健医療計画の一部として 将来 (2025 年 ) あるべき医療提供体制を 構想区域 (= 二次医療圏 ) を設定して策定することとされた 策定及び実現に向けての取組を検討する場として
子宮頸がん予防措置の実施の推進に関する法律案要綱
 第一総則 子宮頸がん予防措置の実施の推進に関する法律案要綱 一目的 けいりこの法律は 子宮頸がんの罹患が女性の生活の質に多大な影響を与えるものであり 近年の子宮頸が んの罹患の若年化の進行が当該影響を一層深刻なものとしている状況及びその罹患による死亡率が高い 状況にあること並びに大部分の子宮頸がんにヒトパピローマウイルスが関与しており 予防ワクチンの 接種及び子宮頸部の前がん病変 ( 子宮頸がんに係る子宮頸部の異形成その他の子宮頸がんの発症前にお
第一総則 子宮頸がん予防措置の実施の推進に関する法律案要綱 一目的 けいりこの法律は 子宮頸がんの罹患が女性の生活の質に多大な影響を与えるものであり 近年の子宮頸が んの罹患の若年化の進行が当該影響を一層深刻なものとしている状況及びその罹患による死亡率が高い 状況にあること並びに大部分の子宮頸がんにヒトパピローマウイルスが関与しており 予防ワクチンの 接種及び子宮頸部の前がん病変 ( 子宮頸がんに係る子宮頸部の異形成その他の子宮頸がんの発症前にお
<4D F736F F D208D B B835896F2938A975E82CC8D6C82A695FB2E646F63>
 事務連絡平成 21 年 5 月 28 日 都道府県 各 保健所設置市 衛生主管部 ( 局 ) 特別区 感染症対策担当者及び新型インフルエンザ対策担当者殿 厚生労働省新型インフルエンザ対策推進本部事務局 新型インフルエンザの診療等に関する情報 ( 抗インフルエンザ薬の予防投与の考え方等 ) に係る Q&A の送付について 平成 21 年 5 月 3 日付新型インフルエンザ対策推進本部事務連絡 新型インフルエンザの診療等に関する情報
事務連絡平成 21 年 5 月 28 日 都道府県 各 保健所設置市 衛生主管部 ( 局 ) 特別区 感染症対策担当者及び新型インフルエンザ対策担当者殿 厚生労働省新型インフルエンザ対策推進本部事務局 新型インフルエンザの診療等に関する情報 ( 抗インフルエンザ薬の予防投与の考え方等 ) に係る Q&A の送付について 平成 21 年 5 月 3 日付新型インフルエンザ対策推進本部事務連絡 新型インフルエンザの診療等に関する情報
平成 26 年の救急出動件数等 ( 速報 ) 消防庁
 平成 27 年 3 月 31 日 消防庁 平成 26 年の救急出動件数等 ( 速報 ) の公表 平成 26 年中の救急出動件数等の速報を取りまとめましたので公表します 救急出動件数 搬送人員とも過去最多を記録 平成 26 年中の救急自動車による救急出動件数は598 万 2,849 件 ( 対前年比 7 万 1,568 件増 1.2% 増 ) 搬送人員は539 万 9,618 人 ( 対前年比 5 万
平成 27 年 3 月 31 日 消防庁 平成 26 年の救急出動件数等 ( 速報 ) の公表 平成 26 年中の救急出動件数等の速報を取りまとめましたので公表します 救急出動件数 搬送人員とも過去最多を記録 平成 26 年中の救急自動車による救急出動件数は598 万 2,849 件 ( 対前年比 7 万 1,568 件増 1.2% 増 ) 搬送人員は539 万 9,618 人 ( 対前年比 5 万
平成 30 年度データマネジャー養成研修 研修生募集要項 主催千葉大学医学部附属病院実施千葉大学医学部附属病院臨床試験部 1. 研修の目的 ICH-GCP の改訂や CDISC(Clinical Data Interchange Standards Consortium) 標準の規格での PMDA
 平成 30 年度データマネジャー養成研修 研修生募集要項 主催千葉大学医学部附属病院実施千葉大学医学部附属病院臨床試験部 1. 研修の目的 ICH-GCP の改訂や CDISC(Clinical Data Interchange Standards Consortium) 標準の規格での PMDA への申請データの提出など 治験や臨床研究のデータ管理を取り巻く環境が変化しています その中で 臨床試験のデータの質の維持
平成 30 年度データマネジャー養成研修 研修生募集要項 主催千葉大学医学部附属病院実施千葉大学医学部附属病院臨床試験部 1. 研修の目的 ICH-GCP の改訂や CDISC(Clinical Data Interchange Standards Consortium) 標準の規格での PMDA への申請データの提出など 治験や臨床研究のデータ管理を取り巻く環境が変化しています その中で 臨床試験のデータの質の維持
<4D F736F F F696E74202D E9197BF A8C928D4E88E397C390ED97AA814091CE8A4F90E096BE C A472E >
 資料 3 健康 医療戦略について 平成 25 年 6 月健康 医療戦略室 期待感好循環の形成 健康 医療戦略の概要 1. 基本的理念 (1) 健康長寿社会の実現社会保障と財政の持続可能性を確保する中で 健康長寿社会を実現し 活力ある社会を構築する (2) 経済成長への寄与医療関連産業を活性化し 我が国経済の成長に寄与する (3) 世界への貢献課題解決先進国として 超高齢化社会を乗り越えるモデルを世界に拡げる
資料 3 健康 医療戦略について 平成 25 年 6 月健康 医療戦略室 期待感好循環の形成 健康 医療戦略の概要 1. 基本的理念 (1) 健康長寿社会の実現社会保障と財政の持続可能性を確保する中で 健康長寿社会を実現し 活力ある社会を構築する (2) 経済成長への寄与医療関連産業を活性化し 我が国経済の成長に寄与する (3) 世界への貢献課題解決先進国として 超高齢化社会を乗り越えるモデルを世界に拡げる
<4D F736F F D E9197BF C A88E397C D A9944E90ED97AA915391CC94C E646F63>
 医療イノベーション 5 か年戦略 医療イノベーション会議 平成 24 年 6 月 6 日 目次 Ⅰ はじめに... 1 Ⅱ 視点及び目標... 4 Ⅲ 分野別戦略と推進方策... 7 Ⅲ-1 革新的医薬品 医療機器の創出... 7 Ⅲ-1-1 研究開発の推進と重点化... 7 Ⅲ-1-2 中小 ベンチャー企業の育成等... 14 Ⅲ-1-3 医薬品 医療機器開発支援体制の整備... 15 Ⅲ-1-4
医療イノベーション 5 か年戦略 医療イノベーション会議 平成 24 年 6 月 6 日 目次 Ⅰ はじめに... 1 Ⅱ 視点及び目標... 4 Ⅲ 分野別戦略と推進方策... 7 Ⅲ-1 革新的医薬品 医療機器の創出... 7 Ⅲ-1-1 研究開発の推進と重点化... 7 Ⅲ-1-2 中小 ベンチャー企業の育成等... 14 Ⅲ-1-3 医薬品 医療機器開発支援体制の整備... 15 Ⅲ-1-4
<4D F736F F D A835E838A F8B7982D18AC48DB85F20534F A68CEB8E9A E9A8F4390B38DCF2
 自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品 医療機器等の品質
 医療機器クラス分類表 ( 平成 30 年 10 月 19 日現在 ) 香川県健康福祉部薬務感染症対策課薬事指導グループ 法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品
医療機器クラス分類表 ( 平成 30 年 10 月 19 日現在 ) 香川県健康福祉部薬務感染症対策課薬事指導グループ 法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品
Microsoft Word - 奈良県GQP-GVPガイドライン doc
 三. 安全確保措置の実施に関する手順 1. 目的安全確保措置の実施に関する手順の目的を記載する < 記載例 > 本手順は GVP 省令の第 9 条に基づき 安全確保措置の実施を適正かつ円滑に行うために必要な手順を定めるものである 2. 適用範囲安全確保措置の実施に関する手順の適用範囲を記載する < 記載例 > 本手順書は 二. 安全管理情報の検討及びその結果に基づく安全確保措置の立案に関する手順 で立案された安全確保措置の決定
三. 安全確保措置の実施に関する手順 1. 目的安全確保措置の実施に関する手順の目的を記載する < 記載例 > 本手順は GVP 省令の第 9 条に基づき 安全確保措置の実施を適正かつ円滑に行うために必要な手順を定めるものである 2. 適用範囲安全確保措置の実施に関する手順の適用範囲を記載する < 記載例 > 本手順書は 二. 安全管理情報の検討及びその結果に基づく安全確保措置の立案に関する手順 で立案された安全確保措置の決定
MDSAP の調査結果の 試行的受入れについて ( 独 ) 医薬品医療機器総合機構 品質管理部 登録認証機関監督課 1
 MDSAP の調査結果の 試行的受入れについて ( 独 ) 医薬品医療機器総合機構 品質管理部 登録認証機関監督課 1 MDSAP 報告書の受入れの概要 (1/2) 日本は 平成 27 年 6 月にMDSAPに参加する旨を発表 関係者との意見交換を行い MDSAP 報告書の受け入れについて 以下の通知を発出した 平成 28 年 6 月 22 日薬生監麻発 0622 第 3 号 薬生機審発 0622
MDSAP の調査結果の 試行的受入れについて ( 独 ) 医薬品医療機器総合機構 品質管理部 登録認証機関監督課 1 MDSAP 報告書の受入れの概要 (1/2) 日本は 平成 27 年 6 月にMDSAPに参加する旨を発表 関係者との意見交換を行い MDSAP 報告書の受け入れについて 以下の通知を発出した 平成 28 年 6 月 22 日薬生監麻発 0622 第 3 号 薬生機審発 0622
はじめて医療機器を製造販売または製造される方へ
 を製造 ( 輸入 ) 販売するには 国内で必要な許可等について を製造販売 製造 ( 輸入 ) するためには 医薬品 等の品質 有効性及び安全性の確保等に関する法律 ( 以下 薬機法という ) の許可等 ( 製造販売業許可 製造業登録 ) が必要になります 製品を市場に出荷するために必要な許可 販売する製品に対して最終責製造販売業任を持ち 自社の名前で市場へ出荷する この許可では製造することはできません
を製造 ( 輸入 ) 販売するには 国内で必要な許可等について を製造販売 製造 ( 輸入 ) するためには 医薬品 等の品質 有効性及び安全性の確保等に関する法律 ( 以下 薬機法という ) の許可等 ( 製造販売業許可 製造業登録 ) が必要になります 製品を市場に出荷するために必要な許可 販売する製品に対して最終責製造販売業任を持ち 自社の名前で市場へ出荷する この許可では製造することはできません
Microsoft Word - 報告書 最終1116.doc
 で薬剤師 臨床検査技師 臨床心理士等となっている 一方 同調査では CRC 養成研修修了者の約半数は CRC 業務や治験事務局業務に携わることなく 治験以外の業務に従事している実態が明らかとなっており CRC の現状について詳細な調査が必要である CRC の認定制度は 現在 我が国では 日本臨床薬理学会 日本 SMO 協会 SoCRA(The Society of Clinical Research
で薬剤師 臨床検査技師 臨床心理士等となっている 一方 同調査では CRC 養成研修修了者の約半数は CRC 業務や治験事務局業務に携わることなく 治験以外の業務に従事している実態が明らかとなっており CRC の現状について詳細な調査が必要である CRC の認定制度は 現在 我が国では 日本臨床薬理学会 日本 SMO 協会 SoCRA(The Society of Clinical Research
Microsoft PowerPoint 中期工程表.pptx
 中短期工程表 国民の 健康寿命 の延伸 1 効果的な予防サービスや健康管理の充実により 健やかに生活し 老いることができる社会概算要求税制改正要望等 健康寿命延伸産業の育成 関連規制のグレーゾーン解消 新サービス等の品質保証 リスク補填等の政策パッケージ策定 法案提出等 予防 健康管理の推進に関する新たな仕組みづくり 健康保険法等に基づく厚生労働大臣指針 ( 告示 ) 改正 糖尿病性腎症患者重症化予防事業等の好事例の横展開に向けた支援策のための調整
中短期工程表 国民の 健康寿命 の延伸 1 効果的な予防サービスや健康管理の充実により 健やかに生活し 老いることができる社会概算要求税制改正要望等 健康寿命延伸産業の育成 関連規制のグレーゾーン解消 新サービス等の品質保証 リスク補填等の政策パッケージ策定 法案提出等 予防 健康管理の推進に関する新たな仕組みづくり 健康保険法等に基づく厚生労働大臣指針 ( 告示 ) 改正 糖尿病性腎症患者重症化予防事業等の好事例の横展開に向けた支援策のための調整
2. 各論 (1) 世界最高水準の医療の提供に資する医療分野の研究開発等に関する施策 基礎的な研究開発から実用化のための研究開発までの一貫した研究開発を推進し その成果の円滑な実用化により 世界最高水準の医療の提供に寄与 これにより 医薬品 医療機器等及び医療技術関連分野における産業競争力の向上を目
 健康 医療戦略 ( 案 ) 概要 参考 1 はじめに 世界に先駆けて超高齢社会を迎える我が国にあって 課題解決先進国として 健康長寿社会の形成に向け 世界最先端の医療技術 サービスを実現し 健康寿命をさらに伸ばすことが重要 健康長寿社会の形成に資する新たな産業活動の創出やこれらの産業の海外における展開を促進することにより 海外における医療の質の向上にも寄与しつつ これらの産業を戦略産業として育成し
健康 医療戦略 ( 案 ) 概要 参考 1 はじめに 世界に先駆けて超高齢社会を迎える我が国にあって 課題解決先進国として 健康長寿社会の形成に向け 世界最先端の医療技術 サービスを実現し 健康寿命をさらに伸ばすことが重要 健康長寿社会の形成に資する新たな産業活動の創出やこれらの産業の海外における展開を促進することにより 海外における医療の質の向上にも寄与しつつ これらの産業を戦略産業として育成し
Microsoft Word - 【案1】登録認証機関立入要領改正通知(Ver )
 薬食機参発 1121 第 38 号平成 26 年 11 月 21 日 各登録認証機関の長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) 登録認証機関等に対する立入検査の実施要領の改正について 薬事法 ( 昭和 35 年法律第 145 号 ) の規定による登録認証機関等に対する立入 検査の実施要領については 登録認証機関等に対する立入検査の実施要領について ( 平成 18
薬食機参発 1121 第 38 号平成 26 年 11 月 21 日 各登録認証機関の長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) 登録認証機関等に対する立入検査の実施要領の改正について 薬事法 ( 昭和 35 年法律第 145 号 ) の規定による登録認証機関等に対する立入 検査の実施要領については 登録認証機関等に対する立入検査の実施要領について ( 平成 18
国立病院機構大阪医療センター受託研究取扱細則
 国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
07案3団体あて臨床研究法COI通知
 様式 A 利益相反管理基準 ver.3.0 日付所属機関立場氏名利用基準 研究課題 : 基準 1 基準 2 研究責任医師は 次に掲げる事項について 研究計画書及び説明文書に記載し 研究結果の公表時に開示すること 研究責任医師以外の者が研究成果を公表する場合も 同様に開示すること 1 規則第 21 条第 1 項第 1 号に規定する関与 ( 研究に対する関与 ) として 次に掲げる関与が有る場合には その内容ア医薬品等製造販売業者
様式 A 利益相反管理基準 ver.3.0 日付所属機関立場氏名利用基準 研究課題 : 基準 1 基準 2 研究責任医師は 次に掲げる事項について 研究計画書及び説明文書に記載し 研究結果の公表時に開示すること 研究責任医師以外の者が研究成果を公表する場合も 同様に開示すること 1 規則第 21 条第 1 項第 1 号に規定する関与 ( 研究に対する関与 ) として 次に掲げる関与が有る場合には その内容ア医薬品等製造販売業者
平成 27 年の救急出動件数等 ( 速報 ) 消防庁
 平成 28 年 3 月 29 日 消防庁 平成 27 年の救急出動件数等 ( 速報 ) の公表 平成 27 年中の救急出動件数等の速報を取りまとめましたので公表します 救急出動件数 搬送人員とも過去最多を記録 平成 27 年中の救急自動車による救急出動件数は 605 万 1,168 件 ( 対前年比 6 万 6,247 件増 1.1% 増 ) 搬送人員は 546 万 5,879 人 ( 対前年比 5
平成 28 年 3 月 29 日 消防庁 平成 27 年の救急出動件数等 ( 速報 ) の公表 平成 27 年中の救急出動件数等の速報を取りまとめましたので公表します 救急出動件数 搬送人員とも過去最多を記録 平成 27 年中の救急自動車による救急出動件数は 605 万 1,168 件 ( 対前年比 6 万 6,247 件増 1.1% 増 ) 搬送人員は 546 万 5,879 人 ( 対前年比 5
<4D F736F F D2088E396F EBF B B836788CB978A95B6>
 アンケート依頼文 医薬品品質システムガイドライン (ICHQ10 の実践導入についてのアンケート平成 22 年 11 月 19 日 ICH の医薬品質システム (Q10 ガイドラインが本年 2 月に厚生労働省より通知をされました このガイドラインは 国際標準化機構 (ISO の品質概念に基づき 製造管理及び品質管理に関する基準 (GMP を包含し ICH Q8 製剤開発 及び ICH Q9 品質リスクマネジメント
アンケート依頼文 医薬品品質システムガイドライン (ICHQ10 の実践導入についてのアンケート平成 22 年 11 月 19 日 ICH の医薬品質システム (Q10 ガイドラインが本年 2 月に厚生労働省より通知をされました このガイドラインは 国際標準化機構 (ISO の品質概念に基づき 製造管理及び品質管理に関する基準 (GMP を包含し ICH Q8 製剤開発 及び ICH Q9 品質リスクマネジメント
京都府がん対策推進条例をここに公布する 平成 23 年 3 月 18 日 京都府知事山田啓二 京都府条例第 7 号 京都府がん対策推進条例 目次 第 1 章 総則 ( 第 1 条 - 第 6 条 ) 第 2 章 がん対策に関する施策 ( 第 7 条 - 第 15 条 ) 第 3 章 がん対策の推進
 京都府がん対策推進条例をここに公布する 平成 23 年 3 月 18 日 京都府知事山田啓二 京都府条例第 7 号 京都府がん対策推進条例 目次 第 1 章 総則 ( 第 1 条 - 第 6 条 ) 第 2 章 がん対策に関する施策 ( 第 7 条 - 第 15 条 ) 第 3 章 がん対策の推進 ( 第 16 条 - 第 18 条 ) 第 4 章 雑則 ( 第 19 条 第 20 条 ) 附則 第
京都府がん対策推進条例をここに公布する 平成 23 年 3 月 18 日 京都府知事山田啓二 京都府条例第 7 号 京都府がん対策推進条例 目次 第 1 章 総則 ( 第 1 条 - 第 6 条 ) 第 2 章 がん対策に関する施策 ( 第 7 条 - 第 15 条 ) 第 3 章 がん対策の推進 ( 第 16 条 - 第 18 条 ) 第 4 章 雑則 ( 第 19 条 第 20 条 ) 附則 第
指定大学院一覧(差替).xlsx
 指定大学院臨床心理学専攻 ( コース ) 一覧第 1 種指定大学院 (159 校 / 修了後 直近の審査の受験可 ) 平成 29 年 (2017) 年 4 月 1 日現在 所在県名種別大学院名研究科名専攻名領域 ( コース ) 名 1 北海道 国 北海道大学大学院 教育学院 教育学専攻 臨床心理学講座 2 北海道 私 札幌学院大学大学院 臨床心理学研究科 臨床心理学専攻 3 北海道 私 札幌国際大学大学院
指定大学院臨床心理学専攻 ( コース ) 一覧第 1 種指定大学院 (159 校 / 修了後 直近の審査の受験可 ) 平成 29 年 (2017) 年 4 月 1 日現在 所在県名種別大学院名研究科名専攻名領域 ( コース ) 名 1 北海道 国 北海道大学大学院 教育学院 教育学専攻 臨床心理学講座 2 北海道 私 札幌学院大学大学院 臨床心理学研究科 臨床心理学専攻 3 北海道 私 札幌国際大学大学院
手順書03
 杏林大学医学部倫理委員会 人を対象とする医学系研究に関する業務手順書 ➂ 研究計画書の作成等に関する手続等 1 はじめに本手順書は 杏林大学医学部倫理委員会規程に基づき 杏林大学医学部及び医学部付属病院の専任教職員が行う人を対象とした医学系研究について 医の倫理に関するヘルシンキ宣言の趣旨に添い 人を対象とする医学系研究に関する倫理指針及び その他関連通知に基づいて適正かつ円滑に行われるよう これらの研究等に係る必要な手順を定めるものである
杏林大学医学部倫理委員会 人を対象とする医学系研究に関する業務手順書 ➂ 研究計画書の作成等に関する手続等 1 はじめに本手順書は 杏林大学医学部倫理委員会規程に基づき 杏林大学医学部及び医学部付属病院の専任教職員が行う人を対象とした医学系研究について 医の倫理に関するヘルシンキ宣言の趣旨に添い 人を対象とする医学系研究に関する倫理指針及び その他関連通知に基づいて適正かつ円滑に行われるよう これらの研究等に係る必要な手順を定めるものである
改めて各法人をグループ分けしてみると 中規模病院有大学の大半が 対 17 年度比 90% 未満の最も削減率の大きいグループに転落することが分かる このことの背景には 病院部門については医療の質の向上と法人の収入確保のために人員の強化が図られた一方で 総人件費改革に対応するために他分野での人員削減を余
 2.2.4 人件費削減の影響 - 常勤教員に関して教員と職員のそれぞれに関して 大学類型によって また常勤と非常勤の違いによって 人件費の増減が異なることを見たが こうした支出の変化が実際にどのような影響を与えたのだろうか 常勤教員と非常勤教員 並びに常勤職員と非常勤職員の4 類型の中で 常勤教員については 3 年に1 度行われる学校教員統計調査によって一定の情報を得ることが可能である 表 2-2
2.2.4 人件費削減の影響 - 常勤教員に関して教員と職員のそれぞれに関して 大学類型によって また常勤と非常勤の違いによって 人件費の増減が異なることを見たが こうした支出の変化が実際にどのような影響を与えたのだろうか 常勤教員と非常勤教員 並びに常勤職員と非常勤職員の4 類型の中で 常勤教員については 3 年に1 度行われる学校教員統計調査によって一定の情報を得ることが可能である 表 2-2
疫学研究の病院HPによる情報公開 様式の作成について
 阪大版 課題名 新薬創出を加速する人工知能の開発 研究対象者 呼吸器系 免疫疾患における細胞外小胞に着目した病態解明及び診断法の開発 にご協力いただきました患者さま 2012 年 4 月 1 日から 2019 年 3 月 31 日までの期間に大阪大学医学部附属病院内において 間質性肺炎 並びに 特発性肺線維症 と診断されて 研究課題名 呼吸器系 免疫疾患における細胞外小胞に着目した病態解明及び診断法の開発
阪大版 課題名 新薬創出を加速する人工知能の開発 研究対象者 呼吸器系 免疫疾患における細胞外小胞に着目した病態解明及び診断法の開発 にご協力いただきました患者さま 2012 年 4 月 1 日から 2019 年 3 月 31 日までの期間に大阪大学医学部附属病院内において 間質性肺炎 並びに 特発性肺線維症 と診断されて 研究課題名 呼吸器系 免疫疾患における細胞外小胞に着目した病態解明及び診断法の開発
資料 5 総務省提出資料 平成 30 年 12 月 21 日 総務省情報流通行政局
 資料 5 総務省提出資料 平成 30 年 12 月 21 日 総務省情報流通行政局 日本の放送コンテンツ海外輸出額の推移 1 日本の放送コンテンツ海外輸出額は 2010 年度以降 毎年増加を続け 2016 年度末で 393.5 億円 ( 対前年度比 36.4% 増 ) 放送コンテンツの海外展開については 従来の目標として 2018 年度までに放送コンテンツ関連海外市場売上高を現在 (2010 年度
資料 5 総務省提出資料 平成 30 年 12 月 21 日 総務省情報流通行政局 日本の放送コンテンツ海外輸出額の推移 1 日本の放送コンテンツ海外輸出額は 2010 年度以降 毎年増加を続け 2016 年度末で 393.5 億円 ( 対前年度比 36.4% 増 ) 放送コンテンツの海外展開については 従来の目標として 2018 年度までに放送コンテンツ関連海外市場売上高を現在 (2010 年度
精神医学研究 教育と精神医療を繋ぐ 双方向の対話 10:00 11:00 特別講演 3 司会 尾崎 紀夫 JSL3 名古屋大学大学院医学系研究科精神医学 親と子どもの心療学分野 AMED のミッション 情報共有と分散統合 末松 誠 国立研究開発法人日本医療研究開発機構 11:10 12:10 特別講
 The 113th Annual Meeting of the Japanese Society of Psychiatry and Neurology -94- 精神医学研究 教育と精神医療を繋ぐ 双方向の対話 10:00 11:00 特別講演 3 司会 尾崎 紀夫 JSL3 名古屋大学大学院医学系研究科精神医学 親と子どもの心療学分野 AMED のミッション 情報共有と分散統合 末松 誠 国立研究開発法人日本医療研究開発機構
The 113th Annual Meeting of the Japanese Society of Psychiatry and Neurology -94- 精神医学研究 教育と精神医療を繋ぐ 双方向の対話 10:00 11:00 特別講演 3 司会 尾崎 紀夫 JSL3 名古屋大学大学院医学系研究科精神医学 親と子どもの心療学分野 AMED のミッション 情報共有と分散統合 末松 誠 国立研究開発法人日本医療研究開発機構
1. ストーマ外来 の問い合わせ窓口 1 ストーマ外来が設定されている ( / ) 上記外来の名称 ストマ外来 対象となるストーマの種類 コロストーマとウロストーマ 4 大腸がん 腎がん 膀胱がん ストーマ管理 ( 腎ろう, 膀胱ろう含む ) ろう孔管理 (PEG 含む ) 尿失禁の管理 ストーマ外
 がんの診療に関連した専門外来の問い合わせ窓口 記載の有無 あり とするとデータ抽出の対象となります 記載する内容がない場合は なし としてください なし の場合は以下について記入の必要はありません 病院名 : 岐阜大学医学部附属病院 平成 9 年 9 月 1 日現在 あり がん診療に関連した専門外来の の項目は 以下の表の疾患名を用いて記載してください 表の中に 該当する病名がない場合は その病名を直接記載してください
がんの診療に関連した専門外来の問い合わせ窓口 記載の有無 あり とするとデータ抽出の対象となります 記載する内容がない場合は なし としてください なし の場合は以下について記入の必要はありません 病院名 : 岐阜大学医学部附属病院 平成 9 年 9 月 1 日現在 あり がん診療に関連した専門外来の の項目は 以下の表の疾患名を用いて記載してください 表の中に 該当する病名がない場合は その病名を直接記載してください
健康研究推進戦略 概要版 平成 21 年 7 月 31 日 健康研究推進会議
 健康研究推進戦略 概要版 平成 21 年 7 月 31 日 健康研究推進会議 健康研究推進戦略策定の背景 ライフサイエンスの成果を 新しい治療法や医薬品 医療機器として社会に還元していくための健康研究 ( 橋渡し研究 臨床研究 ) の強力な推進が不可欠 我が国の優れたライフサイエンスの成果を いち早く新しい医薬品 医療機器等として国民の福利厚生に活かされることの期待が高い 臨床研究分野の論文数が少なく
健康研究推進戦略 概要版 平成 21 年 7 月 31 日 健康研究推進会議 健康研究推進戦略策定の背景 ライフサイエンスの成果を 新しい治療法や医薬品 医療機器として社会に還元していくための健康研究 ( 橋渡し研究 臨床研究 ) の強力な推進が不可欠 我が国の優れたライフサイエンスの成果を いち早く新しい医薬品 医療機器等として国民の福利厚生に活かされることの期待が高い 臨床研究分野の論文数が少なく
QbDを用いた新薬申請の審査とGMP適合性調査 -現状及び課題-
 QbD を用いた新薬申請の 審査と GMP 適合性調査 - 現状及び課題 - 医薬品医療機器総合機構 新薬審査第五部 松田嘉弘 品質管理部 森末政利 審査の視点から 本日の内容 ICH Q8 Q9 Q10 Q11について QbD 申請の状況 審査の事例 審査における課題 調査の視点から GMP 調査とQbD 調査のポイント 調査の事例 QbDが実現すること ICH Q8 Q9 Q10 Q11 について
QbD を用いた新薬申請の 審査と GMP 適合性調査 - 現状及び課題 - 医薬品医療機器総合機構 新薬審査第五部 松田嘉弘 品質管理部 森末政利 審査の視点から 本日の内容 ICH Q8 Q9 Q10 Q11について QbD 申請の状況 審査の事例 審査における課題 調査の視点から GMP 調査とQbD 調査のポイント 調査の事例 QbDが実現すること ICH Q8 Q9 Q10 Q11 について
特定臨床研究に関する手順書
 学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
(別紙1)
 仕様書 ( 実施計画書 ) 資料 1 Ⅰ. 事業の目的ハンズオン支援事務局 ( 地方ブロック毎の地域事務局と全国 1ヵ所の全国事務局の総称 ) を設置し マーケティング等に精通した専門家が 以下の3つの事業活動の促進を図るため 事業計画の策定から事業実施段階まで アドバイスやマッチングなどきめ細かな支援を行うことを目的とする 1 中小企業の新たな事業活動の促進に関する法律 に基づく 異分野の中小企業の有機的連携による新たな事業活動
仕様書 ( 実施計画書 ) 資料 1 Ⅰ. 事業の目的ハンズオン支援事務局 ( 地方ブロック毎の地域事務局と全国 1ヵ所の全国事務局の総称 ) を設置し マーケティング等に精通した専門家が 以下の3つの事業活動の促進を図るため 事業計画の策定から事業実施段階まで アドバイスやマッチングなどきめ細かな支援を行うことを目的とする 1 中小企業の新たな事業活動の促進に関する法律 に基づく 異分野の中小企業の有機的連携による新たな事業活動
平成 23 年 7 月 5 日 米国医療機器 IVD 工業会 (AMDD) 会長デイビット W. パウエル 欧州ビジネス協会 (EBC) 医療機器委員会 委員長ダニー リスバーグ 医療機器 ( 体外診断用検査機器を含む ) の薬事法改正に係る提言 はじめに 医薬品は新しい有効成分を探しあるいは創り
 医療機器の薬事法改正に係る米国医療機器 IVD 工業会 (AMDD) 欧州ビジネス協会 (EBC) 共同提言書 平成 23 年 7 月 5 日 米国医療機器 IVD 工業会 (AMDD) 会長デイビット W. パウエル 欧州ビジネス協会 (EBC) 医療機器委員会 委員長ダニー リスバーグ 医療機器 ( 体外診断用検査機器を含む ) の薬事法改正に係る提言 はじめに 医薬品は新しい有効成分を探しあるいは創り
医療機器の薬事法改正に係る米国医療機器 IVD 工業会 (AMDD) 欧州ビジネス協会 (EBC) 共同提言書 平成 23 年 7 月 5 日 米国医療機器 IVD 工業会 (AMDD) 会長デイビット W. パウエル 欧州ビジネス協会 (EBC) 医療機器委員会 委員長ダニー リスバーグ 医療機器 ( 体外診断用検査機器を含む ) の薬事法改正に係る提言 はじめに 医薬品は新しい有効成分を探しあるいは創り
< F2D91E682588E9F90AE94F58C7689E681698DC58F49816A2E6A7464>
 中央卸売市場整備計画 平成 23 年 3 月 農林水産省 中央卸売市場整備計画の公表について 卸売市場法 ( 昭和 46 年法律第 35 号 ) 第 5 条第 1 項及び卸売市場法施行令 ( 昭和 46 年政令 第 221 号 ) 第 4 条の規定に基づき 平成 27 年度を目標年度とする中央卸売市場整備計画を 次のとおり定めたので 同法第 5 条第 4 項の規定により公表する 平成 23 年 3
中央卸売市場整備計画 平成 23 年 3 月 農林水産省 中央卸売市場整備計画の公表について 卸売市場法 ( 昭和 46 年法律第 35 号 ) 第 5 条第 1 項及び卸売市場法施行令 ( 昭和 46 年政令 第 221 号 ) 第 4 条の規定に基づき 平成 27 年度を目標年度とする中央卸売市場整備計画を 次のとおり定めたので 同法第 5 条第 4 項の規定により公表する 平成 23 年 3
○ 第1~8表、図1~4(平成25年度公立学校教員採用選考試験の実施状況について)
 第 1 表応募者数 受験者数 採用者数 競争率 応募者数受験者数採用者数競争率女性 ( 内数 ) 女性 ( 内数 ) ( 倍率 ) 64,093 58,703 31,192 13,626 7,956 4.3 中学校 70,507 62,998 26,228 8,383 3,582 7.5 高等学校 41,760 37,812 12,184 4,912 1,616 7.7 特別支援学校 11,054
第 1 表応募者数 受験者数 採用者数 競争率 応募者数受験者数採用者数競争率女性 ( 内数 ) 女性 ( 内数 ) ( 倍率 ) 64,093 58,703 31,192 13,626 7,956 4.3 中学校 70,507 62,998 26,228 8,383 3,582 7.5 高等学校 41,760 37,812 12,184 4,912 1,616 7.7 特別支援学校 11,054
2 大腿膝窩動脈ステントの耐久性試験法の開発と ガイドライン案作成 (2) 血液適合性評価試験 4 左心補助人工心臓脱血管の in vitro 血栓性試験法の開発 (3) 国産人工弁開発に伴う非臨床性能試験 6 腱索機能を有する人工僧帽弁の非臨床性能試験法の開発 (5) ナビゲーション ロボット評価
 別添様式 革新的医薬品 医療機器 再生医療等製品実用化促進事業最終報告書 ( 平成 24 年度 ~28 年度 ) 研究機関名 : 早稲田大学先端生命医科学センター (TWIns) 研究事業名 革新的医療機器実用化のための Engineering Based Medicine に基づく非臨床性能評価系と評価方法の確立 分 類 医薬品主体 医療機器主体 再生医療主体 1. 研究の概要革新的医療機器を迅速かつ安全に開発
別添様式 革新的医薬品 医療機器 再生医療等製品実用化促進事業最終報告書 ( 平成 24 年度 ~28 年度 ) 研究機関名 : 早稲田大学先端生命医科学センター (TWIns) 研究事業名 革新的医療機器実用化のための Engineering Based Medicine に基づく非臨床性能評価系と評価方法の確立 分 類 医薬品主体 医療機器主体 再生医療主体 1. 研究の概要革新的医療機器を迅速かつ安全に開発
Microsoft PowerPoint - ⑨140925,30日薬連講習会(後発RMP)930.ppt [互換モード]
![Microsoft PowerPoint - ⑨140925,30日薬連講習会(後発RMP)930.ppt [互換モード] Microsoft PowerPoint - ⑨140925,30日薬連講習会(後発RMP)930.ppt [互換モード]](/thumbs/101/151698947.jpg) 後発医薬品 RMP について 厚生労働省医薬食品局安全対策課磯﨑正季子 1 後発医薬品への RMP の適用 平成 24 年 4 月 11 日薬食安発 0411 第 1 号 薬食審査発 0411 第 2 号安全対策課長 審査管理課長連名通知 医薬品リスク管理計画指針について 適用範囲医療用医薬品 ( 新医薬品 バイオ後続品 後発医薬品 ) 策定検討の時点 承認申請時 新医薬品 バイオ後続品後発医薬品
後発医薬品 RMP について 厚生労働省医薬食品局安全対策課磯﨑正季子 1 後発医薬品への RMP の適用 平成 24 年 4 月 11 日薬食安発 0411 第 1 号 薬食審査発 0411 第 2 号安全対策課長 審査管理課長連名通知 医薬品リスク管理計画指針について 適用範囲医療用医薬品 ( 新医薬品 バイオ後続品 後発医薬品 ) 策定検討の時点 承認申請時 新医薬品 バイオ後続品後発医薬品
2 保険者協議会からの意見 ( 医療法第 30 条の 4 第 14 項の規定に基づく意見聴取 ) (1) 照会日平成 28 年 3 月 3 日 ( 同日開催の保険者協議会において説明も実施 ) (2) 期限平成 28 年 3 月 30 日 (3) 意見数 25 件 ( 総論 3 件 各論 22 件
 資料 1-1 地域医療構想 ( 案 ) に対する意見について 1 市町村からの意見 ( 医療法第 30 条の 4 第 14 項の規定に基づく意見聴取 ) (1) 照会日平成 28 年 3 月 3 日 (2) 期限平成 28 年 3 月 30 日 (3) 意件数 5 件 (4 市 ) (4) 意見の内容 主な意見と県の回答 1 医療提供体制について 日常の医療 緊急時の医療 在宅医療体制の整備 特に周産期
資料 1-1 地域医療構想 ( 案 ) に対する意見について 1 市町村からの意見 ( 医療法第 30 条の 4 第 14 項の規定に基づく意見聴取 ) (1) 照会日平成 28 年 3 月 3 日 (2) 期限平成 28 年 3 月 30 日 (3) 意件数 5 件 (4 市 ) (4) 意見の内容 主な意見と県の回答 1 医療提供体制について 日常の医療 緊急時の医療 在宅医療体制の整備 特に周産期
JCROA自主ガイドライン第4版案 GCP監査WG改訂案及び意見
 受託業務の適正な実施に関する日本 CRO 協会の自主ガイドライン ( 第 4 版 ) 目 次 1. 本ガイドライン制定の背景 2. 目的 3. 関連法規の遵守 4. 受託業務の範囲 5. 受託の検討 6. 受託業務の品質管理及び品質保証 7. 健康被害補償と損害賠償 8. 教育 9. モニタリング 10. 情報セキュリティ 11. 本会員の重大事態への対応 1/5 1. 本ガイドライン制定の背景日本
受託業務の適正な実施に関する日本 CRO 協会の自主ガイドライン ( 第 4 版 ) 目 次 1. 本ガイドライン制定の背景 2. 目的 3. 関連法規の遵守 4. 受託業務の範囲 5. 受託の検討 6. 受託業務の品質管理及び品質保証 7. 健康被害補償と損害賠償 8. 教育 9. モニタリング 10. 情報セキュリティ 11. 本会員の重大事態への対応 1/5 1. 本ガイドライン制定の背景日本
untitled
 資料 2 参考資料 1 主務府省名 独立行政法人名 独立行政法人の資産及び負債の状況 ( 平成 17 年度末 )( 未定稿 ) 土地 1 建物 2 小計 3(1+2) 資産 貸付金 4 その他 5 合計 3+4+5 長期借入金 6 債券 7 負債 小計 8(6+7) その他 9 ( 単位 : 億円 ) 内閣府 国立公文書館 9 47 56 13 69 10 10 国民生活センター 63 13 76
資料 2 参考資料 1 主務府省名 独立行政法人名 独立行政法人の資産及び負債の状況 ( 平成 17 年度末 )( 未定稿 ) 土地 1 建物 2 小計 3(1+2) 資産 貸付金 4 その他 5 合計 3+4+5 長期借入金 6 債券 7 負債 小計 8(6+7) その他 9 ( 単位 : 億円 ) 内閣府 国立公文書館 9 47 56 13 69 10 10 国民生活センター 63 13 76
< E B B798E7793B188F5936F985E8ED EA97975F8E9696B18BC CBB8DDD816A E786C7378>
 1 コーチ 802001677 宮崎 744500076 2 コーチ 802004883 宮崎 744500098 3 コーチ 802005298 北海道 740100003 4 コーチ 802006099 宮城 740400015 5 コーチ 802009308 大阪 742700351 6 コーチ 802012742 沖縄 744700018 7 コーチ 802012867 静岡 742100061
1 コーチ 802001677 宮崎 744500076 2 コーチ 802004883 宮崎 744500098 3 コーチ 802005298 北海道 740100003 4 コーチ 802006099 宮城 740400015 5 コーチ 802009308 大阪 742700351 6 コーチ 802012742 沖縄 744700018 7 コーチ 802012867 静岡 742100061
北里大学グローバル臨床研究拠点
 日本主導型グローバル臨床研究 体制整備 : 北里大学の取り組み 1 1. 事業概要 目的 1. グローバル臨床研究の立案から実施 結果の公表まで グローバル開発の入り口から出口まで を多角的に支援できる体制を強化する 2. 法人内外のネットワークを活用し 日本発の創薬 医療機器シーズを育成する キャッチフレーズ 実学の精神 のもと オール北里体制で日本主導型グローバル臨床研究推進の中核を担う 2 学校法人北里研究所
日本主導型グローバル臨床研究 体制整備 : 北里大学の取り組み 1 1. 事業概要 目的 1. グローバル臨床研究の立案から実施 結果の公表まで グローバル開発の入り口から出口まで を多角的に支援できる体制を強化する 2. 法人内外のネットワークを活用し 日本発の創薬 医療機器シーズを育成する キャッチフレーズ 実学の精神 のもと オール北里体制で日本主導型グローバル臨床研究推進の中核を担う 2 学校法人北里研究所
PSP 省令 と それぞれ略称する 記 1. 改正施行規則について希少疾病用医療機器その他の医療上特にその必要性が高いと認められる医療機器であり かつ 当該医療機器についての臨床試験の実施に特に長期間を要すると認められるものに係る承認申請をする場合においては 改正 GVP 省令第 9 条の3 第 1
 薬生発 07 31 第 4 号 平成 29 年 7 月 31 日 各都道府県知事殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則の一部を改正する省令 医薬品 医薬部外品 化粧品 医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令の一部を改正する省令 及び 医療機器の製造販売後の調査及び試験の実施の基準に関する省令の一部を改正する省令
薬生発 07 31 第 4 号 平成 29 年 7 月 31 日 各都道府県知事殿 厚生労働省医薬 生活衛生局長 ( 公印省略 ) 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則の一部を改正する省令 医薬品 医薬部外品 化粧品 医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令の一部を改正する省令 及び 医療機器の製造販売後の調査及び試験の実施の基準に関する省令の一部を改正する省令
第 40 回 看護総合 2009 年 平成 21 年 2009/7/18-19 京都府京都市 2009 年 2010 年 精神看護 2009/7/23-24 島根県松江市 2009 年 2010 年 母性看護 2009/8/6-7 佐賀県佐賀市 2009 年 2010 年 看護教育 2009/8/2
 学術集会開催実績および冊子発行年 回 学術集会は各回の開催順に掲載 第 49 回 精神看護 2018 年 平成 30 年 2018/7/19-20 徳島県徳島市 2018 年 2019 年 在宅看護 2018/7/27-28 佐賀県佐賀市 2018 年 2019 年 看護管理 2018/8/9-10 宮城県仙台市 2018 年 2019 年 看護教育 2018/8/16-17 広島県広島市 2018
学術集会開催実績および冊子発行年 回 学術集会は各回の開催順に掲載 第 49 回 精神看護 2018 年 平成 30 年 2018/7/19-20 徳島県徳島市 2018 年 2019 年 在宅看護 2018/7/27-28 佐賀県佐賀市 2018 年 2019 年 看護管理 2018/8/9-10 宮城県仙台市 2018 年 2019 年 看護教育 2018/8/16-17 広島県広島市 2018
薬事法等の一部改正に伴う特許法施行令改正に係る事前評価書
 薬事法等の一部改正に伴う特許法施行令改正に係る事前評価書 1. 政策の名称 薬事法改正に伴い新たに定義される再生医療等製品に係る製造販売の承認を特許権 の存続期間の延長登録の理由となる処分に追加するべく措置を講じる政策 2. 担当部局 経済産業省特許庁審査第一部調整課審査基準室長滝口尚良 電話番号 : 03-3501-0046 e-mail: PA2A10@jpo.go.jp 3. 評価実施時期 平成
薬事法等の一部改正に伴う特許法施行令改正に係る事前評価書 1. 政策の名称 薬事法改正に伴い新たに定義される再生医療等製品に係る製造販売の承認を特許権 の存続期間の延長登録の理由となる処分に追加するべく措置を講じる政策 2. 担当部局 経済産業省特許庁審査第一部調整課審査基準室長滝口尚良 電話番号 : 03-3501-0046 e-mail: PA2A10@jpo.go.jp 3. 評価実施時期 平成
住環境テ サ イン学科 建築環境工学住居 建築デザイン 准教授または講師教授または准教授 住環境設備 住環境工学 環境工学演習 環境計画演習ほか住居計画 住環境デザイン概論 設計演習ほか 博士 ( または Ph.D) の学位を有する方 もしくは取得を目指して研究を進めている方 博士 ( または Ph
 採用時期 :207 年 0 月 日応募期限 :207 年 5 月 2 日 ( 金 ) 摂南大学教員公募内容一覧 学部 薬学教育 特任講師任期 2 年 6 ヵ月 物理学 有機化学 Ⅰ 物理化学 Ⅰ 基盤実習ほか 薬剤師免許 (*) を有すること ( 見込み可 ) 2 博士の学位を持っていることが望ましい 3 化学 物理等に関する教育 研究能力の高いこと 薬学部 薬学科 微生物学 特任助教任期 2 年
採用時期 :207 年 0 月 日応募期限 :207 年 5 月 2 日 ( 金 ) 摂南大学教員公募内容一覧 学部 薬学教育 特任講師任期 2 年 6 ヵ月 物理学 有機化学 Ⅰ 物理化学 Ⅰ 基盤実習ほか 薬剤師免許 (*) を有すること ( 見込み可 ) 2 博士の学位を持っていることが望ましい 3 化学 物理等に関する教育 研究能力の高いこと 薬学部 薬学科 微生物学 特任助教任期 2 年
< F2D CFA90B6984A93AD8FC897DF91E632368D868169>
 厚生労働省令第二十六号薬事法(昭和三十五年法律第百四十五号)第十二条の二第二号並びに第十四条の四第四項及び第十四条の六第四項(これらの規定を同法第十九条の四において準用する場合を含む )の規定に基づき 医薬品 医薬部外品 化粧品及び医療機器の製造販売後安全管理の基準に関する省令及び医薬品の製造販売後の調査及び試験の実施の基準に関する省令の一部を改正する省令を次のように定める 平成二十五年三月十一日厚生労働大臣田村憲久医薬品
厚生労働省令第二十六号薬事法(昭和三十五年法律第百四十五号)第十二条の二第二号並びに第十四条の四第四項及び第十四条の六第四項(これらの規定を同法第十九条の四において準用する場合を含む )の規定に基づき 医薬品 医薬部外品 化粧品及び医療機器の製造販売後安全管理の基準に関する省令及び医薬品の製造販売後の調査及び試験の実施の基準に関する省令の一部を改正する省令を次のように定める 平成二十五年三月十一日厚生労働大臣田村憲久医薬品
九州大学IRデータ集2017:本文.indd
 資格試験等合格状(8/74) 8. 資格試験等合格状況 8-1. 司法試験合格状況 況全国平均はH26 年度より減少傾向にあるが 本学の状況を見ると増加傾向にある 合格率推移 0 0 80.00 70.00 60.00 最終合 50.00 格率 (17/55) 40.00 (21/68) 30.00 (18/72) (18/74) (17/73) (14/74) 20.00 (23/74) 110
資格試験等合格状(8/74) 8. 資格試験等合格状況 8-1. 司法試験合格状況 況全国平均はH26 年度より減少傾向にあるが 本学の状況を見ると増加傾向にある 合格率推移 0 0 80.00 70.00 60.00 最終合 50.00 格率 (17/55) 40.00 (21/68) 30.00 (18/72) (18/74) (17/73) (14/74) 20.00 (23/74) 110
< F193B994AD955C817A87402D BD90AC E964089C891E58A CA8D878A698ED CC816A2E786C7378>
 平成 26 年司法試験法科大学院等別合格者数等 出願者受験予定者受験者 短答式試験の合格に必要な成績を得た者 最終合格者数 愛知学院大法科大学院 34 34 32 15 0 愛知大法科大学院 31 30 27 21 7 青山学院大法科大学院 57 54 44 21 3 大阪学院大法科大学院 57 57 46 17 5 大阪市立大法科大学院 120 120 109 73 19 大阪大法科大学院 155
平成 26 年司法試験法科大学院等別合格者数等 出願者受験予定者受験者 短答式試験の合格に必要な成績を得た者 最終合格者数 愛知学院大法科大学院 34 34 32 15 0 愛知大法科大学院 31 30 27 21 7 青山学院大法科大学院 57 54 44 21 3 大阪学院大法科大学院 57 57 46 17 5 大阪市立大法科大学院 120 120 109 73 19 大阪大法科大学院 155
