スライド タイトルなし
|
|
|
- よりお はにうだ
- 5 years ago
- Views:
Transcription
1 医療機器標準バーコードセミナー (UDI=Unique Device Identification) いよいよ来た!! 医療機器ユニークデバイス識別規制法案 ~ 知らないと流通販売が出来なくなるう!? ~
2 セミナー内容 前半 1. 医療機器標準バーコード (UDI) とは何か? 何のメリットがあるのか? 2.FDAのUDI 規制案とは (JIRAの対応は)? 休憩 後半 3. 大型医療機器にとってのUDIとは? 4. 今後の進め方 ( 海外での規制化進捗 ) 5. 今後の進め方 ( 国内行政への対応等々 )
3 1-1.UDI 実施の為にする事は 以下の 3step stepⅠ 標準コード付与 stepⅡ テ ータヘ ース登録 stepⅢ ハ ーコート 表示 汎用コート (GS1) か 医療業界専用コート (HIBCC) かを決定 企業コードを取得する ( どちらも有料 GS1 の方が安価 ) GS1 の場合 : 商品コート ( 数字のみ 3 か 5 桁 ) の切替が必要 ( 従来の専用コート との並行使用が多い ) HIBCC の場合 : 20 桁迄の英数字ならそのまま使用可能 各国の National Database( 公的機関が運営するもの ) に製品情報を登録する ( ファイル転送 /web 入力 ) 但し ; どれが National DB?(Medis-DC? 添付文書 DB?) ; 実態として使われているのは民間の DB(MEDIE 等 ) 必ずしもメーカーが登録しなくても成立 ( 実用可 ) する code128 をベースにした GS1-128 で表示する ( 書式に注意 ) 表示面積が狭くて GS1-128 が不可能ならば 2 次元シンホ ルの GS1-DataMATRIX で表示する ( 書式に注意 ) 印字品質 ( 印刷規格に準拠 ) や耐久性 ( 本体表示 ) に配慮要
4 1-2. 日本の UDI( 医療機器標準バーコード ) ( 医政経発第 号 ) 原文 英訳文 事務局まで
5 1-3. 日本の UDI( 医療機器標準バーコード ) ( 医政経発第 号 )
6 1-4. 日本の UDI( 医療機器標準バーコード ) ( 医政経発第 号 )
7 1-5. 日本の UDI( 医療機器標準バーコード ) ( 医政経発第 号 ) stepⅠ stepⅡ? いつの間にか MEDIS-DC を推奨 stepⅢ
8 1-6. 日本の UDI( 医療機器標準バーコード ) ( 医政経発第 号 )
9 1-7.UDI 表示例 ( 医療機器 ( 機械 )) 医療機器標準バーコード = UDI ( 日本版書式 : 日本の UDI) 日本の UDI = FDA の UDI ( 除 ;UDID)
10 1-8.UDIコンテンツ ( 表示内容 ) UDI 種類の表示 (GS1-128 形式 最有力 ) 商品コード (GTIN( ジーティン ) 形式 ) DI(Device Identifier) 製品名称 / 製品型番 ( 固定 data) シリアル番号 ( 英数 20 桁 max) PI(Production Identifier) シリアル ロット 使用期限 ( 可変 data)
11 1-9.UDI 表示例 ( 医療機器 ( 材料 ) 外箱 ) JAN(EAN13) UDI 医療機器標準バーコード = UDI ( 日本版書式 ) HIBCC GS1-128
12 1-10.UDI 表示例 ( 医療機器 ( 材料 ) 中箱 ) HIBCC GS1
13 1-11.UDI 表示例 ( 医療機器 ( 材料 )) HIBCC(2 番手候補 ) 企業コード商品コード梱包インジケーター DI PI 使用期限 LOT 番号 Code128& 各種 2 次元シンボル使用可能ハ ーコート 種類 企業コード取得の費用が高い(GS1と1 桁違う )
14 1-12.UDI 表示例 ( 医療機器 ( 材料 )) 商品コード (GTIN) 数量 (max8 桁数字 ) 現在は非表示 バーコード種類 UCC/EAN-128 GS1-128 呼称変更 使用期限 (YYMMDD) LOT 番号 (max20 桁英数字 )
15 1-13.UDI 表示例 ( 医療機器 ( 材料 )) GS1-JAPAN HP より DI=GTIN PI: シリアル ロット 使用期限
16 1-14.UDI 表示例 (DI; 機器識別子の構造 ) DI=GTIN((01) ) の構造 アフ リケーション識別子 (AI:Application Indicator) 01 (GTINを表す () はdataには含まない ) 梱包インシ ケーター (PI:Package Indicator 要注意 ) 1 ( 個品 =0 集合包装 =1~8) JAN メーカーコート ( 国 2 桁 + 企業コート 5) 別 Ver ( 国 2 桁 + 企業コート 7) 商品アイテムコート ( 製品種 迄 ) 別 Ver. 123 ( 製品種 999 迄 ) チェックデジット 0 ( モシ ュラス 10 ウェイト 3)
17 1-15.UDI 表示例 (PI; 製造識別子 / 生産識別子の構造 ) PI=(17) (10)2D の構造 アフ リケーション識別子 (AI:Application Indicator) 17 ( 使用期限を表す () はdataには含まない ) 11 ( 製造年月を表す () はdataには含まない ) YYMMDD( 年月日 ) ( 日の指定が無いときは00) アフ リケーション識別子 (AI:Application Indicator) 10 ( ロット番号を表す () はdataには含まない ) 21 ( シリアル番号を表す () はdataには含まない ) ロット/ ハ ッチ番号 シリアル番号 2D ( 英数字最大 20 桁 )
18 1-16.UDI 表示例 ( 医療機器 ( 材料 )) LOT 番号 =max20 桁最後の可変長 data(fnc1 不要 ) GTIN=14 桁固定長 YYMMDD 6 桁固定長 数量 = Max8 桁可変長 code128 の先頭に FNC1 を入れると GS1-128 となる 中間の可変長 data 最後に FNC1
19 1-17. 医療機器データベース ( 例 : MEDIC-DC 医療機器データベース ) 1.JANコード (GTINからPIを除き チェックデジットを再計算したもの) 2.JMDNコード 3. 商品名 (max200 桁 ) 当該商品が特定できる名称 ( 含む規格 ) 4. 商品名略称 (max60 桁 ) 5. 商品名カナ (max400 桁 ) 6. 薬事申請上の販売名 (max200 桁 ) 7. 規格 (max60 桁 ) サイズ 入数等 8. 製品番号 (max30 桁 ) カタログ番号 注文番号等 9. 薬事法承認 ( 認証 ) 番号または届出番号 (max40 桁 ) 10. 生物由来製品分類 11. 添付文書情報管理コード (max100 桁 )
20 1-18. 医療機器データベース ( 例 : MEDIC-DC 医療機器データベース ) 12. 商品画像リンク先 (max50 桁 ) 13. 販売製造企業 14. 国内総販売元企業 15. 材料償還請求区分 ( 償還不可 / 保険償還価格 / 購入価格他 ) 16. 特定保険医療材料名 17. 特材名オーバーフローフラグ 18. 価格区分 ( 希望小売価格 / 償還価格と同じ / オープン価格 / 非開示 ) 19. 価格適応日 (YYYY/MM/DD 18. 希望小売価格の場合 ) 20. 価格が適応される荷姿 (1 桁 : 梱包インジケータ ) 21. 希望小売価格 (max8 桁 ) 22.PI=0の単位の保険償還単位数 (max12 桁 )
21 1-19. 医療機器データベース ( 例 : MEDIC-DC 医療機器データベース ) 23. 材料価格調査用保険償還単位換算値 (max12 桁 ) 24. 梱包形態 ( 荷姿 ) インジケータ (PI) に関する情報 個装(PI-0) の情報について PI GTIN 入数 単位呼称 ハ ーコート 有無 個装以外の梱包形態の情報について同上 25. 製造販売業者最小出荷梱包インジケータ (1 桁 : 梱包インジケータ ) 26. 医療機関最小購入単位梱包インジケータ (1 桁 : 梱包インジケータ ) 27. 構成品 付属品のJANコード (max13 桁 ) 28. 旧 JANコード 29. 新 JANコード 30. 販売終了日 (YYYY/MM/DD) 31. 関連 JMDNコード1~3 (max8 桁 )
22 1-20. 医療機器データベース ( 例 : MEDIC-DC 医療機器データベース ) 32. 添付文書等要確認フラグ 33. 毒劇区分 ( 非該当 毒薬 劇薬 向精神薬 毒物 劇物 麻薬他 ) 34. 危険物区分 ( 非該当 危険物 1~6 類 ) 35. 保管区分 ( 室温 冷暗所 冷蔵 凍結 -20 凍結-20 他 ) 36. 体外診断用医薬品保険適用の可否 ( 保険適用否 可 ) 37. 体外診断用医薬品 JMDNコード2~ 体外診断用医薬品 JMDNコードオーバーフローフラグ 39. 添付文書等要確認フラグ ( 体外診断用医薬品の場合 )
23 1-21.UDIとは ( そもそも ) 何か? 医療機器 (& 医薬品 ) をバーコード等で 自動で識別する為に 1: 全世界で標準化された 商品コード付番形式 (GS1,HIBCC 等 ) で 世界中で絶対にダブらない様に商品コードを付番して 商品情報 ( 名称 型式名等 ) を提供する為に 公開されたデータベース (MEDIS-DC 医療機器 DB 等 ) に登録をして 2: ISO 規格のハ ーコート 等 (GS1-128,GS1-DataMatrix 等 ) で 表示して 人に頼らず ( 間違わない+ 速い ) 識別する と 様々なメリットが得られます?? 様々なメリットとは何か??
24 1-22.UDI とは 何が出来るのか?( 何のためにするのか?) 様々なメリットとは何か? 費用対効果は得られるのか? 費用 : ラベルの変更 ( 枚葉印刷化でのコスト UP 数円 / 枚 ) から 自動包装ラインの改造 (~ 数億円 ) まで + システムの改造 / 新設費用 (? 何をするにも必要 ) 効果 : メーカー 流通 医療施設 それぞれに効果 メーカー : 自動識別に拠る効果 ( 但し 費用負担あり ) 生産管理 在庫管理 入出荷管理の効率化 保守点検 クレーム処理 リコール対応の効率化 流通 : 費用負担無しの自動識別に拠る効果 在庫管理 入出荷管理の効率化 医療施設 : 費用負担無しの自動識別に拠る効果 医療安全の確保 + 病院経営の改善 本当か?
25 1-23.UDI で得られるユーザーメリット ( 医療施設 ) とは? あらゆる医療行為に於ける 全ての段階でのトレーサビリティ ( 追跡可能性 ) 確保から医療安全の確保 + 病院経営の改善 の実現本当か? 医療安全の確保 とは? 医療機器 医薬品 患者 医療従事者を自動で識別して ( 間違わない + 速い ) 誤使用防止 ( 人 製品 時刻 数 等 ) 医療機器使用者の適不適 使用の可否 ( 保守点検 滅菌等 ) 使用条件入力 ( 放射線量等 ) の自動化 ( ハ ーコート net 等で ) UDI( 別の話 ) 病院経営の改善 とは? 使用期限のある医療機器 ( 材料 ) の期限切れ廃棄ロス削減 多数台ある医療機器の適正台数 ( 購入 : レンタル ( ヒ ーク時 )) 推定 保険請求 ( 医薬 材料の使用量把握 ) の精度 + 速度の向上 所在地管理 ( 場所不特定の医療機器 ) の精度 + 速度の向上 他には無いのか? いくらでもメリットはある (UDI はインフラ )
26 2-1.FDA/UDI 規制案内容 原文 ( 英語 ) 和訳文 事務局まで 44 ページ
27 2-2.FDA/UDI 規制案内容 販売及び使用段階で 医療機器を適切に識別する事で達成できる目的は? 人は間違える バーコードで自動識別して 迅速 かつ正確に識別する 1. 医療ミスの削減 使い間違いの防止 機器の誤用につながる混乱 ( 無菌か否か リコール対象か否か 等 ) が減る 2. 機器の使用に関する情報のデータシステムへの統合の簡略化 オーダーエントリーでの適切な ( 迅速に正確に ) 機器選定が可能となる 3. 有害事象を起こした医療機器識別の迅速化 有害事象に該当する機器を適切に特定する事が可能となる 4. 報告された問題の解決策開発の迅速化 有害事象の報告書にUDIを含める事で 問題の検討 分析が迅速化する
28 2-3.FDA/UDI 規制案内容 5. 機器リコールの解決の迅速化及び効率化 6.FDA 安全性通知の正確化と有効性の向上 通知を出す際に 他の類似機器との混同を防止し 素早い対応が可能 7. 機器特定に関する情報に容易にアクセス可能となる 義務ではないが 機器に添付されている文書 トレーニング資料 等にUDIがあれば それから様々な危機に関する情報にアクセスできる 8. その他のメリット 在庫管理精度の向上 患者に使用した機器の記録保存の電子化 機器選択 ( 探す 選ぶ等 ) の迅速性 確実性の向上 9. 日付表示の標準化によるメリット ( 例 ; JAN 1,2012 )
29 2-4.FDA/UDI 規制案内容 (GS1-japan 資料引用 )
30 2-5.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) 医療機器のラベルに表示される日付の形式 使用期限 製造年月は 月 日 年( 例 ; JAN 1,2012 ) の形で表示する バーコードのdataではなく 文字表示の事 (UDIとは関係ない?) JIRAコメント :ISO8601に準拠した表示形式(YYYYMMDD) とすべき 一意の機器識別子 (UDI) の表示が義務づけられるラベル 全ての医療機器のラベル( 本体表示の事 ) に UDI 表示 全ての機器パッケージに UDI 表示 クラスⅢの医療機器には最終規則が公表(2013/5/7?) 後 1 年で発効 埋め込み 救命 生命維持機器は 公表 (2013/5/7?) 後 2 年で発効 クラスⅡの医療機器には最終規則が公表(2013/5/7?) 後 3 年で発効 クラスⅠ 及びクラスⅠ Ⅱ Ⅲのいずれにも分類されない医療機器には 最終規則が公表 (2013/5/7?) 後 5 年で発効
31 2-6.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) Combination Product( 医療機器 + 医薬品のキット ) Convenience Kit( 複数の医療機器のキット ) のUDI それぞれの機器 及びパッケージの双方に異なるUDIを表示する 個々の医療機器 ( 医薬品 ) と集合包装体の双方にUDI 表示 の例外規定 小売される医療機器 研究 教育用機器 動物用機器 個別販売を意図しない使い捨てのクラスⅠ 機器のパッケージは除外不可 JIRAコメント : その典型例がXレイフィルムである ( だから フィルム一枚一枚にはUDIは不要ですよね?) 輸出する機器( 米国内で販売しない機器 ) 出荷用容器 JIRAコメント : 大型機器等の分割梱包 ( 設置する前の機能しない状態 ) は 出荷用容器である ( ですよね?)
32 2-7.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) 輸出する機器 ( 米国内で販売しない機器 ) 出荷用容器 JIRA コメント : 大型機器等の分割梱包 ( 設置する前の機能しない状態 ) は 出荷用容器である ( ですよね?) クラス Ⅰ は PI( 生産識別子 ) を UDI に含めることを義務付けない UDI の形 X レイフィルム等は 使用期限は必要だが UDI 表示部分には その存在を知らせる記号を表示する GS1-128 等の バーコード種別を表す手段は 既に存在する JIRA コメント : 医療機器業界 + 医療関係者に任せるべきで 指定の ( 上記 ) シンボルは不要
33 2-8.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) UDIの直接マーキング (DPM(Direct Parts Marking) 対象機器 ) 埋込み型の機器 複数回使用で使用前に滅菌する機器 スタンドアロンのソフトウェア( 画面に文字のみで表示 ) 発効は それぞれのクラスの2 年後 ( クラスⅢなら1+2 年後 ) 品質に問題が無ければ手段 (DPM?) はどうでも良いはず JIRAコメント : 医療機器業界 + 医療関係者に任せるべきである 新しいバージョンまたは形式が生ずる変更 (DIが変わる時) 仕様 性能 寸法 または組成が変更された場合 機器ハ ッケーシ に含まれている個々の機器の数が変更された場合 該当機器の安全性 または有効性に変更があった場合 ハ ッケーシ カが滅菌から非滅菌に変更された場合 ( 逆も ) ラベルを貼り替えた場合
34 2-9.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) ラベルの貼り替え ラベルを貼り替えた場合 それまでのDIと新たなDIの関係を示す記録を維持しなければならない GUDID(FDAの医療機器データベース ) に必要な情報 ラベラー( メーカー ) の名称 電話番号またはメールアドレス ラベラーが使用したシステムを運営する発行機関の名称 GS1,HIBCC 等 UDIのDI 部分 GTIN 等 UDIの差し替えがあった場合の 以前のUDI 商標名 トレードネーム またはブランド名 バージョン番号 型式番号 または類似の参照番号
35 2-10.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) 滅菌か非滅菌か 人に接触する天然ゴム ラテックスは含まれているか 複数のサイズがある場合 特定バージョンまたは型式のサイズと単位 PIのタイプ FDAの市販前承認申請番号 その機器に割当てられたFDAのリストナンバー GMDNコード その機器ハ ッケーシ に含まれている個々の機器の数 新製品発売時に登録する類の data のみ クレーム リコール情報等は無い ( その話もあった )
36 2-11.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) UDID 情報の提出 ラベラーは FDAとの連絡窓口となる個人を指定しなければならない 情報は電子的手段で提出しなければならない UDID 情報の提出時期 UDIの表示が義務付けられる日迄に UDID 情報をFDAに提出する UDIDの情報に変更があった場合 変更された情報がUDIに表示される日迄にFDAに提出する変更された情報がUDIに表示されない場合は 該当する変更の10 営業日以内にFDAに提出する ラベラーが維持しなければならない記録 UDIを示す記録 及び特定のバージョンまたは型式の記録を 販売を中止した日から3ヵ年にわたって維持するものとする
37 2-12.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) Ⅸ. 意見要請 B. 具体的な質問 1.UDIシステムの目的及び潜在用途で 最も重要と考えるのはどれか? JIRAコメント :UDIは ある種のインフラであって 特定の目的( 潜在用途 ) は無い 目的はUSE CASEによって多様である とは言え 目的は医療安全確保のため と しておいた方が良い 2. 発効日は十分な時間的余裕を考慮したものであるか? 3. 日付表示の特定型式 ( 例 ; JAN 1,2012 ) での発効日は施行の1 年後であるが 適切か? ( 一年後とは条文には書いていないが ) JIRAコメント : 不適切である 4.UDIの標準文字列 ( 可読文字 ) に関する要件は適切か?
38 2-13.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) 5.AIDC 技術 (Automatic identification and data capture ) に関する要件は 明確か? 6. Combination Product( 医療機器 + 医薬品のキット ) の個々の機器への UDI 表示は適切か? 7. Combination Product( 医療機器 + 医薬品のキット ) の個々の機器ではないもの ( 医薬品 ) への UDI 表示は適切か? 8.Combination Product( 医療機器 + 医薬品のキット ) の個々の機器ではないもの ( 医薬品 ) で NDC が表示されるものを除いたものへの UDI 表示は適切か? 9. Convenience Kit( 複数の医療機器のキット ) の各機器への UDI 表示は義務付けられるべきか?
39 2-14.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) 10.Convenience Kit( 複数の医療機器のキット ) に含まれる 複数回使用の クラス Ⅰ 各機器への UDI 表示は 義務付けられるべきか? 11. Convenience Kit( 複数の医療機器のキット ) の個々の機器への UDI よりも Convenience Kit の UDI で識別すべきか? 12. 全ての埋込み機器に 直接マーキングを義務付けるのは適切か? 13. 複数回使用で 使用前に滅菌される全ての機器に 直接マーキングを義務付けるのは適切か? 14. スタンドアロンのソフトウェアの定義を提案してほしい JIRA コメント : 業界 ( メーカー ) を含む全 Stakeholder で作成すべき 15. これら以外に直接マーキングを行うメリットのある機器はあるか?
40 2-15.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) の一般除外は適切か? 17. 他に適切な除外カテゴリーはあるか? 18.1 GMP 要件の適用除外のクラスⅠへのUDI 表示の非義務は適切か? 18.2 参考文献 10のリストにある機器で 適用除外が適切でない機器は? 18.3 GMP 要件の適用除外機器で 参考文献 10に無いものはあるか? 19.1 クラスⅠのDI 表示の例外を更に認めるべきか? 19.2 本提案規則が適用される クラスⅠのPI 表示を義務つけるべきか? JIRAコメント : クラスⅠは広範囲であるので全てのケースを把握する事は難しい メーカーと医療関係者とで判断すべき (a) の手続き ( 例外 代替要請 ) は合理的な根拠となるか? 21. 特定のAIDC 技術の使用を義務付けるべきか? JIRAコメント : 義務付けるべきではない メーカーと医療関係者で判断すべき
41 2-16.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) 22.AIDC の存在を知らせるための記号の使用を義務付けるべきか? の認定要件は適切か? JIRAコメント (23~26): 発行機関は最小限にすべき 24. 複数のUDIシステムが存在すると 混乱が起きないか? 25. たった一つの発行機関が望ましいか? 26. 発行機関に営利目的の組織が認定されることを認める理由はあるか? の中で医療機器の識別に必要ないものはあるか? 28. 医療機器の識別に追加で必要な情報はあるか? 29.UDIDのデータ提供とUDI 表示の時期の関連は合理的でないか?
42 2-17.FDA/UDI 規制案内容 ( 及び JIRA 対応 ) 30.UDIDへのデータ提供の2 方式 (HL7,Web) は適切か? 31.UDIDへのデータ提供のガイダンス (Q&A 等 ) には何が必要か? 32. 日付の型式 ( 例 ; JAN 1,2012 ) が指定されれば 使用期限に関する混乱は軽減されるか? 33. アメリカ式 ( 例 ; JAN 1,2012 ) と国際方式 ( 例 ; 1 JAN 2012 ) のどちらが患者に理解しやすいか? 34. アメリカ式 ( 例 ; JAN 1,2012 ) と国際方式 ( 例 ; 1 JAN 2012 ) のどちらが医療従事者に理解しやすいか? 35. どちらかの一方の型式を好む強力な根拠はあるか?
43 2-18.FDA の UDI 対応で新たにやらなくてはならない事 1. 新たな医療機器データベース (UDID;by FDA) への DATA 登録 ( ファイル一括転送 (HL7) もしくは web 入力 ) 2. 医療機器本体への UDI( バーコード ) 表示 ( 高耐久性 長寿命ラベルもしくは直接印字 大型医療機器はシステムにもコンポーネントにも必要 ) 3. 医療機器パッケージへの UDI( バーコード ) 表示 ( 日本規制対応 ( 特材 特管 ) でクリア済 のはず ) ( 設置管理医療機器 (= 大型医療機器 ) では パッケージとはみなさないで 輸送用容器と解釈し 不要 )
44 3-1. 大型医療機器 (Capital Equipment) にとって UDI とは? 医薬品 > 材料 > 器具 > 小型機器 > 大型機器 * 大型医療機器は UDI のメリットが最も少ない * 医薬品 : UDI のメリットを最も享受するのは医薬品誤投薬 ( 種類 対象患者 量 タイミング 他 ) 防止に寄与する 材料 ( 単回使用の医療材料 ) : 在庫管理 使用記録 ( 種類 対象患者 LOT 番号 医療保険点数計算 他 ) 管理に寄与する 器具 ( 手術器具等 ) : 手術前後の数量確認 滅菌記録管理 使用回数管理 等に寄与する 小型機器 ( 輸液ポンプ等 ) : 病棟への貸出管理 ( 所在地 使用期間 他 ) 保守点検記録管理 等に寄与する では 大型医療機器は どうなのか?
45 3-2. 大型医療機器にとって UDI のメリットとは? デメリットは? 大型医療機器 = 複数の医療機器 ( コンホ ーネント ) 及び医療機器ではないモノ等から構成されたシステム型の医療機器 システムとしても医療機器 メリット : システム構成管理 保守点検記録管理使用履歴管理 他 システム構成が 複数メーカーにまたがる場合は UDI( 標準形式ハ ーコート ) を使用するメリットは大きい 医療機器 モノ ( 非医療機器 ) デメリット? : 既にメーカー もしくは病院独自のハ ーコート にて管理システムが構築されている : 複数の UDI( コンホ ーネントとシステム ) のどれを使用するのか分からない 却って邪魔になる可能性あり 大型機器は台数が少ないので病院側でハ ーコート 作製 + 貼付する事が容易
46 4-1. 今後の進め方 ( 海外での規制化進捗 ) 日本 US 2008 厚労省課長通達 FDA 規制案 FDA 規制 EU MDD 改定案 2014? MDR 詳細ルール各国規制 イタリア トルコ ブラジル GHTF IMDRF GHTF ガイド IMDRF ガイド案 IMDRF ガイド
47 4-2. 今後の進め方 ( 海外での規制化進捗 ) IMDRF ガイドに強制力はない UDI を導入するならこうしてほしい 法規制にしてもその通りである必要なしより詳細な規制はありうる異なる要求もありうる 好ましくない法規制にしてもしなくてもいい FDA 欧州は IMDRF のガイドと規制を整合させるはず FDA は IMDRF 会議で自らのルールとの整合を重視 欧州の MDR( 医療機器法 ) 提案に UDI の記載あるもきわめて簡単 Delegated Act で詳細決まる
48 4-3. DITTA 組織 DITTA 総会議長副議長理事会運営委員会 DITTA 理事 年 ( 任期 2 年 ) JIRA 小松研一, JIRA 会長木村達, JIRA 常務理事 MITA ゲイルロドリゲス, MITA 専務理事ハンスベインキ, MITA 国際委員会委員長 COCIR ニコルデンジョイ, COCIR 事務局長ピーターリンダース, COCIR 国際委員会委員長 DITTA 議長 副議長 年 (2 年ローテーション ) COCIR ニコルデンジョイ DITTA 議長 JIRA 木村達 DITTA 副議長 MITA ゲイルロドリゲス DITTA 副議長 Task Forces RPS 電子申請 UDI ユニークデバイス識別子 MSW メディカルソフトウェア GRP 中古 DITTA 総会風景
49 年の DITTA 活動実績 法人化 6 月完了 新しいネーミングとロゴの決定 新規メンバーの加入承認 o THAIMED (Thailand) o IMEDA (Russia) o CAMDI (China) o ABIMED (Brazil) 組織と管理体制の構築 タスクフォースの設立 :RPS( 電子申請 ), UDI( ユニーク機器識別子 ), MSW( メディカルソフトウェア ),GRP( 中古 ) Website の構築 : 理事会 総会の開催 理事の承認 定款の承認 議長 / 副議長の選出
50 4-5. IMDRF の組織 International Medical Device Regulators Forum ( 国際医療機器規制当局フォーラム ) 管理委員会規制当局日本 米国 EU 豪州 ブラジル ( 中国 ロシア インドは暫定 ) 招待オブザーバー (DITTA,GMTA のみ ) 事務局 事務管理 Website GHTF 文書管理 参加メンバ WG WG WG WG WG UDI 実装ロードマップ GMTA DITTA JIRA RPS ( 電子申請 ) MDSAP 医療機器単一監査 NCAR( 規制当局報告書 ) Recognized standards 標準規格 規制当局規制当局規制当局規制当局規制当局 GMTA DITTA JIRA 内容紹介 Stakeholders Open Forum 利害関係者公開討論会 MSW メディカルソフトウェア DITTA 提案中 GRP 中古 IMDRF 検討中
51 5-1. 今後の進め方 日本版 UDI 規制の望ましい形 バーコード等による医療機器の自動識別は 必然 ( 目的 ) ではなく改善 ( 効率向上の手段 ) である 数字 文字 色 形状で識別は出来る しかし 人間による識別は 間違える + 遅い 機械による自動識別が望ましい だが 必然ではない 但し 手段 ( コート 体系 キャリア ) は様々であり 進歩 (= 変化 ) する 放っておくと 国別 会社別 病院別にバラバラになる 最低限の統一 ( コート 体系 ;2~3 種等 ) は必須 提言 A: 現行のコート 体系は 維持 (GTIN HIBCC) する B: 新たなコート 体系は これ以上 増やさない C: キャリア ( ハ ーコート 等 ) は ISO 準拠の規格のみ使用 従って
52 5-2. 今後の進め方 日本版 UDI 規制の望ましい形 医療安全の確保の為に 医療機器の自動識別手段を活用して 安全に繋がる識別の効率 ( 間違えない + 早い ) を上げたいと判断した場合 バラバラな コード体系とキャリア ( バーコードの種類 ) があってはならない 規制化が必要なのは バーコード表示するかしないかではなく バーコード表示を行う際に どのコード体系を使うべきなのか どのキャリア ( バーコード種類 ) を使うべきなのか を明確に定め それ以外の手段 ( 形式 規格 ) を排除する事 言い換えれば 特定の病院専用 UDI 特定の国専用 UDI を排除する事 従って 法規制よりはガイドライン程度 ( 表示するなら こうしなさい ) が望ましい 特に 効果が疑問視される大型医療機器分野は 熟考が必要
53 5-3. 今後の進め方 日本版 UDI 規制の望ましい形 1. これまでの規制と同様に ( 課長 ) 通知であること 2. 本体表示を加える際に 大型医療機器 ( 設置管理 医療機器 ) の適用は 包装への表示と同様に任意とすること 輸出 ( 米国 (2014/5) 欧州( 今後 )) の場合には UDI 法制化でハ ーコート 表示 +テ ータヘ ース登録は必須となるが 国内出荷の場合には 現行同様としたい ( 設置管理医療機器は任意 )
54 5-4. 今後の進め方 これから JIRA のすべき事 all JIRA 体制の元 1.UDI 法 (2013/5 施行 ) の実施への対応 (JIRA 内各種情報提供他 ) 2.EU その他諸国の UDI 対応 (IMDRF DITTA 等での活動 ) 3. 国内法 ( 日本版 UDI 規制?) への対応 (UDI 研究会での意見表明 ) ( 医機連との連携 )
55 了 UDI は敵に回すと厄介 味方にすれば付加価値 UP! ( 前向きに 仲良く 末永く 付き合うことが大事です )
スライド 1
 @MD-Net 標準フォーム ( 個別情報 ) R1.11 医療機器 材料業界情報化協議会 (@MD-Net) 1. 概要 1.1. 概要 データ交換規約 ( 個別情報 ) VAN では足りないデータ種について 標準フォーマットを作ることを目的として本フォーマットを定義する したがって通信はメールや各企業間における個別通信方法になる 今回定義するデータとその説明を以下に定義する No データ種名情報発信方向物理ファイル名説明
@MD-Net 標準フォーム ( 個別情報 ) R1.11 医療機器 材料業界情報化協議会 (@MD-Net) 1. 概要 1.1. 概要 データ交換規約 ( 個別情報 ) VAN では足りないデータ種について 標準フォーマットを作ることを目的として本フォーマットを定義する したがって通信はメールや各企業間における個別通信方法になる 今回定義するデータとその説明を以下に定義する No データ種名情報発信方向物理ファイル名説明
医政経発第 号 平成 20 年 3 月 28 日 社団法人日本臨床検査薬協会会長 在日米国商工会議所 (ACCJ) 医療機器 IVD 小委員会委員長 殿 欧州ビジネス協会 ( E B C) 医療機器委員会委員長 厚生労働省医政局経済課長 医療機器等へのバーコード表示の実施について 医
 医政経発第 0328001 号 平成 20 年 3 月 28 日 日本医療機器産業連合会会長殿 厚生労働省医政局経済課長 医療機器等へのバーコード表示の実施について 医療機器等へのバーコード表示については これまで関係団体等における自主的な取り組みを基本として その普及を推進してきたところです 今般 規制改革推進のための3か年計画 ( 平成 19 年 6 月 22 日閣議決定 ) において 医療材料への標準コード付与を整備推進することとされたことを踏まえ
医政経発第 0328001 号 平成 20 年 3 月 28 日 日本医療機器産業連合会会長殿 厚生労働省医政局経済課長 医療機器等へのバーコード表示の実施について 医療機器等へのバーコード表示については これまで関係団体等における自主的な取り組みを基本として その普及を推進してきたところです 今般 規制改革推進のための3か年計画 ( 平成 19 年 6 月 22 日閣議決定 ) において 医療材料への標準コード付与を整備推進することとされたことを踏まえ
IMDRFにおけるUDI活動とFDAの動向 国際動向の面からのUDIとは
 IMDRF における UDI 活動と FDA の動向 国際動向の面からの UDI とは 独立行政法人医薬品医療機器総合機構 PMDA 審査マネジメント部薬事戦略相談課 テクニカルエキスパート石川廣 IMDRF と UDI 1 UDI とは何のための UDI 誰のための UDI IMDRF(GHTF) における UDI 活動 米国の状況 欧州の状況 日本の状況 まとめ 本発表は GHTF,IMDRF
IMDRF における UDI 活動と FDA の動向 国際動向の面からの UDI とは 独立行政法人医薬品医療機器総合機構 PMDA 審査マネジメント部薬事戦略相談課 テクニカルエキスパート石川廣 IMDRF と UDI 1 UDI とは何のための UDI 誰のための UDI IMDRF(GHTF) における UDI 活動 米国の状況 欧州の状況 日本の状況 まとめ 本発表は GHTF,IMDRF
<4D F736F F F696E74202D20322E35208D918DDB88CF88F589EF8A8893AE95F18D905F F42205B8CDD8AB B83685D>
 2013 年度 国際展開とDITTA 活動について国際委員会活動報告 2014 年 6 月 2 日国際委員会委員長内山進 国際委員会活動報告 国際展開と DITTA 活動 2 JIRA 国際活動の基本戦略 会員企業の海外への事業展開推進支援 環境整備 1. 国際画像診断 医療 IT 治療機器産業連合会 (DITTA) による 国際機関や各国 地域へのグローバルな提言活動 DITTA ; Global
2013 年度 国際展開とDITTA 活動について国際委員会活動報告 2014 年 6 月 2 日国際委員会委員長内山進 国際委員会活動報告 国際展開と DITTA 活動 2 JIRA 国際活動の基本戦略 会員企業の海外への事業展開推進支援 環境整備 1. 国際画像診断 医療 IT 治療機器産業連合会 (DITTA) による 国際機関や各国 地域へのグローバルな提言活動 DITTA ; Global
Microsoft Word - FDA UDI規制の概要(流開センター 黒澤) .docx
 FDA 医療機器ユニークデバイス識別規則の概要 理解の不一致を回避し情報を共有するために 一般財団法人流通システム開発センター黒澤康雄 何が世界で起きているか 世界の医療機器メーカーは 現在 製品識別 と データベース登録 の義務化という台風に直面している (1) IMDRF の推奨医療機器の製品仕様の日本米国欧州間の統合整合化を審議する GHTF(2012 年から IMDRF に改組織 :International
FDA 医療機器ユニークデバイス識別規則の概要 理解の不一致を回避し情報を共有するために 一般財団法人流通システム開発センター黒澤康雄 何が世界で起きているか 世界の医療機器メーカーは 現在 製品識別 と データベース登録 の義務化という台風に直面している (1) IMDRF の推奨医療機器の製品仕様の日本米国欧州間の統合整合化を審議する GHTF(2012 年から IMDRF に改組織 :International
販売WEBEDI
 WEBEDI MD-NET Version 1.2.5.1 for V3.2 D010 ファイル インターフェース説明 バイヤー ( ディーラー ) 編 1. システム連携データ 1.1. 発注データのアップロード < ファイルの形式 > アップロードするデータファイルは 以下の形式に従って作成してください ( 各項目間はタブ区切で 文字コードはすべてシフト JIS で記述してください ) 開始レコード
WEBEDI MD-NET Version 1.2.5.1 for V3.2 D010 ファイル インターフェース説明 バイヤー ( ディーラー ) 編 1. システム連携データ 1.1. 発注データのアップロード < ファイルの形式 > アップロードするデータファイルは 以下の形式に従って作成してください ( 各項目間はタブ区切で 文字コードはすべてシフト JIS で記述してください ) 開始レコード
Web-EDI_IF仕様(セラー)_V3.2-D009
 WEBEDI MD-NET Version 1.2.5.1 for V3.2 D009 ファイル インターフェース説明 セラー ( メーカー ) 編 1 1. システム連携データ 1.1. 受注データのダウンロード < 出力ファイルの形式 > 出力ファイルの形式は 以下の形式となっています ( 各項目間はタブ区切で 文字コードはすべてシフト JIS となります ) 開始レコード項目名が並べられたタイトル行です
WEBEDI MD-NET Version 1.2.5.1 for V3.2 D009 ファイル インターフェース説明 セラー ( メーカー ) 編 1 1. システム連携データ 1.1. 受注データのダウンロード < 出力ファイルの形式 > 出力ファイルの形式は 以下の形式となっています ( 各項目間はタブ区切で 文字コードはすべてシフト JIS となります ) 開始レコード項目名が並べられたタイトル行です
注意事項 1. 使用文字 改行コード :CRLF 文字コード :Shift_JIS 2. 形式詳細 (1) 文字列 ( 半角 ) 半角の文字 (1 文字 =1バイト ) を設定します バイトに示すバイト数に応じて 半角文字を設定して下さい 文字列がバイトに示すバイト数に満たない場合 半角スペースを設
 基本形 Ver1.3 標準外部入力レイアウト ( 固定長 階層レコード ) 平成 28 年 11 月 1 日 注意事項 1. 使用文字 改行コード :CRLF 文字コード :Shift_JIS 2. 形式詳細 (1) 文字列 ( 半角 ) 半角の文字 (1 文字 =1バイト ) を設定します バイトに示すバイト数に応じて 半角文字を設定して下さい 文字列がバイトに示すバイト数に満たない場合 半角スペースを設定して下さい
基本形 Ver1.3 標準外部入力レイアウト ( 固定長 階層レコード ) 平成 28 年 11 月 1 日 注意事項 1. 使用文字 改行コード :CRLF 文字コード :Shift_JIS 2. 形式詳細 (1) 文字列 ( 半角 ) 半角の文字 (1 文字 =1バイト ) を設定します バイトに示すバイト数に応じて 半角文字を設定して下さい 文字列がバイトに示すバイト数に満たない場合 半角スペースを設定して下さい
下版用.indd
 JAN シンボル ITF シンボルだけじゃない! いろいろ使える ジーエスワン GS1 標準データキャリア 一般財団法人流通システム開発センター The Distribution Systems Research Institute (DSRI) データキャリアとは? 4 912345 123459 一次元シンボル ( バーコード ) 二次元シンボル 電子タグ (IC タグ /RFID) 各種コードを機械で自動的に読み取ることができる形式で表示したものです
JAN シンボル ITF シンボルだけじゃない! いろいろ使える ジーエスワン GS1 標準データキャリア 一般財団法人流通システム開発センター The Distribution Systems Research Institute (DSRI) データキャリアとは? 4 912345 123459 一次元シンボル ( バーコード ) 二次元シンボル 電子タグ (IC タグ /RFID) 各種コードを機械で自動的に読み取ることができる形式で表示したものです
Microsoft PowerPoint - ● GS1チュートリアル
 GS1( ジーエスワン ) 標準と医療分野への展開 第 38 回医療情報学連合大会 第 19 回日本医療情報学会学術大会 2018 年 11 月 22 日 GS1ヘルスケアジャパン協議会前川ふみ 私が発表する今回の演題について 開 すべき COI はありません 本日のテーマ 1. GS1( ジーエスワン ) とは 2. GS1 標準の基礎 1 GS1 識別コード 3. GTINに関する医薬品 医療機器等の注意点!
GS1( ジーエスワン ) 標準と医療分野への展開 第 38 回医療情報学連合大会 第 19 回日本医療情報学会学術大会 2018 年 11 月 22 日 GS1ヘルスケアジャパン協議会前川ふみ 私が発表する今回の演題について 開 すべき COI はありません 本日のテーマ 1. GS1( ジーエスワン ) とは 2. GS1 標準の基礎 1 GS1 識別コード 3. GTINに関する医薬品 医療機器等の注意点!
注意事項 1. 使用文字 改行コード :CRLF 文字コード :Shift_JIS 2. 形式詳細 (1) 文字列 ( 半角 ) 半角の文字 (1 文字 =1バイト ) を設定します バイトに示すバイト数に応じて 半角文字を設定して下さい 文字列がバイトに示すバイト数に満たない場合 半角スペースを設
 基本形 Ver1.3 標準外部出力レイアウト ( 固定長 階層レコード ) 平成 28 年 11 月 1 日 注意事項 1. 使用文字 改行コード :CRLF 文字コード :Shift_JIS 2. 形式詳細 (1) 文字列 ( 半角 ) 半角の文字 (1 文字 =1バイト ) を設定します バイトに示すバイト数に応じて 半角文字を設定して下さい 文字列がバイトに示すバイト数に満たない場合 半角スペースを設定して下さい
基本形 Ver1.3 標準外部出力レイアウト ( 固定長 階層レコード ) 平成 28 年 11 月 1 日 注意事項 1. 使用文字 改行コード :CRLF 文字コード :Shift_JIS 2. 形式詳細 (1) 文字列 ( 半角 ) 半角の文字 (1 文字 =1バイト ) を設定します バイトに示すバイト数に応じて 半角文字を設定して下さい 文字列がバイトに示すバイト数に満たない場合 半角スペースを設定して下さい
SGEC 附属文書 理事会 統合 CoC 管理事業体の要件 目次序文 1 適用範囲 2 定義 3 統合 CoC 管理事業体組織の適格基準 4 統合 CoC 管理事業体で実施される SGEC 文書 4 CoC 認証ガイドライン の要求事項に関わる責任の適用範囲 序文
 SGEC 附属文書 2-8 2012 理事会 2016.1.1 統合 CoC 管理事業体の要件 目次序文 1 適用範囲 2 定義 3 統合 CoC 管理事業体組織の適格基準 4 統合 CoC 管理事業体で実施される SGEC 文書 4 CoC 認証ガイドライン の要求事項に関わる責任の適用範囲 序文この文書の目的は 生産拠点のネットワークをする組織によるCoC 認証を実施のための指針を設定し このことにより
SGEC 附属文書 2-8 2012 理事会 2016.1.1 統合 CoC 管理事業体の要件 目次序文 1 適用範囲 2 定義 3 統合 CoC 管理事業体組織の適格基準 4 統合 CoC 管理事業体で実施される SGEC 文書 4 CoC 認証ガイドライン の要求事項に関わる責任の適用範囲 序文この文書の目的は 生産拠点のネットワークをする組織によるCoC 認証を実施のための指針を設定し このことにより
別紙 1 販売名 医療機器保険適用希望書 ( 決定区分 A1( 包括 )) 整理番号 : 空欄で提出 薬事法承認又は認証された販売名を記載 製品名 製品コード 製品名 製品コード JAN コードの場合必ず 13 桁 薬事法承認書又は認証書上 薬事法承認書又は認証書上記載 記載された類別を記載 された
 事務連絡 平成 24 年 3 月 19 日 日本医療機器産業連合会会長 米国医療機器 IVD 工業会会長 欧州ビジネス協会医療機器委員会委員長 殿 厚生労働省医政局経済課医療機器政策室 医療機器保険適用希望書の記載例等について 平素より 厚生労働行政にご協力いただきありがとうございます 医療機器保険適用希望書の提出に関連した通知として 医療機器の保険適用等に関する取扱いについて ( 平成 24 年
事務連絡 平成 24 年 3 月 19 日 日本医療機器産業連合会会長 米国医療機器 IVD 工業会会長 欧州ビジネス協会医療機器委員会委員長 殿 厚生労働省医政局経済課医療機器政策室 医療機器保険適用希望書の記載例等について 平素より 厚生労働行政にご協力いただきありがとうございます 医療機器保険適用希望書の提出に関連した通知として 医療機器の保険適用等に関する取扱いについて ( 平成 24 年
5、ロット付番
 購買管理基準書 (CPC-C4) 目 次 1. 目的 2 2. 適用範囲 2 3. 購買品の区分 2 4. 新規購買先の評価 選定 2 4-1 校正委託先の評価 選定 3 4-2 検査委託先の評価 選定 3 5. 購買先リスト 4 6. 購買品の発注及び検収検証 4 6-1 購買品の発注 4 6-2 購買品の検収検証 4 6-3 機器の登録 5 6-4 発注及び検収検証の記録 5 7. 購買先の継続評価
購買管理基準書 (CPC-C4) 目 次 1. 目的 2 2. 適用範囲 2 3. 購買品の区分 2 4. 新規購買先の評価 選定 2 4-1 校正委託先の評価 選定 3 4-2 検査委託先の評価 選定 3 5. 購買先リスト 4 6. 購買品の発注及び検収検証 4 6-1 購買品の発注 4 6-2 購買品の検収検証 4 6-3 機器の登録 5 6-4 発注及び検収検証の記録 5 7. 購買先の継続評価
G TIN GTIN-13 JAN GTIN GTIN-12 UPC GS1 A I A
 GS1 標準準拠 原材料メーカー 加工食品メーカー対象 原材料識別のためのバーコードガイドライン効率的な管理 トレーサビリティの確保にむけて 一般財団法人流通システム開発センター The Distribution Systems Research Institute(DSRI) 3 4 1. 7 1.1 7 1.2 8 1.3 12 1.4 12 1.5 15 1.6 15 2. 18 2.1 G
GS1 標準準拠 原材料メーカー 加工食品メーカー対象 原材料識別のためのバーコードガイドライン効率的な管理 トレーサビリティの確保にむけて 一般財団法人流通システム開発センター The Distribution Systems Research Institute(DSRI) 3 4 1. 7 1.1 7 1.2 8 1.3 12 1.4 12 1.5 15 1.6 15 2. 18 2.1 G
Microsoft Word - コンピュータチェック対象事例ファイル仕様書
 平成 30 年 3 月 1 日作成 コンピュータチェック対象事例 ファイル仕様書 平成 30 年 3 月版 編集社会保険診療報酬支払基金 目次 第 1 章ファイル概説 1 ダウンロードファイル ( コンピュータチェック対象事例 ) について 2 2 コンピュータチェック対象事例の構成等 ⑴ コンピュータチェック対象事例の構成イメージ 2 ⑵ コンピュータチェック対象事例の項目説明 2 第 2 章ファイル仕様
平成 30 年 3 月 1 日作成 コンピュータチェック対象事例 ファイル仕様書 平成 30 年 3 月版 編集社会保険診療報酬支払基金 目次 第 1 章ファイル概説 1 ダウンロードファイル ( コンピュータチェック対象事例 ) について 2 2 コンピュータチェック対象事例の構成等 ⑴ コンピュータチェック対象事例の構成イメージ 2 ⑵ コンピュータチェック対象事例の項目説明 2 第 2 章ファイル仕様
LABEL-6
 MIND Web-EDI システム 三菱電機インフォメーションネットワーク ( 株 ) 1 目次 1.Dラベル出力の処理遷移図 3 2. 標準納品書 Dラベルのレイアウトについて 2.1 標準納品書 +Dラベル (1 枚 ) レイアウト 2.2 Dラベル (6 枚綴り ) レイアウト 2.3 標準納品書 Dラベルの詳細レイアウト 5 3.Dラベルのデータ表示項目について 6 3.1 Dラベル様式 6
MIND Web-EDI システム 三菱電機インフォメーションネットワーク ( 株 ) 1 目次 1.Dラベル出力の処理遷移図 3 2. 標準納品書 Dラベルのレイアウトについて 2.1 標準納品書 +Dラベル (1 枚 ) レイアウト 2.2 Dラベル (6 枚綴り ) レイアウト 2.3 標準納品書 Dラベルの詳細レイアウト 5 3.Dラベルのデータ表示項目について 6 3.1 Dラベル様式 6
MDSAP の調査結果の 試行的受入れについて ( 独 ) 医薬品医療機器総合機構 品質管理部 登録認証機関監督課 1
 MDSAP の調査結果の 試行的受入れについて ( 独 ) 医薬品医療機器総合機構 品質管理部 登録認証機関監督課 1 MDSAP 報告書の受入れの概要 (1/2) 日本は 平成 27 年 6 月にMDSAPに参加する旨を発表 関係者との意見交換を行い MDSAP 報告書の受け入れについて 以下の通知を発出した 平成 28 年 6 月 22 日薬生監麻発 0622 第 3 号 薬生機審発 0622
MDSAP の調査結果の 試行的受入れについて ( 独 ) 医薬品医療機器総合機構 品質管理部 登録認証機関監督課 1 MDSAP 報告書の受入れの概要 (1/2) 日本は 平成 27 年 6 月にMDSAPに参加する旨を発表 関係者との意見交換を行い MDSAP 報告書の受け入れについて 以下の通知を発出した 平成 28 年 6 月 22 日薬生監麻発 0622 第 3 号 薬生機審発 0622
スライド 1
 資料 3 Healthcare 日本の医療機器のコード化の動向 2009.6.4 ( 財 ) 流通システム開発センター黒澤康雄 ( 財 ) 流通システム開発センターとは 11972 年 4 月設立 21977 年国際標準化機関の GS1( シ ーエスワン ) に加盟 3 医療業界の情報化 システム化の基盤整備の支援 4 企業コードの管理 JANコードの普及推進 5 二次元シンボル RFID( 無線タグ
資料 3 Healthcare 日本の医療機器のコード化の動向 2009.6.4 ( 財 ) 流通システム開発センター黒澤康雄 ( 財 ) 流通システム開発センターとは 11972 年 4 月設立 21977 年国際標準化機関の GS1( シ ーエスワン ) に加盟 3 医療業界の情報化 システム化の基盤整備の支援 4 企業コードの管理 JANコードの普及推進 5 二次元シンボル RFID( 無線タグ
Microsoft Word - ‡e‡c.doc
 医薬品等電子申請ソフトによる医療機器適合性調査申請書作成の手引き 厚生労働省医薬食品局から配布されている医薬品等電子申請ソフト (FD 申請ソフト ) を使用して 医療機器適合性調査申請を行うための手引きです FD 申請ソフトを使用することで申請書の作成および管理が容易となります ソフトは以下のホームページからダウンロードしてください なお インストールは 別途ホームページに掲載のマニュアルを参照してください
医薬品等電子申請ソフトによる医療機器適合性調査申請書作成の手引き 厚生労働省医薬食品局から配布されている医薬品等電子申請ソフト (FD 申請ソフト ) を使用して 医療機器適合性調査申請を行うための手引きです FD 申請ソフトを使用することで申請書の作成および管理が容易となります ソフトは以下のホームページからダウンロードしてください なお インストールは 別途ホームページに掲載のマニュアルを参照してください
PowerPoint プレゼンテーション
 ファイルを使った一括商品登録 記載の内容は 2018 年 11 月 12 日現在のものです サービス内容 およびインターネットサイト上の表示等は変更となる場合がありますのでご了承ください 無断転載 複製を禁止します Amazon, アマゾン, Amazon.co.jp, Amazon Services Japan, Merchants@amazon.co.jp, フルフィルメント by Amazon,
ファイルを使った一括商品登録 記載の内容は 2018 年 11 月 12 日現在のものです サービス内容 およびインターネットサイト上の表示等は変更となる場合がありますのでご了承ください 無断転載 複製を禁止します Amazon, アマゾン, Amazon.co.jp, Amazon Services Japan, Merchants@amazon.co.jp, フルフィルメント by Amazon,
Taro-再製造単回使用医療機器基準
 厚生労働省告示第二百六十一号医薬品医療機器等の品質有効性及び安全性の確保等に関する法律 ( 昭和三十五年法律第百四十 五号 ) 第四十二条第二項の規定に基づき再製造単回使用医療機器基準を次のように定め平成二十 九年七月三十一日から適用す る平成二十九年七月三十一日厚生労働大臣塩崎恭久再製造単回使用医療機器基準第 1 定義 1 再生部品 とは 医療機関において使用された単回使用の医療機器の全部又は一部であって
厚生労働省告示第二百六十一号医薬品医療機器等の品質有効性及び安全性の確保等に関する法律 ( 昭和三十五年法律第百四十 五号 ) 第四十二条第二項の規定に基づき再製造単回使用医療機器基準を次のように定め平成二十 九年七月三十一日から適用す る平成二十九年七月三十一日厚生労働大臣塩崎恭久再製造単回使用医療機器基準第 1 定義 1 再生部品 とは 医療機関において使用された単回使用の医療機器の全部又は一部であって
セキュリティ委員会活動報告
 2015 年度セキュリティ委員会成果報告 2016 年 2 月 26 日セキュリティ委員会委員長西田慎一郎 ( 島津製作所 ) 1 2015 年度活動内容 1)ISO/TC215 WG4( セキュリティ & プライバシ ) で検討されている国際標準への対応を行った 2) 厚生労働省 医療情報システムの安全管理に関するガイドライン に対して ベンダの立場で取り組みを行った 3) 医療機器におけるサイバーセキュリティへの対応を行った
2015 年度セキュリティ委員会成果報告 2016 年 2 月 26 日セキュリティ委員会委員長西田慎一郎 ( 島津製作所 ) 1 2015 年度活動内容 1)ISO/TC215 WG4( セキュリティ & プライバシ ) で検討されている国際標準への対応を行った 2) 厚生労働省 医療情報システムの安全管理に関するガイドライン に対して ベンダの立場で取り組みを行った 3) 医療機器におけるサイバーセキュリティへの対応を行った
Microsoft Word - 【発送版】製造所の登録通知
 薬食機参発 1003 第 1 号 平成 26 年 10 月 3 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いについて 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業は登録制に移行され
薬食機参発 1003 第 1 号 平成 26 年 10 月 3 日 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省大臣官房参事官 ( 医療機器 再生医療等製品審査管理担当 ) ( 公印省略 ) 医療機器及び体外診断用医薬品の製造業の取扱いについて 薬事法等の一部を改正する法律 ( 平成 25 年法律第 84 号 以下 改正法 という ) により 医療機器及び体外診断用医薬品の製造業は登録制に移行され
「GMP担当者研修・認定講座」の運用規定(案)
 GMP 担当者研修 認定講座 の概要 改訂 8 版 2018 年 8 月 1 日 NPO-QA センター 品質保証委員会 1 1. 趣旨 目的 2002 年の薬事法の全面改正により GQP 省令第 10 条では 製造販売業者は医薬品製造業者の GMP 実施状況の管理監督を義務づけられ GMP 省令第 18 条では 医薬品製造業者は GMP 実施状況の自己点検を義務づけられている GMP の実施については
GMP 担当者研修 認定講座 の概要 改訂 8 版 2018 年 8 月 1 日 NPO-QA センター 品質保証委員会 1 1. 趣旨 目的 2002 年の薬事法の全面改正により GQP 省令第 10 条では 製造販売業者は医薬品製造業者の GMP 実施状況の管理監督を義務づけられ GMP 省令第 18 条では 医薬品製造業者は GMP 実施状況の自己点検を義務づけられている GMP の実施については
文字の装飾 / 配置について 文字の装飾 ( ボールド / イタリック / アンダーライン等 ) 網掛けは行わないでください 背景色は バーコード部分とのコントラストが低下する色を避けてください 文字の回転を行う場合 回転角度は 90 度 180 度 270 度以外は指定しないでください 文字間隔の
 EPSONEAN-128 バーコードフォントの使い方 通常バーコードを作成するには データキャラクタ ( バーコードに登録する文字 ) のほかに様々なコードやキャラクタを指定したり OCR-B* フォント ( バーコード下部の文字 ) を指定する必要があります EPSON バーコードフォントは これらのバーコードやキャラクタを自動的に設定し 各バーコードの規格に従ってバーコードシンボルを簡単に作成
EPSONEAN-128 バーコードフォントの使い方 通常バーコードを作成するには データキャラクタ ( バーコードに登録する文字 ) のほかに様々なコードやキャラクタを指定したり OCR-B* フォント ( バーコード下部の文字 ) を指定する必要があります EPSON バーコードフォントは これらのバーコードやキャラクタを自動的に設定し 各バーコードの規格に従ってバーコードシンボルを簡単に作成
Microsoft Word - CLP規則導入手引(第2.1版)(修正: ) 修正.doc
 目次 1. 序... 12 1.1 この手引について... 12 1.2 この手引は誰のため?... 12 1.3 CLP とは何か そしてなぜ我々はそれを持つのか?... 12 1.4 ハザード分類 表示及び包装とは何か?... 13 1.5* リスクのアセスメントについて?... 14 *JETOC 注 : 原文には抜けているが 本文中には存在する 1.6 欧州化学品庁 (ECHA 又は庁 )
目次 1. 序... 12 1.1 この手引について... 12 1.2 この手引は誰のため?... 12 1.3 CLP とは何か そしてなぜ我々はそれを持つのか?... 12 1.4 ハザード分類 表示及び包装とは何か?... 13 1.5* リスクのアセスメントについて?... 14 *JETOC 注 : 原文には抜けているが 本文中には存在する 1.6 欧州化学品庁 (ECHA 又は庁 )
目次 1. ログイン 報告 ユーザ 病院 使用場所 通知先 材料データベース... 7 ご注意ください...12 JAN コードから材料データを返します マネージャーの情報変更 報告 CS
 1.1 目次 1. ログイン... 3 2. 報告... 3 3. ユーザ... 4 4. 病院 使用場所... 5 5. 通知先... 6 6. 材料データベース... 7 ご注意ください...12 JAN コードから材料データを返します...12 7. マネージャーの情報変更...13 8. 報告 CSV の項目 報告添付ファイル名 の変更...13 2 1. ログイン マネージャアカウントの
1.1 目次 1. ログイン... 3 2. 報告... 3 3. ユーザ... 4 4. 病院 使用場所... 5 5. 通知先... 6 6. 材料データベース... 7 ご注意ください...12 JAN コードから材料データを返します...12 7. マネージャーの情報変更...13 8. 報告 CSV の項目 報告添付ファイル名 の変更...13 2 1. ログイン マネージャアカウントの
<4D F736F F D2088E396F BB91A28BC EF C8EA695DB8AC78BE695AA816A C826F8AEE8F808F918EE88F878F B2E646F63>
 16 12 24 179 26 1 5 26 1 5 注意 品質部門は製造部門から独立していなければならない 各部門の業務を適切かつ円滑に実施しうる能力のある責任者を 組織 規模 業務の種類に応じ 適切な人数を配置すること ( 必要に応じ 上記に挙げた責任者の枠を増やしてもよい ) 各責任者は業務に支障がない限り兼務することができる ただし 製造部門責任者と品質部門責任者は兼務することはできない 出荷可否決定者は品質部門の者とすること
16 12 24 179 26 1 5 26 1 5 注意 品質部門は製造部門から独立していなければならない 各部門の業務を適切かつ円滑に実施しうる能力のある責任者を 組織 規模 業務の種類に応じ 適切な人数を配置すること ( 必要に応じ 上記に挙げた責任者の枠を増やしてもよい ) 各責任者は業務に支障がない限り兼務することができる ただし 製造部門責任者と品質部門責任者は兼務することはできない 出荷可否決定者は品質部門の者とすること
< C B B837D E786C73>
 < 違算通知ヘッダーレコード1> 2 2 レコード識別 X 2 2 H1 1 メーカー情報 5 2 企業コード X 13 11 グローバルロケーションナンバー 6 2 企業名称 X 40 24 カナ40 文字 漢字 20 文字 7 2 事業所コード X 13 64 グローバルロケーションナンバー 8 2 事業所名称 X 40 77 カナ40 文字 漢字 20 文字 1 資材サプライヤー情報 9 2
< 違算通知ヘッダーレコード1> 2 2 レコード識別 X 2 2 H1 1 メーカー情報 5 2 企業コード X 13 11 グローバルロケーションナンバー 6 2 企業名称 X 40 24 カナ40 文字 漢字 20 文字 7 2 事業所コード X 13 64 グローバルロケーションナンバー 8 2 事業所名称 X 40 77 カナ40 文字 漢字 20 文字 1 資材サプライヤー情報 9 2
< C B B837D E786C73>
 < 支払照合ヘッダーレコード1> 条件欄 : 必須 : 限定使用 : 使用不可 2 2 レコード識別 X 2 2 H1 1 メーカー情報 5 2 企業コード X 13 11 グローバルロケーションナンバー 6 2 企業名称 X 40 24 カナ40 文字 漢字 20 文字 7 2 事業所コード X 13 64 グローバルロケーションナンバー 8 2 事業所名称 X 40 77 カナ40 文字 漢字
< 支払照合ヘッダーレコード1> 条件欄 : 必須 : 限定使用 : 使用不可 2 2 レコード識別 X 2 2 H1 1 メーカー情報 5 2 企業コード X 13 11 グローバルロケーションナンバー 6 2 企業名称 X 40 24 カナ40 文字 漢字 20 文字 7 2 事業所コード X 13 64 グローバルロケーションナンバー 8 2 事業所名称 X 40 77 カナ40 文字 漢字
帳簿一覧 フローチャート 品質の確保に関するフローチャート 苦情処理フローチャート 不具合及び回収に関するフローチャート 設置管理医療機器の取扱に関するフローチャート 記録書式 管理者の継続的研修受講状況記録票 品質等点検表 苦情処理記録票 不具合等に関する報告書 回収処理記録票 教育訓練実施記録票
 高度管理医療機器等販売業管理帳簿 作成例 ( 営業者名 ) ( 営業者住所 ) ( 営業所名 ) ( 営業所所在地 ) 平成 22 年 12 月前橋市保健所保健総務課医事薬事係 帳簿一覧 フローチャート 品質の確保に関するフローチャート 苦情処理フローチャート 不具合及び回収に関するフローチャート 設置管理医療機器の取扱に関するフローチャート 記録書式 管理者の継続的研修受講状況記録票 品質等点検表
高度管理医療機器等販売業管理帳簿 作成例 ( 営業者名 ) ( 営業者住所 ) ( 営業所名 ) ( 営業所所在地 ) 平成 22 年 12 月前橋市保健所保健総務課医事薬事係 帳簿一覧 フローチャート 品質の確保に関するフローチャート 苦情処理フローチャート 不具合及び回収に関するフローチャート 設置管理医療機器の取扱に関するフローチャート 記録書式 管理者の継続的研修受講状況記録票 品質等点検表
 SQiP シンポジウム 2016 アジャイルプロジェクトにおけるペアワーク適用の改善事例 日本電気株式会社小角能史 2016 年 9 月 16 日 アジェンダ 自己紹介ペアワークとはプロジェクトへのペアワークの適用方法 スクラム適用ルール作成 最適化の流れ KPTを用いたふりかえり 適用ルールの改善事例 適用プロジェクトの概要ペアワーク適用ルール ( 初期 ) 改善例 1 - ペアのローテーション改善例
SQiP シンポジウム 2016 アジャイルプロジェクトにおけるペアワーク適用の改善事例 日本電気株式会社小角能史 2016 年 9 月 16 日 アジェンダ 自己紹介ペアワークとはプロジェクトへのペアワークの適用方法 スクラム適用ルール作成 最適化の流れ KPTを用いたふりかえり 適用ルールの改善事例 適用プロジェクトの概要ペアワーク適用ルール ( 初期 ) 改善例 1 - ペアのローテーション改善例
農業農村整備民間技術情報データベース技術概要書 (2/4) 17: 連絡先の郵便番号と住所をご記入ください < 郵便番号は半角数字 > < 2/6 > 連絡先 会社名住所担当部署担当者関連 URL MAIL 19 TEL FAX 1 18: 連絡先の担当部署をご記入
 農業農村整備民間技術情報データベース技術概要書 (1/4) : 記入不要です (ARIC にて記入します ) < 1/6 > 登録会社名開発会社名 技術の要約 添付資料の有無 採用実績件数 発表文献 計 実績報文 農業農村整備事業 大分類 中分類 小分類 分野 主 副 1 から選択 副 2 10 10 10 副 3 11 11 11 12 別表 1 技術の概要 3 5 登録年月 カタロク ハ ンフレット
農業農村整備民間技術情報データベース技術概要書 (1/4) : 記入不要です (ARIC にて記入します ) < 1/6 > 登録会社名開発会社名 技術の要約 添付資料の有無 採用実績件数 発表文献 計 実績報文 農業農村整備事業 大分類 中分類 小分類 分野 主 副 1 から選択 副 2 10 10 10 副 3 11 11 11 12 別表 1 技術の概要 3 5 登録年月 カタロク ハ ンフレット
Cica-Web を快適にご利用いただくために Cica-Web は Internet Explorer で動作確認を行っております その他のブラウザでご利用いただく際は本来の動作と異なる動作をすること がありますので ご了承ください Cica-Web は Cookie を有効にする設定でご利用くだ
 ver. : 207. 関東化学株式会社 Cica-Web を快適にご利用いただくために Cica-Web は Internet Explorer で動作確認を行っております その他のブラウザでご利用いただく際は本来の動作と異なる動作をすること がありますので ご了承ください Cica-Web は Cookie を有効にする設定でご利用ください Cookie を無効にすると 一部の機能がご利用いただけなくなることがあり
ver. : 207. 関東化学株式会社 Cica-Web を快適にご利用いただくために Cica-Web は Internet Explorer で動作確認を行っております その他のブラウザでご利用いただく際は本来の動作と異なる動作をすること がありますので ご了承ください Cica-Web は Cookie を有効にする設定でご利用ください Cookie を無効にすると 一部の機能がご利用いただけなくなることがあり
<4D F736F F D B835E8BA4974C8EE888F E63294C5816A8F4390B E31322E F4390B394C5816A2E646F63>
 目次の表 1 序... 11 1.1 データ共有に関する手引文書の目的... 11 1.2 概観... 11 1.2.1 登録義務... 11 1.2.2 段階的導入物質及び非段階的導入物質... 12 1.2.3 登録についての移行制度... 13 1.2.4 予備登録及び遅発予備登録... 13 1.2.5 登録に先立つ照会... 14 1.2.6 物質情報交換フォーラム... 14 1.2.7
目次の表 1 序... 11 1.1 データ共有に関する手引文書の目的... 11 1.2 概観... 11 1.2.1 登録義務... 11 1.2.2 段階的導入物質及び非段階的導入物質... 12 1.2.3 登録についての移行制度... 13 1.2.4 予備登録及び遅発予備登録... 13 1.2.5 登録に先立つ照会... 14 1.2.6 物質情報交換フォーラム... 14 1.2.7
「GMP担当者研修・認定講座」の運用規定(案)
 GMP 担当者研修 認定講座 の概要 改訂 7 版 2017 年 9 月 1 日 NPO-QA センター 品質保証委員会 1 1. 趣旨 目的 2002 年の薬事法の全面改正により GQP 省令第 10 条では 製造販売業者は医薬品製造業者の GMP 実施状況の管理監督を義務づけられ GMP 省令第 18 条では 医薬品製造業者は GMP 実施状況の自己点検を義務づけられている GMP の実施については
GMP 担当者研修 認定講座 の概要 改訂 7 版 2017 年 9 月 1 日 NPO-QA センター 品質保証委員会 1 1. 趣旨 目的 2002 年の薬事法の全面改正により GQP 省令第 10 条では 製造販売業者は医薬品製造業者の GMP 実施状況の管理監督を義務づけられ GMP 省令第 18 条では 医薬品製造業者は GMP 実施状況の自己点検を義務づけられている GMP の実施については
データキャリアについて
 日薬連発第 530 号平成 18 年 9 月 15 日 加盟団体殿 日本製薬団体連合会 医療用医薬品流通コード標準化 検討プロジェクト 医療用医薬品新コード表示ガイドライン策定の件 ( 報告 ) 今般 医療用医薬品流通コード標準化検討プロジェクト では医療用医薬品流通コードの見直しに関する関係省庁及び関係団体との調整を終了し 別添のとおり新たなバーコード表示に関するガイドラインを策定しましたので報告いたします
日薬連発第 530 号平成 18 年 9 月 15 日 加盟団体殿 日本製薬団体連合会 医療用医薬品流通コード標準化 検討プロジェクト 医療用医薬品新コード表示ガイドライン策定の件 ( 報告 ) 今般 医療用医薬品流通コード標準化検討プロジェクト では医療用医薬品流通コードの見直しに関する関係省庁及び関係団体との調整を終了し 別添のとおり新たなバーコード表示に関するガイドラインを策定しましたので報告いたします
2. 各検討課題に関する論点 (1) 費用対効果評価の活用方法 費用対効果評価の活用方法について これまでの保険給付の考え方等の観点も含め どう考 えるか (2) 対象品目の選定基準 1 費用対効果評価の対象とする品目の範囲 選択基準 医療保険財政への影響度等の観点から 対象となる品目の要件をどう設
 中医協費薬材 - 3 3 0. 1 2. 5 費用対効果評価に関する検討状況について ( 報告 ) 1. 概要 費用対効果評価については これまで以下の課題につき 中医協において協議及び論点の整 理を行ってきたところ 今後 関係業界からのヒアリングを行い とりまとめを行う予定 (1) 費用対効果評価の活用方法 (2) 対象品目の選択基準 1 費用対効果評価の対象とする品目の範囲 選択基準 3 品目選定のタイミング
中医協費薬材 - 3 3 0. 1 2. 5 費用対効果評価に関する検討状況について ( 報告 ) 1. 概要 費用対効果評価については これまで以下の課題につき 中医協において協議及び論点の整 理を行ってきたところ 今後 関係業界からのヒアリングを行い とりまとめを行う予定 (1) 費用対効果評価の活用方法 (2) 対象品目の選択基準 1 費用対効果評価の対象とする品目の範囲 選択基準 3 品目選定のタイミング
ISO 企業識別コード (BIC) に関する国際規格 年 6 月 30 日 ISO/TC68 国内委員会事務局 ISO/TC 68 国内委員会事務局 1
 ISO 9362 - 企業識別コード (BIC) に関する国際規格 - 2015 年 6 月 30 日 ISO/TC68 国内委員会事務局 1 目次 1. ISO 9362 とは 2. BIC の構造 3. BIC の主な特徴 4. BIC1 の廃止 参考資料 2014 年 12 月に最新版 ( 第 4 版 ) が発行されているため 本資料はこの最新版の内容に基づいています 2 1. ISO 9362
ISO 9362 - 企業識別コード (BIC) に関する国際規格 - 2015 年 6 月 30 日 ISO/TC68 国内委員会事務局 1 目次 1. ISO 9362 とは 2. BIC の構造 3. BIC の主な特徴 4. BIC1 の廃止 参考資料 2014 年 12 月に最新版 ( 第 4 版 ) が発行されているため 本資料はこの最新版の内容に基づいています 2 1. ISO 9362
<4D F736F F F696E74202D E48FE A92C789C192CA926D82C982C282A282C45F696E6F75652E >
 E2B(R3) 追加通知について 日本製薬団体連合会 E2B(R3) 実装プロジェクト井上学 1 本日のお話 追加通知の概要 これから検討すべきこと 2 追加通知 ( 公開 ) 予定の概要 2013 年 9 月 17 日の通知で 追って通知 とされた部分 ICH E2Bでの検討結果に伴う変更 技術的な部分の補足 Q&A 3 R2 と R3 の比較 R2 R3 報告様式 SGML XML(HL7 形式
E2B(R3) 追加通知について 日本製薬団体連合会 E2B(R3) 実装プロジェクト井上学 1 本日のお話 追加通知の概要 これから検討すべきこと 2 追加通知 ( 公開 ) 予定の概要 2013 年 9 月 17 日の通知で 追って通知 とされた部分 ICH E2Bでの検討結果に伴う変更 技術的な部分の補足 Q&A 3 R2 と R3 の比較 R2 R3 報告様式 SGML XML(HL7 形式
Web型iEDIシステム操作説明書
 Web 型インターネット EDI サービス 操作説明書 ( サプライヤ編 添付文書機能 ) 2018 年 11 月 TOSHIBA Corporation 2000-2017 All Rights Reserved. - 1 - 名称 Web 型インターネット EDI サービス操作説明書 ( サプライヤ編 添付文書 機能 ) 更新記録 REV 番号日付内容承認調査担当 1.0 2007/1/26 新規発行
Web 型インターネット EDI サービス 操作説明書 ( サプライヤ編 添付文書機能 ) 2018 年 11 月 TOSHIBA Corporation 2000-2017 All Rights Reserved. - 1 - 名称 Web 型インターネット EDI サービス操作説明書 ( サプライヤ編 添付文書 機能 ) 更新記録 REV 番号日付内容承認調査担当 1.0 2007/1/26 新規発行
スライド 1
 1 国土地理院殿位置コード勉強会 サプライチェーンに於ける位置情報の活用 デンソーウェーブ柴田彰 自動認識技術のいろいろ 2 1 次元シンボル 2 次元シンボル RFID バイオメトリクス 識別カード RFID 3 サプライチェーンの 国際標準化 ISO TC122 サプライチェーン高度化の考え方 4 EDI (EC) の導入促進 全ての企業の EDI 導入は不可能 ペーパー EDI EDI 補完の手段が必要
1 国土地理院殿位置コード勉強会 サプライチェーンに於ける位置情報の活用 デンソーウェーブ柴田彰 自動認識技術のいろいろ 2 1 次元シンボル 2 次元シンボル RFID バイオメトリクス 識別カード RFID 3 サプライチェーンの 国際標準化 ISO TC122 サプライチェーン高度化の考え方 4 EDI (EC) の導入促進 全ての企業の EDI 導入は不可能 ペーパー EDI EDI 補完の手段が必要
説明項目 1. 審査で注目すべき要求事項の変化点 2. 変化点に対応した審査はどうあるべきか 文書化した情報 外部 内部の課題の特定 リスク 機会 利害関係者の特定 QMS 適用範囲 3. ISO 9001:2015への移行 リーダーシップ パフォーマンス 組織の知識 その他 ( 考慮する 必要に応
 ISO/FDIS 9001 ~ 認証審査における考え方 ~ 2015 年 7 月 14 日 23 日 JAB 認定センター 1 説明項目 1. 審査で注目すべき要求事項の変化点 2. 変化点に対応した審査はどうあるべきか 文書化した情報 外部 内部の課題の特定 リスク 機会 利害関係者の特定 QMS 適用範囲 3. ISO 9001:2015への移行 リーダーシップ パフォーマンス 組織の知識 その他
ISO/FDIS 9001 ~ 認証審査における考え方 ~ 2015 年 7 月 14 日 23 日 JAB 認定センター 1 説明項目 1. 審査で注目すべき要求事項の変化点 2. 変化点に対応した審査はどうあるべきか 文書化した情報 外部 内部の課題の特定 リスク 機会 利害関係者の特定 QMS 適用範囲 3. ISO 9001:2015への移行 リーダーシップ パフォーマンス 組織の知識 その他
平成 23 年 7 月 5 日 米国医療機器 IVD 工業会 (AMDD) 会長デイビット W. パウエル 欧州ビジネス協会 (EBC) 医療機器委員会 委員長ダニー リスバーグ 医療機器 ( 体外診断用検査機器を含む ) の薬事法改正に係る提言 はじめに 医薬品は新しい有効成分を探しあるいは創り
 医療機器の薬事法改正に係る米国医療機器 IVD 工業会 (AMDD) 欧州ビジネス協会 (EBC) 共同提言書 平成 23 年 7 月 5 日 米国医療機器 IVD 工業会 (AMDD) 会長デイビット W. パウエル 欧州ビジネス協会 (EBC) 医療機器委員会 委員長ダニー リスバーグ 医療機器 ( 体外診断用検査機器を含む ) の薬事法改正に係る提言 はじめに 医薬品は新しい有効成分を探しあるいは創り
医療機器の薬事法改正に係る米国医療機器 IVD 工業会 (AMDD) 欧州ビジネス協会 (EBC) 共同提言書 平成 23 年 7 月 5 日 米国医療機器 IVD 工業会 (AMDD) 会長デイビット W. パウエル 欧州ビジネス協会 (EBC) 医療機器委員会 委員長ダニー リスバーグ 医療機器 ( 体外診断用検査機器を含む ) の薬事法改正に係る提言 はじめに 医薬品は新しい有効成分を探しあるいは創り
代理人向け補足資料
 1 枚の電子証明書で介護と障害の電子請求ができるようになります 電子請求受付システムの機能が変わります 代理人の申請方法が変わります 目次 1 2 3 4 電子請求受付システムの機能が変わります 1 枚の電子証明書で介護と障害の電子請求ができるようになります代理人の申請方法が変わります共通証明書を申請するには代理人の登録が必要となります 留意事項 1 登録できる委任事業所数には制限があります 2 見積書の表示金額が変わります
1 枚の電子証明書で介護と障害の電子請求ができるようになります 電子請求受付システムの機能が変わります 代理人の申請方法が変わります 目次 1 2 3 4 電子請求受付システムの機能が変わります 1 枚の電子証明書で介護と障害の電子請求ができるようになります代理人の申請方法が変わります共通証明書を申請するには代理人の登録が必要となります 留意事項 1 登録できる委任事業所数には制限があります 2 見積書の表示金額が変わります
2. 目的 1RationalRose を利用する場合にプログラム仕様書としての最低限必要な記述項目を明確にする 2 プログラム仕様書として記載内容に不足がない事をチェックする 3UML の知識があるものであれば 仕様書の内容を理解できること 4Rose にて入力した内容を SoDaWord を利用
 プログラム仕様書 (UML 表記法 ) ガイドライン 本仕様書に UML(Rational Rose 使用 ) を用いてプログラム仕様書を作成する際のガイドラインを記す 1. ドキュメントの様式について 1 ドキュメントは制御単位で作成する 2 表紙 及び変更履歴は SWS にて指定されたものを付加すること 3 下記の目次内で指定している UML 図 記述項目は必須項目とする 4SoDa にてドキュメントを出力する場合は
プログラム仕様書 (UML 表記法 ) ガイドライン 本仕様書に UML(Rational Rose 使用 ) を用いてプログラム仕様書を作成する際のガイドラインを記す 1. ドキュメントの様式について 1 ドキュメントは制御単位で作成する 2 表紙 及び変更履歴は SWS にて指定されたものを付加すること 3 下記の目次内で指定している UML 図 記述項目は必須項目とする 4SoDa にてドキュメントを出力する場合は
<4D F736F F D20939D8D87837D836A B B816996E BB8DEC8F8A816A F90BB8DEC E646F63>
 統合マネジメントマニュアル サンプル サンプルですので 一部のみの掲載です 全体像を把握される場 合は 目次 を参考にして下さい 第 1 版 制定 改訂 年月日 年月日 株式会社門田製作所 承認 作成 < 目次 > 目次 1 1. 序 3 2. 当社及び統合マネジメントシステムの概要 4 2.1 適用範囲 4 2.2 事業の概要 4 2.3 統合マネジメントシステムの全体像 5 3. 統合マネジメントシステムⅠ(
統合マネジメントマニュアル サンプル サンプルですので 一部のみの掲載です 全体像を把握される場 合は 目次 を参考にして下さい 第 1 版 制定 改訂 年月日 年月日 株式会社門田製作所 承認 作成 < 目次 > 目次 1 1. 序 3 2. 当社及び統合マネジメントシステムの概要 4 2.1 適用範囲 4 2.2 事業の概要 4 2.3 統合マネジメントシステムの全体像 5 3. 統合マネジメントシステムⅠ(
<90568E6493FC B2093B193FC90E096BE8F915F E786C73>
 お取引先様向け 新仕入伝票導入説明書 00 年 月 日.0 版 株式会社ユーホー 目次. 新仕入伝票の導入にむけて. 新伝票印字説明書 ( レイアウト ) 3. 新伝票印字説明書 ( 項目説明 ) 4. 新伝票印字説明書 ( 項目説明 ). 旧仕入伝票での対応について. 旧伝票印字説明書 ( レイアウト ) 7. 旧伝票印字説明書 ( 項目説明 ) 改版履歴 日付 版数 00/4/4.00 00/4/.0
お取引先様向け 新仕入伝票導入説明書 00 年 月 日.0 版 株式会社ユーホー 目次. 新仕入伝票の導入にむけて. 新伝票印字説明書 ( レイアウト ) 3. 新伝票印字説明書 ( 項目説明 ) 4. 新伝票印字説明書 ( 項目説明 ). 旧仕入伝票での対応について. 旧伝票印字説明書 ( レイアウト ) 7. 旧伝票印字説明書 ( 項目説明 ) 改版履歴 日付 版数 00/4/4.00 00/4/.0
内容 第 1 章 - 貴社の情報を必要となる理由? 第 2 章 - サプライヤ安全管理ツールから送信される電子メール通知 電子メールが迷惑メールフォルダに入る場合の処理方法 第 3 章 - サプライヤ安全管理ツール (SVAT) へのアクセス 第 4 章 - サプライヤー更新フォームの記入 サプライ
 HEWLETT PACKARD ENTERPRISE サプライヤー登録マニュアル HEWLETT PACKARD ENTERPRISE のサプライヤデータベースに登録する方法 1 内容 第 1 章 - 貴社の情報を必要となる理由? 第 2 章 - サプライヤ安全管理ツールから送信される電子メール通知 電子メールが迷惑メールフォルダに入る場合の処理方法 第 3 章 - サプライヤ安全管理ツール (SVAT)
HEWLETT PACKARD ENTERPRISE サプライヤー登録マニュアル HEWLETT PACKARD ENTERPRISE のサプライヤデータベースに登録する方法 1 内容 第 1 章 - 貴社の情報を必要となる理由? 第 2 章 - サプライヤ安全管理ツールから送信される電子メール通知 電子メールが迷惑メールフォルダに入る場合の処理方法 第 3 章 - サプライヤ安全管理ツール (SVAT)
Microsoft PowerPoint - 参考資料2
 個人情報を共有化する場合の個人情報の取扱に係る手続について 参考資料 2 地図情報の共有と個人情報 地域の農業関係機関により地図情報や属性情報の共有を行う際に 共有する情報に個人情報を含む場合がある 各種台帳 属性情報 農地関連情報 ( 傾斜度 農道整備状況等 ) 農業用水関連情報 ( 用 排水状況 水利慣行等 ) 所有 耕作者 貸借意向情報 農業 農村基盤図 ( イメージ ) 1/2,500 程度
個人情報を共有化する場合の個人情報の取扱に係る手続について 参考資料 2 地図情報の共有と個人情報 地域の農業関係機関により地図情報や属性情報の共有を行う際に 共有する情報に個人情報を含む場合がある 各種台帳 属性情報 農地関連情報 ( 傾斜度 農道整備状況等 ) 農業用水関連情報 ( 用 排水状況 水利慣行等 ) 所有 耕作者 貸借意向情報 農業 農村基盤図 ( イメージ ) 1/2,500 程度
Microsoft PowerPoint - HP利用マニュアル (事業者用) [互換モード]
![Microsoft PowerPoint - HP利用マニュアル (事業者用) [互換モード] Microsoft PowerPoint - HP利用マニュアル (事業者用) [互換モード]](/thumbs/92/110785241.jpg) みなと森と水ネットワーク会議 みなとモデル 酸化炭素固定認証制度 ホームページ利 マニュアル 事業者用 第 2 版 2012.10.1 1 はじめに 発 された ID とパスワードのメモに使用できます パスワードは最初に変更することをおすすめします ID PASS ログインサイト URL 港区環境リサイクル支援部環境課 地球温暖化対策担当 みなとモデル
みなと森と水ネットワーク会議 みなとモデル 酸化炭素固定認証制度 ホームページ利 マニュアル 事業者用 第 2 版 2012.10.1 1 はじめに 発 された ID とパスワードのメモに使用できます パスワードは最初に変更することをおすすめします ID PASS ログインサイト URL 港区環境リサイクル支援部環境課 地球温暖化対策担当 みなとモデル
2017/10/25 開催 Amazon のトレーナーが教える 商品登録から在庫の管理まで Q&A ( こちらの回答は 2017/10/25 付けの情報です ) 既存 ASIN への出品 ( 相乗り出品 ) に関する質問 Q1. メーカーが異なる場合でも相乗り出品できますか A1. メーカーが異なる
 2017/10/25 開催 Amazon のトレーナーが教える 商品登録から在庫の管理まで Q&A ( こちらの回答は 2017/10/25 付けの情報です ) 既存 ASIN への出品 ( 相乗り出品 ) に関する質問 Q1. メーカーが異なる場合でも相乗り出品できますか A1. メーカーが異なる場合は違う商品との認識でございますので 別のカタログを作成いただく必要がございます Q2. すでにカタログが登録されていて
2017/10/25 開催 Amazon のトレーナーが教える 商品登録から在庫の管理まで Q&A ( こちらの回答は 2017/10/25 付けの情報です ) 既存 ASIN への出品 ( 相乗り出品 ) に関する質問 Q1. メーカーが異なる場合でも相乗り出品できますか A1. メーカーが異なる場合は違う商品との認識でございますので 別のカタログを作成いただく必要がございます Q2. すでにカタログが登録されていて
Ⅲ-3 試用医薬品に関する基準 平成 10 年 1 月 20 日公正取引委員会届出改定平成 13 年 3 月 19 日公正取引委員会届出改定平成 16 年 5 月 25 日公正取引委員会届出改定平成 17 年 3 月 29 日公正取引委員会届出改定平成 26 年 6 月 16 日公正取引委員会 消費
 Ⅲ-3 試用医薬品に関する基準 平成 10 年 1 月 20 日公正取引委員会届出改定平成 13 年 3 月 19 日公正取引委員会届出改定平成 16 年 5 月 25 日公正取引委員会届出改定平成 17 年 3 月 29 日公正取引委員会届出改定平成 26 年 6 月 16 日公正取引委員会 消費者庁長官届出 本基準は規約第 5 条第 3 号 施行規則第 2 条 ( 試用医薬品提供基準 ) に基づくものである
Ⅲ-3 試用医薬品に関する基準 平成 10 年 1 月 20 日公正取引委員会届出改定平成 13 年 3 月 19 日公正取引委員会届出改定平成 16 年 5 月 25 日公正取引委員会届出改定平成 17 年 3 月 29 日公正取引委員会届出改定平成 26 年 6 月 16 日公正取引委員会 消費者庁長官届出 本基準は規約第 5 条第 3 号 施行規則第 2 条 ( 試用医薬品提供基準 ) に基づくものである
インターネット受付システム 収納情報ダウンロード 操作説明書 ver 株式会社電算システム EC ソリューション事業本部
 インターネット受付システム 収納情報ダウンロード 操作説明書 ver 1.0.6 株式会社電算システム EC ソリューション事業本部 改訂履歴 版数発行日改訂履歴 ver1.0.0 2016 年 1 月 18 日初版発行 ver1.0.1 ver1.0.2 ver1.0.3 ver1.0.4 ver1.0.5 ver1.0.6 2016 年 1 月 19 日 2016 年 3 月 8 日 2017
インターネット受付システム 収納情報ダウンロード 操作説明書 ver 1.0.6 株式会社電算システム EC ソリューション事業本部 改訂履歴 版数発行日改訂履歴 ver1.0.0 2016 年 1 月 18 日初版発行 ver1.0.1 ver1.0.2 ver1.0.3 ver1.0.4 ver1.0.5 ver1.0.6 2016 年 1 月 19 日 2016 年 3 月 8 日 2017
Microsoft Word - 規則11.2版_FSSC22000Ver.4特例.doc
 マネジメントシステム審査登録規則 FSSC22000Ver.4 特例 第 11.2 版改訂 :2017 年 9 月 15 日 発効 :2017 年 9 月 15 日 一般財団法人日本品質保証機構 マネジメントシステム部門 はじめに本特例は 一般財団法人日本品質保証機構 ( 以下 JQA という ) が運営する JQA マネジメントシステム審査登録制度 ( 以下 審査登録制度 という ) の詳細を規定した
マネジメントシステム審査登録規則 FSSC22000Ver.4 特例 第 11.2 版改訂 :2017 年 9 月 15 日 発効 :2017 年 9 月 15 日 一般財団法人日本品質保証機構 マネジメントシステム部門 はじめに本特例は 一般財団法人日本品質保証機構 ( 以下 JQA という ) が運営する JQA マネジメントシステム審査登録制度 ( 以下 審査登録制度 という ) の詳細を規定した
バリデーション基準 1. 医薬品 医薬部外品 GMP 省令に規定するバリデーションについては 品質リスクを考慮し 以下の バリデーション基準 に基づいて実施すること 2. バリデーション基準 (1) バリデーションの目的バリデーションは 製造所の構造設備並びに手順 工程その他の製造管理及び品質管理の
 バリデーション基準 1. 医薬品 医薬部外品 GMP 省令に規定するバリデーションについては 品質リスクを考慮し 以下の バリデーション基準 に基づいて実施すること 2. バリデーション基準 (1) バリデーションの目的バリデーションは 製造所の構造設備並びに手順 工程その他の製造管理及び品質管理の方法 ( 以下この基準において 製造手順等 という ) が期待される結果を与えることを検証し これを文書とすることによって
バリデーション基準 1. 医薬品 医薬部外品 GMP 省令に規定するバリデーションについては 品質リスクを考慮し 以下の バリデーション基準 に基づいて実施すること 2. バリデーション基準 (1) バリデーションの目的バリデーションは 製造所の構造設備並びに手順 工程その他の製造管理及び品質管理の方法 ( 以下この基準において 製造手順等 という ) が期待される結果を与えることを検証し これを文書とすることによって
行政文書をより体系的 効率的に管理するための電子的な管理の充実 1. 共有フォルダでの体系的 効率的な管理を実現するため 標準例 共通マニュアルを作成する (A) 標準例 共通マニュアル 下記のポイントを踏まえた標準例 共通マニュアルを作成する (ⅰ) 共有フォルダ内の体系的保存の標準化 (ⅱ) 文
 平成 30 年 11 月 19 日 ( 月 ) 第 70 回公文書管理委員会資料内閣府大臣官房公文書管理課 資料 2-2 文書ファイル等の名称付与の標準化 行政文書の所在情報管理の仕組み 平成 3 0 年 1 1 月 1 9 日 内閣府大臣官房公文書管理課 行政文書をより体系的 効率的に管理するための電子的な管理の充実 1. 共有フォルダでの体系的 効率的な管理を実現するため 標準例 共通マニュアルを作成する
平成 30 年 11 月 19 日 ( 月 ) 第 70 回公文書管理委員会資料内閣府大臣官房公文書管理課 資料 2-2 文書ファイル等の名称付与の標準化 行政文書の所在情報管理の仕組み 平成 3 0 年 1 1 月 1 9 日 内閣府大臣官房公文書管理課 行政文書をより体系的 効率的に管理するための電子的な管理の充実 1. 共有フォルダでの体系的 効率的な管理を実現するため 標準例 共通マニュアルを作成する
Microsoft PowerPoint - US cGMP検討会用080226(資料3-1).ppt
 資料 3-1 米国 FDA による ダイエタリーサプリメントの cgmp 21 CFR Part 111 2008 年 2 月 26 日 日本健康食品規格協会理事長大濱宏文 1 正式名称 ダイエタリーサプリメントの製造 包装 表示および保管のための cgmp (Current Good Manufacturing Practice in Manufacturing, Packaging, Labeling,
資料 3-1 米国 FDA による ダイエタリーサプリメントの cgmp 21 CFR Part 111 2008 年 2 月 26 日 日本健康食品規格協会理事長大濱宏文 1 正式名称 ダイエタリーサプリメントの製造 包装 表示および保管のための cgmp (Current Good Manufacturing Practice in Manufacturing, Packaging, Labeling,
PowerPoint Presentation
 製品ソフトウェアのセットアップ手順 UNIX/Linux 編 1. セットアップファイルの選択開発環境 / 実行環境 / バージョン /Hotfix/ インストール先 OS 2. 対象セットアップファイルのダウンロード開発環境の場合は 2 つのファイルが対象 3. ソフトウェア要件の確認 4. ソフトウェアのインストール 5. ライセンスの認証 1 1. セットアップファイルの選択 選択項目選択肢該当チェック
製品ソフトウェアのセットアップ手順 UNIX/Linux 編 1. セットアップファイルの選択開発環境 / 実行環境 / バージョン /Hotfix/ インストール先 OS 2. 対象セットアップファイルのダウンロード開発環境の場合は 2 つのファイルが対象 3. ソフトウェア要件の確認 4. ソフトウェアのインストール 5. ライセンスの認証 1 1. セットアップファイルの選択 選択項目選択肢該当チェック
る として 平成 20 年 12 月に公表された 規制改革推進のための第 3 次答申 において 医療機器開発の円滑化の観点から 薬事法の適用範囲の明確化を図るためのガイドラインを作成すべきであると提言したところである 今般 薬事法の適用に関する判断の透明性 予見可能性の向上を図るため 臨床研究におい
 都道府県知事 各保健所設置市長殿 特別区長 薬食発 0331 第 7 号 平成 22 年 3 月 31 日 厚生労働省医薬食品局長 臨床研究において用いられる未承認医療機器の提供等に係る 薬事法の適用について 薬事法 ( 昭和 35 年法律第 145 号 ) は 医療機器について品質 有効性及び安全性の確保がなされた製品のみが流通するよう種々の規制を設けているが 薬事法第 14 条第 1 項の承認を受けていない医療機器
都道府県知事 各保健所設置市長殿 特別区長 薬食発 0331 第 7 号 平成 22 年 3 月 31 日 厚生労働省医薬食品局長 臨床研究において用いられる未承認医療機器の提供等に係る 薬事法の適用について 薬事法 ( 昭和 35 年法律第 145 号 ) は 医療機器について品質 有効性及び安全性の確保がなされた製品のみが流通するよう種々の規制を設けているが 薬事法第 14 条第 1 項の承認を受けていない医療機器
IATF16949への移行審査
 International Automotive Task Force TRANSITION STARATEGY ISO/TS 16949 > IATF 16949 www. Iatfglobaloversight.org 前置き 2 移行タイミング要求事項 2 移行審査の要求事項 3 CB に対する移行審査チームの要求事項 5 移行審査の不適合マネジメント 6 IATF 16949 登録証発行 6
International Automotive Task Force TRANSITION STARATEGY ISO/TS 16949 > IATF 16949 www. Iatfglobaloversight.org 前置き 2 移行タイミング要求事項 2 移行審査の要求事項 3 CB に対する移行審査チームの要求事項 5 移行審査の不適合マネジメント 6 IATF 16949 登録証発行 6
< F2D819B955C8EA692CA926D DC58F4994AD8F6F>
 薬食監麻発第 0331008 号平成 17 年 3 月 31 日 各都道府県衛生主管部 ( 局 ) 長 薬事法及び採血及び供血あつせん業取締法の一部を改正する法律 ( 平成 14 年法律第 96 号 以下 一部改正法 という ) 第 2 条の規定による改正後の薬事法 ( 昭和 35 年法律第 145 号 以下 法 という ) 及び関係政省令等の規定に基づく医薬品 医薬部外品 化粧品及び医療機器 (
薬食監麻発第 0331008 号平成 17 年 3 月 31 日 各都道府県衛生主管部 ( 局 ) 長 薬事法及び採血及び供血あつせん業取締法の一部を改正する法律 ( 平成 14 年法律第 96 号 以下 一部改正法 という ) 第 2 条の規定による改正後の薬事法 ( 昭和 35 年法律第 145 号 以下 法 という ) 及び関係政省令等の規定に基づく医薬品 医薬部外品 化粧品及び医療機器 (
目次 ( ページ ) 1. はじめに 1 2. 特例債移行申請 CSV ファイルについて 1 3. 文字種 2 4. 文字コード 2 5. 項目の編集方法について 3 6. 入力ファイルについて 4 7. 提出方法 7 8. セキュリティーについて 7
 特例新株予約権付社債の移行申請データの作成方法について ( 第 1 版 ) 2007( 平成 19) 年 12 月 株式会社証券保管振替機構 目次 ( ページ ) 1. はじめに 1 2. 特例債移行申請 CSV ファイルについて 1 3. 文字種 2 4. 文字コード 2 5. 項目の編集方法について 3 6. 入力ファイルについて 4 7. 提出方法 7 8. セキュリティーについて 7 1.
特例新株予約権付社債の移行申請データの作成方法について ( 第 1 版 ) 2007( 平成 19) 年 12 月 株式会社証券保管振替機構 目次 ( ページ ) 1. はじめに 1 2. 特例債移行申請 CSV ファイルについて 1 3. 文字種 2 4. 文字コード 2 5. 項目の編集方法について 3 6. 入力ファイルについて 4 7. 提出方法 7 8. セキュリティーについて 7 1.
ISO9001:2015内部監査チェックリスト
 ISO9001:2015 規格要求事項 チェックリスト ( 質問リスト ) ISO9001:2015 規格要求事項に準拠したチェックリスト ( 質問リスト ) です このチェックリストを参考に 貴社品質マニュアルをベースに貴社なりのチェックリストを作成してください ISO9001:2015 規格要求事項を詳細に分解し 212 個の質問リストをご用意いたしました ISO9001:2015 は Shall
ISO9001:2015 規格要求事項 チェックリスト ( 質問リスト ) ISO9001:2015 規格要求事項に準拠したチェックリスト ( 質問リスト ) です このチェックリストを参考に 貴社品質マニュアルをベースに貴社なりのチェックリストを作成してください ISO9001:2015 規格要求事項を詳細に分解し 212 個の質問リストをご用意いたしました ISO9001:2015 は Shall
在庫のすぱいす説明資料
 在庫のすぱいす説明資料 2016/06/03 更新 1 在庫のすぱいすとは どこに 何が 何個ある のかを管理する 在庫管理の基本的なソフトです 2 製品の特徴 入出庫 棚卸データの収集は インストールしたパソコンのほかハンディターミナル ( ) でも行うことができます DB を共有する場合でも専用サーバーは不要 ネットワークの割り当てで参照できる Windows 系 (7 8 8.1) のパソコンであれば
在庫のすぱいす説明資料 2016/06/03 更新 1 在庫のすぱいすとは どこに 何が 何個ある のかを管理する 在庫管理の基本的なソフトです 2 製品の特徴 入出庫 棚卸データの収集は インストールしたパソコンのほかハンディターミナル ( ) でも行うことができます DB を共有する場合でも専用サーバーは不要 ネットワークの割り当てで参照できる Windows 系 (7 8 8.1) のパソコンであれば
ISO 9001:2015 改定セミナー (JIS Q 9001:2015 準拠 ) 第 4.2 版 株式会社 TBC ソリューションズ プログラム 年版改定の概要 年版の6 大重点ポイントと対策 年版と2008 年版の相違 年版への移行の実務
 ISO 9001:2015 改定セミナー (JIS Q 9001:2015 準拠 ) 第 4.2 版 株式会社 TBC ソリューションズ プログラム 1.2015 年版改定の概要 2.2015 年版の6 大重点ポイントと対策 3.2015 年版と2008 年版の相違 4.2015 年版への移行の実務 TBC Solutions Co.Ltd. 2 1.1 改定の背景 ISO 9001(QMS) ISO
ISO 9001:2015 改定セミナー (JIS Q 9001:2015 準拠 ) 第 4.2 版 株式会社 TBC ソリューションズ プログラム 1.2015 年版改定の概要 2.2015 年版の6 大重点ポイントと対策 3.2015 年版と2008 年版の相違 4.2015 年版への移行の実務 TBC Solutions Co.Ltd. 2 1.1 改定の背景 ISO 9001(QMS) ISO
14個人情報の取扱いに関する規程
 個人情報の取扱いに関する規程 第 1 条 ( 目的 ) 第 1 章総則 この規程は 東レ福祉会 ( 以下 本会 という ) における福祉事業に係わる個人情報の適法かつ適正な取扱いの確保に関する基本的事項を定めることにより 個人の権利 利益を保護することを目的とする 第 2 条 ( 定義 ) この規程における各用語の定義は 個人情報の保護に関する法律 ( 以下 個人情報保護法 という ) および個人情報保護委員会の個人情報保護に関するガイドラインによるものとする
個人情報の取扱いに関する規程 第 1 条 ( 目的 ) 第 1 章総則 この規程は 東レ福祉会 ( 以下 本会 という ) における福祉事業に係わる個人情報の適法かつ適正な取扱いの確保に関する基本的事項を定めることにより 個人の権利 利益を保護することを目的とする 第 2 条 ( 定義 ) この規程における各用語の定義は 個人情報の保護に関する法律 ( 以下 個人情報保護法 という ) および個人情報保護委員会の個人情報保護に関するガイドラインによるものとする
どのような便益があり得るか? より重要な ( ハイリスクの ) プロセス及びそれらのアウトプットに焦点が当たる 相互に依存するプロセスについての理解 定義及び統合が改善される プロセス及びマネジメントシステム全体の計画策定 実施 確認及び改善の体系的なマネジメント 資源の有効利用及び説明責任の強化
 ISO 9001:2015 におけるプロセスアプローチ この文書の目的 : この文書の目的は ISO 9001:2015 におけるプロセスアプローチについて説明することである プロセスアプローチは 業種 形態 規模又は複雑さに関わらず あらゆる組織及びマネジメントシステムに適用することができる プロセスアプローチとは何か? 全ての組織が目標達成のためにプロセスを用いている プロセスとは : インプットを使用して意図した結果を生み出す
ISO 9001:2015 におけるプロセスアプローチ この文書の目的 : この文書の目的は ISO 9001:2015 におけるプロセスアプローチについて説明することである プロセスアプローチは 業種 形態 規模又は複雑さに関わらず あらゆる組織及びマネジメントシステムに適用することができる プロセスアプローチとは何か? 全ての組織が目標達成のためにプロセスを用いている プロセスとは : インプットを使用して意図した結果を生み出す
1. 口座管理機関 ( 証券会社 ) の意見概要 A 案 ( 部会資料 23: 配当金参考案ベース ) と B 案 ( 部会資料 23: 共通番号参考案ベース ) のいずれが望ましいか 口座管理機 関 ( 証券会社 ) で構成される日証協の WG で意見照会したところ 次頁のとおり各観点において様々
 書面交付請求に係る仕組みについて 平成 30 年 7 月 4 日日本証券業協会 2011 0 1. 口座管理機関 ( 証券会社 ) の意見概要 A 案 ( 部会資料 23: 配当金参考案ベース ) と B 案 ( 部会資料 23: 共通番号参考案ベース ) のいずれが望ましいか 口座管理機 関 ( 証券会社 ) で構成される日証協の WG で意見照会したところ 次頁のとおり各観点において様々な意見が挙げられたが
書面交付請求に係る仕組みについて 平成 30 年 7 月 4 日日本証券業協会 2011 0 1. 口座管理機関 ( 証券会社 ) の意見概要 A 案 ( 部会資料 23: 配当金参考案ベース ) と B 案 ( 部会資料 23: 共通番号参考案ベース ) のいずれが望ましいか 口座管理機 関 ( 証券会社 ) で構成される日証協の WG で意見照会したところ 次頁のとおり各観点において様々な意見が挙げられたが
15288解説_D.pptx
 ISO/IEC 15288:2015 テクニカルプロセス解説 2015/8/26 システムビューロ システムライフサイクル 2 テクニカルプロセス a) Business or mission analysis process b) Stakeholder needs and requirements definieon process c) System requirements definieon
ISO/IEC 15288:2015 テクニカルプロセス解説 2015/8/26 システムビューロ システムライフサイクル 2 テクニカルプロセス a) Business or mission analysis process b) Stakeholder needs and requirements definieon process c) System requirements definieon
~ 目次 ~ 目次 1. はじめに 受注データファイル入力固定長形式レイアウト初期値 受注データファイル入力 CSV 形式レイアウト初期値 受注データファイル出力固定長形式レイアウト初期値 受注データファイル出
 iteran/ae 外部データ連携 ファイル入出力レイアウト初期値 第 1.0 版 2018 年 3 月 27 日 富士通エフ アイ ピー株式会社 ~ 目次 ~ 目次 1. はじめに...- 2-2-1. 受注データファイル入力固定長形式レイアウト初期値...- 4-2-2. 受注データファイル入力 CSV 形式レイアウト初期値...- 7-2-3. 受注データファイル出力固定長形式レイアウト初期値...-
iteran/ae 外部データ連携 ファイル入出力レイアウト初期値 第 1.0 版 2018 年 3 月 27 日 富士通エフ アイ ピー株式会社 ~ 目次 ~ 目次 1. はじめに...- 2-2-1. 受注データファイル入力固定長形式レイアウト初期値...- 4-2-2. 受注データファイル入力 CSV 形式レイアウト初期値...- 7-2-3. 受注データファイル出力固定長形式レイアウト初期値...-
<4D F736F F D D BB95698ADC974C89BB8A7795A88EBF8AC7979D91CE899E834B >
 製品含有化学物質管理対応ガイドライン 第 1.0 版 2014 年 3 月 1 日制定 ニチユ三菱フォークリフト株式会社 目次 1. はじめに 1 2. 方針 2 3. 適用範囲 2 3.1 適用法規 2 3.2 禁止物質 2 3.3 管理物質 2 4. 取引先様へのお願い事項 3 4.1 物質規制対応連絡先窓口の届出 3 4.2 物質規制管理体制の構築 3 4.3 禁止物質の不使用 非含有宣言書の提出
製品含有化学物質管理対応ガイドライン 第 1.0 版 2014 年 3 月 1 日制定 ニチユ三菱フォークリフト株式会社 目次 1. はじめに 1 2. 方針 2 3. 適用範囲 2 3.1 適用法規 2 3.2 禁止物質 2 3.3 管理物質 2 4. 取引先様へのお願い事項 3 4.1 物質規制対応連絡先窓口の届出 3 4.2 物質規制管理体制の構築 3 4.3 禁止物質の不使用 非含有宣言書の提出
<4D F736F F F696E74202D B4B91A582C68CFA90B6984A93AD8FC892CA926D82C682CC94E48A7282C982C282A282C42E B8CDD8AB B83685D>
 医療機器 UDI 規制の国内導入に 当たっての検討資料 2013 年 8 月 一般財団法人流通システム開発センター 目次 そもそも UDI 規制の成り立ちは? 機器識別子と製造識別子 - 混乱せず正確な理解のために - 米国 UDI バーコードと厚生労働省バーコードの比較表 米国 UDI 規制の個別事項の日本での受入れについて FDA の医療機器製品コードは既に世界標準 一般性がある FDA EU
医療機器 UDI 規制の国内導入に 当たっての検討資料 2013 年 8 月 一般財団法人流通システム開発センター 目次 そもそも UDI 規制の成り立ちは? 機器識別子と製造識別子 - 混乱せず正確な理解のために - 米国 UDI バーコードと厚生労働省バーコードの比較表 米国 UDI 規制の個別事項の日本での受入れについて FDA の医療機器製品コードは既に世界標準 一般性がある FDA EU
J I S J A S O 廃止提案書 1. 対象規格 JASO M 304:02 ( 自動車用発泡体 ) 2. 廃止の背景と理由この規格は自動車用の断熱 防音 防振及びクッション用材料の性能 試験方法を標準化する趣旨で 1969 年に制定され 以後 4 回の改正が行われた なお 本年度の定期見直し
 1. 対象規格 JASO M 304:02 ( 自動車用発泡体 ) 2. 廃止の背景と理由この規格は自動車用の断熱 防音 防振及びクッション用材料の性能 試験方法を標準化する趣旨で 1969 年に制定され 以後 4 回の改正が行われた なお 本年度の定期見直しにおいて この規格の維持要否を確認した結果 現在は各社個別の社内規定での運用 または 2004 年に制定された JIS K6400-1~-8(
1. 対象規格 JASO M 304:02 ( 自動車用発泡体 ) 2. 廃止の背景と理由この規格は自動車用の断熱 防音 防振及びクッション用材料の性能 試験方法を標準化する趣旨で 1969 年に制定され 以後 4 回の改正が行われた なお 本年度の定期見直しにおいて この規格の維持要否を確認した結果 現在は各社個別の社内規定での運用 または 2004 年に制定された JIS K6400-1~-8(
(Microsoft PowerPoint - \220V\213\214\225\266\217\221\224\344\212r\203\\\203t\203g\202o\202o\202s\216\221\227\277ADVIT1-30\224\305.ppt)
 新製品 新旧文書比較ソフト の紹介 ~ ドキュメント作成作業の 150% 効率 UP~ 2010 年 1 月 30 日 株式会社 IT 企画 advit2007@gmail.com http://www.advanced-it.co.jp/ 新旧文書比較ソフトの概要 1. 新旧比較表 の必要性について 2. 新旧文書比較ソフト の開発経緯と実績 3. 新旧文書比較ソフト の機能 1 新旧比較機能 2
新製品 新旧文書比較ソフト の紹介 ~ ドキュメント作成作業の 150% 効率 UP~ 2010 年 1 月 30 日 株式会社 IT 企画 advit2007@gmail.com http://www.advanced-it.co.jp/ 新旧文書比較ソフトの概要 1. 新旧比較表 の必要性について 2. 新旧文書比較ソフト の開発経緯と実績 3. 新旧文書比較ソフト の機能 1 新旧比較機能 2
法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品 医療機器等の品質
 医療機器クラス分類表 ( 平成 30 年 10 月 19 日現在 ) 香川県健康福祉部薬務感染症対策課薬事指導グループ 法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品
医療機器クラス分類表 ( 平成 30 年 10 月 19 日現在 ) 香川県健康福祉部薬務感染症対策課薬事指導グループ 法律 出典 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年 8 月 10 日法律第 145 号 ) 政令 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行令 ( 昭和 36 年 1 月 26 日政令第 11 号 ) 省令 医薬品
Webエムアイカード会員規約
 Web エムアイカード会員規約 第 1 条 ( 目的 ) Web エムアイカード会員規約 ( 以下 本規約 といいます ) は 株式会社エムアイカード ( 以下 当社 といいます ) がインターネット上に提供する Web エムアイカード会員サービス ( 以下 本サービス といいます ) を 第 2 条に定める Web エムアイカード会員 ( 以下 Web 会員 といいます ) が利用するための条件を定めたものです
Web エムアイカード会員規約 第 1 条 ( 目的 ) Web エムアイカード会員規約 ( 以下 本規約 といいます ) は 株式会社エムアイカード ( 以下 当社 といいます ) がインターネット上に提供する Web エムアイカード会員サービス ( 以下 本サービス といいます ) を 第 2 条に定める Web エムアイカード会員 ( 以下 Web 会員 といいます ) が利用するための条件を定めたものです
PowerPoint プレゼンテーション
 Amazon ブランド登録 記載の内容は 2016 年 12 月 26 日現在のものです サービス内容 およびインターネットサイト上の表示等は変更となる場合がありますのでご了承ください 無断転載 複製を禁止します Amazon, アマゾン, Amazon.co.jp, Amazon Services Japan, Merchants@amazon.co.jp, フルフィルメント by Amazon,
Amazon ブランド登録 記載の内容は 2016 年 12 月 26 日現在のものです サービス内容 およびインターネットサイト上の表示等は変更となる場合がありますのでご了承ください 無断転載 複製を禁止します Amazon, アマゾン, Amazon.co.jp, Amazon Services Japan, Merchants@amazon.co.jp, フルフィルメント by Amazon,
desknet's NEO 初期設定マニュアル
 デスクネッツネオ desknet's NEO 無料お試し 初期設定マニュアル desknet's NEO V3.5 対応版 Copyright (C) NEOJAPAN Inc. All Rights Reserved. 本資料について この度は desknet s クラウドのお試しをお申込みいただき誠にありがとうございます 本資料では desknet s クラウドのお試しを行うにあたり最低限の設定についてご案内いたします
デスクネッツネオ desknet's NEO 無料お試し 初期設定マニュアル desknet's NEO V3.5 対応版 Copyright (C) NEOJAPAN Inc. All Rights Reserved. 本資料について この度は desknet s クラウドのお試しをお申込みいただき誠にありがとうございます 本資料では desknet s クラウドのお試しを行うにあたり最低限の設定についてご案内いたします
高知県産品データベース
 高知県産品データベース 2017 目次 トップ画面の説明... 3 事業者検索について... 5 事業者名 取扱商品などのキーワードから事業者を探す... 5 取扱商品が属しているカテゴリから事業者を探す... 7 商品検索について... 9 取扱商品名などのキーワードから商品を探す... 9 その商品が属しているカテゴリから商品を探す... 11 閲覧した商品から探す... 12 データベースへのログインについて...
高知県産品データベース 2017 目次 トップ画面の説明... 3 事業者検索について... 5 事業者名 取扱商品などのキーワードから事業者を探す... 5 取扱商品が属しているカテゴリから事業者を探す... 7 商品検索について... 9 取扱商品名などのキーワードから商品を探す... 9 その商品が属しているカテゴリから商品を探す... 11 閲覧した商品から探す... 12 データベースへのログインについて...
Team JBA (日本バスケットボール協会 新会員登録管理システム)
 Team JBA ( 日本バスケットボール協会会員登録管理システム ) 年度更新後の登録手続きガイド [1U12 継続チーム 選手用 ](2018/4/23 版 ) 2018 年度登録について 登録制度改定により ミニ U12 に変更になっています チーム責任者による競技者の一括登録が可能です なお 必ず事前に競技者 ( 保護者 ) の承諾を得た上で登録手続きを行ってください 前年度の登録情報を利用した手続きが可能です
Team JBA ( 日本バスケットボール協会会員登録管理システム ) 年度更新後の登録手続きガイド [1U12 継続チーム 選手用 ](2018/4/23 版 ) 2018 年度登録について 登録制度改定により ミニ U12 に変更になっています チーム責任者による競技者の一括登録が可能です なお 必ず事前に競技者 ( 保護者 ) の承諾を得た上で登録手続きを行ってください 前年度の登録情報を利用した手続きが可能です
目 次 1. タムラグループの環境活動 1 2. グリーン調達基準 1 第 1 章総則 1 第 2 章取引先様への要求事項 3 第 3 章材料 部品等の選定基準 3 第 4 章取引先様への調査内容 4 附則 5
 タムラグループグリーン調達基準 ( 第 05 版 ) 制定 :2009 年 9 月 01 日改定 :2018 年 4 月 19 日 ( 第 05 版 ) 目 次 1. タムラグループの環境活動 1 2. グリーン調達基準 1 第 1 章総則 1 第 2 章取引先様への要求事項 3 第 3 章材料 部品等の選定基準 3 第 4 章取引先様への調査内容 4 附則 5 1. タムラグループの環境活動 タムラグループでは
タムラグループグリーン調達基準 ( 第 05 版 ) 制定 :2009 年 9 月 01 日改定 :2018 年 4 月 19 日 ( 第 05 版 ) 目 次 1. タムラグループの環境活動 1 2. グリーン調達基準 1 第 1 章総則 1 第 2 章取引先様への要求事項 3 第 3 章材料 部品等の選定基準 3 第 4 章取引先様への調査内容 4 附則 5 1. タムラグループの環境活動 タムラグループでは
変更履歴 変 更 日 項目 変 更 内 容 2011/08/01 初版 2017/07/20 客注納品データファイルレイアウト注文番号とSKUを項目追加 2017/08/30 客注納品データファイルレイアウト注文番号とSKUに対する注意事項を追加 1 / 9
 インターネット EDI システム データダウンロードファイルレイアウト (BACREX タイプ ) 2011 年 8 月 1 日初版 2017 年 8 月 30 日改版 株式会社ヒマラヤ 変更履歴 変 更 日 項目 変 更 内 容 2011/08/01 初版 2017/07/20 客注納品データファイルレイアウト注文番号とSKUを項目追加 2017/08/30 客注納品データファイルレイアウト注文番号とSKUに対する注意事項を追加
インターネット EDI システム データダウンロードファイルレイアウト (BACREX タイプ ) 2011 年 8 月 1 日初版 2017 年 8 月 30 日改版 株式会社ヒマラヤ 変更履歴 変 更 日 項目 変 更 内 容 2011/08/01 初版 2017/07/20 客注納品データファイルレイアウト注文番号とSKUを項目追加 2017/08/30 客注納品データファイルレイアウト注文番号とSKUに対する注意事項を追加
3. 電文方式と構造
 3. 電文方式と構造 3. 電文方式と構造 NACCS では NACCS EDI 標準の電文 (NACCS EDI 電文 ) MIME(Multipurpose Internet Mail Extensions) 形式の電文 (EDIFACT 電文及び添付ファイル電文 ) XML 形式電文の 3 種類の電文を利用する NACCS EDI 電文は 業務仕様書にて規定されたすべての業務及び管理資料に対応している
3. 電文方式と構造 3. 電文方式と構造 NACCS では NACCS EDI 標準の電文 (NACCS EDI 電文 ) MIME(Multipurpose Internet Mail Extensions) 形式の電文 (EDIFACT 電文及び添付ファイル電文 ) XML 形式電文の 3 種類の電文を利用する NACCS EDI 電文は 業務仕様書にて規定されたすべての業務及び管理資料に対応している
スライド 1
 医療機器品質マネジメントシステム認証機関認定の最新状況と今後の動向について 公益財団法人日本適合性認定協会 認定センター 中川梓 1 ご説明する項目 医療機器品質マネジメントシステム認定 / 認証制度 ISO13485 認証を取りまく状況 各国規制の状況及び国際整合への動き IAF の取組み 2 マネジメントシステム認定 / 認証制度 認定機関 (ISO/IEC 17011) 認定 認証機関の能力を審査する
医療機器品質マネジメントシステム認証機関認定の最新状況と今後の動向について 公益財団法人日本適合性認定協会 認定センター 中川梓 1 ご説明する項目 医療機器品質マネジメントシステム認定 / 認証制度 ISO13485 認証を取りまく状況 各国規制の状況及び国際整合への動き IAF の取組み 2 マネジメントシステム認定 / 認証制度 認定機関 (ISO/IEC 17011) 認定 認証機関の能力を審査する
BIM/CIM 活用における 段階モデル確認書 作成マニュアル 試行版 ( 案 ) 平成 31 年 3 月 国土交通省 大臣官房技術調査課
 BIM/CIM 活用における 段階モデル確認書 作成マニュアル 試行版 ( 案 ) 平成 31 年 3 月 国土交通省 大臣官房技術調査課 目次 総則... 3 1.1 本マニュアルの位置づけ 目的... 3 1.2 適用範囲... 3 1.3 本マニュアルの構成... 3 1.4 段階モデル確認書の概要... 4 1.5 用語の定義... 6 段階モデル確認書の作成方法... 7 2.1 段階モデル確認書の作成手順...
BIM/CIM 活用における 段階モデル確認書 作成マニュアル 試行版 ( 案 ) 平成 31 年 3 月 国土交通省 大臣官房技術調査課 目次 総則... 3 1.1 本マニュアルの位置づけ 目的... 3 1.2 適用範囲... 3 1.3 本マニュアルの構成... 3 1.4 段階モデル確認書の概要... 4 1.5 用語の定義... 6 段階モデル確認書の作成方法... 7 2.1 段階モデル確認書の作成手順...
J-STAGE 記事登載時の入力データのチェック強化について
 J-STAGE ご利用学協会様向け J-STAGE 記事登載時の入力データのチェック強化について 2016 年 3 月 23 日 2016 年 6 月 30 日改訂 知識基盤情報部 記事登載時の入力データのチェック強化の目的 JST は J-STAGE の論文情報が国内外からアクセスされることを目的として ジャパンリンクセンター (JaLC) を介して永続的アクセスを確保する DOI の登録を行い
J-STAGE ご利用学協会様向け J-STAGE 記事登載時の入力データのチェック強化について 2016 年 3 月 23 日 2016 年 6 月 30 日改訂 知識基盤情報部 記事登載時の入力データのチェック強化の目的 JST は J-STAGE の論文情報が国内外からアクセスされることを目的として ジャパンリンクセンター (JaLC) を介して永続的アクセスを確保する DOI の登録を行い
<4D F736F F D2095CA8E F955C92A382E A E B5B8C5E8EAE5D5F95BD95A82E646F63>
 別紙 5 表張りの平物ユニットタイルの型式認定の新規申請の手順 平成 26 年 03 月 31 日 全国タイル工業組合 申請の基本的な流れを下記に記します 進捗番号とは 申請システムの各画面上部に 5 角形矢印で表示される番号を意味します 進捗番号 項目 ( 各画面タイトル ) ログイン メニュー ( 新規申請 ) 1 認定区分入力 2 申請製品情報 3 タイル情報入力 タイル基本情報タイル寸法 質量情報タイル品質評価表
別紙 5 表張りの平物ユニットタイルの型式認定の新規申請の手順 平成 26 年 03 月 31 日 全国タイル工業組合 申請の基本的な流れを下記に記します 進捗番号とは 申請システムの各画面上部に 5 角形矢印で表示される番号を意味します 進捗番号 項目 ( 各画面タイトル ) ログイン メニュー ( 新規申請 ) 1 認定区分入力 2 申請製品情報 3 タイル情報入力 タイル基本情報タイル寸法 質量情報タイル品質評価表
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
BACREX-R 小売標準化テンプレートドキュメント
 Ver5 株式会社ナンバ送受信ファイルレイアウト ( 取引先側 ) 第 6 版 変更履歴 変更日項目変更内容 2016/09/07 第 2 版 出荷メッセージ明細レコード 型番 項目の形式の誤りを修正 2016/09/12 第 3 版 伝票区分を変更いたしました 対象 : 出荷メッセージ 受領メッセージ 支払メッセージ 2016/10/14 第 4 版 便 項目を メッセージ区分 に変更 対象 :
Ver5 株式会社ナンバ送受信ファイルレイアウト ( 取引先側 ) 第 6 版 変更履歴 変更日項目変更内容 2016/09/07 第 2 版 出荷メッセージ明細レコード 型番 項目の形式の誤りを修正 2016/09/12 第 3 版 伝票区分を変更いたしました 対象 : 出荷メッセージ 受領メッセージ 支払メッセージ 2016/10/14 第 4 版 便 項目を メッセージ区分 に変更 対象 :
A 債権発生請求(一括記録請求)H291205_四校.indd
 でんさいサービス でんさいサービス 操作ガイド 債権発生請求 ( 一括記録請求 ) 目次一括記録ファイルのアップロード手順 1 ページ一括記録請求結果の照会手順 4 ページエラー ( 連鎖 ) のみ再請求する手順 6 ページ一括記録請求の導入テスト手順 8 ページ付録 11 ページ H30.01 権発生請求(一括記録請求)1 債 概要 債権発生記録請求 ( 一括 ) 一括して ( まとめて ) 記録請求を行うことができます
でんさいサービス でんさいサービス 操作ガイド 債権発生請求 ( 一括記録請求 ) 目次一括記録ファイルのアップロード手順 1 ページ一括記録請求結果の照会手順 4 ページエラー ( 連鎖 ) のみ再請求する手順 6 ページ一括記録請求の導入テスト手順 8 ページ付録 11 ページ H30.01 権発生請求(一括記録請求)1 債 概要 債権発生記録請求 ( 一括 ) 一括して ( まとめて ) 記録請求を行うことができます
(Microsoft Word -
 事務連絡 平成 30 年 2 月 28 日 医薬品 医療機器等製造販売業者殿 奈良県医療政策部薬務課薬物監視係長 医薬品 医療機器等の回収の取扱いについて 医薬品 医薬部外品 化粧品及び医療機器等の回収については 医薬品 医療機器等の回収について ( 平成 26 年 12 月 21 日付け薬食発 1121 第 10 号厚生労働省医薬食品局長通知 ) 及び 医薬品 医療機器等の回収の取扱いについて (
事務連絡 平成 30 年 2 月 28 日 医薬品 医療機器等製造販売業者殿 奈良県医療政策部薬務課薬物監視係長 医薬品 医療機器等の回収の取扱いについて 医薬品 医薬部外品 化粧品及び医療機器等の回収については 医薬品 医療機器等の回収について ( 平成 26 年 12 月 21 日付け薬食発 1121 第 10 号厚生労働省医薬食品局長通知 ) 及び 医薬品 医療機器等の回収の取扱いについて (
申請ソフトの起動 申請ソフトを起動して ファイル 申請書の新規作成 を選択 様式から C04 を選択し 了解 クリック ( 参考 1) FD 申請ソフトでの申請書鑑の打出しは 印字されない空欄箇所がありますので 別途 書面による鑑の作成が必要です その方法は FD 申請ソフトの入力手順の次 (P14
 外国製造業者認定申請の作成例 - C04( 医療機器外国製造業者認定申請 ) の事例 - 本作成例は FD 申請ソフトで作成した申請書の提出を前提に その入力方法や申請時に必要な書類などの説明をしています FD 申請へのご協力をお願いします PMDA へ提出する 医療機器医療機器の外国製造業者認定外国製造業者認定申請において 入力情報を最小限にとどめた 簡易入力による簡易入力による FD 申請の受付を平成
外国製造業者認定申請の作成例 - C04( 医療機器外国製造業者認定申請 ) の事例 - 本作成例は FD 申請ソフトで作成した申請書の提出を前提に その入力方法や申請時に必要な書類などの説明をしています FD 申請へのご協力をお願いします PMDA へ提出する 医療機器医療機器の外国製造業者認定外国製造業者認定申請において 入力情報を最小限にとどめた 簡易入力による簡易入力による FD 申請の受付を平成
該非判定ツールの整備と電子化について 2012 年 5 月 15 日 UCIP 外為 NET 会員 A 該非判定は安全保障輸出管理において特に重要なプロセスである 然しながら判定対象の技術的な内容等を法令の規制内容に照らして判断する作業ゆえ 容易にかつ高品質な結果を得るにはある一定レベルの体制 知識
 該非判定ツールの整備と電子化について 2012 年 5 月 15 日 UCIP 外為 NET 会員 A 該非判定は安全保障輸出管理において特に重要なプロセスである 然しながら判定対象の技術的な内容等を法令の規制内容に照らして判断する作業ゆえ 容易にかつ高品質な結果を得るにはある一定レベルの体制 知識 経験等を必要とする 該非判定ツールの整備と電子化は 体制 知識 経験等の不足を補う手段として期待でき
該非判定ツールの整備と電子化について 2012 年 5 月 15 日 UCIP 外為 NET 会員 A 該非判定は安全保障輸出管理において特に重要なプロセスである 然しながら判定対象の技術的な内容等を法令の規制内容に照らして判断する作業ゆえ 容易にかつ高品質な結果を得るにはある一定レベルの体制 知識 経験等を必要とする 該非判定ツールの整備と電子化は 体制 知識 経験等の不足を補う手段として期待でき
プロジェクトマネジメント知識体系ガイド (PMBOK ガイド ) 第 6 版 訂正表 - 第 3 刷り 注 : 次の正誤表は PMBOK ガイド第 6 版 の第 1 刷りと第 2 刷りに関するものです 本 ( または PDF) の印刷部数を確認するには 著作権ページ ( 通知ページおよび目次の前 )
 プロジェクトマネジメント知識体系ガイド (PMBOK ガイド ) 第 6 版 訂正表 - 第 3 刷り 注 : 次の正誤表は PMBOK ガイド第 6 版 の第 1 刷りと第 2 刷りに関するものです 本 ( または PDF) の印刷部数を確認するには 著作権ページ ( 通知ページおよび目次の前 ) の一番下を参照してください 10 9 8 などで始まる文字列の 最後の 数字は その特定コピーの印刷を示します
プロジェクトマネジメント知識体系ガイド (PMBOK ガイド ) 第 6 版 訂正表 - 第 3 刷り 注 : 次の正誤表は PMBOK ガイド第 6 版 の第 1 刷りと第 2 刷りに関するものです 本 ( または PDF) の印刷部数を確認するには 著作権ページ ( 通知ページおよび目次の前 ) の一番下を参照してください 10 9 8 などで始まる文字列の 最後の 数字は その特定コピーの印刷を示します
1.ICD-10(2013 年版 ) のコーディングの確認対象 確認対象医療機関 DPC 対象病院および DPC 準備病院 確認対象期間 平成 28 年 10 月診療分 ~ 平成 30 年 3 月診療分 ( 計 18 か月 ) 確認対象 ICD-10 様式 1 の診断情報の ICD-10 コードを対
 2017.11.21 変更箇所緑字 ICD-10(2013 年版 ) 準拠データの作成 確認作業について 実施要領 現在 DPC 制度では 疾病及び関連保健問題の国際統計分類 ICD-10( 以下 ICD-10 という )( 2003 年版 ) に基づいて疾病のコーディングを行っていただいておりますが 我が国における 疾病 傷害及び死因の統計分類 が ICD-10(2013 年版 ) 準拠に改正されたことを踏まえ
2017.11.21 変更箇所緑字 ICD-10(2013 年版 ) 準拠データの作成 確認作業について 実施要領 現在 DPC 制度では 疾病及び関連保健問題の国際統計分類 ICD-10( 以下 ICD-10 という )( 2003 年版 ) に基づいて疾病のコーディングを行っていただいておりますが 我が国における 疾病 傷害及び死因の統計分類 が ICD-10(2013 年版 ) 準拠に改正されたことを踏まえ
<4D F736F F D F8E FEE95F1836C F8EE88F878F F88979D8BC68ED2976C A2E646F63>
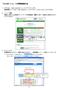 さんぱいくん への情報登録方法 1. まず http://www2.sanpainet.or.jp にアクセスします 産廃情報ネット http://www.sanpainet.or.jp からもリンクをたどることができます 2. メニュー画面情報を公表する公表項目セットデータの新規登録 編集や公表 公表停止の設定を行なうことができます 処理業者データ登録 変更 をクリック 3. ログインする処理業者向けのログイン画面が表示されます
さんぱいくん への情報登録方法 1. まず http://www2.sanpainet.or.jp にアクセスします 産廃情報ネット http://www.sanpainet.or.jp からもリンクをたどることができます 2. メニュー画面情報を公表する公表項目セットデータの新規登録 編集や公表 公表停止の設定を行なうことができます 処理業者データ登録 変更 をクリック 3. ログインする処理業者向けのログイン画面が表示されます
V-CUBE One
 V-CUBE One ご利用マニュアル ブイキューブ 2016/12/22 この文書は V-CUBE One のご利用マニュアルです 更新履歴更新日内容 2014/09/01 新規作成 2014/09/25 画像修正 2015/02/04 ログイン URL の変更 セミナーも V-CUBE ID を利用して V-CUBE One のログイン画面からログインできるよう機能追加 画像修正 2015/03/20
V-CUBE One ご利用マニュアル ブイキューブ 2016/12/22 この文書は V-CUBE One のご利用マニュアルです 更新履歴更新日内容 2014/09/01 新規作成 2014/09/25 画像修正 2015/02/04 ログイン URL の変更 セミナーも V-CUBE ID を利用して V-CUBE One のログイン画面からログインできるよう機能追加 画像修正 2015/03/20
【押印あり】日本医学会宛
 別紙 再生医療等製品患者登録システムへの参加協力のお願い 患者登録システムの目的 患者登録システムは 再生医療等製品の市販後の使用状況や患者予後等のデータを収集し 迅速な安全対策や新たな製品開発等を通じて 医療の向上に役立てることを目的としています 患者登録システムは 製品毎に構築 運用されます この患者登録システムは 一般的には レジストリ と呼ばれることもあります 構築形態例 患者登録システムの対象
別紙 再生医療等製品患者登録システムへの参加協力のお願い 患者登録システムの目的 患者登録システムは 再生医療等製品の市販後の使用状況や患者予後等のデータを収集し 迅速な安全対策や新たな製品開発等を通じて 医療の向上に役立てることを目的としています 患者登録システムは 製品毎に構築 運用されます この患者登録システムは 一般的には レジストリ と呼ばれることもあります 構築形態例 患者登録システムの対象
