ネキシウムカプセル10mg_インタビューフォーム
|
|
|
- らむ まきい
- 5 years ago
- Views:
Transcription
1 2018 年 11 月 ( 第 12 版 ) 日本標準商品分類番号 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 剤 形腸溶性顆粒を充てんしたカプセル剤 製剤の規制区分処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 規格 含量ネキシウムカプセル 10mg:1 カプセル中エソメプラゾール 10mg を含有ネキシウムカプセル 20mg:1 カプセル中エソメプラゾール 20mg を含有 一般名 製造販売承認年月日薬価基準収載 発売年月日 開発 製造販売 ( 輸入 ) 提携 販売会社名 和名 : エソメプラゾールマグネシウム水和物 (JAN) 洋名 :Esomeprazole Magnesium Hydrate(JAN) 製 造 販 売 承 認 年 月 日 :2011 年 7 月 1 日 薬 価 基 準 収 載 年 月 日 :2011 年 9 月 12 日 発 売 年 月 日 :2011 年 9 月 15 日 製造販売承認事項一部変更承認年月日 :2012 年 6 月 22 日 ( 効能 効果の変更による ) 製造販売承認事項一部変更承認年月日 :2013 年 2 月 21 日 ( 効能 効果の変更による ) 製造販売承認事項一部変更承認年月日 :2018 年 1 月 19 日 ( 用法 用量の変更による ) 製造販売元 : アストラゼネカ株式会社販売元 : 第一三共株式会社 医療情報担当者の連絡先 問い合わせ窓口 アストラゼネカ株式会社メディカルインフォメーションセンター TEL: 医療関係者向けホームページ (MediChannel) 第一三共株式会社製品情報センター TEL: 医療関係者向けホームページ 本 IF は 2018 年 1 月改訂 ( 第 10 版 ) の添付文書の記載に基づき改訂した 最新の添付文書情報は 独立行政法人医薬品医療機器総合機構ホームページ にてご確認ください
2 1. 医薬品インタビューフォーム作成の経緯 IF 利用の手引きの概要 日本病院薬剤師会 医療用医薬品の基本的な要約情報として医療用医薬品添付文書 ( 以下 添付文書と略す ) がある 医療現場で医師 薬剤師等の医療従事者が日常業務に必要な医薬品の適正使用情報を活用する際には 添付文書に記載された情報を裏付ける更に詳細な情報が必要な場合がある 医療現場では 当該医薬品について製薬企業の医薬情報担当者等に情報の追加請求や質疑をして情報を補完して対処してきている この際に必要な情報を網羅的に入手するための情報リストとしてインタビューフォームが誕生した 昭和 63 年に日本病院薬剤師会 ( 以下 日病薬と略す ) 学術第 2 小委員会が 医薬品インタビューフォーム ( 以下 IF と略す ) の位置付け並びに IF 記載様式を策定した その後 医療従事者向け並びに患者向け医薬品情報ニーズの変化を受けて 平成 10 年 9 月に日病薬学術第 3 小委員会において IF 記載要領の改訂が行われた 更に 10 年が経過し 医薬品情報の創り手である製薬企業 使い手である医療現場の薬剤師 双方にとって薬事 医療環境は大きく変化したことを受けて 平成 20 年 9 月に日病薬医薬情報委員会において IF 記載要領 2008 が策定された IF 記載要領 2008 では IF を紙媒体の冊子として提供する方式から PDF 等の電磁的データとして提供すること (e-if) が原則となった この変更にあわせて 添付文書において 効能 効果の追加 警告 禁忌 重要な基本的注意の改訂 などの改訂があった場合に 改訂の根拠データを追加した最新版の e-if が提供されることとなった 最新版の e-if は ( 独 ) 医薬品医療機器総合機構の医薬品情報提供ホームページ ( から一括して入手可能となっている 日本病院薬剤師会では e-if を掲載する医薬品情報提供ホームページが公的サイトであることに配慮して 薬価基準収載にあわせて e-if の情報を検討する組織を設置して 個々の IF が添付文書を補完する適正使用情報として適切か審査 検討することとした 2008 年より年 4 回のインタビューフォーム検討会を開催した中で指摘してきた事項を再評価し 製薬企業にとっても 医師 薬剤師等にとっても 効率の良い情報源とすることを考えた そこで今般 IF 記載要領の一部改訂を行い IF 記載要領 2013 として公表する運びとなった 2.IF とは IF は 添付文書等の情報を補完し 薬剤師等の医療従事者にとって日常業務に必要な 医薬品の品質管理のための情報 処方設計のための情報 調剤のための情報 医薬品の適正使用のための情報 薬学的な患者ケアのための情報等が集約された総合的な個別の医薬品解説書として 日病薬が記載要領を策定し 薬剤師等のために当該医薬品の製薬企業に作成及び提供を依頼している学術資料 と位置付けられる ただし 薬事法 製薬企業機密等に関わるもの 製薬企業の製剤努力を無効にするもの及び薬剤師自らが評価 判断 提供すべき事項等は IF の記載事項とはならない 言い換えると 製薬企業から提供された IF は 薬剤師自らが評価 判断 臨床適応するとともに 必要な補完をするものという認識を持つことを前提としている [IF の様式 ] 1 規格は A4 版 横書きとし 原則として 9 ポイント以上の字体 ( 図表は除く ) で記載し 一色刷りとする ただし 添付文書で赤枠 赤字を用いた場合には 電子媒体ではこれに従うものとする 2IF 記載要領に基づき作成し 各項目名はゴシック体で記載する 3 表紙の記載は統一し 表紙に続けて日病薬作成の IF 利用の手引きの概要 の全文を記載するものとし 2 頁にまとめる
3 [IF の作成 ] 1IF は原則として製剤の投与経路別 ( 内用剤 注射剤 外用剤 ) に作成される 2IF に記載する項目及び配列は日病薬が策定した IF 記載要領に準拠する 3 添付文書の内容を補完するとの IF の主旨に沿って必要な情報が記載される 4 製薬企業の機密等に関するもの 製薬企業の製剤努力を無効にするもの及び薬剤師をはじめ医療従事者自らが評価 判断 提供すべき事項については記載されない 5 医薬品インタビューフォーム記載要領 2013 ( 以下 IF 記載要領 2013 と略す ) により作成された IF は 電子媒体での提供を基本とし 必要に応じて薬剤師が電子媒体 (PDF) から印刷して使用する 企業での製本は必須ではない [IF の発行 ] 1 IF 記載要領 2013 は 平成 25 年 10 月以降に承認された新医薬品から適用となる 2 上記以外の医薬品については IF 記載要領 2013 による作成 提供は強制されるものではない 3 使用上の注意の改訂 再審査結果又は再評価結果 ( 臨床再評価 ) が公表された時点並びに適応症の拡大等がなされ 記載すべき内容が大きく変わった場合には IF が改訂される 3.IF の利用にあたって IF 記載要領 2013 においては PDF ファイルによる電子媒体での提供を基本としている 情報を利用する薬剤師は 電子媒体から印刷して利用することが原則である 電子媒体の IF については 医薬品医療機器総合機構の医薬品医療機器情報提供ホームページに掲載場所が設定されている 製薬企業は 医薬品インタビューフォーム作成の手引き に従って作成 提供するが IF の原点を踏まえ 医療現場に不足している情報や IF 作成時に記載し難い情報等については製薬企業の MR 等へのインタビューにより薬剤師等自らが内容を充実させ IF の利用性を高める必要がある また 随時改訂される使用上の注意等に関する事項に関しては IF が改訂されるまでの間は 当該医薬品の製薬企業が提供する添付文書やお知らせ文書等 あるいは医薬品医療機器情報配信サービス等により薬剤師等自らが整備するとともに IF の使用にあたっては 最新の添付文書を医薬品医療機器情報提供ホームページで確認する なお 適正使用や安全性の確保の点から記載されている 臨床成績 や 主な外国での発売状況 に関する項目等は承認事項に関わることがあり その取扱いには十分留意すべきである 4. 利用に際しての留意点 IF を薬剤師等の日常業務において欠かすことができない医薬品情報源として活用して頂きたい しかし 薬事法や医療用医薬品プロモーションコード等による規制により 製薬企業が医薬品情報として提供できる範囲には自ずと限界がある IF は日病薬の記載要領を受けて 当該医薬品の製薬企業が作成 提供するものであることから 記載 表現には制約を受けざるを得ないことを認識しておかなければならない また製薬企業は IF があくまでも添付文書を補完する情報資材であり インターネットでの公開等も踏まえ 薬事法上の広告規制に抵触しないよう留意し作成されていることを理解して情報を活用する必要がある (2013 年 4 月改訂 )
4 目次 Ⅰ. 概要に関する項目 1 1. 開発の経緯 1 2. 製品の治療学的 製剤学的特性 2 Ⅱ. 名称に関する項目 3 1. 販売名 3 2. 一般名 3 3. 構造式又は示性式 3 4. 分子式及び分子量 3 5. 化学名 ( 命名法 ) 3 6. 慣用名 別名 略号 記号番号 4 7.CAS 登録番号 4 Ⅲ. 有効成分に関する項目 5 1. 物理化学的性質 5 2. 有効成分の各種条件下における安定性 6 3. 有効成分の確認試験法 6 4. 有効成分の定量法 6 Ⅳ. 製剤に関する項目 7 1. 剤形 7 2. 製剤の組成 7 3. 懸濁剤 乳剤の分散性に対する注意 8 4. 製剤の各種条件下における安定性 8 5. 調製法及び溶解後の安定性 8 6. 他剤との配合変化 ( 物理化学的変化 ) 9 7. 溶出性 9 8. 生物学的試験法 9 9. 製剤中の有効成分の確認試験法 製剤中の有効成分の定量法 力価 混入する可能性のある夾雑物 注意が必要な容器 外観が特殊な容器に関する情報 その他 9 Ⅴ. 治療に関する項目 効能又は効果 用法及び用量 臨床成績 15 Ⅵ. 薬効薬理に関する項目 薬理学的に関連ある化合物又は化合物群 薬理作用 38 Ⅶ. 薬物動態に関する項目 血中濃度の推移 測定法 薬物速度論的パラメータ 吸収 分布 代謝 排泄 トランスポーターに関する情報 透析等による除去率 55 Ⅷ. 安全性 ( 使用上の注意等 ) に関する項目 警告内容とその理由 禁忌内容とその理由 ( 原則禁忌を含む ) 効能又は効果に関連する使用上の注意とその理由 用法及び用量に関連する使用上の注意とその理由 慎重投与内容とその理由 重要な基本的注意とその理由及び処置方法 相互作用 副作用 高齢者への投与 妊婦 産婦 授乳婦等への投与 小児等への投与 臨床検査結果に及ぼす影響 過量投与 適用上の注意 その他の注意 その他 75 Ⅸ. 非臨床試験に関する項目 薬理試験 毒性試験 77 Ⅹ. 管理的事項に関する項目 規制区分 有効期間又は使用期限 貯法 保存条件 薬剤取扱い上の注意点 承認条件等 包装 容器の材質 同一成分 同効薬 国際誕生年月日 製造販売承認年月日及び承認番号 薬価基準収載年月日 効能又は効果追加 用法及び用量変更追加等の年月日及びその内容 再審査結果 再評価結果公表年月日及びその内容 再審査期間 投薬期間制限医薬品に関する情報 各種コード 保険給付上の注意 86 ⅩⅠ. 文献 引用文献 その他の参考文献 89 ⅩⅡ. 参考資料 主な外国での発売状況 海外における臨床支援情報 95 ⅩⅢ. 備考 97 その他の関連資料 97
5 Ⅰ. 概要に関する項目 Ⅰ. 概要に関する項目 1. 開発の経緯エソメプラゾールは AstraZeneca が開発した ラセミ体であるオメプラゾールの一方の光学異性体 (S 体 ) を含有するプロトンポンプインヒビター (PPI) である エソメプラゾールは 既存のオメプラゾールと比べて薬物動態及び薬力学作用の個体間変動が小さく オメプラゾール以上の臨床効果を発揮する薬剤を目指して開発された 2000 年 3 月 10 日にスウェーデンで胃食道逆流症を初めとする胃酸関連疾患の効能 効果で承認されて以降 2017 年 3 月現在 世界 125 カ国以上で承認 販売されている また 2006 年 10 月 20 日に米国でエソメプラゾールの懸濁用顆粒剤が承認されて以降 2017 年 3 月現在 世界 75 カ国以上で小児への効能 効果を取得している エソメプラゾール及びオメプラゾールの臨床効果は胃酸分泌抑制に起因することが確認されているため エソメプラゾールの胃酸分泌抑制効果がオメプラゾールと同程度であれば 両剤の臨床効果も同程度であると推測される そこで 本邦ではオメプラゾールを対照とした薬力学試験及び胃酸関連疾患の代表的疾患である逆流性食道炎治療におけるオメプラゾールとの非劣性試験を実施し エソメプラゾールの臨床効果について同用量のオメプラゾールに対する非劣性を確認するとともに 安全性においてオメプラゾールと同程度であることを確認した その結果 既承認のオメプラゾールが有する逆流性食道炎以外の効能 効果については新たな臨床試験を実施せず オメプラゾールと同じ用法 用量で 2011 年 7 月 逆流性食道炎 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 非びらん性胃食道逆流症 Zollinger-Ellison 症候群及びヘリコバクター ピロリの除菌の補助 ( 胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ) の承認を得るに至った また 同時に 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 が胃潰瘍又は十二指腸潰瘍の既往歴を有する非ステロイド性抗炎症薬継続投与患者を対象とした国内第 Ⅲ 相臨床試験の結果に基づき 効能 効果として承認された 2012 年 6 月 アジア共同第 Ⅲ 相比較試験成績に基づき 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 の効能 効果が追加承認された 2013 年 2 月 ヘリコバクター ピロリ感染胃炎におけるヘリコバクター ピロリの除菌の補助 の効能 効果が追加承認された また 2018 年 1 月 日本人小児患者を対象とした第 Ⅰ/Ⅲ 相臨床試験の成績に基づき 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 非びらん性胃食道逆流症 Zollinger-Ellison 症候群 における 1 歳以上の幼児及び小児の用法 用量が追加承認された 1
6 Ⅰ. 概要に関する項目 2. 製品の治療学的 製剤学的特性 優れた酸分泌抑制効果 ( Ⅵ.2.(2) 薬効を裏付ける試験成績 参照 ) 成人に対する速やかな症状持続消失効果 ( 逆流性食道炎 ) ( Ⅴ.3.(5) 検証的試験 参照 ) 成人に対する優れた内視鏡的治癒効果 ( 逆流性食道炎 ) ( Ⅴ.3.(5) 検証的試験 参照 ) 幼児及び小児に対する上部消化器症状持続消失効果 ( Ⅴ.3.(5) 検証的試験 参照 ) 副作用 ( Ⅷ.8. 副作用 参照 ) 成人 - 逆流性食道炎 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制総症例数 756 例中 87 例 ( 11.5%) の副作用が報告されている 主な副作用は 下痢 7 例 ( 0.93% ) CK(CPK) 上昇 7 例 (0.93%) 肝機能異常 5 例 (0.66%) ALT(GPT) 上昇 4 例 (0.53%) 等であった ( カプセル剤の承認時 ) - 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 非びらん性胃食道逆流症 Zollinger-Ellison 症候群ならびに胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎におけるヘリコバクター ピロリの除菌の補助国内において臨床試験等の副作用発現頻度が明確となる試験を実施していない ( カプセル剤の承認時 ) - 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制アジア共同第 Ⅲ 相比較試験 ( 日本人患者を含む ) で総症例数 214 例中 31 例 (14.5%) の副作用が報告されている 主な副作用は 下痢 2 例 (0.9%) びらん性胃炎 2 例 (0.9%) 腹部膨満 2 例 (0.9%) 胃ポリープ 2 例 (0.9%) 貧血 2 例 (0.9%) 等であった ( カプセル剤の効能 効果追加承認時 ) 幼児及び小児 - 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 非びらん性胃食道逆流症 Zollinger-Ellison 症候群国内で実施された臨床試験で総症例数 50 例中 2 例 (4.0%) の副作用が報告されている その内訳は 下痢及び腹痛 光線過敏性反応各 1 例 (2.0%) であった ( 小児に対する用法 用量追加承認時 ) 重大な副作用( 共通 ) - 重大な副作用として ショック アナフィラキシー 汎血球減少症 無顆粒球症 血小板減少 劇症肝炎 肝機能障害 黄疸 肝不全 中毒性表皮壊死融解症 (Toxic Epidermal Necrolysis: TEN) 皮膚粘膜眼症候群(Stevens-Johnson 症候群 ) 間質性肺炎 間質性腎炎 横紋筋融解症 低ナトリウム血症 錯乱状態が報告されている また 類薬 ( オメプラゾール ) の重大な副作用として 溶血性貧血 視力障害 急性腎障害が報告されている 2
7 Ⅱ. 名称に関する項目 Ⅱ. 名称に関する項目 1. 販売名 (1) 和名ネキシウム カプセル 10mg ネキシウム カプセル 20mg (2) 洋名 Nexium Capsules 10mg Nexium Capsules 20mg (3) 名称の由来 Next Millennium に由来する 2. 一般名 (1) 和名 ( 命名法 ) エソメプラゾールマグネシウム水和物 (JAN) (2) 洋名 ( 命名法 ) Esomeprazole Magnesium Hydrate(JAN) esomeprazole(inn) (3) ステム ベンズイミダゾール誘導体の抗潰瘍剤 :-prazole 3. 構造式又は示性式 4. 分子式及び分子量 分子式 :C34H36N6O6S2Mg 3H2O 分子量 : 化学名 ( 命名法 ) Bis{5-methoxy-2-[(S)-(4-methoxy-3,5-dimethylpyridin-2-yl)methanesulfinyl]-1H-benzimidazol- 1-yl}monomagnesium trihydrate 3
8 Ⅱ. 名称に関する項目 6. 慣用名 別名 略号 記号番号 H199/18 マグネシウム三水和物 H199/18 マグネシウム D961H 7.CAS 登録番号
9 Ⅲ. 有効成分に関する項目 Ⅲ. 有効成分に関する項目 1. 物理化学的性質 (1) 外観 性状性状 : エソメプラゾールマグネシウム水和物は白色 ~ごくうすい灰色又はごくうすい黄色の粉末である (2) 溶解性 溶媒 エソメプラゾールマグネシウム水和物 1g を溶解するのに要する溶媒量 (ml) 日本薬局方の溶解性の表現 メタノール 70mL やや溶けにくい エタノール 170mL 溶けにくい 水 700mL 溶けにくい (3) 吸湿性 90%RH で水蒸気吸着を測定した結果 ロット間で 0.3~3% の変動はあるが 本薬に吸湿性は認められなかった (4) 融点 ( 分解点 ) 沸点 凝固点融点 : 約 170 (5) 酸塩基解離定数 pka=8.8( ベンズイミダゾール ) pka= 約 4( ピリジニウムイオン ) (6) 分配係数オメプラゾールの n-オクタノールと水の分配係数は 2.24 であった (7) その他の主な示性値 1) 比旋光度 [ α] 20 D = (1% メタノール溶液 ) 2) 紫外吸収スペクトル 溶媒極大吸収の波長分子吸光係数 メタノール溶液 302nm M -1 cm -1 5
10 Ⅲ. 有効成分に関する項目 2. 有効成分の各種条件下における安定性 試験項目 : 類縁物質 溶状 ( 吸光度 ) 定量法 保存条件保存期間保存形態結果 長期保存試験 25 C/60%RH 36 カ月 二重のポリエチレン 袋及びアルミニウム ラミネート袋 類縁物質のわずかな増加が認められたが 規格に適合していた 加速試験 40 C/75%RH 6 カ月 二重のポリエチレン 袋及びアルミニウム ラミネート袋 類縁物質のわずかな増加が認められたが 規格に適合していた 苛酷試験 温度 / 湿度 25 C/60%RH 48 カ月 HDPE ボトル 開放類縁物質のわずかな増加が認め られたが 規格に適合していた 30 C/60%RH 12 カ月 HDPE ボトル 開放類縁物質のわずかな増加が認め られたが 規格に適合していた 40 C/75%RH 12 カ月 HDPE ボトル 開放類縁物質及び確認試験溶状 ( 吸 光度 ) の増加が認められた 温度 50 C 12 カ月 HDPE ボトル 開放類縁物質及び確認試験溶状 ( 吸 光度 ) の増加が認められた 光 1) 曝光 2) - 無包装 類縁物質の増加及び含量の低下 が認められた 1) 類縁物質 定量のみを実施 2) 総照度として 330 万 lx hr 及び総近紫外放射エネルギーとして 250W h/m 2 HDPE: 高密度ポリエチレン 3. 有効成分の確認試験法 日局赤外吸収スペクトル測定法 ( 参照スペクトルに一致 ) 4. 有効成分の定量法 日局液体クロマトグラフィー 6
11 Ⅳ. 製剤に関する項目 Ⅳ. 製剤に関する項目 1. 剤形 (1) 剤形の区別 外観及び性状 販売名ネキシウムカプセル 10mg ネキシウムカプセル 20mg 剤形 色調灰紫色 ( キャップ ) うすい黄色 ( ボディ ) 外形 カプセル剤内容物 : 白色 ~ ごくうすい黄色の腸溶性顆粒である また 褐色の腸溶性顆粒を認めることがある 濃い青色 ( キャップ ) ごくうすい黄赤 ( ボディ ) 5 号カプセル 5 号カプセル カプセル周囲に AZ ネキシウム 10 の記載あり カプセル周囲に AZ ネキシウム 20 の記載あり 長径 (mm) 短径 (mm) 識別コード AZ ネキシウム 10 AZ ネキシウム 20 (2) 製剤の物性 該当資料なし (3) 識別コード 上記 Ⅳ.1.(1) 剤形の区別 外観及び性状 参照 (4)pH 浸透圧比 粘度 比重 無菌の旨及び安定な ph 域等 該当しない 2. 製剤の組成 (1) 有効成分 ( 活性成分 ) の含量 販売名ネキシウムカプセル 10mg ネキシウムカプセル 20mg 有効成分 (1 カプセル中 ) エソメプラゾール 10mg ( エソメプラゾールマグネシウム水和物として 11.1mg) エソメプラゾール 20mg ( エソメプラゾールマグネシウム水和物として 22.3mg) 7
12 Ⅳ. 製剤に関する項目 (2) 添加物 販売名ネキシウムカプセル 10mg ネキシウムカプセル 20mg 添加物 モノステアリン酸グリセリン ヒドロキモノステアリン酸グリセリン ヒドロキシプロピルセルロース ヒプロメローシプロピルセルロース ヒプロメロース ステアリン酸マグネシウム メタクス ステアリン酸マグネシウム メタクリル酸コポリマー LD ポリソルベートリル酸コポリマー LD ポリソルベート 80 白糖 デンプン球状顆粒 タルク 80 白糖 デンプン球状顆粒 タルク クエン酸トリエチルクエン酸トリエチル 青色 1 号 赤色 102 号 (3) その他 該当しない 3. 懸濁剤 乳剤の分散性に対する注意 該当しない 4. 製剤の各種条件下における安定性 試験項目 : 外観 類縁物質 溶出性 エナンチオマー ( 長期保存試験及び苛酷試験 - 光のみで実施 ) 微生物限度試験 ( 長期保存試験のみで実施 ) 定量法 保存条件保存期間保存形態結果 長期保存試験 25 C/60%RH 36 カ月 PTP 包装 類縁物質のわずかな増加が認め られたが 規格に適合していた 36 カ月 瓶包装 試験項目に経時変化は認められ ず 規格に適合していた 加速試験 40 C/75%RH 3 カ月 PTP 包装 類縁物質の増加 溶出性の低下及 び含量の低下が認められた 6 カ月 瓶包装 類縁物質のわずかな増加が認め られたが 規格に適合していた 中間試験 30 C/65%RH 12 カ月 PTP 包装 類縁物質のわずかな増加が認め られたが 規格に適合していた 苛酷試験 温度 / 湿度 30 C/75%RH 2 カ月 無包装 類縁物質のわずかな増加が認め られたが 規格に適合していた 光 曝光 1) 無包装 試験項目に経時変化は認められ ず 規格に適合していた 1) 総照度として 120 万 lx hr 及び総近紫外放射エネルギーとして 200W h/m 2 5. 調製法及び溶解後の安定性 該当しない 8
13 Ⅳ. 製剤に関する項目 6. 他剤との配合変化 ( 物理化学的変化 ) 該当資料なし 7. 溶出性試験液に 0.1mol/L 塩酸溶液 300mL を用い 日局溶出試験法パドル法により毎分 100 回転で 2 時間攪拌後 0.086mol/L リン酸水素二ナトリウム溶液 700mL を加えて試験を行うとき 30 分後の Q 値は 75% である 8. 生物学的試験法 該当しない 9. 製剤中の有効成分の確認試験法 日局液体クロマトグラフィー ( 保持時間 ) 10. 製剤中の有効成分の定量法 近赤外スペクトル測定法あるいは日局液体クロマトグラフィー 11. 力価 該当しない 12. 混入する可能性のある夾雑物 H 153/73 O N O S N O N H O H 168/66 O N O S O N N H O 13. 注意が必要な容器 外観が特殊な容器に関する情報 該当しない 14. その他 特になし 9
14 Ⅴ. 治療に関する項目 Ⅴ. 治療に関する項目 1. 効能又は効果 (1) 効能 効果 <ネキシウムカプセル 10mg> 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 非びらん性胃食道逆流症 Zollinger-Ellison 症候群 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 下記におけるヘリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 <ネキシウムカプセル 20mg> 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 Zollinger-Ellison 症候群 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 下記におけるヘリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 (2) 効能 効果に関連する使用上の注意 1. 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制の場合関節リウマチ 変形性関節症等における疼痛管理等のために非ステロイド性抗炎症薬を長期継続投与している患者を投与対象とし 投与開始に際しては 胃潰瘍又は十二指腸潰瘍の既往を確認すること 本剤の投与対象は 慢性疾患による疼痛に対し非ステロイド性抗炎症薬の継続投与を必要とし 胃潰瘍又は十二指腸潰瘍の既往を有している患者である 2. 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制の場合血栓 塞栓の形成抑制のために低用量のアスピリンを継続投与している患者を投与対象とし 投与開始に際しては 胃潰瘍又は十二指腸潰瘍の既往を確認すること 本剤の投与対象は 血栓 塞栓の形成抑制のために低用量のアスピリンの継続投与を必要とし 胃潰瘍又は十二指腸潰瘍の既往を有している患者である 10
15 Ⅴ. 治療に関する項目 3. ヘリコバクター ピロリの除菌の補助の場合 (1) 進行期胃 MALT リンパ腫に対するヘリコバクター ピロリ除菌治療の有効性は確立していない ヘリコバクター ピロリ除菌療法の適応となる胃 MALT リンパ腫は 限局期 (Lugano 国際会議分類の stage I もしくは II1) の症例であり 進行期症例におけるヘリコバクター ピロリ除菌療法の有効性は確立されていないことから 記載している なお ヘリコバクター ピロリ除菌治療抵抗例が報告されていることや 除菌療法による長期間の寛解維持については有効性が不明確であるため ヘリコバクター ピロリ除菌治療後も経過観察を十分に行い 必要に応じて適切な追加治療を行うこと (2) 特発性血小板減少性紫斑病に対しては ガイドライン等を参照し ヘリコバクター ピロリ除菌治療が適切と判断される症例にのみ除菌治療を行うこと ヘリコバクター ピロリ除菌治療の対象が 原則として 18 歳以上の慢性特発性血小板減少性紫斑病 (ITP) 症例であること 及び重篤な出血のリスクが予測される場合には ヘリコバクター ピロリ除菌治療よりも対症療法が優先されることから ガイドライン等を参照し ヘリコバクター ピロリ除菌治療が適切と判断される症例にのみ除菌治療が行われるよう 記載している なお ITP の治療にあたっては 厚生労働省難治性疾患克服研究事業 血液凝固異常症に関する調査研究班 による 成人 ITP 治療ガイドライン (2004 年度 ) * を参照のこと このガイドラインでは ヘリコバクター ピロリ除菌治療の対象を原則として 18 歳以上の血小板数が 1 万 /μl を超える慢性 ITP 症例としており 除菌療法の副作用 ( 皮疹 消化器症状 出血傾向の悪化等 ) に注意し 除菌療法を行うことが望ましいとされている * 藤村欣吾ら : 厚生労働科学研究費補助金難治性疾患克服研究事業平成 16 年度総括 分担研究報告書血液 凝固異常症に関する調査研究 ( 班長池田康夫 ), 2005;
16 Ⅴ. 治療に関する項目 (3) 早期胃癌に対する内視鏡的治療後胃以外には ヘリコバクター ピロリ除菌治療による胃癌の発症抑制に対する有効性は確立していない 胃癌の抑制効果が検証されているのは 早期胃癌に対する内視鏡的治療後胃のみであることから記載している なお ヘリコバクター ピロリ除菌療法が行われた症例は限定されており 長期的な予後についての情報は不明であることから ヘリコバクター ピロリ除菌治療後も内視鏡検査等による定期的な観察を行うこと (4) ヘリコバクター ピロリ感染胃炎に用いる際には ヘリコバクター ピロリが陽性であること及び内視鏡検査によりヘリコバクター ピロリ感染胃炎であることを確認すること 本剤を適正に使用するために ヘリコバクター ピロリが陽性であること及び内視鏡によるヘリコバクター ピロリ感染胃炎の確認が必要であることから記載している ヘリコバクター ピロリ感染胃炎の確認に際しては 患者ごとに 1) 及び 2) の両方を実施する必要がある 1) ヘリコバクター ピロリの感染を以下のいずれかの方法で確認する 迅速ウレアーゼ試験 鏡検法 培養法 抗体測定 尿素呼気試験 糞便中抗原測定 2) 胃内視鏡検査により 慢性胃炎の所見があることを確認する なお 感染診断及び除菌判定の詳細については 各種ガイドライン等を参照すること 12
17 Ⅴ. 治療に関する項目 2. 用法及び用量 (1) 用法 用量 <ネキシウムカプセル 10mg> 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger-Ellison 症候群成人通常 成人にはエソメプラゾールとして 1 回 20mg を 1 日 1 回経口投与する なお 通常 胃潰瘍 吻合部潰瘍では 8 週間まで 十二指腸潰瘍では 6 週間までの投与とする 小児通常 1 歳以上の幼児及び小児にはエソメプラゾールとして 体重 20kg 未満では 1 回 10mg を 体重 20kg 以上では症状に応じて 1 回 10~20mg を 1 日 1 回経口投与する なお 通常 胃潰瘍 吻合部潰瘍では 8 週間まで 十二指腸潰瘍では 6 週間までの投与とする 逆流性食道炎成人通常 成人にはエソメプラゾールとして 1 回 20mg を 1 日 1 回経口投与する なお 通常 8 週間までの投与とする さらに再発 再燃を繰り返す逆流性食道炎の維持療法においては 1 回 10~20mg を 1 日 1 回経口投与する 小児通常 1 歳以上の幼児及び小児にはエソメプラゾールとして 体重 20kg 未満では 1 回 10mg を 体重 20kg 以上では症状に応じて 1 回 10~20mg を 1 日 1 回経口投与する なお 通常 8 週間までの投与とする 非びらん性胃食道逆流症成人通常 成人にはエソメプラゾールとして 1 回 10mg を 1 日 1 回経口投与する なお 通常 4 週間までの投与とする 小児通常 1 歳以上の幼児及び小児にはエソメプラゾールとして 1 回 10mg を 1 日 1 回経口投与する なお 通常 4 週間までの投与とする 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制通常 成人にはエソメプラゾールとして 1 回 20mg を 1 日 1 回経口投与する 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制通常 成人にはエソメプラゾールとして 1 回 20mg を 1 日 1 回経口投与する ヘリコバクター ピロリの除菌の補助通常 成人にはエソメプラゾールとして 1 回 20mg アモキシシリン水和物として 1 回 750mg ( 力価 ) 及びクラリスロマイシンとして 1 回 200mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する なお クラリスロマイシンは 必要に応じて適宜増量することができる ただし 1 回 400mg( 力価 )1 日 2 回を上限とする 13
18 Ⅴ. 治療に関する項目 プロトンポンプインヒビター アモキシシリン水和物及びクラリスロマイシンの 3 剤投与によるヘリコバクター ピロリの除菌治療が不成功の場合は これに代わる治療として 通常 成人にはエソメプラゾールとして 1 回 20mg アモキシシリン水和物として 1 回 750mg( 力価 ) 及びメトロニダゾールとして 1 回 250mg の 3 剤を同時に 1 日 2 回 7 日間経口投与する <ネキシウムカプセル 20mg> 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger-Ellison 症候群成人通常 成人にはエソメプラゾールとして 1 回 20mg を 1 日 1 回経口投与する なお 通常 胃潰瘍 吻合部潰瘍では 8 週間まで 十二指腸潰瘍では 6 週間までの投与とする 小児通常 体重 20kg 以上の幼児及び小児にはエソメプラゾールとして 症状に応じて 1 回 10~ 20mg を 1 日 1 回経口投与する なお 通常 胃潰瘍 吻合部潰瘍では 8 週間まで 十二指腸潰瘍では 6 週間までの投与とする 逆流性食道炎成人通常 成人にはエソメプラゾールとして 1 回 20mg を 1 日 1 回経口投与する なお 通常 8 週間までの投与とする さらに再発 再燃を繰り返す逆流性食道炎の維持療法においては 1 回 10~20mg を 1 日 1 回経口投与する 小児通常 体重 20kg 以上の幼児及び小児にはエソメプラゾールとして 症状に応じて 1 回 10~ 20mg を 1 日 1 回経口投与する なお 通常 8 週間までの投与とする 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制通常 成人にはエソメプラゾールとして 1 回 20mg を 1 日 1 回経口投与する 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制通常 成人にはエソメプラゾールとして 1 回 20mg を 1 日 1 回経口投与する ヘリコバクター ピロリの除菌の補助通常 成人にはエソメプラゾールとして 1 回 20mg アモキシシリン水和物として 1 回 750mg ( 力価 ) 及びクラリスロマイシンとして 1 回 200mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する なお クラリスロマイシンは 必要に応じて適宜増量することができる ただし 1 回 400mg( 力価 )1 日 2 回を上限とする プロトンポンプインヒビター アモキシシリン水和物及びクラリスロマイシンの 3 剤投与によるヘリコバクター ピロリの除菌治療が不成功の場合は これに代わる治療として 通常 成人にはエソメプラゾールとして 1 回 20mg アモキシシリン水和物として 1 回 750mg( 力価 ) 及びメトロニダゾールとして 1 回 250mg の 3 剤を同時に 1 日 2 回 7 日間経口投与する 14
19 Ⅴ. 治療に関する項目 3. 臨床成績 (1) 臨床データパッケージ注 ) 成人 申請時評価資料 試験区分試験デザイン目的投与方法対象 第 Ⅰ 相 二重盲検 無作為 薬物動態 ( 日本及びスウェーデン ) 化 プラセボ対照 安全性用量漸増 (SH-QBE-0094 試 験 ) 1 ) 第 Ⅰ 相 ( 日本 ) 第 Ⅰ 相 ( スイス ) 第 Ⅰ 相 ( 日本 ) 第 Ⅰ 相 ( 日本 ) 第 Ⅲ 相 ( 日本 ) 二重盲検 無作為薬物動態化 プラセボ対照 薬力学用量漸増安全性 (SH-QBE-0098 試験 ) 2 ) 単盲検 無作為化 並行群間 プラセボ対照 (SH-QBE-0095 試験 ) 3 ) 単盲検 無作為化 3 期クロスオーバー (D961HC00004 試験 ) 4 ) 単盲検 無作為化 2 期クロスオーバー (D961HC00009 試験 ) 4 ) 薬物動態薬力学安全性 薬力学 ( 胃内 ph) 薬物動態 薬力学 ( 胃内 ph) 薬物動態 多施設共同 二重盲逆流性食道炎検 無作為化 3 群 ( 初期治療 ) に並行群間 ダブルダ対する有効性ミー (D961HC00002 試験 ) 5 ) 注 ) 承認外の用法 用量を含む ( Ⅴ.2. 用法及び用量 参照 ) エソメプラゾール mg 注 ) 又はプラセボを 1 日 1 回単回経口投与 エソメプラゾール mg 注 ) 又はプラセボを 1 日 1 回反復経口投与 (5 日間 ) エソメプラゾール mg 注 ) 又はプラセボを 1 日 1 回反復経口投与 (5 日間 ) エソメプラゾール 20 注 40mg ) プラセボ又はオメプラゾール 20mg を 1 日 1 回反復経口投与 (5 日間 ) エソメプラゾール 10mg オメプラゾール 10mg 又はプラセボを 1 日 1 回反復経口投与 (5 日間 ) 日本人健康成人男性 32 例 homo EM:12 hetero EM:12 PM:8 白人健康成人男性 26 例 homo EM:12 hetero EM:10 PM:4 日本人健康成人男性 90 例 homo EM:30 hetero EM:30 PM:30 白人健康成人男性 64 例 homo EM:30 hetero EM:30 PM:4 日本人健康成人男性 42 例 homo EM:14 hetero EM:14 PM:14 日本人健康成人男性 42 例 homo EM:14 hetero EM:14 PM:14 エソメプラゾール 20 逆流性食道炎患者 572 例注 ) 40mg 又はオメプラゾー (LA 分類 A-D) ル 20mg を 1 日 1 回反復エソメプラゾール 20mg: 経口投与 (8 週間 ) 190 注エソメプラゾール 40mg ) : 191 オメプラゾール 20mg:
20 Ⅴ. 治療に関する項目 試験区分試験デザイン目的投与方法対象 第 Ⅲ 相 ( 日本 ) 第 Ⅲ 相 ( 日本 ) 長期投与 ( 日本 ) 第 Ⅰ 相 ( 日本 ) 第 Ⅰ 相 ( 日本 ) 多施設共同 二重盲逆流性食道炎検 無作為化 3 群 ( 維持療法 ) に並行群間 ダブルダ対する有効性ミー (D961HC00006 試験 ) 6 ) 多施設共同 二重盲検 無作為化 2 群並行群間 プラセボ対照 (D961HC00001 試験 ) 7 ) 多施設共同 オープン 単群 (D961HC00005 試験 ) 8 ) オープン 無作為化 3 期クロスオーバー (D961HC00007 試験 ) 9 ) オープン 無作為化 2 期クロスオーバー (D961HC00008 試験 ) 10 ) NSAID 潰瘍発症抑制に対する有効性 長期投与時の安全性 薬物動態 ( ロキソプロフェンナトリウムとの薬物相互作用 ) 生物学的同等性 エソメプラゾール 10 20mg 又はオメプラゾール 10mg を 1 日 1 回反復経口投与 (24 週間 ) エソメプラゾール 20mg 又はプラセボを 1 日 1 回反復経口投与 (24 週間 ) エソメプラゾール 20mg を 1 日 1 回反復経口投与 (52 週間 ) エソメプラゾール 20mg を 1 日 1 回反復経口投与又はロキソプロフェンナトリウム 60mg を 1 日 3 回反復経口投与 (5 日間 ) エソメプラゾール 40mg 注 ) ( ヒプロメロースカプセル又はゼラチンカプセル ) を 1 日 1 回反復経口投与 (5 日間 ) 逆流性食道炎治癒患者 564 例エソメプラゾール 20mg: 188 エソメプラゾール 10mg: 189 オメプラゾール 10mg: 187 胃又は十二指腸潰瘍の既往を有する NSAID 継続投与中の患者 343 例エソメプラゾール 20mg: 175 プラセボ :168 胃又は十二指腸潰瘍の既往を有する NSAID 継続投与中の患者 130 例エソメプラゾール 20mg: 130 日本人健康成人男性 30 例 homo EM:12 hetero EM:12 PM:6 日本人健康成人男性 48 例 homo EM:48 homo EM:homozygote extensive metaboliser hetero EM:heterozygote extensive metaboliser PM:Poor metaboliser LA 分類 : ロサンゼルス分類 NSAID: 非ステロイド性消炎鎮痛剤注 ) 承認外の用法 用量を含む ( Ⅴ.2. 用法及び用量 参照 ) 低用量アスピリン適応追加時評価資料 試験区分試験デザイン目的投与方法対象 第 Ⅲ 相 ( 日本 韓国 台湾 ) 無作為化 二重盲検 並行群間 多施設共同 (D961PC00001 試験 ) 11 ) LDA(Low dose Aspirin): 低用量アスピリン 胃又は十二指腸潰瘍の既往を有する LDA の継続投与を受ける患者に対してエソメプラゾール 20mg を継続投与したときの有効性 ( 胃又は十二指腸潰瘍の発症予防 ) エソメプラゾール 20mg 又はプラセボを 1 日 1 回反復経口投与 ( 最長 72 週間 ) 血栓 塞栓形成の抑制のために LDA の継続投与を受ける胃又は十二指腸潰瘍の既往を有する患者 366 例 16
21 Ⅴ. 治療に関する項目 幼児及び小児 評価資料 試験区分試験デザイン目的投与方法対象 第 Ⅰ/Ⅲ 相 ( 日本 ) 非盲検 並行群間 多施設共同 (D961TC00002 試験 ) 12 ) 小児患者におけるエソメプラゾール経口投与の安全性 忍容性 薬物動態 薬力学及び有効性 エソメプラゾール懸濁用顆粒剤 10mg エソメプラゾールカプセル 10mg 又は 20mg を 1 日 1 回反復経口投与 (8 週間 ) 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 非びらん性胃食道逆流症 逆流性食道炎又は Zollinger-Ellison 症候群を有する又は有する疑いのある 1~14 歳の小児患者 50 例 エソメプラゾール及びオメプラゾールの臨床効果は胃酸分泌抑制に起因する 国内における薬力学試験及び逆流性食道炎治療に対するエソメプラゾールとオメプラゾールの非劣性及び比較試験で エソメプラゾールの臨床効果は同用量のオメプラゾールと同程度もしくはそれ以上であり かつ安全性において問題が認められないことが確認されたため 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger-Ellison 症候群 非びらん性胃食道逆流症 及び胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃におけるヘリコバクター ピロリの除菌の補助 については新たな臨床試験を実施せず オメプラゾールと同じ用法 用量で承認を得た また 胃潰瘍又は十二指腸潰瘍の既往歴を有する非ステロイド性抗炎症薬継続投与患者を対象とした国内臨床試験の結果に基づき 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制も効能 効果として承認された 2012 年 6 月 胃潰瘍又は十二指腸潰瘍の既往歴を有する低用量アスピリン継続服用患者を対象としたアジア共同第 Ⅲ 相比較試験の結果に基づき 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制の効能 効果が追加承認された 2013 年 2 月 ヘリコバクター ピロリ感染胃炎に対するヘリコバクター ピロリ除菌療法の適応追加の要望書に基づき 適応外使用に係る医療用医薬品の取扱いについて ( 平成 11 年 2 月 1 日研第 4 号医薬審第 104 号厚生省健康政策局研究開発振興課長 厚生省医薬安全局審査管理課長通知 ) に則り 国内外の公表文献等を科学的根拠として 臨床試験を実施することなく 関連する製品を有する会社と共同申請を行い ヘリコバクター ピロリ感染胃炎に対するヘリコバクター ピロリ除菌療法の 効能 効果 は医学薬学上公知であるとして承認された また 2018 年 1 月 日本人小児患者を対象とした第 Ⅰ/Ⅲ 相臨床試験の成績に基づき 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 非びらん性胃食道逆流症 Zollinger-Ellison 症候群 における 1 歳以上の幼児及び小児の用法 用量が追加承認された 17
22 Ⅴ. 治療に関する項目 (2) 臨床効果成人 1) 逆流性食道炎 (D961HC00002 試験 D961HC00006 試験 ) 逆流性食道炎患者を対象とした二重盲検比較試験 ( 非劣性試験 ) では オメプラゾール 20mg エソメプラゾール 20mg 又は 40mg 注 ) が 1 日 1 回最大 8 週間投与され 投与 8 週時のそれぞれの治癒率 [95% 信頼区間 ] は 87.4%(166/190 例 )[ 81.9~91.4% ] 87.3%(165/189 例 )[ 81.8 ~91.3%] 及び 90.0%(171/190 例 )[ 84.9~93.5%] であり オメプラゾール 20mg に対する本剤 20mg 及び 40mg の非劣性が認められている 5 ) ( 木下芳一他 : 日本消化器病学会雑誌, 110(2), 234, 2013) 注 ) 承認外の用法 用量 ( Ⅴ.2. 用法及び用量 参照 ) また 逆流性食道炎の治癒患者を対象とした二重盲検比較試験において オメプラゾール 10mg と比較したエソメプラゾール 10mg 及び 20mg の 1 日 1 回 24 週間投与時における逆流性食道 炎の再発抑制効果が認められている 6 ) エソメプラゾール 20mg(188 例 ) エソメプラゾール 10mg(188 例 ) オメプラゾール 10mg(187 例 ) 再発例数 14 例 22 例 31 例 投与 24 週後の非再発率 a) [95% 信頼区間 ] 92.0% [88.0~96.0%] 87.5% [82.7~92.4%] 82.7% [77.2~88.3%] ハザード比 [95% 信頼区間 ] p 値 b) 0.62[0.32~1.21] ( エソメプラゾール 20mg 群 vs エソメプラゾール 10mg 群 ) 0.43[0.23~0.80] ( エソメプラゾール 20mg 群 vs オメプラゾール 10mg 群 ) p=0.158( エソメプラゾール 20mg 群 vs エソメプラゾール 10mg 群 ) p=0.007( エソメプラゾール 20mg 群 vs オメプラゾール 10mg 群 ) a)kaplan-meier 法による推定 b)log-rank 検定 有意水準両側 5% Hochberg の方法による検定の多重性の調整 Kaplan-Meier 法による逆流性食道炎の非再発率 ( 木下芳一他 : 日本消化器病学会雑誌, 110(8), 1428, 2013) 18
23 Ⅴ. 治療に関する項目 2) 非ステロイド性抗炎症薬 (NSAID) 投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 (D961HC00001 試験 D961HC00005 試験 ) 消化性潰瘍の既往を有する NSAID 継続服用患者を対象とした二重盲検比較試験において エ ソメプラゾール 20mg の 1 日 1 回 24 週間投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 効果が認められている 7 ) エソメプラゾール 20mg (173 例 ) プラセボ (168 例 ) 発症例数 6 例 56 例 投与 24 週後の非発症率 a) [95% 信頼区間 ] ハザード比 [95% 信頼区間 ] p 値 b) 96.0% [92.8~99.1%] 0.09[0.04~0.20] p<0.001 a)kaplan-meier 法による推定 b)log-rank 検定 有意水準両側 5% 64.4% [56.8~71.9%] Kaplan-Meier 法による胃潰瘍又は十二指腸潰瘍の非発症率 (Sugano, K., et al.:aliment. Pharmacol. Ther., 36(2), 115, 2012) また 消化性潰瘍の既往を有する NSAID 継続服用患者を対象としたエソメプラゾール 20mg の 1 日 1 回 52 週間投与時における胃潰瘍又は十二指腸潰瘍の非発症率は以下のとおりであ る 8 ) 投与群 52 週後非発症率 (Kaplan-Meier 法 ) エソメプラゾール 20mg 群 (130 例 ) 95.9% (Sugano, K., et al.:bmc Gastroenterol., 13, 54, 2013) 19
24 Ⅴ. 治療に関する項目 3) 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 (D961PC00001 試験 ) 消化性潰瘍の既往を有する低用量アスピリン (81~324mg) 継続服用患者を対象としたアジア共同第 Ⅲ 相比較試験 ( 日本人患者含む ) の中間解析における結果において エソメプラゾール 20mg の 1 日 1 回 48 週間投与時における胃潰瘍又は十二指腸潰瘍の再発抑制効果が認められている さらに 中間解析以降 本薬群の被験者のみ投与が継続され エソメプラゾール 20mg を 1 日 1 回最長 72 週間投与時において 投与 72 週後の非発症率は 96.4% であった なお 本試験においては本薬群 プラセボ群ともに全例ゲファルナートを併用していた 11 ) エソメプラゾール 20mg (182 例 ) プラセボ (182 例 ) 発症例数 2 例 22 例 投与 48 週後の非発症率 a) [96.65% 信頼区間 ] 98.3% [95.7~100%] ハザード比 [96.65% 信頼区間 ] 0.09[0.02~0.41] p 値 b) p<0.001 a)kaplan-meier 法による推定 b)log-rank 検定 有意水準両側 3.35% 81.2% [72.7~89.7%] Kaplan-Meier 法による胃潰瘍又は十二指腸潰瘍の非発症率 ( 中間解析における結果 ) (Sugano, K., et al.:gut, 63(7), 1061, 2014) 20
25 Ⅴ. 治療に関する項目 < 参考 > オメプラゾール 10mg 20mg の臨床効果 1) 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger-Ellison 症候群一般臨床試験の概要は次のとおりである また 二重盲検比較試験 ( 胃潰瘍 十二指腸潰瘍 ) において本剤の有用性が認められている 疾患名 有効率 治癒率 胃潰瘍 98.0%(388/396 例 ) 92.5%(359/388 例 ) 十二指腸潰瘍 98.3%(238/242 例 ) 95.7%(223/233 例 ) 吻合部潰瘍 100%(34/34 例 ) 97.1%(33/34 例 ) Zollinger-Ellison 症候群 100%(4/4 例 ) 100%(3/3 例 ) 有効率は 中等度改善以上 を集計 治癒率は 内視鏡判定 による 2) 非びらん性胃食道逆流症非びらん性胃食道逆流症を対象とした国内の臨床試験において オメプラゾール 10mg を 4 週間投与したときの投与 4 週時の胸やけ完全消失率及び十分な胸やけ改善率はそれぞれ 32.3% (31/96 例 ) 45.8%(44/96 例 ) であった 3) 胃潰瘍又は十二指腸潰瘍におけるヘリコバクター ピロリの除菌の補助 <オメプラゾール アモキシシリン水和物及びクラリスロマイシンの 3 剤投与 > 国内臨床試験除菌率各薬剤の 1 回投与量投与回数胃潰瘍十二指腸潰瘍合算 オメプラゾール 20mg アモキシシリン水和物 750mg( 力価 ) クラリスロマイシン 400mg( 力価 ) 2 回 / 日 75.9% (44/58 例 ) 81.8% (45/55 例 ) 78.8% (89/113 例 ) ( ) 内は除菌例数 / 評価例数感染診断 : 迅速ウレアーゼ試験及び培養検査で陽性と判定された場合 ヘリコバクター ピロリ陽性と判定 除菌判定 : 除菌療法後 6 週における培養検査 組織学的検査及び尿素呼気試験のすべての検査で陰性の場合 ヘリコバクター ピロリ陰性と判定 国内市販後臨床試験 各薬剤の 1 回投与量 オメプラゾール 20mg アモキシシリン水和物 750mg( 力価 ) クラリスロマイシン 200mg( 力価 ) オメプラゾール 20mg アモキシシリン水和物 750mg( 力価 ) クラリスロマイシン 400mg( 力価 ) 投与回数 2 回 / 日 2 回 / 日 除菌率 胃潰瘍 十二指腸潰瘍 合 算 86.3% (63/73 例 ) 77.1% (54/70 例 ) 75.7% (53/70 例 ) 82.7% (62/75 例 ) 81.1% (116/143 例 ) 80.0% (116/145 例 ) ( ) 内は除菌例数 / 評価例数感染診断 : 迅速ウレアーゼ試験及び培養検査で陽性と判定された場合 ヘリコバクター ピロリ陽性と判定 除菌判定 : 除菌療法後 6 週における培養検査 組織学的検査及び尿素呼気試験のすべての検査で陰性の場合 ヘリコバクター ピロリ陰性と判定 21
26 Ⅴ. 治療に関する項目 ヘリコバクター ピロリ感染胃炎におけるヘリコバクター ピロリ除菌の補助 国内 2 文献 ( 承認内の用法 用量 1 文献 承認外の用法 用量 1 文献 ) 海外 7 文献が評価さ れ承認を受けた ⅰ)Watanabe, H., et al. :J. Int. Med. Res., 31(5), 362, 2003 ⅱ)Kodama, M., et al. :J. Gastroenterol., 47(4), 394, 2012 ⅲ)Sung, JJ., et al. :Gastroenterology, 119(1), 7, 2000 ⅳ)Mazzoleni, LE., et al. :Dig. Dis. Sci., 51(1), 89, 2006 ⅴ)Vakil, N., et al. :Aliment. Pharmacol. Ther., 24(1), 55, 2006 ⅵ)Koskenpato, J., et al. :Scand. J. Gastroenterol., 37(7), 778, 2002 ⅶ)Ercin, CN., et al. :Anatol. J. Clin. Investig., 2(3), 118, 2008 ⅷ)Milutinovic, AS., et al. :Eur. J. Gastroenterol. Hepatol., 15(7), 755, 2003 ⅸ)van der Schaar, PJ., et al. :Dig. Dis. Sci., 46(9), 1833, 2001 幼児及び小児日本人小児患者における国内第 Ⅰ/Ⅲ 相臨床試験 (D961TC00002 試験 ) 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 非びらん性胃食道逆流症 逆流性食道炎 又は Zollinger-Ellison 症候群を有する又は有する疑いのある 1~14 歳の患者 50 例を対象とした非盲検試験では 体重 10kg 以上 20kg 未満 (10 例 [ 第 1 群 ]) にエソメプラゾール 1 回 10mg を 20kg 以上に 1 回 10mg(1~11 歳 10 例 [ 第 2 群 ] 12~14 歳 10 例 [ 第 4 群 ]) 又は 1 回 20mg (1~11 歳 10 例 [ 第 3 群 ] 12~14 歳 10 例 [ 第 5 群 ]) を 1 日 1 回最大 8 週間投与した 各投与群の上部消化器症状 ( 胸やけ 呑酸 心窩部痛 及び上腹部不快感 ) は 投与前に症状を有していた患者の 40% 以上の割合で消失した また 投与前に内視鏡的評価が実施できた患者のうち病理学的所見が認められた 3 例すべてにおいて投与後に所見が消失した 12 ) 投与群 ( 投与例数 ) 第 1 群 (10 例 ) 第 2 群 (10 例 ) 第 3 群 (10 例 ) 第 4 群 (10 例 ) 年齢 1 歳以上 1~11 歳 12~14 歳 体重 10kg 以上 20kg 未満 20kg 以上 第 5 群 (10 例 ) 投与量 10mg 10mg 20mg 10mg 20mg Kaplan-Meier 法による最終時点の累積持続消失率胸やけ 100%(2 例 ) 66.7%(3 例 ) 100%(1 例 ) 50%(2 例 ) 75%(4 例 ) 呑酸 75%(4 例 ) 100%(3 例 ) 80%(5 例 ) 50%(4 例 ) 100%(4 例 ) 心窩部痛 100%(2 例 ) 50%(6 例 ) 100%(6 例 ) 40%(5 例 ) 57.1%(7 例 ) 上腹部不快感 100%(3 例 ) 66.7%(6 例 ) 100%(4 例 ) 60%(5 例 ) 50%(6 例 ) () 投与前に症状を有していた例数 ( 社内資料 : 日本人小児患者における第 Ⅰ/Ⅲ 相試験,2016) 22
27 Ⅴ. 治療に関する項目 (3) 臨床薬理試験 1) 単回投与試験 (SH-QBE-0094 試験 ) 1) 注 ) 健康成人男性 32 例を対象に エソメプラゾール mg 又はプラセボを空腹時に単回経口投与した 重篤な有害事象例 有害事象による中止例の報告はなかった 全体的に忍容性に問題となる所見は無く また CYP2C19 遺伝子型の extensive metabolizer(em) poor metabolizer(pm) のいずれにおいても忍容性に問題となる所見は無かった ( 社内資料 : 日本人及び白人健康成人被験者における単回投与試験,2003) 注 ) 承認外の用法 用量 ( Ⅴ.2. 用法及び用量 参照 ) 2) 反復投与試験 (SH-QBE-0098 試験 ) 2) 注 ) 健康成人男性 90 例を対象に エソメプラゾール mg 又はプラセボを 1 日 1 回 5 日間反復経口投与した 重篤な有害事象例 有害事象による中止例の報告はなかった プラセボ群に比べてエソメプラゾール群で中等度の血清ガストリン増加がみられ エソメプラゾール注 20mg までは用量依存的だったが 40mg ) ではさらなる増加はみられなかった エソメプラゾールはおおむね忍容性に問題となる所見は無く 異なる遺伝子型であっても安全性は類似していた ( 社内資料 : 日本人健康成人被験者における反復投与試験,2004) 注 ) 承認外の用法 用量 ( Ⅴ.2. 用法及び用量 参照 ) (4) 探索的試験該当資料なし 23
28 Ⅴ. 治療に関する項目 (5) 検証的試験 1) 無作為化並行用量反応試験 該当資料なし 2) 比較試験 1 逆流性食道炎初期治療 [ 第 Ⅲ 相試験 (D961HC00002 試験 )] 5 ) 逆流性食道炎患者を対象とした無作為化二重盲検比較試験 ( 非劣性試験 ) において エソメプ注ラゾール 20mg 40mg ) を 1 日 1 回最大 8 週間投与したときのオメプラゾール 20mg1 日 1 回投与に対する非劣性が認められた 項目 内容 試験デザイン多施設共同 無作為化 二重盲検 並行群間比較試験 ( 非劣性試験 ) 試験対象 主要選択基準 主要除外基準 方法 主要評価項目 副次的評価項目 上部消化管内視鏡検査 (EGD) で確認された逆流性食道炎患者 572 例 無作為割付け前 1 週間以内に実施された EGD にて ロサンゼルス (LA) 分類のグレード A B C 又は D の逆流性食道炎と確定診断された患者 自己記入式疾患特異的 QOL 調査票 (QOLRAD) 及び患者日誌に回答可能な患者 同意取得時に 20 歳未満である男性及び女性 以下の消化管の疾患又は状態を有する あるいは有していた患者食道狭窄 原発性食道運動障害 ( びまん性食道痙攣 アカラジア ) 全身性硬化症 ( 強皮症 ) 過敏性腸症候群 炎症性腸疾患 Zollinger-Ellison 症候群 吸収不良症候群 重大もしくは病状の不安定な疾患又は状態を有する あるいは有していた患者 スクリーニング時の EGD 実施 14 日前から無作為割付け時までにプロトンポンプインヒビター (PPI) が投与された患者 EGD 所見によりバレット食道 ( バレット上皮 3cm 以上 ) が認められた患者又は顕著な食道の異形成のある患者 PPI へのアレルギーや過敏症等の治験薬の投与が禁忌である疾患 症状を有する患者 無作為に エソメプラゾール 20mg 群 エソメプラゾール 40mg 群注 ) オメプラゾール 20mg 群の 3 群に割り付け それぞれの薬剤を 1 日 1 回朝食後に最大 8 週間投与した LA 分類に基づく投与 8 週後の逆流性食道炎の有無 有効性 LA 分類に基づく投与 4 週後の逆流性食道炎の有無 胸やけ症状等の持続的な消失までの期間 ( 定義 : 治験薬投与開始日を基点として 当該症状が 7 日間連続して なし と判定されたときの最初の日までの日数 ) QOLRAD を用いた健康に関連した生活の質 (QOL) の評価等安全性 有害事象等 注 ) 承認外の用法 用量 ( Ⅴ.2. 用法及び用量 参照 ) 24
29 Ⅴ. 治療に関する項目 有効性投与 4 週後及び 8 週後の逆流性食道炎の治癒率を下表に示す エソメプラゾール 20mg 群及び 40mg 群注 ) とオメプラゾール 20mg 群との 8 週後治癒率の差の 95% 信頼区間の下限は -10% 以上であったことから エソメプラゾール 20mg 40mg 注 ) のオメプラゾール 20mg に対する非劣性が示された 結果 逆流性食道炎の治癒率 (FAS) エソメプラゾール 20mg 投与 4 週後 推定値 77.8% (147/189) エソメプラゾール 40mg 注 ) 74.2% (141/190) オメプラゾール 20mg 75.3% (143/190) 95% 信頼区間 71.3~83.1% 67.6~79.9% 68.7~80.9% 投与 8 週後 推定値 87.3% (165/189) 90.0% (171/190) 87.4% (166/190) 95% 信頼区間 81.8~91.3% 84.9~93.5% 81.9~91.4% FAS: 最大の解析対象集団 胸やけ症状の持続的な消失までの期間 ( 中央値 ) は エソメプラゾール 20mg 1.5 日 40mg 注 ) 1.0 日 オメプラゾール 20mg 2.0 日であった QOLRAD を用いて QOL を評価した結果 投与 4 週後において いずれの投与群においても 全ての領域 ( 感情 睡眠 飲食 身体 / 社会機能 活力 ) でスコアの改善が認められた 安全性副作用が報告された症例は エソメプラゾール 20mg 群 7.9%(189 例中 15 例 ) エソメプラゾール 40mg 群注 ) 4.2%(190 例中 8 例 ) オメプラゾール 20mg 群 8.4%(190 例中 16 例 ) であった 発現率が 1% 以上であった副作用は エソメプラゾール 20mg 群で下痢 血中クレアチンホスホキナーゼ増加 アラニン アミノトランスフェラーゼ増加 オメプラゾール 20mg 群で下痢 血中クレアチンホスホキナーゼ増加であった 重篤な副作用として オメプラゾール 20mg 群で胃腸炎が 1 例に認められた 投与中止に至った副作用はエソメプラゾール 40mg 群で 1 例 ( 発疹 ) 認められた 死亡例は報告されなかった ( 木下芳一他 : 日本消化器病学会雑誌, 110(2), 234, 2013) 注 ) 承認外の用法 用量 ( Ⅴ.2. 用法及び用量 参照 ) 25
30 Ⅴ. 治療に関する項目 2 逆流性食道炎維持療法 [ 第 Ⅲ 相試験 (D961HC00006 試験 )] 6 ) 逆流性食道炎の治癒患者を対象とした無作為化二重盲検比較試験において エソメプラゾール 20mg 10mg 及びオメプラゾール 10mg の 1 日 1 回 24 週間投与は高い再発抑制効果を示し エソメプラゾール 20mg1 日 1 回投与はオメプラゾール 10mg1 日 1 回投与に比べて有意に優れていることが認められた 項目試験デザイン試験対象主要選択基準主要除外基準方法主要評価項目副次的評価項目 内容 多施設共同 無作為化 二重盲検 並行群間比較試験 上部消化管内視鏡検査 (EGD) で逆流性食道炎の治癒が確認された患者 564 例 以下のいずれかに該当する患者 先行する試験 ( 逆流性食道炎初期治療の第 Ⅲ 相試験 ) において EGD にて逆流性食道炎の治癒が確認された患者 通常診療でプロトンポンプインヒビター (PPI) の投与を受け EGD にて逆流性食道炎の治癒が確認され 以下の基準をいずれも満たす患者 通常診療での PPI 投与前 2 週間以内の EGD の画像写真にて ロサンゼルス (LA) 分類のグレード A-D の逆流性食道炎に罹患していたことが確認できる PPI の投与期間が 12 週間以内である ただし 通常診療での PPI 最終投与後 1 週間以内に無作為割付けを行うこと 問診票に回答可能な患者 同意取得時に 20 歳未満である男性及び女性 以下の消化管の疾患又は状態を有する あるいは有していた患者食道狭窄 原発性食道運動障害 ( びまん性食道痙攣 アカラジア ) 全身性硬化症 ( 強皮症 ) 過敏性腸症候群 炎症性腸疾患 Zollinger-Ellison 症候群 吸収不良症候群 重大もしくは病状の不安定な疾患又は状態を有する あるいは有していた患者 EGD 所見によりバレット食道 ( バレット上皮 3cm 以上 ) が認められた患者又は顕著な食道の異形成のある患者 PPI へのアレルギーや過敏症等の治験薬の投与が禁忌である疾患 症状を有する患者 無作為に エソメプラゾール 20mg 群 エソメプラゾール 10mg 群 オメプラゾール 10mg 群の 3 群に割り付け それぞれの薬剤を 1 日 1 回朝食後に最大 24 週間投与した LA 分類に基づく薬剤投与期間を通じての逆流性食道炎再発の有無 有効性 LA 分類に基づく投与 4 及び 12 週後までの逆流性食道炎再発の有無 投与 及び 24 週後の各来院日前 7 日間の重症度評価に基づく胸やけ症状等の有無安全性 有害事象等 26
31 Ⅴ. 治療に関する項目 有効性 投与 24 週後の逆流性食道炎の非再発率は エソメプラゾール 20mg がオメプラゾール 10mg と比較して有意に高かった エソメプラゾール 20mg とエソメプラゾール 10mg の比較では 有意差は認められなかった 投与 4 週後及び 12 週後の逆流性食道炎の非再発率は 投与 24 週後と同様に エソメプラゾール 20mg が最も高く オメプラゾール 10mg が最も低かった 結果 Kaplan-Meier 法による逆流性食道炎の非再発率の推定値 (FAS) エソメプラゾール 20mg(188 例 ) エソメプラゾール 10mg(188 例 ) オメプラゾール 10mg(187 例 ) 投与 4 週後 推定値 97.8% 95.7% 91.4% 95% 信頼区間 95.7~99.9% 92.7~98.6% 87.3~95.4% 投与 12 週 推定値 95.0% 91.1% 86.8% 後 95% 信頼区間 91.8~98.2% 86.9~95.3% 81.9~91.8% 投与 24 週 推定値 92.0% 87.5% 82.7% 後 95% 信頼区間 88.0~96.0% 82.7~92.4% 77.2~88.3% ハザード比 0.62[0.32~1.21] [95% 信頼区間 ]( エソメプラゾール 20mg vs エソメプラゾール 10mg) 0.43[0.23~0.80] ( エソメプラゾール 20mg vs オメプラゾール 10mg) p 値 a) p=0.158 ( エソメプラゾール 20mg vs エソメプラゾール 10mg) p=0.007 ( エソメプラゾール 20mg vs オメプラゾール 10mg) a)log-rank 検定 有意水準両側 5% Hochberg の方法による検定の多重性の調整 投与前に胸やけ症状がなかった患者において 最終観察時に症状がみられた患者は エソメプラゾール 20mg 群 3.4%(5/146 例 ) エソメプラゾール 10mg 群 4.9%(8/164 例 ) オメプラゾール 10mg 群 4.9%(8/163 例 ) であった 安全性副作用が報告された症例は エソメプラゾール 20mg 群 10.8%(139 例中 15 例 ) エソメプラゾール 10mg 群 8.8%(125 例中 11 例 ) オメプラゾール 10mg 群 6.1%(147 例中 9 例 ) であった 発現率が 1% 以上であった副作用は 下痢 胃ポリープ 血中クレアチンホスホキナーゼ増加 便秘 アラニン アミノトランスフェラーゼ増加 高血圧であった 重篤な副作用として エソメプラゾール 20mg 群で頻脈性不整脈が 1 例に認められた 投与中止に至った副作用は エソメプラゾール 20mg 群で 4 例 ( 血中クレアチンホスホキナーゼ増加 腸炎 頻脈性不整脈 胃不快感 ) エソメプラゾール 10mg 群で 5 例 ( 肝酵素上昇 回転性めまい 肝機能異常 鼻出血 高血圧 ) 認められた 死亡例は報告されなかった ( 木下芳一他 : 日本消化器病学会雑誌, 110(8), 1428, 2013) 27
32 Ⅴ. 治療に関する項目 3 非ステロイド性抗炎症薬 (NSAID) 投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 [ 第 Ⅲ 相試験 (D961HC00001 試験 )] 7 ) 消化性潰瘍の既往を有する NSAID 継続服用患者を対象とした無作為化二重盲検比較試験において エソメプラゾール 20mg1 日 1 回 24 週間投与はプラセボと比較して胃又は十二指腸潰瘍の再発抑制に有効であった 項目試験デザイン試験対象主要選択基準主要除外基準方法主要評価項目副次的評価項目 内容 多施設共同 無作為化 二重盲検 プラセボ対照並行群間比較試験 胃又は十二指腸潰瘍の既往を有する非ステロイド性抗炎症薬 (NSAID) 継続投与中の患者 343 例 胃又は十二指腸潰瘍の既往がある患者既往とは無作為割付け前 2 週間以内に実施された上部消化管内視鏡検査 (EGD) で胃又は十二指腸潰瘍瘢痕が確認された場合をさす 過去に実施された EGD 所見から潰瘍の存在を確認できれば組み入れてもよい 治験薬投与期間中にわたり NSAID の継続投与が必要と考えられる慢性的な疾患 ( 変形性関節症 関節リウマチ又は腰痛症等 ) の診断を受けている患者 なお NSAID の継続投与とは 1 週間のうち 5 日以上 医師の服薬指導に従って NSAID を服薬していることをさす NSAID の投与量 * 及び剤型については 以下の基準を満たしていなければならない 無作為割付けから最終規定来院日まで NSAID の投与量が一定であると考えられること 服薬されている NSAID は経口投与であること これに加え NSAID 経口剤及び NSAID 外用剤を追加投与することは可能である * 鎮痛目的で使用されるアスピリンの取り扱い 1) アスピリン単独の場合 その投与量は 1000mg/ 日以上 2)NSAID とアスピリン併用の場合 その投与量は 325mg/ 日以上 同意取得時に 20 歳未満である男性及び女性 崎田 三輪分類の活動期又は治癒期の胃又は十二指腸潰瘍を有する患者 肝硬変 急性又は慢性肝炎等の重度の肝障害がある患者 無作為割付け前 2 週間以内の臨床検査において 肝酵素 (AST ALT 又は ALP) あるいは総ビリルビン値が基準値上限の 3 倍以上の患者 慢性腎疾患を有する患者 腎機能障害を有する患者又は無作為割付け前 2 週間以内における臨床検査において 血清クレアチニン値が 2.0mg/dL を超える患者 プロトンポンプインヒビター (PPI) へのアレルギーや過敏症等の治験薬の投与が禁忌である疾患 症状を有する患者 無作為割付け前 1 週間以内に PPI あるいは H2 受容体拮抗剤が投与された患者 無作為に エソメプラゾール 20mg 群又はプラセボ群に割り付け それぞれ 1 日 1 回朝食後に 24 週間投与した 薬剤投与期間を通じての胃又は十二指腸潰瘍の再発の有無 有効性 投与 4 週後及び 12 週後までの胃又は十二指腸潰瘍発症の有無 投与 4 12 及び 24 週後における改訂版 LANZA スコアによる胃粘膜病変の程度 投与 及び 24 週後における医師等の診断による NSAID 起因性消化器症状の有無及び重症度安全性 有害事象等 28
33 Ⅴ. 治療に関する項目 有効性 24 週後までの投与期間を通じての潰瘍非発症率は エソメプラゾール 20mg 群の方がプラセボ群よりも有意に高かった エソメプラゾール 20mg 群の潰瘍非発症率は投与 4 週後から 24 週後まで継続して高かった 一方 プラセボ群においては 投与 4 週後から 24 週後までの間に経時的に低下した Kaplan-Meier 法による胃潰瘍 十二指腸潰瘍の非発症率の推定値 (FAS) エソメプラゾール 20mg(173 例 ) プラセボ (168 例 ) 投与 4 週後 推定値 99.4% 78.8% 95% 信頼区間 98.2~100.0% 72.6~85.0% 投与 12 週後 推定値 96.7% 69.4% 95% 信頼区間 93.8~99.5% 62.3~76.6% 投与 24 週後 推定値 96.0% 64.4% 95% 信頼区間 92.8~99.1% 56.8~71.9% ハザード比 [95% 信頼区間 ] 0.09[0.04~0.20] p 値 a) p<0.001 a)log-rank 検定 有意水準両側 5% 結果 CYP2C19 遺伝子多型別の潰瘍非発症率は 下表のとおりであり 患者全体と同様の傾向が認められた Kaplan-Meier 法による胃潰瘍 十二指腸潰瘍の非発症率の推定値 (FAS) 投与 24 週後 CYP2C19 遺伝子多型 エソメプラゾール 20mg(173 例 ) n 推定値 (95% 信頼区間 ) PM % (90.6~100.0%) hetero EM homo EM % (91.0~100.0%) % (90.2~100.0%) 不明 0-1 プラセボ (168 例 ) n 推定値 (95% 信頼区間 ) % (53.7~84.5%) % (45.5~68.9%) % (58.8~83.5%) 100.0% (100.0~100.0%) 安全性副作用が報告された症例は エソメプラゾール 20mg 群 13.9%(173 例中 24 例 ) プラセボ群 16.1%(168 例中 27 例 ) であった 発現率が 1% 以上であった副作用は エソメプラゾール 20mg 群で上腹部痛 便秘 下痢 嘔吐 肝機能異常 プラセボ群で逆流性食道炎 下痢 便秘 血中クレアチンホスホキナーゼ増加 そう痒症であった 重篤な副作用として エソメプラゾール 20mg 群で腎盂腎炎 胃癌 腰部脊柱管狭窄症が各 1 例に認められた 投与中止に至った副作用は エソメプラゾール 20mg 群で 6 例 ( 紫斑 腎盂腎炎 食欲不振 動悸 胃腸炎 湿疹 ) プラセボ群で 8 例 ( 逆流性食道炎 2 例 尿中血陽性 頭痛 末梢性浮腫 便秘 胃不快感 発疹 ) 認められた 死亡例は報告されなかった (Sugano, K., et al.:aliment. Pharmacol. Ther., 36(2), 115, 2012) 29
34 Ⅴ. 治療に関する項目 4 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 [ 第 Ⅲ 相試験 (D961PC00001 試験 )] 11 ) 消化性潰瘍の既往を有する低用量アスピリン (81~324mg) 継続服用患者を対象としたアジア ( 日本 韓国 台湾 ) 共同第 Ⅲ 相比較試験において エソメプラゾール 20mg の 1 日 1 回最長 72 週間投与時における胃潰瘍又は十二指腸潰瘍の再発抑制効果が認められている 項目試験デザイン試験対象主要選択基準主要除外基準方法主要評価項目副次的評価項目 内容無作為化 二重盲検 並行群間 多施設共同 プラセボ対照 第 Ⅲ 相試験胃又は十二指腸潰瘍の既往を有する低用量アスピリン (Low dose Aspirin:LDA) 継続投与中の患者 366 例 胃又は十二指腸潰瘍の既往がある者既往とは無作為割付け前 2 週間以内に実施された EGD で胃又は十二指腸潰瘍瘢痕が確認された場合をさす なお 無作為割付けの 2 週間前までに実施されたものであれば 同意前の検査結果であっても同意の下で使用可とする EGD で胃又は十二指腸潰瘍の瘢痕が不明瞭な場合は 過去に実施された EGD 所見から潰瘍の存在を確認できれば組み入れてもよい 治験薬投与期間中にわたり LDA の継続投与が必要と考えられる慢性的な疾患 ( 血栓 塞栓形成の抑制が必要な狭心症 心筋梗塞及び虚血性脳血管障害等 ) の診断を受けて 1 週間のうち 5 日以上 医師の服薬指導に従って LDA を服薬している者 *LDA の用量は 81~324mg/ 日とする 同意取得時に 20 歳未満である男性及び女性 胃又は十二指腸潰瘍 ( 潰瘍瘢痕を除く ) を有する者 食道 胃又は十二指腸の手術の既往がある者 ( 但し 穿孔部単純閉鎖術は除く ) 重度の肝障害がある者又は無作為割付け前 2 週間以内の臨床検査において 肝酵素 (AST ALT 又は ALP) あるいは総ビリルビン値が施設基準値上限の 3 倍以上の者 重度の慢性腎疾患を有する患者 重度の腎機能障害を有する患者又は無作為割付け前 2 週間以内における臨床検査において 血清クレアチニン値が施設基準値上限の 2 倍以上の患者 プロトンポンプインヒビター (PPI) へのアレルギーや過敏症等がある者無作為に エソメプラゾール 20mg 群又はプラセボ群に割り付け それぞれ 1 日 1 回朝食後に最長 72 週間投与した 無作為割付けから胃又は十二指腸潰瘍の発症までの期間有効性 無作為割付け 週及び 72 週後までの胃又は十二指腸潰瘍発症の有無 無作為割付け 週及び 72 週後における改訂版 LANZA スコアによる胃粘膜病変の程度 無作為割付け 週及び 72 週後における LA 分類による逆流性食道炎の有無及び重症度 各来院時における治験責任医師等の診断による消化器症状の有無及び重症度安全性 有害事象等 30
35 Ⅴ. 治療に関する項目 有効性消化性潰瘍の既往を有する低用量アスピリン (81~324mg) 継続服用患者を対象としたアジア共同第 Ⅲ 相比較試験 ( 日本人患者含む ) の中間解析 (FAS:364 例 ) における結果において エソメプラゾール 20mg の 1 日 1 回 48 週間投与時における胃潰瘍又は十二指腸潰瘍の再発抑制効果が認められている さらに 中間解析以降 本薬群の被験者のみ投与が継続され エソメプラゾール 20mg を 1 日 1 回最長 72 週間投与時において 投与 72 週後の非発症率は 96.4% であった なお 本試験においては 本薬群 プラセボ群ともに全例ゲファルナートを併用していた 結果 Kaplan-Meier 法による胃潰瘍 十二指腸潰瘍の非発症率の推定値 (FAS) エソメプラゾール 20mg (182 例 ) プラセボ (182 例 ) 発症例数 2 例 22 例 投与 48 週後の非発症率 a) [96.65% 信頼区間 ] ハザード比 [96.65% 信頼区間 ] p 値 b) 98.3% [95.7~100%] 0.09[0.02~0.41] p<0.001 a)kaplan-meier 法による推定 b)log-rank 検定 有意水準両側 3.35% 81.2% [72.7~89.7%] 安全性最終解析時 副作用が報告された症例は エソメプラゾール 20mg 群 14.5%(214 例中 31 例 ) プラセボ群 13.6%(213 例中 29 例 ) であった 主な副作用は エソメプラゾール群では 腹部膨満 下痢 胃ポリープ びらん性胃炎 貧血 ( 各 0.9%[2/214 例 ]) プラセボ群では便秘 十二指腸炎 上腹部痛 ( 各 1.4%[3/213 例 ]) 下痢 びらん性胃炎 胃炎 びらん性十二指腸炎 ( 各 0.9%[2/213 例 ]) であった 重篤な副作用として プラセボ群でびらん性胃炎が 1 例に認められた 投与中止に至った副作用として エソメプラゾール 20mg 群でびらん性胃炎が 2 例に 下痢 頭痛 蕁麻疹 発疹 血小板減少症が各 1 例に認められ プラセボ群では上腹部痛が 2 例に 下痢及び消化不良 逆流性食道炎及び回転性めまい 胃食道逆流性疾患及び胃十二指腸炎 血圧上昇 肝炎 蕁麻疹 多形紅斑が各 1 例に認められた 死亡例は報告されなかった (Sugano, K., et al.:gut, 63(7), 1061, 2014) 31
36 Ⅴ. 治療に関する項目 3) 安全性試験 1 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 [( 長期投与試験 )(D961HC00005 試験 )] 8 ) 消化性潰瘍の既往を有する非ステロイド性抗炎症薬 (NSAID) 継続服用患者を対象とした 52 週間の長期投与試験において NSAID 併用時におけるエソメプラゾール 20mg1 日 1 回 52 週間の投与期間中 副作用が報告された症例は 130 例中 22 例 (16.9%) であり 胃潰瘍又は十二指腸潰瘍の再発抑制に有効であった 項目試験デザイン試験対象主要選択基準主要除外基準方法主要評価項目副次的評価項目 内容 多施設共同 単群 オープン 長期投与試験 胃又は十二指腸潰瘍の既往を有する非ステロイド性抗炎症薬 (NSAID) 継続投与中の患者 130 例 胃又は十二指腸潰瘍の既往がある患者既往とは登録前 2 週間以内に実施された上部消化管内視鏡検査 (EGD) で胃又は十二指腸潰瘍瘢痕が確認された場合をさす なお 登録の 2 週間前までに実施されたものであれば 同意前の検査結果であっても同意の下で使用可とする EGD で胃又は十二指腸潰瘍の瘢痕が不明瞭な場合は 過去に実施された EGD 所見から潰瘍の存在を確認できれば組み入れてもよい 治験薬投与期間中にわたり NSAID の継続投与が必要と考えられる慢性的な疾患 ( 変形性関節症 関節リウマチ又は腰痛症等 ) の診断を受けている患者 なお NSAID の継続投与とは 1 週間のうち 5 日以上 医師の服薬指導に従って NSAID を服薬していることをさす NSAID の投与量 * 及び剤型については 以下の基準を満たしていること 登録日から最終規定来院日まで NSAID の投与量が一定であると考えられること 服薬されている NSAID は経口投与であること これに加え NSAID 経口剤及び NSAID 外用剤を追加投与することは可能である * 鎮痛目的で使用されるアスピリンの取り扱い 1) アスピリン単独使用の場合 その投与量は 1000mg/ 日以上 2)NSAID とアスピリン併用使用の場合 その投与量は 325mg/ 日以上 同意取得時に 20 歳未満である男性及び女性 崎田 三輪分類の活動期又は治癒期の胃又は十二指腸潰瘍を有する患者 肝硬変 急性又は慢性肝炎等の重度の肝障害がある患者 登録前 2 週間以内の臨床検査において 肝酵素 (AST ALT 又は ALP) あるいは総ビリルビン値が基準値上限の 3 倍以上の患者 慢性腎疾患を有する患者 腎機能障害を有する患者又は登録前 2 週間以内における臨床検査において 血清クレアチニン値が 2.0mg/dL を超える患者 プロトンポンプインヒビター (PPI) へのアレルギーや過敏症等の治験薬の投与が禁忌である疾患 症状を有する患者 登録前 1 週間以内に PPI あるいは H2 受容体拮抗剤が投与された患者 スクリーニング時の EGD で潰瘍瘢痕が認められた被験者に エソメプラゾール 20mg を 1 日 1 回朝食後に 52 週間経口投与した 安全性有害事象 臨床検査 バイタルサイン 有効性 投与 及び 52 週後における胃又は十二指腸潰瘍再発の有無 投与 及び 52 週後における改訂版 LANZA スコアによる胃粘膜病変の程度 投与 4~52 週後の 4 週ごとにおける医師等の診断による NSAID 起因性消化器症状の有無及び重症度 32
37 Ⅴ. 治療に関する項目 安全性 52 週間の投与期間中 副作用が報告された症例は 130 例中 22 例 (16.9%) であった 発現率が 1% 以上であった副作用は エソメプラゾール 20mg 群で γ- グルタミルトランスフェラーゼ (γ-gtp) 増加 頭痛 肝機能異常 筋痙縮であった 重篤な副作用として 丹毒及び肺炎が 1 例に認められた 投与中止に至った副作用として びらん性胃炎が 1 例に認められた 死亡例は報告されなかった 有効性潰瘍の非再発率は 投与 4 週後から投与 52 週後まで著しい変化なく継続して高かった ( 投与 4 週後 :100.0% 投与 12 週後 :97.6% 投与 24 週後 :96.7% 投与 52 週後 :95.9% ) Kaplan-Meier 法による胃潰瘍 十二指腸潰瘍の非再発率の推定値 (FAS) 結果 (Sugano, K., et al.:bmc Gastroenterol., 13, 54, 2013) 33
38 Ⅴ. 治療に関する項目 4) 患者 病態別試験 1 日本人小児患者における国内第 Ⅰ/Ⅲ 相臨床試験 (D961TC00002 試験 ) 12 ) 胃酸関連疾患を有する又は有する疑いのある 1~14 歳の患者 50 例を対象とした非盲検試験では エソメプラゾール 10mg 又は 20mg を 1 日 1 回最大 8 週間投与したところ 上部消化器症状に対する本剤の有効性が認められた 項目試験デザイン試験対象主要選択基準主要除外基準方法主要評価項目副次的評価項目 多施設共同 非盲検 並行群間試験 内容 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 非びらん性胃食道逆流症 逆流性食道炎 又は Zollinger-Ellison 症候群を有する又は有する疑いのある 1~14 歳の患者 50 例 治験に関わる手順 検査を開始する前に 代諾者により文書による同意が得られている患者 同意取得時に 1~14 歳の患者 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 非びらん性胃食道逆流症 逆流性食道炎又は Zollinger-Ellison 症候群を有する又は有すると疑われる患者 肥満指数 (BMI) が年齢別 BMI 標準曲線の 3~97 パーセンタイルである患者 代諾者等が治験責任医師等と連絡をとり 全ての治験手順を遵守できる患者 体重が 10kg 未満の患者 胃全摘出術の既往のある患者 プロトンポンプインヒビター (PPI) へのアレルギーや過敏症のある患者 治験期間中にヘリコバクター ピロリ除菌の必要がある患者 投与群への割付け前 14 日以内に PPI を使用した患者等 エソメプラゾール懸濁用顆粒剤 10mg エソメプラゾールカプセル 10mg 及び 20mg を割付け それぞれ 1 日 1 回朝食後に最大 8 週間投与した 対象群例数投与年齢体重 1 1 歳以上 20kg 未満 5~10 例エソメプラゾール懸濁用顆粒 10 mg 2 エソメプラゾールカプセル 10 mg 1~11 歳 3 エソメプラゾールカプセル 20 mg 20kg 以上 10 例 4 エソメプラゾールカプセル 10 mg 12~14 歳 5 エソメプラゾールカプセル 20 mg 安全性有害事象 臨床検査 バイタルサイン有効性 投与 1 4 及び 8 週後のベースラインとの比較における上部消化器症状 ( 胸やけ 呑酸 心窩部痛及び上腹部不快感 ) の有無及び重症度 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 及び逆流性食道炎の有無の内視鏡的評価薬物動態 5 日間以上経口投与後のエソメプラゾールの薬物動態パラメータ (AUC τ AUC t Cmax tmax t1/2 CL/F 及び Vz/F) 5 日間以上経口投与後のエソメプラゾールの代謝物である 5- 水酸化体及びスルホン体の薬物動態パラメータ (AUC τ AUC t Cmax tmax 及び t1/2) CYP2C19 遺伝子多型が薬物動態に及ぼす影響薬力学 ベースライン時及び 5 日間以上経口投与後の観察期間 12 時間での胃内 ph が 4 を超える及び 3 を超える割合 ( 時間率 ) 並びに中央値 CYP2C19 遺伝子多型が薬力学に及ぼす影響 34
39 Ⅴ. 治療に関する項目 有効性胃潰瘍 十二指腸潰瘍 吻合部潰瘍 非びらん性胃食道逆流症 逆流性食道炎 又は Zollinger-Ellison 症候群を有する又は有する疑いのある 1~14 歳の患者 50 例を対象とした非盲検試験では 体重 10kg 以上 20kg 未満 (10 例 [ 第 1 群 ]) にエソメプラゾール 1 回 10mg を 20kg 以上に 1 回 10mg(1~11 歳 10 例 [ 第 2 群 ] 12~14 歳 10 例 [ 第 4 群 ]) 又は 1 回 20mg(1~11 歳 10 例 [ 第 3 群 ] 12~14 歳 10 例 [ 第 5 群 ]) を 1 日 1 回最大 8 週間投与した 各投与群の上部消化器症状 ( 胸やけ 呑酸 心窩部痛 及び上腹部不快感 ) は 投与前に症状を有していた患者の 40% 以上の割合で消失した また 投与前に内視鏡的評価が実施できた患者のうち病理学的所見が認められた 3 例すべてにおいて投与後に所見が消失した 結果 投与群 ( 投与例数 ) 第 1 群 (10 例 ) 第 2 群 (10 例 ) 第 3 群 (10 例 ) 第 4 群 (10 例 ) 年齢 1 歳以上 1~11 歳 12~14 歳 10kg 以上体重 20kg 以上 20kg 未満 第 5 群 (10 例 ) 投与量 10mg 10mg 20mg 10mg 20mg Kaplan-Meier 法による最終時点の累積持続消失率 胸やけ 100%(2 例 ) 66.7%(3 例 ) 100%(1 例 ) 50%(2 例 ) 75%(4 例 ) 呑酸 75%(4 例 ) 100%(3 例 ) 80%(5 例 ) 50%(4 例 ) 100%(4 例 ) 心窩部痛 100%(2 例 ) 50%(6 例 ) 100%(6 例 ) 40%(5 例 ) 57.1%(7 例 ) 上腹部不快感 100%(3 例 ) 66.7%(6 例 ) 100%(4 例 ) 60%(5 例 ) 50%(6 例 ) () 投与前に症状を有していた例数 安全性総症例数 50 例中 2 例 (4.0%) の副作用が報告されている その内訳は 第 3 群で下痢及び腹痛 第 5 群で光線過敏性反応が各 1 例 (2.0%) であった 投与中止に至った副作用は第 3 群で 1 例 ( 下痢及び腹痛 ) 認められた 重篤な副作用及び死亡例は報告されなかった ( 社内資料 : 日本人小児患者における第 Ⅰ/Ⅲ 相試験,2016) (6) 治療的使用 1) 使用成績調査 特定使用成績調査 ( 特別調査 ) 製造販売後臨床試験 ( 市販後臨床試験 ) < 使用成績調査 > 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 非びらん性胃食道逆流症 Zollinger-Ellison 症候群を対象とした使用成績調査 13) 成人を対象に使用実態下における安全性及び有効性の検討を目的に使用成績調査を実施し 3,671 例を収集した 安全性解析対象症例 3,394 例中 45 例 (1.3%) に副作用が認められた 3 例以上発現した副作用は 下痢 6 例 (0.2%) 便秘 4 例 (0.1%) 及び嘔吐 3 例 (0.1%) であり いずれも非重篤な副作用であった 3 例以上発現した未知の副作用はなかった 重篤な副作用は脳梗塞及び血小板減少の各 1 例であった 副作用発現率に有意差が認められた因子は 消化性潰瘍では入院 外来 既往歴の有無 調査対象疾患 ( 主病変 ) の前治療薬の有無及び本剤の投与中止の有無であり 逆流性食道炎及び非びらん性胃食道逆流症では喫煙習慣の有無 35
40 Ⅴ. 治療に関する項目 アレルギーの有無 合併症の有無 併用療法の有無 本剤の投与状況の変更の有無及び本剤の投与中止の有無であった 有効性解析対象症例 3,038 例において 内視鏡治癒率は胃潰瘍 82.2%(254/309 例 ) 十二指腸潰瘍 91.6%(98/107 例 ) 逆流性食道炎 78.9%(120/152 例 ) であった 吻合部潰瘍 2 例は治癒 Zollinger-Ellison 症候群 1 例では潰瘍が消失した 自覚症状のうち 心窩部痛の改善率は胃潰瘍 98.3%(588/598 例 ) 十二指腸潰瘍 97.3%(285/293 例 ) 吻合部潰瘍 87.5%(7/8 例 ) であり 胸やけの改善率は逆流性食道炎 93.2%(1,285/1,379 例 ) 非びらん性胃食道逆流症 89.9%( 213/237 例 ) であった また 添付文書の成人の用法 用量に準じた処方症例 (2,672 例 ) における内視鏡治癒率は胃潰瘍 81.4%(237/291 例 ) 十二指腸潰瘍 92.2%(95/103 例 ) 逆流性食道炎 78.4%( 105/134 例 ) であり 自覚症状のうち 心窩部痛の改善率は胃潰瘍 98.2% (557/567 例 ) 十二指腸潰瘍 97.2%(273/281 例 ) 吻合部潰瘍 87.5%(7/8 例 ) 胸やけの改善率は逆流性食道炎 93.6%(1,167/1,247 例 ) 非びらん性胃食道逆流症 92.1%(105/114 例 ) であった ( 吉田茂 : 臨床医薬, 30(9), 787, 2014[Erratum in: 臨床医薬, 32(6), 528, 2016]) < 特定使用成績調査 > 14) ヘリコバクター ピロリ除菌療法に係る特定使用成績調査 成人を対象に使用実態下におけるヘリコバクター ピロリ除菌療法における安全性及び有効性の検討を目的に特定使用成績調査を実施し 364 例を収集した 安全性解析対象症例 352 例 ( 一次除菌 319 例 二次除菌 33 例 ) 中 12 例 (3.4%) に副作用が認められた すべて一次除菌での発現例で 二次除菌において副作用の発現はなかった 発現した副作用の内訳は下痢 7 例 (2.0%) 味覚異常 3 例 ( 0.9%) 肝障害 薬疹 蕁麻疹及びリウマチ性多発筋痛各 1 例 ( 0.3%) であり いずれも非重篤な副作用であった 未知の副作用はリウマチ性多発筋痛 1 例 (0.3%) であった 副作用発現率に有意差が認められた因子は 飲酒習慣の有無 3 剤併用療法 の投与状況の変更の有無及び 3 剤併用療法 の中止の有無であった 有効性解析対象症例 316 例における 3 剤併用療法後の除菌率は全体で 81.6%(258/316 例 ) 一次除菌 81.4%(232/285 例 ) 二次除菌 83.9%(26/31 例 ) であった また 添付文書の成人の用法 用量に準じた処方症例 (314 例 ) における除菌率は全体で 81.5%(256/314 例 ) 一次除菌 81.3%(230/283 例 ) 二次除菌 83.9%(26/31 例 ) であった ( 吉田茂 : 臨床医薬, 30(10), 869, 2014) 36
41 Ⅴ. 治療に関する項目 再発 再燃を繰り返す逆流性食道炎の維持療法に関する特定使用成績調査 15) 成人を対象に使用実態下における再発 再燃を繰り返す逆流性食道炎患者に対する維持療法の安全性及び有効性の検討を目的に特定使用成績調査を実施し 631 例を収集した 安全性解析対象症例 601 例中 10 例 (1.7%) に 15 件の副作用が認められた その内訳は上腹部痛 2 件 気管支炎 不眠症 眼瞼湿疹 腹部膨満 慢性胃炎 便秘 下痢 嘔吐 肝機能異常 薬疹 湿疹 痒疹及びそう痒症の各 1 件であり いずれも非重篤な副作用であった 未知の副作用は気管支炎 眼瞼湿疹 慢性胃炎で 重篤な副作用はなかった 副作用発現率に有意差が認められた因子は本剤の投与中止の有無であった 有効性解析対象症例 496 例のうち 維持療法開始後から観察期間終了時又は投与中止時までに一度でも内視鏡検査が行われた 105 例 (21.2%) における内視鏡的非再発率は 86.7%(91/105 例 ) であった 自覚症状の改善率は胸やけ 90.8%(317/349 例 ) 呑酸 91.3%(209/229 例 ) 心窩部痛 89.8%(168/187 例 ) 自覚症状の消失率は胸やけ 79.4%(277/349 例 ) 呑酸 83.8% (192/229 例 ) 心窩部痛 85.0%(159/187 例 ) であった また 添付文書の成人の用法 用量に準じた処方症例 (494 例 ) における内視鏡的非再発率は 86.7%(91/105 例 ) 自覚症状の改善率は胸やけ 90.8%(316/348 例 ) 呑酸 91.2%(208/228 例 ) 心窩部痛 89.8%(167/186 例 ) 自覚症状の消失率は胸やけ 79.3%(276/348 例 ) 呑酸 83.8%(191/228 例 ) 心窩部痛 84.9%(158/186 例 ) であった ( 吉田茂他 : 臨床医薬, 31(10), 907, 2015[Erratum in: 臨床医薬, 32(6), 528, 2016]) 2) 承認条件として実施予定の内容又は実施した試験の概要該当しない 37
42 Ⅵ. 薬効薬理に関する項目 Ⅵ. 薬効薬理に関する項目 1. 薬理学的に関連ある化合物又は化合物群 プロトンポンプインヒビター 2. 薬理作用 (1) 作用部位 作用機序 1) 胃酸分泌抑制作用胃壁細胞内においては 各種酸分泌刺激物質 ( ヒスタミン アセチルコリン ガストリン ) が胃壁細胞膜上に存在するそれぞれの受容体へ結合することにより 一連の胃酸分泌反応がおこる この反応の最終過程では 胃壁細胞内から分泌細管腔に H + を放出し 代わりに K + を取り込むプロトンポンプと呼ばれる酵素 H +, K + -ATPase が関与している 本剤は 強酸性領域である胃壁細胞の分泌細管腔に集積し 酸により活性体であるスルフェンアミド体に変換される この活性体の S 部分が プロトンポンプの SH 基と結合し (S-S 結合 ) プロトンポンプの働きを阻害することによって 胃酸分泌を抑制する なお 本剤とプロトンポンプの SH 基との結合は不可逆結合であり プロトンポンプのターン オーバー ( 分解 再合成 ) に合わせて 胃酸分泌は回復すると考えられている 2) ヘリコバクター ピロリ除菌の補助作用の機序ヘリコバクター ピロリ除菌治療における本剤の役割は胃内 ph を上昇させることにより 併用されるアモキシシリン水和物 クラリスロマイシンの抗菌活性を高めることにあると考えられる 38
43 Ⅵ. 薬効薬理に関する項目 (2) 薬効を裏付ける試験成績 1) ヒトでの作用 1 胃内 ph に及ぼす影響注 ) 健康成人男性において クロスオーバー法によりエソメプラゾール 20mg 40mg 及びオメプラゾール 20mg を 1 日 1 回 5 日間反復経口投与したとき 24 時間中に胃内 ph が 4 以上を示す時間の割合は それぞれ 62±14% 68±8% 59±19% であった 1 ) 例数 胃内 ph>4 の時間率 (%) 算術平均 標準偏差 エソメプラゾール 20mg エソメプラゾール 40mg オメプラゾール 20mg 注 ) 承認外の用法 用量 ( Ⅴ.2. 用法及び用量 参照 ) 健康成人男性において クロスオーバー法によりエソメプラゾール 10mg オメプラゾール 10mg を 1 日 1 回 5 日間反復経口投与したとき 24 時間中に胃内 ph が 4 以上を示す時間の割 合は それぞれ 48±23% 43±26% であった 1 ) 例数 胃内 ph>4 の時間率 (%) 算術平均 標準偏差 エソメプラゾール 10mg オメプラゾール 10mg 小児患者 5 例において エソメプラゾール 10mg 及び 20mg 投与により 12 時間中に胃内 ph が 4 以上を示す時間の割合は 51.2~98.3% であった 2 ) 2 胃内 ph に及ぼす影響と薬物動態 [ 外国人のデータ ] 3 ) 胃食道逆流症症状を有する成人 36 例において クロスオーバー法によりエソメプラゾール 20mg オメプラゾール 20mg を 1 日 1 回 5 日間反復経口投与し 24 時間胃内 ph モニタリング及び薬物動態の検討を行った 24 時間中に胃内 ph が 4 以上を示す時間の割合は エソメプラゾール 20mg がオメプラゾール 20mg に比べて有意に高かった また エソメプラゾール 20mg の AUC はオメプラゾール 20mg に比べて有意に高かった 39
44 Ⅵ. 薬効薬理に関する項目 胃内 ph>4 の時間率 (95% 信頼区間 ) 薬物動態パラメータ AUC(95% 信頼区間 ) エソメプラゾール 20mg 53.0%( ) 4.18μmol h/l( ) オメプラゾール 20mg 43.7%( ) 2.34μmol h/l( ) p<0.01 vs オメプラゾール p< vs オメプラゾール (mixed-model analysis of variance) エソメプラゾールのプロトンポンプ阻害作用は ラセミ体であるオメプラゾールと同じであることが示されている ( Ⅵ.2.(2) 2) 1プロトンポンプ阻害作用 参照 ) そのため 臨床においてエソメプラゾールが同用量のオメプラゾールよりも高い酸分泌抑制効果を示す理由は エソメプラゾールの血中からの消失がオメプラゾールよりも緩やかであり 高い AUC が得られるためと考えられている 2) 非臨床試験 1プロトンポンプ阻害作用 [in vitro 試験 ] 4 ) ウサギ胃粘膜由来のプロトンポンプ (H +, K + -ATPase) に対し エソメプラゾール オメプラゾール R-オメプラゾールは いずれもプロトンポンプ阻害作用を有し その作用強度は同程度であった 薬物 IC50 値 (μmol/l) エソメプラゾール 3.7 オメプラゾール 5.4 R- オメプラゾール 4.4 平均 ± 標準誤差 試験方法 : 摘出ウサギ胃粘膜層より調整したプロトンポンプ (H +, K + -ATPase) とエソメプラゾール オメプラゾール R- オメプラゾールを反応液中 (ph5.7) で 15 分間反応させ ATP( アデノシン三リン酸 ) の加水分解により生じた無機リン酸を定量することにより酵素活性を算出した 2 胃酸分泌抑制作用 (ⅰ) 単離ウサギ胃底腺 [in vitro 試験 ] 5 ) エソメプラゾール オメプラゾール R-オメプラゾールは 単離ウサギ胃底腺におけるヒスタミン刺激胃酸産生を濃度依存的に抑制した IC50 値 (50% 阻害濃度 ) はそれぞれ μmol/L であり 同程度の胃酸産生抑制作用を示した 40
45 Ⅵ. 薬効薬理に関する項目 胃底腺におけるヒスタミン刺激胃酸産生に対する抑制作用 *1:100μmol/L ヒスタミンによる胃酸産生を 100% として計算各カラムに付与した数値は平均値 各薬物の IC50 値は平均 ± 標準誤差 (n=4) 試験方法 : ウサギ胃底腺標品を作成し 薬物 ( エソメプラゾール オメプラゾール R- オメプラゾール いずれもナトリウム塩 ) ヒスタミン 14 C- アミノピリンを添加して反応させ 胃底腺標品に取り込まれた弱塩基である 14 C- アミノピリンの蓄積を酸生成の指標とした (ⅱ) 胃瘻ラット 6 ) 胃瘻ラットにおいて エソメプラゾール オメプラゾール R- オメプラゾールは ペンタガス トリン及びカルバコール刺激酸分泌に対して用量依存的な抑制作用を示した 胃酸分泌量に対する抑制作用の効力は R- オメプラゾール (ED50 値 :5.1±0.1μmol/kg) はオ メプラゾール (ED50 値 :7.2±0.7μmol/kg) よりも高く オメプラゾールはエソメプラゾール (ED50 値 :>12μmol/kg) よりも高かった この所見はこれら 3 剤の薬物動態パラメータであ る AUC が R- オメプラゾール > オメプラゾール > エソメプラゾールの順で高値になることと一 致していた すなわち 今回示されたエソメプラゾール オメプラゾール R- オメプラゾール の胃酸分泌抑制作用強度の差は これらの薬物がラットにおいて異なる薬物動態学的プロファ イルを示すことが主な原因であると考えられる 試験方法 : 胃瘻ラットに 薬物 ( エソメプラゾール オメプラゾール R- オメプラゾール いずれもナトリウム塩 ) もしくは溶媒を単回経口投与し 薬物投与 120 分後から ペンタガストリン及びカルバコール皮下 150 分間持続投与による胃酸分泌刺激を行った 胃酸分泌刺激中の胃液を 30 分間隔で採取した また 薬物投与後 180 分までの血漿中薬物濃度を測定した 41
46 Ⅵ. 薬効薬理に関する項目 (ⅲ)Heidenhain pouch イヌ 7 ) エソメプラゾール オメプラゾール R-オメプラゾールは Heidenhain pouch イヌにおけるヒスタミン刺激胃酸分泌に対し用量依存的な抑制作用を示した 3 剤の効力は同等 ( 薬物投与後 120~300 分における 胃酸分泌量に対する抑制作用の ED50 値はエソメプラゾール オメプラゾール R-オメプラゾールでそれぞれ 2.5± ± ±0.1μmol/kg) であった また これら 3 剤の AUC も同等であった 薬物 投与量 (μmol/kg) エソメプラゾール オメプラゾール R- オメプラゾール 平均 ± 標準誤差 胃酸分泌量に対する抑制率 (%) 17.5± ± ± ± ± ± ± ± ±4.5 薬物動態パラメータ AUC(μmol h/l) 0.41± ± ± ± ± ± ± ± ±0.18 試験方法 : 薬物 ( エソメプラゾール オメプラゾール R- オメプラゾール いずれもナトリウム塩 ) もしくは溶媒を時間 0 の時点で経口投与し 胃酸分泌刺激をヒスタミン静脈内 390 分間持続投与 (- 90 分から +300 分まで ) により行った 胃液をヒスタミン刺激前の 15 分間 ( 胃酸分泌の基準値とする ) 及びヒスタミン刺激中の 30 分間毎に Heidenhain pouch から採取した 血漿中薬物濃度は薬物投与後 180 分まで測定した (3) 作用発現時間 持続時間 Ⅵ.2.(2) 1) ヒトでの作用 参照 42
47 Ⅶ. 薬物動態に関する項目 Ⅶ. 薬物動態に関する項目 1. 血中濃度の推移 測定法 (1) 治療上有効な血中濃度 エソメプラゾールの胃酸分泌抑制効果は血中濃度には相関しない (2) 最高血中濃度到達時間 下記 Ⅶ.1.(3) 臨床試験で確認された血中濃度 参照 (3) 臨床試験で確認された血中濃度 1) 1) 健康成人 1 単回投与健康成人男性被験者 (24 例 CYP2C19 の homo EM hetero EM 及び PM が同数 ) にエソメプラゾール 10mg 及び 20mg を空腹時に単回経口投与したときの未変化体の薬物動態パラメータは以下のとおりである 投与量 Cmax(ng/mL) Tmax(hr) AUC(ng hr/ml) T1/2(hr) 10mg ( ) 20mg ( ) 2.50 ( ) 2.75 ( ) a ) ( ) ( ) Tmax は中央値 ( 最小値 - 最大値 ) それ以外は幾何平均 (95% 信頼区間 ) a)n= a ) ( ) 1.08 ( ) 平均値 ± 標準偏差 n=24 43
48 Ⅶ. 薬物動態に関する項目 2 反復投与 健康成人男性被験者 (24 例 CYP2C19 の homo EM hetero EM 及び PM が同数 ) にエソメ プラゾール 10mg 及び 20mg を 1 日 1 回 5 日間反復経口投与したときの第 5 日目 ( 空腹時投与 ) の未変化体の薬物動態パラメータは以下のとおりである 投与量 Cmax(ng/mL) Tmax(hr) AUC(ng hr/ml) T1/2(hr) 10mg ( ) 20mg ( ) 1.75 ( ) 2.25 ( ) a ) ( ) ( ) Tmax は中央値 ( 最小値 - 最大値 ) それ以外は幾何平均 (95% 信頼区間 ) a)n= a ) ( ) 1.25 ( ) 投与 3 日目及び 5 日目の Cmax は同程度であったことから 反復投与開始後 3 日には血漿中エ ソメプラゾール濃度は定常状態に到達したと考えられた 投与 5 日目の投与後 12 時間におけ る血漿中エソメプラゾール濃度はほぼ検出限界以下に低下し 1 日 1 回反復投与しても累積は 認められなかった 平均値 ± 標準偏差 n=24 2) 幼児及び小児 2) 幼児及び小児患者 (48 例 CYP2C19 の homo EM 13 例 hetero EM 28 例 及び PM 7 例 ) にエソメプラゾール 10mg 及び 20mg を 1 日 1 回 5 日間以上反復経口投与したところ 未変化 体の薬物動態パラメータは以下のとおりであった 被験者の投与量年齢及び体重 (mg) n エソメプラゾールの薬物動態パラメータ Cmax(ng/mL) a ) Tmax(hr) b ) AUCτ(ng hr/ml) a) T1/2(hr) c ) 1 歳以上 (141.7%)1.58(1.03~5.92) 2261 (42.6%) 10kg 以上 20kg 未満 d) 0.80±0.18 d ) 1~11 歳 (110.4%)1.52(0.92~6.00) 995 (78.3%) e) 0.97±0.55 e ) 20kg 以上 (41.5%) 1.47 (0.93~1.52) 3459 (50.9%) 1.08± ~14 歳 (91.7%) 1.57 (0.93~2.95) 619 (105.5%) 1.37± kg 以上 (51.3%) 1.75 (0.95~3.00) 1918 (33.6%) 1.06±0.25 a) 幾何平均値 ( 変動係数 ) b) 中央値 ( 最小値 - 最大値 ) c) 平均値 ± 標準偏差 d)n=7 e)n=9 44
49 Ⅶ. 薬物動態に関する項目 3) 高齢者における薬物動態 [ 外国人のデータ ] 3) 注健康高齢被験者 ( 平均年齢 74 歳 (71~80 歳 )) にエソメプラゾール 40mg ) を 1 日 1 回 5 日 間反復経口投与したとき 投与 5 日目の AUC 及び Cmaxは非高齢の症候性胃食道逆流症患者 ( 平 均年齢 45 歳 (29~58 歳 )) よりも高い傾向を示し 幾何平均の比 ( 健康高齢者 / 非高齢患者 ) は各々 1.25(95% 信頼区間 :0.94~1.67) 1.18( 同 :0.91~1.52) であった Cmax(μmol/L) AUC(μmol hr/l) 健康高齢者 (n=13) 非高齢の症候性胃食道逆流症患者 (n=36) 健康高齢者 / 非高齢患者の比 (95% 信頼区間 ) 1.18( ) 1.25( ) 幾何平均 注 ) 承認外の用法 用量 ( Ⅴ.2. 用法及び用量 参照 ) 4) 肝障害患者における薬物動態 [ 外国人のデータ ] 4) 注肝機能障害患者にエソメプラゾール 40mg ) を 1 日 1 回 5 日間反復経口投与したとき AUC τは 肝機能低下のない症候性胃食道逆流症患者に比べ 重度の肝機能障害患者では約 2.3 倍高く 軽度 ~ 中程度の肝機能障害患者でもその比は 1.4~1.8 であった 肝障害 Cmax a ) (μmol/l) 軽度 (n=4) 6.5 ( ) 中程度 (n=4) 5.4 ( ) 重度 (n=4) 6.4 ( ) 肝機能正常の症候性胃食道逆流症患者 (n=36) 4.7 ( ) Tmax b ) (hr) 1.7 ( ) 2.3 ( ) 1.8 ( ) 1.6 ( ) a) 幾何平均 (95% 信頼区間 ) b) 算術平均 (95% 信頼区間 ) AUCτ: 投与間隔 (τ) における血漿中濃度時間曲線下面積 AUC τ a) (μmol hr/l) 18.2 ( ) 22.6 ( ) 30.0 ( ) 12.8 ( ) T1/2 a ) (hr) 1.3 ( ) 2.4 ( ) 3.1 ( ) 1.5 ( ) 注 ) 承認外の用法 用量 ( Ⅴ.2. 用法及び用量 参照 ) 45
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
<4D F736F F D2082A8926D82E782B995B68F C D815B838B43505F4F E31302E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
<4D F736F F D2082A8926D82E782B995B68F D815B838B8FF E31312E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
Z_O_IF_1409_06.indb
 2014 年 9 月改訂 ( 改訂第 6 版 ) 日本標準商品分類番号 872649 医薬品インタビューフォーム IF 2013 外用ビタミン A 剤 ビタミン A 製剤 剤形 製剤の規制区分 規格 含量 一般名 製造販売承認年月日薬価基準収載 発売年月日 開発 製造販売 ( 輸入 ) 提携 販売会社名 医薬情報担当者の連絡先 問い合わせ窓口 1g A 5mg A 5,000 A A Vitamin
2014 年 9 月改訂 ( 改訂第 6 版 ) 日本標準商品分類番号 872649 医薬品インタビューフォーム IF 2013 外用ビタミン A 剤 ビタミン A 製剤 剤形 製剤の規制区分 規格 含量 一般名 製造販売承認年月日薬価基準収載 発売年月日 開発 製造販売 ( 輸入 ) 提携 販売会社名 医薬情報担当者の連絡先 問い合わせ窓口 1g A 5mg A 5,000 A A Vitamin
MRS_T_IF_1509_08.indb
 2015 年 9 月改訂 ( 改訂第 8 版 ) 日本標準商品分類番号 871339 医薬品インタビューフォーム IF 2013 めまい 平衡障害治療剤日本薬局方ベタヒスチンメシル酸塩錠 剤形 製剤の規制区分 規格 含量 一般名 製造販売承認年月日薬価基準収載 発売年月日 開発 製造販売 ( 輸入 ) 提携 販売会社名 医薬情報担当者の連絡先 問い合わせ窓口 6mg 1 6mg 12mg 1 12mg
2015 年 9 月改訂 ( 改訂第 8 版 ) 日本標準商品分類番号 871339 医薬品インタビューフォーム IF 2013 めまい 平衡障害治療剤日本薬局方ベタヒスチンメシル酸塩錠 剤形 製剤の規制区分 規格 含量 一般名 製造販売承認年月日薬価基準収載 発売年月日 開発 製造販売 ( 輸入 ) 提携 販売会社名 医薬情報担当者の連絡先 問い合わせ窓口 6mg 1 6mg 12mg 1 12mg
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
< F2D C D838A8BDB92CA926D2E6A7464>
 保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
<4D F736F F D2082A8926D82E782B995B68F D815B838B4E618FF931306D E3131>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加及び 使用上の注意 改訂のお知らせ 2012 年 11 月 東和薬品株式会社 このたび 平成 24 年 5 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 24 年 11 月 19 日付にて 下記の内容で承認されました また 使用上の注意 の項も改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加及び 使用上の注意 改訂のお知らせ 2012 年 11 月 東和薬品株式会社 このたび 平成 24 年 5 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 24 年 11 月 19 日付にて 下記の内容で承認されました また 使用上の注意 の項も改訂致しましたので 併せてお知らせ申し上げます
ネキシウムカプセル10mg/ネキシウムカプセル20mg
 NEX-10.0 **2018 年 1 月改訂 ( 第 10 版 ) * 2016 年 2 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 プロトンポンプ インヒビター エソメプラゾールマグネシウム水和物カプセル 日本標準商品分類番号 872329 10mg 20mg 承認番号 22300AMX00598 22300AMX00599
NEX-10.0 **2018 年 1 月改訂 ( 第 10 版 ) * 2016 年 2 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 プロトンポンプ インヒビター エソメプラゾールマグネシウム水和物カプセル 日本標準商品分類番号 872329 10mg 20mg 承認番号 22300AMX00598 22300AMX00599
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
ネキシウムカプセル10mg/ネキシウムカプセル20mg
 NEX-9.0 **2016 年 2 月改訂 ( 第 9 版 ) * 2015 年 1 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 プロトンポンプ インヒビター エソメプラゾールマグネシウム水和物カプセル 日本標準商品分類番号 872329 10mg 20mg 承認番号 22300AMX00598 22300AMX00599
NEX-9.0 **2016 年 2 月改訂 ( 第 9 版 ) * 2015 年 1 月改訂 処方箋医薬品 : 注意 - 医師等の処方箋により使用すること 貯法 : 室温保存使用期限 : ケース等に表示 プロトンポンプ インヒビター エソメプラゾールマグネシウム水和物カプセル 日本標準商品分類番号 872329 10mg 20mg 承認番号 22300AMX00598 22300AMX00599
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに
 ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg 有効成分 ボノプラザンフマル酸塩 製造販売業者 武田薬品工業株式会社 薬効分類 提出年月 2018 年 4 月 1.1. 安全性検討事項 重要
 タケキャブ錠 10 mg タケキャブ錠 20 mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は 武田薬品工業株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません 武田薬品工業株式会社 タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg
タケキャブ錠 10 mg タケキャブ錠 20 mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は 武田薬品工業株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません 武田薬品工業株式会社 タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg
シプロフロキサシン錠 100mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを
 シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
あった AUCtはで ± ng hr/ml で ± ng hr/ml であった 2. バイオアベイラビリティの比較およびの薬物動態パラメータにおける分散分析の結果を Table 4 に示した また 得られた AUCtおよび Cmaxについてとの対数値
 モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能
 医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
審査報告書 平成 29 年 10 月 13 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] 1ネキシウムカプセル 10 mg 2 同カプセル 20 mg 3ネキシウム懸濁用顆粒分包 10 mg
![審査報告書 平成 29 年 10 月 13 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] 1ネキシウムカプセル 10 mg 2 同カプセル 20 mg 3ネキシウム懸濁用顆粒分包 10 mg 審査報告書 平成 29 年 10 月 13 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] 1ネキシウムカプセル 10 mg 2 同カプセル 20 mg 3ネキシウム懸濁用顆粒分包 10 mg](/thumbs/91/105640160.jpg) 審議結果報告書 平成 29 年 11 月 16 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] ネキシウムカプセル10mg 同カプセル20mg 同懸濁用顆粒分包 10mg 同懸濁用顆粒分包 20mg [ 一 般 名 ] エソメプラゾールマグネシウム水和物 [ 申請者名 ] アストラゼネカ株式会社 [ 申請年月日 ] 平成 28 年 12 月 20 日 [ 審議結果 ] 平成 29 年 11
審議結果報告書 平成 29 年 11 月 16 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] ネキシウムカプセル10mg 同カプセル20mg 同懸濁用顆粒分包 10mg 同懸濁用顆粒分包 20mg [ 一 般 名 ] エソメプラゾールマグネシウム水和物 [ 申請者名 ] アストラゼネカ株式会社 [ 申請年月日 ] 平成 28 年 12 月 20 日 [ 審議結果 ] 平成 29 年 11
用法・用量DB
 データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
改訂後 ( 下線 : 追加記載 ) 改訂前 用法 用量 用法 用量 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger Ellison 症候群 Ellison 症候群現行のとおり略 逆流性食道炎 逆流性食道炎現行のとおり略 非びらん性胃食道逆流
 適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 の一部変更承認に伴う 使用上の注意 改訂のお知らせ 2013 年 7 月 注 ) 注意 - 医師等の処方せんにより使用すること このたび 標記製品の 効能 効果 用法 用量 が一部変更承認されました それに伴い 関連する 使用上の注意 を下記のとおり改訂致しましたのでお知らせ申し上げます 本剤のご使用に際しましては 添付文書の各項を十分ご覧くださいますようお願い申し上げます
適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 の一部変更承認に伴う 使用上の注意 改訂のお知らせ 2013 年 7 月 注 ) 注意 - 医師等の処方せんにより使用すること このたび 標記製品の 効能 効果 用法 用量 が一部変更承認されました それに伴い 関連する 使用上の注意 を下記のとおり改訂致しましたのでお知らせ申し上げます 本剤のご使用に際しましては 添付文書の各項を十分ご覧くださいますようお願い申し上げます
スイッチ OTC 医薬品の候補となる成分についての要望 に対する見解 1. 要望内容に関連する事項 組織名日本消化器病学会 要望番号 H28-11 H28-12 H28-16 成分名 ( 一般名 ) オメプラゾール ランソプラゾール ラベプラゾールオメプラゾール : 胸やけ ( 胃酸の逆流 ) 胃痛
 スイッチ OTC 医薬品の候補となる成分についての要望 に対する見解 1. 要望内容に関連する事項 組織名日本消化器病学会 要望番号 H28-11 H28-12 H28-16 成分名 ( 一般名 ) オメプラゾール ランソプラゾール ラベプラゾールオメプラゾール : 胸やけ ( 胃酸の逆流 ) 胃痛 もたれ むかつき 要望内容 効能 効果 ランソプラゾール : 繰り返しおこる胸やけ ( 食道への胃酸の逆流
スイッチ OTC 医薬品の候補となる成分についての要望 に対する見解 1. 要望内容に関連する事項 組織名日本消化器病学会 要望番号 H28-11 H28-12 H28-16 成分名 ( 一般名 ) オメプラゾール ランソプラゾール ラベプラゾールオメプラゾール : 胸やけ ( 胃酸の逆流 ) 胃痛 もたれ むかつき 要望内容 効能 効果 ランソプラゾール : 繰り返しおこる胸やけ ( 食道への胃酸の逆流
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
医薬品の適正使用に欠かせない情報です
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 平成 25 年 7 月 プロトンポンプ阻害剤 処方せん医薬品注 ) 一般名 : ラベプラゾールナトリウム錠注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は弊社製品につきまして格別のお引立てを賜り 厚く御礼申し上げます この度平成 25
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 平成 25 年 7 月 プロトンポンプ阻害剤 処方せん医薬品注 ) 一般名 : ラベプラゾールナトリウム錠注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は弊社製品につきまして格別のお引立てを賜り 厚く御礼申し上げます この度平成 25
厚生労働省告示024号/平成22年1月22日告示/平成22年1月22日施行
 厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
ネキシウムに係る医薬品リスク管理計画書 (RMP) の概要 販売名 ネキシウム カプセル 10 mg 20mg ネキシウム 懸濁用顆粒分包 10mg 20mg 有効成分 エソメプラゾールマグネシウム水和物 製造販売業者アストラゼネカ株式会社薬効分類 提出年月 平成 30 年 10 月
 ネキシウム カプセル 10 mg ネキシウム カプセル 20 mg ネキシウム 懸濁用顆粒分包 10 mg ネキシウム 懸濁用顆粒分包 20 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はアストラゼネカ株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません アストラゼネカ株式会社 ネキシウムに係る医薬品リスク管理計画書 (RMP)
ネキシウム カプセル 10 mg ネキシウム カプセル 20 mg ネキシウム 懸濁用顆粒分包 10 mg ネキシウム 懸濁用顆粒分包 20 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はアストラゼネカ株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません アストラゼネカ株式会社 ネキシウムに係る医薬品リスク管理計画書 (RMP)
したことによると考えられています 4. ピロリ菌の検査法ピロリ菌の検査法にはいくつかの種類があり 内視鏡を使うものとそうでないものに大きく分けられます 前者は 内視鏡を使って胃の組織を採取し それを材料にしてピロリ菌の有無を調べます 胃粘膜組織を顕微鏡で見てピロリ菌を探す方法 ( 鏡検法 ) 先に述
 ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
Microsoft Word - LIA RMP_概要ver2.docx
 リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
<4D F736F F D208BA38D DA81458BA38D878AE98BC6838A E646F6378>
 平成 26 年 10 月 14 日 ジャディアンス錠 平成 25 年 10 月 8 日 ( 錠 25mg) 日本ベーリンガー 品目 10mg, 同錠 25mg 年月日 平成 25 年 12 月 13 日 ( 錠 10mg) 者名 インゲルハイム株式会社 薬事分科会審議参加規程における, 上記品目に係る競合品目, 競合企業及びその選定理由は以下のとおりです 競合品目 1 競合品目 2 競合品目 3 スーグラ錠
平成 26 年 10 月 14 日 ジャディアンス錠 平成 25 年 10 月 8 日 ( 錠 25mg) 日本ベーリンガー 品目 10mg, 同錠 25mg 年月日 平成 25 年 12 月 13 日 ( 錠 10mg) 者名 インゲルハイム株式会社 薬事分科会審議参加規程における, 上記品目に係る競合品目, 競合企業及びその選定理由は以下のとおりです 競合品目 1 競合品目 2 競合品目 3 スーグラ錠
患者 ID: 氏名 : ピロリ菌外来説明文書 1. ピロリ菌はいつ誰によって発見されたのでしょうかピロリ菌はオーストラリアのウォレンとマーシャルによって 1983 年ヒトの胃の中から発見されました その後 ピロリ菌がヒトの胃に与える様々な影響が解明
 ピロリ菌外来 についてのお知らせ ( 平成 21 年 11 月開設 ) 平成 21 年 11 月より当院消化器内科外来において 保険適応のない方についてピロリ菌の判定 除菌を目的とする ピロリ菌外来を実施してきましたが 平成 26 年 4 月からは 内視鏡検査を 6 ヶ月以内に行った方については 原則すべての患者において保険診療でピロリ菌の除菌ができるようになりました しかしながら 保険診療では除菌治療は
ピロリ菌外来 についてのお知らせ ( 平成 21 年 11 月開設 ) 平成 21 年 11 月より当院消化器内科外来において 保険適応のない方についてピロリ菌の判定 除菌を目的とする ピロリ菌外来を実施してきましたが 平成 26 年 4 月からは 内視鏡検査を 6 ヶ月以内に行った方については 原則すべての患者において保険診療でピロリ菌の除菌ができるようになりました しかしながら 保険診療では除菌治療は
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社 (TPC) 大阪市中央区道修町四丁目 1 番 1 号 治験課題名 : びらん性食道炎の患者を対象にした TAK-438 の 20 mg を 1 日 1 回経口投与したときの有効性及び安全性を 1 日 1 回経口投与
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
症例報告書の記入における注意点 1 必須ではない項目 データ 斜線を引くこと 未取得 / 未測定の項目 2 血圧平均値 小数点以下は切り捨てとする 3 治験薬服薬状況 前回来院 今回来院までの服薬状況を記載する服薬無しの場合は 1 日投与量を 0 錠 とし 0 錠となった日付を特定すること < 演習
 ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
目次 C O N T E N T S 1 下痢等の胃腸障害 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副
 目次 C O N T E N T S 1 下痢等の胃腸障害 3 1.1 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 5 1.2 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副作用発現状況 6 胃腸障害に関連する重篤な副作用発現症例 6 1.3 消化性潰瘍, 炎症性腸疾患等の胃腸疾患のある患者さんにおける安全性について
目次 C O N T E N T S 1 下痢等の胃腸障害 3 1.1 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 5 1.2 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副作用発現状況 6 胃腸障害に関連する重篤な副作用発現症例 6 1.3 消化性潰瘍, 炎症性腸疾患等の胃腸疾患のある患者さんにおける安全性について
[ 症例概要 ]( 国内自発報告 ) [ 症例 (1)] 患者 性 年齢男 90 代 使用理由 ( 合併症 ) 胃食道逆流性疾患 ( 高血圧 良性前立腺肥大症 心筋虚血 緑内障 ) 1 日投与量投与期間 20mg 不明 副作用 経過及び処置 2~3ヶ月前 A 院にてオメプラゾールから本剤へ切り替えた
 [ 症例 (1)] 患者 性 年齢男 90 代 使用理由 ( 合併症 ) 胃食道逆流性疾患 ( 高血圧 良性前立腺肥大症 心筋虚血 緑内障 ) 1 日投与量投与期間 20mg 不明 副作用 経過及び処置 2~3ヶ月前 A 院にてオメプラゾールから本剤へ切り替えた [ 症例概要 ]( 国内自発報告 ) [ 症例 (1)] 患者 性 年齢男 90 代 使用理由 ( 合併症 ) 胃食道逆流性疾患 ( 高血圧 良性前立腺肥大症 心筋虚血 緑内障 ) 1 日投与量投与期間 20mg 不明 副作用 経過及び処置 2~3ヶ月前 A 院にてオメプラゾールから本剤へ切り替えた](/thumbs/91/105029300.jpg) 医薬品の適正使用に欠かせない情報です 必ずお読み下さい プロトンポンプ インヒビター 2016 年 2 月 エソメプラゾールマグネシウム水和物カプセル この度 ネキシウムカプセルの 使用上の注意 を 厚生労働省医薬 生活衛生局安全対策課長通知 ( 平成 28 年 2 月 16 日 ) により改訂を行いましたので ご連絡申し上げます なお 新しい添付文書を封入した製品をお届けするのに日数を要すると存じますので
医薬品の適正使用に欠かせない情報です 必ずお読み下さい プロトンポンプ インヒビター 2016 年 2 月 エソメプラゾールマグネシウム水和物カプセル この度 ネキシウムカプセルの 使用上の注意 を 厚生労働省医薬 生活衛生局安全対策課長通知 ( 平成 28 年 2 月 16 日 ) により改訂を行いましたので ご連絡申し上げます なお 新しい添付文書を封入した製品をお届けするのに日数を要すると存じますので
<4D F736F F D20836C834C A A838B5F8AB38ED28CFC88E396F B A6D92E894C5816A2E646F6378>
 患者向医薬品ガイド 2018 年 1 月更新 ネキシウムカプセル 10mg ネキシウムカプセル 20mg この薬は? 販売名 一般名 含有量 (1 カプセル中 ) ネキシウムカプセル 10mg ネキシウムカプセル 20mg Nexium Capsules 10mg Nexium Capsules 20mg エソメプラゾールマグネシウム水和物 Esomeprazole Magnesium Hydrate
患者向医薬品ガイド 2018 年 1 月更新 ネキシウムカプセル 10mg ネキシウムカプセル 20mg この薬は? 販売名 一般名 含有量 (1 カプセル中 ) ネキシウムカプセル 10mg ネキシウムカプセル 20mg Nexium Capsules 10mg Nexium Capsules 20mg エソメプラゾールマグネシウム水和物 Esomeprazole Magnesium Hydrate
スライド 1
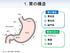 1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
記載データ一覧 品目名 製造販売業者 BE 品質再評価 1 マグミット錠 250mg 協和化学工業 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 # 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 # 5 酸化マグネシ
 医療用医薬品最新品質情報集 ( ブルーブック ) 2017.7.7 初版 有効成分 酸化マグネシウム 品目名 ( 製造販売業者 ) 1 マグミット錠 250mg 協和化学工業 後発医薬品 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 5 酸化マグネシウム錠 250mg ケンエー
医療用医薬品最新品質情報集 ( ブルーブック ) 2017.7.7 初版 有効成分 酸化マグネシウム 品目名 ( 製造販売業者 ) 1 マグミット錠 250mg 協和化学工業 後発医薬品 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 5 酸化マグネシウム錠 250mg ケンエー
テイカ製薬株式会社 社内資料
 テイカ製薬株式会社社内資料 アレルギー性結膜炎治療剤トラニラスト点眼液.5% TS TRANILAST Ophthalmic Solution.5% TS 生物学的同等性に関する資料 発売元 : 興和株式会社 製造販売元 : テイカ製薬株式会社 9 年 月作成 TSTR5BE9 ラット及びモルモットアレルギー性結膜炎モデルにおける生物学的同等性試験 Ⅰ. 試験の目的トラニラスト点眼液.5% TS および標準製剤の生物学的同等性をラット受動感作アレルギー性結膜炎モデル及びモルモット能動感作アレルギー性結膜炎モデルを用い薬力学的に検討した
テイカ製薬株式会社社内資料 アレルギー性結膜炎治療剤トラニラスト点眼液.5% TS TRANILAST Ophthalmic Solution.5% TS 生物学的同等性に関する資料 発売元 : 興和株式会社 製造販売元 : テイカ製薬株式会社 9 年 月作成 TSTR5BE9 ラット及びモルモットアレルギー性結膜炎モデルにおける生物学的同等性試験 Ⅰ. 試験の目的トラニラスト点眼液.5% TS および標準製剤の生物学的同等性をラット受動感作アレルギー性結膜炎モデル及びモルモット能動感作アレルギー性結膜炎モデルを用い薬力学的に検討した
p 13
 p 12 p 13 p 14 p 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 10. 安全性 (1) 副作用 ( 臨床検査値異常を含む ) 総症例 1030 例中 副作用が報告されたのは 519 例 (50.4%) でした 主な症状は鼓腸 197 例 (19.1%) 下痢 188 例 (18.3%) 腹部膨満
p 12 p 13 p 14 p 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 10. 安全性 (1) 副作用 ( 臨床検査値異常を含む ) 総症例 1030 例中 副作用が報告されたのは 519 例 (50.4%) でした 主な症状は鼓腸 197 例 (19.1%) 下痢 188 例 (18.3%) 腹部膨満
医療用医薬品最新品質情報集 ( ブルーブック ) 初版 有効成分 ニカルジピン塩酸塩 品目名 ( 製造販売業者 ) 1 ニカルジピン塩酸塩徐放カプセル20mg 日医工 日医工 後発医薬品 2 ニカルジピン塩酸塩徐放カプセル40mg 日医工 日医工 品目名 ( 製造販売業者 )
 医療用医薬品最新品質情報集 ( ブルーブック ) 2018.10.25 初版 有効成分 ニカルジピン塩酸塩 品目名 ( 製造販売業者 ) 1 ニカルジピン塩酸塩徐放カプセル20mg 日医工 日医工 後発医薬品 2 ニカルジピン塩酸塩徐放カプセル40mg 日医工 日医工 品目名 ( 製造販売業者 ) 1 ペルジピンLAカプセル20mg アステラス製薬 先発医薬品 2 ペルジピンLAカプセル40mg アステラス製薬
医療用医薬品最新品質情報集 ( ブルーブック ) 2018.10.25 初版 有効成分 ニカルジピン塩酸塩 品目名 ( 製造販売業者 ) 1 ニカルジピン塩酸塩徐放カプセル20mg 日医工 日医工 後発医薬品 2 ニカルジピン塩酸塩徐放カプセル40mg 日医工 日医工 品目名 ( 製造販売業者 ) 1 ペルジピンLAカプセル20mg アステラス製薬 先発医薬品 2 ペルジピンLAカプセル40mg アステラス製薬
より詳細な情報を望まれる場合は 担当の医師または薬剤師におたずねください また 患者向医薬品ガイド 医療専門家向けの 添付文書情報 が医薬品医療機器総合機構のホームページに掲載されています
 くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ
![審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ 審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ](/thumbs/92/110667825.jpg) 審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
目次 頁 目次... 2 略語及び専門用語一覧表 製品開発の根拠 はじめに 予定する効能 効果及び用法 用量 薬剤の概要 薬剤開発に至った科学的背景
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.5 臨床に関する概括評価 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 目次 頁 目次... 2 略語及び専門用語一覧表... 5 2.5.1 製品開発の根拠...
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.5 臨床に関する概括評価 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 目次 頁 目次... 2 略語及び専門用語一覧表... 5 2.5.1 製品開発の根拠...
2000年7月作成(新様式第1版)
 2015 年 10 月改訂 ( 第 3 版 ) 日本標準商品分類番号 872399 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 剤 形 2.5mg: 白色のフィルムコーティング錠 5mg: 白色の割線入りフィルムコーティング錠 製剤の規制区分 規格 含量 一般名 製造販売承認年月日薬価基準収載 発売年月日 開発 製造販売 ( 輸入 ) 提携 販売会社名
2015 年 10 月改訂 ( 第 3 版 ) 日本標準商品分類番号 872399 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 剤 形 2.5mg: 白色のフィルムコーティング錠 5mg: 白色の割線入りフィルムコーティング錠 製剤の規制区分 規格 含量 一般名 製造販売承認年月日薬価基準収載 発売年月日 開発 製造販売 ( 輸入 ) 提携 販売会社名
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
150800247.indd
 ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
301226更新 (薬局)平成29 年度に実施した個別指導指摘事項(溶け込み)
 平成 29 年度に実施した個別指導において保険薬局に改善を求めた主な指摘事項 東海北陸厚生局 目次 Ⅰ 調剤全般に関する事項 1 処方せんの取扱い 1 2 処方内容に関する薬学的確認 1 3 調剤 1 4 調剤済処方せんの取扱い 1 5 調剤録等の取扱い 2 Ⅱ 調剤技術料に関する事項 1 調剤料 2 2 一包化加算 2 3 自家製剤加算 2 Ⅲ 薬剤管理料に関する事項 1 薬剤服用歴管理指導料 2
平成 29 年度に実施した個別指導において保険薬局に改善を求めた主な指摘事項 東海北陸厚生局 目次 Ⅰ 調剤全般に関する事項 1 処方せんの取扱い 1 2 処方内容に関する薬学的確認 1 3 調剤 1 4 調剤済処方せんの取扱い 1 5 調剤録等の取扱い 2 Ⅱ 調剤技術料に関する事項 1 調剤料 2 2 一包化加算 2 3 自家製剤加算 2 Ⅲ 薬剤管理料に関する事項 1 薬剤服用歴管理指導料 2
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
<4D F736F F D20836C834C E8F797B15F8AB38ED28CFC88E396F B C45F CE38A6D92E894C52E646F6378>
 ネキシウム懸濁用顆粒分包 10mg ネキシウム懸濁用顆粒分包 20mg 患者向医薬品ガイド 2018 年 1 月作成 この薬は? 販売名 一般名 含有量 (1 包中 ) ネキシウム懸濁用顆粒分包 10mg Nexium Granules for Suspension 10mg ネキシウム懸濁用顆粒分包 20mg Nexium Granules for Suspension 20mg エソメプラゾールマグネシウム水和物
ネキシウム懸濁用顆粒分包 10mg ネキシウム懸濁用顆粒分包 20mg 患者向医薬品ガイド 2018 年 1 月作成 この薬は? 販売名 一般名 含有量 (1 包中 ) ネキシウム懸濁用顆粒分包 10mg Nexium Granules for Suspension 10mg ネキシウム懸濁用顆粒分包 20mg Nexium Granules for Suspension 20mg エソメプラゾールマグネシウム水和物
**2016 年 10 月改訂 ( 第 25 版 ) *2016 年 4 月改訂 日本標準商品分類番号 プロトンポンプ インヒビター日本薬局方オメプラゾール腸溶錠 処方箋医薬品注 ) 貯法 : 室温保存 ( 開封後は湿気を避けて保存すること ) 使用期限 : 3 年 ( 外箱に表示 )
 2016 年 10 月改訂 ( 第 25 版 ) *2016 年 4 月改訂 日本標準商品分類番号 872329 プロトンポンプ インヒビター日本薬局方オメプラゾール腸溶錠 処方箋医薬品注 ) 貯法 : 室温保存 ( 開封後は湿気を避けて保存すること ) 使用期限 : 3 年 ( 外箱に表示 ) 注 ) 注意 - 医師等の処方箋により使用すること 錠 10mg 錠 20mg 承認番号 22400AMX00130
2016 年 10 月改訂 ( 第 25 版 ) *2016 年 4 月改訂 日本標準商品分類番号 872329 プロトンポンプ インヒビター日本薬局方オメプラゾール腸溶錠 処方箋医薬品注 ) 貯法 : 室温保存 ( 開封後は湿気を避けて保存すること ) 使用期限 : 3 年 ( 外箱に表示 ) 注 ) 注意 - 医師等の処方箋により使用すること 錠 10mg 錠 20mg 承認番号 22400AMX00130
IF 利 用 の 手 引 きの 概 要 日 本 病 院 薬 剤 師 会 1. 医 薬 品 インタビューフォーム 作 成 の 経 緯 医 療 用 医 薬 品 の 基 本 的 な 要 約 情 報 として 医 療 用 医 薬 品 添 付 文 書 ( 以 下 添 付 文 書 と 略 す)がある 医 療 現
 2016 年 2 月 ( 第 10 版 ) 日 本 標 準 商 品 分 類 番 号 872329 医 薬 品 インタビューフォーム 日 本 病 院 薬 剤 師 会 の IF 記 載 要 領 2008 に 準 拠 して 作 成 剤 形 腸 溶 性 顆 粒 を 充 てんしたカプセル 剤 製 剤 の 規 制 区 分 処 方 箋 医 薬 品 ( 注 意 医 師 等 の 処 方 箋 により 使 用 すること)
2016 年 2 月 ( 第 10 版 ) 日 本 標 準 商 品 分 類 番 号 872329 医 薬 品 インタビューフォーム 日 本 病 院 薬 剤 師 会 の IF 記 載 要 領 2008 に 準 拠 して 作 成 剤 形 腸 溶 性 顆 粒 を 充 てんしたカプセル 剤 製 剤 の 規 制 区 分 処 方 箋 医 薬 品 ( 注 意 医 師 等 の 処 方 箋 により 使 用 すること)
ヒアルロン酸ナトリウム架橋体製剤 特定使用成績調査
 ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
 医薬品の使用上の注意の改訂について ( 平成 14 年 6 月 5 日 ) ( 医薬安発第 0605002 号 ) ( 各都道府県衛生主管部 ( 局 ) 長あて厚生労働省医薬局安全対策課長通知 ) 医薬品の安全対策については 日頃よりご尽力いただいているところでありますが 今般 別添のとおり日本製薬団体連合会安全性委員会委員長あて通知及び連絡したので ご承知願います 医薬品の使用上の注意の改訂について
医薬品の使用上の注意の改訂について ( 平成 14 年 6 月 5 日 ) ( 医薬安発第 0605002 号 ) ( 各都道府県衛生主管部 ( 局 ) 長あて厚生労働省医薬局安全対策課長通知 ) 医薬品の安全対策については 日頃よりご尽力いただいているところでありますが 今般 別添のとおり日本製薬団体連合会安全性委員会委員長あて通知及び連絡したので ご承知願います 医薬品の使用上の注意の改訂について
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7
![審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7 審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7](/thumbs/92/110490968.jpg) 審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
(3) 摂取する上での注意事項 ( 該当するものがあれば記載 ) 機能性関与成分と医薬品との相互作用に関する情報を国立健康 栄養研究所 健康食品 有効性 安全性データベース 城西大学食品 医薬品相互作用データベース CiNii Articles で検索しました その結果 検索した範囲内では 相互作用
 販売しようとする機能性表示食品の科学的根拠等に関する基本情報 ( 一般消費者向け ) 商品名蹴脂粒食品の区分 加工食品 ( サプリメント形状 その他 ) 生鮮食品機能性関与成分名キトグルカン ( エノキタケ抽出物 ) 表示しようとする機能性本品はキトグルカン ( エノキタケ抽出物 ) を配合しており 体脂肪 ( 内臓脂肪 ) を減少させる働きがあります 体脂肪が気になる方 肥満気味の方に適しています
販売しようとする機能性表示食品の科学的根拠等に関する基本情報 ( 一般消費者向け ) 商品名蹴脂粒食品の区分 加工食品 ( サプリメント形状 その他 ) 生鮮食品機能性関与成分名キトグルカン ( エノキタケ抽出物 ) 表示しようとする機能性本品はキトグルカン ( エノキタケ抽出物 ) を配合しており 体脂肪 ( 内臓脂肪 ) を減少させる働きがあります 体脂肪が気になる方 肥満気味の方に適しています
Microsoft PowerPoint - 薬物療法専門薬剤師制度_症例サマリー例_HP掲載用.pptx
 薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
Microsoft PowerPoint - __________________________ ppt
 日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
Microsoft Word - 新薬123(2018.4).doc
 新薬情報 平成 30 年 4 月 18 日付内用薬 12 品目 外用薬 2 品目 注射薬 8 品目が薬価収載されました [ 内用薬 ] は最小包装単位 [ 新医薬品情報 ] 2018.5.1 薬効分類番号 商品名 ( 社名 ) 薬価 成分 含量 ホンタイ識別コード * 効能 効果 / 用法 用量 117 レキサルティ錠 1mg 268.90 ブレクスピプラゾール1mg/ 錠 BRX1 レキサルティ錠
新薬情報 平成 30 年 4 月 18 日付内用薬 12 品目 外用薬 2 品目 注射薬 8 品目が薬価収載されました [ 内用薬 ] は最小包装単位 [ 新医薬品情報 ] 2018.5.1 薬効分類番号 商品名 ( 社名 ) 薬価 成分 含量 ホンタイ識別コード * 効能 効果 / 用法 用量 117 レキサルティ錠 1mg 268.90 ブレクスピプラゾール1mg/ 錠 BRX1 レキサルティ錠
301128_課_薬生薬審発1128第1号_ニボルマブ(遺伝子組換え)製剤の最適使用推進ガイドラインの一部改正について
 薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
恩賜第 42 回社会福祉法人財団済生会中央治験審査委員会 会議の記録の概要 開催日時 平成 28 年 1 月 13 日 ( 水 )15:30~17:17 開催場所 出席委員名 東京都港区三田 三田国際ビル 21 階 社会福祉法人 恩賜財団済生会本部事務局中会議室 豊島
 恩賜第 42 回社会福祉法人財団済生会中央治験審査委員会 会議の記録の概要 開催日時 平成 28 年 1 月 13 日 ( 水 )15:30~17:17 開催場所 出席委員名 108-0073 東京都港区三田 1-4-28 三田国際ビル 21 階 社会福祉法人 恩賜財団済生会本部事務局中会議室 豊島聰 ( 出席 ) 委員長林茂樹 ( 出席 ) 副委員長 市場みすゞ ( 出席 ) 漆原尚巳 ( 出席
恩賜第 42 回社会福祉法人財団済生会中央治験審査委員会 会議の記録の概要 開催日時 平成 28 年 1 月 13 日 ( 水 )15:30~17:17 開催場所 出席委員名 108-0073 東京都港区三田 1-4-28 三田国際ビル 21 階 社会福祉法人 恩賜財団済生会本部事務局中会議室 豊島聰 ( 出席 ) 委員長林茂樹 ( 出席 ) 副委員長 市場みすゞ ( 出席 ) 漆原尚巳 ( 出席
Microsoft Word - sa_niflec_ doc
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
改訂の理由及び調査の結果直近 3 年度の国内副作用症例の集積状況 転帰死亡症例 アモキシシリン水和物及びクラブラン酸カリウム アモキシシリン水和物の国内症例が集積したことから 専門委員の意見も踏まえた調査の結果 改訂することが適切と判断した 血小板減少関連症例 1 アモキシシリン水和物 3 例 (
 アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1
 医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1 顆粒球コロニー刺激因子 (Granulocyte Colony-Stimulating Factor: G-CSF) 一般名 : フィルグラスチム 調達法 国内企業より無償提供 製造元または供給元の名称協和発酵キリン
医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1 顆粒球コロニー刺激因子 (Granulocyte Colony-Stimulating Factor: G-CSF) 一般名 : フィルグラスチム 調達法 国内企業より無償提供 製造元または供給元の名称協和発酵キリン
ソフティア点眼液0.02%
 2018 年 12 月改訂 [ 第 6 版 ] 日本標準商品分類番号 871319 医薬品インタビューフォーム日本病院薬剤師会のIF 記載要領 2013に準拠して作成 剤形水性点眼剤 製剤の規制区分 規格 含量 1mL 中シアノコバラミン 0.2 mg含有 一般名製造販売承認年月日薬価基準収載 発売年月日開発 製造販売 ( 輸入 ) 提携 販売会社名 和名 : シアノコバラミン (JAN) 洋名 :Cyanocobalamin
2018 年 12 月改訂 [ 第 6 版 ] 日本標準商品分類番号 871319 医薬品インタビューフォーム日本病院薬剤師会のIF 記載要領 2013に準拠して作成 剤形水性点眼剤 製剤の規制区分 規格 含量 1mL 中シアノコバラミン 0.2 mg含有 一般名製造販売承認年月日薬価基準収載 発売年月日開発 製造販売 ( 輸入 ) 提携 販売会社名 和名 : シアノコバラミン (JAN) 洋名 :Cyanocobalamin
審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開
![審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開 審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開](/thumbs/53/31072016.jpg) 審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
 2016 年 7 月改訂 新様式第 3 版 日本標準商品分類番号 872454 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 合成副腎皮質ホルモン剤 剤 形 懸濁注射液 製 剤 の 規 制 区 分 処方箋医薬品 規 量 筋注用関節腔内用 1mL 中にトリアムシノロンアセトニド 40mg 含有 皮内用関節腔内用 1mL 中にトリアムシノロンアセトニド 10mg
2016 年 7 月改訂 新様式第 3 版 日本標準商品分類番号 872454 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 合成副腎皮質ホルモン剤 剤 形 懸濁注射液 製 剤 の 規 制 区 分 処方箋医薬品 規 量 筋注用関節腔内用 1mL 中にトリアムシノロンアセトニド 40mg 含有 皮内用関節腔内用 1mL 中にトリアムシノロンアセトニド 10mg
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
オメプラゾール錠「アメル」
 **2018 年 10 月改訂 ( 第 18 版 ) *2017 年 9 月改訂 規制区分 : 処方箋医薬品注意 - 医師等の処方箋により使用すること プロトンポンプ インヒビター 日本薬局方オメプラゾール腸溶錠 日本標準商品分類番号 872329 貯法 : 気密容器 室温保存 ( 開封後は湿気を避けて保存すること ) 使用期限 : 包装箱 ラベルに表示 使用期限を過ぎた製品は使用しないこと OMEPRAZOLE
**2018 年 10 月改訂 ( 第 18 版 ) *2017 年 9 月改訂 規制区分 : 処方箋医薬品注意 - 医師等の処方箋により使用すること プロトンポンプ インヒビター 日本薬局方オメプラゾール腸溶錠 日本標準商品分類番号 872329 貯法 : 気密容器 室温保存 ( 開封後は湿気を避けて保存すること ) 使用期限 : 包装箱 ラベルに表示 使用期限を過ぎた製品は使用しないこと OMEPRAZOLE
先発品とのの相違の一覧 エダラボン点滴静注 30mg 杏林 エダラボン点滴静注 30mg 杏林 脳梗塞急性期に伴う神経症候 日常生活動作障害 機能障害の改善 通常 成人に 1 回 1 管 ( エダラボンとして 30mg) を適当量の生理食塩液等で用時希釈し 30 分かけて 1 日朝夕 2 回の点滴静
 先発品とのの相違の一覧 ( ご注意 ) 赤字は 先発品と異なる です この一覧に掲載している項目は 主に です その他使用上の注意などにつきましては 各製品の添付文書をご参照下さい 用語や文面など 一部異なる場合があります 詳細は各製品の添付文書ご参照ください 2018 年 4 月 4 日 アリピプラゾール OD 錠 3mg/6mg/12mg 杏林 アリピプラゾール OD 錠 3mg 杏林 アリピプラゾール
先発品とのの相違の一覧 ( ご注意 ) 赤字は 先発品と異なる です この一覧に掲載している項目は 主に です その他使用上の注意などにつきましては 各製品の添付文書をご参照下さい 用語や文面など 一部異なる場合があります 詳細は各製品の添付文書ご参照ください 2018 年 4 月 4 日 アリピプラゾール OD 錠 3mg/6mg/12mg 杏林 アリピプラゾール OD 錠 3mg 杏林 アリピプラゾール
区分商品名規格単位薬価 ( 円 ) 包装単位製造販売成分名効能 効果用法 用量規制等承認年月日備考 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger-Ellison 症候群ネキシウム懸濁用顆粒分包 10mg1 包 円 28 包アストラゼネエソメプラ 胃潰瘍 十二指腸潰処方 新用量 剤
 新医薬品が薬価収載されましたのでお知らせいたします 区分 商品名 規格単位 薬価 ( 円 ) 包装単位 製造販売 成分名 効能 効果 用法 用量 規制等 承認年月日 備考 レキサルティ錠 1mg 1mg1 錠 268.90 円 [PTP]100 錠 10) 500 錠 50) [ プラスチックボトル ] 500 錠 1,000 錠 大塚製薬 ブレクスピプラゾール 統合失調症 通常 成人にはブレクスピプラゾールとして1
新医薬品が薬価収載されましたのでお知らせいたします 区分 商品名 規格単位 薬価 ( 円 ) 包装単位 製造販売 成分名 効能 効果 用法 用量 規制等 承認年月日 備考 レキサルティ錠 1mg 1mg1 錠 268.90 円 [PTP]100 錠 10) 500 錠 50) [ プラスチックボトル ] 500 錠 1,000 錠 大塚製薬 ブレクスピプラゾール 統合失調症 通常 成人にはブレクスピプラゾールとして1
食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり
![食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり 食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり](/thumbs/91/105740782.jpg) くすりのしおり内服剤 2013 年 11 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : グラクティブ錠 12.5mg 主成分 : シタグリプチンリン酸塩水和物 (Sitagliptin phosphate hydrate) 剤形
くすりのしおり内服剤 2013 年 11 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : グラクティブ錠 12.5mg 主成分 : シタグリプチンリン酸塩水和物 (Sitagliptin phosphate hydrate) 剤形
ランソプラゾールOD錠15mg「テバ」/ランソプラゾールOD錠30mg「テバ」
 印 :2017 年 10 月改訂 ( 第 18 版 ) 印 :2017 年 4 月改訂 貯法 : 室温保存 ( 開封後は湿気を避けて保存すること ) 使用期限 : 外装に表示の使用期限内に使用すること 注意 : の項参照規制区分 : 処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 腸溶性口腔内崩壊錠 15mg 日本標準商品分類番号 872329 30mg 承認番号 22600AMX00160000
印 :2017 年 10 月改訂 ( 第 18 版 ) 印 :2017 年 4 月改訂 貯法 : 室温保存 ( 開封後は湿気を避けて保存すること ) 使用期限 : 外装に表示の使用期限内に使用すること 注意 : の項参照規制区分 : 処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 腸溶性口腔内崩壊錠 15mg 日本標準商品分類番号 872329 30mg 承認番号 22600AMX00160000
た 18 歳以上の AD/HD 患者を対象に 日本人を含むアジア人によるプラセボ対照二重盲検比較試験及びその長期継続投与試験が現在実施されており 本剤の製造販売者によれば これらの試験成績に基づき 本剤の成人期 AD/HD 患者への追加適応に関する承認事項一部変更承認申請が行われる予定とされている
 ( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全性検討事項 重要な特定されたリスク 頁 重要な潜在
 アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
<4D F736F F F696E74202D208E7396AF835A837E B814088DD82AA82F1975C966882C68C9F D838A8BDB82C682CC90ED82A >
 胃がん予防と検診 ピロリ菌との戦い けいあいクリニックク木村正之 2012.01.21 横浜市民セミナー 本日の内容 ピロリ菌の発見 ピロリ菌の感染 ピロリ菌の特徴 ピロリ菌の検査方法 ピロリ菌と胃の病気 ピロリ菌の治療 ( 除菌治療 ) 胃がんの予防 ピロリ菌の発見 細菌は胃内に棲息できない? 胃の中に細菌がすみつくことはありえるのだろうか? ピロリ菌って ピロリ菌の正式名 : ヘリコバクターピロリHelicobacter
胃がん予防と検診 ピロリ菌との戦い けいあいクリニックク木村正之 2012.01.21 横浜市民セミナー 本日の内容 ピロリ菌の発見 ピロリ菌の感染 ピロリ菌の特徴 ピロリ菌の検査方法 ピロリ菌と胃の病気 ピロリ菌の治療 ( 除菌治療 ) 胃がんの予防 ピロリ菌の発見 細菌は胃内に棲息できない? 胃の中に細菌がすみつくことはありえるのだろうか? ピロリ菌って ピロリ菌の正式名 : ヘリコバクターピロリHelicobacter
Microsoft Word _2180AMY10104_K104_1.doc
 アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
年 月改訂(第 版)
 2016 年 10 月改訂 ( 第 10 版 ) 日本標準商品分類番号 873133 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 パンテチン製剤 パンテチン散 20% テバ Pantethine Powder 20% TEVA 剤形散剤 製剤の規制区分 規格 含量 1g 中日局パンテチン 200mg( 脱水物として ) 含有 一般名 和名 : パンテチン
2016 年 10 月改訂 ( 第 10 版 ) 日本標準商品分類番号 873133 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2013 に準拠して作成 パンテチン製剤 パンテチン散 20% テバ Pantethine Powder 20% TEVA 剤形散剤 製剤の規制区分 規格 含量 1g 中日局パンテチン 200mg( 脱水物として ) 含有 一般名 和名 : パンテチン
医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など ) 医薬品候補物質のスクリーニン
 特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
未承認の医薬品又は適応の承認要望に関する意見募集について
 ( 別添様式 1-1) 未承認薬の要望 要望者 日本てんかん学会 優先順位 2 位 ( 全 12 要望中 ) 医薬品名 成分名 ルフィナマイド 販売名 Inovelon( 欧州 ) Banzel( 米国 ) 会社名 エーザイ 承認国 欧州 29 カ国 ( 英国 独国 仏国を含む ) 米国 効能 効果 レノックス ガストー症候群 (4 歳以上 ) に伴う発作に対する併用 療法 用法 用量 欧州 小児患者
( 別添様式 1-1) 未承認薬の要望 要望者 日本てんかん学会 優先順位 2 位 ( 全 12 要望中 ) 医薬品名 成分名 ルフィナマイド 販売名 Inovelon( 欧州 ) Banzel( 米国 ) 会社名 エーザイ 承認国 欧州 29 カ国 ( 英国 独国 仏国を含む ) 米国 効能 効果 レノックス ガストー症候群 (4 歳以上 ) に伴う発作に対する併用 療法 用法 用量 欧州 小児患者
糖尿病経口薬 QOL 研究会研究 1 症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12
 症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12 患者背景同意取得時から試験開始までの状況について記入 性別 男 女 年齢生年月日 歳 西暦年月日 身長. cm 体重. kg 腹囲. cm 糖尿病罹病期間 西暦年月 ~ 現在 喫煙 合併症 あり なし飲酒 あり
症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12 患者背景同意取得時から試験開始までの状況について記入 性別 男 女 年齢生年月日 歳 西暦年月日 身長. cm 体重. kg 腹囲. cm 糖尿病罹病期間 西暦年月 ~ 現在 喫煙 合併症 あり なし飲酒 あり
untitled
 1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
ランソプラゾールOD錠15mg「武田テバ」/ランソプラゾールOD錠30mg「武田テバ」
 作成年月 :2018 年 2 月 ( 第 1 版 ) 貯法 : 室温保存使用期限 : 外装に表示の使用期限内に使用すること ( 使用期限内であっても開封後はなるべく速やかに使用すること ) 規制区分 : 処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 日本標準商品分類番号 872329 15mg 30mg 承認番号 23000AMX00200000 23000AMX00201000
作成年月 :2018 年 2 月 ( 第 1 版 ) 貯法 : 室温保存使用期限 : 外装に表示の使用期限内に使用すること ( 使用期限内であっても開封後はなるべく速やかに使用すること ) 規制区分 : 処方箋医薬品 ( 注意 - 医師等の処方箋により使用すること ) 日本標準商品分類番号 872329 15mg 30mg 承認番号 23000AMX00200000 23000AMX00201000
IF 利用の手引きの概要 - 日本病院薬剤師会 - 1. 医薬品インタビューフォーム作成の経緯当該医薬品について製薬企業の医薬情報担当者 ( 以下 MR と略す ) 等にインタビューし 当該医薬品の評価を行うのに必要な医薬品情報源として使われていたインタビューフォームを 昭和 63 年日本病院薬剤師
 2016 年 12 月改訂 ( 第 3 版 ) 日本標準商品分類番号 875200 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 (1998 年 9 月 ) に準拠して作成 漢方製剤 ジュンコウ桂枝茯苓丸料 FC エキス細粒医療用 JUNKOU Keishibukuryoganryo FC Extract Fine Granules for Ethical Use 剤形散剤 ( 細粒
2016 年 12 月改訂 ( 第 3 版 ) 日本標準商品分類番号 875200 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 (1998 年 9 月 ) に準拠して作成 漢方製剤 ジュンコウ桂枝茯苓丸料 FC エキス細粒医療用 JUNKOU Keishibukuryoganryo FC Extract Fine Granules for Ethical Use 剤形散剤 ( 細粒
Microsoft Word - MMD配合散IF201212改訂.doc
 2012 年 12 月改訂 2010 年 1 月作成 日本標準商品分類番号 872339 ドラッグインフォメーション 健胃消化剤規制区分 : 普通薬 MMD 配合散 剤形 散剤 規格 含量 1 日分 (3.9g) につきでんぷん糊精化力として 900 ~1400 単位 定量するとき 表示量の 95~110% に対応する炭酸水素ナトリウムを含む 一般名 ビオヂアスターゼ 炭酸水素ナトリウム ゲンチアナ末合剤
2012 年 12 月改訂 2010 年 1 月作成 日本標準商品分類番号 872339 ドラッグインフォメーション 健胃消化剤規制区分 : 普通薬 MMD 配合散 剤形 散剤 規格 含量 1 日分 (3.9g) につきでんぷん糊精化力として 900 ~1400 単位 定量するとき 表示量の 95~110% に対応する炭酸水素ナトリウムを含む 一般名 ビオヂアスターゼ 炭酸水素ナトリウム ゲンチアナ末合剤
2010年12月改訂(第2版)
 2012 年 10 月改訂 ( 第 7 版 ) 日本標準商品分類番号 872329 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2008 に準拠して作成 プロトンポンプ インヒビター ラベプラゾール Na 錠 10mg 興和テバ ラベプラゾール Na 錠 20mg 興和テバ Rabeprazole Na Tab. 10mg 20mg TEVA-KOWA 剤形腸溶フィルムコーティング錠
2012 年 10 月改訂 ( 第 7 版 ) 日本標準商品分類番号 872329 医薬品インタビューフォーム 日本病院薬剤師会の IF 記載要領 2008 に準拠して作成 プロトンポンプ インヒビター ラベプラゾール Na 錠 10mg 興和テバ ラベプラゾール Na 錠 20mg 興和テバ Rabeprazole Na Tab. 10mg 20mg TEVA-KOWA 剤形腸溶フィルムコーティング錠
