試験実施者 ( 企業名 ) 商品名 試験結果の概要 武田薬品工業株式会社 インフルエンザワクチン ( 開発コード :TAK-850) 有効成分名 A/H1N1/California/07/ A/H3N2/Victoria/361/ 試験の名称 試験実施医療機関及び試験責任医師
|
|
|
- きゅうた かたづ
- 5 years ago
- Views:
Transcription
1 試験実施者 ( 企業名 ) 商品名 試験結果の概要 武田薬品工業株式会社 インフルエンザワクチン ( 開発コード :TAK-850) 有効成分名 A/H1N1/California/07/ A/H3N2/Victoria/361/ 試験の名称 試験実施医療機関及び試験責任医師名 公表文献 ( 本試験結果の報告文献 ) 試験期間 ( 最初の被験者の同意取得日 ~ 最後の被験者の治療期終了日試験のフェーズ 試験の目的 試験の方法 被験者数 B/Hubei-Wujiagang/158/2009 [ 各株の赤血球凝集素 (HA) 含量は 1 株当たり 15μg] 健康成人男女を対象に TAK-850 を単回筋肉内接種した場合の 安全性及び免疫原性を検討するための第 1/2 相非盲検試験 1 医療機関及び 1 名の治験責任医師 なし 2014 年 3 月 23 日 ~2014 年 4 月 15 日 第 1/2 相 日本人の健康成人男女を対象として TAK-850 の単回筋肉内接種時の安全性及び免疫原性を検討する 本治験は 日本人の健康成人男女を対象とした TAK-850 の第 1/2 相単回筋肉内接種試験であり TAK-850(0.5 ml) を上腕三角筋に単回で筋肉内接種した際の安全性及び免疫原性を非盲検試験により検討した 治験は以下に示す治験デザイン ( 来院スケジュール ) の概略に従って実施した 治験薬接種日 (Day 1 Visit 1) に被験者の適格性判定を行った 治験薬接種前に検査及び免疫原性評価のための採血を実施した後に 治験薬を筋肉内接種し 接種後 30 分間は医療機関にて検査 観察を行った 被験者に被験者日誌を交付し 接種日を含め接種後 7 日間 ( Day 1~Day 7) 体温( 口腔温 ) 全身症状及び注射部位反応等について記録するよう指示した 接種 7 日後 ( 許容範囲 :+ 2 日 ) に来院し (Day 8 Visit 2) 検査 観察及び被験者日誌の回収 評価を行った 被験者に新たな被験者日誌を交付し 次回来院までの間 (Day 8 来院後 ~Day 22 来院前 ) 有害事象等について記録するよう指示した 接種 21 日後 ( 許容範囲 :± 2 日 ) に来院し (Day 22 Visit 3) 検査 観察 被験者日誌の回収 評価及び免疫原性評価のための採血を実施し 治験終了とした 計画時
2 ( 計画時 解析時 ) TAK-850(0.5 ml) 筋肉内接種群 :55 例 対象基準 解析時 TAK-850(0.5 ml) 筋肉内接種群 :55 例最大の解析対象集団 (FAS): 合計 55 例安全性データの解析対象集団 : 合計 55 例 < 対象 > < 主な選択基準 > 1) 治験の内容を理解し それを遵守する能力があると治験責任医師又は治験分担医師が判断した者 2) 治験手順が行われる前に 同意 説明文書に被験者による署名及び日付記入ができる者 3) 日本人の健康成人男女 4) 同意取得時に 20 歳以上 49 歳以下である者 5) 適格性判定時にBMIが 18.5 kg/m 2 以上 25.0 kg/m 2 以下である者 6) 避妊治療を受けていない男性パートナーを持つ 妊娠する可能性のある女性の場合 同意取得時から治験期間を通して 日常的に適切な避妊の実施に同意する者 < 主な除外基準 > 1) 治験薬接種前 4 ヵ月以内に他の治験薬の投与を受けた者 2) 治験薬接種前 6 ヵ月以内に季節性インフルエンザワクチンの接種を受けた者 3) 治験薬接種前 6 ヵ月以内にインフルエンザに罹患した者 4) 治験実施医療機関の従業員 その家族 又は本治験の実施に関わる治験実施医療機関の従業員と依存した関係にある者 ( 例 : 夫婦 親 子供 兄弟姉妹 ) 若しくは強制の下に同意するおそれがある者 5) コントロール不良かつ臨床的に問題のある神経 循環器 肺 肝 腎 代謝 消化器 泌尿器又は内分泌疾患若しくはその他の異常を有しており 治験参加や治験結果に影響を与える可能性がある者 6) 治験薬接種日の接種前の検査で口腔温が 37.5 C 以上である者 7) 過去に免疫不全の診断がなされている 又は疑われる者 8) 易感染性状態又は疾患のある 若しくは免疫反応に影響を及ぼす可能性のある治療を現在受けている又は治験薬接種前 30 日以内に受けた者 可能性のある治療には以下が含まれるが これに限るものではない : 全身性コルチコステロイド剤又は高用量の吸入コルチコステロイド剤 ( ジプロピ
3 オン酸ベクロメタゾン 800 μg/ 日超若しくは相当量 これを超えないステロイドの吸入及び経鼻使用は可 ) 放射線療法 その他の免疫抑制剤 若しくは細胞傷害性薬剤 9) 治験薬接種前 4 時間以内に解熱剤を使用した者 10) ギラン バレー症候群又は脱髄性疾患 急性散在性脳脊髄炎 (ADEM) 多発性硬化症を含む 又は痙攣の既往歴のある者 11) 機能的又は解剖学的無脾症である者 12) 注射部位反応の評価に影響を及ぼす可能性がある発疹 その他皮膚症状 又は刺青がある者 13) B 型肝炎ウイルス (HBsAg) C 型肝炎ウイルス (HCV) ヒト免疫不全ウイルス (HIV) 感染の既往がある又は罹患している者 14) TAK-850 に含まれる成分 ( 剤形及び含量の項を参照 ) に対して過敏症を有する者 15) 重度のアレルギー反応又はアナフィラキシーの既往歴がある者 16) 治験薬接種前 1 年以内に薬物濫用 ( 不法な薬物使用に定義される ) 又はアルコール依存症の既往がある者 若しくは治験期間中 アルコールの過剰摂取及び薬物使用をやめる意思のない者 17) 治験薬接種前 90 日以内に血液製剤 ( 輸血又は免疫グロブリン ) の投与を受けた者 18) 治験薬接種前 4 週 ( 28 日 ) 以内に生ワクチン 又は 2 週 ( 14 日 ) 以内に不活化ワクチンの接種を受けた者 19) 妊娠している又は授乳中の女性 同意取得前 本治験期間中又は治験終了後 1 ヵ月以内に妊娠の予定がある女性又はその期間中に卵子を提供する予定のある女性 20) 治験薬接種前 4 週 (28 日 ) 以内に 200 ml 以上又は治験薬接種前 12 週 (84 日 ) 以内に 400 ml 以上若しくは治験薬接種前 52 週 (364 日 ) 以内に合計 800 ml 以上の全血 又は治験薬接種前 2 週 (14 日 ) 以内に血液成分を採取した者 21) 治験薬接種前の検査にて ( 臨床的に問題のある ) 心電図の異常が認められた者 22) 治験薬接種前の検査にて臨床的に問題のある原疾患を示唆する臨床検査値の異常を認めた者又は次の項目の異常値が認められた者 : 正常上限の 3 倍を超える ALT 及び / 又は AST 23) 治験実施計画書に従う可能性の低い又はその他の理由で不
4 適と治験責任医師又は治験分担医師が判断する者 被験薬 用量 投与方法 ロット番号 < 用量 投与方法 > TAK-850(1 株当たりの HA 抗原量 15 µg)0.5 ml を 臨床検査及び免疫原性検査の検体採取のために採血した部位と可能な限り反対側の上腕部三角筋中央部の筋肉内に 1 回接種 <ロット番号 > SI 治療期間 22 日間 (1 回接種 ) エンドポイント < 主要評価項目 > 安全性 : 日誌収集項目として特定した注射部位及び全身性の有害事象 有害事象 免疫原性 : 接種 21 日後の 3 株それぞれに対する HI 抗体価 鶏卵培養由来ウイルス抗原 ( 以下 鶏卵抗原 ) の抗体保有率(HI 抗体価 40 を基準とする ) 接種 21 日後の 3 株それぞれに対する HI 抗体価 ( 鶏卵抗原 ) の抗体陽転率 HI 抗体価が接種開始前値から 4 倍以上増加 ( 前値 10 の場合 ) 又は HI 抗体価 40( 前値 <10 の場合 ) 接種 21 日後の 3 株それぞれに対する HI 抗体価 ( 鶏卵抗原 ) の接種開始前値からの増加倍率の幾何平均値 ( 幾何平均増加倍率 ) < 副次評価項目 > 安全性 : バイタルサイン 臨床検査 心電図 免疫原性 : 接種 21 日後の 3 株それぞれに対する HI 抗体価 ( 鶏卵抗原 ) の幾何平均値 (GMT) 接種 21 日後の 3 株それぞれに対する SRH 抗体価 ( 鶏卵抗原 ) の GMT 接種 21 日後の 3 株それぞれに対するSRH 抗体価 ( 鶏卵抗原 ) の抗体保有率 (SRH 抗体価 25 mm 2 を基準とする ) 接種 21 日後の 3 株それぞれに対するSRH 抗体価 ( 鶏卵抗原 )
5 の抗体陽転率 SRH 抗体価が接種開始前値から 50% 以上増加 ( 前値 >4 mm 2 の場合 ) 又はSRH 抗体価 25 mm 2 ( 前値 4 mm 2 の場合 ) 接種 21 日後の 3 株それぞれに対する SRH 抗体価 ( 鶏卵抗原 ) の接種開始前値からの増加倍率の幾何平均値 ( 幾何平均増加倍率 ) 統計手法 (1) 安全性の解析安全性データの解析対象集団を対象として以下の解析を行った 日誌収集項目として特定した注射部位及び全身性の有害事象について 頻度集計 程度別頻度集計及び発現時期別頻度集計を行った Treatment-emergent adverse event(teae) とは 治験薬接種開始後に発現した事象又は現病歴が悪化した事象とした TEAE について 以下の解析を行った TEAE は MedDRA を用いて読み替え 器官別大分類 (System Organ Class; SOC) 及び基本語 (Preferred Term; PT) で要約した すべての TEAE の頻度集計 治験薬との因果関係が 関連あり である TEAE の頻度集計 すべての TEAE の程度別頻度集計 治験薬との因果関係が 関連あり である TEAE の程度別頻度集計 重篤な TEAE の頻度集計 (2) 免疫原性の解析 FAS を対象として 接種 21 日後の 3 株それぞれに対する HI 抗体価 ( 鶏卵抗原 ) の抗体保有率及び抗体陽転率について 頻度集計を行い 点推定値及び両側 95% 信頼区間 (CI) を算出した また 接種 21 日後の 3 株それぞれに対する HI 抗体価 ( 鶏卵抗原 ) の幾何平均増加倍率について HI 抗体価 ( 鶏卵抗原 ) の接種開始前値からの増加倍率の要約統計量 幾何平均値及び幾何平均値の両側 95% CI を算出した 幾何平均値の両側 95% CI は 抗体価を対数変換した値の平均値の両側 95% CI の上限値及び下限値を逆対数変換することにより算出した 要約 結論 < 免疫原性の結論 > FAS を対象に TAK-850 単回筋肉内接種時の免疫原性について解析した結果 以下の結論が得られた 治験薬接種 21 日後のインフルエンザウイルス 3 株
6 (A/H1N1 A/H3N2 B) それぞれに対する HI 抗体価 ( 鶏卵抗原 ) の抗体保有率は A/H1N1 が 81.8%(45/55 例 両側 95% CI: ~90.921) A/H3N2 が 87.3%(48/55 例 両側 95% CI: ~94.726) 及び B が 76.4%(42/55 例 両側 95% CI: ~86.772) であり 接種前 34.5%(19/55 例 両側 95% CI: ~48.581) 63.6%(35/55 例 両側 95% CI:49.563~76.186) 及び 20.0%(11/55 例 両側 95% CI:10.430~32.973) に比べいずれも高値を示した 米国第 3 相試験 試験 (TAK-850 と同一製法 製造株を用いた接種群の成人コホート [18~49 歳 581 例 ] 以下同様):94.7%( 両側 95% CI:92.5~96.3) 91.6%( 両側 95% CI:89.0~97.3) 及び 82.8%( 両側 95% CI: 79.5~85.8) と比較すると 全体的にやや低かった 治験薬接種 21 日後のインフルエンザウイルス 3 株 (A/H1N1 A/H3N2 B) それぞれに対する HI 抗体価 ( 鶏卵抗原 ) の抗体陽転率は A/H1N1 が 70.9%( 両側 95% CI: ~82.370) A/H3N2 が 52.7%( 両側 95% CI:38.804~66.347) 及び B が 61.8%( 両側 95% CI:47.726~74.591) であった いずれも米国第 3 相試験 試験 :70.9%( 両側 95% CI:67.0 ~74.6) 57.5%( 両側 95% CI:53.4~61.5) 及び 61.4%( 両側 95% CI:57.4~65.4) と全体的に類似していた 治験薬接種 21 日後のインフルエンザウイルス 3 株 (A/H1N1 A/H3N2 B) それぞれに対する HI 抗体価 ( 鶏卵抗原 ) の接種開始前値からの幾何平均増加倍率は A/H1N1 が 14.74( 両側 95% CI:8.578~25.335) A/H3N2 が 6.71( 両側 95% CI:3.997~11.252) 及び B が 7.14( 両側 95% CI:4.592~11.108) であった 米国第 3 相試験 試験 :9.6( 両側 95% CI: 8.5~10.8) 5.6( 両側 95% CI:5.0~6.3) 及び 6.7( 両側 95% CI: 6.0~7.5) と比較すると 3 株いずれも高い平均値を示した 治験薬接種 21 日後のインフルエンザウイルス 3 株 (A/H1N1 A/H3N2 及び B) それぞれに対する HI 抗体価 ( 鶏卵抗原 ) の GMT は A/H1N1 が ( 両側 95% CI: ~ ) A/H3N2 が ( 両側 95% CI: ~ ) 及び B が 59.49( 両側 95% CI:39.810~88.908) であり 接種前 17.86( 両側 95% CI:10.915~29.209) 76.07( 両側 95% CI: ~ ) 及び 8.33( 両側 95% CI:6.342~10.943) と比べ 3 株いずれも上昇が認められた 治験薬接種 21 日後におけるインフルエンザウイルス 3 株 (A/H1N1 A/H3N2 B) に対する鶏卵抗原を用いた HI 抗体価と SRH 抗体価は B 型を除き相関関係が示唆された ま
7 た 鶏卵抗原を用いた測定の結果 (HI 抗体価及び SRH 抗体価 ) と Vero 抗原を用いた測定の結果は 3 株いずれにおいても相関 関係が示唆された 以上より 本治験において日本人の健康成人男女 (20~49 歳 ) を対象とした TAK-850 単回筋肉内接種時の免疫原性は 18~49 歳の被験者を対象として本治験と同一の用法 用量で実施された米国第 3 相試験 ( 試験 ) の成績と全体的に大きく劣っておらず TAK-850 単回筋肉内接種時のインフルエンザウイルス 3 株 (A/H1N1 A/H3N2 及び B) に対する免疫原性が確認された < 安全性の結論 > 本治験を通して 死亡例はなかった また アナフィラキシーなどの過敏反応の発現は認められなかった その他の重篤な有害事象及び治験薬接種又は治験の中止に至る有害事象は認められなかった 本治験における有害事象の発現頻度及び発現件数は 54.5% (30/55 例 )54 件であり 副反応の発現頻度は 50.9%(28/55 例 ) であった 有害事象の程度は すべて軽度であった 発現頻度が 3% 以上に認められた有害事象は 注射部位反応では注射部位疼痛 40.0%(22/55 例 ) 注射部位そう痒感 3.6%(2/55 例 ) であり 全身反応では 倦怠感 16.4%(9/55 例 ) 頭痛 5.5% (3/55 例 ) 悪寒 3.6%(2/55 例 ) 筋肉痛 3.6%(2/55 例 ) であった これらの有害事象の程度はすべて軽度であった 発現時期別では アラニンアミノトランスフェラーゼ増加及びアスパラギン酸アミノトランスフェラーゼ増加の 1 例 ( 同一被験者 ) 2 件が治験薬接種 8 日目 (Day 8) 以降 (Day 22) に発現したのに対し その他はいずれも接種 7 日目 (Day 7) 以内に発現した また 副反応の発現頻度は 注射部位疼痛 40.0%(22/55 例 ) 倦怠感 14.5%(8/55 例 ) 注射部位そう痒感 3.6%(2/55 例 ) 筋肉痛 3.6%(2/55 例 ) 頭痛 3.6%(2/55 例 ) 悪寒 1.8%(1/55 例 ) 疲労 1.8%(1/55 例 ) 注射部位熱感 1.8%(1/55 例 ) 関節痛 1.8% (1/55 例 ) 多汗症 1.8%(1/55 例 ) であった 臨床検査では アラニンアミノトランスフェラーゼ増加及びアスパラギン酸アミノトランスフェラーゼ増加の 1 例 ( 同一被験者 )2 件が有害事象と認められたものの いずれも治験薬との因果関係は否定された
8 本概要の作成日 バイタルサイン ( 収縮期 拡張期血圧 脈拍数 体温及び呼吸数 ) 及び 12 誘導心電図の所見では 臨床的に問題となる異常所見は認められなかった また 注射部位反応については 注射部位発赤 注射部位腫脹及び注射部位硬結の最大径 (cm) において いずれも全被験者の計測値は 規定した毒性評価尺度の最小値 (2.5 cm) 未満であり 有害事象と判断される事象は認められなかった 以上より 日本人の健康成人男女を対象とした TAK-850 の単回筋肉内接種時における忍容性及び安全性に大きな問題はないと判断した 2014 年 9 月 17 日
2.0 概要治験情報 : 治験依頼者名 : 武田薬品工業株式会社 大阪市中央区道修町四丁目 1 番 1 号 治験課題名 : 健康成人男性を対象に TAK-536TCH の最終製剤を単回経口投与したときの食事の影響を検討する第 1 相無作為化非盲検クロスオーバー試験 治験課題名の短縮
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要治験情報 : 治験依頼者名 : 武田薬品工業株式会社
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要治験情報 : 治験依頼者名 : 武田薬品工業株式会社
2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社 (TPC) 大阪市中央区道修町四丁目 1 番 1 号 治験課題名 : びらん性食道炎の患者を対象にした TAK-438 の 20 mg を 1 日 1 回経口投与したときの有効性及び安全性を 1 日 1 回経口投与
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
症例報告書の記入における注意点 1 必須ではない項目 データ 斜線を引くこと 未取得 / 未測定の項目 2 血圧平均値 小数点以下は切り捨てとする 3 治験薬服薬状況 前回来院 今回来院までの服薬状況を記載する服薬無しの場合は 1 日投与量を 0 錠 とし 0 錠となった日付を特定すること < 演習
 ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
Microsoft Word - ①【修正】B型肝炎 ワクチンにおける副反応の報告基準について
 資料 1 B 型肝炎ワクチンの副反応報告基準について 予防接種法における副反応報告制度について 制度の趣旨副反応報告制度は 予防接種後に生じる種々の身体的反応や副反応が疑われる症状等について情報を収集し ワクチンの安全性について管理 検討を行うことで 広く国民に情報を提供すること及び今後の予防接種行政の推進に資することを目的としている 報告の義務 予防接種法第 12 条 1 項 ( 参考資料 1)
資料 1 B 型肝炎ワクチンの副反応報告基準について 予防接種法における副反応報告制度について 制度の趣旨副反応報告制度は 予防接種後に生じる種々の身体的反応や副反応が疑われる症状等について情報を収集し ワクチンの安全性について管理 検討を行うことで 広く国民に情報を提供すること及び今後の予防接種行政の推進に資することを目的としている 報告の義務 予防接種法第 12 条 1 項 ( 参考資料 1)
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
1. 今回の変更に関する整理 効能 効果及び用法 用量 ( 添付文書より転載 ) 従来製剤 ( バイアル製剤 ) と製法変更製剤 ( シリンジ製剤 ) で変更はない 効能 効果 用法 容量 B 型肝炎の予防通常 0.5mL ずつ4 週間隔で2 回 更に 20~24 週を経過した後に1 回 0.5mL
 資料 6 MSD 社の製造する B 型肝炎単抗原ワクチンについて 経緯 1986 年米国メルク社製 B 型肝炎ワクチン ( 酵母由来 ) が米国で承認 1988 年 MSD 社製 B 型肝炎ワクチン ( 酵母由来 ) が日本で承認 2000 年欧州で HEXAVAC( ジフテリア 破傷風 百日咳 B 型肝炎 不活化ポリオ Hib 感染症を予防する 6 種混合ワクチン ) 承認 2001 年欧州で HEXAVAC
資料 6 MSD 社の製造する B 型肝炎単抗原ワクチンについて 経緯 1986 年米国メルク社製 B 型肝炎ワクチン ( 酵母由来 ) が米国で承認 1988 年 MSD 社製 B 型肝炎ワクチン ( 酵母由来 ) が日本で承認 2000 年欧州で HEXAVAC( ジフテリア 破傷風 百日咳 B 型肝炎 不活化ポリオ Hib 感染症を予防する 6 種混合ワクチン ) 承認 2001 年欧州で HEXAVAC
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
シプロフロキサシン錠 100mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを
 シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
B 型肝炎 予防接種予診票 * 接種希望の方へ : 太ワク内にご記入ください * お子さんの場合には 健康状態をよく把握している保護者がご記入ください 記入日年月日 男 ふ り が な 住 所 ける人の氏名女受 保護者の氏名 生年月日 大正昭和平成 年月日生 ( 満歳ヵ月 ) 診察前の体温度分 電話
 B 型肝炎ワクチン接種申込書 予診票 任意接種用 本予診票は定期接種の予診票としては使用できません 別途市町村等より配布されているものを使用してください B 型肝炎 予防接種予診票 * 接種希望の方へ : 太ワク内にご記入ください * お子さんの場合には 健康状態をよく把握している保護者がご記入ください 記入日年月日 男 ふ り が な 住 所 ける人の氏名女受 保護者の氏名 生年月日 大正昭和平成
B 型肝炎ワクチン接種申込書 予診票 任意接種用 本予診票は定期接種の予診票としては使用できません 別途市町村等より配布されているものを使用してください B 型肝炎 予防接種予診票 * 接種希望の方へ : 太ワク内にご記入ください * お子さんの場合には 健康状態をよく把握している保護者がご記入ください 記入日年月日 男 ふ り が な 住 所 ける人の氏名女受 保護者の氏名 生年月日 大正昭和平成
B 型肝炎 予防接種予診票 * 接種希望の方へ : 太ワク内にご記入ください * お子さんの場合には 健康状態をよく把握している保護者がご記入ください 記入日年月日 男 ふ り が な 住 所 ける人の氏名女受 保護者の氏名 生年月日 大正昭和平成 年月日生 ( 満歳ヵ月 ) 診察前の体温度分 電話
 B 型肝炎ワクチン接種申込書 予診票 任意接種用 本予診票は定期接種の予診票としては使用できません 別途市町村等より配布されているものを使用してください B 型肝炎 予防接種予診票 * 接種希望の方へ : 太ワク内にご記入ください * お子さんの場合には 健康状態をよく把握している保護者がご記入ください 記入日年月日 男 ふ り が な 住 所 ける人の氏名女受 保護者の氏名 生年月日 大正昭和平成
B 型肝炎ワクチン接種申込書 予診票 任意接種用 本予診票は定期接種の予診票としては使用できません 別途市町村等より配布されているものを使用してください B 型肝炎 予防接種予診票 * 接種希望の方へ : 太ワク内にご記入ください * お子さんの場合には 健康状態をよく把握している保護者がご記入ください 記入日年月日 男 ふ り が な 住 所 ける人の氏名女受 保護者の氏名 生年月日 大正昭和平成
検査項目情報 インフルエンザウイルスB 型抗体 [HI] influenza virus type B, viral antibodies 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 5F410 分析物 インフルエン
![検査項目情報 インフルエンザウイルスB 型抗体 [HI] influenza virus type B, viral antibodies 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 5F410 分析物 インフルエン 検査項目情報 インフルエンザウイルスB 型抗体 [HI] influenza virus type B, viral antibodies 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 5F410 分析物 インフルエン](/thumbs/104/163903853.jpg) influenza virus type B, viral antibodies 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 5F410 分析物 インフルエンザウイルス B 型 6091 5. 免疫学的検査 >> 5F. ウイルス感染症検査 >> 5F410. Ver.11 診療報酬 特掲診療料 >> 検査 >> 検体検査料
influenza virus type B, viral antibodies 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 5F410 分析物 インフルエンザウイルス B 型 6091 5. 免疫学的検査 >> 5F. ウイルス感染症検査 >> 5F410. Ver.11 診療報酬 特掲診療料 >> 検査 >> 検体検査料
あった AUCtはで ± ng hr/ml で ± ng hr/ml であった 2. バイオアベイラビリティの比較およびの薬物動態パラメータにおける分散分析の結果を Table 4 に示した また 得られた AUCtおよび Cmaxについてとの対数値
 モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
インフルエンザ(成人)
 ⅩⅠ-2 インフルエンザ 1 概要 インフルエンザは A 型 B 型インフルエンザウイルスによる急性呼吸器疾患である 主に冬季に流行する 典型的なものでは 急激で高度の発熱 頭痛 倦怠感などの全身症状が現れ 同時かやや遅れて鼻汁 咽頭痛 咳などの呼吸器症状が出現する 熱は 38 度以上となり 諸症状とともに次第に緩解し 1 週間ほどで治癒に向かう 2 診断 臨床症状に加え下記の方法で診断する 迅速診断
ⅩⅠ-2 インフルエンザ 1 概要 インフルエンザは A 型 B 型インフルエンザウイルスによる急性呼吸器疾患である 主に冬季に流行する 典型的なものでは 急激で高度の発熱 頭痛 倦怠感などの全身症状が現れ 同時かやや遅れて鼻汁 咽頭痛 咳などの呼吸器症状が出現する 熱は 38 度以上となり 諸症状とともに次第に緩解し 1 週間ほどで治癒に向かう 2 診断 臨床症状に加え下記の方法で診断する 迅速診断
針刺し切創発生時の対応
 1. 初期対応 1) 発生直後の対応 (1) 曝露部位 ( 針刺し 切創等の経皮的創傷 粘膜 皮膚など ) を確認する (2) 曝露部位を直ちに洗浄する 1 創傷 粘膜 正常な皮膚 創傷のある皮膚 : 流水 石鹸で十分に洗浄する 2 口腔 : 大量の水でうがいする 3 眼 : 生理食塩水で十分に洗浄する (3) 曝露の程度 ( 深さ 体液注入量 直接接触量 皮膚の状態 ) を確認する (4) 原因鋭利器材の種類
1. 初期対応 1) 発生直後の対応 (1) 曝露部位 ( 針刺し 切創等の経皮的創傷 粘膜 皮膚など ) を確認する (2) 曝露部位を直ちに洗浄する 1 創傷 粘膜 正常な皮膚 創傷のある皮膚 : 流水 石鹸で十分に洗浄する 2 口腔 : 大量の水でうがいする 3 眼 : 生理食塩水で十分に洗浄する (3) 曝露の程度 ( 深さ 体液注入量 直接接触量 皮膚の状態 ) を確認する (4) 原因鋭利器材の種類
5_使用上の注意(37薬効)Web作業用.indd
 34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに
 ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
モニタリング計画書・報告書
 0 ... 2... 2... 2... 3 4.1.... 3 4.1.1.... 3 4.1.2.... 4 4.1.3.... 4 4.1.4.... 5 4.2.... 5 4.3.... 6 4.4.... 6... 6 5.1.... 6 5.1.1.... 7 5.1.2.... 8 5.1.3.... 9 5.1.4.... 9 5.2.... 15 5.2.1.... 15 5.2.2....
0 ... 2... 2... 2... 3 4.1.... 3 4.1.1.... 3 4.1.2.... 4 4.1.3.... 4 4.1.4.... 5 4.2.... 5 4.3.... 6 4.4.... 6... 6 5.1.... 6 5.1.1.... 7 5.1.2.... 8 5.1.3.... 9 5.1.4.... 9 5.2.... 15 5.2.1.... 15 5.2.2....
2)HBV の予防 (1)HBV ワクチンプログラム HBV のワクチンの接種歴がなく抗体価が低い職員は アレルギー等の接種するうえでの問題がない場合は HB ワクチンを接種することが推奨される HB ワクチンは 1 クールで 3 回 ( 初回 1 か月後 6 か月後 ) 接種する必要があり 病院の
 Ⅵ. 職業感染対策 1. 針刺し 切創 粘膜曝露 1) 針刺し 切創 粘膜曝露対策および事例発生時の対応 職業感染を防止するためには 針刺し 切創 粘膜曝露を起こさないことが重要ではあ るが もし針刺し 切創 粘膜曝露が発生した場合は 迅速に対処することが必要となる 針刺し 切創 粘膜曝露事例発生時はフローチャートに従い行動する 表 1 感染症別の針刺しによる感染率 問題となるウイルス 感染率 備考
Ⅵ. 職業感染対策 1. 針刺し 切創 粘膜曝露 1) 針刺し 切創 粘膜曝露対策および事例発生時の対応 職業感染を防止するためには 針刺し 切創 粘膜曝露を起こさないことが重要ではあ るが もし針刺し 切創 粘膜曝露が発生した場合は 迅速に対処することが必要となる 針刺し 切創 粘膜曝露事例発生時はフローチャートに従い行動する 表 1 感染症別の針刺しによる感染率 問題となるウイルス 感染率 備考
検体採取 患者の検査前準備 検体採取のタイミング 5. 免疫学的検査 >> 5G. 自己免疫関連検査 >> 5G010. 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 F 凝固促進剤 + 血清分離剤 ( 青 細 ) 血液 3 ml 血清 H 凝固促進剤 + 血清分離剤 ( ピンク
 5. 免疫学的検査 >> 5G. 自己免疫関連検査 >> 5G010. anti nuclear antibody 連絡先 : 3764 基本情報 分析物 5G010 JLAC10 診療報酬 識別材料 023 血清 測定法 162 蛍光抗体法 (FAT) 結果識別 第 2 章 特掲診療料 D014 5 抗核抗体 ( 蛍光抗体法 ) 半定量 105 点 第 3 部 検査 第 1 節 検体検査料 第 1
5. 免疫学的検査 >> 5G. 自己免疫関連検査 >> 5G010. anti nuclear antibody 連絡先 : 3764 基本情報 分析物 5G010 JLAC10 診療報酬 識別材料 023 血清 測定法 162 蛍光抗体法 (FAT) 結果識別 第 2 章 特掲診療料 D014 5 抗核抗体 ( 蛍光抗体法 ) 半定量 105 点 第 3 部 検査 第 1 節 検体検査料 第 1
審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]
![審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ] 審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]](/thumbs/91/105024304.jpg) 審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
サーバリックス の効果について 1 サーバリックス の接種対象者は 10 歳以上の女性です 2 サーバリックス は 臨床試験により 15~25 歳の女性に対する HPV 16 型と 18 型の感染や 前がん病変の発症を予防する効果が確認されています 10~15 歳の女児および
 1 2 3 4 5 子宮頸がんと発がん性ヒトパピローマウイルス 1 子宮頸がんは 子宮頸部 ( 子宮の入り口 ) にできるがんで 20~30 代で急増し 日本では年間約 15,000 人の女性が発症していると報告されています 子宮頸がんは 初期の段階では自覚症状がほとんどないため しばしば発見が遅れてしまいます がんが進行すると 不正出血や性交時の出血などがみられます 2 子宮頸がんは 発がん性 HPVというウイルスの感染が原因で引き起こされる病気です
1 2 3 4 5 子宮頸がんと発がん性ヒトパピローマウイルス 1 子宮頸がんは 子宮頸部 ( 子宮の入り口 ) にできるがんで 20~30 代で急増し 日本では年間約 15,000 人の女性が発症していると報告されています 子宮頸がんは 初期の段階では自覚症状がほとんどないため しばしば発見が遅れてしまいます がんが進行すると 不正出血や性交時の出血などがみられます 2 子宮頸がんは 発がん性 HPVというウイルスの感染が原因で引き起こされる病気です
ヒアルロン酸ナトリウム架橋体製剤 特定使用成績調査
 ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
試験デザイン :n=152 試験開始前に第 VIII 因子製剤による出血時止血療法を受けていた患者群を 以下のい ずれかの群に 2:2:1 でランダム化 A 群 (n=36) (n=35) C 群 (n=18) ヘムライブラ 3 mg/kg を週 1 回 4 週間定期投与し その後 1.5 mg/k
 各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国ま
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください AD-4833MET/CCT-001 治験総括報告書初版
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください AD-4833MET/CCT-001 治験総括報告書初版
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
恩賜第 42 回社会福祉法人財団済生会中央治験審査委員会 会議の記録の概要 開催日時 平成 28 年 1 月 13 日 ( 水 )15:30~17:17 開催場所 出席委員名 東京都港区三田 三田国際ビル 21 階 社会福祉法人 恩賜財団済生会本部事務局中会議室 豊島
 恩賜第 42 回社会福祉法人財団済生会中央治験審査委員会 会議の記録の概要 開催日時 平成 28 年 1 月 13 日 ( 水 )15:30~17:17 開催場所 出席委員名 108-0073 東京都港区三田 1-4-28 三田国際ビル 21 階 社会福祉法人 恩賜財団済生会本部事務局中会議室 豊島聰 ( 出席 ) 委員長林茂樹 ( 出席 ) 副委員長 市場みすゞ ( 出席 ) 漆原尚巳 ( 出席
恩賜第 42 回社会福祉法人財団済生会中央治験審査委員会 会議の記録の概要 開催日時 平成 28 年 1 月 13 日 ( 水 )15:30~17:17 開催場所 出席委員名 108-0073 東京都港区三田 1-4-28 三田国際ビル 21 階 社会福祉法人 恩賜財団済生会本部事務局中会議室 豊島聰 ( 出席 ) 委員長林茂樹 ( 出席 ) 副委員長 市場みすゞ ( 出席 ) 漆原尚巳 ( 出席
ハイゼントラ20%皮下注1g/5mL・2g/10mL・4g/20mL
 CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
Microsoft PowerPoint - 【参考資料4】安全性に関する論文Ver.6
 第 31 回厚生科学審議会予防接種 ワクチン分科会副反応検討部会 平成 29 年度第 9 回薬事 食品衛生審議会医薬品等安全対策部会安全対策調査会 ( 合同開催 ) 資料 14 参考資料 4 諸外国における HPV ワクチンの安全性に関する文献等について 1 米国における 4 価 HPV ワクチンの市販後調査による安全性評価 (2006~2008) O VAERS に報告された 4 価 HPV ワクチン接種後の有害事象報告を要約し
第 31 回厚生科学審議会予防接種 ワクチン分科会副反応検討部会 平成 29 年度第 9 回薬事 食品衛生審議会医薬品等安全対策部会安全対策調査会 ( 合同開催 ) 資料 14 参考資料 4 諸外国における HPV ワクチンの安全性に関する文献等について 1 米国における 4 価 HPV ワクチンの市販後調査による安全性評価 (2006~2008) O VAERS に報告された 4 価 HPV ワクチン接種後の有害事象報告を要約し
日本小児科学会が推奨する予防接種スケジュール
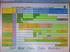 日本小児科学会推奨の予防接種スケジュールの主な変更点 2012 年 4 月 20 日 1) ヒブワクチン ヒブワクチンの追加接種 (4) に関して 添付文書上は 3 からおおむね 1 年あけるとありますが 追加接種による効果は 早期に得られるべきであると 考えます したがって 4 は 12 から接種することで適切な免疫が早期にえられる という 1 文を加えました 2) ワクチン 5 価ワクチンのスケジュールを加えました
日本小児科学会推奨の予防接種スケジュールの主な変更点 2012 年 4 月 20 日 1) ヒブワクチン ヒブワクチンの追加接種 (4) に関して 添付文書上は 3 からおおむね 1 年あけるとありますが 追加接種による効果は 早期に得られるべきであると 考えます したがって 4 は 12 から接種することで適切な免疫が早期にえられる という 1 文を加えました 2) ワクチン 5 価ワクチンのスケジュールを加えました
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
untitled
 1 2 有害事象とは何ですか? 有害事象 (Adverse Event) 治験薬又は製造販売後臨床試験薬を投与された被験者に生じたすべての好ましくない又は意図しない疾病又はその徴候をいう 当該治験薬又は当該製造販売後臨床試験薬との因果関係の有無は問わない 副作用とは何ですか? 副作用 (Adverse Drug Reaction) 治験薬 ( 対象薬として用いられる市販薬を除く ) については以下のとおり
1 2 有害事象とは何ですか? 有害事象 (Adverse Event) 治験薬又は製造販売後臨床試験薬を投与された被験者に生じたすべての好ましくない又は意図しない疾病又はその徴候をいう 当該治験薬又は当該製造販売後臨床試験薬との因果関係の有無は問わない 副作用とは何ですか? 副作用 (Adverse Drug Reaction) 治験薬 ( 対象薬として用いられる市販薬を除く ) については以下のとおり
10038 W36-1 ワークショップ 36 関節リウマチの病因 病態 2 4 月 27 日 ( 金 ) 15:10-16:10 1 第 5 会場ホール棟 5 階 ホール B5(2) P2-203 ポスタービューイング 2 多発性筋炎 皮膚筋炎 2 4 月 27 日 ( 金 ) 12:4
 10001 P1-089 ポスタービューイング 1 関節リウマチの治療 :DMARDs NSAIDs 4 月 26 日 ( 木 ) 13:20-14:40 - ポスター 展示会場ホール E B2 階 ホール E 10002 P2-041 ポスタービューイング 2 関節リウマチの治療評価と予測 2 4 月 27 日 ( 金 ) 12:40-14:00 - ポスター 展示会場ホール E B2 階 ホール
10001 P1-089 ポスタービューイング 1 関節リウマチの治療 :DMARDs NSAIDs 4 月 26 日 ( 木 ) 13:20-14:40 - ポスター 展示会場ホール E B2 階 ホール E 10002 P2-041 ポスタービューイング 2 関節リウマチの治療評価と予測 2 4 月 27 日 ( 金 ) 12:40-14:00 - ポスター 展示会場ホール E B2 階 ホール
現在にいたっております その結果 現在 HPVワクチンは定期接種でありながら 接種対象となる12 歳から16 歳の女子に対する接種がほとんど行われていないのが現状です このような状況は先進国では日本だけで見られていることであり 将来 子宮頸がんの発症が他国に比べて著しく高くなるというような事態が起き
 2016 年 10 月 5 日放送 HPV ワクチン 最近の動向 慶應義塾大学感染症学教授岩田敏はじめにわが国の子宮頸がん患者数は年間約 1 万人 死亡者数は約 3 千人と言われており 国内では 子宮頸がんによる死亡率の増加傾向がみられています また 若年女性に多い子宮頸がんの発生頻度のピークは 出産年齢のピークと重なっており 子宮頸がんに罹患した女性は 死亡するリスクだけではなく 妊娠 出産を諦めなければならなくなるというリスクを負うことになります
2016 年 10 月 5 日放送 HPV ワクチン 最近の動向 慶應義塾大学感染症学教授岩田敏はじめにわが国の子宮頸がん患者数は年間約 1 万人 死亡者数は約 3 千人と言われており 国内では 子宮頸がんによる死亡率の増加傾向がみられています また 若年女性に多い子宮頸がんの発生頻度のピークは 出産年齢のピークと重なっており 子宮頸がんに罹患した女性は 死亡するリスクだけではなく 妊娠 出産を諦めなければならなくなるというリスクを負うことになります
< F2D91E F18B638E968E9F91E62E6A7464>
 第 11 回新型インフルエンザ専門家会議 日時 : 平成 21 年 4 月 20 日 ( 月 ) 14:00~16:00 場所 :K K R ホテル東京孔雀の間 ( 1 1 階 ) 議事次第 1. 開会 2. 議題 (1) 新型インフルエンザプレパンデミックワクチンの安全性 (2) その他 免疫原性および交叉免疫性に関する研究 について 3. 今後の予定について 4. 閉会 第 11 回新型インフルエンザ専門家会議
第 11 回新型インフルエンザ専門家会議 日時 : 平成 21 年 4 月 20 日 ( 月 ) 14:00~16:00 場所 :K K R ホテル東京孔雀の間 ( 1 1 階 ) 議事次第 1. 開会 2. 議題 (1) 新型インフルエンザプレパンデミックワクチンの安全性 (2) その他 免疫原性および交叉免疫性に関する研究 について 3. 今後の予定について 4. 閉会 第 11 回新型インフルエンザ専門家会議
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果
 2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
別紙様式 (Ⅱ) 商品名 : 伝統にんにく卵黄 (31 粒入り 62 粒入り ) 食経験の評価 1 喫食実績による食経験の評価 安全性評価シート 喫食実績の有無 : あり なし ( あり の場合に実績に基づく安全性の評価を記載) 本製品 伝統にんにく卵黄 と同等の製品は 1993 年 11 月より日
 商品名 : 伝統にんにく卵黄 (31 粒入り 62 粒入り ) 食経験の評価 1 喫食実績による食経験の評価 安全性評価シート 喫食実績の有無 : あり なし ( あり の場合に実績に基づく安全性の評価を記載) 本製品 伝統にんにく卵黄 と同等の製品は 1993 年 11 月より日本国内で全国規模の通信販売を開始し 現在まで全国 250 万人以上 累計 1 億 10 00 万袋を超える販売実績とともに幅広い層での食経験があります
商品名 : 伝統にんにく卵黄 (31 粒入り 62 粒入り ) 食経験の評価 1 喫食実績による食経験の評価 安全性評価シート 喫食実績の有無 : あり なし ( あり の場合に実績に基づく安全性の評価を記載) 本製品 伝統にんにく卵黄 と同等の製品は 1993 年 11 月より日本国内で全国規模の通信販売を開始し 現在まで全国 250 万人以上 累計 1 億 10 00 万袋を超える販売実績とともに幅広い層での食経験があります
医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1
 医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1 顆粒球コロニー刺激因子 (Granulocyte Colony-Stimulating Factor: G-CSF) 一般名 : フィルグラスチム 調達法 国内企業より無償提供 製造元または供給元の名称協和発酵キリン
医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1 顆粒球コロニー刺激因子 (Granulocyte Colony-Stimulating Factor: G-CSF) 一般名 : フィルグラスチム 調達法 国内企業より無償提供 製造元または供給元の名称協和発酵キリン
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
も 医療関連施設という集団の中での免疫の度合いを高めることを基本的な目標として 書かれています 医療関係者に対するワクチン接種の考え方 この後は 医療関係者に対するワクチン接種の基本的な考え方について ワクチン毎 に分けて述べていこうと思います 1)B 型肝炎ワクチンまず B 型肝炎ワクチンについて
 2015 年 2 月 16 日放送 院内感染対策としての予防接種 慶應義塾大学感染症学教授岩田敏はじめに ワクチンで防ぐことのできる疾病(Vaccine Preventable Disease; VPD) はワクチンの接種により予防する ということは 感染制御の基本です 医療関係者においても 感染症をうつさない うつされないために VPD に対して 免疫を持つ必要がある という考えのもと B 型肝炎
2015 年 2 月 16 日放送 院内感染対策としての予防接種 慶應義塾大学感染症学教授岩田敏はじめに ワクチンで防ぐことのできる疾病(Vaccine Preventable Disease; VPD) はワクチンの接種により予防する ということは 感染制御の基本です 医療関係者においても 感染症をうつさない うつされないために VPD に対して 免疫を持つ必要がある という考えのもと B 型肝炎
Microsoft Word _2180AMY10104_K104_1.doc
 アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
臨床試験結果
 試験実施者 ( 企業名 ) 商品名 有効成分名 試験の名称 試験実施医療機関及び 試験責任医師名 試験結果の概要 武田薬品工業株式会社 TAK-085 公表文献 ( 本試験結果の報告文献 ) なし 試験期間 ( 最初の被験者の同意取得日 ~ 最後の被験者の治療期終了日 ) 試験のフェーズ 試験の目的 試験の方法 被験者数 ( 計画時 解析時 ) 対象基準 Omega-3-acid ethyl esters
試験実施者 ( 企業名 ) 商品名 有効成分名 試験の名称 試験実施医療機関及び 試験責任医師名 試験結果の概要 武田薬品工業株式会社 TAK-085 公表文献 ( 本試験結果の報告文献 ) なし 試験期間 ( 最初の被験者の同意取得日 ~ 最後の被験者の治療期終了日 ) 試験のフェーズ 試験の目的 試験の方法 被験者数 ( 計画時 解析時 ) 対象基準 Omega-3-acid ethyl esters
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認され
 ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
別紙 1 新型インフルエンザ (1) 定義新型インフルエンザウイルスの感染による感染症である (2) 臨床的特徴咳 鼻汁又は咽頭痛等の気道の炎症に伴う症状に加えて 高熱 (38 以上 ) 熱感 全身倦怠感などがみられる また 消化器症状 ( 下痢 嘔吐 ) を伴うこともある なお 国際的連携のもとに
 別紙 1 新型インフルエンザ (1) 定義新型インフルエンザウイルスの感染による感染症である (2) 臨床的特徴咳 鼻汁又は咽頭痛等の気道の炎症に伴う症状に加えて 高熱 (38 以上 ) 熱感 全身倦怠感などがみられる また 消化器症状 ( 下痢 嘔吐 ) を伴うこともある なお 国際的連携のもとに最新の知見を集約し 変更される可能性がある (3) 届出基準ア患者 ( 確定例 ) 患者 ( 確定例
別紙 1 新型インフルエンザ (1) 定義新型インフルエンザウイルスの感染による感染症である (2) 臨床的特徴咳 鼻汁又は咽頭痛等の気道の炎症に伴う症状に加えて 高熱 (38 以上 ) 熱感 全身倦怠感などがみられる また 消化器症状 ( 下痢 嘔吐 ) を伴うこともある なお 国際的連携のもとに最新の知見を集約し 変更される可能性がある (3) 届出基準ア患者 ( 確定例 ) 患者 ( 確定例
免疫学的検査 >> 5E. 感染症 ( 非ウイルス ) 関連検査 >> 5E106. 検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 F 凝固促進剤 + 血清分離剤 ( 青 細 ) 血液 3 ml 血清 H 凝固促進剤
 6102 5. 免疫学的検査 >> 5E. 感染症 ( 非ウイルス ) 関連検査 >> 5E106. mycoplasma pneumoniae antibody 連絡先 : 3764 基本情報 5E106 分析物 JLAC10 診療報酬 識別材料 023 血清 測定法 117 粒子凝集反応 結果識別 第 2 章 特掲診療料 D012 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料
6102 5. 免疫学的検査 >> 5E. 感染症 ( 非ウイルス ) 関連検査 >> 5E106. mycoplasma pneumoniae antibody 連絡先 : 3764 基本情報 5E106 分析物 JLAC10 診療報酬 識別材料 023 血清 測定法 117 粒子凝集反応 結果識別 第 2 章 特掲診療料 D012 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料
日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 名称日本脳炎ウイル
 日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 2.1.1 名称日本脳炎ウイルス中山株薬検系又はこれと同等と認められた株 2.1.2 性状豚腎初代細胞で増殖し がちょう 鶏初生ひな及びはとの赤血球を凝集する
日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 2.1.1 名称日本脳炎ウイルス中山株薬検系又はこれと同等と認められた株 2.1.2 性状豚腎初代細胞で増殖し がちょう 鶏初生ひな及びはとの赤血球を凝集する
テイカ製薬株式会社 社内資料
 テイカ製薬株式会社社内資料 アレルギー性結膜炎治療剤トラニラスト点眼液.5% TS TRANILAST Ophthalmic Solution.5% TS 生物学的同等性に関する資料 発売元 : 興和株式会社 製造販売元 : テイカ製薬株式会社 9 年 月作成 TSTR5BE9 ラット及びモルモットアレルギー性結膜炎モデルにおける生物学的同等性試験 Ⅰ. 試験の目的トラニラスト点眼液.5% TS および標準製剤の生物学的同等性をラット受動感作アレルギー性結膜炎モデル及びモルモット能動感作アレルギー性結膜炎モデルを用い薬力学的に検討した
テイカ製薬株式会社社内資料 アレルギー性結膜炎治療剤トラニラスト点眼液.5% TS TRANILAST Ophthalmic Solution.5% TS 生物学的同等性に関する資料 発売元 : 興和株式会社 製造販売元 : テイカ製薬株式会社 9 年 月作成 TSTR5BE9 ラット及びモルモットアレルギー性結膜炎モデルにおける生物学的同等性試験 Ⅰ. 試験の目的トラニラスト点眼液.5% TS および標準製剤の生物学的同等性をラット受動感作アレルギー性結膜炎モデル及びモルモット能動感作アレルギー性結膜炎モデルを用い薬力学的に検討した
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国ま
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 試験番号 :/CPH-001 2.0 概要 治験情報
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 試験番号 :/CPH-001 2.0 概要 治験情報
(3) 摂取する上での注意事項 ( 該当するものがあれば記載 ) 機能性関与成分と医薬品との相互作用に関する情報を国立健康 栄養研究所 健康食品 有効性 安全性データベース 城西大学食品 医薬品相互作用データベース CiNii Articles で検索しました その結果 検索した範囲内では 相互作用
 販売しようとする機能性表示食品の科学的根拠等に関する基本情報 ( 一般消費者向け ) 商品名蹴脂粒食品の区分 加工食品 ( サプリメント形状 その他 ) 生鮮食品機能性関与成分名キトグルカン ( エノキタケ抽出物 ) 表示しようとする機能性本品はキトグルカン ( エノキタケ抽出物 ) を配合しており 体脂肪 ( 内臓脂肪 ) を減少させる働きがあります 体脂肪が気になる方 肥満気味の方に適しています
販売しようとする機能性表示食品の科学的根拠等に関する基本情報 ( 一般消費者向け ) 商品名蹴脂粒食品の区分 加工食品 ( サプリメント形状 その他 ) 生鮮食品機能性関与成分名キトグルカン ( エノキタケ抽出物 ) 表示しようとする機能性本品はキトグルカン ( エノキタケ抽出物 ) を配合しており 体脂肪 ( 内臓脂肪 ) を減少させる働きがあります 体脂肪が気になる方 肥満気味の方に適しています
Microsoft Word - (QAその1)子宮頸がん予防ワクチンQ&A
 子宮頸がん予防ワクチン Q&A 子宮頸がんについて Q1. 子宮頸がんとは何ですか? 子宮頸がん とは 女性の子宮頸部にできるがんのことです 子宮は 胎児を育てる器官で 全体に西洋梨のような形をしています また 子宮頸部は 腟へと細長く付き出た子宮の入り口部分 ( 腟の方から見た場合には 奥の突き当たり部分になります ) のことを言います Q2. 何が原因で子宮頸がんになるのですか? 子宮頸がんの発生にはヒトパピローマウイルス
子宮頸がん予防ワクチン Q&A 子宮頸がんについて Q1. 子宮頸がんとは何ですか? 子宮頸がん とは 女性の子宮頸部にできるがんのことです 子宮は 胎児を育てる器官で 全体に西洋梨のような形をしています また 子宮頸部は 腟へと細長く付き出た子宮の入り口部分 ( 腟の方から見た場合には 奥の突き当たり部分になります ) のことを言います Q2. 何が原因で子宮頸がんになるのですか? 子宮頸がんの発生にはヒトパピローマウイルス
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生年月日 住所 M T S H 西暦 電話番号 年月日 ( ) - 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 ( ) - 家族構成 ( ) - ( ) - ( ) - ( ) - 担当医情報 医
 佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
ロタウイルスワクチンは初回接種を1 価で始めた場合は 1 価の2 回接種 5 価で始めた場合は 5 価の3 回接種 となります 母子感染予防の場合のスケジュール案を示す 母子感染予防以外の目的で受ける場合は 4 週間の間隔をあけて2 回接種し 1 回目 の接種から20~24 週あけて3 回目を接種生
 注 1) 本スケジュール案は 2014 年 10 月現在 接種可能な主なワクチンをすべて受けると仮定して 1 例を示したものです 接種の順番や受けるワクチンの種類については お子様の体調や周りの感染症発生状況によって 異なってきます 詳しくはかかりつけの医療機関 保健所等でご相談ください 注 2) 接種に際しては次の決まりがあります スケジュールを立てるときの参考にしてください 別の種類のワクチンを接種する場合は
注 1) 本スケジュール案は 2014 年 10 月現在 接種可能な主なワクチンをすべて受けると仮定して 1 例を示したものです 接種の順番や受けるワクチンの種類については お子様の体調や周りの感染症発生状況によって 異なってきます 詳しくはかかりつけの医療機関 保健所等でご相談ください 注 2) 接種に際しては次の決まりがあります スケジュールを立てるときの参考にしてください 別の種類のワクチンを接種する場合は
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 F 凝固促進剤 + 血清分離剤 ( 青 細 ) 血液 3 ml 血清 H 凝固促進剤 + 血清分離剤 ( ピンク ) 血液 6 ml 血清 I 凝固促進剤 + 血清分離剤 ( 茶色 )
 toxoplasma gondii antibody-igg 連絡先 : 3764 基本情報 分析物 5E156 JLAC10 診療報酬 識別材料 023 血清 測定法 052 化学 生物発光イムノアッセイ (CLEIA) 結果識別 第 2 章 特掲診療料 D012 14 トキソプラズマ抗体 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 免疫学的検査 ) 93 点 加算等
toxoplasma gondii antibody-igg 連絡先 : 3764 基本情報 分析物 5E156 JLAC10 診療報酬 識別材料 023 血清 測定法 052 化学 生物発光イムノアッセイ (CLEIA) 結果識別 第 2 章 特掲診療料 D012 14 トキソプラズマ抗体 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 免疫学的検査 ) 93 点 加算等
検査項目情報 P-ANCA Department of Clinical Laboratory, Kyoto University Hospital 一次サンプル採取マニュアル 免疫学的検査 >> 5G. 自己免疫関連検査 >> 5G552.P-ANCA Ver.7 perinucl
 6629 5. 免疫学的検査 >> 5G. 自己免疫関連検査 >> 5G552. Ver.7 perinuclear-anti neutrophil cytoplasmic antibody 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 5G552 特掲診療料 >> 検査 >> 検体検査料 >> 検体検査実施料
6629 5. 免疫学的検査 >> 5G. 自己免疫関連検査 >> 5G552. Ver.7 perinuclear-anti neutrophil cytoplasmic antibody 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 5G552 特掲診療料 >> 検査 >> 検体検査料 >> 検体検査実施料
Microsoft PowerPoint - 【資料1】シンフロリックス_基本方針部会
 資料 1 沈降 10 価肺炎球菌結合型ワクチン ( シンフロリックス 水性懸濁筋注 ) の臨床試験データの概要 予防接種基本方針部会 2015 年 5 月 13 日 ジャパンワクチン株式会社 本日説明させていただくこと 1. シンフロリックス 水性懸濁筋注について 2. 国内第 3 相臨床試験の概要 (058 試験 ) 海外臨床試験に対する国内臨床試験の非劣性試験 [DPT 同時接種 ] 3. 海外第
資料 1 沈降 10 価肺炎球菌結合型ワクチン ( シンフロリックス 水性懸濁筋注 ) の臨床試験データの概要 予防接種基本方針部会 2015 年 5 月 13 日 ジャパンワクチン株式会社 本日説明させていただくこと 1. シンフロリックス 水性懸濁筋注について 2. 国内第 3 相臨床試験の概要 (058 試験 ) 海外臨床試験に対する国内臨床試験の非劣性試験 [DPT 同時接種 ] 3. 海外第
2017 年 2 月 1 日放送 ウイルス性肺炎の現状と治療戦略 国立病院機構沖縄病院統括診療部長比嘉太はじめに肺炎は実地臨床でよく遭遇するコモンディジーズの一つであると同時に 死亡率も高い重要な疾患です 肺炎の原因となる病原体は数多くあり 極めて多様な病態を呈します ウイルス感染症の診断法の進歩に
 2017 年 2 月 1 日放送 ウイルス性肺炎の現状と治療戦略 国立病院機構沖縄病院統括診療部長比嘉太はじめに肺炎は実地臨床でよく遭遇するコモンディジーズの一つであると同時に 死亡率も高い重要な疾患です 肺炎の原因となる病原体は数多くあり 極めて多様な病態を呈します ウイルス感染症の診断法の進歩に伴い 肺炎におけるウイルスの重要性が注目されてきました 本日のお話では 成人におけるウイルス性肺炎の疫学と診断の現状
2017 年 2 月 1 日放送 ウイルス性肺炎の現状と治療戦略 国立病院機構沖縄病院統括診療部長比嘉太はじめに肺炎は実地臨床でよく遭遇するコモンディジーズの一つであると同時に 死亡率も高い重要な疾患です 肺炎の原因となる病原体は数多くあり 極めて多様な病態を呈します ウイルス感染症の診断法の進歩に伴い 肺炎におけるウイルスの重要性が注目されてきました 本日のお話では 成人におけるウイルス性肺炎の疫学と診断の現状
p
 2016.9.1 p23-25 80 4 6 29 1 3 3 1 2 3 3 40 30 20 10 0 -- PIO-NET 54 4 282-289 2013 PIONET) BMJ Open. 5(11):e009038 2015 Highly probable, 9% probable, 28%, 22% Highly possible, 32% Possible, 9%,
2016.9.1 p23-25 80 4 6 29 1 3 3 1 2 3 3 40 30 20 10 0 -- PIO-NET 54 4 282-289 2013 PIONET) BMJ Open. 5(11):e009038 2015 Highly probable, 9% probable, 28%, 22% Highly possible, 32% Possible, 9%,
<4 種ウイルス疾患 ( 麻疹 風疹 水痘 流行性耳下腺炎 ) フローチャート> 医療機関の記録または母子手帳でワクチンを接種したことが A B C 2 回確認できる 1 回確認できる全く確認できない D E 前回接種より少なくとも 1 ヶ月以上あけて さらに 1 回ワクチン接種を受ける 抗体検査を
 ホッチキス 記入日 : 西暦年月日 抗体調査表 : 実習 研修生用 職種 : 氏名 : 学校名 : 実習 研修期間 : 西暦 年 月 日 ~ 月 日 説明文 1. 記入上の注意事項 必ず後述の 抗体検査方法別_ 基準値 および 4 種ウイルス疾患 ( 麻疹 風疹 水痘 流行性耳下腺炎 ) フローチャート を確認した上で 自身のワクチン接種歴および抗体価結果を抗体調査表に記入する B 型肝炎は後述の注意事項を一読後
ホッチキス 記入日 : 西暦年月日 抗体調査表 : 実習 研修生用 職種 : 氏名 : 学校名 : 実習 研修期間 : 西暦 年 月 日 ~ 月 日 説明文 1. 記入上の注意事項 必ず後述の 抗体検査方法別_ 基準値 および 4 種ウイルス疾患 ( 麻疹 風疹 水痘 流行性耳下腺炎 ) フローチャート を確認した上で 自身のワクチン接種歴および抗体価結果を抗体調査表に記入する B 型肝炎は後述の注意事項を一読後
検査項目情報 トータルHCG-β ( インタクトHCG+ フリー HCG-βサブユニット ) ( 緊急検査室 ) chorionic gonadotropin 連絡先 : 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10)
 chorionic gonadotropin 連絡先 : 3479 2-2908 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 分析物 9186 4. 内分泌学的検査 >> 4F. 性腺 胎盤ホルモンおよび結合蛋白 >> 4F090. Ver.2 4F090 HCGβ サブユニット (β-hcg) 特掲診療料 >> 検査 >> 検体検査料
chorionic gonadotropin 連絡先 : 3479 2-2908 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 分析物 9186 4. 内分泌学的検査 >> 4F. 性腺 胎盤ホルモンおよび結合蛋白 >> 4F090. Ver.2 4F090 HCGβ サブユニット (β-hcg) 特掲診療料 >> 検査 >> 検体検査料
インフルエンザ定点以外の医療機関用 ( 別記様式 1) インフルエンザに伴う異常な行動に関する調査のお願い インフルエンザ定点以外の医療機関用 インフルエンザ様疾患罹患時及び抗インフルエンザ薬使用時に見られた異常な行動が 医学的にも社会的にも問題になっており 2007 年より調査をお願いしております
 ( 別記様式 1) インフルエンザに伴う異常な行動に関する調査のお願い インフルエンザ様疾患罹患時及び抗インフルエンザ薬使用時に見られた異常な行動が 医学的にも社会的にも問題になっており 2007 年より調査をお願いしております 厚生労働省では 引き続き その背景に関する実態把握をいたしたく 川崎市健康安全研究所により研究を行うこととしておりますので 以下のとおり 当該研究にかかる調査へのご協力をお願いします
( 別記様式 1) インフルエンザに伴う異常な行動に関する調査のお願い インフルエンザ様疾患罹患時及び抗インフルエンザ薬使用時に見られた異常な行動が 医学的にも社会的にも問題になっており 2007 年より調査をお願いしております 厚生労働省では 引き続き その背景に関する実態把握をいたしたく 川崎市健康安全研究所により研究を行うこととしておりますので 以下のとおり 当該研究にかかる調査へのご協力をお願いします
臨床試験の実施計画書作成の手引き
 臨床試験実施計画書 汗中乳酸測定システムを用いた 組織酸素代謝評価の検討 聖マリアンナ医科大学救急医学 神奈川県川崎市宮前区菅生 2-16-1 電話 :044-977-8111( 医局内線 3931) 医局 FAX:044-979-1522 責任医師森澤健一郎 kmori0079@yahoo.co.jp 臨床試験実施予定期間 : 承認後 ~ 2018 年 6 月 30 日まで 作成日 :2016 年
臨床試験実施計画書 汗中乳酸測定システムを用いた 組織酸素代謝評価の検討 聖マリアンナ医科大学救急医学 神奈川県川崎市宮前区菅生 2-16-1 電話 :044-977-8111( 医局内線 3931) 医局 FAX:044-979-1522 責任医師森澤健一郎 kmori0079@yahoo.co.jp 臨床試験実施予定期間 : 承認後 ~ 2018 年 6 月 30 日まで 作成日 :2016 年
マンスリー・ヘルシートピックス(2015年4月号)
 1 マンスリー ヘルシートピックス (2015 年 4 月号 ) 4 月 9 日は 子宮の日 4 月 9 日は し (4) きゅう (9) の語呂から子宮の日とされ これにちなんで子宮頸がん予防啓発デーが制定されました 当初は 市民団体が独自に 4 月 9 日を 子宮頸がんを予防する日 子宮の日 と提唱していましたが 啓発活動の強化により 2009 年 日本記念協会が 4 月 9 日を 子宮頸がんを予防する日と認定したものです
1 マンスリー ヘルシートピックス (2015 年 4 月号 ) 4 月 9 日は 子宮の日 4 月 9 日は し (4) きゅう (9) の語呂から子宮の日とされ これにちなんで子宮頸がん予防啓発デーが制定されました 当初は 市民団体が独自に 4 月 9 日を 子宮頸がんを予防する日 子宮の日 と提唱していましたが 啓発活動の強化により 2009 年 日本記念協会が 4 月 9 日を 子宮頸がんを予防する日と認定したものです
検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 F 凝固促進剤 + 血清分離剤 ( 青 細 ) 血液 3 ml 血清 H 凝固促進剤 + 血清分離剤 ( ピンク ) 血液 6 ml 血清 I 凝固促進剤 + 血清分離剤 ( 茶色 )
 varicella-zoster virus, viral antibody IgG 連絡先 : 3764 基本情報 5F193 水痘. 帯状ヘルペスウイルス分析物 JLAC10 診療報酬 識別 1431 ウイルス抗体 IgG 材料 023 血清 測定法 結果識別 第 2 章 特掲診療料 D012 38 グロブリンクラス別ウイルス抗体価 (1 項目当たり ) 第 3 部 検査 D012 381 ヘルペスウイルス
varicella-zoster virus, viral antibody IgG 連絡先 : 3764 基本情報 5F193 水痘. 帯状ヘルペスウイルス分析物 JLAC10 診療報酬 識別 1431 ウイルス抗体 IgG 材料 023 血清 測定法 結果識別 第 2 章 特掲診療料 D012 38 グロブリンクラス別ウイルス抗体価 (1 項目当たり ) 第 3 部 検査 D012 381 ヘルペスウイルス
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
スライド 1
 薬事承認に向けたワクチン開発の課題 厚生労働省医薬食品局総務課 紀平哲也 1 医薬品の開発 医薬品 感染症予防ワクチン 基礎 応用研究 基礎 応用研究 品質開発 品質開発 非臨床試験 非臨床試験 臨床研究 治験 臨床研究 治験 承認審査 承認審査 保険適用 定期接種化 市販後調査 市販後調査 2 おことわり 講演内容は演者個人の見解であり 必ずしも厚生労働省または PMDA の 見解ではありません
薬事承認に向けたワクチン開発の課題 厚生労働省医薬食品局総務課 紀平哲也 1 医薬品の開発 医薬品 感染症予防ワクチン 基礎 応用研究 基礎 応用研究 品質開発 品質開発 非臨床試験 非臨床試験 臨床研究 治験 臨床研究 治験 承認審査 承認審査 保険適用 定期接種化 市販後調査 市販後調査 2 おことわり 講演内容は演者個人の見解であり 必ずしも厚生労働省または PMDA の 見解ではありません
Microsoft Word - 日薬連宛抗インフル薬通知(写).doc
 薬生安発 0821 第 1 号 平成 3 0 年 8 月 2 1 日 日本製薬団体連合会 安全性委員会委員長 殿 厚生労働省医薬 生活衛生局医薬安全対策課長 抗インフルエンザウイルス薬の 使用上の注意 の改訂について 平成 30 年度第 1 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会 ( 平成 30 年 5 月 16 日開催 ) 及び平成 30 年度第 4 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会
薬生安発 0821 第 1 号 平成 3 0 年 8 月 2 1 日 日本製薬団体連合会 安全性委員会委員長 殿 厚生労働省医薬 生活衛生局医薬安全対策課長 抗インフルエンザウイルス薬の 使用上の注意 の改訂について 平成 30 年度第 1 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会 ( 平成 30 年 5 月 16 日開催 ) 及び平成 30 年度第 4 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会
70 例程度 デング熱は最近増加傾向ではあるものの 例程度で推移しています それでは実際に日本人渡航者が帰国後に診断される疾患はどのようなものが多いのでしょうか 私がこれまでに報告したデータによれば日本人渡航者 345 名のうち頻度が高かった疾患は感染性腸炎を中心とした消化器疾患が
 2014 年 4 月 23 日放送 輸入感染症の鑑別診断 東京医科大学病院感染制御部部長水野泰孝はじめに近年の国際化に伴い 日本人海外渡航者は 1800 万人を超える時代となっています このような背景のもと 一般臨床でも海外渡航者の診療機会は日常的になっていると思われます 本日は 海外渡航者が帰国後に何らかの症状を訴えて医療機関を受診した場合に どのような問診をし どのような疾患を鑑別に挙げ もし日本国内には存在しないあるいは稀な輸入感染症が疑われた場合の診断へのアプローチについて解説します
2014 年 4 月 23 日放送 輸入感染症の鑑別診断 東京医科大学病院感染制御部部長水野泰孝はじめに近年の国際化に伴い 日本人海外渡航者は 1800 万人を超える時代となっています このような背景のもと 一般臨床でも海外渡航者の診療機会は日常的になっていると思われます 本日は 海外渡航者が帰国後に何らかの症状を訴えて医療機関を受診した場合に どのような問診をし どのような疾患を鑑別に挙げ もし日本国内には存在しないあるいは稀な輸入感染症が疑われた場合の診断へのアプローチについて解説します
標準的な健診・保健指導の在り方に関する検討会
 第 3 章保健指導対象者の選定と階層化 (1) 保健指導対象者の選定と階層化の基準 1) 基本的考え方生活習慣病の予防を期待できる内臓脂肪症候群 ( メタボリックシンドローム ) の選定及び階層化や 生活習慣病の有病者 予備群を適切に減少させることができたかを的確に評価するために 保健指導対象者の選定及び階層化の標準的な数値基準が必要となる 2) 具体的な選定 階層化の基準 1 内臓脂肪型肥満を伴う場合の選定内臓脂肪蓄積の程度を判定するため
第 3 章保健指導対象者の選定と階層化 (1) 保健指導対象者の選定と階層化の基準 1) 基本的考え方生活習慣病の予防を期待できる内臓脂肪症候群 ( メタボリックシンドローム ) の選定及び階層化や 生活習慣病の有病者 予備群を適切に減少させることができたかを的確に評価するために 保健指導対象者の選定及び階層化の標準的な数値基準が必要となる 2) 具体的な選定 階層化の基準 1 内臓脂肪型肥満を伴う場合の選定内臓脂肪蓄積の程度を判定するため
Microsoft PowerPoint - 2.医療費プロファイル 平成25年度(長野県・・
 都道府県別医療費に関するレーダーチャート等 ( ) 平成 年度 2 ( 平成 年度 ) 医療費に関するレーダーチャート 全傷病 : 医療費 に関するレーダーチャート ( 男性 ) に関するレーダーチャート ( 女性 ) ( 入院 入院外計 ) 1 1 1 5 5 5 入院 入院外 ( 医療費の比率 ) データ : 協会けんぽ月報年次 : 平成 年度注 : 入院外医療費には調剤分が含まれている データ
都道府県別医療費に関するレーダーチャート等 ( ) 平成 年度 2 ( 平成 年度 ) 医療費に関するレーダーチャート 全傷病 : 医療費 に関するレーダーチャート ( 男性 ) に関するレーダーチャート ( 女性 ) ( 入院 入院外計 ) 1 1 1 5 5 5 入院 入院外 ( 医療費の比率 ) データ : 協会けんぽ月報年次 : 平成 年度注 : 入院外医療費には調剤分が含まれている データ
免疫学的検査 >> 5E. 感染症 ( 非ウイルス ) 関連検査 >> 5E106. 検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 F 凝固促進剤 + 血清分離剤 ( 青 細 ) 血液 3 ml 血清 H 凝固促進剤
 6528 5. 免疫学的検査 >> 5E. 感染症 ( 非ウイルス ) 関連検査 >> 5E106. mycoplasma pneumoniae antibody 連絡先 : 3764 基本情報 5E106 分析物 JLAC10 診療報酬 識別材料 023 血清 測定法 141 補体結合反応 (CF 法 ) 結果識別 第 2 章 特掲診療料 D012 第 3 部 検査 第 1 節 検体検査料 第 1
6528 5. 免疫学的検査 >> 5E. 感染症 ( 非ウイルス ) 関連検査 >> 5E106. mycoplasma pneumoniae antibody 連絡先 : 3764 基本情報 5E106 分析物 JLAC10 診療報酬 識別材料 023 血清 測定法 141 補体結合反応 (CF 法 ) 結果識別 第 2 章 特掲診療料 D012 第 3 部 検査 第 1 節 検体検査料 第 1
豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株
 豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚繁殖 呼吸障害症候群ウイルス JJ1882 株又はこれと同等と認められた株 2.1.2
豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚繁殖 呼吸障害症候群ウイルス JJ1882 株又はこれと同等と認められた株 2.1.2
<4D F736F F D2089BB8A7797C C B B835888E790AC8C7689E6>
 2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
 一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
<4D F736F F D DC58F4994C5817A54524D5F8AB38ED28CFC88E396F B CF8945C8CF889CA92C789C1816A5F3294C52E646
 患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
免疫学的検査 >> 5E. 感染症 ( 非ウイルス ) 関連検査 >> 5E301. 検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 イ ヘパリンナトリウム ( 緑 ) 血液 5 ml 全血 検体ラベル ( 単項目オー
 6938 5. 免疫学的検査 >> 5E. 感染症 ( 非ウイルス ) 関連検査 >> 5E301. 結核菌特異蛋白刺激性遊離インターフェロン -γ interferon-gamma released by Mycobacterium tuberculosis specific protein 連絡先 : 3764 基本情報 5E301 分析物 JLAC10 診療報酬 識別材料 019 全血 ( 添加物入り
6938 5. 免疫学的検査 >> 5E. 感染症 ( 非ウイルス ) 関連検査 >> 5E301. 結核菌特異蛋白刺激性遊離インターフェロン -γ interferon-gamma released by Mycobacterium tuberculosis specific protein 連絡先 : 3764 基本情報 5E301 分析物 JLAC10 診療報酬 識別材料 019 全血 ( 添加物入り
第 66 回厚生連病院共同治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名 議題及び審議結果を含む主な議論の概要 2018 年 09 月 19 日 18 時 00 分 ~18 時 20 分日本文化厚生農業協同組合連合会 8 階中会議室高瀬浩造 西田博 板井勉 田中克巳 江口善美 山崎きよ
 第 66 回厚生連病院共同治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名 議題及び審議結果を含む主な議論の概要 2018 年 09 月 19 日 18 時 00 分 ~18 時 20 分日本文化厚生農業協同組合連合会 8 階中会議室高瀬浩造 西田博 板井勉 田中克巳 江口善美 山崎きよ子 松本恵美子 山田尚之議題 1. アステラス製薬株式会社の依頼によるリウマチ患者を対象としたASP015K
第 66 回厚生連病院共同治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名 議題及び審議結果を含む主な議論の概要 2018 年 09 月 19 日 18 時 00 分 ~18 時 20 分日本文化厚生農業協同組合連合会 8 階中会議室高瀬浩造 西田博 板井勉 田中克巳 江口善美 山崎きよ子 松本恵美子 山田尚之議題 1. アステラス製薬株式会社の依頼によるリウマチ患者を対象としたASP015K
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
遡及調査にて77日前の献血時のHBVウイルス血症が確認できた急性B型肝炎の一例
 輸血後 HBV 感染事例とその対策 香川県赤十字血液センター 所長本田豊彦 2013 年 9 月 30 日 輸血後肝炎発症率 肝炎ウイルスと感染経路 1) 経口感染 HAV と HEV で 急性肝炎を起こし 慢性化はしない 2) 血液 体液による感染 HBV と HCV で 慢性肝炎 肝硬変 肝癌の原因となる 輸血による HBV 感染経路 1 急性 B 型肝炎のウインドウ期の献血者か らの感染 2
輸血後 HBV 感染事例とその対策 香川県赤十字血液センター 所長本田豊彦 2013 年 9 月 30 日 輸血後肝炎発症率 肝炎ウイルスと感染経路 1) 経口感染 HAV と HEV で 急性肝炎を起こし 慢性化はしない 2) 血液 体液による感染 HBV と HCV で 慢性肝炎 肝硬変 肝癌の原因となる 輸血による HBV 感染経路 1 急性 B 型肝炎のウインドウ期の献血者か らの感染 2
9 中止基準 ( 研究対象者の中止 研究全体の中止について ) 10 研究対象者への研究実施後の医療提供に関する対応 通常の診療を超える医療行為 を伴う研究を実施した場合 研究実施後において 研究対象者が研究の結果より得られた利用可能な最善の予防 診断及び治療が受けられるように努めること 11 研究
 倫理審査書類 ( 研究計画書 ) チェックシート 研究計画書には 原則として以下の項目を含めてください 申請時 提出は不要です 2017.5.2 1 研究の名称 ( 標題 ) 2 研究の実施体制 ( 研究組織 ) 多施設共同研究の場合 共同研究機関の研究者名 役割も詳細に記載 3 研究の背景及び意義 研究を実施する意義 必要性に関して 文献等を用いて研究の 科学的合理性の根拠 と 本研究で得られる成果
倫理審査書類 ( 研究計画書 ) チェックシート 研究計画書には 原則として以下の項目を含めてください 申請時 提出は不要です 2017.5.2 1 研究の名称 ( 標題 ) 2 研究の実施体制 ( 研究組織 ) 多施設共同研究の場合 共同研究機関の研究者名 役割も詳細に記載 3 研究の背景及び意義 研究を実施する意義 必要性に関して 文献等を用いて研究の 科学的合理性の根拠 と 本研究で得られる成果
検査項目情報 抗アクアポリン 4 抗体 Department of Clinical Laboratory, Kyoto University Hospital 一次サンプル採取マニュアル 免疫学的検査 >> 5G. 自己免疫関連検査 >> 5G821. 抗アクアポリン4 抗体 Ve
 anti aquaporin 4 antibody 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 5G821 抗アクアポリン4 抗体 特掲診療料 >> 検査 >> 検体検査料 >> 検体検査実施料 >> ( 免疫学的検査 ) 分析物 D014 43 抗アクアポリン4 抗体 1,000 点 識別材料測定法 023
anti aquaporin 4 antibody 連絡先 : 3764 基本情報 ( 標準コード (JLAC10) ) 基本情報 ( 診療報酬 ) 標準コード (JLAC10) 診療報酬 5G821 抗アクアポリン4 抗体 特掲診療料 >> 検査 >> 検体検査料 >> 検体検査実施料 >> ( 免疫学的検査 ) 分析物 D014 43 抗アクアポリン4 抗体 1,000 点 識別材料測定法 023
Microsoft Word - 2-① 補償ガイドライン平成27年版(本文)Ver3.1.1.do
 1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14 回 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 29 年 10 月 1.1. 安全性検討事項 重要な特
 レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
静岡県立静岡がんセンター臨床研究事務局の業務手順書
 治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
平成 29 年度第 1 回小児治験ネットワーク中央治験審査委員会 会議の記録の概要 開催日時 平成 29 年 4 月 18 日 ( 火 )14:00~15:15 開催場所国立研究開発法人国立成育医療研究センター管理棟 2 階会議室 21 金子剛 石川洋一 鈴木康之 安達昌功 三浦大 掛江直子 廣部兼
 平成 29 年度第 1 回小児治験ネットワーク中央治験審査委員会 会議の記録の概要 開催日時 平成 29 年 4 月 18 日 ( 火 )14:00~15:15 開催場所国立研究開発法人国立成育医療研究センター管理棟 2 階会議室 21 金子剛 石川洋一 鈴木康之 安達昌功 三浦大 掛江直子 廣部兼児 出席委員 髙橋尚人 苅谷夏子 但し 当該治験に関係のある委員は審議及び採決に参加しない 議題及びを含む主な議論の概要
平成 29 年度第 1 回小児治験ネットワーク中央治験審査委員会 会議の記録の概要 開催日時 平成 29 年 4 月 18 日 ( 火 )14:00~15:15 開催場所国立研究開発法人国立成育医療研究センター管理棟 2 階会議室 21 金子剛 石川洋一 鈴木康之 安達昌功 三浦大 掛江直子 廣部兼児 出席委員 髙橋尚人 苅谷夏子 但し 当該治験に関係のある委員は審議及び採決に参加しない 議題及びを含む主な議論の概要
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
日本内科学会雑誌第98巻第12号
 表 1. 喘息の長期管理における重症度対応段階的薬物療法 重症度 長期管理薬 : 連用 : 考慮 発作時 ステップ 1 軽症間欠型 喘息症状がやや多い時 ( 例えば 1 月に 1 ~2 回 ), 血中 喀痰中に好酸球増加のある時は下記のいずれか 1 つの投与を考慮 吸入ステロイド薬 ( 最低用量 ) テオフィリン徐放製剤 ロイコトリエン拮抗薬 抗アレルギー薬 短時間作用性吸入 β2 刺激薬または短時間作用性経口
表 1. 喘息の長期管理における重症度対応段階的薬物療法 重症度 長期管理薬 : 連用 : 考慮 発作時 ステップ 1 軽症間欠型 喘息症状がやや多い時 ( 例えば 1 月に 1 ~2 回 ), 血中 喀痰中に好酸球増加のある時は下記のいずれか 1 つの投与を考慮 吸入ステロイド薬 ( 最低用量 ) テオフィリン徐放製剤 ロイコトリエン拮抗薬 抗アレルギー薬 短時間作用性吸入 β2 刺激薬または短時間作用性経口
検体採取 患者の検査前準備 検体採取のタイミング 記号 添加物 ( キャップ色等 ) 採取材料 採取量 測定材料 F 凝固促進剤 + 血清分離剤 ( 青 細 ) 血液 3 ml 血清 H 凝固促進剤 + 血清分離剤 ( ピンク ) 血液 6 ml 血清 I 凝固促進剤 + 血清分離剤 ( 茶色 )
 6649 5. 免疫学的検査 >> 5G. 自己免疫関連検査 >> 5G176. 抗ミトコンドリアM2 抗体 anti mitochondria M2 antibody 連絡先 : 3764 基本情報 5G176 抗ミトコンドリアM2 抗体分析物 JLAC10 診療報酬 識別材料 023 血清 測定法 052 化学 生物発光イムノアッセイ (CLEIA) 結果識別 第 2 章 特掲診療料 D014
6649 5. 免疫学的検査 >> 5G. 自己免疫関連検査 >> 5G176. 抗ミトコンドリアM2 抗体 anti mitochondria M2 antibody 連絡先 : 3764 基本情報 5G176 抗ミトコンドリアM2 抗体分析物 JLAC10 診療報酬 識別材料 023 血清 測定法 052 化学 生物発光イムノアッセイ (CLEIA) 結果識別 第 2 章 特掲診療料 D014
My DIARY ベンリスタをご使用の患者さんへ
 My DIARY ベンリスタをご使用の患者さんへ ベンリスタによる全身性エリテマトーデスの治療を受けられる患者さんへ この手帳は ベンリスタによる全身性エリテマトーデスの治療を受けられる方のための手帳です 受診時に主治医に見せて あなたの体調を一緒に確認しましょう 編集協力産業医科大学医学部第 内科学講座 教授田中良哉先生 本人緊急連絡先PERSONAL DATA 氏名 住所 電話番号 生年月日 血液型
My DIARY ベンリスタをご使用の患者さんへ ベンリスタによる全身性エリテマトーデスの治療を受けられる患者さんへ この手帳は ベンリスタによる全身性エリテマトーデスの治療を受けられる方のための手帳です 受診時に主治医に見せて あなたの体調を一緒に確認しましょう 編集協力産業医科大学医学部第 内科学講座 教授田中良哉先生 本人緊急連絡先PERSONAL DATA 氏名 住所 電話番号 生年月日 血液型
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
顎下腺 舌下腺 ) の腫脹と疼痛で発症し そのほか倦怠感や食欲低下などを訴えます 潜伏期間は一般的に 16~18 日で 唾液腺腫脹の 7 日前から腫脹後 8 日後まで唾液にウイルスが排泄され 分離できます これらの症状を認めない不顕性感染も約 30% に認めます 合併症は 表 1 に示すように 無菌
 2017 年 8 月 30 日放送 無菌性髄膜炎の診断と治療 川崎医科大学小児科教授寺田喜平はじめに本日は無菌性髄膜炎をテーマにお話しさせていただきます 時間も限られていますので 4 つに焦点を絞ってお話しいたします はじめに 図 1 の無菌性髄膜炎から分離 検出されたウイルスについて 2013 年から 2017 年までのデータを見ていただきましょう 2013 年は黄色のエコー 6 と青色のエコー
2017 年 8 月 30 日放送 無菌性髄膜炎の診断と治療 川崎医科大学小児科教授寺田喜平はじめに本日は無菌性髄膜炎をテーマにお話しさせていただきます 時間も限られていますので 4 つに焦点を絞ってお話しいたします はじめに 図 1 の無菌性髄膜炎から分離 検出されたウイルスについて 2013 年から 2017 年までのデータを見ていただきましょう 2013 年は黄色のエコー 6 と青色のエコー
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん
 米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
検査項目情報 6475 ヒト TARC 一次サンプル採取マニュアル 5. 免疫学的検査 >> 5J. サイトカイン >> 5J228. ヒトTARC Department of Clinical Laboratory, Kyoto University Hospital Ver.6 thymus a
 thymus and activation-regulated chemokine 連絡先 : 3764 基本情報 5J228 ヒトTARC 分析物 JLAC10 診療報酬 識別 材料 023 血清 測定法 052 化学 生物発光イムノアッセイ (CLEIA) 結果識別 第 2 章 特掲診療料 D015 19 TARC 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 免疫学的検査
thymus and activation-regulated chemokine 連絡先 : 3764 基本情報 5J228 ヒトTARC 分析物 JLAC10 診療報酬 識別 材料 023 血清 測定法 052 化学 生物発光イムノアッセイ (CLEIA) 結果識別 第 2 章 特掲診療料 D015 19 TARC 第 3 部 検査 第 1 節 検体検査料 第 1 款 検体検査実施料 ( 免疫学的検査
より詳細な情報を望まれる場合は 担当の医師または薬剤師におたずねください また 患者向医薬品ガイド 医療専門家向けの 添付文書情報 が医薬品医療機器総合機構のホームページに掲載されています
 くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
