(表紙)【中医協用】平成27年2月収載予定新薬0202
|
|
|
- しょうすけ むこやま
- 7 years ago
- Views:
Transcription
1 新医薬品等一覧表 ( 平成 27 年 2 月 24 日収載予定 ) 中医協総 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 タケキャブ錠 10mg タケキャブ錠 20mg 10mg1 錠 20mg1 錠 武田薬品工業 ボノプラザンフマル酸塩 新有効成分含 有医薬品 2 パリエット錠 5mg 5mg1 錠 エーザイ ラベプラゾールナトリウム 新効能 新用 量医薬品 3 ジャディアンス錠 10mg ジャディアンス錠 25mg 4 オーファディンカプセル2mg オーファディンカプセル5mg オーファディンカプセル10mg 10mg1 錠 25mg1 錠 2mg1カプセル 5mg1カプセル 10mg1カプセル 日本ベーリンガーインゲルハイム エンパグリフロジン 新有効成分含有医薬品 アステラス製薬 ニチシノン 新有効成分含 有医薬品 5 ゼルボラフ錠 240mg 240mg1 錠 中外製薬 ベムラフェニブ 新有効成分含 有医薬品 6 メチレンブルー静注 50mg 第一三共 50mg10mL1 管 第一三共 メチルチオニニウム塩化物水和 物 新有効成分含有医薬品 円類似薬効比較 円方式 (Ⅱ) 内 232 消化性潰瘍用剤 ( 逆流性食道炎等用薬 ) 円規格間調整内 232 消化性潰瘍用剤 ( 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制用薬 ) 円類似薬効比較 円方式 (Ⅰ) 内 396 糖尿病用剤 (2 型糖尿病用薬 ) 3, 円原価計算方式 外国平均価格調整 内 399 他に分類されない代謝性医薬品 ( 高チロシン血 8, 円 15, 円 ( 引き下げ ) 症 Ⅰ 型用薬 ) 8 4, 円原価計算方式営業利益率 (+20%) 内 429 その他の腫瘍用薬 (BRAF 遺伝子変異を有する根治切除不能な悪性黒色腫用薬 ) ,382 円原価計算方式外国平均価格調整 ( 引き下げ ) 注 392 解毒剤 ( 中毒性メトヘモグロビン血症用薬 ) ビミジム点滴静注液 5mg 5mg5mL1 瓶 BioMarin Pharmaceutical Japan 8 コセンティクス皮下注用 150mg コセンティクス皮下注 150mg シリンジ 9 治療用ダニアレルゲンエキス皮下注 トリイ 10,000JAU/mL 治療用ダニアレルゲンエキス皮下注 トリイ 100,000JAU/mL 150mg1 瓶 150mg1mL1 筒 2mL1 瓶 2mL1 瓶 ノバルティスファーマ 鳥居薬品 エロスルファーゼアルファ ( 遺伝子組換え ) セクキヌマブ ( 遺伝子組換え ) なし ( コナヒョウヒダニエキス及びヤケヒョウヒダニエキスを含有する水性注射剤 ) 10 メナクトラ筋注 0.5mL1 瓶 サノフィ 4 価髄膜炎菌ワクチン ( ジフテリ アトキソイド結合体 ) 11 イロクテイト静注用 250 イロクテイト静注用 500 イロクテイト静注用 750 イロクテイト静注用 1000 イロクテイト静注用 1500 イロクテイト静注用 2000 イロクテイト静注用 国際単位 1 瓶 ( 溶解液付 ) 500 国際単位 1 瓶 ( 溶解液付 ) 750 国際単位 1 瓶 ( 溶解液付 ) 1,000 国際単位 1 瓶 ( 溶解液付 ) 1,500 国際単位 1 瓶 ( 溶解液付 ) 2,000 国際単位 1 瓶 ( 溶解液付 ) 3,000 国際単位 1 瓶 ( 溶解液付 ) バイオジェン アイデック ジャパン エフラロクトコグアルファ ( 遺伝子組換え ) 新有効成分含有医薬品 新有効成分含有医薬品 新有効成分含有医薬品 新有効成分含有医薬品 新有効成分含有医薬品 12 ベピオゲル2.5% 2.5%1g マルホ 過酸化ベンゾイル 新有効成分含 有医薬品 13 ロゼックスゲル0.75% 0.75%1g ガルデルマ メトロニダゾール 新投与経路医 薬品 129,908 円原価計算方式注 395 酵素製剤 ( ムコ多糖症 ⅣA 型用薬 ) 73,123 円類似薬効比較 73,132 円方式 (Ⅰ) 4,320 円類似薬効比較 4,320 円方式 (Ⅰ) 19,827 円原価計算方式外国平均価格調整 ( 引き下げ ) 26,766 円類似薬効比較 49,637 円方式 (Ⅱ) 71,236 円 92,050 円 132,105 円 170,702 円 244,983 円 円類似薬効比較方式 (Ⅰ) 注 399 他に分類されない代謝性医薬品 ( 既存治療で効果不十分な尋常性乾癬及び関節症性乾癬用薬 ) 24 注 449 その他のアレルギー用薬 ( ダニ抗原によるアレルギー性鼻炎及び気管支喘息に対する減感作療法用薬 ) 注 631 ワクチン類 ( 髄膜炎菌 ( 血清型 A,C,Y 及び W-1 35) による侵襲性髄膜炎菌感染症の予防用薬 ) 注 634 血液製剤類 ( 血液凝固第 Ⅷ 因子欠乏患者における出血傾向の抑制用薬 ) 外 269 その他の外皮用薬 ( 尋常性ざ瘡用薬 ) 円原価計算方式外 269 その他の外皮用薬 ( がん性皮膚潰瘍部位の殺菌 臭気の軽減用薬 ) スクラッチダニアレルゲンエキス トリイ 100,000JAU/mL 1mL1 瓶 鳥居薬品 なし ( コナヒョウヒダニエキス及 びヤケヒョウヒダニエキスを含 有する液剤 ) 新有効成分含有医薬品 7,966 円類似薬効比較方式 (Ⅰ) 注 729 その他の診断用薬 ( 体外診断用医薬品を除く )( アレルギー性疾患のアレルゲンの確認用薬 ) 38 品目数 成分数 内用薬 9 5 注射薬 15 7 外用薬 2 2 計
2 新医薬品の薬価算定について 整理番号 内 -1 薬効分類 232 消化性潰瘍用剤 ( 内用薬 ) 成分名ボノプラザンフマル酸塩新薬収載希望者武田薬品工業 ( 株 ) 販売名 ( 規格単位 ) 効能 効果 主な用法 用量 タケキャブ錠 10mg(10mg1 錠 ) タケキャブ錠 20mg(20mg1 錠 ) 胃潰瘍 十二指腸潰瘍 逆流性食道炎 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制下記におけるヘリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 < 胃潰瘍 十二指腸潰瘍 > 通常 成人には 1 回 20mg を 1 日 1 回投与 < 逆流性食道炎 > 通常 成人には 1 回 20mg を 1 日 1 回投与 再発 再燃を繰り返す逆流性食道炎の維持療法においては 1 回 10mg を 1 日 1 回投与するが 効果不十分の場合は 1 回 20mg を 1 日 1 回投与できる < 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 > 通常 成人には 1 回 10mg を 1 日 1 回投与 < 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 > 通常 成人には 1 回 10mg を 1 日 1 回投与 < ヘリコバクター ピロリの除菌の補助 > 通常 成人には 1 回 20mg アモキシシリン水和物として 1 回 750mg( 力価 ) 及びクラリスロマイシンとして 1 回 200mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間投与 算定方式類似薬効比較方式 (II) 算 比較薬過去 6 年間の薬理作用類似薬の最低 1 日薬価 : 円 定 規格間比 ネキシウムカプセル 20mg と同 10mg の規格間比 : ただし 20mg 製剤については 通常最大用量を超える用量に対応する規格の ため 補正加算なし 外国調整なし 算定薬価 10mg1 錠 円 (1 日薬価 : 円 ) 20mg1 錠 円 なし 外国価格 最初に承認された国 : 日本 予測年度 新薬収載希望者による市場規模予測 予測本剤投与患者数予測販売金額 ( ピーク時 ) 10 年度 180 万人 620 億円 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日 平成 27 年 2 月 24 日 2
3 薬価算定組織における検討結果のまとめ 算定方式類似薬効比較方式 (II) 第一回算定組織平成 27 年 1 月 30 日 新薬 最類似薬 最類似薬選定の妥当性 成分名ボノプラザンフマル酸塩エソメプラゾールマグネシウム水和物 イ. 効能 効果 胃潰瘍 十二指腸潰瘍 逆流性食道炎 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制下記におけるヘリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MAL T リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 ロ. 薬理作用プロトンポンプ阻害作用左に同じ 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 非びらん性胃食道逆流症 (10mg カプセルのみ ) Zollinger-Ellison 症候群 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制下記におけるヘリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 ハ. 組成及び化学構造 補正加算 ニ. 投与形態剤形用法 画期性加算 (70~120%) 有用性加算 (Ⅰ) (35~60%) 有用性加算 (Ⅱ) (5~30%) 市場性加算 (Ⅰ) (10~20%) 市場性加算 (Ⅱ) (5%) 小児加算 (5~20%) 内用錠剤 1 日 1 回 左に同じカプセル剤左に同じ 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 3
4 整理番号 内 -2 新医薬品の薬価算定について 薬効分類 232 消化性潰瘍用剤 ( 内用薬 ) 成分名ラベプラゾールナトリウム 新薬収載希望者エーザイ ( 株 ) 販売名 ( 規格単位 ) パリエット錠 5mg(5mg1 錠 ) 効能 効果 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 Zollinger-Ellison 症候群 非びらん性胃食道逆流症 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制下記におけるヘリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 主な用法 用量 < 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger-Ellison 症候群 > 通常 成人には 1 回 10mg を 1 日 1 回投与 病状により 1 回 20mg を 1 日 1 回経口投与できる < 逆流性食道炎 > 通常 成人には 1 回 10mg を 1 日 1 回投与 病状により 1 回 20mg を 1 日 1 回経口投与できる 再発 再燃を繰り返す逆流性食道炎の維持療法においては 1 回 10mg を 1 日 1 回投与する < 非びらん性胃食道逆流症 > 通常 成人には 1 回 10mg を 1 日 1 回投与する < 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 > 通常 成人には 1 回 5mg を 1 日 1 回投与 効果不十分の場合は 1 回 10mg を 1 日 1 回投与できる < ヘリコバクター ピロリの除菌の補助 > 通常 成人には 1 回 10mg アモキシシリン水和物として 1 回 750mg( 力価 ) 及びクラリスロマイシンとして 1 回 200mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間投与する 算定方式規格間調整 算 定 比較薬 成分名 : ラベプラゾールナトリウム会社名 : エーザイ ( 株 ) 販売名 ( 規格単位 ) パリエット錠 10mg(10mg1 錠 ) 薬価 円 規格間比パリエット錠 10mg と同 20mg 規格間比 : 外国調整なし 算定薬価 5mg1 錠 円 なし 外国価格 最初に承認された国 : 日本 予測年度 新薬収載希望者による市場規模予測 予測本剤投与患者数予測販売金額 ( ピーク時 ) 8 年度 12 万人 18 億円 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日 平成 27 年 2 月 24 日 4
5 薬価算定組織における検討結果のまとめ 算定方式規格間調整第一回算定組織平成 27 年 1 月 30 日 新薬 最類似薬 成分名ラベプラゾールナトリウム左に同じ 最類似薬選定の妥当性 イ. 効能 効果 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 Zollinger-Ellison 症候群 非びらん性胃食道逆流症 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 下記におけるヘリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 左に同じ ロ. 薬理作用プロトンポンプ阻害作用左に同じ ハ. 組成及び化学構造 左に同じ 補正加算 ニ. 投与形態剤形用法 画期性加算 (70~120%) 有用性加算 (Ⅰ) (35~60%) 有用性加算 (Ⅱ) (5~30%) 市場性加算 (Ⅰ) (10~20%) 市場性加算 (Ⅱ) (5%) 小児加算 (5~20%) 内用錠剤 1 日 1 回 左に同じ左に同じ左に同じ 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織平成年月日 5
6 新医薬品の薬価算定について 整理番号 内 -3 薬効分類 396 糖尿病用剤 ( 内用薬 ) 成分名エンパグリフロジン新薬収載希望者日本ベーリンガーインゲルハイム ( 株 ) 販売名 ( 規格単位 ) ジャディアンス錠 10mg(10mg1 錠 ) ジャディアンス錠 25mg(25mg1 錠 ) 効能 効果 2 型糖尿病 主な用法 用量 通常 成人にはエンパグリフロジンとして 10mg を 1 日 1 回朝食前又は朝食後に経 口投与する なお 効果不十分な場合には 経過を十分に観察しながら 25mg1 日 算定方式類似薬効比較方式 (Ⅰ) 1 回に増量することができる 算比較薬定成分名 : ルセオグリフロジン水和物会社名 : 大正製薬 ( 株 ) 販売名 ( 規格単位 ) 薬価 (1 日薬価 ) ルセフィ錠 2.5mg 円 (2.5mg1 錠 ) ( 円 ) 補正加算なし ルセフィ錠 2.5mgと同 5mgの規格間比 : 規格間比ただし 25mg 製剤については 通常最大用量を超える用量に対応する規格のため 外国調整なし 算定薬価 10mg1 錠 円 (1 日薬価 : 円 ) 25mg1 錠 円 外国価格 10mg1 錠 米国 ドル 1, 円 英国 ポンド 円 独国 ユーロ 円 外国平均価格 円 25mg1 錠 米国 ドル 1, 円 英国 ポンド 円 独国 ユーロ 円 外国平均価格 円 ( 注 1) 為替レートは平成 26 年 2 月 ~ 平成 27 年 1 月の平均 ( 注 2) 外国の価格に大きな開きがあるため 調整した外国平均価格を用いている ( は最低価格の 3 倍を上回るため 対象から除いた ) 予測年度 新薬収載希望者による市場規模予測 予測本剤投与患者数予測販売金額 ( ピーク時 ) 10 年度 60 万人 390 億円 最初に承認された国 ( 年月 ): オーストラリア (2014 年 4 月 ) 製造販売承認日平成 26 年 12 月 26 日 薬価基準収載予定日平成 27 年 2 月 24 日 6
7 算定方式類似薬効比較方式 (Ⅰ) 第一回算定組織平成 27 年 1 月 30 日最類似薬選定の妥当性薬価算定組織における検討結果のまとめ 新薬 最類似薬 成分名エンパグリフロジンルセオグリフロジン水和物 イ. 効能 効果 2 型糖尿病左に同じ ロ. 薬理作用 ハ. 組成及び化学構造 Na + / グルコース共輸送担体 (Sodium glucose cotransporter:sglt)2 阻害作用 左に同じ ニ. 投与形態剤形用法 画期性加算 (70~120%) 有用性加算 (Ⅰ) (35~60%) 有用性加算 (Ⅱ) (5~30%) 市場性加算 (Ⅰ) (10~20%) 市場性加算 (Ⅱ) (5%) 小児加算 (5~20%) 先駆導入加算 (10%) 内用錠剤 1 日 1 回 左に同じ左に同じ左に同じ補正加算当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 7
8 整理番号 内 -4 新医薬品の薬価算定について 薬効分類 399 他に分類されない代謝性医薬品 ( 内用薬 ) 成分名 ニチシノン 新薬収載希望者アステラス製薬 ( 株 ) 販売名 ( 規格単位 ) 効能 効果 オーファディンカプセル 2mg(2mg1 カプセル ) オーファディンカプセル 5mg(5mg1 カプセル ) オーファディンカプセル 10mg(10mg1 カプセル ) 注 ) 医療上の必要性の高い未承認薬 適応外薬検討会議の評価に基づく開発公募品目 高チロシン血症 Ⅰ 型 主な用法 用量 算定方式 通常 ニチシノンとして 1 日 1mg/kg を 2 回に分割して経口投与する なお 患者の状態に応じて適宜増減するが 1 日 2mg/kg を上限とする 原価計算方式 2mg1 カプセル 5mg1 カプセル 10mg1 カプセル 製品総原価 4, 円 9, 円 17, 円 算 定 営業利益 流通経費 円 ( 流通経費を除く価格の 16.9%) 円 ( 消費税を除く価格の 6.8%) 出典 : 医薬品産業実態調査報告書 ( 厚生労働省医政局経済課 ) 1, 円 ( 流通経費を除く価格の 16.9%) 円 ( 消費税を除く価格の 6.8%) 出典 : 同左 3, 円 ( 流通経費を除く価格の 16.9%) 1, 円 ( 消費税を除く価格の 6.8%) 出典 : 同左 消費税 円 1, 円 1, 円 算定薬価 外国調整 (2mg1 カプセル ) ( 調整前 ) ( 調整後 ) 2mg1カプセル 6, 円 3, 円 5mg1カプセル 13, 円 8, 円 10mg1カプセル 24, 円 15, 円 外国価格 米国 ドル 8, 円 英国 ポンド 1, 円 独国 ユーロ 3, 円 外国平均価格 2mg1 カプセル 3, 円 5mg1 カプセル 8, 円 10mg1 カプセル 15, 円 2, 円 新薬収載希望者による市場規模予測 予測年度予測本剤投与患者数予測販売金額 ( ピーク時 ) 10 年度 8 人 1.1 億円 (5mg1カプセル) 米国 ドル 21, 円 英国 ポンド 3, 円独国 ユーロ 6, 円外国平均価格 4, 円 8
9 (10mg1カプセル) 米国 ドル 43, 円 英国 ポンド 5, 円独国 ユーロ 11, 円外国平均価格 8, 円 ( 注 1) 為替レートは平成 26 年 2 月 ~ 平成 27 年 1 月の平均 ( 注 2) 外国の価格に大きな開きがあるため 調整した外国平均価格を用いている ( は最低価格の 3 倍を上回るため 対象から除いた ) 最初に承認された国 ( 年月 ): 米国 (2002 年 1 月 ) 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 9
10 薬価算定組織における検討結果のまとめ 算定方式原価計算方式第一回算定組織平成 27 年 1 月 30 日 新薬 類似薬がない根拠 原価計算方式を採用する妥当性 成分名 イ. 効能 効果 ロ. 薬理作用 ハ. 組成及び化学構造 ニチシノン 高チロシン血症 Ⅰ 型 4- ヒドロキシフェニルピルビン酸ジオキシゲナーゼ (HPPD) 阻害作用 同一の効能 効果を有する既収載品はない ニ. 投与形態剤形用法 内用カプセル剤 1 日 1mg/kg を 2 回に分割して経口投与 営業利益率 平均的な営業利益率 (16.9%) ( 注 ) 100%=16.9% ( 注 ) 出典 : 産業別財務データハンドブック ( 日本政策投資銀行 ) 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 10
11 < 余白 > 11
12 ( 参考 ) 高チロシン血症 Ⅰ 型の病態 高チロシン血症 Ⅰ 型について 高チロシン血症 I 型は 主に小児期より発症する重篤な常染色体劣性遺伝疾患であり チロシン分解酵素の一つであるフマリルアセト酢酸ヒドロラーゼの先天的欠損により 有害な中間代謝物であるマレイルアセト酢酸及びフマリルアセト酢酸や これらの代謝物であるサクシニルアセトン及びサクシニルアセト酢酸の体内濃度が上昇し 肝障害 腎尿細管障害を引き起こす また サクシニルアセトン及びサクシニルアセト酢酸が ポルフォビリノーゲン合成酵素を阻害することにより 同酵素の基質である 5-アミノレブリン酸の蓄積を惹起し ポルフィリン症様の神経症状を引き起こす 毒性代謝物の蓄積は出生時に始まり 重症度は症状の発症年齢によって異なる 最も多くみられる急性型では 生後数週から数ヵ月で肝不全の徴候 発育不全 嘔吐 下痢及び発熱がみられ 下血及び鼻出血が頻繁にみられる 治療を行わなかった場合 通常は 2~8 ヵ月以内に肝不全のために死亡する 亜急性型では 慢性進行性肝疾患及び尿細管機能障害 ( ファンコニー症候群 ) を特徴とし 低リン酸血症やくる病を伴うが 急性型ほど急速な臨床経過は示さず重症度も低い また 約 40% の患者において呼吸不全を伴う再発性のポルフィリン症様発作 あるいは肝細胞癌が認められ これらはいずれも生後 10 年以内の死亡の主要因であるとされる 慢性型は疾患の進行が遅く 最も顕著な所見は くる病及び尿細管障害である 高チロシン血症 I 型の診断では 肝障害 腎尿細管障害の存在が重要である 血清トランスアミナーゼの上昇などの肝機能障害 凝固因子の合成低下による凝固障害の所見 低リン酸血症 糖尿 タンパク尿など腎尿細管機能障害に一致する所見が認められる また 血清中 α-フェトプロテインの増加が特徴的である 確定診断のためには 尿有機酸分析を行いチロシン代謝産物である 4-ヒドロキシフェニルピルビン酸 4-ヒドロキシフェニル乳酸 4-ヒドロキシフェニル酢酸などの増加と サクシニルアセトンの増加を明らかにする 尿中サクシニルアセトンの増加は診断的な価値が高い 欧州及び北米における高チロシン血症 Ⅰ 型の発症率は出生 10 万人あたり約 1 人であり カナダの ケベック州など一部の地域では 2 万人あたり約 1 人であるとされている 一方 日本での発症率 は不明であり これまでに国内では通算して 6 例の患者が存在したことが確認されている 既存治療について 高チロシン血症 Ⅰ 型の治療法として チロシン及びフェニルアラニン制限食事療法があるが 食事療法のみでは疾患の進行を完全に防ぐことはできない また 唯一の代替選択肢は肝移植であるが 主な懸念点として 周術期の疾病及び死亡のリスク 長期免疫抑制療法の潜在的リスク 手術の心理的ストレス 並びに適合するドナー肝臓を入手することの難しさがある 12
13 < 余白 > 13
14 算定方式原価計算方式原価計算整理番号 内 -5 新医薬品の薬価算定について 薬効分類 429 その他の腫瘍用薬 ( 内用薬 ) 成分名 ベムラフェニブ 新薬収載希望者中外製薬 ( 株 ) 販売名 ( 規格単位 ) 効能 効果 ゼルボラフ錠 240mg(240mg1 錠 ) BRAF 遺伝子変異を有する根治切除不能な悪性黒色腫 主な用法 用量 通常 成人にはベムラフェニブとして 1 回 960mg を 1 日 2 回経口投与する 算 定 製品総原価営業利益流通経費消費税 3, 円 円 ( 流通経費を除く価格の 20.3%) 円 ( 消費税を除く価格の 6.8%) 出典 : 医薬品産業実態調査報告書 ( 厚生労働省医政局経済課 ) 円 外国調整 なし 算定薬価 240mg1 錠 4, 円 外国価格 1 錠 米国 54.25ドル 5, 円 英国 31.25ホ ント 5, 円 独国 51.58ユーロ 7, 円 仏国 40.87ユーロ 5, 円 外国平均価格 6, 円 ( 注 ) 為替レートは平成 26 年 2 月 ~ 平成 27 年 1 月の平均 予測年度 新薬収載希望者による市場規模予測 予測本剤投与患者予測販売金額 ( ピーク時 ) 3 年度 120 人 8.9 億円 最初に承認された国 ( 年月 ): 米国 (2011 年 8 月 ) 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 14
15 薬価算定組織における検討結果のまとめ 算定方式原価計算方式第一回算定組織平成 27 年 1 月 30 日 新薬 類似薬がない根拠 原価計算方式を採用する妥当性 成分名 イ. 効能 効果 ロ. 薬理作用 ハ. 組成及び化学構造 ベムラフェニブ BRAF 遺伝子変異を有する根治切除不能な悪性黒色腫 セリン / スレオニンキナーゼ阻害作用 (BRAF 阻害 ) 本剤と同様の効能 効果 薬理作用 組成及び化学構造等を有する既収載品はないことから 新薬算定最類似薬はないと判断した ニ. 投与形態剤形用法 営業利益率 内用錠剤 1 日 2 回 平均的な営業利益率 (16.9%) ( 注 ) 120%=20.3% ( 注 ) 出典 : 産業別財務データハンドブック ( 日本政策投資銀行 ) 本剤は 化学療法未治療の BRAF V600 変異を有する根治切除不能 ( ステージ Ⅲ 又は Ⅳ) な悪性黒色腫患者を対象とした海外第 Ⅲ 相試験において 主要評価項目である全生存期間について ダカルバジン群と比較して統計学的に有意な延長が認められた ただし 国内における治験症例が限られていることを踏まえ 平均的な営業利益率の +20% を適用することが妥当と考える 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 15
16 整理番号 注 -1 新医薬品の薬価算定について 薬効分類 392 解毒剤 ( 注射薬 ) 成分名 メチルチオニニウム塩化物水和物 新薬収載希望者第一三共 ( 株 ) 販売名 ( 規格単位 ) 効能 効果 主な用法 用量 メチレンブルー静注 50mg 第一三共 (50mg10mL1 管 ) 注 ) 医療上の必要性の高い未承認薬 適応外薬検討会議の評価に基づく開発公募品目 中毒性メトヘモグロビン血症 生後 3 ヵ月を過ぎた乳幼児 小児及び成人には メチルチオニニウム塩化物水和物として 1 回 1~2mg/kg を 5 分以上かけて静脈内投与 投与 1 時間以内に症状が改善しない場合は 必要に応じ 同量を繰り返し投与できるが 累積投与量は最大 7mg/kg までとする 新生児及び生後 3 ヵ月以下の乳児には メチルチオニニウム塩化物水和物として 1 回 0.3~0.5mg/kg を 5 分以上かけて静脈内投与 投与 1 時間以内に症状が改善しない場合は 必要に応じ 同量を繰り返し投与できる 算定方式 原価計算方式 製品総原価 246,771 円 算 原価 営業利益 50,186 円 ( 流通経費を除く価格の 16.9%) 定 計算 流通経費 21,666 円 ( 消費税を除く価格の 6.8%) 出典 : 医薬品産業実態調査報告書 ( 厚生労働省医政局経済課 ) 消費税 25,490 円 外国調整 ( 調整前 ) ( 調整後 ) 50mg10mL1 管 344,113 円 120,382 円 算定薬価 50mg10mL1 管 120,382 円 外国価格 新薬収載希望者による市場規模予測 50mg10mL1 管英国 39.38ポンド 6,813 円外国平均価格 6,813 円 ( 注 ) 為替レートは平成 26 年 2 月 ~ 平成 27 年 1 月の平均 予測年度 予測本剤投与患者数予測販売金額 ( ピーク時 ) 10 年度 10 人 360 万円 最初に承認された国 ( 年月 ): 欧州 (2011 年 5 月 ) 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 16
17 薬価算定組織における検討結果のまとめ 算定方式原価計算方式第一回算定組織平成 27 年 1 月 30 日 新薬 類似薬がない根拠 原価計算方式を採用する妥当性 成分名メチルチオニニウム塩化物水和物類似の薬理作用 組成及び化学構造等を有する既収載品がなく 新薬算定上最類似薬はないと判断した イ. 効能 効果中毒性メトヘモグロビン血症 ロ. 薬理作用 ハ. 組成及び化学構造 メトヘモグロビン還元作用 ニ. 投与形態剤形用法 注射注射剤 5 分以上かけて静脈内投与 平均的な営業利益率 (16.9%) ( 注 ) 100%=16.9% ( 注 ) 出典 : 産業別財務データハンドブック ( 日本政策投資銀行 ) 営業利益率 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 17
18 ( 参考 ) メトヘモグロビン血症の病態 メトヘモグロビンは ヘモグロビン中の 2 価の鉄イオン (Fe 2+ ) が酸化されて 3 価の Fe 3+ になったもので 通常は赤血球内の機構により還元されて 1% 以下に維持されている 何らかの要因によりこの機構が崩れ 血中のメトヘモグロビン濃度が 1~2% 以上となった状態がメトヘモグロビン血症である メトヘモグロビン血症は先天的なものと後天的なものに大別できるが 後天的なものである中毒性メトヘモグロビン血症は 医薬品や農薬等の化学物質や種々の原因物質により 生理的な調節機構 ( 還元機構 ) を凌駕して正常時の 100~1000 倍の速度で ヘモグロビン中の Fe 2+ が直接的に又は間接的に酸化され Fe 3+ の状態に変化させられることで 血中メトヘモグロビン濃度が上昇し チアノーゼ 頭痛 めまい 呼吸困難 意識障害などの症状を呈する中毒性の疾患である 血中メトヘモグロビン濃度が 20~50% では頭痛 めまい 疲労 呼吸困難等が認められ 50% 程度では嗜眠や昏睡が発現し 約 70% では死に至る可能性がある 中毒性メトヘモグロビン血症の年間発症患者数に関するデータは極めて乏しい状況であるが 厚生労働省薬事 食品衛生審議会医薬品等安全対策部会の資料 国内副作用報告の状況 によると 平成 19 年 4 月 1 日から平成 25 年 11 月 30 日までの期間に報告された薬剤性 ( 医療用医薬品 一般用医薬品 ) のメトヘモグロビン血症は 21 件であり 極めて少数であると推定される 18
19 < 余白 > 19
20 新医薬品の薬価算定について 整理番号 注 -2 薬効分類 395 酵素製剤 ( 注射薬 ) 成分名 エロスルファーゼアルファ ( 遺伝子組換え ) 新薬収載希望者 BioMarin Pharmaceutical Japan( 株 ) 販売名 ( 規格単位 ) 効能 効果 ビミジム点滴静注液 5mg (5mg5mL1 瓶 ) ムコ多糖症 ⅣA 型 主な用法 用量 エロスルファーゼアルファ ( 遺伝子組換え ) として 1 回体重 1kg あたり 2mg を週 1 回 点滴静注 算定方式 原価計算方式 算 定 原価計算 製品総原価営業利益流通経費消費税 93,160 円 18,946 円 ( 流通経費を除く価格の 16.9%) 8,179 円 ( 消費税を除く価格の 6.8%) 出典 : 医薬品産業実態調査報告書 ( 厚生労働省医政局経済課 ) 9,623 円 外国調整 なし 算定薬価 5mg5mL1 瓶 129,908 円 外国価格 新薬収載希望者による市場規模予測 5mg5mL1 瓶米国 1,281.60ドル 134,568 円独国 1,136.22ユーロ 159,071 円外国平均価格 146,819 円 ( 注 ) 為替レートは平成 26 年 2 月 ~ 平成 27 年 1 月の平均 予測年度 予測本剤投与患者数予測販売金額 ( ピーク時 ) 10 年度 20 人 14 億円 最初に承認された国 ( 年月 ): 米国 (2014 年 2 月 ) 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 20
21 薬価算定組織における検討結果のまとめ 算定方式原価計算方式第一回算定組織平成 27 年 1 月 30 日 新薬 類似薬がない根拠 原価計算方式を採用する妥当性 成分名 イ. 効能 効果 ロ. 薬理作用 ハ. 組成及び化学構造 エロスルファーゼアルファ ( 遺伝子組換え ) ムコ多糖症 ⅣA 型 N- アセチルガラクトサミン -6- スルファターゼ作用 496 個のアミノ酸残基からなるサブユニット 2 個から構成される糖タンパク質 ( 分子量 : 約 113,000~ 114,000) 類似の薬理作用 組成及び化学構造等を有する既収載品がなく 新薬算定上最類似薬はないと判断した ニ. 投与形態剤形用法 注射注射剤週 1 回点滴静注 平均的な営業利益率 (16.9%) ( 注 ) 100%=16.9% ( 注 ) 出典 : 産業別財務データハンドブック ( 日本政策投資銀行 ) 営業利益率 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 21
22 ( 参考 ) ムコ多糖症 ⅣA 型の病態 ムコ多糖症 IVA 型 ( モルキオ A 症候群 ) はケラタン硫酸やコンドロイチン-6- 硫酸等のグリコサミノグリカンを分解するライソゾーム酵素 N-アセチルガラクトサミン-6-スルファターゼ ( 以下 GALNS ) をコードする遺伝子の変異により GALNS の活性が低下する常染色体劣性遺伝疾患である ムコ多糖症 IVA 型では GALNS の活性低下によりグリコサミノグリカンが広範な組織に進行性に蓄積することで 骨格形成不全 筋骨格障害又は呼吸機能不全を呈する 疾患の進行速度にかかわらず呼吸循環器系又は神経系の合併症 ( 脊髄 頸髄圧迫 ) 致死性の肺炎や呼吸不全を併発しやすいとされ 10~20 歳で死亡に至る ムコ多糖症 ⅣB 型は,β-galactosidase の活性低下により起こる疾患であり 比較的軽症とされている 本邦での罹患率は新生児 625,000 人あたり 1 人であるとの報告 があり 年間推 定 1~2 例の新生児がムコ多糖症 IVA 型と診断されると推定されることから 患者 数は最大 20 人と推計される Tomatsu, S, Montaño, AM, Oikawa, H, Rowan, Daniel J et.al. Mucopolysaccharidosis Type IVA (Morquio A Disease): Clinical Review and Current Treatment: A Special Review. Curr Pharm Biotechnol 12,
23 < 余白 > 23
24 新医薬品の薬価算定について 整理番号 注 -3 薬効分類 399 他に分類されない代謝性医薬品 ( 注射薬 ) 成分名セクキヌマブ ( 遺伝子組換え ) 新薬収載希望者ノバルティスファーマ ( 株 ) 販売名 ( 規格単位 ) 効能 効果 主な用法 用量 コセンティクス皮下注用 150mg(150mg1 瓶 ) コセンティクス皮下注 150mg シリンジ (150mg1mL1 筒 ) 既存治療で効果不十分な下記疾患尋常性乾癬 間節症性乾癬 通常 成人にはセクキヌマブ ( 遺伝子組換え ) として 1 回 300mg を 初回 1 週後 2 週後 3 週後 4 週後に皮下投与し 以降 4 週間間隔で皮下投与する また 体重により 1 回 150mg を投与することができる 算定方式類似薬効比較方式 (I) 算 定 比較薬 補正加算なし 成分名 : ウステキヌマブ ( 遺伝子組換え ) 会社名 : ヤンセンファーマ ( 株 ) 販売名 ( 規格単位 ) 薬価 (1 日薬価 ) ステラーラ皮下注 45mg シリンジ 438,739 円 (5,223 円 ) 注 ) 新薬創出 適応外薬解消等促進加算の対象品目 キット特徴部分の原材料費 150mg1mL1 筒 73,123 円 73,132 円 外国調整なし 算定薬価 150mg1 瓶 73,123 円 150mg1mL1 筒 73,132 円 (1 日薬価 5,224 円 ) なし 外国価格 最初に承認された国 : 日本 予測年度 新薬収載希望者による市場規模予測 予測本剤投与患者数予測販売金額 ( ピーク時 ) 10 年度 5.3 千人 90 億円 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 24
25 薬価算定組織における検討結果のまとめ 算定方式類似薬効比較方式 (I) 第一回算定組織平成 27 年 1 月 30 日 新薬 最類似薬 成分名セクキヌマブ ( 遺伝子組換え ) ウステキヌマブ ( 遺伝子組換え ) 最類似薬選定の妥当性 イ. 効能 効果 既存治療で効果不十分な下記疾患尋常性乾癬 間節症性乾癬 左に同じ ロ. 薬理作用 IL-17A 阻害作用 IL-12/23p40 阻害作用 ハ. 組成及び化学構造 ヒトインターロイキン -17A に対する遺伝子組換えヒト IgG1 モノクローナル抗体で チャイニーズハムスター卵巣細胞により産生される 457 個のアミノ酸残基からなる H 鎖 (γ1 鎖 )2 分子及び 215 個のアミノ酸残基からなる L 鎖 (κ 鎖 )2 分子で構成される糖タンパク質 ヒトインターロイキン -12 及びインターロイキン -23 の p40 サブユニットに対する遺伝子組換えヒト Ig G1 モノクローナル抗体で マウスミエローマ細胞により産生される 449 個のアミノ酸残基からなる H 鎖 (γ1 鎖 )2 分子及び 214 個のアミノ酸残基からなる L 鎖 (κ 鎖 )2 分子で構成される糖タンパク質からなる 補正加算 ニ. 投与形態剤形用法 画期性加算 (70~120%) 有用性加算 (Ⅰ) (35~60%) 有用性加算 (Ⅱ) (5~30%) 市場性加算 (Ⅰ) (10~20%) 市場性加算 (Ⅱ) (5%) 小児加算 (5~20%) 注射注射剤 4 週に 1 回 皮下投与 左に同じ左に同じ 12 週に 1 回 皮下投与 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 25
26 新医薬品の薬価算定について 整理番号 注 -4 薬効分類 449 その他のアレルギー用薬 ( 注射薬 ) 成分名なし新薬収載希望者鳥居薬品 ( 株 ) 販売名 ( 規格単位 ) 効能 効果 治療用ダニアレルゲンエキス皮下注 トリイ 10,000JAU/mL(2mL1 瓶 ) 治療用ダニアレルゲンエキス皮下注 トリイ 100,000JAU/mL(2mL1 瓶 ) ダニ抗原による下記アレルギー性疾患に対する減感作療法アレルギー性鼻炎 気管支喘息 主な用法 用量 通常 初回投与量として 0.02~0.05mL を皮下に注射する 初回後の投与 量は 1 週 1~2 回約 50% ずつ増量し 0.5mL に至れば 10 倍濃度の液 0.0 5mL にかえて同様に増量しながら投与を続け次第に高濃度の液に移り 維持量に 算定方式類似薬効比較方式 (Ⅰ) 達したら2 週に1 回の注射を数回行い その後は1ヵ月に1 回とする 算比較薬定成分名 : なし ( ハウスダスト ( 室内塵 ) から抽出し 透析法により得た特異的アレルゲンを含有する水性注射剤 ) 会社名 : 鳥居薬品 ( 株 ) 販売名 ( 規格単位 ) 薬価 治療用アレルゲンエキス皮下注 トリイ ハウスダスト 1:10 4,320 円 (2mL1 瓶 ) 補正加算なし 規格間比 治療用アレルゲンエキス皮下注 トリイ ハウスダスト 1:10 と同 1:100 の規格間比 :0 外国調整なし 算定薬価 10,000JAU/mL 2mL1 瓶 4,320 円 100,000JAU/mL 2mL1 瓶 4,320 円 外国価格 新薬収載希望者による市場規模予測 なし 予測年度 予測本剤投与患者数予測販売金額 最初に承認された国 ( 年月 ) : 米国 (1991 年 7 月 ) ( ピーク時 ) 10 年度 1.4 万人 1.7 億円 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 26
27 算定方式類似薬効比較方式 (Ⅰ) 第一回算定組織平成 27 年 1 月 30 日最類似薬選定の妥当性薬価算定組織における検討結果のまとめ 新薬 最類似薬 成分名 イ. 効能 効果 なし ( コナヒョウヒダニエキス及びヤケヒョウヒダニエキスを含有する水性注射剤 ) ダニ抗原による下記アレルギー性疾患に対する減感作療法アレルギー性鼻炎 気管支喘息 なし ( ハウスダスト ( 室内塵 ) から抽出し 透析法により得た特異的アレルゲンを含有する水性注射剤 ) 治療気管支喘息 ( 減感作療法 ) ロ. 薬理作用特異的減感作作用左に同じ ハ. 組成及び化学構造 コナヒョウヒダニエキス及びヤケヒハウスダスト ( 室内塵 ) から抽出し ョウヒダニエキス透析法により得た特異的アレルゲン ニ. 投与形態剤形用法 画期性加算 (70~120%) 有用性加算 (Ⅰ) (35~60%) 有用性加算 (Ⅱ) (5~30%) 市場性加算 (Ⅰ) (10~20%) 市場性加算 (Ⅱ) (5%) 小児加算 (5~20%) 先駆導入加算 (10%) 注射注射剤初回投与量として0.02~0.05mLを皮下注射する 初回後 1 週 1~2 回約 50% ずつ増量し 0.5mLに至れば 10 倍濃度の液 0.05mLにかえて同様に増量しながら投与を続け次第に高濃度の液に移る 維持量に達したら2 週に1 回の注射を数回行い その後は1ヵ月に1 回とする 左に同じ左に同じ初回投与量として 0.02~0.05mL を皮下注射する 初回後 1 週 2 回約 50% ずつ増量し 0.5mL に至れば 10 倍濃度の液 0.05mL にかえて同様に増量しながら投与を続け次第に高濃度の液に移り 最も高い濃度 0.3~0.5mL の維持量とする 維持量に達したら 2 週に 1 回の注射を数回行い その後は 1 ヵ月に 1 回とする 補正加算当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 27
28 算定方式原価計算方式原価計算新医薬品の薬価算定について 整理番号 注 -5 薬効分類 631 ワクチン類 ( 注射薬 ) 成分名 4 価髄膜炎菌ワクチン ( ジフテリアトキソイド結合体 ) 新薬収載希望者 サノフィ ( 株 ) 販売名 ( 規格単位 ) 効能 効果 メナクトラ筋注 (0.5mL1 瓶 ) 髄膜炎菌 ( 血清型 A C Y 及び W-135) による侵襲性髄膜炎菌感染症の予防 ( 保険適用の対象は エクリズマブ ( 遺伝子組換え ) 投与対象患者に限る ) 注 ) 医療上の必要性の高い未承認薬 適応外薬検討会議の評価に基づく開発要請品目 主な用法 用量 1 回 0.5mL を筋肉内接種する 算 定 製品総原価営業利益流通経費消費税外国調整 17,172 円 3,492 円 ( 流通経費を除く価格の 16.9%) 1,508 円 ( 消費税を除く価格の 6.8%) 出典 : 医薬品産業実態調査報告書 ( 厚生労働省医政局経済課 ) 1,774 円 ( 調整前 ) ( 調整後 ) 0.5mL1 瓶 23,946 円 19,827 円 算定薬価 0.5mL1 瓶 19,827 円 外国価格 0.5mL1 瓶米国 ドル 14,214 円 外国平均価格 14,214 円 ( 注 ) 為替レートは平成 26 年 2 月 ~ 平成 27 年 1 月の平均 予測年度 新薬収載希望者による市場規模予測 予測本剤投与患者数予測販売金額 ( ピーク時 ) 初年度 20 人 50 万円 最初に承認された国 ( 年月 ): 米国 (2005 年 1 月 ) 製造販売承認日平成 26 年 7 月 4 日薬価基準収載予定日平成 27 年 2 月 24 日 28
29 薬価算定組織における検討結果のまとめ 算定方式原価計算方式第一回算定組織平成 27 年 1 月 30 日 新薬 類似薬がない根拠 原価計算方式を採用する妥当性 成分名 イ. 効能 効果 ロ. 薬理作用 ハ. 組成及び化学構造 ニ. 投与形態剤形用法 4 価髄膜炎菌ワクチン ( ジフテリアトキソイド結合体 ) 髄膜炎菌 ( 血清型 A C Y 及び W-135) による侵襲性髄膜炎菌感染症の予防 抗髄膜炎菌抗体産生作用 4 種類の血清型 (A C Y 及び W-135) の髄膜炎菌莢膜多糖体に キャリアタンパク質としてジフテリアトキソイドを結合した髄膜炎菌結合体型ワクチン 注射 注射剤 1 回 本剤と同様の効能 効果 薬理作用 組成及び化学構造等を有する既収載品はないことから 新薬算定最類似薬はないと判断した 営業利益率 平均的な営業利益率 (16.9%) ( 注 ) 100%=16.9% ( 注 ) 出典 : 産業別財務データハンドブック ( 日本政策投資銀行 ) 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 29
30 ( 参考 ) エクリズマブ ( 遺伝子組換え ) について 販売名 : ソリリス点滴静注 300mg ( 規格単位 )300mg30mL1 瓶 製造販売業者 : アレクシオンファーマ合同会社 効能 効果 : 発作性夜間ヘモグロビン尿症における溶血抑制 非典型溶血性尿毒症症候群における血栓性微小血管障害の抑制 薬理作用 : 補体 C5 の開裂阻害による終末補体複合体 C5b-9 の生成の抑制 添付文書の警告欄等において 以下を含む髄膜炎菌感染症に対する注意喚起がなされている 本剤の投与により 髄膜炎菌感染症を発症することがあり 海外では死亡例も認められていること 髄膜炎菌感染症は致命的な経過をたどることがあるので 緊急時に十分に措置できる医療施設及び医師のもとで あるいは髄膜炎菌感染症の診断及び治療が可能な医療施設との連携下で投与すること 30
31 < 余白 > 31
32 整理番号 注 -6 薬効分類 634 血液製剤類 ( 注射薬 ) 新医薬品の薬価算定について 成分名エフラロクトコグアルファ ( 遺伝子組換え ) 新薬収載希望者バイオジェン アイデック ジャパン ( 株 ) 販売名 ( 規格単位 ) イロクテイト静注用 250 (250 国際単位 1 瓶 ( 溶解液付 )) イロクテイト静注用 500 (500 国際単位 1 瓶 ( 溶解液付 )) イロクテイト静注用 750 (750 国際単位 1 瓶 ( 溶解液付 )) イロクテイト静注用 1000(1,000 国際単位 1 瓶 ( 溶解液付 )) イロクテイト静注用 1500(1,500 国際単位 1 瓶 ( 溶解液付 )) イロクテイト静注用 2000(2,000 国際単位 1 瓶 ( 溶解液付 )) イロクテイト静注用 3000(3,000 国際単位 1 瓶 ( 溶解液付 )) 効能 効果血液凝固第 VIII 因子欠乏患者における出血傾向の抑制 主な用法 用量 緩徐に静脈内に投与する 1 回体重 1Kg あたり 10~30 国際単位を投与 適宜増減 定期的に投与する場合 通常 1 日目に体重 1Kg あたり 25 国際単位 4 日目に体重 1 Kg あたり 50 国際単位から開始 以降は患者の状態に応じて 1 回体重 1Kg あたり 25 ~65 国際単位 投与間隔は 3~5 日の範囲で適宜調節 週 1 回の投与を行う場合は 体重 1Kg あたり 65 国際単位を投与 算定方式類似薬効比較方式 (II) 算 比較薬過去 6 年間の薬理作用類似薬の最低 1 日薬価 :79,255 円 補正加算なし 定 規格間比ノボエイト静注用 2000 と同 1500 の規格間比 : 外国調整なし 算定薬価 250 国際単位 1 瓶 ( 溶解液付 ) 26,766 円 500 国際単位 1 瓶 ( 溶解液付 ) 49,637 円 750 国際単位 1 瓶 ( 溶解液付 ) 71,236 円 1,000 国際単位 1 瓶 ( 溶解液付 ) 92,050 円 1,500 国際単位 1 瓶 ( 溶解液付 ) 132,105 円 2,000 国際単位 1 瓶 ( 溶解液付 ) 170,702 円 3,000 国際単位 1 瓶 ( 溶解液付 ) 244,983 円 外国価格 250 国際単位 1 瓶 ( 溶解液付 ) 米国 595 ドル 62,475 円 500 国際単位 1 瓶 ( 溶解液付 ) 米国 1,190 ドル 124,950 円 750 国際単位 1 瓶 ( 溶解液付 ) 米国 1,785 ドル 187,425 円 1,000 国際単位 1 瓶 ( 溶解液付 ) 米国 2,380 ドル 249,900 円 1,500 国際単位 1 瓶 ( 溶解液付 ) 米国 3,570 ドル 374,850 円 2,000 国際単位 1 瓶 ( 溶解液付 ) 米国 4,760 ドル 499,800 円 3,000 国際単位 1 瓶 ( 溶解液付 ) 米国 7,140 ドル 749,700 円 ( 注 1) 為替レートは平成 26 年 2 月 ~ 平成 27 年 1 月の平均 ( 注 2) 外国価格として参照可能な国が米国のみであるため 外 国平均価格調整の対象外最初に承認された国 : 米国 (2014 年 6 月 ) 新薬収載希望者による市場規模予測 予測年度予測本剤投与患者数予測販売金額 ( ピーク時 ) 10 年度 2.1 千人 200 億円 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 32
33 薬価算定組織における検討結果のまとめ 算定方式類似薬効比較方式 (II) 第一回算定組織平成 27 年 1 月 30 日 最類似薬選定の妥当性 成分名 イ. 効能 効果 ロ. 薬理作用 ハ. 組成及び化学構造 新薬エフラロクトコグアルファ ( 遺伝子組換え ) 血液凝固第 VIII 因子欠乏患者における出血傾向の抑制 止血作用 / 血液凝固第 VIII 因子の補充 754 個のアミノ酸残基からなる A 鎖 911 個のアミノ酸残基からなる B 鎖 及び 227 個のアミノ酸残基からなる C 鎖で構成される遺伝子組換え Fc- ヒト血液凝固第 VIII 因子 (FVIII) 融合糖タンパク質 ( 分子量 : 約 225,000) 最類似薬 ツロクトコグアルファ ( 遺伝子組換え ) 左に同じ 左に同じ 遺伝子組換えヒト血液凝固第 VIII 因子類縁体であり ヒト血液凝固第 VI II 因子の 1~750 番目及び 1,638~2,3 32 番目のアミノ酸に相当する 761 個のアミノ酸残基からなる H 鎖及び 684 個のアミノ酸残基からなる L 鎖で構成される糖タンパク質 ( 分子量 : 約 1 76,000) 補正加算 ニ. 投与形態剤形用法 画期性加算 (70~120%) 有用性加算 (Ⅰ) (35~60%) 有用性加算 (Ⅱ) (5~30%) 市場性加算 (Ⅰ) (10~20%) 市場性加算 (Ⅱ) (5%) 小児加算 (5~20%) 注射注射剤静脈内注射定期的投与の場合 3~5 日に 1 回 左に同じ左に同じ静脈内注射定期的投与の場合 隔日又は週 3 回投与 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 33
34 新医薬品の薬価算定について 整理番号 外 -1 薬効分類 269 その他の外皮用薬 ( 外用薬 ) 成分名過酸化ベンゾイル新薬収載希望者マルホ ( 株 ) 販売名 ( 規格単位 ) ベピオゲル 2.5%(2.5%1g) 効能 効果尋常性ざ瘡 主な用法 用量 1 日 1 回 洗顔後 患部に適量を塗布する 算定算定方式類似薬効比較方式 (Ⅰ) 比較薬 成分名 : アダパレン会社名 : ガルデルマ ( 株 ) 販売名 ( 規格単位 ) 薬価 (1 日薬価 ) ディフェリンゲル0.1% 円 (0.1%1g) ( 円 ) 注 ) 新薬創出 適応外薬解消等促進加算の対象品目 補正加算なし 外国調整なし 算定薬価 2.5%1g 円 (1 日薬価 : 円 ) 外国価格 新薬収載希望者による市場規模予測 なし 予測年度 予測本剤投与患者数予測販売金額 最初に承認された国 : 日本 ( ピーク時 ) 10 年度 55 万人 30 億円 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 34
35 算定方式類似薬効比較方式 (Ⅰ) 第一回算定組織平成 27 年 1 月 30 日最類似薬選定の妥当性薬価算定組織における検討結果のまとめ 新薬 最類似薬 成分名過酸化ベンゾイルアダパレン イ. 効能 効果尋常性ざ瘡左に同じ ロ. 薬理作用角層剥離作用 / 抗菌作用毛包上皮細胞異常角化抑制作用 ハ. 組成及び化学構造 ニ. 投与形態剤形用法 画期性加算 (70~120%) 有用性加算 (Ⅰ) (35~60%) 有用性加算 (Ⅱ) (5~30%) 市場性加算 (Ⅰ) (10~20%) 市場性加算 (Ⅱ) (5%) 小児加算 (5~20%) 先駆導入加算 (10%) 外用軟膏剤 1 日 1 回塗布 左に同じ左に同じ左に同じ補正加算当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 35
36 新医薬品の薬価算定について 整理番号 外 -2 薬効分類 269 その他の外皮用薬 ( 外用薬 ) 成分名 メトロニダゾール 新薬収載希望者 ガルデルマ ( 株 ) 販売名 ( 規格単位 ) 効能 効果 ロゼックスゲル 0.75%(0.75%1g) 注 ) 医療上の必要性の高い未承認薬 適応外薬検討会議の評価に基づく開発要請品目 がん性皮膚潰瘍部位の殺菌 臭気の軽減 主な用法 用量 症状及び病巣の広さに応じて適量を使用する 潰瘍面を清拭後 1 日 1~2 回ガーゼ等にのばして貼付するか 患部に直接塗布しその上をガーゼ等で保護する 算定方式 原価計算方式 算 定 製品総原価営業利益流通経費消費税外国調整 円 円 ( 流通経費を除く価格の 16.9%) 6.40 円 ( 消費税を除く価格の 6.8%) 出典 : 医薬品産業実態調査報告書 ( 厚生労働省医政局経済課 ) 7.50 円 なし 算定薬価 0.75%1g 円 外国価格 新薬収載希望者による市場規模予測 0.75%1g 英国 ポンド 円 外国平均価格 円 ( 注 ) 為替レートは平成 26 年 2 月 ~ 平成 27 年 1 月の平均 予測年度予測本剤投与患者数予測販売金額 ( ピーク時 ) 10 年度 3.1 千人 3.4 億円 最初に承認された国 ( 年月 ) : 英国 (1994 年 11 月 ) 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 36
37 薬価算定組織における検討結果のまとめ 算定方式原価計算方式第一回算定組織平成 27 年 1 月 30 日 新薬 類似薬がない根拠 原価計算方式を採用する妥当性 成分名 イ. 効能 効果 ロ. 薬理作用 ハ. 組成及び化学構造 メトロニダゾール がん性皮膚潰瘍部位の殺菌 臭気の軽減 核酸 (DNA) 障害作用 同一の効能 効果等を有する既収載品はない ニ. 投与形態剤形用法 外用軟膏剤 1 日 1~2 回塗布 営業利益率 平均的な営業利益率 (16.9%) ( 注 ) 100%=16.9% ( 注 ) 出典 : 産業別財務データハンドブック ( 日本政策投資銀行 ) 当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 37
38 医薬品 の薬価算定について 整理番号 注 -7 薬効分類 729 その他の診断用薬 ( 体外診断用医薬品を除く )( 注射薬 ) 成分名なし新薬収載希望者鳥居薬品 ( 株 ) 販売名 ( 規格単位 ) 効能 効果 主な用法 用量 スクラッチダニアレルゲンエキス トリイ 100,000JAU/mL (1mL1 瓶 ) 診断アレルギー性疾患のアレルゲンの確認 通常乱刺 ( プリック ) 又は切皮 ( スクラッチ ) 法により皮膚面に出血しない程度に 傷をつけ 本品 1 滴を滴下する 算定算定方式類似薬効比較方式 (Ⅰ) 成分名 : なし ( コナヒョウヒダニエキスを含有する液剤 ) 会社名 : 鳥居薬品 ( 株 ) 比較薬 販売名 ( 規格単位 ) 診断用アレルゲンスクラッチエキス トリイ (1mL1 瓶 ) 薬価 7,966 円 補正加算なし 外国調整なし 算定薬価 1mL1 瓶 7,966 円 外国価格 新薬収載希望者による市場規模予測 なし 予測年度 予測本剤投与患者数予測販売金額 最初に承認された国 ( 年月 ) : 米国 (1991 年 7 月 ) ( ピーク時 ) 10 年度 2.9 万人 0.12 億円 製造販売承認日平成 26 年 12 月 26 日薬価基準収載予定日平成 27 年 2 月 24 日 薬事 食品衛生審議会医薬品第二部会に報告された医薬品 38
39 算定方式類似薬効比較方式 (Ⅰ) 第一回算定組織平成 27 年 1 月 30 日最類似薬選定の妥当性薬価算定組織における検討結果のまとめ 新薬 最類似薬 成分名 イ. 効能 効果 なし ( コナヒョウヒダニエキス及びヤケヒョウヒダニエキスを含有する液剤 ) 診断アレルギー性疾患のアレルゲンの確認 なし ( コナヒョウヒダニエキスを含有する液剤 ) 左に同じ ロ. 薬理作用アレルギー反応左に同じ ハ. 組成及び化学構造 コナヒョウヒダニエキス及びヤケヒコナヒョウヒダニエキスョウヒダニエキス ニ. 投与形態剤形用法 画期性加算 (70~120%) 有用性加算 (Ⅰ) (35~60%) 有用性加算 (Ⅱ) (5~30%) 市場性加算 (Ⅰ) (10~20%) 市場性加算 (Ⅱ) (5%) 小児加算 (5~20%) 先駆導入加算 (10%) 注射注射剤 1 滴を滴下 左に同じ左に同じ左に同じ補正加算当初算定案に対する新薬収載希望者の不服意見の要点 上記不服意見に対する見解 第二回算定組織 平成年月日 39
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
厚生労働省告示024号/平成22年1月22日告示/平成22年1月22日施行
 厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
新医薬品一覧表 ( 平成 31 年 2 月 26 日収載予定 ) 中医協総 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 ビムパットドライシロップ10% 10%1g ユーシービージャパン ラコサミド 新用量 新剤形医 薬品 386.
 新医薬品一覧表 ( 平成 31 年 2 月 26 日収載予定 ) 中医協総 -1-1 31.2.20 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 ビムパットドライシロップ10% 10%1g ユーシービージャパン ラコサミド 新用量 新剤形医 薬品 386.20 円類似薬効比較方式 (Ⅰ) 新薬創出等加算 内 113 抗てんかん剤 ( てんかん患者の部分発作
新医薬品一覧表 ( 平成 31 年 2 月 26 日収載予定 ) 中医協総 -1-1 31.2.20 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 ビムパットドライシロップ10% 10%1g ユーシービージャパン ラコサミド 新用量 新剤形医 薬品 386.20 円類似薬効比較方式 (Ⅰ) 新薬創出等加算 内 113 抗てんかん剤 ( てんかん患者の部分発作
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
用法・用量DB
 データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
新医薬品の薬価算定について 整理番号 内 -1 薬効分類 119 その他の中枢神経系用薬 ( 内用薬 ) 成分名フマル酸ジメチル新薬収載希望者バイオジェン ジャパン ( 株 ) 販売名 ( 規格単位 ) テクフィデラカプセル 120mg(120mg1 カプセル ) テクフィデラカプセル
 新医薬品一覧表 ( 平成 29 年 2 月 15 日収載予定 ) 中医協総 -1-1 29.2.8 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 テクフィデラカプセル 120mg テクフィデラカプセル 240mg 120mg1 カプセル 240mg1 カプセル バイオジェン ジャパンフマル酸ジメチル 新有効成分含有医薬品 2 リンゼス錠 0.25mg 0.25mg1
新医薬品一覧表 ( 平成 29 年 2 月 15 日収載予定 ) 中医協総 -1-1 29.2.8 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 テクフィデラカプセル 120mg テクフィデラカプセル 240mg 120mg1 カプセル 240mg1 カプセル バイオジェン ジャパンフマル酸ジメチル 新有効成分含有医薬品 2 リンゼス錠 0.25mg 0.25mg1
新医薬品の薬価算定について 整理番号 内 -1 薬効分類 235 下剤 浣腸剤 ( 内用薬 ) 成分名 マクロゴール4000/ 塩化ナトリウム / 炭酸水素ナトリウム / 塩化カリウム 新薬収載希望者 EAファーマ ( 株 ) 販売名 ( 規格単位 ) モビコール配合内用剤 (6.85
 新医薬品一覧表 ( 平成 30 年 11 月 20 日収載予定 ) 中医協総 -2-1 30.11.14 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 モビコール配合内用剤 6.8523g1 包 EAファーマ マクロゴール4000/ 塩化ナ新医療用配合剤 トリウム / 炭酸水素ナトリウ ム / 塩化カリウム 83.90 円類似薬効比較方式 (Ⅰ) 小児加算
新医薬品一覧表 ( 平成 30 年 11 月 20 日収載予定 ) 中医協総 -2-1 30.11.14 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 モビコール配合内用剤 6.8523g1 包 EAファーマ マクロゴール4000/ 塩化ナ新医療用配合剤 トリウム / 炭酸水素ナトリウ ム / 塩化カリウム 83.90 円類似薬効比較方式 (Ⅰ) 小児加算
タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg 有効成分 ボノプラザンフマル酸塩 製造販売業者 武田薬品工業株式会社 薬効分類 提出年月 2018 年 4 月 1.1. 安全性検討事項 重要
 タケキャブ錠 10 mg タケキャブ錠 20 mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は 武田薬品工業株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません 武田薬品工業株式会社 タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg
タケキャブ錠 10 mg タケキャブ錠 20 mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は 武田薬品工業株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません 武田薬品工業株式会社 タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
< F2D F289BF8AEE8F808D908EA CA926D>
 保医発 0912 第 1 号平成 23 年 9 月 12 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 使用薬剤の薬価 ( 薬価基準 ) 等の一部改正について 使用薬剤の薬価( 薬価基準 ) ( 平成 20 年厚生労働省告示第 60 号
保医発 0912 第 1 号平成 23 年 9 月 12 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 使用薬剤の薬価 ( 薬価基準 ) 等の一部改正について 使用薬剤の薬価( 薬価基準 ) ( 平成 20 年厚生労働省告示第 60 号
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]
![審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ] 審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]](/thumbs/91/105024304.jpg) 審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
150800247.indd
 ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
< F2D C D838A8BDB92CA926D2E6A7464>
 保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開
![審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開 審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開](/thumbs/53/31072016.jpg) 審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
<4D F736F F D DC58F4994C5817A53544C2094E789BA928D5F8AB38ED28CFC834B F94CC94848CB392C78B4C C5292E646F63>
 ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
(表紙)【中医協用】平成28年11月収載予定新薬1018
 新医薬品一覧表 ( 平成 28 年 11 月 18 日収載予定 ) 中医協総 -1-1 28.11.9 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 エビリファイ錠 1mg 1mg1 錠 大塚製薬 アリピプラゾール 新効能 新用 量 新剤型医 薬品 2 ミカトリオ配合錠 1 錠 日本ベーリンガー インゲルハイム テルミサルタン / アムロジピンベシル酸塩 /
新医薬品一覧表 ( 平成 28 年 11 月 18 日収載予定 ) 中医協総 -1-1 28.11.9 No. 銘柄名規格単位会社名成分名承認区分算定薬価算定方式補正加算等薬効分類ページ 1 エビリファイ錠 1mg 1mg1 錠 大塚製薬 アリピプラゾール 新効能 新用 量 新剤型医 薬品 2 ミカトリオ配合錠 1 錠 日本ベーリンガー インゲルハイム テルミサルタン / アムロジピンベシル酸塩 /
01-04(別紙2-1)CYP2D6遺伝子多型検査
 様式第 5 号 別紙 2-1 先進医療の内容 ( 概要 ) 先進医療の名称 :CYP2D6 遺伝子多型検査適応症 : ゴーシェ病患者のうち経口投与治療薬を投与される予定の患者内容 : ( 先進性 ) 本邦において CYP2D6 遺伝子多型検査に用いる体外診断薬は過去に存在したが 現在は販売されていない xtag CYP2D6 kit v3 RUO は米国及び欧州で承認を得ている標準的な体外診断薬である
様式第 5 号 別紙 2-1 先進医療の内容 ( 概要 ) 先進医療の名称 :CYP2D6 遺伝子多型検査適応症 : ゴーシェ病患者のうち経口投与治療薬を投与される予定の患者内容 : ( 先進性 ) 本邦において CYP2D6 遺伝子多型検査に用いる体外診断薬は過去に存在したが 現在は販売されていない xtag CYP2D6 kit v3 RUO は米国及び欧州で承認を得ている標準的な体外診断薬である
DRAFT#9 2011
 報道関係各位 2019 年 3 月 25 日 ユーシービージャパン株式会社 第一三共株式会社 抗てんかん剤 ビムパット 点滴静注 200mg 新発売のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン ユーシービーグループを総称して以下 ユーシービー ) と第一三共株式会社 ( 本社 : 東京都中央区 代表取締役社長 : 眞鍋淳
報道関係各位 2019 年 3 月 25 日 ユーシービージャパン株式会社 第一三共株式会社 抗てんかん剤 ビムパット 点滴静注 200mg 新発売のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン ユーシービーグループを総称して以下 ユーシービー ) と第一三共株式会社 ( 本社 : 東京都中央区 代表取締役社長 : 眞鍋淳
したことによると考えられています 4. ピロリ菌の検査法ピロリ菌の検査法にはいくつかの種類があり 内視鏡を使うものとそうでないものに大きく分けられます 前者は 内視鏡を使って胃の組織を採取し それを材料にしてピロリ菌の有無を調べます 胃粘膜組織を顕微鏡で見てピロリ菌を探す方法 ( 鏡検法 ) 先に述
 ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
ポプスカイン0.75% 注シリンジ 75mg /10 院 Popscaine 75mg /10 院 / 筒 丸石 薬価 円 / 筒 効 硬膜外麻酔 用 ( 注 )1 回 150mg ( 本剤として20 院 ) までを硬膜外腔に投与 禁 大量出血やショック状態, 注射部位またはその周辺に
 神経系に作用する薬剤 局所麻酔薬 ( エステル型 ) ( プロカイン塩酸塩 ) プロカニン注 0.5% Procanine 25mg /5 院 / 管 光 薬価 92.00 円 /A 効 浸潤麻酔 用 ( 注 )1 回 1000mgの範囲内で使用 ( 基準最高用量 :1 回 1000mg ). 必要に応じアドレナリン ( 濃度 1:10 万 ~ 20 万 ) を添加 禁 メトヘモグロビン血症, 本剤の成分又は安息香酸エステル
神経系に作用する薬剤 局所麻酔薬 ( エステル型 ) ( プロカイン塩酸塩 ) プロカニン注 0.5% Procanine 25mg /5 院 / 管 光 薬価 92.00 円 /A 効 浸潤麻酔 用 ( 注 )1 回 1000mgの範囲内で使用 ( 基準最高用量 :1 回 1000mg ). 必要に応じアドレナリン ( 濃度 1:10 万 ~ 20 万 ) を添加 禁 メトヘモグロビン血症, 本剤の成分又は安息香酸エステル
<4D F736F F D DC58F4994C5817A54524D5F8AB38ED28CFC88E396F B CF8945C8CF889CA92C789C1816A5F3294C52E646
 患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
中医協総 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適
 中医協総 - 3 3 1. 3. 2 7 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適用に係る今後の対応について 再生医療等製品の保険適用に関する当面の間の対応 薬事法改正後に承認 ( 条件
中医協総 - 3 3 1. 3. 2 7 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適用に係る今後の対応について 再生医療等製品の保険適用に関する当面の間の対応 薬事法改正後に承認 ( 条件
Microsoft Word - 鑑
 日医発第 133 号 ( 保 33) 平成 2 8 年 4 月 2 5 日 都道府県医師会長 殿 日本医師会長横倉義武 使用薬剤の薬価 ( 薬価基準 ) の一部改正等について 平成 28 年 4 月 19 日付け厚生労働省告示第 209 号をもって薬価基準の一部が改正され 平成 28 年 4 月 20 日から適用されました 今回の改正は 医薬品医療機器等法の規定に基づき承認を得た新医薬品等 (7 成分
日医発第 133 号 ( 保 33) 平成 2 8 年 4 月 2 5 日 都道府県医師会長 殿 日本医師会長横倉義武 使用薬剤の薬価 ( 薬価基準 ) の一部改正等について 平成 28 年 4 月 19 日付け厚生労働省告示第 209 号をもって薬価基準の一部が改正され 平成 28 年 4 月 20 日から適用されました 今回の改正は 医薬品医療機器等法の規定に基づき承認を得た新医薬品等 (7 成分
Microsoft PowerPoint 臨床薬理学会ポスターKFK.ppt [互換モード]
![Microsoft PowerPoint 臨床薬理学会ポスターKFK.ppt [互換モード] Microsoft PowerPoint 臨床薬理学会ポスターKFK.ppt [互換モード]](/thumbs/48/24461773.jpg) 日本人と外国人の薬物動態の違いが日本における承認用量に与える影響 福永悟史, Frank Arnold, 草間真紀子, 小野俊介, 杉山雄一 東京大学大学院薬学系研究科 背景 日本で承認申請される医薬品の申請資料に 海外臨床試験データが含まれることは多い 海外臨床試験データを利用する場合 開発企業またはPMDAの審査では 民族的要因の影響が慎重に検討される 内因性民族的要因を検討する重要な指標として薬物動態がある
日本人と外国人の薬物動態の違いが日本における承認用量に与える影響 福永悟史, Frank Arnold, 草間真紀子, 小野俊介, 杉山雄一 東京大学大学院薬学系研究科 背景 日本で承認申請される医薬品の申請資料に 海外臨床試験データが含まれることは多い 海外臨床試験データを利用する場合 開発企業またはPMDAの審査では 民族的要因の影響が慎重に検討される 内因性民族的要因を検討する重要な指標として薬物動態がある
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
Microsoft Word _ソリリス点滴静注300mg 同意説明文書 aHUS-ICF-1712.docx
 患者様同意説明文書 非典型溶血性尿毒症症候群 (ahus) ソリリスの投与開始前に 医師または医療従事者から ソリリスを投与される方へ (ahus) 及び 患者安全性カード に従ってこの薬の安全性 有効性の説明 髄膜炎菌ワクチン等の接種の必要性及び患者様のデータの取扱いの説明を十分に理解できるまで受け さらにこの 患者様同意説明文書 の記載に従ってご確認ください 担当医師または医療従事者は 患者様にこの薬を投与する場合
患者様同意説明文書 非典型溶血性尿毒症症候群 (ahus) ソリリスの投与開始前に 医師または医療従事者から ソリリスを投与される方へ (ahus) 及び 患者安全性カード に従ってこの薬の安全性 有効性の説明 髄膜炎菌ワクチン等の接種の必要性及び患者様のデータの取扱いの説明を十分に理解できるまで受け さらにこの 患者様同意説明文書 の記載に従ってご確認ください 担当医師または医療従事者は 患者様にこの薬を投与する場合
WIC-2
 WIC-1 WIC-2 No. 銘柄名規格単位会社名成分名承認区分定薬価定方式補正加等 1 イムセラカプセル 0.5mg ジレニアカプセル 0.5mg 0.5mg1 カプセル 0.5mg1 カプセル 田辺三菱製薬ノバルティスファーマ 新医薬品一覧表 ( 平成 23 年 11 月 25 日収載予定 ) フィンゴリモド塩酸塩新有効成分 8,172.00 円類似薬効比較方式 (Ⅰ) 有用性加 (Ⅰ) 8,172.00
WIC-1 WIC-2 No. 銘柄名規格単位会社名成分名承認区分定薬価定方式補正加等 1 イムセラカプセル 0.5mg ジレニアカプセル 0.5mg 0.5mg1 カプセル 0.5mg1 カプセル 田辺三菱製薬ノバルティスファーマ 新医薬品一覧表 ( 平成 23 年 11 月 25 日収載予定 ) フィンゴリモド塩酸塩新有効成分 8,172.00 円類似薬効比較方式 (Ⅰ) 有用性加 (Ⅰ) 8,172.00
5_使用上の注意(37薬効)Web作業用.indd
 34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
PT51_p69_77.indd
 臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
汎発性膿疱性乾癬のうちインターロイキン 36 受容体拮抗因子欠損症の病態の解明と治療法の開発について ポイント 厚生労働省の難治性疾患克服事業における臨床調査研究対象疾患 指定難病の 1 つである汎発性膿疱性乾癬のうち 尋常性乾癬を併発しないものはインターロイキン 36 1 受容体拮抗因子欠損症 (
 平成 29 年 3 月 1 日 汎発性膿疱性乾癬のうちインターロイキン 36 受容体拮抗因子欠損症の病態の解明と治療法の開発について 名古屋大学大学院医学系研究科 ( 研究科長 髙橋雅英 ) 皮膚科学の秋山真志 ( あきやままさし ) 教授 柴田章貴 ( しばたあきたか ) 客員研究者 ( 岐阜県立多治見病院皮膚科医長 ) 藤田保健衛生大学病院皮膚科の杉浦一充 ( すぎうらかずみつ 前名古屋大学大学院医学系研究科准教授
平成 29 年 3 月 1 日 汎発性膿疱性乾癬のうちインターロイキン 36 受容体拮抗因子欠損症の病態の解明と治療法の開発について 名古屋大学大学院医学系研究科 ( 研究科長 髙橋雅英 ) 皮膚科学の秋山真志 ( あきやままさし ) 教授 柴田章貴 ( しばたあきたか ) 客員研究者 ( 岐阜県立多治見病院皮膚科医長 ) 藤田保健衛生大学病院皮膚科の杉浦一充 ( すぎうらかずみつ 前名古屋大学大学院医学系研究科准教授
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
Microsoft PowerPoint - __________________________ ppt
 日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
スライド 1
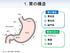 1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
日医発第147号(保27)
 日医発第 618 号 ( 保 151) 平成 23 年 9 月 30 日 都道府県医師会長殿 日本医師会長 原中勝征 使用薬剤の薬価 ( 薬価基準 ) 等の一部改正について 平成 23 年 9 月 12 日付け厚生労働省告示第 319 号をもって薬価基準の一部が改正され 告示の日から適用されました 今回の改正は 薬事法の規定に基づき承認を得た新医薬品で 薬価基準への収載希望のあった14 成分 18
日医発第 618 号 ( 保 151) 平成 23 年 9 月 30 日 都道府県医師会長殿 日本医師会長 原中勝征 使用薬剤の薬価 ( 薬価基準 ) 等の一部改正について 平成 23 年 9 月 12 日付け厚生労働省告示第 319 号をもって薬価基準の一部が改正され 告示の日から適用されました 今回の改正は 薬事法の規定に基づき承認を得た新医薬品で 薬価基準への収載希望のあった14 成分 18
汎発性膿庖性乾癬の解明
 汎発性膿疱性乾癬の病因の解明 名古屋大学大学院医学系研究科 ( 研究科長 髙橋雅英 ) 皮膚病態学杉浦一充 ( すぎうらかずみつ ) 准教授 秋山真志 ( あきやままさし ) 教授らの研究チームは 国内 11 施設との共同研究で汎発性膿疱性乾癬の 8 割以上の患者の病因がインターロイキン 36 受容体阻害因子の欠損であることを解明しました 汎発性膿疱性乾癬は厚労省の難治性疾患克服研究事業における臨床調査研究対象疾患
汎発性膿疱性乾癬の病因の解明 名古屋大学大学院医学系研究科 ( 研究科長 髙橋雅英 ) 皮膚病態学杉浦一充 ( すぎうらかずみつ ) 准教授 秋山真志 ( あきやままさし ) 教授らの研究チームは 国内 11 施設との共同研究で汎発性膿疱性乾癬の 8 割以上の患者の病因がインターロイキン 36 受容体阻害因子の欠損であることを解明しました 汎発性膿疱性乾癬は厚労省の難治性疾患克服研究事業における臨床調査研究対象疾患
より詳細な情報を望まれる場合は 担当の医師または薬剤師におたずねください また 患者向医薬品ガイド 医療専門家向けの 添付文書情報 が医薬品医療機器総合機構のホームページに掲載されています
 くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
ロミプレート 患者用冊子 特発性血小板減少性紫斑病の治療を受ける患者さんへ
 はじめ に 特発性血小板減少性紫斑病 ITP は血小板が減少し その 結果として出血の危険が高まる病気で 国が指定する難病 特定疾患 の対象になっています 慢性に経過する病気の性格上 治療の目標は出血を防ぐ ことです 血小板数が5万/μL以上であれば通常は出血の危険はほと んどありませんので 定期的に血小板数と出血症状をみな がら経過を観察します ロミプレートは 慢性 ITP の治療において 新たな作用で
はじめ に 特発性血小板減少性紫斑病 ITP は血小板が減少し その 結果として出血の危険が高まる病気で 国が指定する難病 特定疾患 の対象になっています 慢性に経過する病気の性格上 治療の目標は出血を防ぐ ことです 血小板数が5万/μL以上であれば通常は出血の危険はほと んどありませんので 定期的に血小板数と出血症状をみな がら経過を観察します ロミプレートは 慢性 ITP の治療において 新たな作用で
