二糖類 ( 改訂 2.0) α グルコース 2 つ マルトース β グルコース 2 つ セロビオースグルコースとフルクトース スクロース ( サッカロース ) スクロースだけは還元力をもたない 糖の脱水単糖 2 分子が脱水縮合すると二糖類ができる このあたりは計算問題よりも名前が必要となってくる 分
|
|
|
- えみ たかはし
- 7 years ago
- Views:
Transcription
1 単糖類 ( 改訂 2.0) C 6 H 12 O 6 グルコースの構造式は必須 α 型と β 型があるフルクトースは最も甘い単糖類は還元力を持つ グルコース ブドウ糖分子式は C 6 H 12 O 6 地球上に生きる生物にとって必要なエネルギー源であるブドウ糖である ブドウ糖は栄養補助食品として薬局にも売っている 構造式は必ず覚えること 6 個の炭素原子には番号がついている 上記 要点 の図のようにした場合, 右側から 1,2,3,4,5,6 の順である これは必ずしも覚えなくてもよいことではあるが, 知っていると便利である 1 番の炭素に結合するヒドロキシル基 OH の方向が違うだけの α 型と β 型がある 両方ともにしっかり覚えておきたい フルクトース 果糖構造は念のため覚えておいた方がいい 普通は 6 個の原子が環状構造を作っており, それを六員環というが, フルクトースは水中では結合が変わり,5 個の原子が環状となる五員環構造もとる 五員環構造は知っていて損はない フルクトースと α-グルコースが結合した二糖類のスクロースがたまに出題される フルクトースはすべての糖の中で最も甘い 還元性単糖類 C 6 H 12 O 6 はすべて還元力がある フェーリング反応, 銀鏡反応に陽性である 水に溶けると下のように鎖状となり, アルデヒド基を形成するからである フルクトースはケトン基を持つが, 水溶液中ではその隣の OH が移動して結局アルデヒド基を作るため, フルクトースも還元性をもつ また, フルクトースのように直鎖型構造のときにケトン基をもつ糖をケトースという c 新快速のページ講義ノートシリーズ化学
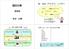
2 二糖類 ( 改訂 2.0) α グルコース 2 つ マルトース β グルコース 2 つ セロビオースグルコースとフルクトース スクロース ( サッカロース ) スクロースだけは還元力をもたない 糖の脱水単糖 2 分子が脱水縮合すると二糖類ができる このあたりは計算問題よりも名前が必要となってくる 分解する酵素 ( 加水分解における触媒 ) の名前もしっかり覚えたい 脱水によってできるエーテル結合の C O C はグリコシド結合とよばれる 2C 6 H 12 O 6 C 12 H 22 O 11 +H 2 O のように,2 つの単糖を脱水することでできる マルトース 麦芽糖 α グルコース 2 分子が脱水したもの 酵素マルターゼで分解できる 下図の右側で開環できるため, 還元力を有する セロビオース β グルコース 2 分子が脱水したもの 酵素セロビアーゼで分解できる 右側のグルコースは上下反転して結合している スクロース ショ糖 α グルコースとフルクトースが脱水したもの 分解酵素はスクラーゼ ( インベルターゼ ) となる 出題としては少ないが, 念のため覚えておきたい 構造式はあまり重要とはされないが, 書けるに越したことはない スクロースは還元性はない フルクトースが関連するショ糖の構造式の問題はたまに出題される また, 還元性に関してはよく出題される 二糖類はスクロースを除いて還元性がある 開環してアルデヒド基を形成する部分がグリコシド結合に使われているからである この理由は述べられるようにしておいてほしい この他二糖類にはラクトースなどがある c 新快速のページ講義ノートシリーズ化学
3 多糖類 ( 改訂 2.0) 単糖類が縮合重合したもので (C 6 H 10 O 5 ) n α グルコースが重合したものはデンプン β グルコースが重合したものは繊維デンプンはアミロース アミロペクチンセルロースは繊維 デンプンすべて α グルコースからできているもの (C 6 H 10 O 5 ) n で表される 途中, 枝分かれのないアミロースと, 枝分かれのあるアミロペクチンがある アミロースは 1 番と 4 番の炭素どうしがグリコシド結合したもので, らせん構造が長く, 水によく溶けてヨウ素液で青色に染まる またアミロペクチンは 1 番と 4 番のほか, 所々 6 番と 1 番の炭素どうしがグリコシド結合をする そのためらせんは短くヨウ素液ではアミロースほど鮮やかな色にならず, 赤紫色になる また, 水には溶けにくい デンプンはアミラーゼで加水分解され, デキストリンを経て二糖類のマルトースになる 例題デンプン 400g を加水分解して得られるグルコースの質量を有効数字 2 桁で求めよ C=12,H =1.0,O =16 解答 グルコース単位で考える デンプン 400g 中に含まれる α グルコース 1 単位の C 6 H 10 O 5 は式量 162 なので, グルコース単位は 400 mol が存在する これは分解して出 162 てくる α グルコース (C 6 H 12 O 6 分子量 180) のモル数そのものであるから, = ; g セルロース β グルコースが連結した糖類をセルロースという セルロースは植物の細胞壁などを構成する 水にも熱水にも溶けにくい糖である セルロースを溶かせる溶液としてはシュバイツァー試薬というものがある 酵素セルラーゼで加水分解され, セロビオースになる セルロースに無水酢酸 (CH 3 CO) 2 O を作用させて, ヒドロキシル基をアセチル化をしたものをアセチルセルロースという 例題セルロース 200g を完全にアセチル化するための無水酢酸の質量を求めてみる まず 200g に含まれる β グルコースは mol となる 糖を構成するグルコース単位 1 分子中にはアセチル化されるヒドロキシル基は 3 つあるので, この 3 倍のモル数の無水酢酸が必要となる 無水酢酸の分子量は 102 なので = ; g c 新快速のページ講義ノートシリーズ化学
4 アミノ酸 ( 改訂 2.0) α- アミノ酸は 1 つの炭素原子に水素, アミノ基, カルボキシル基が結合している他のアミノ酸とペプチド結合をする アミノ酸とはアミノ酸はカルボキシル基 COOH とアミノ基 NH 2 を持つ炭化水素である カルボキシル基のついた炭素から順に α,β,γ, δ, と続き, カルボキシル基とアミノ基が同じ炭素原子に結合しているものを α-アミノ酸とよぶ 高校化学では基本的に α-アミノ酸のみを扱う α-アミノ酸は 1 つの炭素原子に水素, アミノ基, カルボキシル基が結合しており, あと 1 つは任意である これをここでは X と書くことにする X が H となると, グリシンとよぶが, このように X の部分が何であるかによって別個に名前がつけられている 水溶液中での電離アミノ酸は親水基であるカルボキシル基とアミノ基を持つので水に溶ける このときカルボキシル基とアミノ基はそれぞれ COOH À COO +H + 1 NH 2 +H + À NH 3+ 2 のように電離する 水溶液の液性を塩基性にする (H + を減らす ) とルシャトリエの原理より,1の反応が右へ,2の反応は左へ平衡が移動し, その結果 COO が増えて NH + 3 が減る 水溶液の中では1,2の反応が同時に起こっており,pH によって右図の L,M,N の存在比が変化する また1と2 が同時に起こった状態である N は双性イオンとよばれる 等電点平衡を使い, うまく ph を調整すると L と M の濃度が等しくなり, このときの ph を等電点という L À N+H + K 1 = [N][H+ ] [L] N À M+H + K 2 = [M][H+ ] [N] の式において [L]=[M] であればよいので, 辺々かけ合わせると [M] と [L], そして [N] がすべて約分され,K 1 K 2 =[H + ] 2 となる 水素イオンの濃度が分かったので, 等電点は次のように表せる ph = log K 1 K 2 c 新快速のページ講義ノートシリーズ化学
5 タンパク質 (I) タンパク質の性質 ( 改訂 2.0) アミノ酸が重合した大きな分子タンパク質を構成するアミノ酸は 20 種類ビウレット反応に陽性その他反応を覚える水に溶けて親水コロイドとなる タンパク質の定義アミノ基とカルボキシル基が脱水して結合したものをアミド結合とよぶが,α-アミノ酸どうしのアミド結合はペプチド結合とよばれる アミノ酸が 2 つでペプチド結合が 1 つのものをジペプチド, アミノ酸が 3 つのものをトリペプチド と言い, 多くのアミノ酸が連結したものをポリペプチドという そして分子量が 10,000 以上 ( 一部 5,000 程度のタンパク質もある ) のポリペプチドがタンパク質である タンパク質の各種反応 ビウレット反応タンパク質の水溶液に水酸化ナトリウム水溶液と, 硫酸銅 (II) 水溶液を加えると赤紫色になる これはペプチド結合が 2 個以上ある場合のみ反応する アミノ酸が 2 個のペプチドではビウレット反応しない あくまでアミノ酸が 3 個以上つながっている必要がある キサントプロテイン反応タンパク質に濃硝酸を加えて加熱すると黄色い沈殿を作ることがある これはタンパク質内にあるベンゼン環がニトロ化されるためであり, キサントプロテイン反応とよばれる キサントとは, 英単語の xanthic( 黄色のという形容詞 ) で, プロテインは protein( タンパク質 ) である そのため, 構成アミノ酸としてフェニルアラニンやチロシンのようなベンゼン環を持つアミノ酸を含むものであればこの反応が起こる 硫黄反応構成アミノ酸としてシステインやメチオニンを含むタンパク質をまず水酸化ナトリウム水溶液に溶かして酢酸にて中和し, 酢酸鉛水溶液を加えて加熱すると黒色沈殿を生じる これは硫化鉛の沈殿であり, 硫黄反応とよばれる 普通のタンパク質はシステインの他, シスチンという, システインどうしが結合したものを含むため, 硫黄反応は一般的なタンパク質なら陽性となる 上記 3 つの反応はペプチドの構成アミノ酸決定の問題では重要な考え方である 例えばあるペプチドでビウレット反応は起こさなかったがキサントプロテイン反応と硫黄反応を起こしたとすれば, それはベンゼン環を持つアミノ酸と硫黄を持つアミノ酸で構成されたジペプチドと考えられる 例としてフェニルアラニンとシステインがペプチド結合したものとも考えることができる c 新快速のページ講義ノートシリーズ化学
6 タンパク質 (II) 酵素 タンパク質は立体構造らせんの α- ヘリックス構造ジグザグの β- シート構造酵素は生物体内での触媒最適 ph と最適温度がある タンパク質の構造前項 タンパク質 (I) で説明した通り, アミノ酸どうしがペプチド結合をし, 分子量が 5000 以上になったものをタンパク質という タンパク質のような長いペプチドはらせん構造であるα-ヘリックス構造やジグザグのβ-シート構造をとる またタンパク質は構成アミノ酸の種類によって特有の立体構造をとる これは 2 個のシステインの SH どうしが酸化されて S と S が結合した S S 結合もしくはジスルフィド結合とよばれるものと, 水素結合やファンデルワールス力などが複雑に絡み合っている 変性タンパク質は結構ヤワである 熱, 強酸, 強塩基, 水以外の液体, 金属イオンなどに弱く, 立体構造が変わってしまう これを変性という 酵素生体内では様々な化学反応が行われている たった今, あなたの体内でも無数の化学反応が進んでいる途中である その化学反応を触媒するものが酵素とよばれるものである 酵素はタンパク質でできている そのタンパク質の立体構造が標的となる物質と見事にハマるのである 酵素の標的となる物質を基質, 酵素タンパク質の, 基質と結合する部分のことを活性部位 ( または活性中心 ) という 酵素と基質が結合したものを酵素基質複合体という 酵素を構成するのもタンパク質なので, 独自の立体構造を持つ その立体構造により相手, つまり基質が決まるが, この性質を基質特異性という また, 温度や ph がちょうどよくないとはたらいてくれないのである ちょうどいい温度を最適温度, ちょうどいい ph を最適 ph という 人体の中にある酵素は最適温度は 37 前後, つまり体温と同じ温度が多い 最適 ph は種類によって違う 酵素はタンパク質なのでもちろん, 加熱すると変性してしまい触媒能力を失ってしまう ということは酵素として役に立たなくなる これを酵素の失活という 覚えてほしい酵素はいくつかあるが, 代表を挙げる その他は教科書などで確認してもらいたい デンプンを分解するアミロースがだ液の中に, タンパク質を分解するペプシンが胃液の中, トリプシンがすい液の中にある 油脂を分解するのはリパーゼである また, 過酸化水素を分解するカタラーゼが肝臓や血液中にある c 新快速のページ講義ノートシリーズ化学
7 合成繊維 (I) ( 改訂 2.5) ε- カプロラクタム 6- ナイロンヘキサメチレンジアミン + アジピン酸 6,6- ナイロンテレフタル酸 + エチレングリコール ポリエチレンテレフタラート 覚えるべき単量体合成繊維としてよく出題される 3 つを扱う それぞれ単量体の名前, 構造式と, 多量体の名前, 構造式を覚えるようにしたい そうすれば計算問題が出されても比較的楽に答えられる ここでは 6-ナイロン,6,6-ナイロン, ポリエチレンテレフタラートを扱う ポリエチレンテレフタラートベンゼン環に 2 つのカルボキシル基がパラ位に結合したテレフタル酸と, エチレングリコール (1,2-エタンジオール) はエステル結合を繰り返してポリエチレンテレフタラート (PET) を作る このように,2 種類の単量体から重合体が作られる反応を共重合という ペットボトルの他, オーディオテープや衣類のポリエステル繊維として使われている 6- ナイロンカプロラクタム ( 正式名称は ε- カプロラクタム ) を必ず覚えてもらいたい 5 つのメチレン基をアミド結合で閉じて 1 周した環状分子である カプロラクタムはいったん加水分解によりリングが切れて, アミノカプロン酸になる そこで他のアミノカプロン酸と再びアミド結合をして重合する これが開環重合であり,6-ナイロンができる 炭素原子が 6 個連続で続くためにこの名前となっている 6,6-ナイロン前述の 6-ナイロンの他, アジピン酸 HOOC (CH 2 ) 4 COOH ヘキサメチレンジアミン H 2 N (CH 2 ) 6 NH 2 とがアミド結合により共重合して出来上がる 6,6-ナイロンがある 例題 6,6-ナイロン 100g の中に含まれる窒素原子の質量を求めよ 有効数字は 2 桁で 原子量は H=1.0, C=12, O=16, N=14 重合度を n とすると 6,6-ナイロンの式量は 226n で, そのうち窒素原子は 28n に相当するので, n =12.38 ; 12g 226n c 新快速のページ講義ノートシリーズ化学
8 合成繊維 (II) ( 改訂 2.0) アクリロニトリルとアクリル酸メチルの共重合における計算練習ポリビニルアルコールは木工用ボンドの原料である酢酸ビニルから アクリル系繊維アクリロニトリル CH 2 =CH(CN) はビニル基にシアノ基が結合したものであり, アクリル繊維に使われる アクリル酸メチルなどとともに重合される 2 種類の単量体が重合される反応を共重合とよぶ 例題アクリロニトリルとアクリル酸メチルを 4:1の比で共重合した重合体に含まれる窒素原子の質量パーセントを求めよ ただし,C =12, H=1.0, N=14, O=16, 有効数字は 2 桁 解答 式量はアクリロニトリルが 53, アクリル酸メチルが 86 であり, 反応式は 4nCH 2 CH(CN) + nch 2 CH(COOCH 3 ) [ CH 2 CH(CN) ] 4n [ CH 2 CH(COOCH 3 ) ] n となる この重合体 1mol に含まれる窒素は 14 4n[g], 全体の質量, つまり分子量は 53 4n +86 n[g] なので 14 4n 100 = ; 19 % 53 4n +86 n ビニロンビニロンは複雑な反応を経て作られる 正誤問題でも出されることがあるので流れはしっかりおさえておきたい まずポリ酢酸ビニルのエステル結合をけん化によって加水分解し, ポリビニルアルコールを作る ビニルアルコールをそのまま付加重合することはできない なぜならビニルアルコールは非常に不安定で, すぐにアセトアルデヒドになってしまうからである ポリビニルアルコールはメチレン基 CH 2 が続くが,1 つおきの C ごとにヒドロキシル基 OH が結合している そこへホルムアルデヒドを作用すると, 脱水がおこり, 一種のエーテル結合ができる この反応をアセタール化といい, ここでできあがったものがビニロンである なお, ビニロンはすべてのヒドロキシル基をアセタール化するわけではない エーテル結合ビニロンは全体の 3 割程度しかアセタール化されない しかしアセタール化された部分は 2 個のエーテル結合を持つため, 水には溶けにくくなる アルコールポリビニルアルコールはその名の通りアルコールなのでヒドロキシル基をもつ ビニロンはアセタール化されずに残るヒドロキシル基が多いため, 水とはよく馴染み, 吸水性に富む そのため全ヒドロキシル基をアセタール化するわけではない c 新快速のページ講義ノートシリーズ化学
9 合成樹脂 ( 改訂 2.0) 覚えるべきプラスチックビニル基が付加重合してできた鎖式のものは熱可塑性立体網目構造のものは熱硬化性単量体をはっきり覚えておくべき 熱可塑性樹脂プラスチックは種類が多い 熱を加えても化学的な構造が変わらないものである アクリルプラスチックといってもさまざまなものがあるが, 代表としては硬くて透明なアクリルがある CH 2 =CH(COOH) がアクリル酸であり, このカルボキシル基側の炭素原子に結合している水素をメチル基にしたものをメチルアクリル酸, 略してメタクリル酸, さらにカルボキシル基をメタノールでエステル化したものはメタクリル酸メチルとなり, これを付加重合したポリメタクリル酸メチルがいわゆるアクリル素材である プラスチック板以外にも, コンタクトレンズや光ファイバーなどにも使われている スチロール用途は発泡スチロールや, 食品の容器などである スチレン CH 2 =CH(C 6 H 5 ) を付加重合したものである 塩化ビニル水道管などに使われる 塩ビ である これは塩化ビニル CH 2 =CHClが付加重合したポリ塩化ビニルのことである 化学薬品に強く, 熱に弱い ポリエチレン ポリプロピレンプラスチックでもよく見かけるのがこれである エチレン CH 2 =CH 2 やプロピレン CH 2 =CHCH 3 が付加重合したもので, バケツ, ケース, クリアファイルなどに利用されている 以上 4 つ, まずはこれらを覚えることから始まる 熱硬化性樹脂立体網目構造のものは熱硬化性のものが多い フェノール樹脂フェノールとホルムアルデヒドを共重合すると, ベンゼン環の水素とホルムアルデヒドの酸素原子とで脱水が起こり, 網目構造になる これをフェノール樹脂という 立体網目構造の熱硬化性樹脂である また, ベークライトともよばれ, プリント基板などにも使われている プリント基板というのは機械の中に入っており, 回路を固定するものである 中学の技術家庭などで組み立てた人も多いのではないだろうか 尿素樹脂尿素 (NH 2 ) 2 CO もホルムアルデヒドと共重合することにより, 尿素樹脂ができる アミノ基の H とホルムアルデヒドの酸素とで脱水が起こるのである 尿素樹脂はユリア樹脂ともよばれている 尿素樹脂の代表的な用途としては衣類のボタンなどが挙げられる c 新快速のページ講義ノートシリーズ化学
10 イオン交換樹脂 ( 改訂 2.0) 陽イオン交換樹脂 陽イオンを水素イオンに陰イオン交換樹脂 陰イオンを水酸化物イオンに両方使うと純水が得られる 陽イオン交換樹脂スチレンと p-ジビニルベンゼンを共重合させ, さらに濃硫酸を加えてベンゼン環の一部をスルホン化し, スルホ基をつけるなどの処置をとったものは陽イオン交換樹脂とよばれる つまり, ポリスチレンどうしが所々ベンゼン環でつながっており, さらにベンゼン環にスルホ基がついているものと考えればよい ここに塩化ナトリウム水溶液や塩化カルシウム水溶液などのイオン結合性の溶質を溶かした水溶液を通すと, 陽イオンであるナトリウムイオン Na + やカルシウムイオン Ca 2+ などがスルホ基で引っかかって代わりにスルホ基についていた水素イオンが外に出される 陽イオンが水素イオンになるため, 陽イオン交換樹脂に電解質水溶液を通した場合は一般的には ph は下がって酸性に近づく メチルオレンジを入れておいて陽イオン交換樹脂を使うと酸性になるため, 赤色に変色する 陰イオン交換樹脂陽イオン交換樹脂と同じようにスチレン,p-ジビニルベンゼンを共重合した樹脂に, トリメチルアミンという原子団に水酸化物イオンを結合させた N + (CH 3 ) 3 OH のような基をつけたものを考える ここに塩化ナトリウム水溶液や硫酸カリウム水溶液などを通すと, 塩化物イオン Cl や硫酸イオン SO 2 4 などの代わりに水酸化物イオンが外に出される このような樹脂のことを陰イオン交換樹脂という 陰イオン交換樹脂に水溶液を通すと水酸化物イオンが増えるので塩基性に近づく 例題硫酸ナトリウム水溶液 Na 2 SO 4 を陰イオン交換樹脂に通す 通した水溶液を 10m` を中和するのに 0.10mol/` 塩酸が 20m` が必要だった 初めの硫酸ナトリウム水溶液のモル濃度を求めよ 解答 求める濃度を x[mol/`] とする Na 2 SO 4 +2OH 2NaOH + SO 2 4 のように 1mol の硫酸ナトリウムから 2mol の水酸化ナトリウムができるため 2 価として扱う x = x = mol/` 脱イオン水陽イオン交換樹脂では色々な陽イオンが水素イオン H + となる また陰イオン交換樹脂では色々な陰イオンが水酸化物イオン OH となる ではこの 2 つの樹脂を同時に使って電解質の水溶液を接触させた場合はどうなるか これは H + と OH が出るので,2 つが結合して水が出る このようにして作られた水を脱イオン水という c 新快速のページ講義ノートシリーズ化学
木村の有機化学小ネタ 糖の構造 単糖類の鎖状構造と環状構造 1.D と L について D-グルコースとか L-アラニンの D,L の意味について説明する 1953 年右旋性 ( 偏光面を右に曲げる ) をもつグリセルアルデヒドの立体配置が
 糖の構造 単糖類の鎖状構造と環状構造.D と L について D-グルコースとか L-アラニンの D,L の意味について説明する 9 年右旋性 ( 偏光面を右に曲げる ) をもつグリセルアルデヒドの立体配置が X 線回折実験により決定され, 次の約束に従い, 構造式が示された 最も酸化された基を上端にする 上下の原子または原子団は中心原子より紙面奥に位置する 左右の原子または原子団は中心原子より紙面手前に位置する
糖の構造 単糖類の鎖状構造と環状構造.D と L について D-グルコースとか L-アラニンの D,L の意味について説明する 9 年右旋性 ( 偏光面を右に曲げる ) をもつグリセルアルデヒドの立体配置が X 線回折実験により決定され, 次の約束に従い, 構造式が示された 最も酸化された基を上端にする 上下の原子または原子団は中心原子より紙面奥に位置する 左右の原子または原子団は中心原子より紙面手前に位置する
2019 年度大学入試センター試験解説 化学 第 1 問問 1 a 塩化カリウムは, カリウムイオン K + と塩化物イオン Cl - のイオン結合のみを含む物質であり, 共有結合を含まない ( 答 ) 1 1 b 黒鉛の結晶中では, 各炭素原子の 4 つの価電子のうち 3 つが隣り合う他の原子との
 219 年度大学入試センター試験解説 化学 第 1 問問 1 a 塩化カリウムは, カリウムイオン K + と塩化物イオン Cl - のイオン結合のみを含む物質であり, 共有結合を含まない ( 答 ) 1 1 b 黒鉛の結晶中では, 各炭素原子の 4 つの価電子のうち 3 つが隣り合う他の原子との共有結合に使われ, 残りの 1 つは結晶を構成する層上を自由に移動している そのため, 黒鉛は固体の状態で電気をよく通す
219 年度大学入試センター試験解説 化学 第 1 問問 1 a 塩化カリウムは, カリウムイオン K + と塩化物イオン Cl - のイオン結合のみを含む物質であり, 共有結合を含まない ( 答 ) 1 1 b 黒鉛の結晶中では, 各炭素原子の 4 つの価電子のうち 3 つが隣り合う他の原子との共有結合に使われ, 残りの 1 つは結晶を構成する層上を自由に移動している そのため, 黒鉛は固体の状態で電気をよく通す
2004 年度センター化学 ⅠB p1 第 1 問問 1 a 水素結合 X HLY X,Y= F,O,N ( ) この形をもつ分子は 5 NH 3 である 1 5 b 昇華性の物質 ドライアイス CO 2, ヨウ素 I 2, ナフタレン 2 3 c 総電子数 = ( 原子番号 ) d CH 4 :6
 004 年度センター化学 ⅠB p 第 問問 a 水素結合 X HLY X,Y= F,O,N ( ) この形をもつ分子は 5 NH である 5 b 昇華性の物質 ドライアイス CO, ヨウ素 I, ナフタレン c 総電子数 = ( 原子番号 ) d CH 4 :6+ 4 = 0個 6+ 8= 4個 7+ 8= 5個 + 7= 8個 4 + 8= 0個 5 8= 6個 4 構造式からアプローチして電子式を書くと次のようになる
004 年度センター化学 ⅠB p 第 問問 a 水素結合 X HLY X,Y= F,O,N ( ) この形をもつ分子は 5 NH である 5 b 昇華性の物質 ドライアイス CO, ヨウ素 I, ナフタレン c 総電子数 = ( 原子番号 ) d CH 4 :6+ 4 = 0個 6+ 8= 4個 7+ 8= 5個 + 7= 8個 4 + 8= 0個 5 8= 6個 4 構造式からアプローチして電子式を書くと次のようになる
Taro-化学3 酸塩基 最新版
 11 酸 塩基の反応 P oint.29 酸 塩基 ブレンステッドの酸 塩基 酸 水素イオンを 物質 塩基 水素イオンを 物質 NH3 + H2O NH4 + + OH - 酸 塩基の性質 1 リトマス紙 2 フェノールフタレイン溶液 3BTB 液 4 メチルオレンジ 5 金属と反応 6 味 7 水溶液中に存在するイオン 酸 塩基 酸 塩基の分類 1 価数による分類 1 価 2 価 3 価 酸 塩基
11 酸 塩基の反応 P oint.29 酸 塩基 ブレンステッドの酸 塩基 酸 水素イオンを 物質 塩基 水素イオンを 物質 NH3 + H2O NH4 + + OH - 酸 塩基の性質 1 リトマス紙 2 フェノールフタレイン溶液 3BTB 液 4 メチルオレンジ 5 金属と反応 6 味 7 水溶液中に存在するイオン 酸 塩基 酸 塩基の分類 1 価数による分類 1 価 2 価 3 価 酸 塩基
Word Pro - matome_7_酸と塩基.lwp
 酸と 酸と 酸 acid 亜硫酸 pka =.6 pka =.9 酸 acid ( : 酸, すっぱいもの a : 酸の, すっぱい ) 酸性 p( ) 以下 酸っぱい味 ( 酸味 ) を持つ リトマス ( ) BTB( ) 金属と反応して ( ) を発生 ( 例 )Z l Zl リン酸 P pka =.5 pka =. pka =.8 P P P P P P P 酸性のもと 水素イオン 塩化水素
酸と 酸と 酸 acid 亜硫酸 pka =.6 pka =.9 酸 acid ( : 酸, すっぱいもの a : 酸の, すっぱい ) 酸性 p( ) 以下 酸っぱい味 ( 酸味 ) を持つ リトマス ( ) BTB( ) 金属と反応して ( ) を発生 ( 例 )Z l Zl リン酸 P pka =.5 pka =. pka =.8 P P P P P P P 酸性のもと 水素イオン 塩化水素
細胞の構造
 大阪電気通信大学 5/8/18 本日の講義の内容 酵素 教科書 第 4 章 触媒反応とエネルギーの利用 酵素の性質 酵素反応の調節 酵素の種類 触媒の種類 無機物からなる無機触媒と有機物からなる有機触媒がある 触媒反応とエネルギーの利用 1 無機触媒の例 過酸化水素水に二酸化マンガンを入れると過酸化水素水が分解して水と酸素になる 2 有機触媒の例 細胞内に含まれるカタラーゼという酵素を過酸化水素水に加えると
大阪電気通信大学 5/8/18 本日の講義の内容 酵素 教科書 第 4 章 触媒反応とエネルギーの利用 酵素の性質 酵素反応の調節 酵素の種類 触媒の種類 無機物からなる無機触媒と有機物からなる有機触媒がある 触媒反応とエネルギーの利用 1 無機触媒の例 過酸化水素水に二酸化マンガンを入れると過酸化水素水が分解して水と酸素になる 2 有機触媒の例 細胞内に含まれるカタラーゼという酵素を過酸化水素水に加えると
化学基礎 化学 化学基礎 化学 ( 全問必答 ) 第 1 問次の各問い ( 問 1~ 6 ) に答えよ 解答番号 1 ~ 8 ( 配点 25) 問 1 次の a ~ c に当てはまるものを, それぞれの解答群 1~4 のうちから一つずつ 選べ a Al 3+ と物質量の比 2 :3 で化合物をつくる
 ( 全問必答 ) 第 1 問次の各問い ( 問 1~ 6 ) に答えよ 解答番号 1 ~ 8 ( 配点 5) 問 1 次の a ~ c に当てはまるものを, それぞれの解答群 1~4 のうちから一つずつ 選べ a Al + と物質量の比 : で化合物をつくる多原子イオン 1 1 塩化物イオン 酸化物イオン 硫酸イオン 4 リン酸イオン b 水溶液を白金線につけ, ガスバーナーの外炎に入れると, 黄色の炎が見ら
( 全問必答 ) 第 1 問次の各問い ( 問 1~ 6 ) に答えよ 解答番号 1 ~ 8 ( 配点 5) 問 1 次の a ~ c に当てはまるものを, それぞれの解答群 1~4 のうちから一つずつ 選べ a Al + と物質量の比 : で化合物をつくる多原子イオン 1 1 塩化物イオン 酸化物イオン 硫酸イオン 4 リン酸イオン b 水溶液を白金線につけ, ガスバーナーの外炎に入れると, 黄色の炎が見ら
2014 年度大学入試センター試験解説 化学 Ⅰ 第 1 問物質の構成 1 問 1 a 1 g に含まれる分子 ( 分子量 M) の数は, アボガドロ定数を N A /mol とすると M N A 個 と表すことができる よって, 分子量 M が最も小さい分子の分子数が最も多い 分 子量は, 1 H
 01 年度大学入試センター試験解説 化学 Ⅰ 第 1 問物質の構成 1 問 1 a 1 g に含まれる分子 ( 分子量 M) の数は, アボガドロ定数を N A /mol とすると M N A 個 と表すことができる よって, 分子量 M が最も小さい分子の分子数が最も多い 分 子量は, 1 = 18 N = 8 3 6 = 30 Ne = 0 5 = 3 6 l = 71 となり,1 が解答 (
01 年度大学入試センター試験解説 化学 Ⅰ 第 1 問物質の構成 1 問 1 a 1 g に含まれる分子 ( 分子量 M) の数は, アボガドロ定数を N A /mol とすると M N A 個 と表すことができる よって, 分子量 M が最も小さい分子の分子数が最も多い 分 子量は, 1 = 18 N = 8 3 6 = 30 Ne = 0 5 = 3 6 l = 71 となり,1 が解答 (
2011年度 化学1(物理学科)
 014 年度スペシャルプログラム (1/17) 酸 塩基 : 酸 塩基の定義を確認する No.1 1 酸と塩基の定義に関する以下の文章の正を答えよ 場合は 間違いを指摘せよ 文章正指摘 1 酸と塩基の定義はアレニウスとブレンステッド ローリーの 種類である ルイスの定義もある アレニウスの定義によれば 酸とは H を含むものである 水に溶けて 電離して H+ を出すものである 3 アレニウスの定義によれば
014 年度スペシャルプログラム (1/17) 酸 塩基 : 酸 塩基の定義を確認する No.1 1 酸と塩基の定義に関する以下の文章の正を答えよ 場合は 間違いを指摘せよ 文章正指摘 1 酸と塩基の定義はアレニウスとブレンステッド ローリーの 種類である ルイスの定義もある アレニウスの定義によれば 酸とは H を含むものである 水に溶けて 電離して H+ を出すものである 3 アレニウスの定義によれば
高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ
![高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ 高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ](/thumbs/94/118405200.jpg) 高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ溶質の20% 溶液 100gと30% 溶液 200gを混ぜると質量 % はいくらになるか ( 有効数字
高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ溶質の20% 溶液 100gと30% 溶液 200gを混ぜると質量 % はいくらになるか ( 有効数字
練習問題
 生物有機化学 練習問題 ( はじめに ) 1 以下の各問題中で 反応機構を書け ということは 電子の流れを曲がった矢印を用いて説明せよ ということである 単純に生成物を書くだけでは正答とはならない 2 で表される結合は 立体異性体の混合物であることを表す 3 反応式を表す矢印 ( ) に書かれている試薬に番号が付いている場合 1. の試薬 を十分に反応させた後に 2. の試薬を加えることを表す 例えば
生物有機化学 練習問題 ( はじめに ) 1 以下の各問題中で 反応機構を書け ということは 電子の流れを曲がった矢印を用いて説明せよ ということである 単純に生成物を書くだけでは正答とはならない 2 で表される結合は 立体異性体の混合物であることを表す 3 反応式を表す矢印 ( ) に書かれている試薬に番号が付いている場合 1. の試薬 を十分に反応させた後に 2. の試薬を加えることを表す 例えば
木村の有機化学小ネタ セルロース系再生繊維 再生繊維セルロースなど天然高分子物質を化学的処理により溶解後, 細孔から押し出し ( 紡糸 という), 再凝固させて繊維としたもの セルロース系の再生繊維には, ビスコースレーヨン, 銅アンモニア
 セルロース系再生繊維 再生繊維セルロースなど天然高分子物質を化学的処理により溶解後, 細孔から押し出し ( 紡糸 という), 再凝固させて繊維としたもの セルロース系の再生繊維には, ビスコースレーヨン, 銅アンモニアレーヨンがあり, タンパク質系では, カゼイン, 大豆タンパク質, 絹の糸くず, くず繭などからの再生繊維がある これに対し, セルロースなど天然の高分子物質の誘導体を紡糸して繊維としたものを半合成繊維と呼び,
セルロース系再生繊維 再生繊維セルロースなど天然高分子物質を化学的処理により溶解後, 細孔から押し出し ( 紡糸 という), 再凝固させて繊維としたもの セルロース系の再生繊維には, ビスコースレーヨン, 銅アンモニアレーヨンがあり, タンパク質系では, カゼイン, 大豆タンパク質, 絹の糸くず, くず繭などからの再生繊維がある これに対し, セルロースなど天然の高分子物質の誘導体を紡糸して繊維としたものを半合成繊維と呼び,
化学 1( 応用生物 生命健康科 現代教育学部 ) ( 解答番号 1 ~ 29 ) Ⅰ 化学結合に関する ⑴~⑶ の文章を読み, 下の問い ( 問 1~5) に答えよ ⑴ 塩化ナトリウム中では, ナトリウムイオン Na + と塩化物イオン Cl - が静電気的な引力で結び ついている このような陽イ
 化学 1( 応用生物 生命健康科 現代教育学部 ) ( 解答番号 1 ~ 29 ) Ⅰ 化学結合に関する ⑴~⑶ の文章を読み, 下の問い ( 問 1~5) に答えよ ⑴ 塩化ナトリウム中では, ナトリウムイオン Na + と塩化物イオン Cl - が静電気的な引力で結び ついている このような陽イオンと陰イオンの静電気的な引力による結合を 1 1 という ⑵ 2 個の水素原子は, それぞれ1 個の価電子を出し合い,
化学 1( 応用生物 生命健康科 現代教育学部 ) ( 解答番号 1 ~ 29 ) Ⅰ 化学結合に関する ⑴~⑶ の文章を読み, 下の問い ( 問 1~5) に答えよ ⑴ 塩化ナトリウム中では, ナトリウムイオン Na + と塩化物イオン Cl - が静電気的な引力で結び ついている このような陽イオンと陰イオンの静電気的な引力による結合を 1 1 という ⑵ 2 個の水素原子は, それぞれ1 個の価電子を出し合い,
< イオン 電離練習問題 > No. 1 次のイオンの名称を書きなさい (1) H + ( ) (2) Na + ( ) (3) K + ( ) (4) Mg 2+ ( ) (5) Cu 2+ ( ) (6) Zn 2+ ( ) (7) NH4 + ( ) (8) Cl - ( ) (9) OH -
 < イオン 電離練習問題 > No. 1 次のイオンの名称を書きなさい (1) + (2) Na + (3) K + (4) Mg 2+ (5) Cu 2+ (6) Zn 2+ (7) N4 + (8) Cl - (9) - (10) SO4 2- (11) NO3 - (12) CO3 2- 次の文中の ( ) に当てはまる語句を 下の選択肢から選んで書きなさい 物質の原子は (1 ) を失ったり
< イオン 電離練習問題 > No. 1 次のイオンの名称を書きなさい (1) + (2) Na + (3) K + (4) Mg 2+ (5) Cu 2+ (6) Zn 2+ (7) N4 + (8) Cl - (9) - (10) SO4 2- (11) NO3 - (12) CO3 2- 次の文中の ( ) に当てはまる語句を 下の選択肢から選んで書きなさい 物質の原子は (1 ) を失ったり
DVIOUT-酸と塩
 中和反応 中和反応は H + + OH H 2 O 酸の溶質分子と塩基の溶質分子それぞれのイオン価数に注目するまた, 酸, 塩基の強さにも注目する イオンのモル数に注目中和は, 酸性溶液から出る水素イオンと塩基性溶液から出る 水酸化物イオンの物質量が一致したときに起こる 最も簡単な 例は塩酸と水酸化ナトリウム水溶液である 塩酸は 1 価の酸 で, 水酸化ナトリウム水溶液は 1 価の塩基なので HCl
中和反応 中和反応は H + + OH H 2 O 酸の溶質分子と塩基の溶質分子それぞれのイオン価数に注目するまた, 酸, 塩基の強さにも注目する イオンのモル数に注目中和は, 酸性溶液から出る水素イオンと塩基性溶液から出る 水酸化物イオンの物質量が一致したときに起こる 最も簡単な 例は塩酸と水酸化ナトリウム水溶液である 塩酸は 1 価の酸 で, 水酸化ナトリウム水溶液は 1 価の塩基なので HCl
Microsoft Word 後期化学問題
 問 1~ 問 28 の解答を, 指定された解答欄にマークせよ 必要があれば, 次の数値を用いよ 原子量 :H = 1.0,C = 12,N = 14,O = 16,Na = 23,P = 31,S = 32, Cl = 35.5,Fe = 56,Cu = 64,I = 127,Pb = 207 アボガドロ定数 :6.02 10 23 / mol 気体定数 :8.3 10 3 Pa L / (K mol)
問 1~ 問 28 の解答を, 指定された解答欄にマークせよ 必要があれば, 次の数値を用いよ 原子量 :H = 1.0,C = 12,N = 14,O = 16,Na = 23,P = 31,S = 32, Cl = 35.5,Fe = 56,Cu = 64,I = 127,Pb = 207 アボガドロ定数 :6.02 10 23 / mol 気体定数 :8.3 10 3 Pa L / (K mol)
▲ 電離平衡
 電離平衡演習その 1 [04 金沢 ] 電離平衡 1 1 酢酸の濃度 C mol/l の水溶液がある 酢酸の電離度を とすると, 平衡状態で溶液中に存在する酢酸イオンの濃度は Ⅰ mol/l, 電離していない酢酸の濃度は Ⅱ mol/l, 水素イオンの濃度は Ⅲ mol/l と表される ここで, 電離度が 1より非常に小さく,1 1と近似すると, 電離定数は Ⅳ mol/l と表される いま,3.0
電離平衡演習その 1 [04 金沢 ] 電離平衡 1 1 酢酸の濃度 C mol/l の水溶液がある 酢酸の電離度を とすると, 平衡状態で溶液中に存在する酢酸イオンの濃度は Ⅰ mol/l, 電離していない酢酸の濃度は Ⅱ mol/l, 水素イオンの濃度は Ⅲ mol/l と表される ここで, 電離度が 1より非常に小さく,1 1と近似すると, 電離定数は Ⅳ mol/l と表される いま,3.0
木村の理論化学小ネタ 熱化学方程式と反応熱の分類発熱反応と吸熱反応化学反応は, 反応の前後の物質のエネルギーが異なるため, エネルギーの出入りを伴い, それが, 熱 光 電気などのエネルギーの形で現れる とくに, 化学変化と熱エネルギーの関
 熱化学方程式と反応熱の分類発熱反応と吸熱反応化学反応は, 反応の前後の物質のエネルギーが異なるため, エネルギーの出入りを伴い, それが, 熱 光 電気などのエネルギーの形で現れる とくに, 化学変化と熱エネルギーの関係を扱う化学の一部門を熱化学という 発熱反応反応前の物質のエネルギー 大ネルギ熱エネルギーー小エ反応後の物質のエネルギー 吸熱反応 反応後の物質のエネルギー 大ネルギー熱エネルギー小エ反応前の物質のエネルギー
熱化学方程式と反応熱の分類発熱反応と吸熱反応化学反応は, 反応の前後の物質のエネルギーが異なるため, エネルギーの出入りを伴い, それが, 熱 光 電気などのエネルギーの形で現れる とくに, 化学変化と熱エネルギーの関係を扱う化学の一部門を熱化学という 発熱反応反応前の物質のエネルギー 大ネルギ熱エネルギーー小エ反応後の物質のエネルギー 吸熱反応 反応後の物質のエネルギー 大ネルギー熱エネルギー小エ反応前の物質のエネルギー
塩基に弱い : 羊毛 絹 5 繊維 : 羊毛原因 : 硫黄を含み 硫化鉛 (Ⅱ) の黒色沈殿が生じたため 羊毛以外の繊維については はじめに Pb(OH)2 の生成によって白く濁るが NaOH が多いと その後 [Pb(OH)4] 2- となり白濁は消える 発展例 1 羊毛 絹 ( ナイロンは色の変
![塩基に弱い : 羊毛 絹 5 繊維 : 羊毛原因 : 硫黄を含み 硫化鉛 (Ⅱ) の黒色沈殿が生じたため 羊毛以外の繊維については はじめに Pb(OH)2 の生成によって白く濁るが NaOH が多いと その後 [Pb(OH)4] 2- となり白濁は消える 発展例 1 羊毛 絹 ( ナイロンは色の変 塩基に弱い : 羊毛 絹 5 繊維 : 羊毛原因 : 硫黄を含み 硫化鉛 (Ⅱ) の黒色沈殿が生じたため 羊毛以外の繊維については はじめに Pb(OH)2 の生成によって白く濁るが NaOH が多いと その後 [Pb(OH)4] 2- となり白濁は消える 発展例 1 羊毛 絹 ( ナイロンは色の変](/thumbs/92/107894085.jpg) ナイロン 66 の合成 ~ 代表的な合成繊維 ~ 繊維の燃え方と反応繊維の染色 1 繊維について繊維には 天然の植物繊維 動物繊維に加えて 加工を加えた半合成繊維 モノマーから合成した合成繊維がある 繊維の種類による燃え方や薬品との反応 染色の違いについての実験と 衣料 ( 繊維 ) は高分子化合物でできていることを学ぶナイロン 66 の合成の実験を取り上げた 植物繊維 ( 綿や麻の主成分セルロース
ナイロン 66 の合成 ~ 代表的な合成繊維 ~ 繊維の燃え方と反応繊維の染色 1 繊維について繊維には 天然の植物繊維 動物繊維に加えて 加工を加えた半合成繊維 モノマーから合成した合成繊維がある 繊維の種類による燃え方や薬品との反応 染色の違いについての実験と 衣料 ( 繊維 ) は高分子化合物でできていることを学ぶナイロン 66 の合成の実験を取り上げた 植物繊維 ( 綿や麻の主成分セルロース
PowerPoint プレゼンテーション
 酵素 : タンパク質の触媒 タンパク質 Protein 酵素 Enzyme 触媒 Catalyst 触媒 Cataylst: 特定の化学反応の反応速度を速める物質 自身は反応の前後で変化しない 酵素 Enzyme: タンパク質の触媒 触媒作用を持つタンパク質 第 3 回 : タンパク質はアミノ酸からなるポリペプチドである 第 4 回 : タンパク質は様々な立体構造を持つ 第 5 回 : タンパク質の立体構造と酵素活性の関係
酵素 : タンパク質の触媒 タンパク質 Protein 酵素 Enzyme 触媒 Catalyst 触媒 Cataylst: 特定の化学反応の反応速度を速める物質 自身は反応の前後で変化しない 酵素 Enzyme: タンパク質の触媒 触媒作用を持つタンパク質 第 3 回 : タンパク質はアミノ酸からなるポリペプチドである 第 4 回 : タンパク質は様々な立体構造を持つ 第 5 回 : タンパク質の立体構造と酵素活性の関係
CERT化学2013前期_問題
 [1] から [6] のうち 5 問を選んで解答用紙に解答せよ. いずれも 20 点の配点である.5 問を超えて解答した場合, 正答していれば成績評価に加算する. 有効数字を適切に処理せよ. 断りのない限り大気圧は 1013 hpa とする. 0 C = 273 K,1 cal = 4.184 J,1 atm = 1013 hpa = 760 mmhg, 重力加速度は 9.806 m s 2, 気体
[1] から [6] のうち 5 問を選んで解答用紙に解答せよ. いずれも 20 点の配点である.5 問を超えて解答した場合, 正答していれば成績評価に加算する. 有効数字を適切に処理せよ. 断りのない限り大気圧は 1013 hpa とする. 0 C = 273 K,1 cal = 4.184 J,1 atm = 1013 hpa = 760 mmhg, 重力加速度は 9.806 m s 2, 気体
FdData理科3年
 FdData 中間期末 : 中学理科 3 年 [ 酸 アルカリとイオン ] [ 問題 ](1 学期期末 ) 次の各問いに答えよ (1) 塩酸の中に含まれている 酸 に共通するイオンは何か 1 イオンの名称を答えよ 2 また, このイオンの記号を書け (2) 水酸化ナトリウム水溶液の中に含まれている アルカリ に共通するイオンは何か 1 イオンの名称を答えよ 2 また, このイオンの記号を答えよ [
FdData 中間期末 : 中学理科 3 年 [ 酸 アルカリとイオン ] [ 問題 ](1 学期期末 ) 次の各問いに答えよ (1) 塩酸の中に含まれている 酸 に共通するイオンは何か 1 イオンの名称を答えよ 2 また, このイオンの記号を書け (2) 水酸化ナトリウム水溶液の中に含まれている アルカリ に共通するイオンは何か 1 イオンの名称を答えよ 2 また, このイオンの記号を答えよ [
木村の理論化学小ネタ 緩衝液 緩衝液とは, 酸や塩基を加えても,pH が変化しにくい性質をもつ溶液のことである A. 共役酸と共役塩基 弱酸 HA の水溶液中での電離平衡と共役酸 共役塩基 弱酸 HA の電離平衡 HA + H 3 A にお
 緩衝液 緩衝液とは, 酸や塩基を加えても,pH が変化しにくい性質をもつ溶液のことである A. 酸と塩基 弱酸 HA の水溶液中での電離平衡と酸 塩基 弱酸 HA の電離平衡 HA H 3 A において, O H O ( HA H A ) HA H O H 3O A の反応に注目すれば, HA が放出した H を H O が受け取るから,HA は酸,H O は塩基である HA H O H 3O A
緩衝液 緩衝液とは, 酸や塩基を加えても,pH が変化しにくい性質をもつ溶液のことである A. 酸と塩基 弱酸 HA の水溶液中での電離平衡と酸 塩基 弱酸 HA の電離平衡 HA H 3 A において, O H O ( HA H A ) HA H O H 3O A の反応に注目すれば, HA が放出した H を H O が受け取るから,HA は酸,H O は塩基である HA H O H 3O A
Microsoft PowerPoint - D.酸塩基(2)
 D. 酸塩基 (2) 1. 多塩基酸の ph 2. 塩の濃度と ph 3. 緩衝溶液と ph 4. 溶解度積と ph 5. 酸塩基指示薬 D. 酸塩基 (2) 1. 多塩基酸の ph 1. 多塩基酸の ph (1) 硫酸 H 2 SO 4 ( 濃度 C) 硫酸 H 2 SO 4 は2 段階で電離する K (C) (C) K a1 [H+ ][HSO 4 ] [H 2 SO 4 ] 10 5 第 1
D. 酸塩基 (2) 1. 多塩基酸の ph 2. 塩の濃度と ph 3. 緩衝溶液と ph 4. 溶解度積と ph 5. 酸塩基指示薬 D. 酸塩基 (2) 1. 多塩基酸の ph 1. 多塩基酸の ph (1) 硫酸 H 2 SO 4 ( 濃度 C) 硫酸 H 2 SO 4 は2 段階で電離する K (C) (C) K a1 [H+ ][HSO 4 ] [H 2 SO 4 ] 10 5 第 1
<連載講座>アルマイト従事者のためのやさしい化学(XVII)--まとめと問題 (1)
 アルマイト従事者のためのやさしい化学 (ⅩⅦ) - まとめと問題 1- 野口駿雄 Ⅰ. はじめに前号までに化学の基礎 アルミニウム表面処理に使用されている前処理液 ( 特にアルカリ溶液 ) 及び硫酸電解液や蓚酸電解液の分析方法について その手順を 使用する分析用器具を図示し また簡単な使用方法を付け加えながら示し 初心者でもその図を見ながら順を追って操作を行えば それぞれの分析が出来るように心がけ
アルマイト従事者のためのやさしい化学 (ⅩⅦ) - まとめと問題 1- 野口駿雄 Ⅰ. はじめに前号までに化学の基礎 アルミニウム表面処理に使用されている前処理液 ( 特にアルカリ溶液 ) 及び硫酸電解液や蓚酸電解液の分析方法について その手順を 使用する分析用器具を図示し また簡単な使用方法を付け加えながら示し 初心者でもその図を見ながら順を追って操作を行えば それぞれの分析が出来るように心がけ
<4D F736F F F696E74202D A E90B6979D89C8816B91E63195AA96EC816C82DC82C682DF8D758DC03189BB8A7795CF89BB82C68CB48E AA8E E9197BF2E >
 中学 2 年理科まとめ講座 第 1 分野 1. 化学変化と原子 分子 物質の成り立ち 化学変化 化学変化と物質の質量 基本の解説と問題 講師 : 仲谷のぼる 1 物質の成り立ち 物質のつくり 物質をつくる それ以上分けることができない粒を原子という いくつかの原子が結びついてできたものを分子という いろいろな物質のうち 1 種類の原子からできている物質を単体 2 種類以上の原子からできている物質を化合物という
中学 2 年理科まとめ講座 第 1 分野 1. 化学変化と原子 分子 物質の成り立ち 化学変化 化学変化と物質の質量 基本の解説と問題 講師 : 仲谷のぼる 1 物質の成り立ち 物質のつくり 物質をつくる それ以上分けることができない粒を原子という いくつかの原子が結びついてできたものを分子という いろいろな物質のうち 1 種類の原子からできている物質を単体 2 種類以上の原子からできている物質を化合物という
H27看護化学-講義資料13rev
 双極子 (dipole) とファンデルワールス力ファンデルワールス力も結局は静電的相互作用によるものだが 原動力になるのは 双極子という分子の分極状態である ファンデルワールス力は以下の 3 種類に分けて考えることができる 前回使ったスライドです 1 タンパク質はひも状ではなく 決まった形に折り畳む つまり 安定性はひも状 < 折り畳まった形 化合物や物質の安定性は自由エネルギーで決まる 特に 温度一定
双極子 (dipole) とファンデルワールス力ファンデルワールス力も結局は静電的相互作用によるものだが 原動力になるのは 双極子という分子の分極状態である ファンデルワールス力は以下の 3 種類に分けて考えることができる 前回使ったスライドです 1 タンパク質はひも状ではなく 決まった形に折り畳む つまり 安定性はひも状 < 折り畳まった形 化合物や物質の安定性は自由エネルギーで決まる 特に 温度一定
Microsoft Word - 酸塩基
 化学基礎実験 : 酸 塩基と (1) 酸と塩基 の基本を学び の実験を通してこれらの事柄に関する認識を深めます さらに 緩衝液の性質に ついて学び 緩衝液の 変化に対する緩衝力を実験で確かめます 化学基礎実験 : 酸 塩基と 酸と塩基 水の解離 HCl H Cl - 塩酸 塩素イオン 酸 強酸 ヒドロニウムイオン H 3 O H O H OH - OH ー [H ] = [OH - ]= 1-7 M
化学基礎実験 : 酸 塩基と (1) 酸と塩基 の基本を学び の実験を通してこれらの事柄に関する認識を深めます さらに 緩衝液の性質に ついて学び 緩衝液の 変化に対する緩衝力を実験で確かめます 化学基礎実験 : 酸 塩基と 酸と塩基 水の解離 HCl H Cl - 塩酸 塩素イオン 酸 強酸 ヒドロニウムイオン H 3 O H O H OH - OH ー [H ] = [OH - ]= 1-7 M
第 11 回化学概論 酸化と還元 P63 酸化還元反応 酸化数 酸化剤 還元剤 金属のイオン化傾向 酸化される = 酸素と化合する = 水素を奪われる = 電子を失う = 酸化数が増加する 還元される = 水素と化合する = 酸素を奪われる = 電子を得る = 酸化数が減少する 銅の酸化酸化銅の還元
 第 11 回化学概論 酸化と還元 P63 酸化還元反応 酸化数 酸化剤 還元剤 金属のイオン化傾向 酸化される = 酸素と化合する = 水素を奪われる = 電子を失う = 酸化数が増加する 還元される = 水素と化合する = 酸素を奪われる = 電子を得る = 酸化数が減少する 銅の酸化酸化銅の還元 2Cu + O 2 2CuO CuO + H 2 Cu + H 2 O Cu Cu 2+ + 2e
第 11 回化学概論 酸化と還元 P63 酸化還元反応 酸化数 酸化剤 還元剤 金属のイオン化傾向 酸化される = 酸素と化合する = 水素を奪われる = 電子を失う = 酸化数が増加する 還元される = 水素と化合する = 酸素を奪われる = 電子を得る = 酸化数が減少する 銅の酸化酸化銅の還元 2Cu + O 2 2CuO CuO + H 2 Cu + H 2 O Cu Cu 2+ + 2e
<4D F736F F F696E74202D D8295AA8E7189BB8D8795A882CC8EED97DE82C68D5C91A2>
 J. 高分子化合物の種類と構造 1. 高分子化合物とは 2. 主な重合方法 3. 付加重合により生成するポリマー 4. 他の重合方法により生成するポリマー J. 高分子化合物の種類と構造 1. 高分子化合物とは 1. 高分子化合物とは 分子量が 1 万以上で, その主鎖が共有結合によりできている化合物 ( 分子量 2000 程度でも高分子という場合もある ) 高分子化合物 無機高分子化合物 ガラス繊維,
J. 高分子化合物の種類と構造 1. 高分子化合物とは 2. 主な重合方法 3. 付加重合により生成するポリマー 4. 他の重合方法により生成するポリマー J. 高分子化合物の種類と構造 1. 高分子化合物とは 1. 高分子化合物とは 分子量が 1 万以上で, その主鎖が共有結合によりできている化合物 ( 分子量 2000 程度でも高分子という場合もある ) 高分子化合物 無機高分子化合物 ガラス繊維,
基礎化学 Ⅰ 第 5 講原子量とモル数 第 5 講原子量とモル数 1 原子量 (1) 相対質量 まず, 大きさの復習から 原子 ピンポン玉 原子の直径は, 約 1 億分の 1cm ( 第 1 講 ) 原子とピンポン玉の関係は, ピンポン玉と地球の関係と同じくらいの大きさです 地球 では, 原子 1
 第 5 講原子量とモル数 1 原子量 (1) 相対質量 まず, 大きさの復習から 原子 ピンポン玉 原子の直径は, 約 1 億分の 1cm ( 第 1 講 ) 原子とピンポン玉の関係は, ピンポン玉と地球の関係と同じくらいの大きさです 地球 では, 原子 1 つの質量は? 水素原子は,0.167 10-23 g 酸素原子は,2.656 10-23 g 炭素原子は,1.993 10-23 g 原子の質量は,
第 5 講原子量とモル数 1 原子量 (1) 相対質量 まず, 大きさの復習から 原子 ピンポン玉 原子の直径は, 約 1 億分の 1cm ( 第 1 講 ) 原子とピンポン玉の関係は, ピンポン玉と地球の関係と同じくらいの大きさです 地球 では, 原子 1 つの質量は? 水素原子は,0.167 10-23 g 酸素原子は,2.656 10-23 g 炭素原子は,1.993 10-23 g 原子の質量は,
糖質(炭水化物)
 Chapter 2 生体分子の構造と機能糖質 生体内における糖は広範囲にわたる多彩な機能に関与している 1) エネルギー貯蔵動物 : グリコーゲン 2) 情報性分子 核酸 植物 : デンプン, マンナン デオキシリボース, リボース 細胞表面の複合糖質 抗原抗体反応, 微生物と宿主との相互作用, 細胞の分化 接着, 生理活性物質の受容体 3) 生体の構造材料 ( 形態維持と保護, 生育環境の維持 )
Chapter 2 生体分子の構造と機能糖質 生体内における糖は広範囲にわたる多彩な機能に関与している 1) エネルギー貯蔵動物 : グリコーゲン 2) 情報性分子 核酸 植物 : デンプン, マンナン デオキシリボース, リボース 細胞表面の複合糖質 抗原抗体反応, 微生物と宿主との相互作用, 細胞の分化 接着, 生理活性物質の受容体 3) 生体の構造材料 ( 形態維持と保護, 生育環境の維持 )
イオン化傾向 イオン化傾向 1 金属の単体はいずれも酸化されて陽イオンになりうる 金属のイオンのなりやすさを表したものをイオン化傾向という イオン化傾向 K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au e- を出してイオンになりやすい酸化されやすい イ
 イオン化傾向 イオン化傾向 金属の単体はいずれも酸化されて陽イオンになりうる 金属のイオンのなりやすさを表したものをイオン化傾向という イオン化傾向 K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au e- を出してイオンになりやすい酸化されやすい イオンになりにくい酸化されにくい イオン化傾向の覚え方 K かそう Ca か Na な Mg ま Al あ
イオン化傾向 イオン化傾向 金属の単体はいずれも酸化されて陽イオンになりうる 金属のイオンのなりやすさを表したものをイオン化傾向という イオン化傾向 K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au e- を出してイオンになりやすい酸化されやすい イオンになりにくい酸化されにくい イオン化傾向の覚え方 K かそう Ca か Na な Mg ま Al あ
FdData理科3年
 FdData 中間期末 : 中学理科 3 年 : 中和 [ 中和とイオン数の変化 ] [ 問題 ](2 学期中間 ) 次の図は A 液に B 液を加えたときのようすを示している A 液は塩酸,B 液は水酸化ナトリウム水溶液である (1) 1~4 の水溶液はそれぞれ何性か (2) 4 の水溶液にフェノールフタレイン溶液を加えると何色になるか (3) 塩酸 (A 液 ) に水酸化ナトリウム水溶液 (B
FdData 中間期末 : 中学理科 3 年 : 中和 [ 中和とイオン数の変化 ] [ 問題 ](2 学期中間 ) 次の図は A 液に B 液を加えたときのようすを示している A 液は塩酸,B 液は水酸化ナトリウム水溶液である (1) 1~4 の水溶液はそれぞれ何性か (2) 4 の水溶液にフェノールフタレイン溶液を加えると何色になるか (3) 塩酸 (A 液 ) に水酸化ナトリウム水溶液 (B
解法 1 原子の性質を周期表で理解する 原子の結合について理解するには まずは原子の種類 (= 元素 ) による性質の違いを知る必要がある 原子の性質は 次の 3 つによって理解することができる イオン化エネルギー = 原子から電子 1 個を取り除くのに必要なエネルギー ( イメージ ) 電子 原子
 解法 1 原子の性質を周期表で理解する 原子の結合について理解するには まずは原子の種類 (= 元素 ) による性質の違いを知る必要がある 原子の性質は 次の 3 つによって理解することができる イオン化エネルギー = 原子から電子 1 個を取り除くのに必要なエネルギー ( イメージ ) 電子 原子 いやだ!! の強さ 電子親和力 = 原子が電子 1 個を受け取ったときに放出するエネルギー ( イメージ
解法 1 原子の性質を周期表で理解する 原子の結合について理解するには まずは原子の種類 (= 元素 ) による性質の違いを知る必要がある 原子の性質は 次の 3 つによって理解することができる イオン化エネルギー = 原子から電子 1 個を取り除くのに必要なエネルギー ( イメージ ) 電子 原子 いやだ!! の強さ 電子親和力 = 原子が電子 1 個を受け取ったときに放出するエネルギー ( イメージ
フォルハルト法 NH SCN の標準液または KSCN の標準液を用い,Ag または Hg を直接沈殿滴定する方法 および Cl, Br, I, CN, 試料溶液に Fe SCN, S 2 を指示薬として加える 例 : Cl の逆滴定による定量 などを逆滴定する方法をいう Fe を加えた試料液に硝酸
 沈殿滴定とモール法 沈殿滴定沈殿とは溶液に試薬を加えたり加熱や冷却をしたとき, 溶液から不溶性固体が分離する現象, またはその不溶性固体を沈殿という 不溶性固体は, 液底に沈んでいいても微粒子 ( コロイド ) として液中を浮遊していても沈殿と呼ばれる 沈殿滴定とは沈殿が生成あるいは消失する反応を利用した滴定のことをいう 沈殿が生成し始めた点, 沈殿の生成が完了した点, または沈殿が消失した点が滴定の終点となる
沈殿滴定とモール法 沈殿滴定沈殿とは溶液に試薬を加えたり加熱や冷却をしたとき, 溶液から不溶性固体が分離する現象, またはその不溶性固体を沈殿という 不溶性固体は, 液底に沈んでいいても微粒子 ( コロイド ) として液中を浮遊していても沈殿と呼ばれる 沈殿滴定とは沈殿が生成あるいは消失する反応を利用した滴定のことをいう 沈殿が生成し始めた点, 沈殿の生成が完了した点, または沈殿が消失した点が滴定の終点となる
FdText理科1年
 中学理科 3 年 : 酸とアルカリ [ http://www.fdtext.com/dat/ ] [ 要点 ] 酸の性質 青色リトマスを赤に変える BTB 溶液を黄色に変える あえん金属 ( 亜鉛, マグネシウム, 鉄など ) と反応して水素を発生させる アルカリの性質 赤色リトマスを青色に変える BTB 溶液を青色に変える フェノールフタレイン溶液を赤色に変える ひふタンパク質をとかす ( 皮膚につけるとぬるぬるする
中学理科 3 年 : 酸とアルカリ [ http://www.fdtext.com/dat/ ] [ 要点 ] 酸の性質 青色リトマスを赤に変える BTB 溶液を黄色に変える あえん金属 ( 亜鉛, マグネシウム, 鉄など ) と反応して水素を発生させる アルカリの性質 赤色リトマスを青色に変える BTB 溶液を青色に変える フェノールフタレイン溶液を赤色に変える ひふタンパク質をとかす ( 皮膚につけるとぬるぬるする
電子配置と価電子 P H 2He 第 4 回化学概論 3Li 4Be 5B 6C 7N 8O 9F 10Ne 周期表と元素イオン 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 価電子数 陽
 電子配置と価電子 P11 1 2 13 14 15 16 17 18 1H 2He 第 4 回化学概論 3Li 4Be 5B 6C 7N 8O 9F 10Ne 周期表と元素イオン 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 1 2 3 4 5 6 7 0 陽性元素陰性元素安定電子を失いやすい電子を受け取りやすい 原子番号と価電子の数 P16 元素の周期表 P17 最外殻の電子配置と周期表
電子配置と価電子 P11 1 2 13 14 15 16 17 18 1H 2He 第 4 回化学概論 3Li 4Be 5B 6C 7N 8O 9F 10Ne 周期表と元素イオン 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 1 2 3 4 5 6 7 0 陽性元素陰性元素安定電子を失いやすい電子を受け取りやすい 原子番号と価電子の数 P16 元素の周期表 P17 最外殻の電子配置と周期表
平成 29 年度大学院博士前期課程入学試験問題 生物工学 I 基礎生物化学 生物化学工学から 1 科目選択ただし 内部受験生は生物化学工学を必ず選択すること 解答には 問題ごとに1 枚の解答用紙を使用しなさい 余った解答用紙にも受験番号を記載しなさい 試験終了時に回収します 受験番号
 平成 29 年度大学院博士前期課程入学試験問題 生物工学 I から 1 科目選択ただし 内部受験生はを必ず選択すること 解答には 問題ごとに1 枚の解答用紙を使用しなさい 余った解答用紙にも受験番号を記載しなさい 試験終了時に回収します 受験番号 問題 1. ( 配点率 33/100) 生体エネルギーと熱力学に関する以下の問に答えなさい (1) 細胞内の反応における ATP 加水分解時の実際の自由エネルギー変化
平成 29 年度大学院博士前期課程入学試験問題 生物工学 I から 1 科目選択ただし 内部受験生はを必ず選択すること 解答には 問題ごとに1 枚の解答用紙を使用しなさい 余った解答用紙にも受験番号を記載しなさい 試験終了時に回収します 受験番号 問題 1. ( 配点率 33/100) 生体エネルギーと熱力学に関する以下の問に答えなさい (1) 細胞内の反応における ATP 加水分解時の実際の自由エネルギー変化
PowerPoint プレゼンテーション
 薬品分析化学第 8 回 HendersonHasselbalch の式 ( 復習 ) ph 緩衝液 (p 55 ~) 溶液中に共役酸 塩基対が存在しているとき ph p 共役酸 塩基の濃度関係を表す 8 弱酸 HA の平衡式 O H O A において HA H A = mol/l, [A= mol/l とすると O [A より O A A [A となり ph p が導かれる 〇弱酸 HA ( mol/l)
薬品分析化学第 8 回 HendersonHasselbalch の式 ( 復習 ) ph 緩衝液 (p 55 ~) 溶液中に共役酸 塩基対が存在しているとき ph p 共役酸 塩基の濃度関係を表す 8 弱酸 HA の平衡式 O H O A において HA H A = mol/l, [A= mol/l とすると O [A より O A A [A となり ph p が導かれる 〇弱酸 HA ( mol/l)
官能基の酸化レベルと官能基相互変換 還元 酸化 炭化水素 アルコール アルデヒド, ケトン カルボン酸 炭酸 H R R' H H R' R OH H R' R OR'' H R' R Br H R' R NH 2 H R' R SR' R" O R R' RO OR R R' アセタール RS S
 官能基の酸化レベルと官能基相互変換 還元 酸化 炭化水素 アルコール アルデヒド, ケトン カルボン酸 炭酸 ' ' ' '' ' ' 2 ' ' " ' ' アセタール ' チオアセタール -'' ' イミン '' '' 2 C Cl C 二酸化炭素 2 2 尿素 脱水 加水分解 ' 薬品合成化学 小問題 1 1) Al 4 は次のような構造であり, ( ハイドライドイオン ) の求核剤攻撃で還元をおこなう
官能基の酸化レベルと官能基相互変換 還元 酸化 炭化水素 アルコール アルデヒド, ケトン カルボン酸 炭酸 ' ' ' '' ' ' 2 ' ' " ' ' アセタール ' チオアセタール -'' ' イミン '' '' 2 C Cl C 二酸化炭素 2 2 尿素 脱水 加水分解 ' 薬品合成化学 小問題 1 1) Al 4 は次のような構造であり, ( ハイドライドイオン ) の求核剤攻撃で還元をおこなう
B. モル濃度 速度定数と化学反応の速さ 1.1 段階反応 ( 単純反応 ): + I HI を例に H ヨウ化水素 HI が生成する速さ は,H と I のモル濃度をそれぞれ [ ], [ I ] [ H ] [ I ] に比例することが, 実験により, わかっている したがって, 比例定数を k
![B. モル濃度 速度定数と化学反応の速さ 1.1 段階反応 ( 単純反応 ): + I HI を例に H ヨウ化水素 HI が生成する速さ は,H と I のモル濃度をそれぞれ [ ], [ I ] [ H ] [ I ] に比例することが, 実験により, わかっている したがって, 比例定数を k B. モル濃度 速度定数と化学反応の速さ 1.1 段階反応 ( 単純反応 ): + I HI を例に H ヨウ化水素 HI が生成する速さ は,H と I のモル濃度をそれぞれ [ ], [ I ] [ H ] [ I ] に比例することが, 実験により, わかっている したがって, 比例定数を k](/thumbs/81/83835231.jpg) 反応速度 触媒 速度定数 反応次数について. 化学反応の速さの表し方 速さとは単位時間あたりの変化の大きさである 大きさの値は 0 以上ですから, 速さは 0 以上の値をとる 化学反応の速さは単位時間あたりの物質のモル濃度変化の大きさで表すのが一般的 たとえば, a + bb c (, B, は物質, a, b, c は係数 ) という反応において,, B, それぞれの反応の速さを, B, とし,
反応速度 触媒 速度定数 反応次数について. 化学反応の速さの表し方 速さとは単位時間あたりの変化の大きさである 大きさの値は 0 以上ですから, 速さは 0 以上の値をとる 化学反応の速さは単位時間あたりの物質のモル濃度変化の大きさで表すのが一般的 たとえば, a + bb c (, B, は物質, a, b, c は係数 ) という反応において,, B, それぞれの反応の速さを, B, とし,
SO の場合 Leis の酸塩基説 ( 非プロトン性溶媒までも摘要可 一般化 ) B + B の化学反応の酸と塩基 SO + + SO SO + + SO 酸 塩基 酸 塩基 SO は酸にも塩基にもなっている 酸の強さ 酸が強い = 塩基へプロトンを供与する能力が大きい 強酸 ( 優れたプロトン供与
 溶液溶媒 + 溶質 均一な相 溶質を溶かしている物質 溶けている物質 固体 + 液体液体 + 固体 溶質 (solute) イオンの形に解離して溶けているもの ( 電解質 ) 酸と塩基 Copyrigt: A.Asno 1 水素イオン濃度 (ydrogenion concentrtion) 水素イオン指数 (ydrogenion exponent; p) 水の電離 O + O O + + O O +
溶液溶媒 + 溶質 均一な相 溶質を溶かしている物質 溶けている物質 固体 + 液体液体 + 固体 溶質 (solute) イオンの形に解離して溶けているもの ( 電解質 ) 酸と塩基 Copyrigt: A.Asno 1 水素イオン濃度 (ydrogenion concentrtion) 水素イオン指数 (ydrogenion exponent; p) 水の電離 O + O O + + O O +
カールフィッシャー法と濃度計算問題
 酸化還元滴定の応用例 カールフィッシャー法 (Karl Fischer s method) 微量の水分を滴定で求める方法 試料を無水メタノールなどと振って水を抽出し これをカールフィッシャー試薬で滴定する カールフィッシャー試薬は ヨウ素 二酸化イオウ ピリジンを 1:3:10( モル比 ) の割合にメタノールに溶かしたもの 水の存在によってヨウ素が二酸化イオウによって定量的に還元され この両者がピリジンと化合して明るい黄色に変わる
酸化還元滴定の応用例 カールフィッシャー法 (Karl Fischer s method) 微量の水分を滴定で求める方法 試料を無水メタノールなどと振って水を抽出し これをカールフィッシャー試薬で滴定する カールフィッシャー試薬は ヨウ素 二酸化イオウ ピリジンを 1:3:10( モル比 ) の割合にメタノールに溶かしたもの 水の存在によってヨウ素が二酸化イオウによって定量的に還元され この両者がピリジンと化合して明るい黄色に変わる
Alcian blue染色 Elastica Van Gieson染色
 Alcian blue 染色 平成 19 年度基礎講座 目的 Alcian blue 染色 生体に存在する酸性ムコ物質を検出する方法として広く用いられている 酸性ムコ物質はカルボキシル基を有するヒアルロン酸 硫酸基を有するコンドロイチン硫酸 ムコイチン硫酸 ケラト硫酸 ヘパリンなどの 2 つのグループに分類される Alcian blue 染色液の ph 値を調節することにより その 2 種類の酸性ムコ物質を染め分けることができる
Alcian blue 染色 平成 19 年度基礎講座 目的 Alcian blue 染色 生体に存在する酸性ムコ物質を検出する方法として広く用いられている 酸性ムコ物質はカルボキシル基を有するヒアルロン酸 硫酸基を有するコンドロイチン硫酸 ムコイチン硫酸 ケラト硫酸 ヘパリンなどの 2 つのグループに分類される Alcian blue 染色液の ph 値を調節することにより その 2 種類の酸性ムコ物質を染め分けることができる
Microsoft PowerPoint マクロ生物学9
 マクロ生物学 9 生物は様々な化学反応で動いている 大阪大学工学研究科応用生物工学専攻細胞動態学領域 : 福井希一 1 生物の物質的基盤 Deleted based on copyright concern. カープ分子細胞生物学 より 2 8. 生物は様々な化学反応で動い ている 1. 生命の化学的基礎 2. 生命の物理法則 3 1. 生命の化学的基礎 1. 結合 2. 糖 脂質 3. 核酸 4.
マクロ生物学 9 生物は様々な化学反応で動いている 大阪大学工学研究科応用生物工学専攻細胞動態学領域 : 福井希一 1 生物の物質的基盤 Deleted based on copyright concern. カープ分子細胞生物学 より 2 8. 生物は様々な化学反応で動い ている 1. 生命の化学的基礎 2. 生命の物理法則 3 1. 生命の化学的基礎 1. 結合 2. 糖 脂質 3. 核酸 4.
Ⅲ-2 酸 塩基の電離と水素イオン濃度 Ⅲ-2-1 弱酸 Ex. 酢酸 CH 3 COOH 希薄水溶液 (0.1mol/L 以下 ) 中では 一部が解離し 大部分は分子状で存在 CH 3 COOH CH 3 COO +H + 化学平衡の法則より [CH 3 COO ][H + ] = K [CH 3
![Ⅲ-2 酸 塩基の電離と水素イオン濃度 Ⅲ-2-1 弱酸 Ex. 酢酸 CH 3 COOH 希薄水溶液 (0.1mol/L 以下 ) 中では 一部が解離し 大部分は分子状で存在 CH 3 COOH CH 3 COO +H + 化学平衡の法則より [CH 3 COO ][H + ] = K [CH 3 Ⅲ-2 酸 塩基の電離と水素イオン濃度 Ⅲ-2-1 弱酸 Ex. 酢酸 CH 3 COOH 希薄水溶液 (0.1mol/L 以下 ) 中では 一部が解離し 大部分は分子状で存在 CH 3 COOH CH 3 COO +H + 化学平衡の法則より [CH 3 COO ][H + ] = K [CH 3](/thumbs/96/129573147.jpg) Ⅲ-2 酸 塩基の電離と水素イオン濃度 Ⅲ-2-1 弱酸 Ex. 酢酸 CH 3 COOH 希薄水溶液 (0.1mol/L 以下 ) 中では 一部が解離し 大部分は分子状で存在 CH 3 COOH CH 3 COO +H + 化学平衡の法則より COO ][H + ] = K COOH] a :( 見かけの ) 酸解離定数 ( 電離定数 ): 指数表示 pka = log Ka = log 1 K
Ⅲ-2 酸 塩基の電離と水素イオン濃度 Ⅲ-2-1 弱酸 Ex. 酢酸 CH 3 COOH 希薄水溶液 (0.1mol/L 以下 ) 中では 一部が解離し 大部分は分子状で存在 CH 3 COOH CH 3 COO +H + 化学平衡の法則より COO ][H + ] = K COOH] a :( 見かけの ) 酸解離定数 ( 電離定数 ): 指数表示 pka = log Ka = log 1 K
Microsoft Word - basic_15.doc
 分析の原理 15 電位差測定装置の原理と応用 概要 電位差測定法は 溶液内の目的成分の濃度 ( 活量 ) を作用電極と参照電極の起電力差から測定し 溶液中のイオン濃度や酸化還元電位の測定に利用されています また 滴定と組み合わせて当量点の決定を電極電位変化より行う電位差滴定法もあり 電気化学測定法の一つとして古くから研究 応用されています 本編では 電位差測定装置の原理を解説し その応用装置である
分析の原理 15 電位差測定装置の原理と応用 概要 電位差測定法は 溶液内の目的成分の濃度 ( 活量 ) を作用電極と参照電極の起電力差から測定し 溶液中のイオン濃度や酸化還元電位の測定に利用されています また 滴定と組み合わせて当量点の決定を電極電位変化より行う電位差滴定法もあり 電気化学測定法の一つとして古くから研究 応用されています 本編では 電位差測定装置の原理を解説し その応用装置である
Microsoft Word - t30_西_修正__ doc
 反応速度と化学平衡 金沢工業大学基礎教育部西誠 ねらい 化学反応とは分子を構成している原子が組み換り 新しい分子構造を持つことといえます この化学反応がどのように起こるのか どのような速さでどの程度の分子が組み換るのかは 反応の種類や 濃度 温度などの条件で決まってきます そして このような反応の進行方向や速度を正確に予測するために いろいろな数学 物理的な考え方を取り入れて化学反応の理論体系が作られています
反応速度と化学平衡 金沢工業大学基礎教育部西誠 ねらい 化学反応とは分子を構成している原子が組み換り 新しい分子構造を持つことといえます この化学反応がどのように起こるのか どのような速さでどの程度の分子が組み換るのかは 反応の種類や 濃度 温度などの条件で決まってきます そして このような反応の進行方向や速度を正確に予測するために いろいろな数学 物理的な考え方を取り入れて化学反応の理論体系が作られています
jhs-science1_05-02ans
 気体の発生と性質 (1 1 次の文章の ( に当てはまる言葉を書くか 〇でかこみなさい (1 気体には 水にとけやすいものと ものがある また 空気より (1 密度 が大きい ( 重い ものと 小さい ( 軽い ものがある (2 水に ( とけやすい 気体は水上で集められる 空気より 1 が ( 大きい 小さい 気体は下方 ( 大きい 小さい 気体は上方で それぞれ集められる (3 酸素の中に火のついた線香を入れると
気体の発生と性質 (1 1 次の文章の ( に当てはまる言葉を書くか 〇でかこみなさい (1 気体には 水にとけやすいものと ものがある また 空気より (1 密度 が大きい ( 重い ものと 小さい ( 軽い ものがある (2 水に ( とけやすい 気体は水上で集められる 空気より 1 が ( 大きい 小さい 気体は下方 ( 大きい 小さい 気体は上方で それぞれ集められる (3 酸素の中に火のついた線香を入れると
生理学 1章 生理学の基礎 1-1. 細胞の主要な構成成分はどれか 1 タンパク質 2 ビタミン 3 無機塩類 4 ATP 第5回 按マ指 (1279) 1-2. 細胞膜の構成成分はどれか 1 無機りん酸 2 リボ核酸 3 りん脂質 4 乳酸 第6回 鍼灸 (1734) E L 1-3. 細胞膜につ
 の基礎 1-1. 細胞の主要な構成成分はどれか 1 タンパク質 2 ビタミン 3 無機塩類 4 ATP 第5回 (1279) 1-2. 細胞膜の構成成分はどれか 1 無機りん酸 2 リボ核酸 3 りん脂質 4 乳酸 第6回 (1734) 1-3. 細胞膜について正しい記述はどれか 1 糖脂質分子が規則正しく配列している 2 イオンに対して選択的な透過性をもつ 3 タンパク質分子の二重層膜からなる 4
の基礎 1-1. 細胞の主要な構成成分はどれか 1 タンパク質 2 ビタミン 3 無機塩類 4 ATP 第5回 (1279) 1-2. 細胞膜の構成成分はどれか 1 無機りん酸 2 リボ核酸 3 りん脂質 4 乳酸 第6回 (1734) 1-3. 細胞膜について正しい記述はどれか 1 糖脂質分子が規則正しく配列している 2 イオンに対して選択的な透過性をもつ 3 タンパク質分子の二重層膜からなる 4
生物学入門
 第 2 章生命の化学的基礎 生物を構成している元素は 地球上の物質を構成している元素と何ら異なることはない 化学で学んできたこと これから学ぶことが 生物学を理解するための基礎となる 化学の詳しいことは 化学科のおこなう講義や実習に任せることにして ここでは生物学を学ぶために必要な 最低限のことを学ぶことにする 1. 水の性質 生体を構成している分子の中で 割合が一番多いのは 水 である 生体に占める水の割合はおよそ
第 2 章生命の化学的基礎 生物を構成している元素は 地球上の物質を構成している元素と何ら異なることはない 化学で学んできたこと これから学ぶことが 生物学を理解するための基礎となる 化学の詳しいことは 化学科のおこなう講義や実習に任せることにして ここでは生物学を学ぶために必要な 最低限のことを学ぶことにする 1. 水の性質 生体を構成している分子の中で 割合が一番多いのは 水 である 生体に占める水の割合はおよそ
<4D F736F F F696E74202D208D918E8E91CE8DF481698E5F89968AEE816A F38DFC97702E707074>
 国試対策 酸塩基 酸 塩基 ( アルカリ ) って何? H 2 SO 4 水酸化カルシウムアンモニア CH HNO 3 4 HCl 硫酸ナトリウム 新垣 知輝 どれが酸? どれが塩基? 酸 酸と塩基の定義 塩基 H + を出すもの OH を出すもの by アレニウス H + を渡すもの H + を受け取るもの by ブレンステッド ローリー電子対を受け取る電子対を渡すものもの by ルイス 水素イオン
国試対策 酸塩基 酸 塩基 ( アルカリ ) って何? H 2 SO 4 水酸化カルシウムアンモニア CH HNO 3 4 HCl 硫酸ナトリウム 新垣 知輝 どれが酸? どれが塩基? 酸 酸と塩基の定義 塩基 H + を出すもの OH を出すもの by アレニウス H + を渡すもの H + を受け取るもの by ブレンステッド ローリー電子対を受け取る電子対を渡すものもの by ルイス 水素イオン
第3回 糖類(炭水化物)
 第 3 回糖類 ( 炭水化物 ) 日紫喜光良 基礎生化学 2014.5.13 1 概要 1 単糖分子の構造と性質 2 主な単糖 3 二糖 多糖 4 複合糖質 イラストレイテッド生化学第 7 章 ( 糖質とは?) ならびに 第 14 章 ( グリコサミノグリカンと糖タンパク質 ) の一部に相当 2 糖質 ( 炭水化物 ) の役割 エネルギー源 エネルギー貯蔵形態 デンプン グリコーゲン 細胞膜成分 糖タンパク質の原料
第 3 回糖類 ( 炭水化物 ) 日紫喜光良 基礎生化学 2014.5.13 1 概要 1 単糖分子の構造と性質 2 主な単糖 3 二糖 多糖 4 複合糖質 イラストレイテッド生化学第 7 章 ( 糖質とは?) ならびに 第 14 章 ( グリコサミノグリカンと糖タンパク質 ) の一部に相当 2 糖質 ( 炭水化物 ) の役割 エネルギー源 エネルギー貯蔵形態 デンプン グリコーゲン 細胞膜成分 糖タンパク質の原料
木村の化学重要問題集 01 解答編解説補充 H S H HS ( 第 1 電離平衡 ) HS H S ( 第 電離平衡 ) そこで溶液を中性または塩基性にすることにより, つまり [ H ] を小さくすることにより, 上の電離平衡を右に片寄らせ,[ S ] を大きくする 193. 陽イオン分析 配位
![木村の化学重要問題集 01 解答編解説補充 H S H HS ( 第 1 電離平衡 ) HS H S ( 第 電離平衡 ) そこで溶液を中性または塩基性にすることにより, つまり [ H ] を小さくすることにより, 上の電離平衡を右に片寄らせ,[ S ] を大きくする 193. 陽イオン分析 配位 木村の化学重要問題集 01 解答編解説補充 H S H HS ( 第 1 電離平衡 ) HS H S ( 第 電離平衡 ) そこで溶液を中性または塩基性にすることにより, つまり [ H ] を小さくすることにより, 上の電離平衡を右に片寄らせ,[ S ] を大きくする 193. 陽イオン分析 配位](/thumbs/91/107310906.jpg) 木村の化学重要問題集 01 解答編解説補充 1. 無機物質の性質 反応 187. 気体の製法と性質補足ネスラー試薬とアンモニアの反応 1.. ネスラー試薬 [ HgI ] の調製 KI KI Hg ¾¾ HgI ¾¾ [ HgI ] 赤色沈殿. ネスラー試薬とアンモニアの反応 [ HgI ] ( NH ) [ ] NH HgI ( 微量 : 黄色, 多量 : 赤褐色 ) 190. 陽イオンの分離と性質
木村の化学重要問題集 01 解答編解説補充 1. 無機物質の性質 反応 187. 気体の製法と性質補足ネスラー試薬とアンモニアの反応 1.. ネスラー試薬 [ HgI ] の調製 KI KI Hg ¾¾ HgI ¾¾ [ HgI ] 赤色沈殿. ネスラー試薬とアンモニアの反応 [ HgI ] ( NH ) [ ] NH HgI ( 微量 : 黄色, 多量 : 赤褐色 ) 190. 陽イオンの分離と性質
第3類危険物の物質別詳細 練習問題
 第 3 類危険物の物質別詳細練習問題 問題 1 第 3 類危険物の一般的な消火方法として 誤っているものは次のうちいくつあるか A. 噴霧注水は冷却効果と窒息効果があるので 有効である B. 乾燥砂は有効である C. 分子内に酸素を含むので 窒息消火法は効果がない D. 危険物自体は不燃性なので 周囲の可燃物を除去すればよい E. 自然発火性危険物の消火には 炭酸水素塩類を用いた消火剤は効果がある
第 3 類危険物の物質別詳細練習問題 問題 1 第 3 類危険物の一般的な消火方法として 誤っているものは次のうちいくつあるか A. 噴霧注水は冷却効果と窒息効果があるので 有効である B. 乾燥砂は有効である C. 分子内に酸素を含むので 窒息消火法は効果がない D. 危険物自体は不燃性なので 周囲の可燃物を除去すればよい E. 自然発火性危険物の消火には 炭酸水素塩類を用いた消火剤は効果がある
i ( 23 ) ) SPP Science Partnership Project ( (1) (2) 2010 SSH
 i 1982 2012 ( 23 ) 30 1998 ) 2002 2006 2009 1999 2009 10 2004 SPP Science Partnership Project 2004 2005 2009 ( 29 2010 (1) (2) 2010 SSH ii ph 21 2006 10 B5 A5 2014 2 2014 2 iii 21 1962 1969 1987 1992 2005
i 1982 2012 ( 23 ) 30 1998 ) 2002 2006 2009 1999 2009 10 2004 SPP Science Partnership Project 2004 2005 2009 ( 29 2010 (1) (2) 2010 SSH ii ph 21 2006 10 B5 A5 2014 2 2014 2 iii 21 1962 1969 1987 1992 2005
スライド 0
 熱 学 Ⅲ 講義資料 化学反応のエクセルギー解析 京都 芸繊維 学 学院 芸科学研究科機械システム 学部 耕介准教授 2014/5/13 2014/5/9 1/23 なぜ, 化学反応を伴うエクセルギーを学ぶのか?? 従来までに学んだ熱 学 エンジンやガスタービンの反応器は, 外部加熱過程 ( 外部から熱を加える過程 ) に置き換えていた. 実際には化学反応を伴うため, 現実的. 化学反応 を伴う熱
熱 学 Ⅲ 講義資料 化学反応のエクセルギー解析 京都 芸繊維 学 学院 芸科学研究科機械システム 学部 耕介准教授 2014/5/13 2014/5/9 1/23 なぜ, 化学反応を伴うエクセルギーを学ぶのか?? 従来までに学んだ熱 学 エンジンやガスタービンの反応器は, 外部加熱過程 ( 外部から熱を加える過程 ) に置き換えていた. 実際には化学反応を伴うため, 現実的. 化学反応 を伴う熱
Taro-化学5 無機化学 最新版
 18 典型元素とその化合物 Ⅰ P oint.43 アルカリ金属元素 1 価電子価のイオン 2 常温で水と激しく反応する強いアルカリ性を示す Na + H2O に保存 3すべての塩は水に溶ける 4 炎色反応を示す Sr Li Ca Na Ba Cu K 5 イオン化傾向が大きい酸化されやすい 力 6 単体 Na は 7 アンモニアソーダ法 で得る ソルベー法 (1) (5) NaCl NaHCO3
18 典型元素とその化合物 Ⅰ P oint.43 アルカリ金属元素 1 価電子価のイオン 2 常温で水と激しく反応する強いアルカリ性を示す Na + H2O に保存 3すべての塩は水に溶ける 4 炎色反応を示す Sr Li Ca Na Ba Cu K 5 イオン化傾向が大きい酸化されやすい 力 6 単体 Na は 7 アンモニアソーダ法 で得る ソルベー法 (1) (5) NaCl NaHCO3
キレート滴定
 4. キレート滴定 4.1 0.01MEDTA 標準溶液の調製 キレート滴定において標準溶液として用いられる EDTA は 普通 EDTA の2ナトリウム塩 H 2 Na 2 Y 2H 2 O で ETA と表示されている この試薬は結晶水以外に多少の水分を含んでいるので 通常は約 80 で数時間乾燥して使用するが 本実験では精密な分析を行うために 調製した EDTA 溶液をZnの一次標準溶液で標定して
4. キレート滴定 4.1 0.01MEDTA 標準溶液の調製 キレート滴定において標準溶液として用いられる EDTA は 普通 EDTA の2ナトリウム塩 H 2 Na 2 Y 2H 2 O で ETA と表示されている この試薬は結晶水以外に多少の水分を含んでいるので 通常は約 80 で数時間乾燥して使用するが 本実験では精密な分析を行うために 調製した EDTA 溶液をZnの一次標準溶液で標定して
ドリル No.6 Class No. Name 6.1 タンパク質と核酸を構成するおもな元素について述べ, 比較しなさい 6.2 糖質と脂質を構成するおもな元素について, 比較しなさい 6.3 リン (P) の生体内での役割について述べなさい 6.4 生物には, 表 1 に記した微量元素の他に, ど
 1 微視的生物学 生化学 1.1 生物を構成する元素 (element) 生物を構成する主要元素の種類と, おもな微量元素とその役割の概略について説明できる 地球上には 100 種類以上の元素があり, そのうち生体を構成する元素の種類は限られていて, 約 20 種類である 主要元素としては水素 (H), 炭素 (C), 窒素 (N), 酸素 (O) の 4 元素で, これらで, 生体を構成するタンパク質や核酸,
1 微視的生物学 生化学 1.1 生物を構成する元素 (element) 生物を構成する主要元素の種類と, おもな微量元素とその役割の概略について説明できる 地球上には 100 種類以上の元素があり, そのうち生体を構成する元素の種類は限られていて, 約 20 種類である 主要元素としては水素 (H), 炭素 (C), 窒素 (N), 酸素 (O) の 4 元素で, これらで, 生体を構成するタンパク質や核酸,
ここで Ω は系全体の格子数,φ は高分子の体積分率,k BT は熱エネルギー,f m(φ) は 1 格子 あたりの混合自由エネルギーを表す. またこのとき浸透圧 Π は Π = k BT v c [ φ N ln(1 φ) φ χφ2 ] (2) で与えられる. ここで N は高分子の長さ,χ は
![ここで Ω は系全体の格子数,φ は高分子の体積分率,k BT は熱エネルギー,f m(φ) は 1 格子 あたりの混合自由エネルギーを表す. またこのとき浸透圧 Π は Π = k BT v c [ φ N ln(1 φ) φ χφ2 ] (2) で与えられる. ここで N は高分子の長さ,χ は ここで Ω は系全体の格子数,φ は高分子の体積分率,k BT は熱エネルギー,f m(φ) は 1 格子 あたりの混合自由エネルギーを表す. またこのとき浸透圧 Π は Π = k BT v c [ φ N ln(1 φ) φ χφ2 ] (2) で与えられる. ここで N は高分子の長さ,χ は](/thumbs/92/110051847.jpg) 東京理科大学 Ⅰ 部化学研究部 2013 年度春輪講書 多糖類を用いた吸水性ポリマーの 吸水能の評価 Inoshita.D(2K),Katoh.D(2K),Katogi.A(2K),Saitoh.K(2C),Handa.Y(2K), Maekawa.J(2K),Yamada.T(2K),Doi.R(2K),Niwa.K(2K),Aoki.S(2C) 水曜班 1. 動機吸水性ポリマーは紙おむつなどの私たちの生活における身近な製品や,
東京理科大学 Ⅰ 部化学研究部 2013 年度春輪講書 多糖類を用いた吸水性ポリマーの 吸水能の評価 Inoshita.D(2K),Katoh.D(2K),Katogi.A(2K),Saitoh.K(2C),Handa.Y(2K), Maekawa.J(2K),Yamada.T(2K),Doi.R(2K),Niwa.K(2K),Aoki.S(2C) 水曜班 1. 動機吸水性ポリマーは紙おむつなどの私たちの生活における身近な製品や,
FdData理科3年
 FdData 中間期末 : 中学理科 1 年化学 [ 気体総合 ] パソコン タブレット版へ移動 [ 各気体の製法 ] [ 問題 ](3 学期 ) 次の各問いに答えよ (1) 二酸化マンガンにオキシドールを加えると発生する気体は何か (2) 亜鉛にうすい塩酸を加えると発生する気体は何か (3) 発泡入浴剤に湯を加えて発生した気体を石灰水に通したら, 石灰水が白くにごった 発生した気体は何か (4)
FdData 中間期末 : 中学理科 1 年化学 [ 気体総合 ] パソコン タブレット版へ移動 [ 各気体の製法 ] [ 問題 ](3 学期 ) 次の各問いに答えよ (1) 二酸化マンガンにオキシドールを加えると発生する気体は何か (2) 亜鉛にうすい塩酸を加えると発生する気体は何か (3) 発泡入浴剤に湯を加えて発生した気体を石灰水に通したら, 石灰水が白くにごった 発生した気体は何か (4)
31608 要旨 ルミノール発光 3513 後藤唯花 3612 熊﨑なつみ 3617 新野彩乃 3619 鈴木梨那 私たちは ルミノール反応で起こる化学発光が強い光で長時間続く条件について興味をもち 研究を行った まず触媒の濃度に着目し 1~9% の値で実験を行ったところ触媒濃度が低いほど強い光で長
 31608 要旨 ルミノール発光 3513 後藤唯花 3612 熊﨑なつみ 3617 新野彩乃 3619 鈴木梨那 私たちは ルミノール反応で起こる化学発光が強い光で長時間続く条件について興味をもち 研究を行った まず触媒の濃度に着目し 1~9% の値で実験を行ったところ触媒濃度が低いほど強い光で長時間発光した 次にルミノール溶液の液温に着目し 0 ~60 にて実験を行ったところ 温度が低いほど強く発光した
31608 要旨 ルミノール発光 3513 後藤唯花 3612 熊﨑なつみ 3617 新野彩乃 3619 鈴木梨那 私たちは ルミノール反応で起こる化学発光が強い光で長時間続く条件について興味をもち 研究を行った まず触媒の濃度に着目し 1~9% の値で実験を行ったところ触媒濃度が低いほど強い光で長時間発光した 次にルミノール溶液の液温に着目し 0 ~60 にて実験を行ったところ 温度が低いほど強く発光した
スライド 1
 酸と塩基 代謝概要 平成 25 年 4 月 15 日 病態生化学分野 ( 生化学 2) 教授 山縣和也 本日の学習の目標 ヘンダーソン ハッセルバルヒの式を理解する アミノ酸の電荷について理解する 自由エネルギーについて理解する 1. 酸と塩基 2. 代謝概要 ( 反応速度について ) 生体内の反応の多くに酸 塩基反応が関わっている またアミノ酸や核酸は酸や塩基の性質を示す 酸 Acid 塩基 Base
酸と塩基 代謝概要 平成 25 年 4 月 15 日 病態生化学分野 ( 生化学 2) 教授 山縣和也 本日の学習の目標 ヘンダーソン ハッセルバルヒの式を理解する アミノ酸の電荷について理解する 自由エネルギーについて理解する 1. 酸と塩基 2. 代謝概要 ( 反応速度について ) 生体内の反応の多くに酸 塩基反応が関わっている またアミノ酸や核酸は酸や塩基の性質を示す 酸 Acid 塩基 Base
1. 構造式ファイルの作成について 平成 31 年度からの少量新規化学物質の申出には電子データ ( ML ファイル形式 ) の提出が必要となります 本講演資料における 構造式ファイル は ML ファイルのことを指しています 経済産業省推奨構造式描画ソフトウェア以下のソフトウェアを用いて ML ファイ
 少量新規化学物質の申出における 構造式ファイルの作成について 平成 30 年秋 独立行政法人製品評価技術基盤機構 (NITE) 1 1 1. 構造式ファイルの作成について 平成 31 年度からの少量新規化学物質の申出には電子データ ( ML ファイル形式 ) の提出が必要となります 本講演資料における 構造式ファイル は ML ファイルのことを指しています 経済産業省推奨構造式描画ソフトウェア以下のソフトウェアを用いて
少量新規化学物質の申出における 構造式ファイルの作成について 平成 30 年秋 独立行政法人製品評価技術基盤機構 (NITE) 1 1 1. 構造式ファイルの作成について 平成 31 年度からの少量新規化学物質の申出には電子データ ( ML ファイル形式 ) の提出が必要となります 本講演資料における 構造式ファイル は ML ファイルのことを指しています 経済産業省推奨構造式描画ソフトウェア以下のソフトウェアを用いて
<4D F736F F D2093C58C8088C38B4C A F94708AFC96405F2E646F63>
 廃棄法暗記プリント 希釈法 : 多量の水で希釈して処理する 希釈法 : 多量の水で希釈して処理する 中和法 : 水を加えて希薄な水溶液とし 酸 ( 希塩酸 希硫酸など ) で中和させた後 多量の水で希釈して処理する 中和法 : 水を加えて希薄な水溶液とし 酸 ( 希塩酸 希硫酸など ) で中和させた後 多量の水で希釈して処理する 中和法 : 水で希薄な水溶液とし 酸 ( 希塩酸 希硫酸など ) で中和させた後
廃棄法暗記プリント 希釈法 : 多量の水で希釈して処理する 希釈法 : 多量の水で希釈して処理する 中和法 : 水を加えて希薄な水溶液とし 酸 ( 希塩酸 希硫酸など ) で中和させた後 多量の水で希釈して処理する 中和法 : 水を加えて希薄な水溶液とし 酸 ( 希塩酸 希硫酸など ) で中和させた後 多量の水で希釈して処理する 中和法 : 水で希薄な水溶液とし 酸 ( 希塩酸 希硫酸など ) で中和させた後
酢酸エチルの合成
 化学実験レポート 酢酸エチルの合成 2008 年度前期 木曜 学部 学科 担当 : 先生 先生実験日 :200Y 年 M 月 DD 日天候 : 雨 室温 23 湿度 67% レポート提出 :200Y 年 M 月 DD 日共同実験者 : アルコールとカルボン酸を脱水縮合すると エステルが得られる エステルは分子を構成するアルキル基に依存した特有の芳香を持つ 本実験ではフィッシャー法によりエタノールと酢酸から酢酸エチルを合成した
化学実験レポート 酢酸エチルの合成 2008 年度前期 木曜 学部 学科 担当 : 先生 先生実験日 :200Y 年 M 月 DD 日天候 : 雨 室温 23 湿度 67% レポート提出 :200Y 年 M 月 DD 日共同実験者 : アルコールとカルボン酸を脱水縮合すると エステルが得られる エステルは分子を構成するアルキル基に依存した特有の芳香を持つ 本実験ではフィッシャー法によりエタノールと酢酸から酢酸エチルを合成した
理科科学習指導案
 第 3 学年理科学習指導案 日時平成 27 年 月 日 ( ) 第 校時対象第 3 学年 組 名学校名 立 中学校 1 単元名 化学変化とイオン第 2 章酸 アルカリとイオン 中学校科学 3 ( 学校図書 ) 2 単元の目標 酸性とアルカリ性の水溶液の性質を調べ 酸とアルカリのそれぞれの特性が水素イオンと水酸化物イオ ンによることや 酸とアルカリを混ぜると 水と塩が生成することを理解する 3 単元の評価規準
第 3 学年理科学習指導案 日時平成 27 年 月 日 ( ) 第 校時対象第 3 学年 組 名学校名 立 中学校 1 単元名 化学変化とイオン第 2 章酸 アルカリとイオン 中学校科学 3 ( 学校図書 ) 2 単元の目標 酸性とアルカリ性の水溶液の性質を調べ 酸とアルカリのそれぞれの特性が水素イオンと水酸化物イオ ンによることや 酸とアルカリを混ぜると 水と塩が生成することを理解する 3 単元の評価規準
スライド 1
 タンパク質 ( 生化学 1) 平成 29 年 4 月 20 日病態生化学分野 分子酵素化学分野教授 山縣和也 生化学 1のスケジュール 4 月 20 日 講義開始 6 月 1 日 中間試験 9 月 25 日 生化学 1 試験 講義日程 内容は一部変更があります 講義資料 ( 山縣 吉澤分 ): 熊本大学病態生化学 で検索 ID: Biochem2 パスワード :76TgFD3Xc 生化学 1 の合否判定は
タンパク質 ( 生化学 1) 平成 29 年 4 月 20 日病態生化学分野 分子酵素化学分野教授 山縣和也 生化学 1のスケジュール 4 月 20 日 講義開始 6 月 1 日 中間試験 9 月 25 日 生化学 1 試験 講義日程 内容は一部変更があります 講義資料 ( 山縣 吉澤分 ): 熊本大学病態生化学 で検索 ID: Biochem2 パスワード :76TgFD3Xc 生化学 1 の合否判定は
