Microsoft PowerPoint - 【資料2-2】名古屋大学拠点提出資料
|
|
|
- しなつ うるしはた
- 7 years ago
- Views:
Transcription
1 材支援試験物製造支援 資料 2-2 第 2 回橋渡し研究戦略作業部会発表資料 橋渡し研究加速のための名古屋大学の取り組み 水野正明 名古屋大学総長補佐名古屋大学医学部附属病院先端医療 臨床研究支援センター 2016 年 2 月 3 日 名古屋大学革新的医療技術創出拠点の概要 革新的医療技術創出拠点 名古屋大学医学部附属病院 病院開設者 総長 病院長 拠点長 監査委員会先端医療開発拠点戦略会議 産学協同研究講座 学術研究 産学官連携推進本部 ( 知的 技術移転グループ ) 先端医療 臨床研究支援センター 進捗管理支援リソース PM 進捗管理会議センター運営協議会進捗報告会プログレスレポート 進捗管理支センター長ジェネラルプロジェクトディレクター (GPD) センター病院教授人ジェネラルプロジェクトマネージャー (GPM) 援データセンター 試験物製造施設バイオマテリアル調製ユニット遺伝子 細胞 再生医療 ISO9001:2008/13485:2003 人材支援リソース 試験事務局試験薬管理者生物統計家モニタリング担当者 PM コーディネーター試験計画作成担当者データ管理者監査担当者 連携 中部先端医療開発円環コンソーシアム中部 10 大学病院 2 センター間ネットワーク 中部医療産業化ネットワークメディカルデバイス産業振興協議会 ( 中部関連企業 / 名大間ネットワーク ) 名大関連病院ネットワーク 500 床以上の大規模病院が 34 施設 20,000 床以上をもつネットワーク 看護部門 事務部門 薬剤部門 切れ目のないシーズ発掘と育成 並びに臨床試験を強力に推進する学外連携組織 PM への全データの開示 提供 PM への全データの開示 提供 研究代表者 -1 学内プロジェクト 1 研究者 A 研究者 B 研究者 C 研究代表者 -2 学内プロジェクト 2 研究者 A 研究者 B 研究者 C その他の学内プロジェクト 研究代表者 -1 学外プロジェクト 1 研究者 A 研究者 B 研究者 C その他の学外プロジェクト 2
2 名大病院先端医療 臨床研究支援センターセンター組織体制 ( 概要 )
3 名大病院先端医療 臨床研究支援センターセンター組織体制 ( 詳細 ) 先端医療開発拠点戦略会議 臨床研究中核病院承認要件検討委員会 先端医療開発推進ネットワーク WG バイオバンク運用検討 WG バイオインフォマティクス活用 WG 次世代シーケンサー運用検討 WG 監査委員会 先端医療支援部門 臨床研究支援部門 支援研究室マテリアル調製室研究データ品質管理室システム情報室センター知財管理室臨床試験企画室臨床試験推進室 クリニカルシーケンス担当細胞バンク担当マテリアル調製担当企画 立案 進捗管理担当薬事担当メディカルライティング担当試験薬管理担当コーディネート担当 総長 病院長 課題選考 評価委員会 先端研究支援経費 先端医療開発経費 生命倫理審査委員会 治験審査委員会 事務局 IRB 事務局 学術研究 産学官連携推進本部 センター長ジェネラルプロジェクトディレクター & マネージャー 知財 技術移転グループ センター戦略会議 PM 会議 知財戦略会議 運営協議会 副センター長 人事委員会 教育委員会 センターアドバイザリー データ品質管理部門 ( データセンター ) 品質保証部門 管理部門 品質管理室 クリニカルネットワーク管理室 データマネジメント室 統計解析室 監査室 事務管理室 患者対応窓口担当 モニタリング担当 システム担当 データ管理担当 生物統計担当 バイオインフォマティクス担当 庶務担当 教育 評価担当 シーズ プロジェクト管理担当 病院支援経費担当 学外組織 (C-CAM 等 ) 担当 治験担当 5 名大病院先端医療 臨床研究支援センターセンターが提供する開発段階別 ARO 機能 6
4 名古屋大学のパイプライン 研究棚卸 R&Dシーズ発掘メカニズム 支援シーズ数 2015年10月 学内 190件 学外 C-CAM 46件 競争的資金 科研費等 競争的資金 TRシーズB C 随時センター HPで受付 特許出願 学内 学外 棚卸し前の シーズ シーズA 非臨床試験 シーズB シーズC CCAM等) 橋渡し研究開発費 特許戦略支援 知財戦略会議 先端研究支援経費 先端医療開発経費 外部の有識者を含む 学内対象 診療費免除を含む 学内対象 7 アカデミアによるパイプラインの強化 Ⅰ 臨床試験 研究受付窓口の一本化 Ⅱ 倫理審査委員会業務の電子化による臨床試験のデータベース化 申 理 トップページ 請システムの主な機能 Webブラウザを使った利 境 臨床試験の進行 況一覧や実施管 が可能 Decision tree による書式の一括ダウンロード 事前審査 専門審査ディスカッションが実施 確認できる 研究経過 年次 報告 有害事象報告 終了報告の早期確認 状 環 用 電子 Decision Tree プロジェクト詳細 Ⅲ シーズ情報収集管理システムによるⅠ Ⅱの統合管理 インターネット SSL3.0/TSL1.0 クライアント認証 VPN(Ipsec +IKE) 証明書認証 シーズ情報収集 センター 基盤 ネットワーク基盤 Ipsec + IKE センター 基盤 連携アダプタ 超セキュアクラウド 理 セキュアクラウド シーズ情報管 CTC Managed Cloud 現 医療情報の標準化を実 HL-7(CDA), DICOM, SS-MIX1/2など VPN(Ipsec +IKE) 証明書認証 閉域網 CTC EtherDIVE 電子カルテ外情報 電子カルテ情報 オミクスデータ等 病 匿名化 院HIS 病 名古屋大学医学部附属 院内 ネットワーク基盤 Ipsec + IKE ゲートウェイ サーバー 匿名化 i2m2oraシステム i2m2oraシステム 研究支援データベースシステム 診療科データ出力支援システム バックアップクラウド 8
5 企業との連携によるパイプラインの強化 臨床試験企画推進コンソーシアム ( 仮称 ) によるサイエンス支援体制 原薬合成製剤化 PK 測定 バイオマーカー 各種分析遺伝子解析相談 サンプリング 非臨床試験 早期探索的臨床試験 GO 臨床試験ライセンスアウト 情報フィードバック No Go 他候補化合物 29 戦略的知財権の確保によるパイプラインの強化 パイプライン ( シーズ育成 ) と知財権の確保のカップリング体制 実績 (2014 年度 ) 競争的資金 ( 科研費等 ) 競争的資金 (TR シーズ B C) 出願種類 件数 棚卸し前 シーズ シーズ A < 特許出願 > シーズ B 特許 非臨床 非臨床試験 シーズ C 臨床 基本特許 ( 物質特許等 ) 国内 8 PCT 0 外国 2 < 先端研究支援経費 > 知財戦略会議 < 先端医療開発経費 > 知財戦略支援 発明創出 特許出願 (0 年 ) PCT 出願 (1 年 ) 公開(1.5 年 ) 各国移行(2.5 年 ) 契約支援 明細書充実 侵害調査 ( 共同研究 ) 先行技術調査 公開日前の戦略的な関連出願 技術移転可能性検討 ( 新規効能 改良発明 ) 円環コンソーシアム知財管理支援侵害調査支援 特許出願相談 技術移転相談 周辺特許 ( 用途特許 製剤特許 製法特許 等 ) 国内 PCT 外国
6 支援シーズの選択と優先順位付けの取り組み 支援シーズの選択と優先順位付け 課題選考 評価委員会 PM 会議 センター運営協議会 独自に作り上げた評価マトリックスに従い 選定 評価を実施 橋渡し研究への移行 評価マトリックス 採点項目 研究の新規性 独自性 実現性 ( 出口戦略も考慮 ) 研究実施体制 ( 共同研究の有無 ) シーズ A または 先端研究支援シーズ ( 学内 ) 1 先端医療の研究といえるか? 2 研究ターゲットはバリデーションされているか? 3 2 年以内にバリデーションが可能か? stage シーズ B または 先端医療開発等シーズ ( 学内 ) シーズ C 1 出口戦略は明確か?( 治療? 診断? 予防?) 2 治療の場合 その期待すべき効果は明確か?( 根治療法? 進展抑制療法? 補充療法?) 1 患者さんにとって費用対効果の優れる医療になりうるか? 3 既存の医療技術 医薬品等のアンメットニーズを補うことが可能か? 1 研究チームは新しい医療を開拓しようという目的意識 1 企業とのマッチングの可能性はあるか ( 具体的社名 )? 1 試験物の品質確保 供給体制を2 年以内に確立するを共有しているか? 2 適切な治験 ( 臨床研究 ) の実施体制が確立しているか? ことは可能か? 2 研究チームの主体はアカデミアか 企業へライセンスアウトされた試験薬? / 機器 3 実用化を踏まえた製品の供給体制を 3 件 2 年以内に確立すること 3 共同研究機関との業務分担は明確か? は可能か? 研究資金の獲得状況 1 共同研究先がある場合 利益相反の問題はないか? 1 1 臨床試験を実施する費用が適切に見積もられて 確保され実施機関からの資金の支援があるか? ているか? 2 科研費などの戦略的研究資金を獲得しているか? 2 広告 宣伝に用いることを目的とした臨床研究ではない 知財の獲得状況 ( 他社侵害の有無も考慮 ) これまでの実績 ( 第 2 期 ) 1 基本特許は成立しているか? 1 基本特許は出願されているか? 2 基本特許を2 年以内に特許出願することは可能か? 実績開発状況 1 アカデミア発のシーズといえるか? 治験届が受理された / 提出された医師主導治験 製造または販売を承認( 認証 ) 申請した試験薬 / 機器 製造または販売を承認( 認証 ) された試験薬 / 機器 2 利用特許がある場合 譲渡 実施許諾交渉は行っているか? 4 件 2 件 2 件 1 利用特許がある場合 譲渡 実施許諾は完了しているか? 2 侵害調査は実施しているか? 3 基本特許を回避できる競合技術 製品は存在しないか? 1 レギュラトリーサイエンス面から実用化へのリスクは回避されているか? 1 人への外挿 ( 有効性 ADME 毒性) の科学的妥当性は確認 2 リスク回避のための前臨床試験計画は適切であり されているか? 2 年以内にリスク回避は可能か? ( 注 ) 継続支援シーズの場合 支援決定時またはステー ( 注 ) 継続支援シーズの場合 支援決定時またはステージアップジアップ時に設定したマイルストンが達成されていること 時に設定したマイルストンが達成されていること 新規支援シー新規支援シーズの場合 シーズAの基準も併せて満たズの場合 シーズA, シーズBの基準も併せて満たすこと すこと 11 中部先端医療開発円環コンソーシアム Chubu-regional Consortium for Advanced Medicine (C-CAM) 拠点外の橋渡し研究の底上げと拠点のさらなら発展に関する取り組み 強みを伸ばし 弱みを補完しあう関係づくり 12
7 中部先端医療開発円環コンソーシアム 参加 12 施設 (2012 年 4 月発足 ) 目的 本コンソーシアムにおいては 難病や希少疾患など未だに有効な治療方法が明らかにされていない疾病や 患者の生活の質の向上のための医療技術の改良等について 加盟する大学が連携して研究及び開発に取り組み 前臨床研究や臨床研究を協働して行うことにより開発を加速し いち早く患者の下へ届けることを目的とする 各大学の病院長等の代表が理事会を構成 2016 年 4 月より NPO 法人化 13 中部先端医療開発円環コンソーシアム WG の実績 (2014 年度 ) 共同倫理審査委員会検討 WG 共同倫理審査委員会の設置 審議 (2 件 ) 多施設共同研究推進 WG 施設間相互モニタリング体制の構築 ( 施設間 SOP)(4 件 ) 人材育成 WG 臨床研究セミナーの参加施設へのライブ配信 ( 月 1 回以上 ) 臨床研究認定者制度モニタリング担当者認定制度 産学連携推進 WG メディカルデバイス産業振興協議会 ( 名商 ) とのシーズ ニーズマッチイングシステムの運用 商談 情報共有 WG シーズ情報収集管理システム 疾患レジストリの開始 知的財産検討 WG 施設間知的財産連携協議会の開設 知財情報の共有化と評価の平準化 ( 目利き ) クリニカルデータサイエンス WG 生物統計家を中心とした臨床試験専門家 WG 登録 割付 EDC SOP/ マニュアル セミナー /OJT 14
8 C-CAM 内の他機関臨床試験の運営支援体制 MHLW 情報 PMDA 予算 有害事象報告 治験届有害事象報告 臨床試験の主となる他機関治験調整医師事務局効果安全性評価委員会 治験薬概要書の提供 CRO 及び CRC ( 安全性情報の収集及び当局報告など ) 有害事象情報提供 製薬会社等 治験手順書様式などの支援 治験施設との契約 /IRB 症例情報提供 支援拠点名古屋大学医学部附属病院先端医療 臨床研究支援センター 支援業務 手順書, プロトコール, 症例報告書, 同意説明文書, 症例登録 統計解析 データマネジメント業務 報告書作成業務 モニタリング / 監査 連携医療機関 相互モニタリング 15 次期プログラムへの課題と期待 次期プログラムへの課題 1 企業とは異なる 我が国独特のアカデミア創薬体制の確立 アカデミア : サイエンスの出口は 実用( 化 ) 製薬企業 : ビジネスの出口は 事業( 化 ) アカデミア製薬企業 : 患者にとって コスト アンド ベネフィット に優れた医療の提供 : 会社経営にとって リスク アンド リターン に優れた製品の提供 2 他機関の底上げ ( コンソーシアム等の組織化 ) 3 ARO 機能の強化 :PM 臨床疫学 生物統計 知財強化 情報共有 事務局機能 4 自立に向けた基盤の強化 次期プログラムの目標 ( 案 ) 1 世界最強の医療イノベーション国家の創成 2 先端医療開発を通した自立可能な大学 大学病院づくり 3 世界最高水準の医療 ( 先制 予防医療を含む ) 及び国民 市民 患者満足度世界一の医療の創成 16
医師主導治験取扱要覧
 15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
医療機器開発マネジメントにおけるチェック項目
 2018 年 11 月作成 医療機器開発マネジメントにおけるチェック項目 1. 各ステージゲートにおけるチェック項目 (1) チェック項目作成の目的従来個々の事業において実施されていた 事前 中間 事後の各ゲートにおける評価項目 Go/no-go の判断を 医療機器開発全期間を通して整理し 共通認識化する 技術的観点及び事業化の観点の双方を意識し 医療機器開発の特性を考慮したチェック項目を設定する
2018 年 11 月作成 医療機器開発マネジメントにおけるチェック項目 1. 各ステージゲートにおけるチェック項目 (1) チェック項目作成の目的従来個々の事業において実施されていた 事前 中間 事後の各ゲートにおける評価項目 Go/no-go の判断を 医療機器開発全期間を通して整理し 共通認識化する 技術的観点及び事業化の観点の双方を意識し 医療機器開発の特性を考慮したチェック項目を設定する
CROCO について
 CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
<4D F736F F D E34208EA18CB18EE891B182AB977697CC C8E8DB782B591D682A688CB978A>
 Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
標準業務手順 目次
 浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
北里大学グローバル臨床研究拠点
 日本主導型グローバル臨床研究 体制整備 : 北里大学の取り組み 1 1. 事業概要 目的 1. グローバル臨床研究の立案から実施 結果の公表まで グローバル開発の入り口から出口まで を多角的に支援できる体制を強化する 2. 法人内外のネットワークを活用し 日本発の創薬 医療機器シーズを育成する キャッチフレーズ 実学の精神 のもと オール北里体制で日本主導型グローバル臨床研究推進の中核を担う 2 学校法人北里研究所
日本主導型グローバル臨床研究 体制整備 : 北里大学の取り組み 1 1. 事業概要 目的 1. グローバル臨床研究の立案から実施 結果の公表まで グローバル開発の入り口から出口まで を多角的に支援できる体制を強化する 2. 法人内外のネットワークを活用し 日本発の創薬 医療機器シーズを育成する キャッチフレーズ 実学の精神 のもと オール北里体制で日本主導型グローバル臨床研究推進の中核を担う 2 学校法人北里研究所
PowerPoint プレゼンテーション
 研究開発課題名難病 希少疾患の医薬品開発におけるクリニカルイノベーションネットワーク構想の推進を目指した疾患登録システム ( 患者レジストリ ) の構築 研究開発代表者 国立研究開発法人国立精神 神経医療研究センター 資料 2-3 トランスレーショナルメディカルセンター 臨床研究支援室長 発表内容 本研究の目標 実施体制 Remudy の実績と課題 目指すもの 疾患登録システム レジストリの信頼性について
研究開発課題名難病 希少疾患の医薬品開発におけるクリニカルイノベーションネットワーク構想の推進を目指した疾患登録システム ( 患者レジストリ ) の構築 研究開発代表者 国立研究開発法人国立精神 神経医療研究センター 資料 2-3 トランスレーショナルメディカルセンター 臨床研究支援室長 発表内容 本研究の目標 実施体制 Remudy の実績と課題 目指すもの 疾患登録システム レジストリの信頼性について
9 中止基準 ( 研究対象者の中止 研究全体の中止について ) 10 研究対象者への研究実施後の医療提供に関する対応 通常の診療を超える医療行為 を伴う研究を実施した場合 研究実施後において 研究対象者が研究の結果より得られた利用可能な最善の予防 診断及び治療が受けられるように努めること 11 研究
 倫理審査書類 ( 研究計画書 ) チェックシート 研究計画書には 原則として以下の項目を含めてください 申請時 提出は不要です 2017.5.2 1 研究の名称 ( 標題 ) 2 研究の実施体制 ( 研究組織 ) 多施設共同研究の場合 共同研究機関の研究者名 役割も詳細に記載 3 研究の背景及び意義 研究を実施する意義 必要性に関して 文献等を用いて研究の 科学的合理性の根拠 と 本研究で得られる成果
倫理審査書類 ( 研究計画書 ) チェックシート 研究計画書には 原則として以下の項目を含めてください 申請時 提出は不要です 2017.5.2 1 研究の名称 ( 標題 ) 2 研究の実施体制 ( 研究組織 ) 多施設共同研究の場合 共同研究機関の研究者名 役割も詳細に記載 3 研究の背景及び意義 研究を実施する意義 必要性に関して 文献等を用いて研究の 科学的合理性の根拠 と 本研究で得られる成果
PowerPoint プレゼンテーション
 背景 クリニカル イノベーション ネットワーク (CIN) の背景と概要 資料 3 新しい医薬品 医療機器等の開発に当たっては 世界的にコストが高騰している 特に 医薬品にあっては タフツ大学の試算によると 1 新薬当たり $2,558 million( 約 3,000 億円 ) 要するといわれている (Nov. 18, 2014, Tufts Center for the Study of Drug
背景 クリニカル イノベーション ネットワーク (CIN) の背景と概要 資料 3 新しい医薬品 医療機器等の開発に当たっては 世界的にコストが高騰している 特に 医薬品にあっては タフツ大学の試算によると 1 新薬当たり $2,558 million( 約 3,000 億円 ) 要するといわれている (Nov. 18, 2014, Tufts Center for the Study of Drug
治験事務局標準業務マニュアル
 治験申請等に関する手順書 Ⅰ) 新規治験の申請 1. 実施体制 治験事務局院内スタッフが SMO との提携し 事務局を運営する なお SMO の費用は院内費用とは別に算定するため 別途相談とする CRC 院内スタッフを用いる場合 SMO を利用する場合 どちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され 責任医師との合意が文書で得られた時点で予約は可能とする
治験申請等に関する手順書 Ⅰ) 新規治験の申請 1. 実施体制 治験事務局院内スタッフが SMO との提携し 事務局を運営する なお SMO の費用は院内費用とは別に算定するため 別途相談とする CRC 院内スタッフを用いる場合 SMO を利用する場合 どちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され 責任医師との合意が文書で得られた時点で予約は可能とする
静岡県立静岡がんセンター臨床研究事務局の業務手順書
 治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
サマリー記載について
 第 64 回 HL7 セミナー HL7 標準規格 退院時サマリー のご紹介 退院時サマリー標準規格 開発検討の経緯 平成 30 年 3 月 豊田建日本 HL7 協会 ( 株式会社 HCI) HL7 CDA について HL7 Clinical Document Architecture (CDA) 文書構造を有する診療情報を記述するためのXMLによる言語 2009 年 11 月 ISO 規格 ISO/HL7
第 64 回 HL7 セミナー HL7 標準規格 退院時サマリー のご紹介 退院時サマリー標準規格 開発検討の経緯 平成 30 年 3 月 豊田建日本 HL7 協会 ( 株式会社 HCI) HL7 CDA について HL7 Clinical Document Architecture (CDA) 文書構造を有する診療情報を記述するためのXMLによる言語 2009 年 11 月 ISO 規格 ISO/HL7
治験審査委員会手順書 平成 27 年 10 月 1 日 医療法人新光会
 治験審査委員会手順書 平成 27 年 10 月 1 日 医療法人新光会 第 1 条 ( 目的 ) 1. 本手順書は 新光会治験審査委員会 ( 以下 委員会という ) において 医薬品及び医療機器 ( 以下 医薬品等という ) の治験の調査審議を実施するに当たり 薬事法 ( 昭和 35 年 8 月 10 日法律第 145 号 ) に基づく 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3
治験審査委員会手順書 平成 27 年 10 月 1 日 医療法人新光会 第 1 条 ( 目的 ) 1. 本手順書は 新光会治験審査委員会 ( 以下 委員会という ) において 医薬品及び医療機器 ( 以下 医薬品等という ) の治験の調査審議を実施するに当たり 薬事法 ( 昭和 35 年 8 月 10 日法律第 145 号 ) に基づく 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3
Microsoft PowerPoint - 運用 [互換モード]
![Microsoft PowerPoint - 運用 [互換モード] Microsoft PowerPoint - 運用 [互換モード]](/thumbs/91/105850431.jpg) 押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
12_モニタリングの実施に関する手順書
 12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
アカデミアにおける医師主導治験PM(岡山大学・櫻井)
 2017/7/19(Wed.) JSGCT 臨床試験トレーニングコース アカデミアにおける医師主導治験のプロジェクトマネジメント 岡山大学病院 新医療研究開発センター 講師櫻井淳 1 本日の内容 p 医師主導治験について p アカデミアの治験プロジェクトマネジメント p 実際にあったプロジェクトマネジメントの困った事例 ARO 協議会 PM 専門家連絡会編 アカデミアにおける医師主導治験のプロジェクトマネジメント
2017/7/19(Wed.) JSGCT 臨床試験トレーニングコース アカデミアにおける医師主導治験のプロジェクトマネジメント 岡山大学病院 新医療研究開発センター 講師櫻井淳 1 本日の内容 p 医師主導治験について p アカデミアの治験プロジェクトマネジメント p 実際にあったプロジェクトマネジメントの困った事例 ARO 協議会 PM 専門家連絡会編 アカデミアにおける医師主導治験のプロジェクトマネジメント
臨床試験(治験)の手続きについて
 臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
製造販売後調査事務手続き等 について
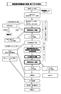 製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後 予測因子および副作用発現の危険因子についての探索的研究 (JACCRO GC-07AR) という臨床研究について説明したものです この文書と私の説明のな かで わかりにくいと
 StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
静岡県立静岡がんセンター臨床研究事務局の業務手順書
 治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 1 目次 1. 目的と適用範囲...
治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 1 目次 1. 目的と適用範囲...
<4D F736F F F696E74202D208EA18CB B90B389BB8DEC8BC694C F E B93C782DD8EE682E890EA97705D205B8CDD8AB
 治験等適正化作業班における 検討 独立行政法人国立病院機構本部伊藤澄信 第 6 回治験中核病院 拠点医療機関等協議会 本日の内容 設置の経緯等について 主な検討内容について 今後の課題について その他 1 設置の経緯 (1) 1. 設置の背景 新たな治験活性化 5 カ年計画の中間見直しに関する検討会 報告の 重点的取組事項 ( アクションプラン ) の進捗 において 今後 取組みをより加速かつ強化すべき課題
治験等適正化作業班における 検討 独立行政法人国立病院機構本部伊藤澄信 第 6 回治験中核病院 拠点医療機関等協議会 本日の内容 設置の経緯等について 主な検討内容について 今後の課題について その他 1 設置の経緯 (1) 1. 設置の背景 新たな治験活性化 5 カ年計画の中間見直しに関する検討会 報告の 重点的取組事項 ( アクションプラン ) の進捗 において 今後 取組みをより加速かつ強化すべき課題
untitled
 1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
平成28年度 第1回 臨床研究に関する研修会
 平成 28 年度第 1 回 臨床研究に関する研修会 臨床研究センター臨床研究ユニット 平成 28 年 4 月 22 日 1 人を対象とする医学系研究に関する倫理指針について 2 臨床研究における様々な指針 医薬品 医療機器 再生医療等製品の承認申請を目的としているか? Yes 治験 No 治験以外の臨床研究 法律 医薬品医療機器等法 ( 旧薬事法 ) 省令 臨床試験の実施の基準に関する省令 (GCP)
平成 28 年度第 1 回 臨床研究に関する研修会 臨床研究センター臨床研究ユニット 平成 28 年 4 月 22 日 1 人を対象とする医学系研究に関する倫理指針について 2 臨床研究における様々な指針 医薬品 医療機器 再生医療等製品の承認申請を目的としているか? Yes 治験 No 治験以外の臨床研究 法律 医薬品医療機器等法 ( 旧薬事法 ) 省令 臨床試験の実施の基準に関する省令 (GCP)
臨床研究に関する標準業務手順書
 臨床研究に関する標準業務手順書 2018/04/01 第 15 版 改定履歴 日付 版 改定理由 改定箇所 内容 2010/02/06 1 新規制定 2010/04/14 2 COI 関連手順の明確化 フローチャートに COI に関する手順の追記 2010/08/19 3 様式 必要書類の追加 COI 関連様式の追記 安全性に関する報告の手順および様式 ( 様式 11) の追加 委託研究に関する手順
臨床研究に関する標準業務手順書 2018/04/01 第 15 版 改定履歴 日付 版 改定理由 改定箇所 内容 2010/02/06 1 新規制定 2010/04/14 2 COI 関連手順の明確化 フローチャートに COI に関する手順の追記 2010/08/19 3 様式 必要書類の追加 COI 関連様式の追記 安全性に関する報告の手順および様式 ( 様式 11) の追加 委託研究に関する手順
< F2D8E9197BF A836F815B2E6A7464>
 ( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
山形県立中央病院治験審査委員会業務手順書
 山形県立中央病院治験審査委員会業務手順書 第 1 目的この手順書は山形県立中央病院医薬品等臨床試験受託研究取扱要綱 ( 以下 取扱要綱 という ) に基づいて山形県立中央病院治験審査委員会 ( 以下 本委員会 という ) の運用方法を定め それに基づく業務手順書を示すものである なお 製造販売後臨床試験においては 以下 治験 とあるのを 製造販売後臨床試験 と読み替えるものとする 第 2 本委員会の責務本委員会は全ての被験者の人権の保護
山形県立中央病院治験審査委員会業務手順書 第 1 目的この手順書は山形県立中央病院医薬品等臨床試験受託研究取扱要綱 ( 以下 取扱要綱 という ) に基づいて山形県立中央病院治験審査委員会 ( 以下 本委員会 という ) の運用方法を定め それに基づく業務手順書を示すものである なお 製造販売後臨床試験においては 以下 治験 とあるのを 製造販売後臨床試験 と読み替えるものとする 第 2 本委員会の責務本委員会は全ての被験者の人権の保護
過去の医薬品等の健康被害から学ぶもの
 新薬による薬害事件を如何に防ぐか - ソリブジン事件とイレッサ事件から学ぶ - 土井脩 ( 医薬品医療機器レギュラトリーサイエンス財団 ) Pharmaceutical and Medical Device Regulatory Science Society of Japan 2019.01.01 ( レギュラトリーサイエンスエキスパート研修会 薬害教育 ) 研修用教材としてまとめたものであり 公式見解などをまとめたものではありません
新薬による薬害事件を如何に防ぐか - ソリブジン事件とイレッサ事件から学ぶ - 土井脩 ( 医薬品医療機器レギュラトリーサイエンス財団 ) Pharmaceutical and Medical Device Regulatory Science Society of Japan 2019.01.01 ( レギュラトリーサイエンスエキスパート研修会 薬害教育 ) 研修用教材としてまとめたものであり 公式見解などをまとめたものではありません
Microsoft PowerPoint - 01CDISC概要短縮版.ppt
 CDISC 標準の概要 東京大学医学部附属病院大学病院医療情報ネットワーク研究センター木内貴弘 目次 1.CDISC 標準について 2. 医療の世界のデータ交換標準と臨床研究の世界のデータ交換標準 3.CDISC 標準を活用した効率的な臨床研究 1.CDISC 標準について CDISC とは? Clinical Data Interchange Standards Consortium の略 ( 非営利の臨床データ標準化団体
CDISC 標準の概要 東京大学医学部附属病院大学病院医療情報ネットワーク研究センター木内貴弘 目次 1.CDISC 標準について 2. 医療の世界のデータ交換標準と臨床研究の世界のデータ交換標準 3.CDISC 標準を活用した効率的な臨床研究 1.CDISC 標準について CDISC とは? Clinical Data Interchange Standards Consortium の略 ( 非営利の臨床データ標準化団体
目次 1. はじめに 2. 実際の応募手続き 2-a. 手続きを始める前に 2-b. 研究開発提案書様式の取得 2-c. 応募の新規登録 2-d. 応募情報の入力 2
 免疫アレルギー疾患等実用化研究事業 ( 移植医療技術開発研究分野 ) 2019 年度 1 次公募に係る府省共通研究開発管理システム (e-rad) への入力方法について 戦略推進部 難病研究課 2018 年 11 月 1 目次 1. はじめに 2. 実際の応募手続き 2-a. 手続きを始める前に 2-b. 研究開発提案書様式の取得 2-c. 応募の新規登録 2-d. 応募情報の入力 2 1. はじめに
免疫アレルギー疾患等実用化研究事業 ( 移植医療技術開発研究分野 ) 2019 年度 1 次公募に係る府省共通研究開発管理システム (e-rad) への入力方法について 戦略推進部 難病研究課 2018 年 11 月 1 目次 1. はじめに 2. 実際の応募手続き 2-a. 手続きを始める前に 2-b. 研究開発提案書様式の取得 2-c. 応募の新規登録 2-d. 応募情報の入力 2 1. はじめに
臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美
 臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美 本日の Agenda 1. 臨床評価とは 2. 医療機器の特性を踏まえた有効性 安全性評価 3. 各国の規制の違い 4. 臨床評価報告書について 5. 臨床評価報告書の概念 6. 臨床研究と治験の違いは? 7. 文献評価の問題点 8. 治験活性化にむけて 臨床評価 とは そのものの有効性と安全性をヒトで評価すること 自己認証の欧州から出てきた概念
臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美 本日の Agenda 1. 臨床評価とは 2. 医療機器の特性を踏まえた有効性 安全性評価 3. 各国の規制の違い 4. 臨床評価報告書について 5. 臨床評価報告書の概念 6. 臨床研究と治験の違いは? 7. 文献評価の問題点 8. 治験活性化にむけて 臨床評価 とは そのものの有効性と安全性をヒトで評価すること 自己認証の欧州から出てきた概念
臨床試験(治験)実施の手続き
 製造販売後調査実施の手続き はじめに 本書は 昭和大学藤が丘病院における製造販売後調査実施の手続き方法等について記載したものです 本書内のは当院が提供する書類を示し は審査等に必要な書類を示しております 調査内容により提出書類 資料に変更が生じる場合があります 詳細は支援室にご確認ください 申請する書類および資料は 事前に E-mail に添付して支援室にお送りください 内容の確認をし ご連絡させて頂きます
製造販売後調査実施の手続き はじめに 本書は 昭和大学藤が丘病院における製造販売後調査実施の手続き方法等について記載したものです 本書内のは当院が提供する書類を示し は審査等に必要な書類を示しております 調査内容により提出書類 資料に変更が生じる場合があります 詳細は支援室にご確認ください 申請する書類および資料は 事前に E-mail に添付して支援室にお送りください 内容の確認をし ご連絡させて頂きます
革新的がん治療薬の実用化を目指した非臨床研究 ( 厚生労働科学研究 ) に採択 大学院医歯学総合研究科遺伝子治療 再生医学分野の小戝健一郎教授の 難治癌を標的治療できる完全オリジナルのウイルス遺伝子医薬の実用化のための前臨床研究 が 平成 24 年度の厚生労働科学研究費補助金 ( 難病 がん等の疾患
 革新的がん治療薬の実用化を目指した非臨床研究 ( 厚生労働科学研究 ) に採択 大学院医歯学総合研究科遺伝子治療 再生医学分野の小戝健一郎教授の 難治癌を標的治療できる完全オリジナルのウイルス遺伝子医薬の実用化のための前臨床研究 が 平成 24 年度の厚生労働科学研究費補助金 ( 難病 がん等の疾患分野の医療の実用化研究事業 がん関係研究分野 ) に採択されました 厚生労働科学研究の背景と本研究事業の概要がんは我が国の死亡原因の第
革新的がん治療薬の実用化を目指した非臨床研究 ( 厚生労働科学研究 ) に採択 大学院医歯学総合研究科遺伝子治療 再生医学分野の小戝健一郎教授の 難治癌を標的治療できる完全オリジナルのウイルス遺伝子医薬の実用化のための前臨床研究 が 平成 24 年度の厚生労働科学研究費補助金 ( 難病 がん等の疾患分野の医療の実用化研究事業 がん関係研究分野 ) に採択されました 厚生労働科学研究の背景と本研究事業の概要がんは我が国の死亡原因の第
