<4D F736F F F696E74202D208EA18CB B90B389BB8DEC8BC694C F E B93C782DD8EE682E890EA97705D205B8CDD8AB
|
|
|
- しほこ ほがり
- 5 years ago
- Views:
Transcription
1 治験等適正化作業班における 検討 独立行政法人国立病院機構本部伊藤澄信 第 6 回治験中核病院 拠点医療機関等協議会
2 本日の内容 設置の経緯等について 主な検討内容について 今後の課題について その他 1
3 設置の経緯 (1) 1. 設置の背景 新たな治験活性化 5 カ年計画の中間見直しに関する検討会 報告の 重点的取組事項 ( アクションプラン ) の進捗 において 今後 取組みをより加速かつ強化すべき課題 が掲げられた その中でも治験等の効率化に係る以下の事項について検討 1) コストの適正化 ( 実績に基づく支払い方法 ) 2) 共同審査委員会等運用関連 ( 具体的なあり方や効率的な活用方法 ) 3) 症例集積性の向上 ( 各疾患症例数の把握 複数機関で連携した症例数確保 ) 疾患 インフラ等に関するデータベースに求められる項目の整理 治験ネットワークに求められる機能の明確化 4) 治験実施プロセス (GCPの要求に沿った必要最小限の手順) GCP で要求されている必要最小限のプロセスの整理 2 当該プロセスに基づき 現場で運用可能な改善策の提示
4 設置の経緯 (2) 2. 外部環境の変化国際共同治験の増加等による各国間の症例集積性 症例あたりのコスト 契約形態等の治験実施状況の比較が可能となり 国際競争力や透明性の確保が強く意識 費用支払い方法 : Performance Based Payment( 諸外国 )vs 前納制が残存 基幹病院の規模 : 2000 床 ( アジア諸国 ) vs 500 床 ( 基幹病院など ) 法的規制 : IND Trial( 国家研究法 )( 米国 ) vs 治験 ( 薬事法 ) 欧州臨床試験指令 (EU) 臨床研究 ( 倫理指針 ) コスト スピードを改善し 治験 臨床試験の Japan passing を阻止して Life science の開発環境をわが国に 3
5 主な検討内容 治験活性化 5 カ年計画のみならず 治験環境に関する諸外国との違いも考慮の上 日本における治験環境改善を目的に以下を検討 治験等適正化作業班国際的商習慣に合わせた治験費用の支払い方法の推奨 ( コストそのものの適正化は次のステップとする ) 症例集積性向上検討チームアジアの医療機関に匹敵する症例集積性を確保するためにネットワークが 1 医療機関と同様の事務手続きで機能するための改善策 治験プロセス検討チーム業務改善による効率化 人件費の削減を目的とした不要な手続きの削減 4
6 1 アジア医療機関 =1 ネットワーク 1 アジア病院 = 共通電子カルテ 2,000 床外来患者多数 コスト = 医療機関コスト + モニタリングコスト 実績に基づき透明化 仮想的に施設数を少なく契約 治験薬配送 Over qualityの改善不要な工程を省略 5
7 治験費用の支払いに関する現状 海外 (US/UK) における治験費用の支払いの基本概念 実施した業務 に対して費用を支払う! Visit 毎 実施項目別の費用算出 ( 積上げ方式 ) 人件費 ( 医師 CRC 等 ) は時給ベースでの計算 日本では 前納返還なし の医療機関が未だ存在! US $ $ $ $ $ $ JAPAN 治験実施実績に基づく医療機関への支払い方法のモデル案 提示へ!! 6
8 モデル案のポイント 1 - 固定費 変動費の概念の導入 - 費用項目の基本的考え方固定費 : 実施状況 ( 実施症例数や症例ごとの進捗度 ) に拘わらず発生する費用変動費 : 実施状況 ( 実施症例数や症例ごとの進捗度 ) に依存する費用 従来の 間接費 治験事務局経費等の経費 ( 含 IRB 事務局経費 委員謝金等 ) 施設管理費 ( 一部 ) CRC 等人件費 ( 一部 ) 治験薬管理費 臨床試験研究費 施設管理費 ( 一部 ) CRC 等人件費 ( 一部 ) ( 含モニタリング対応経費等 ) 従来の 間接費 固定費 15~30% 変動費 70~85% その他の費用 ( 実費精算 ) 被験者負担軽減費 保険外併用療養費対象外費 当該治験に係る会議等の旅費 算定された総額 100% この総額の中から 間接費相当分 を計上 変動費 / 契約症例数 1 症例の単価 7
9 取得モデル案のポイント 2 -PERFORMANCE BASED PAYMENT の導入 - 固定費 : 費目ごとに費用発生時期に支払う 一例 : 算定総額の 15~30% ( 初回 IRB 費用 契約締結時 治験薬管理費 初回治験薬設置時など ) 契約締結時に一括して支払う ( 前納 ) も可能 ( 年毎に案分も可能 ) 変動費 : 実績に基づき支払う ( 後納 ) 一例 : 算定総額の 70~85% 症例ごとの進捗度に応じて費用を算定設定した適切な期間 ( 例 :3~6 カ月に 1 度 ) に集計 請求 変動費部分に関する 1 症例あたりの治験期間における進捗度の例示 ( 長期試験 ) 意観察期脱落症例費 3~5 万 治験薬投与開始 30% ¼ 期間経過 20% 同 算定された変動費を契約症例数で除した金額に対する割合 の高さは治験費用のスケール ( 合計 100%) ¾ 期間経過 20% 20% 終了時 10% 験終了中間点経過 治8
10 今後の課題 臨床試験研究費ポイント算出表のあり方 治験の内容や規模 治験期間等を加味した算定 ( 長期試験 小児対象試験など ) 保険外併用療養費制度の見直し 対象となる期間や薬剤の定義 契約書雛型の作成 経費全体の統一化による透明性の確保 治験費用の算定方法 ( 適切な業務手順 内容を考慮した人件費算定など ) 費用発生毎の支払い 9
11 共同治験審査委員会等の利用の 促進にむけて 現行の問題点治験審査委員が実施医療機関及び治験責任医師などの適格性や実施体制を審査するための情報を充実させる必要がある 改善策 医療機関のネットワーク化に通じた取組み と合わせて改善策を 10
12 症例集積性向上検討チーム (1) 検討 1: 治験ネットワークに求められる機能の明確化 アジア諸国のメガホスピタルと同等の症例集積を可能とする治験ネットワーク体制を構築するための目標を設定アジア諸国 1MH(2000 床 ) VS 日本 3~5HP (500 床程度のHP 3) どの疾患領域に対しても 常に積極的に対応出来る医療機関が最低 3~5 が連携し それらが 1 医療機関のように機能する必要がある 更に GCP 改定 ( 実施医療機関との契約 ) 運用通知改定に向けての提言の必要性について検討 11
13 実施医療機関と開発薬の関係 12
14 ONE STOP SERVICEに向けての効率化 標準業務手順書の作成と各種様式等の一元化 共同治験審査委員会の設置及びその活用 治験ネットワーク事務局の積極的なマネジメント 具体的に : 治験の契約を依頼者と治験ネットワーク間で締結することは無理 しかしながら ネットワーク事務局の者を当該施設の治験事務局として選任 契約することで以下の内容が可能となる ネットワーク事務局が治験依頼者からの安全性情報などを一元的に管理可能 ネットワーク事務局が治験関連文書の作成 保管を一元管理 13
15 治験ネットワークにおける治験事務局機能のモデル案 14
16 症例集積性向上検討チーム (2) 検討 2: データベース項目 症例集積性の観点から有益な情報は? 疾患別症例数治験実績 費用関連など これらは流動的な情報であり DB 化した際の医療機関の更新等メンテナンスが困難 治験の効率化に繋がる実施体制を含む DB 項目を XML 化 (CDISC 対応 ) し Web に掲載 モニターがダウンロードして利用 15
17 実施医療機関情報入力システムを用いた作業工程 16
18 治験プロセス検討チーム GCP 要求に沿った必要最小限のプロセスの明確化 (1) IRB 審査資料の統一化と電子化 統一書式の使用の徹底 IRB 審査資料の種類や並び順の統一化 資料作成に係る負担軽減を 郵送 宅配 電子メールの活用 IT 化 ( 電子化 )( 保存資料の電子化も含む ) 共同 IRBの積極的活用 作業手順 依頼者 医療機関双方の業務の洗い出し それらの業務の根拠となる GCP 及び運用通知の確認 17
19 治験プロセス検討チーム GCP 要求に沿った必要最小限のプロセスの明確化 (2) 実施医療機関における治験実施体制の整備と役割分担の適正化 治験に係る手順書 実施体制 実績の公表 機器のバリデーションの提示 依頼者と実施医療機関職員の役割分担の適正化 情報や文書の事務局での作成と一元管理 院内調整は施設側で 治験依頼者からの提供は標準版のみ ( 改変は施設で ) 治験薬交付は運搬業者を活用 18
20 治験プロセス検討チーム GCP 要求に沿った必要最小限のプロセスの明確化 (3) 事前ヒアリング等 事前ヒアリングはGCP 上は必須でないが 効率的な衆知の機会に スタートアップミーティングの日程調整は事務局で EDCトレーニングなどはe-learningなどで効率的に モニタリング業務の効率化 治験評価に必要なデータだけ収集 直接閲覧の結果報告書 は医療機関に提出しない モニタリングの場所の提供 サンプリング SDV 実施を考慮 19
21 ご清聴ありがとうございました 20
<4D F736F F D E34208EA18CB18EE891B182AB977697CC C8E8DB782B591D682A688CB978A>
 Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
Project Goals
 平成 23 年度治験推進地域連絡会議 治験推進に向けた欧州製薬団体連合会 (EFPIA) の取り組み 欧州製薬団体連合会 (EFPIA) 技術委員会臨床部会 本日の内容 日本の治験環境の変化と現状 治験等の効率化に関する今後の期待 EFPIA臨床部会の取り組み On/Off-site Monitoringの普及 ALCOAの普及 合同モニター研修 2 3 日本の治験環境の変化と現状 - 新 G C
平成 23 年度治験推進地域連絡会議 治験推進に向けた欧州製薬団体連合会 (EFPIA) の取り組み 欧州製薬団体連合会 (EFPIA) 技術委員会臨床部会 本日の内容 日本の治験環境の変化と現状 治験等の効率化に関する今後の期待 EFPIA臨床部会の取り組み On/Off-site Monitoringの普及 ALCOAの普及 合同モニター研修 2 3 日本の治験環境の変化と現状 - 新 G C
untitled
 1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
京都府立医科大学附属病院
 治験費用の取扱に関する手順書 京都府立医科大学附属病院 第 1 版平成 21 年 11 月 16 日 第 2 版平成 23 年 3 月 16 日 第 3 版平成 25 年 2 月 1 日 1. 目的 本手順書は 京都府立医科大学附属病院治験実施取扱規定の定めるところにより 治験 費用の取り扱いに関する運用方法を定め それに基づく業務手順を示すものである 2. 治験に係る経費の範囲 (1) 治験経費
治験費用の取扱に関する手順書 京都府立医科大学附属病院 第 1 版平成 21 年 11 月 16 日 第 2 版平成 23 年 3 月 16 日 第 3 版平成 25 年 2 月 1 日 1. 目的 本手順書は 京都府立医科大学附属病院治験実施取扱規定の定めるところにより 治験 費用の取り扱いに関する運用方法を定め それに基づく業務手順を示すものである 2. 治験に係る経費の範囲 (1) 治験経費
研究報告書レイアウト例(当該年度が最終年度ではない研究班の場合)
 長寿医療研究開発費平成 29 年度総括研究報告 治験関連情報の一元管理を可能とする治験管理システムの開発 (29-44) 主任研究者平島学国立長寿医療研究センター 治験 臨床研究推進センター ( 治験 臨床研究主任薬剤師 ) 研究要旨治験には 症例実施時に発生する費用があり 治験薬の投与期間や治験の進捗状況に応じて依頼者毎で請求時期が異なっている 現状では 契約 進捗 請求の情報が 別々の情報として管理されているため
長寿医療研究開発費平成 29 年度総括研究報告 治験関連情報の一元管理を可能とする治験管理システムの開発 (29-44) 主任研究者平島学国立長寿医療研究センター 治験 臨床研究推進センター ( 治験 臨床研究主任薬剤師 ) 研究要旨治験には 症例実施時に発生する費用があり 治験薬の投与期間や治験の進捗状況に応じて依頼者毎で請求時期が異なっている 現状では 契約 進捗 請求の情報が 別々の情報として管理されているため
治験実施に必要な手続きについて (HP 用 ) 治験 製造販売後臨床試験 聖マリアンナ医科大学病院治験管理室 聖マリアンナ医科大学病院治験管理室 2011 年 10 月作成 2013 年 1 月改訂 2014 年 4 月改訂 2018 年 4 月改定 2018 年 5 月改定 Ⅰ. 治験審査委員会
 治験実施に必要な手続きについて (HP 用 ) 治験 製造販売後臨床試験 2011 年 10 月作成 2013 年 1 月改訂 2014 年 4 月改訂 2018 年 4 月改定 2018 年 5 月改定 Ⅰ. 治験審査委員会 (IRB) と連絡先 治験審査委員会名称 治験審査委員会設置者 聖マリアンナ医科大学附属病院等治験審査委員会 St. Marianna University Group Institutional
治験実施に必要な手続きについて (HP 用 ) 治験 製造販売後臨床試験 2011 年 10 月作成 2013 年 1 月改訂 2014 年 4 月改訂 2018 年 4 月改定 2018 年 5 月改定 Ⅰ. 治験審査委員会 (IRB) と連絡先 治験審査委員会名称 治験審査委員会設置者 聖マリアンナ医科大学附属病院等治験審査委員会 St. Marianna University Group Institutional
別紙 1 治験費用の支払い方法に関するモデル案 ( 一部改訂 ) 治験等適正化作業班における検討の目的及び検討の範囲 本作業班は 新たな治験活性化 5 カ年計画の中間見直しに関する検討会 報告 において掲げられた課題のうち 治験等の効率化に係る以下の事項について検討することを目的に設置された 1)
 資料 5 治験費用の支払い方法に関するモデル案 に対する意見聴取結果 及び質疑応答集 (Q&A) について 平成 23 年 2 月 21 日 治験等適正化作業班事務局 平成 22 年 11 月 16 日付けでご連絡いたしました 治験費用の算定 支払い方法に関するモデル案 ( 以下 モデル案 という ) に関しましては 貴重なご意見を賜りまして誠にありがとうございました この度 頂戴いたしました疑義照会事項等につきましては
資料 5 治験費用の支払い方法に関するモデル案 に対する意見聴取結果 及び質疑応答集 (Q&A) について 平成 23 年 2 月 21 日 治験等適正化作業班事務局 平成 22 年 11 月 16 日付けでご連絡いたしました 治験費用の算定 支払い方法に関するモデル案 ( 以下 モデル案 という ) に関しましては 貴重なご意見を賜りまして誠にありがとうございました この度 頂戴いたしました疑義照会事項等につきましては
<93648EA593498B4C985E82C98AD682B782E E838A F E315F C668DDA95AA292E786C7378>
 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 ( 版 :2013 年 9 月 1 日 ver2.0) 2 3 電磁的記録として扱う治験関連文書 電磁的記録の交付
1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 ( 版 :2013 年 9 月 1 日 ver2.0) 2 3 電磁的記録として扱う治験関連文書 電磁的記録の交付
内容 1. はじめに 大規模治験ネットワーク登録医療機関への支援内容 治験実施医療機関情報の登録と公開 登録の条件 事前確認 大規模治験ネットワーク への登録方法 登録の手順 登録でき
 大規模治験ネットワーク 登録マニュアル Ver1.1 2013/4/1 公益社団法人日本医師会治験促進センター 0 内容 1. はじめに... 2 2. 大規模治験ネットワーク登録医療機関への支援内容... 2 3. 治験実施医療機関情報の登録と公開... 3 4. 登録の条件... 4 5. 事前確認... 5 6. 大規模治験ネットワーク への登録方法... 6 6-1 登録の手順... 6 6-2
大規模治験ネットワーク 登録マニュアル Ver1.1 2013/4/1 公益社団法人日本医師会治験促進センター 0 内容 1. はじめに... 2 2. 大規模治験ネットワーク登録医療機関への支援内容... 2 3. 治験実施医療機関情報の登録と公開... 3 4. 登録の条件... 4 5. 事前確認... 5 6. 大規模治験ネットワーク への登録方法... 6 6-1 登録の手順... 6 6-2
Microsoft PowerPoint - 運用 [互換モード]
![Microsoft PowerPoint - 運用 [互換モード] Microsoft PowerPoint - 運用 [互換モード]](/thumbs/91/105850431.jpg) 押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
<4D F736F F D2092CA926D88C45F8A B9957B8CA B68EE58AC BC7816A92B788B6816A2E646F6378>
 写 平成 23 年 6 月 30 日医政研発 0630 第 1 号 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医政局研究開発振興課長 治験等の効率化に関する報告書について 治験 臨床研究の推進につきましては 平素から格別のご高配を賜り厚く御礼申し上げます 我が国における治験 臨床研究の推進に向けて平成 19 年 3 月に策定された 新たな治験活性化 5カ年計画 ( 平成 19 年 3 月 30
写 平成 23 年 6 月 30 日医政研発 0630 第 1 号 各都道府県衛生主管部 ( 局 ) 長殿 厚生労働省医政局研究開発振興課長 治験等の効率化に関する報告書について 治験 臨床研究の推進につきましては 平素から格別のご高配を賜り厚く御礼申し上げます 我が国における治験 臨床研究の推進に向けて平成 19 年 3 月に策定された 新たな治験活性化 5カ年計画 ( 平成 19 年 3 月 30
依頼者様
 2080530 治験実施に必要な手続き 治験依頼者様 船橋市立医療センターの治験管理室は 治験事務局 と 治験審査委員会事務局 を兼務しています 治験実施を依頼又は依頼を検討される際には 下記治験管理室へご連絡ください 治験管理室 273-8588 千葉県船橋市金杉 -2- TEL:047-438-332( 内線 :20) FAX:047-438-7223( 直通 ) e-mail:chiken@mmc.funabashi.chiba.jp
2080530 治験実施に必要な手続き 治験依頼者様 船橋市立医療センターの治験管理室は 治験事務局 と 治験審査委員会事務局 を兼務しています 治験実施を依頼又は依頼を検討される際には 下記治験管理室へご連絡ください 治験管理室 273-8588 千葉県船橋市金杉 -2- TEL:047-438-332( 内線 :20) FAX:047-438-7223( 直通 ) e-mail:chiken@mmc.funabashi.chiba.jp
<4D F736F F D208DEC8BC694C795F18D908F918DC58F4994C55F E646F63>
 治験等の効率化に関する報告書 平成 23 年 5 月 治験等適正化作業班 治験等適正化作業班 構成員名簿 ( 平成 23 年 3 月 31 日現在 ) 座長 伊藤澄信 独立行政法人国立病院機構本部総合研究センター臨床研究統括部部長 構成員 青木寛 日本製薬工業協会医薬品評価委員会臨床評価部会副部会長 青野寛之 欧州製薬団体連合会技術委員会副委員長臨床部会部会長 岡裕爾 株式会社日立製作所茨城病院センタセンタ長
治験等の効率化に関する報告書 平成 23 年 5 月 治験等適正化作業班 治験等適正化作業班 構成員名簿 ( 平成 23 年 3 月 31 日現在 ) 座長 伊藤澄信 独立行政法人国立病院機構本部総合研究センター臨床研究統括部部長 構成員 青木寛 日本製薬工業協会医薬品評価委員会臨床評価部会副部会長 青野寛之 欧州製薬団体連合会技術委員会副委員長臨床部会部会長 岡裕爾 株式会社日立製作所茨城病院センタセンタ長
<4D F736F F D208E9197BF332D CF897A689BB94C78A E646F63>
 資料 3-4 治験の効率化に向けた治験書式 手続き IT 化に関する現状調査班 報告書 概要版 調査班構成員 班長伊藤澄信 国立病院機構本部医療部研究課長 班員池田俊也 国際医療福祉大学薬学部 石川洋一 国立成育医療センター治験管理室主任 神谷晃 山口大学医学部附属病院薬剤部長 河村俊一 慶應義塾大学病院副薬剤部長 木内貴弘 東京大学医学部教授 (UMIN センター長 ) 木村通男 浜松医科大学附属病院医療情報部長
資料 3-4 治験の効率化に向けた治験書式 手続き IT 化に関する現状調査班 報告書 概要版 調査班構成員 班長伊藤澄信 国立病院機構本部医療部研究課長 班員池田俊也 国際医療福祉大学薬学部 石川洋一 国立成育医療センター治験管理室主任 神谷晃 山口大学医学部附属病院薬剤部長 河村俊一 慶應義塾大学病院副薬剤部長 木内貴弘 東京大学医学部教授 (UMIN センター長 ) 木村通男 浜松医科大学附属病院医療情報部長
ICH-GCPとJ-GCPとの比較表
 参考資料 10 我が国の GCP と ICH-GCP の主な 1 治験の契約に関する規定 1-1 契約者に関する規定 1-2 実施医療機関の長との契約を規定したことに伴う規定 2 治験審査委員会 (IRB) に関する規定 2-1 IRB の設置に関する規定 2-2 IRB への審議依頼に関する規定 1/11 1. 治験の契約に関する規定 1-1. 契約者に関する規定 ICH-GCP 1.17( 用語の定義
参考資料 10 我が国の GCP と ICH-GCP の主な 1 治験の契約に関する規定 1-1 契約者に関する規定 1-2 実施医療機関の長との契約を規定したことに伴う規定 2 治験審査委員会 (IRB) に関する規定 2-1 IRB の設置に関する規定 2-2 IRB への審議依頼に関する規定 1/11 1. 治験の契約に関する規定 1-1. 契約者に関する規定 ICH-GCP 1.17( 用語の定義
治験費用の支払い方法に関するモデル案 に対する質疑応答集 (Q&A) について別紙 2 *: 国公立 : 国公立大学病院 私大協 : 日本私立医科大学協会病院会 : 日本病院会 NHO: 国立病院機構 NC: 国立高度専門医療研究センター JPMA: 日本製薬工業協会 EFPIA: 欧州製薬団体連合
 治験費用の支払い方法に関するモデル案 に対する質疑応答集 (Q&A) について別紙 2 *: : 大学病院 : 日本私立医科大学協会病院会 : 日本病院会 : 国立病院機構 : 国立高度専門医療研究センター JPMA: 日本製薬工業協会 EFPIA: 欧州製薬団体連合会 PhRMA: 米国研究製薬工業協会 CRO: 日本 CRO 協会 SMO: 日本 SMO 協会 番号質疑内容団体名 * 1 今回の
治験費用の支払い方法に関するモデル案 に対する質疑応答集 (Q&A) について別紙 2 *: : 大学病院 : 日本私立医科大学協会病院会 : 日本病院会 : 国立病院機構 : 国立高度専門医療研究センター JPMA: 日本製薬工業協会 EFPIA: 欧州製薬団体連合会 PhRMA: 米国研究製薬工業協会 CRO: 日本 CRO 協会 SMO: 日本 SMO 協会 番号質疑内容団体名 * 1 今回の
IRB の 4 週間前までに事前確認に必要な資料をご提出ください 必要時にはヒアリングも実施いたします IRB 審議用確認資料 電子 ( メール ) にてご提出ください 製造販売後調査申請書 ( 様式 1) 1 部 審査用資料 1 薬品概要書 ( 添付文書でも可 ) 1 部 2 調査実施計画書 (
 国立大学法人信州大学医学部附属病院製造販売後調査実施に係わる手続き要領 2018 年 4 月 はじめにご確認ください 本要領の対象となる調査は 再審査 再評価のために GPSP で規定された日常診療下で実施される調査です 製薬会社が独自で行う調査 (= 観察研究 ) は対象外です 独自に実施する調査は 臨床研究として信州大学医学部医倫理委員会で審議となります 各種手続きについて担当医師又は信州大学医学部庶務係
国立大学法人信州大学医学部附属病院製造販売後調査実施に係わる手続き要領 2018 年 4 月 はじめにご確認ください 本要領の対象となる調査は 再審査 再評価のために GPSP で規定された日常診療下で実施される調査です 製薬会社が独自で行う調査 (= 観察研究 ) は対象外です 独自に実施する調査は 臨床研究として信州大学医学部医倫理委員会で審議となります 各種手続きについて担当医師又は信州大学医学部庶務係
<4D F736F F D A835E838A F8B7982D18AC48DB85F20534F A68CEB8E9A E9A8F4390B38DCF2
 自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
<4D F736F F F696E74202D2090BB91A294CC94848CE392B28DB CC905C90BF82C982C282A282C45F F566F6C2E33>
 この冊 における製造販売後調査等とは 使 成績調査 特定使 成績調査 副作 感染症報告 です 1/Mar/2016 Vol.3 1 ホームページのご案内 1 当院ホームページに手続き内容や 必要書類等を UP しています 2 依頼者のページ 3 製造販売後調査について 1 治験のお知らせ 2 ホームページのご案内 2 当院ホームページに手続き内容や 必要書類等を UP しています 申請の内容に応じて
この冊 における製造販売後調査等とは 使 成績調査 特定使 成績調査 副作 感染症報告 です 1/Mar/2016 Vol.3 1 ホームページのご案内 1 当院ホームページに手続き内容や 必要書類等を UP しています 2 依頼者のページ 3 製造販売後調査について 1 治験のお知らせ 2 ホームページのご案内 2 当院ホームページに手続き内容や 必要書類等を UP しています 申請の内容に応じて
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下
 北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
PowerPoint プレゼンテーション
 研究開発課題名難病 希少疾患の医薬品開発におけるクリニカルイノベーションネットワーク構想の推進を目指した疾患登録システム ( 患者レジストリ ) の構築 研究開発代表者 国立研究開発法人国立精神 神経医療研究センター 資料 2-3 トランスレーショナルメディカルセンター 臨床研究支援室長 発表内容 本研究の目標 実施体制 Remudy の実績と課題 目指すもの 疾患登録システム レジストリの信頼性について
研究開発課題名難病 希少疾患の医薬品開発におけるクリニカルイノベーションネットワーク構想の推進を目指した疾患登録システム ( 患者レジストリ ) の構築 研究開発代表者 国立研究開発法人国立精神 神経医療研究センター 資料 2-3 トランスレーショナルメディカルセンター 臨床研究支援室長 発表内容 本研究の目標 実施体制 Remudy の実績と課題 目指すもの 疾患登録システム レジストリの信頼性について
Ⅲ 治験に係る直接費用と間接費用 ( 但し 治験検討会議出席に係る旅費については 下記 Ⅳにて記載する ) 1. 算出方法 (1) 治験に係る経費設定( 表 1) に従い費用を算出する 2. 覚書の作成と請求方法 (1) 治験契約の際 病院長と治験依頼者は 治験契約書 ( 別記様式第 12 号第 3
 治験費用に関する手順書 ( 改訂第 5 版 ) Ⅰ 目的 本手順書は 当院で実施される治験費用の事務手続き方法を定めたものである Ⅱ 治験に係る経費の範囲 1. 治験に係る直接費用 間接費用 及び治験検討会議出席に係る指導料 ( 表 1) (1) 直接費用 1) 研究費 2) 治験検討会議出席に係る旅費 3) 治験審査委員会外部委員の講師指導 4) 治験に関し雇用したアルバイト賃金及び備品費 5)
治験費用に関する手順書 ( 改訂第 5 版 ) Ⅰ 目的 本手順書は 当院で実施される治験費用の事務手続き方法を定めたものである Ⅱ 治験に係る経費の範囲 1. 治験に係る直接費用 間接費用 及び治験検討会議出席に係る指導料 ( 表 1) (1) 直接費用 1) 研究費 2) 治験検討会議出席に係る旅費 3) 治験審査委員会外部委員の講師指導 4) 治験に関し雇用したアルバイト賃金及び備品費 5)
<4D F736F F D208CF897A689BB94C795F18D908F A2E646F63>
 への利用がまだ主体であり 製薬会社 CRO 内での使用に限られている 治験効率化の必要な部分は むしろ医療機関内における治験実施の部分の方が大きい 医療機関における治験 IT 化については 日本がイニシアチブをとれるように 日本の医療機関において 電子カルテの CDISC 標準仕様対応及び CDISC 標準仕様対応の治験情報システムを早急に開発 運用することが望まれる 今後 CDISC 標準仕様の策定
への利用がまだ主体であり 製薬会社 CRO 内での使用に限られている 治験効率化の必要な部分は むしろ医療機関内における治験実施の部分の方が大きい 医療機関における治験 IT 化については 日本がイニシアチブをとれるように 日本の医療機関において 電子カルテの CDISC 標準仕様対応及び CDISC 標準仕様対応の治験情報システムを早急に開発 運用することが望まれる 今後 CDISC 標準仕様の策定
治験事務局標準業務マニュアル
 治験申請等に関する手順書 Ⅰ) 新規治験の申請 1. 実施体制 治験事務局院内スタッフが SMO との提携し 事務局を運営する なお SMO の費用は院内費用とは別に算定するため 別途相談とする CRC 院内スタッフを用いる場合 SMO を利用する場合 どちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され 責任医師との合意が文書で得られた時点で予約は可能とする
治験申請等に関する手順書 Ⅰ) 新規治験の申請 1. 実施体制 治験事務局院内スタッフが SMO との提携し 事務局を運営する なお SMO の費用は院内費用とは別に算定するため 別途相談とする CRC 院内スタッフを用いる場合 SMO を利用する場合 どちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され 責任医師との合意が文書で得られた時点で予約は可能とする
国立病院機構大阪医療センター受託研究取扱細則
 国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
国立病院機構大阪医療センター 受託研究取扱細則 ( 主旨 ) 第 1 条国立病院機構大阪医療センターにおける受託研究の取扱いに関しては 国立病院機構大阪医療センター受託研究取扱規程 ( 以下 規程 という ) 及び他に定めるもののほか 規程第 1 条第 2 項に規定するこの細則の定めるところによる ( 総則 ) 第 2 条研究責任者は 原則として医長職相当以上とする ただし 副作用報告及び感染症報告を受託研究として実施する場合
<ヒアリング内容 > 1 依頼者からの説明 ( 概要書 プロトコールの要点 をそれぞれ10 分程度で ) ハンドアウト等の資料を準備すること 2 質疑 応答 ( 手順の確認を中心に ) 3 提出資料の確認 検討 修正指示 4その他 当該治験で検討を要する事項についての協議 保険外併用療養費の支給対象
 Ⅰ) 新規治験の申請 藤田医科大学病院治験申請等に関する手順書 1. 実施体制 治験事務局 SMO 費用は院内費用とは別に算定するため 別途相談とする 臨床研究コーディネーター (CRC) CRC は 院内または SMO のどちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され ( 治験届提出後 14 日 ( 初回届けの場合は 30 日 ) 経過したか否かは問わない
Ⅰ) 新規治験の申請 藤田医科大学病院治験申請等に関する手順書 1. 実施体制 治験事務局 SMO 費用は院内費用とは別に算定するため 別途相談とする 臨床研究コーディネーター (CRC) CRC は 院内または SMO のどちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され ( 治験届提出後 14 日 ( 初回届けの場合は 30 日 ) 経過したか否かは問わない
臨床試験(治験)の手続きについて
 臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
【押印あり】日本医学会宛
 別紙 再生医療等製品患者登録システムへの参加協力のお願い 患者登録システムの目的 患者登録システムは 再生医療等製品の市販後の使用状況や患者予後等のデータを収集し 迅速な安全対策や新たな製品開発等を通じて 医療の向上に役立てることを目的としています 患者登録システムは 製品毎に構築 運用されます この患者登録システムは 一般的には レジストリ と呼ばれることもあります 構築形態例 患者登録システムの対象
別紙 再生医療等製品患者登録システムへの参加協力のお願い 患者登録システムの目的 患者登録システムは 再生医療等製品の市販後の使用状況や患者予後等のデータを収集し 迅速な安全対策や新たな製品開発等を通じて 医療の向上に役立てることを目的としています 患者登録システムは 製品毎に構築 運用されます この患者登録システムは 一般的には レジストリ と呼ばれることもあります 構築形態例 患者登録システムの対象
< F2D8E9197BF A836F815B2E6A7464>
 ( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
院内 SOP 等の入手 (web*/ メール / 郵送 ) 施設 SOP の入手 IC 施設テンプレート 契約書式の確認 IRB の SOP 入手 要件確認 費用算定基準の確認 ( 研究費 負担軽減費 保険外併用療養費等 ) 依頼手続きスケジュール確認 モニタリングの実施方法 場所等確認 院内 /I
 資料 7-4 当該施設が候補施設として浮上 ( マーケット 論文等々 ) 依頼者 施設 対応者 備考 事前情報収集とアポイント取得 事前アンケート調査 (FAX/e-mail) アンケートへの協力依頼 (TEL) アンケート / 機密保持同意書の可否回答 アンケート用紙 / 機密保持同意書 / プロトコール概要などの郵送 対象疾患患者数 組入れ可能例数 依頼者からのアンケート用紙に基づく調査の実施
資料 7-4 当該施設が候補施設として浮上 ( マーケット 論文等々 ) 依頼者 施設 対応者 備考 事前情報収集とアポイント取得 事前アンケート調査 (FAX/e-mail) アンケートへの協力依頼 (TEL) アンケート / 機密保持同意書の可否回答 アンケート用紙 / 機密保持同意書 / プロトコール概要などの郵送 対象疾患患者数 組入れ可能例数 依頼者からのアンケート用紙に基づく調査の実施
治験は、医薬品として未だ認められていない物質を人(被験者)に投与して、有効性、安全性等を検討する臨床試験のことであり、新薬の承認申請資料の作成を目的としています
 このページでは 名古屋大学医学部附属病院において治験を実施する場合の手順を紹介しています ご不明な点がありましたら 臨床治験管理センターまでお問い合わせ下さい 治験責任医師の基本的な責務 治験責任医師は 治験に関連する医療上のすべての判断に責任を負う (GCP 第 45 条第 3 4 項 ) 治験責任医師は 治験依頼者と合意した治験実施計画書を遵守する (GCP 第 46 条第 1 項 ) 治験責任医師は
このページでは 名古屋大学医学部附属病院において治験を実施する場合の手順を紹介しています ご不明な点がありましたら 臨床治験管理センターまでお問い合わせ下さい 治験責任医師の基本的な責務 治験責任医師は 治験に関連する医療上のすべての判断に責任を負う (GCP 第 45 条第 3 4 項 ) 治験責任医師は 治験依頼者と合意した治験実施計画書を遵守する (GCP 第 46 条第 1 項 ) 治験責任医師は
PowerPoint プレゼンテーション
 治験の電子化 IRB 5 分間セミナー 第 1 回臨床研究の分類と治験 第 11 回 CRCの業務 ( その2) 第 2 回治験とGCPの動向 第 12 回治験中の臨床検査等の精度管理 第 3 回治験の計画 選定 合意 第 13 回 ALCOA 原則とは 第 4 回治験審査委員会の役割 第 14 回治験の電子化 第 5 回 CROとSMOの業務 第 15 回有害事象と副作用 第 6 回被験者の選定と同意取得
治験の電子化 IRB 5 分間セミナー 第 1 回臨床研究の分類と治験 第 11 回 CRCの業務 ( その2) 第 2 回治験とGCPの動向 第 12 回治験中の臨床検査等の精度管理 第 3 回治験の計画 選定 合意 第 13 回 ALCOA 原則とは 第 4 回治験審査委員会の役割 第 14 回治験の電子化 第 5 回 CROとSMOの業務 第 15 回有害事象と副作用 第 6 回被験者の選定と同意取得
治験手続きについて
 2 国立研究開発法人国立精神 神経医療研究センターにおける治験手続き要領 治験申込みは 治験審査依頼を希望する IRB の原則として 8 週間前が締切りです 当センター IRB は 毎月第 4 木曜に実施しています 新規申請の流れと必要な書類 1. 電話受付 新規申込み希望の場合は 治験主任 ( 内線 3783) へ電話連絡下さい その際に施設選定受入の日程 調整を行います 2. 施設選定受入 治験実施計画内容等の説明をお願いします
2 国立研究開発法人国立精神 神経医療研究センターにおける治験手続き要領 治験申込みは 治験審査依頼を希望する IRB の原則として 8 週間前が締切りです 当センター IRB は 毎月第 4 木曜に実施しています 新規申請の流れと必要な書類 1. 電話受付 新規申込み希望の場合は 治験主任 ( 内線 3783) へ電話連絡下さい その際に施設選定受入の日程 調整を行います 2. 施設選定受入 治験実施計画内容等の説明をお願いします
<4D F736F F D208EA18CB182C98AD682B782E995578F808BC696B18EE88F878F E38E748EE593B1816A E7B8D732E646F637
 治験に関する標準業務手順書 ( 医師主導治験 ) 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医師主導治験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 (
治験に関する標準業務手順書 ( 医師主導治験 ) 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医師主導治験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 (
医師主導治験実施医療機関を対象とした調査協力のお願い Ver 医師主導治験における治験調整事務局業務の標準化 効率化に関する研究 班へのご協力をいただき ありがとうございます 本研究班では 医師主導治験を実施する医療機関において 準備や実施に役立つ教育コンテンツやモデル標準業務手順
 医師主導治験実施医療機関を対象とした調査協力のお願い 医師主導治験における治験調整事務局業務の標準化 効率化に関する研究 班へのご協力をいただき ありがとうございます 本研究班では 医師主導治験を実施する医療機関において 準備や実施に役立つ教育コンテンツやモデル標準業務手順書 ロードマップなどを作成し 公開することを目指しています 本調査では 医師主導治験の現状やニーズに沿った成果物を提供するため
医師主導治験実施医療機関を対象とした調査協力のお願い 医師主導治験における治験調整事務局業務の標準化 効率化に関する研究 班へのご協力をいただき ありがとうございます 本研究班では 医師主導治験を実施する医療機関において 準備や実施に役立つ教育コンテンツやモデル標準業務手順書 ロードマップなどを作成し 公開することを目指しています 本調査では 医師主導治験の現状やニーズに沿った成果物を提供するため
標準業務手順 目次
 浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
ワークシート 原資料 電子カルテ EDC SDV 監査 質問 当院の状況 原資料 原資料のうち 電子情報として取り扱われているものを教えてください データの保管期間は治験終了から 15 年を満たしていますか? 診療録 ( 入院 外来 ) 臨床検査値 画像情報 (X 線 内視鏡等 ) 波形情報 ( 心
 ワークシート 原資料 電子カルテ EDC SDV 監査 質問 当院の状況 原資料 原資料のうち 電子情報として取り扱われているものを教えてください データの保管期間は治験終了から 15 年を満たしていますか? 診療録 ( 入院 外来 ) 臨床検査値 画像情報 (X 線 内視鏡等 ) 波形情報 ( 心電図 脳波等 ) 薬剤オーダー記録 その他 ( ) スキャン等により紙媒体を電子化している 原資料と治験関連記録の保存期間は決まっていますか?
ワークシート 原資料 電子カルテ EDC SDV 監査 質問 当院の状況 原資料 原資料のうち 電子情報として取り扱われているものを教えてください データの保管期間は治験終了から 15 年を満たしていますか? 診療録 ( 入院 外来 ) 臨床検査値 画像情報 (X 線 内視鏡等 ) 波形情報 ( 心電図 脳波等 ) 薬剤オーダー記録 その他 ( ) スキャン等により紙媒体を電子化している 原資料と治験関連記録の保存期間は決まっていますか?
製造販売後調査事務手続き等 について
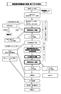 製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
申請等の手引き
 新規治験の手続きについて 治験に関する問い合わせ先臨床研究支援センター治験事務局 Tel:06-6692-1201 ( 内線 2024) 平日 9:00~17:00 新規治験を実施する場合は 医師へ問い合わせ前に必ず治験事務局へご連絡ください 本文中のはホームページ上の をご確認ください 手順書等は最新版をホームページに掲載しております 各自ダウンロードしてください
新規治験の手続きについて 治験に関する問い合わせ先臨床研究支援センター治験事務局 Tel:06-6692-1201 ( 内線 2024) 平日 9:00~17:00 新規治験を実施する場合は 医師へ問い合わせ前に必ず治験事務局へご連絡ください 本文中のはホームページ上の をご確認ください 手順書等は最新版をホームページに掲載しております 各自ダウンロードしてください
医師主導治験取扱要覧
 15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
規程書
 独立行政法人国立病院機構栃木医療センター 受託研究取扱規程 平成 25 年 4 月 1 日 独立行政法人国立病院機構栃木医療センター受託研究取 扱規程 ( 通則 ) 第 1 条独立行政法人国立病院機構栃木医療センター ( 以下 当院 という ) における国及びそれに準じる機関以外の者 ( 以下 依頼者 という ) から委託を受けて行う研究 ( 以下 受託研究 という ) の取扱いについては この規程定めるところによる
独立行政法人国立病院機構栃木医療センター 受託研究取扱規程 平成 25 年 4 月 1 日 独立行政法人国立病院機構栃木医療センター受託研究取 扱規程 ( 通則 ) 第 1 条独立行政法人国立病院機構栃木医療センター ( 以下 当院 という ) における国及びそれに準じる機関以外の者 ( 以下 依頼者 という ) から委託を受けて行う研究 ( 以下 受託研究 という ) の取扱いについては この規程定めるところによる
Ⅲ. 新規申請 1. 受付期間 : 毎月 31 日締め ( 事前に 申請日時 を下記申請窓口に必ずご連絡下さい ) 月末 (31 日 ) までに提出されたものが翌月の治験審査委員会で審査されます なお 3 月については原則として継続審査のみとなりますのでご了承ください 例 )7 月 1 日 ~7 月
 治験 製造販売後臨床試験 申請時提出書類等について I. 申請前に 1 原則として申請希望日の 2 週前までに事前ヒアリングを行いますので必ず予約を取って下さい (TEL)092-642-5924(ARO 次世代医療センター 治験事務局西田 ) 2 事前ヒアリング予約後 治験情報管理システム (Clinical Effort) の利用申込書 ( 九大書式 ) を 作成し FAX(092-642-5775)
治験 製造販売後臨床試験 申請時提出書類等について I. 申請前に 1 原則として申請希望日の 2 週前までに事前ヒアリングを行いますので必ず予約を取って下さい (TEL)092-642-5924(ARO 次世代医療センター 治験事務局西田 ) 2 事前ヒアリング予約後 治験情報管理システム (Clinical Effort) の利用申込書 ( 九大書式 ) を 作成し FAX(092-642-5775)
M. 旅行計画書 A. 1 申請の際には当院の標準業務手順書 契約書 ( 案 ) 覚書 ( 案 ) マニュアル等を熟読の上 目標症例数を責任医師と依頼者で十分協議 し 実施可能な症例数を申し込んでくだ 1 申請の際には当院の標準業務手順書 契約書 ( 案 ) マニュアル等を熟 読の上
 広島大学病院製造販売後医薬品調査マニュアル変更対比表 変更前 変更後 頁 項目等 Ver.6.20 2015 年 1 月 30 日 Ver.6.30 2017 年 2 月 27 日 (2015 年 2 月 1 日より適用 ) (2017 年 3 月 1 日より適用 ) 表紙 (ver.6.20) (ver.6.30) ver.6.30 2017 年 2 月 27 日 (2017 年 3 月 1 日より適用
広島大学病院製造販売後医薬品調査マニュアル変更対比表 変更前 変更後 頁 項目等 Ver.6.20 2015 年 1 月 30 日 Ver.6.30 2017 年 2 月 27 日 (2015 年 2 月 1 日より適用 ) (2017 年 3 月 1 日より適用 ) 表紙 (ver.6.20) (ver.6.30) ver.6.30 2017 年 2 月 27 日 (2017 年 3 月 1 日より適用
独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版
 独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版 第 1 章総則 1. 目的と適用範囲この標準業務手順書は 独立行政法人国立病院機構仙台医療センターにおける医薬品の再審査申請 再評価申請の際に提出すべき資料の収集のための 使用成績調査 及び 特定使用成績調査
独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版 第 1 章総則 1. 目的と適用範囲この標準業務手順書は 独立行政法人国立病院機構仙台医療センターにおける医薬品の再審査申請 再評価申請の際に提出すべき資料の収集のための 使用成績調査 及び 特定使用成績調査
1. 各項目に共通する注意点等について *IRB 審査資料の提出期限は IRB 開催日の 2 週間前までとします * 事前確認依頼については 資料提出期限の 1 週間前を目安に電子にて事務局担当者までご依頼ください スケジュールについては 当センター HP の IRB 年間開催日程と書類提出締切日
 西暦 2016 年 9 月 1 日 大阪市立大学医学部附属病院 医薬品 食品効能評価センター 治験事務局 新規契約締結以降の IRB 等の対応について 1. 各項目に共通する注意事項 2. 安全性情報 ( 委員会審査 ) 3.1 変更申請 ( 委員会審査 ) 2 変更申請 ( 軽微な変更委員会審査及び迅速審査 ) 3 変更契約書 各種覚書の締結について 4. 継続審査 ( 委員会審査 ) 5. 症例数確定後の手続きについて
西暦 2016 年 9 月 1 日 大阪市立大学医学部附属病院 医薬品 食品効能評価センター 治験事務局 新規契約締結以降の IRB 等の対応について 1. 各項目に共通する注意事項 2. 安全性情報 ( 委員会審査 ) 3.1 変更申請 ( 委員会審査 ) 2 変更申請 ( 軽微な変更委員会審査及び迅速審査 ) 3 変更契約書 各種覚書の締結について 4. 継続審査 ( 委員会審査 ) 5. 症例数確定後の手続きについて
国立仙台病院受託研究取扱規程
 独立行政法人国立病院機構仙台医療センター受託研究取扱規程 ( 通則 ) 第 1 条独立行政法人国立病院機構仙台医療センター ( 以下 当院 という ) における国及びそれに準じる機関以外の者 ( 以下 依頼者 という ) から委託を受けて行う研究 ( 以下 受託研究 という ) の取扱いについては この規程の定めるところによる 2 契約 経理及び書式等については 原則として独立行政法人国立病院機構
独立行政法人国立病院機構仙台医療センター受託研究取扱規程 ( 通則 ) 第 1 条独立行政法人国立病院機構仙台医療センター ( 以下 当院 という ) における国及びそれに準じる機関以外の者 ( 以下 依頼者 という ) から委託を受けて行う研究 ( 以下 受託研究 という ) の取扱いについては この規程の定めるところによる 2 契約 経理及び書式等については 原則として独立行政法人国立病院機構
2 IRB 審査書類の作成 1. 必要部数 : 20 部 (1) 保管 事務処理用ア病院長保管用 1 部イ IRB 審査依頼用 1 部 (2)IRB 審査用ア委員配布用 10 部イ治験責任医師用 1 部ウ治験管理室員用 7 部 2. 提出書類内訳 ( 事務局担当者との摺り合わせが必要 ) (1) 試
 治験の手続きについて 治験実施までの手続き 1 治験相談 施設調査 1. 治験管理室来室依頼表を提出 治験管理室来室依頼票 にご記入の上 こちら (aokenchu_chiken@med.pref.aomori.jp) までお送りください 後日担当より 面談可能日をご回答差し上げます (1) 施設調査 でご来室の場合治験事務局が対応します 当院の治験実施体制をホームページ上に公開しておりますので ご来室までにご確認いただき
治験の手続きについて 治験実施までの手続き 1 治験相談 施設調査 1. 治験管理室来室依頼表を提出 治験管理室来室依頼票 にご記入の上 こちら (aokenchu_chiken@med.pref.aomori.jp) までお送りください 後日担当より 面談可能日をご回答差し上げます (1) 施設調査 でご来室の場合治験事務局が対応します 当院の治験実施体制をホームページ上に公開しておりますので ご来室までにご確認いただき
受託研究費算定要領(180731改正)
 受託研究費算定要領 別紙 2 1. 医薬品 医療機器の臨床試験 ( 製造販売後臨床試験を含む ) に係る経費 算出基準 (1) 主たる治験 1 事前準備費用 : 治験事務局等の経費等 研究を開始するまでに必要な費用 契約期間が 2 年未満の場合 45 万円 2 年以上 5 年未満の場合 50 万円 5 年以上または未定の場合 55 万円 ( 消費税額及び地方消費税額 ( 以下 消費税額等 という )
受託研究費算定要領 別紙 2 1. 医薬品 医療機器の臨床試験 ( 製造販売後臨床試験を含む ) に係る経費 算出基準 (1) 主たる治験 1 事前準備費用 : 治験事務局等の経費等 研究を開始するまでに必要な費用 契約期間が 2 年未満の場合 45 万円 2 年以上 5 年未満の場合 50 万円 5 年以上または未定の場合 55 万円 ( 消費税額及び地方消費税額 ( 以下 消費税額等 という )
費 複写費 現像 焼付費 通信費 ( 切手 電話等 ) 運搬費 研究実施場所借り上げ費 ( 研究機関の施設において補助事業の遂行が困難な場合に限る ) 会議費 ( 会場借料 食事 ( アルコール類を除く ) 費用等 ) リース レンタル費用 ( コンピュータ 自動車 実験機器 器具等 ) 機器修理費
 別紙 7 平成 29 年度科学研究費助成事業における交付条件等の主な変更点について 1. 科学研究費助成事業- 科研費 -( 基盤研究 (B) 若手研究(A))( 平成 24 年度から平成 26 年度に採択された研究課題 ) 研究者使用ルール ( 交付条件 ) の主な変更点平成 28 年度平成 29 年度 1 総則 1 総則 2 直接経費の使用 2 直接経費の使用 直接経費の各費目の対象となる経費
別紙 7 平成 29 年度科学研究費助成事業における交付条件等の主な変更点について 1. 科学研究費助成事業- 科研費 -( 基盤研究 (B) 若手研究(A))( 平成 24 年度から平成 26 年度に採択された研究課題 ) 研究者使用ルール ( 交付条件 ) の主な変更点平成 28 年度平成 29 年度 1 総則 1 総則 2 直接経費の使用 2 直接経費の使用 直接経費の各費目の対象となる経費
eRequest - Frequently Asked Questions
 2018 年度 UCBJ 研究支援申請方法 1. 趣旨 ユーシービージャパン株式会社 ( 以下 UCBJ ) は 革新的な医薬品を開発し 患者の皆様の治療に貢献するとともに 医学 薬学領域の学術研究活動を支援いたします UCBJ は 2017 年から研究支援の公募を開始いたしました 患者の皆様にとって有益な治療につながる革新的で独創性のある研究に対して 研究支援金 ( 以下 支援金 ) の拠出をもって支援いたします
2018 年度 UCBJ 研究支援申請方法 1. 趣旨 ユーシービージャパン株式会社 ( 以下 UCBJ ) は 革新的な医薬品を開発し 患者の皆様の治療に貢献するとともに 医学 薬学領域の学術研究活動を支援いたします UCBJ は 2017 年から研究支援の公募を開始いたしました 患者の皆様にとって有益な治療につながる革新的で独創性のある研究に対して 研究支援金 ( 以下 支援金 ) の拠出をもって支援いたします
JCROA自主ガイドライン第4版案 GCP監査WG改訂案及び意見
 受託業務の適正な実施に関する日本 CRO 協会の自主ガイドライン ( 第 4 版 ) 目 次 1. 本ガイドライン制定の背景 2. 目的 3. 関連法規の遵守 4. 受託業務の範囲 5. 受託の検討 6. 受託業務の品質管理及び品質保証 7. 健康被害補償と損害賠償 8. 教育 9. モニタリング 10. 情報セキュリティ 11. 本会員の重大事態への対応 1/5 1. 本ガイドライン制定の背景日本
受託業務の適正な実施に関する日本 CRO 協会の自主ガイドライン ( 第 4 版 ) 目 次 1. 本ガイドライン制定の背景 2. 目的 3. 関連法規の遵守 4. 受託業務の範囲 5. 受託の検討 6. 受託業務の品質管理及び品質保証 7. 健康被害補償と損害賠償 8. 教育 9. モニタリング 10. 情報セキュリティ 11. 本会員の重大事態への対応 1/5 1. 本ガイドライン制定の背景日本
静岡県立静岡がんセンター臨床研究事務局の業務手順書
 治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
CROCO について
 CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
SGEC 附属文書 理事会 統合 CoC 管理事業体の要件 目次序文 1 適用範囲 2 定義 3 統合 CoC 管理事業体組織の適格基準 4 統合 CoC 管理事業体で実施される SGEC 文書 4 CoC 認証ガイドライン の要求事項に関わる責任の適用範囲 序文
 SGEC 附属文書 2-8 2012 理事会 2016.1.1 統合 CoC 管理事業体の要件 目次序文 1 適用範囲 2 定義 3 統合 CoC 管理事業体組織の適格基準 4 統合 CoC 管理事業体で実施される SGEC 文書 4 CoC 認証ガイドライン の要求事項に関わる責任の適用範囲 序文この文書の目的は 生産拠点のネットワークをする組織によるCoC 認証を実施のための指針を設定し このことにより
SGEC 附属文書 2-8 2012 理事会 2016.1.1 統合 CoC 管理事業体の要件 目次序文 1 適用範囲 2 定義 3 統合 CoC 管理事業体組織の適格基準 4 統合 CoC 管理事業体で実施される SGEC 文書 4 CoC 認証ガイドライン の要求事項に関わる責任の適用範囲 序文この文書の目的は 生産拠点のネットワークをする組織によるCoC 認証を実施のための指針を設定し このことにより
<4D F736F F F696E74202D EF8B638E9197BF82CC B A6D92E894C5816A E >
 資料 3-1 無駄の撲滅の取組について ー行政事業レビューについてー 平成 25 年 2 月 27 日 これまでの行政事業レビューについて 1 行政事業レビューとは 毎年 各府省が自ら全ての事業の点検 見直しを行うもの ( 閣議決定が実施根拠 ) 1 前年度の事業を対象に 概算要求前に 執行状況 ( 支出先や使途 ) 等の事後点検を実施 2 5,000 を超える全事業についてレビューシートを作成し
資料 3-1 無駄の撲滅の取組について ー行政事業レビューについてー 平成 25 年 2 月 27 日 これまでの行政事業レビューについて 1 行政事業レビューとは 毎年 各府省が自ら全ての事業の点検 見直しを行うもの ( 閣議決定が実施根拠 ) 1 前年度の事業を対象に 概算要求前に 執行状況 ( 支出先や使途 ) 等の事後点検を実施 2 5,000 を超える全事業についてレビューシートを作成し
本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員
 ( 第 1 版 :2015 年 7 月 1 日 ) 本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員会の間での電子的記録の作成, 交付, 受領及び保存に用いるシステム規定や文書等で責任者の行うべき業務の権限を与えられ,
( 第 1 版 :2015 年 7 月 1 日 ) 本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員会の間での電子的記録の作成, 交付, 受領及び保存に用いるシステム規定や文書等で責任者の行うべき業務の権限を与えられ,
4.7.4 プロセスのインプットおよびアウトプット (1) プロセスへのインプット情報 インプット情報 作成者 承認者 備 考 1 開発に関するお客様から お客様 - の提示資料 2 開発に関する当社収集資 リーダ - 料 3 プロジェクト計画 完了報 リーダ マネージャ 告書 ( 暫定計画 ) 4
 サンプル : プロジェクト管理規定 4.7 プロジェクト立ち上げ 4.7.1 目的 本プロセスはリーダ主導で プロジェクト体制の確立とプロジェクト内容 分担 業務指示 プロジェクト目標 担当者別プロジェクト目標を開発メンバに周知徹底することによって 組織としての意識統一を図るとともに開発プロセスをスムーズに立ち上げることを目的とする 4.7.2 このプロセスにかかわる人物の役割と責務 部門 略記 参加
サンプル : プロジェクト管理規定 4.7 プロジェクト立ち上げ 4.7.1 目的 本プロセスはリーダ主導で プロジェクト体制の確立とプロジェクト内容 分担 業務指示 プロジェクト目標 担当者別プロジェクト目標を開発メンバに周知徹底することによって 組織としての意識統一を図るとともに開発プロセスをスムーズに立ち上げることを目的とする 4.7.2 このプロセスにかかわる人物の役割と責務 部門 略記 参加
臨床試験(治験)実施の手続き
 製造販売後調査実施の手続き はじめに 本書は 昭和大学藤が丘病院における製造販売後調査実施の手続き方法等について記載したものです 本書内のは当院が提供する書類を示し は審査等に必要な書類を示しております 調査内容により提出書類 資料に変更が生じる場合があります 詳細は支援室にご確認ください 申請する書類および資料は 事前に E-mail に添付して支援室にお送りください 内容の確認をし ご連絡させて頂きます
製造販売後調査実施の手続き はじめに 本書は 昭和大学藤が丘病院における製造販売後調査実施の手続き方法等について記載したものです 本書内のは当院が提供する書類を示し は審査等に必要な書類を示しております 調査内容により提出書類 資料に変更が生じる場合があります 詳細は支援室にご確認ください 申請する書類および資料は 事前に E-mail に添付して支援室にお送りください 内容の確認をし ご連絡させて頂きます
(Ver
 治験手続き要領 担当者連絡先 治験事務局 治験審査委員会事務局 : TEL (092) 801-1011 ( 内線 2796 2797) 企業治験 医師主導治験 臨床研究支援センター浦塚正伸, 室長山口賢二 E mail : rinshou@adm.fukuoka-u.ac.jp 臨床研究支援センター室長山口賢二 E mail : rinshou@adm.fukuoka-u.ac.jp 保険外併用療養費支給対象外費用の請求臨床研究支援センター堂園伸代
治験手続き要領 担当者連絡先 治験事務局 治験審査委員会事務局 : TEL (092) 801-1011 ( 内線 2796 2797) 企業治験 医師主導治験 臨床研究支援センター浦塚正伸, 室長山口賢二 E mail : rinshou@adm.fukuoka-u.ac.jp 臨床研究支援センター室長山口賢二 E mail : rinshou@adm.fukuoka-u.ac.jp 保険外併用療養費支給対象外費用の請求臨床研究支援センター堂園伸代
な技術がある この技術は 臨床研究 治験活性化 5 か年計画 2012 でも提案されており 当協会でも本技術を利用した治験関連書式の授受について 信頼性確保と効率化の両面で検討していく 3. 規制上 押印は必須ではなく 押印以外の方法で当該書類の信頼性を担保することにより 実質上は問題ないことを実施
 2012 年 5 月 22 日 各位殿 日本製薬工業協会医薬品評価委員会 臨床評価部会長中島唯善 電子化情報部会長庄本幸司 平素は臨床評価部会ならびに電子化情報部会の運営に関しご高配いただき誠にありがとうございます さて 平成 24 年 3 月 7 日に研究開発振興課長 審査管理課長の二課長通知により 新たな 治験の依頼等に係る統一書式 について ( 以下 統一書式通知 ) が発出され 治験依頼者と実施医療機関の協議により押印が省略できるとともに
2012 年 5 月 22 日 各位殿 日本製薬工業協会医薬品評価委員会 臨床評価部会長中島唯善 電子化情報部会長庄本幸司 平素は臨床評価部会ならびに電子化情報部会の運営に関しご高配いただき誠にありがとうございます さて 平成 24 年 3 月 7 日に研究開発振興課長 審査管理課長の二課長通知により 新たな 治験の依頼等に係る統一書式 について ( 以下 統一書式通知 ) が発出され 治験依頼者と実施医療機関の協議により押印が省略できるとともに
<4D F736F F D208EA18CB182C98AD682B782E995578F808BC696B18EE88F878F E7B8D732E646F6378>
 治験に関する標準業務手順書 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医薬品及び医療機器の臨床試験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和
治験に関する標準業務手順書 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医薬品及び医療機器の臨床試験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和
研究者を支援するために 必要な人材 CRC データマネージャー 国際化 生物統計家 プロジェクトマネージャー 開発戦略と知財戦略の担当者 高度化 煩雑化 多様化 利益相反マネージャー IRB/EC 事務局担当者 教育 / 研修担当者 薬事担当者 新薬開発の多様化 国際化の時代 ICH-GCP に則っ
 治験推進地域連絡会議 福岡会場 専門 CRC LDM による チーム支援体制を目指して 独立行政法人 国立精神 神経医療研究センター玉浦明美 研究者を支援するために 必要な人材 CRC データマネージャー 国際化 生物統計家 プロジェクトマネージャー 開発戦略と知財戦略の担当者 高度化 煩雑化 多様化 利益相反マネージャー IRB/EC 事務局担当者 教育 / 研修担当者 薬事担当者 新薬開発の多様化
治験推進地域連絡会議 福岡会場 専門 CRC LDM による チーム支援体制を目指して 独立行政法人 国立精神 神経医療研究センター玉浦明美 研究者を支援するために 必要な人材 CRC データマネージャー 国際化 生物統計家 プロジェクトマネージャー 開発戦略と知財戦略の担当者 高度化 煩雑化 多様化 利益相反マネージャー IRB/EC 事務局担当者 教育 / 研修担当者 薬事担当者 新薬開発の多様化
川崎市水道局規程第 号
 川崎市立川崎病院治験取扱要綱 ( 要旨 ) 第 1 条川崎市立川崎病院 ( 川崎市病院事業の設置等に関する条例 ( 昭和 41 年川崎市条例第 42 号 ) 第 2 条第 2 項の表に規定する病院 以下 病院 という ) の医薬品等の臨床研究の実施については 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 以下 法 という ) 医薬品の臨床試験の実施の基準に関する省令
川崎市立川崎病院治験取扱要綱 ( 要旨 ) 第 1 条川崎市立川崎病院 ( 川崎市病院事業の設置等に関する条例 ( 昭和 41 年川崎市条例第 42 号 ) 第 2 条第 2 項の表に規定する病院 以下 病院 という ) の医薬品等の臨床研究の実施については 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 以下 法 という ) 医薬品の臨床試験の実施の基準に関する省令
臨床研究に関する標準業務手順書
 臨床研究に関する標準業務手順書 2018/04/01 第 15 版 改定履歴 日付 版 改定理由 改定箇所 内容 2010/02/06 1 新規制定 2010/04/14 2 COI 関連手順の明確化 フローチャートに COI に関する手順の追記 2010/08/19 3 様式 必要書類の追加 COI 関連様式の追記 安全性に関する報告の手順および様式 ( 様式 11) の追加 委託研究に関する手順
臨床研究に関する標準業務手順書 2018/04/01 第 15 版 改定履歴 日付 版 改定理由 改定箇所 内容 2010/02/06 1 新規制定 2010/04/14 2 COI 関連手順の明確化 フローチャートに COI に関する手順の追記 2010/08/19 3 様式 必要書類の追加 COI 関連様式の追記 安全性に関する報告の手順および様式 ( 様式 11) の追加 委託研究に関する手順
総合行政ネットワーク-9.indd
 今回は eltax( エルタックス ) の概要や国税連携等における LGWAN 利用などについて説明します 1 eltax( エルタックス ) 1 とは 地方税ポータルシステムの呼称で 地方税における手続きを ネットワークを利用して電子的に行うシステムで 全地方公共団体を会員とする社団法人地方税電子化協議会が運営しています これまで地方税の申告 申請 納税など ( 以下 電子申告サービス という )
今回は eltax( エルタックス ) の概要や国税連携等における LGWAN 利用などについて説明します 1 eltax( エルタックス ) 1 とは 地方税ポータルシステムの呼称で 地方税における手続きを ネットワークを利用して電子的に行うシステムで 全地方公共団体を会員とする社団法人地方税電子化協議会が運営しています これまで地方税の申告 申請 納税など ( 以下 電子申告サービス という )
表 3 厚生労働省新旧ガイドライン目次比較 は新ガイドラインで追加された項目 コンピュータ使用医薬品等製造所適正管理ガイドライン 第 1 目的 1. 総則 1.1 目的 第 2 適用の範囲 2. 適用の範囲 第 3 開発業務 1. 開発検討段階 (1) 開発段階の責任体制の確立 (2) 開発マニュア
 表 3 厚生労働省新旧ガイドライン目次比較 は新ガイドラインで追加された項目 コンピュータ使用医薬品等製造所適正管理ガイドライン 第 1 目的 1. 総則 1.1 目的 第 2 適用の範囲 2. 適用の範囲 第 3 開発業務 1. 開発検討段階 (1) 開発段階の責任体制の確立 (2) 開発マニュアルの作成 (3) 開発計画書の作成 2. システム設計段階 (1) システム設計書の作成 (2) システム設計書の確認
表 3 厚生労働省新旧ガイドライン目次比較 は新ガイドラインで追加された項目 コンピュータ使用医薬品等製造所適正管理ガイドライン 第 1 目的 1. 総則 1.1 目的 第 2 適用の範囲 2. 適用の範囲 第 3 開発業務 1. 開発検討段階 (1) 開発段階の責任体制の確立 (2) 開発マニュアルの作成 (3) 開発計画書の作成 2. システム設計段階 (1) システム設計書の作成 (2) システム設計書の確認
岩手医科大学医学部及び附属病院における人を対象とする医学系研究に係るモニタリング及び監査の実施に関する標準業務手順書 岩手医科大学医学部及び附属病院における 人を対象とする医学系研究に係る モニタリング及び監査の実施に関する標準業務手順書 岩手医科大学 第 1.0 版平成 29 年 10 月 1 日
 岩手医科大学医学部及び附属病院における 人を対象とする医学系研究に係る モニタリング及び監査の実施に関する標準業務手順書 岩手医科大学 第 1.0 版平成 29 年 10 月 1 日施行 目次 1. 目的...1 2. 研究機関の長の責務...1 3. 研究責任者の責務...1 4. モニタリング担当者の責務...1 5. 監査担当者の責務...2 6. 多施設共同研究におけるモニタリング及び監査の実施について...2
岩手医科大学医学部及び附属病院における 人を対象とする医学系研究に係る モニタリング及び監査の実施に関する標準業務手順書 岩手医科大学 第 1.0 版平成 29 年 10 月 1 日施行 目次 1. 目的...1 2. 研究機関の長の責務...1 3. 研究責任者の責務...1 4. モニタリング担当者の責務...1 5. 監査担当者の責務...2 6. 多施設共同研究におけるモニタリング及び監査の実施について...2
臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美
 臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美 本日の Agenda 1. 臨床評価とは 2. 医療機器の特性を踏まえた有効性 安全性評価 3. 各国の規制の違い 4. 臨床評価報告書について 5. 臨床評価報告書の概念 6. 臨床研究と治験の違いは? 7. 文献評価の問題点 8. 治験活性化にむけて 臨床評価 とは そのものの有効性と安全性をヒトで評価すること 自己認証の欧州から出てきた概念
臨床評価とは何か ( 独 ) 医薬品医療機器総合機構医療機器審査第一部方眞美 本日の Agenda 1. 臨床評価とは 2. 医療機器の特性を踏まえた有効性 安全性評価 3. 各国の規制の違い 4. 臨床評価報告書について 5. 臨床評価報告書の概念 6. 臨床研究と治験の違いは? 7. 文献評価の問題点 8. 治験活性化にむけて 臨床評価 とは そのものの有効性と安全性をヒトで評価すること 自己認証の欧州から出てきた概念
仮訳 原文 P2 補遺 E6 (R2) コード 履歴 日付 E6(R2) R1 文書に対する補遺以下の各項に対する追加 : 序文,1.63,1.64, 1.65,2.10,2.13,4.2.5,4.2.6,4.9.0,5.0, 5.0.1,5.0.2,5.0.3,5.0.4,5.0.5,5.0.6,
 仮訳 原文 P2 E6 (R2) コード 履歴 日付 E6(R2) R1 文書に対する以下の各項に対する追加 : 序文,1.63,1.64, 1.65,2.10,2.13,4.2.5,4.2.6,4.9.0,5.0, 5.0.1,5.0.2,5.0.3,5.0.4,5.0.5,5.0.6,5.0.7, 5.2.2,5.5.3(a),5.5.3 (b),5.5.3 (h),5.18.3, 5.18.6
仮訳 原文 P2 E6 (R2) コード 履歴 日付 E6(R2) R1 文書に対する以下の各項に対する追加 : 序文,1.63,1.64, 1.65,2.10,2.13,4.2.5,4.2.6,4.9.0,5.0, 5.0.1,5.0.2,5.0.3,5.0.4,5.0.5,5.0.6,5.0.7, 5.2.2,5.5.3(a),5.5.3 (b),5.5.3 (h),5.18.3, 5.18.6
治験実施規程
 京都市立病院 治験実施要綱 平成 25 年 9 月 2 日 ( 第 7 版 ) 目次 第 Ⅰ 章総則 1 第 1 条 ( 目的 ) 1 第 2 条 ( 治験に関する原則事項 ) 1 第 3 条 ( 用語 ) 2 第 4 条 ( 秘密の保全 ) 2 第 5 条 ( 直接閲覧 ) 2 第 Ⅱ 章院長 2 第 6 条 ( 治験実施体制の構築 ) 2 第 7 条 ( 治験の受託 ) 3 第 8 条 ( 治験の継続
京都市立病院 治験実施要綱 平成 25 年 9 月 2 日 ( 第 7 版 ) 目次 第 Ⅰ 章総則 1 第 1 条 ( 目的 ) 1 第 2 条 ( 治験に関する原則事項 ) 1 第 3 条 ( 用語 ) 2 第 4 条 ( 秘密の保全 ) 2 第 5 条 ( 直接閲覧 ) 2 第 Ⅱ 章院長 2 第 6 条 ( 治験実施体制の構築 ) 2 第 7 条 ( 治験の受託 ) 3 第 8 条 ( 治験の継続
1-澤田-インクル.indd
 第 Ⅰ 章研究の概要 研究の概要 1. 研究の全体構想インクルーシブ教育システムを構築し それを推進していくには まずは 教員をはじめとして それに関わる人たちがインクルーシブ教育システムについて理解し それぞれに必要とされる専門性を確実に高めていくことが大切である そして 組織及び地域としても専門性を担保していく仕組みを整備することが必要である インクルーシブ教育システムに関する教職員の資質 能力としては
第 Ⅰ 章研究の概要 研究の概要 1. 研究の全体構想インクルーシブ教育システムを構築し それを推進していくには まずは 教員をはじめとして それに関わる人たちがインクルーシブ教育システムについて理解し それぞれに必要とされる専門性を確実に高めていくことが大切である そして 組織及び地域としても専門性を担保していく仕組みを整備することが必要である インクルーシブ教育システムに関する教職員の資質 能力としては
ISO19011の概要について
 3 技術資料 3-1 ISO19011 の概要について 従来の環境マネジメントシステムの監査の指針であった ISO14010 ISO14011 ISO1401 2 が改正 統合され 2002 年 10 月に ISO19011 として発行されました この指針は 単に審査登録機関における審査の原則であるばかりでなく 環境マネジメントシステムの第二者監査 ( 取引先等利害関係対象の審査 ) や内部監査に適用できる有効な指針です
3 技術資料 3-1 ISO19011 の概要について 従来の環境マネジメントシステムの監査の指針であった ISO14010 ISO14011 ISO1401 2 が改正 統合され 2002 年 10 月に ISO19011 として発行されました この指針は 単に審査登録機関における審査の原則であるばかりでなく 環境マネジメントシステムの第二者監査 ( 取引先等利害関係対象の審査 ) や内部監査に適用できる有効な指針です
第三者による品質証明制度について 参考資料 Ministry of Land, Infrastructure, Transport and Tourism
 第三者による品質証明制度について 参考資料 Ministry of Land, Infrastructure, Transport and Tourism 第三者による品質証明制度について 制度の概要本制度は 今後の品質確保の方向として 従来 発注者による監督 検査業務や施工者による品質管理として段階的に実施してきた施工管理に代えて 工事実施状況など現場におけ工事実施状況など現場における施工プロセスを臨場により確認することにより
第三者による品質証明制度について 参考資料 Ministry of Land, Infrastructure, Transport and Tourism 第三者による品質証明制度について 制度の概要本制度は 今後の品質確保の方向として 従来 発注者による監督 検査業務や施工者による品質管理として段階的に実施してきた施工管理に代えて 工事実施状況など現場におけ工事実施状況など現場における施工プロセスを臨場により確認することにより
スライド 1
 資料 7-3 治験の効率化を目指した医療機関と依頼者の共有プロセス - 施設選定から Site initiation- 欧州製薬団体連合会技術委員会臨床部会 青野寛之, 越智由貴子 ( アストラゼネカ株式会社 ), 原輝文, 西山逸夫 ( グラクソ スミスクライン株式会社 ), 廣瀬隆 ( サノフィ アベンティス株式会社 ), 山地宏和 ( 日本ベーリンガーインゲルハイム株式会社 ), 桜井丙午 (
資料 7-3 治験の効率化を目指した医療機関と依頼者の共有プロセス - 施設選定から Site initiation- 欧州製薬団体連合会技術委員会臨床部会 青野寛之, 越智由貴子 ( アストラゼネカ株式会社 ), 原輝文, 西山逸夫 ( グラクソ スミスクライン株式会社 ), 廣瀬隆 ( サノフィ アベンティス株式会社 ), 山地宏和 ( 日本ベーリンガーインゲルハイム株式会社 ), 桜井丙午 (
する 研究実施施設の環境 ( プライバシーの保護状態 ) について記載する < 実施方法 > どのような手順で研究を実施するのかを具体的に記載する アンケート等を用いる場合は 事前にそれらに要する時間を測定し 調査による患者への負担の度合いがわかるように記載する 調査手順で担当が複数名いる場合には
 参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
目次 1. 目的と適用範囲 定義 原則 使用機器 審査資料交付システム タブレット端末 管理運用体制 電磁的記録管理運用責任者の役割 電磁的記録管理運用担当者の役割
 特定非営利活動法人臨床研究の倫理を考える会 治験審査委員会 倫理審査委員会における電磁的記録の 活用に係る標準業務手順書 版数 : 初版承認日 : 2014 年 4 月 18 日承認者 : 理事長橋爪敬三 この手順書は 2014 年 4 月 21 日から施行する 目次 1. 目的と適用範囲... 1 2. 定義... 1 3. 原則... 1 4. 使用機器... 2 4.1 審査資料交付システム...
特定非営利活動法人臨床研究の倫理を考える会 治験審査委員会 倫理審査委員会における電磁的記録の 活用に係る標準業務手順書 版数 : 初版承認日 : 2014 年 4 月 18 日承認者 : 理事長橋爪敬三 この手順書は 2014 年 4 月 21 日から施行する 目次 1. 目的と適用範囲... 1 2. 定義... 1 3. 原則... 1 4. 使用機器... 2 4.1 審査資料交付システム...
弊社の紹介 創業 :2002 年 社員数 :110 名 (2014 年 10 月現在 ) 業務内容 : CRC 業務 ( 治験 臨床研究 医師主導治験 その他調査 ) 治験事務局 IRB 事務局運営支援業務 医師主導治験調整事務局支援業務 医療機関体制整備支援業務 GCP 教育 CRC 教育 CRA
 カット ドゥ スクエア (CtDoS2) の 事例紹介 ~ 治験依頼者 - 実施医療機関 -IRB の三者間で CtDoS2 を活用してみて ~ 株式会社新日本科学臨床薬理研究所九州エリア支援部鹿児島支援室サイトマネジメントチーム黒木沙織 1 弊社の紹介 創業 :2002 年 社員数 :110 名 (2014 年 10 月現在 ) 業務内容 : CRC 業務 ( 治験 臨床研究 医師主導治験 その他調査
カット ドゥ スクエア (CtDoS2) の 事例紹介 ~ 治験依頼者 - 実施医療機関 -IRB の三者間で CtDoS2 を活用してみて ~ 株式会社新日本科学臨床薬理研究所九州エリア支援部鹿児島支援室サイトマネジメントチーム黒木沙織 1 弊社の紹介 創業 :2002 年 社員数 :110 名 (2014 年 10 月現在 ) 業務内容 : CRC 業務 ( 治験 臨床研究 医師主導治験 その他調査
<4D F736F F F696E74202D DC58F4994C5816A82732B825195D78BAD89EF95F18D908F9182CC8A E >
 株式決済期間短縮 (T+2) に関する勉強会 報告書の概要 平成 27 年 3 月 17 日株式決済期間短縮 (T+2) に関する勉強会 Japan Securities Dealers Association.All Rights Reserved. # Ⅰ. 勉強会の設置の趣旨及び参加者 1. 設置の趣旨 我が国では 平成 21 年 1 月に株券等の電子化が実施される等 株式等の決済処理に係る
株式決済期間短縮 (T+2) に関する勉強会 報告書の概要 平成 27 年 3 月 17 日株式決済期間短縮 (T+2) に関する勉強会 Japan Securities Dealers Association.All Rights Reserved. # Ⅰ. 勉強会の設置の趣旨及び参加者 1. 設置の趣旨 我が国では 平成 21 年 1 月に株券等の電子化が実施される等 株式等の決済処理に係る
RBMへの取り組みの実際
 日本ベーリンガーインゲルハイム株式会社志岐甲介 被験者の安全性及び データの品質向上 各国規制当局が 推奨する手法 Why? IT 技術の活用 : 早期に 問題や傾向分析が可能 製薬業界の標準手法 となる動向 2 TransCelerate(TCBI): 新薬をいち早く患者さんに届けることを目的に 臨床開発におけるイノベーション促進 新薬開発メーカーの共通する課題解決 そして臨床試験に参加される患者さんの安全性のさらなる向上に重点を置いて活動する非営利団体
日本ベーリンガーインゲルハイム株式会社志岐甲介 被験者の安全性及び データの品質向上 各国規制当局が 推奨する手法 Why? IT 技術の活用 : 早期に 問題や傾向分析が可能 製薬業界の標準手法 となる動向 2 TransCelerate(TCBI): 新薬をいち早く患者さんに届けることを目的に 臨床開発におけるイノベーション促進 新薬開発メーカーの共通する課題解決 そして臨床試験に参加される患者さんの安全性のさらなる向上に重点を置いて活動する非営利団体
02 IT 導入のメリットと手順 第 1 章で見てきたように IT 技術は進展していますが ノウハウのある人材の不足やコスト負担など IT 導入に向けたハードルは依然として高く IT 導入はなかなか進んでいないようです 2016 年版中小企業白書では IT 投資の効果を分析していますので 第 2 章
 IT 導入のメリットと手順 第 1 章で見てきたように IT 技術は進展していますが ノウハウのある人材の不足やコスト負担など IT 導入に向けたハードルは依然として高く IT 導入はなかなか進んでいないようです 2016 年版中小企業白書では IT 投資の効果を分析していますので 第 2 章では そのデータを参考にIT 導入のメリットについてご紹介するとともに 生産性向上の観点からIT 導入の方向性を示した上で
IT 導入のメリットと手順 第 1 章で見てきたように IT 技術は進展していますが ノウハウのある人材の不足やコスト負担など IT 導入に向けたハードルは依然として高く IT 導入はなかなか進んでいないようです 2016 年版中小企業白書では IT 投資の効果を分析していますので 第 2 章では そのデータを参考にIT 導入のメリットについてご紹介するとともに 生産性向上の観点からIT 導入の方向性を示した上で
Microsoft Word - 入札公告(官報)
 入札公告 次のとおり一般競争入札に付します 平成 2 9 年 2 月 2 7 日経理責任者独立行政法人国立病院機構佐賀病院院長島正義 調達機関番号 5 9 7 所在地番号 4 1 第 1 3 3 0 1 号 ( N o. 1 3 3 0 1 ) 1 調達内容 ( 1 ) 品目分類番号 4, 3 2, 3 4 ( 2 ) 購入等件名及び数量 S P D 業務委託一式 ( 3 ) 調達案件の仕様等入札説明書及び仕様書による
入札公告 次のとおり一般競争入札に付します 平成 2 9 年 2 月 2 7 日経理責任者独立行政法人国立病院機構佐賀病院院長島正義 調達機関番号 5 9 7 所在地番号 4 1 第 1 3 3 0 1 号 ( N o. 1 3 3 0 1 ) 1 調達内容 ( 1 ) 品目分類番号 4, 3 2, 3 4 ( 2 ) 購入等件名及び数量 S P D 業務委託一式 ( 3 ) 調達案件の仕様等入札説明書及び仕様書による
評価(案)「財務省行政情報化LANシステムの運用管理業務」
 資料 4-2 平成 28 年 3 月 9 日 内閣府公共サービス改革推進室 民間競争入札実施事業 財務省行政情報化 LAN システムの運用管理業務の評価 ( 案 ) 競争の導入による公共サービスの改革に関する法律 ( 平成 18 年法律第 51 号 ) 第 7 条第 8 項の規定に基づく標記事業の評価は以下のとおりである Ⅰ 事業の概要等 1 実施の経緯及び事業の概要財務省が実施する 財務省行政情報化
資料 4-2 平成 28 年 3 月 9 日 内閣府公共サービス改革推進室 民間競争入札実施事業 財務省行政情報化 LAN システムの運用管理業務の評価 ( 案 ) 競争の導入による公共サービスの改革に関する法律 ( 平成 18 年法律第 51 号 ) 第 7 条第 8 項の規定に基づく標記事業の評価は以下のとおりである Ⅰ 事業の概要等 1 実施の経緯及び事業の概要財務省が実施する 財務省行政情報化
Microsoft PowerPoint JRF-WS2.pptx
 プライバシー保護とモバイルコンピューティングのングの観点からハードディスク暗号化への期待 2010/11/4 インテル株式会社 竹井淳 Networked Readiness Index Source: http://www.weforum.org/pdf/gitr10/gitr%202009-2010_full%20report%20final.pdf Page 5 NRI と国際競争力 NRI:
プライバシー保護とモバイルコンピューティングのングの観点からハードディスク暗号化への期待 2010/11/4 インテル株式会社 竹井淳 Networked Readiness Index Source: http://www.weforum.org/pdf/gitr10/gitr%202009-2010_full%20report%20final.pdf Page 5 NRI と国際競争力 NRI:
12_モニタリングの実施に関する手順書
 12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
受付番号 Panasonic NPO/NGO サポートファンド for SDGs [ 国内助成 ] 2019 年募集 新規助成応募企画書 ( 様式 1) パナソニック株式会社御中 応募要項に記載の 個人情報の取り扱い に同意の上 応募します 応募日 :2019 年月日 (1) 応募団体
![受付番号 Panasonic NPO/NGO サポートファンド for SDGs [ 国内助成 ] 2019 年募集 新規助成応募企画書 ( 様式 1) パナソニック株式会社御中 応募要項に記載の 個人情報の取り扱い に同意の上 応募します 応募日 :2019 年月日 (1) 応募団体 受付番号 Panasonic NPO/NGO サポートファンド for SDGs [ 国内助成 ] 2019 年募集 新規助成応募企画書 ( 様式 1) パナソニック株式会社御中 応募要項に記載の 個人情報の取り扱い に同意の上 応募します 応募日 :2019 年月日 (1) 応募団体](/thumbs/103/157483155.jpg) 受付番号 19 1 1 Panasonic NPO/NGO サポートファンド for SDGs [ 国内助成 ] 2019 年募集 新規助成応募企画書 ( 様式 1) パナソニック株式会社御中 応募要項に記載の 個人情報の取り扱い に同意の上 応募します 応募日 :2019 年月日 (1) 応募団体に関する情報 団体名 公印 代表者役職 氏名 住所 ( 宛名 ) 電話 E-mail (2) 連絡責任者に関する情報氏名所属
受付番号 19 1 1 Panasonic NPO/NGO サポートファンド for SDGs [ 国内助成 ] 2019 年募集 新規助成応募企画書 ( 様式 1) パナソニック株式会社御中 応募要項に記載の 個人情報の取り扱い に同意の上 応募します 応募日 :2019 年月日 (1) 応募団体に関する情報 団体名 公印 代表者役職 氏名 住所 ( 宛名 ) 電話 E-mail (2) 連絡責任者に関する情報氏名所属
 別冊 平成 30 年度 科学研究費助成事業 募集要領 特別研究員奨励費 特別研究員 ( 応募書類の様式 入力要領 ) 平成 30 年 1 月 独立行政法人日本学術振興会 (http://www.jsps.go.jp/) 1 平成 30 年度科学研究費助成事業 ( 特別研究員奨励費 )( 特別研究員 ) 研究計画調書 (Web 入力項目 ) 画面イメージ ----------------------------------------------------
別冊 平成 30 年度 科学研究費助成事業 募集要領 特別研究員奨励費 特別研究員 ( 応募書類の様式 入力要領 ) 平成 30 年 1 月 独立行政法人日本学術振興会 (http://www.jsps.go.jp/) 1 平成 30 年度科学研究費助成事業 ( 特別研究員奨励費 )( 特別研究員 ) 研究計画調書 (Web 入力項目 ) 画面イメージ ----------------------------------------------------
1
 1 2 < 調査実施項目 > Ⅰ 院内がん登録の組織体制 Ⅱ 院内がん登録の実施体制 Ⅲがん登録の方法 Ⅳ 集計 解析 報告書 Ⅴ 院内がん登録システムのソフト Ⅵ 院内がん登録の研修教育 3 1. 院内がん登録の組織 (1) 院内がん登録委員会について (2) 院内がん登録委員会の定期開催 施設数 16 14 3 施設数 16 14 12 12 2 10 なし 10 していない 8 8 6 13
1 2 < 調査実施項目 > Ⅰ 院内がん登録の組織体制 Ⅱ 院内がん登録の実施体制 Ⅲがん登録の方法 Ⅳ 集計 解析 報告書 Ⅴ 院内がん登録システムのソフト Ⅵ 院内がん登録の研修教育 3 1. 院内がん登録の組織 (1) 院内がん登録委員会について (2) 院内がん登録委員会の定期開催 施設数 16 14 3 施設数 16 14 12 12 2 10 なし 10 していない 8 8 6 13
検討課題の整理 1 第 1 回合同会議での意見及びその後委員から提出された意見を 第 1 回合同会議の 検討の進め方 ( 下記参照 ) に沿って分類 第 1 回合同会議資料 合同会議における検討の進め方 の抜粋 合同会議においては 以下の順で検討を進める (1) ゲノム指針と医学系指針との条文の整合
 第 1 回医学研究等に係る倫理指針の見直しに関する合同会議 TF 平成 30 年 10 月 29 日 参考資料 1 合同会議における委員コメント ( 追記版 ) 検討課題の整理 1 第 1 回合同会議での意見及びその後委員から提出された意見を 第 1 回合同会議の 検討の進め方 ( 下記参照 ) に沿って分類 第 1 回合同会議資料 合同会議における検討の進め方 の抜粋 合同会議においては 以下の順で検討を進める
第 1 回医学研究等に係る倫理指針の見直しに関する合同会議 TF 平成 30 年 10 月 29 日 参考資料 1 合同会議における委員コメント ( 追記版 ) 検討課題の整理 1 第 1 回合同会議での意見及びその後委員から提出された意見を 第 1 回合同会議の 検討の進め方 ( 下記参照 ) に沿って分類 第 1 回合同会議資料 合同会議における検討の進め方 の抜粋 合同会議においては 以下の順で検討を進める
<4D F736F F F696E74202D E48FE A92C789C192CA926D82C982C282A282C45F696E6F75652E >
 E2B(R3) 追加通知について 日本製薬団体連合会 E2B(R3) 実装プロジェクト井上学 1 本日のお話 追加通知の概要 これから検討すべきこと 2 追加通知 ( 公開 ) 予定の概要 2013 年 9 月 17 日の通知で 追って通知 とされた部分 ICH E2Bでの検討結果に伴う変更 技術的な部分の補足 Q&A 3 R2 と R3 の比較 R2 R3 報告様式 SGML XML(HL7 形式
E2B(R3) 追加通知について 日本製薬団体連合会 E2B(R3) 実装プロジェクト井上学 1 本日のお話 追加通知の概要 これから検討すべきこと 2 追加通知 ( 公開 ) 予定の概要 2013 年 9 月 17 日の通知で 追って通知 とされた部分 ICH E2Bでの検討結果に伴う変更 技術的な部分の補足 Q&A 3 R2 と R3 の比較 R2 R3 報告様式 SGML XML(HL7 形式
2. 各検討課題に関する論点 (1) 費用対効果評価の活用方法 費用対効果評価の活用方法について これまでの保険給付の考え方等の観点も含め どう考 えるか (2) 対象品目の選定基準 1 費用対効果評価の対象とする品目の範囲 選択基準 医療保険財政への影響度等の観点から 対象となる品目の要件をどう設
 中医協費薬材 - 3 3 0. 1 2. 5 費用対効果評価に関する検討状況について ( 報告 ) 1. 概要 費用対効果評価については これまで以下の課題につき 中医協において協議及び論点の整 理を行ってきたところ 今後 関係業界からのヒアリングを行い とりまとめを行う予定 (1) 費用対効果評価の活用方法 (2) 対象品目の選択基準 1 費用対効果評価の対象とする品目の範囲 選択基準 3 品目選定のタイミング
中医協費薬材 - 3 3 0. 1 2. 5 費用対効果評価に関する検討状況について ( 報告 ) 1. 概要 費用対効果評価については これまで以下の課題につき 中医協において協議及び論点の整 理を行ってきたところ 今後 関係業界からのヒアリングを行い とりまとめを行う予定 (1) 費用対効果評価の活用方法 (2) 対象品目の選択基準 1 費用対効果評価の対象とする品目の範囲 選択基準 3 品目選定のタイミング
内部統制ガイドラインについて 資料
 内部統制ガイドラインについて 資料 内部統制ガイドライン ( 案 ) のフレーム (Ⅲ)( 再掲 ) Ⅲ 内部統制体制の整備 1 全庁的な体制の整備 2 内部統制の PDCA サイクル 内部統制推進部局 各部局 方針の策定 公表 主要リスクを基に団体における取組の方針を設定 全庁的な体制や作業のよりどころとなる決まりを決定し 文書化 議会や住民等に対する説明責任として公表 統制環境 全庁的な体制の整備
内部統制ガイドラインについて 資料 内部統制ガイドライン ( 案 ) のフレーム (Ⅲ)( 再掲 ) Ⅲ 内部統制体制の整備 1 全庁的な体制の整備 2 内部統制の PDCA サイクル 内部統制推進部局 各部局 方針の策定 公表 主要リスクを基に団体における取組の方針を設定 全庁的な体制や作業のよりどころとなる決まりを決定し 文書化 議会や住民等に対する説明責任として公表 統制環境 全庁的な体制の整備
治験関連文書を電磁的記録として扱う際に確認すべきチェックリスト ( 第 1 版 ) 番号 必須 授受 保存 確認内容チェック項目メモ欄 ( 協議事項を記載する ) 備考 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機
 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 主な確認資料及びその版数 / 制定日 1. 久留米大学臨床試験審査委員会における電磁的記録の活用に関するマニュアル
1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 主な確認資料及びその版数 / 制定日 1. 久留米大学臨床試験審査委員会における電磁的記録の活用に関するマニュアル
目次 1. はじめに サービス概要 決済手段概要 契約体系 エンドユーザー向け購入手順 エンドユーザー向けサービス利用条件 エンドユーザー向け決済時認証方法..
 [B502] サービス仕様書 ( 永久不滅ポイント決済 ) 2017/01/31 版 ソフトバンク ペイメント サービス株式会社 目次 1. はじめに... - 3-2. サービス概要... - 5-2.1. 決済手段概要... - 5-2.2. 契約体系... - 6-2.3. エンドユーザー向け購入手順... - 7-2.4. エンドユーザー向けサービス利用条件... - 8-2.5. エンドユーザー向け決済時認証方法...
[B502] サービス仕様書 ( 永久不滅ポイント決済 ) 2017/01/31 版 ソフトバンク ペイメント サービス株式会社 目次 1. はじめに... - 3-2. サービス概要... - 5-2.1. 決済手段概要... - 5-2.2. 契約体系... - 6-2.3. エンドユーザー向け購入手順... - 7-2.4. エンドユーザー向けサービス利用条件... - 8-2.5. エンドユーザー向け決済時認証方法...
長崎大学病院治験審査委員会内規 平成 21 年 4 月 1 日 病院内規第 3 号 ( 趣旨 ) 第 1 条この内規は, 長崎大学病院における医薬品の臨床試験の実施に関する内規 ( 以下 治験内規 という ) 第 4 条第 2 項, 長崎大学病院における医療機器の臨床試験の実施に関する内規 ( 以下
 長崎大学病院治験審査委員会内規 平成 21 年 4 月 1 日 病院内規第 3 号 ( 趣旨 ) 第 1 条この内規は, 長崎大学病院における医薬品の臨床試験の実施に関する内規 ( 以下 治験内規 という ) 第 4 条第 2 項, 長崎大学病院における医療機器の臨床試験の実施に関する内規 ( 以下 医療機器治験内規 という ) 第 4 条第 2 項及び長崎大学病院における再生医療等製品の臨床試験の実施に関する内規
長崎大学病院治験審査委員会内規 平成 21 年 4 月 1 日 病院内規第 3 号 ( 趣旨 ) 第 1 条この内規は, 長崎大学病院における医薬品の臨床試験の実施に関する内規 ( 以下 治験内規 という ) 第 4 条第 2 項, 長崎大学病院における医療機器の臨床試験の実施に関する内規 ( 以下 医療機器治験内規 という ) 第 4 条第 2 項及び長崎大学病院における再生医療等製品の臨床試験の実施に関する内規
特定臨床研究に関する手順書
 学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
目次 第 1 章治験審査委員会... 3 ( 目的と適用範囲 )... 3 ( 治験審査委員会の責務 )... 3 ( 治験審査委員会の設置及び構成 )... 3 ( 治験審査委員会の業務 )... 4 ( 治験審査委員会の運営 )... 6 第 2 章治験審査委員会事務局... 8 ( 治験審査委
 治験審査委員会標準業務手順書 < 医師主導治験 > 横浜労災病院 目次 第 1 章治験審査委員会... 3 ( 目的と適用範囲 )... 3 ( 治験審査委員会の責務 )... 3 ( 治験審査委員会の設置及び構成 )... 3 ( 治験審査委員会の業務 )... 4 ( 治験審査委員会の運営 )... 6 第 2 章治験審査委員会事務局... 8 ( 治験審査委員会事務局の設置と業務 )... 8
治験審査委員会標準業務手順書 < 医師主導治験 > 横浜労災病院 目次 第 1 章治験審査委員会... 3 ( 目的と適用範囲 )... 3 ( 治験審査委員会の責務 )... 3 ( 治験審査委員会の設置及び構成 )... 3 ( 治験審査委員会の業務 )... 4 ( 治験審査委員会の運営 )... 6 第 2 章治験審査委員会事務局... 8 ( 治験審査委員会事務局の設置と業務 )... 8
Microsoft Word _アンケート集計書HP版 .docx
 平成 20 年度医療情報システムに関する調査 ( 財 ) 医療情報システム開発センターでは ( 財 )JKA( 旧 日本自転車振興会 ) から補助金を受けて標記の調査を実施いたしました その調査結果概要を公表いたします [ 調査の概要 ] (1) 調査の目的病院におけるIT 化の状況及びシステム導入後の効果等について実態を調査する (2) 調査方法調査票による郵送アンケート (3) 調査内容主な調査項目
平成 20 年度医療情報システムに関する調査 ( 財 ) 医療情報システム開発センターでは ( 財 )JKA( 旧 日本自転車振興会 ) から補助金を受けて標記の調査を実施いたしました その調査結果概要を公表いたします [ 調査の概要 ] (1) 調査の目的病院におけるIT 化の状況及びシステム導入後の効果等について実態を調査する (2) 調査方法調査票による郵送アンケート (3) 調査内容主な調査項目
本事業の意義 実効性 ( 見直しの必要性 ) 医療情報データベース基盤整備事業 ( 平成 23 年度 ~ 10 協力医療機関 ) 日本再興戦略 ( 平成 25 年 6 月 14 日 ) 医療 介護情報の電子化の促進 医薬品の副作用データベースシステムについて データ収集の拠点となる病院の拡充や地域連
 資料 3 検討について ( 案 ) 1 本事業の意義 実効性 ( 見直しの必要性 ) 医療情報データベース基盤整備事業 ( 平成 23 年度 ~ 10 協力医療機関 ) 日本再興戦略 ( 平成 25 年 6 月 14 日 ) 医療 介護情報の電子化の促進 医薬品の副作用データベースシステムについて データ収集の拠点となる病院の拡充や地域連携の推進を図ることにより 利活用できる十分な情報を確保し 医薬品の有効性
資料 3 検討について ( 案 ) 1 本事業の意義 実効性 ( 見直しの必要性 ) 医療情報データベース基盤整備事業 ( 平成 23 年度 ~ 10 協力医療機関 ) 日本再興戦略 ( 平成 25 年 6 月 14 日 ) 医療 介護情報の電子化の促進 医薬品の副作用データベースシステムについて データ収集の拠点となる病院の拡充や地域連携の推進を図ることにより 利活用できる十分な情報を確保し 医薬品の有効性
前項に規定する事項のうち当該被験薬の治験薬概要書から予測できないもの に改め 同項を同条第三項とし 同条第一項の次に次の一項を加える 2治験依頼者は 被験薬について法第八十条の二第六項に規定する事項を知ったときは その発現症例一覧等を当該被験薬ごとに 当該被験薬について初めて治験の計画を届け出た日等
 厚生労働省令第二十四号薬事法(昭和三十五年法律第百四十五号)第十四条第三項(同条第九項及び同法第十九条の二第五項において準用する場合を含む ) 第十四条の四第四項及び第十四条の六第四項(これらの規定を同法第十九条の四において準用する場合を含む ) 第八十条の二第一項 第四項及び第五項並びに第八十二条の規定に基づき 医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令を次のように定める 平成二十年二月二十九日厚生労働大臣舛添要一医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令医薬品の臨床試験の実施の基準に関する省令(平成九年厚生省令第二十八号)の一部を次のように改正する
厚生労働省令第二十四号薬事法(昭和三十五年法律第百四十五号)第十四条第三項(同条第九項及び同法第十九条の二第五項において準用する場合を含む ) 第十四条の四第四項及び第十四条の六第四項(これらの規定を同法第十九条の四において準用する場合を含む ) 第八十条の二第一項 第四項及び第五項並びに第八十二条の規定に基づき 医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令を次のように定める 平成二十年二月二十九日厚生労働大臣舛添要一医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令医薬品の臨床試験の実施の基準に関する省令(平成九年厚生省令第二十八号)の一部を次のように改正する

