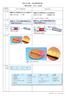
化学基礎 20 1 年 ( ) 組 ( ) 番 ( ) 周期表と元素の性質 ( 教科書 p51) 1.< 典型元素と遷移元素 > H He 2 Li Be B C N O F Ne 3 Na Mg Al S
|
|
|
- かずひろ はにうだ
- 7 years ago
- Views:
Transcription
1 化学基礎 20 1 年 ( ) 組 ( ) 番 ( ) 周期表と元素の性質 ( 教科書 p51) 1.< 典型元素と遷移元素 > H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Mo Tc Ru Rn Pd Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Rf Db Sg Bh Hs Mt Ds Rg Cn Fl Lv (17 族 : ハロゲンン ) (2 族 : アルカリ土類金属 ) 1 (18 族 : 希ガス ) (1 族 : アルカリ金属 ) 私の好きな元素 : : ランタノイド原子番号 性質が似ている : アクチノイド原子番号 人工元素の多いグループ その理由 : 教科書 p51 を参考に 金属元素と非金属元素を色分けしなさい 1 族 2 族 17 族 18 族を色分けし ( ) に特別な名称を書きなさい 3~11 族は 遷移元素 ( その他は 典型元素 ) である 遷移元素を色線で分けなさい
2 化学基礎 21 1 年 ( ) 組 ( ) 番 ( ) D. 元素の周期表 (p50 51) 周期律と周期表 1.< 周期律 > (1) 元素を 1 原子番号 の順に並べると 2 価電子 の数が周期的に変化するため化学的性質のよく似た元素が周期的に現れる このような規則性を元素の 3 周期律 という 2.< 周期表 > 前後見返し参照 (1)1869 年 ロシアの 4 メンデレーエフ ( 1834~1907) が発表した すべ ての元素を周期律に従って配列した表を 5 周期表 という (2) 当時は 63 種類の元素しか知られていなかったが メンデレーエフは周期表の空欄に 当てはまる元素を 6 予言 した ( 例 ) エカケイ素 予言から 16 年後 7 32 番ゲルマニウム が発見された 3.< 周期と族 >( 教科書 p50) (1) 周期表の縦の列を 1 族 横の行を 2 周期 という 族 3 1 ~ 18 族 周期 第 4 1 ~ 7 周期 (2) 同じ族に属する元素を 5 同族元素 といい 互いに性質がよく似ている ア.1 族元素 (H を除く ) を 6 アルカリ金属 という 例 :Li( リチウム ) Na( ナトリウム ) K( カリウム ) など a. 価電子は 6 1 個で 7 1 価の陽 イオンになりやすい b. 水と激しく反応して 8 水素 を発生する c. 水溶液は強い 9 アルカリ 性を示す イ.2 族元素 (Be Mg 除く ) は 10 アルカリ土類金属 という 例 :Ca( カルシウム ) Sr( ストロンチウム ) Ba( バリウム ) など a. 価電子は 11 2 個で 12 2 価の陰 イオンになりやすい b. 水と反応して 13 水素 を発生する ウ.17 族元素は 14 ハロゲン という 例 :F( フッ素 ) Cl( 塩素 ) Br( 臭素 ) I( ヨウ素 ) など a. 価電子は 15 1 個で 16 1 価の陰 イオンになりやすい エ.18 族元素は 17 希ガス という a. 価電子は 18 0 で 化合物をつくり 19 にくい
3 化学基礎 22 1 年 ( ) 組 ( ) 番 ( ) 1.< 典型元素と遷移元素 > (1) 周期表の 1,2 族と 族の元素を 1 典型元素 という ア. 2 金属元素 と 3 非金属元素 がある イ. 価電子の数が 族番号の一の位と一致する (18 族除く ) 同族元素では 4 化学的性質 がよく似ている (2) 周期表の 3 11 族の元素を 5 遷移元素 という ア. 遷移元素はすべて 6 金属元素 である イ. 価電子の数は 7 1 または 8 2 のものが多い ウ. 9 同周期 の元素どうし( 隣どうし ) の性質がよく似ている 2.< 金属元素と非金属元素 > (1) 単体が 10 金属光沢 をもち 11 電気 や 12 熱 をよく導く 元素を 13 金属元素 という ア. 金属元素は 14 陽 イオンになりやすい (2) 金属でない元素を 16 非金属元素 という ア. 非金属元素はすべて 17 典型元素 で 水素を除き周期表の 18 右上 側を占めている 問題 次の(1)~(3) の元素を ( ア )~( ク ) で示しなさい (1) アルカリ金属 イ (5) 典型元素 ア イ ウ オ カ キ ク (2) アルカリ土類金属 ウ (6) 遷移元素 エ (3) ハロゲン キ (7) 金属元素 イ ウ エ オ (4) 希ガス ク (8) 非金属元素 ア カ キ ク
4 化学基礎 23 1 年 ( ) 組 ( ) 番 ( ) 第 2 章化学結合 A. イ才ン結合 (p.54 ) イオン結合による物質の性質 1.< イオン結合 > (1) 陽イオンと陰イオンが 1 静電気力 ( クーロン力 ) によって互いに引き合 って結びつく化学結合を 2 イオン結合 という 2.< 組成式 > (1) 物質を構成する原子 ( または原子団 ) をもっとも簡単な整数比で示した式を 3 組成式 という (2) イオン結合でできた物質は 4 陽 イオンによる正の電荷と 5 陰 イオンによる負の電荷の 6 合計 が 0 になるように ( 電気的に中性 ) できて いる 練習 1 (1)Na + とCl - からできる物質 Na Cl- 2 NaCl (2)Mg 2 + とCl - からできる物質 Mg Cl 4 MgCl2 (3)A1 3+ とCl - からできる物質 Al Cl 6 AlCl3 練習 2 次のイオンの組み合わせによってできる組成式と名称を書きなさい Cl - OH - SO 4 2- 塩化物イオン 水酸化物イオン 硫酸イオン Na + 7 NaCl 8 NaOH 9 Na2SO4 ナトリウムイオン 塩化ナトリウム 水酸化ナトリウム 硫酸ナトリウム Ca CaCl2 11Ca(OH)2 12 CaSO4 カルシウムイオン 塩化カルシウム 水酸化カルシウム 硫酸カルシウム Al AlCl3 14Al(OH)3 15Al2(SO4) アルミニウムイオン 塩化アルミニウム 水酸化アルミニウム 3 硫酸アルミニウム
5 化学基礎 24 1 年 ( ) 組 ( ) 番 ( ) 3.< イオン結合でできた物質の性質 > (1) 融点 沸点が 16 高い ものが多く 常温 常圧では固体である (2) 固体は電気を 17 通さない が 水溶液にすると電気をよく 18 通す 4.< イオン結合でできた物質の例 > 食卓塩 組成式 19 NaCl 名称 20 塩化ナトリウム 除湿剤や凍結防止剤 組成式 21 CaCl2 名称 22塩化カルシウム 写真感光剤 沈殿 組成式 23 AgCl 名称 24塩化銀 卵の殻や貝殻 チョ一クなど組成式 25 CaCO3 名称 26炭酸カルシウム 5.< イオン結晶 > (1) イオン結合でできた物質の結晶を 27イオン結晶 という たた (2) イオン結晶は イオン結合の結合力が大きいので一般に 28硬い が 強く叩 へきかいくと特定の面にそって 29割れる ( 劈開 という )
6 化学基礎 25 1 年 ( ) 組 ( ) 番 ( ) B. 共有結合 (p57 67) 1.< 分子の存在 > (1)2 個以上の原子が結合したものを 1 分子 という ( 例 ) 水素分子 水素原子が 2 2 個結合 水分子 水素原子 3 2 個と酸素原子 4 1 個が結合 2.< 分子式 > (1) 分子を構成する原子の種類を元素記号で示し 原子の個数を元素記号の右下に書き添えて表した式を 5 分子式 という ( 例 ) 水素分子 : 6 H2 酸素分子: 7 O2 窒素分子 : 8 N2 水分子 : 9 H2O 二酸化炭素分子 : 10 CO2 3.< 共有結合と分子 > (1) 分子を作る際 原子間で出し合った価電子を共有して結合する場合 その結合を 13 共有結合 という (2) 希ガス以外の 14 非金属 元素の原子どうしの結合 水素分子の場合 (1) 水素分子 H 2 では 2 個の水素原子が互いに 1 個の 15 価電子 を出し合い これを共有して結合を形成している (2) 水素分子中の水素原子は ともに 16 ヘリウム 原子 He と同じ安定な電子配置となる (3) 共有結合を形成している原子は価電子を共有することによって 17 希ガス 原子と同じ安定な電子配置になる 図 9 水素分子のでき方
7 化学基礎 26 1 年 ( ) 組 ( ) 番 ( ) 水分子の場合 (1) 水分子 H 2 Oでは 2 個の 1 水素 原子 H はそれぞれ 2 1 個 の電子を 3 酸素 原子 Oは 4 2 個の電子を共有している (2) 酸素原子の価電子 6 個中の 5 4 個は結合に直接関与しない (3) 水分子中での 2 個の水素原子はともに 6 ヘリウム 原子 H e と同じ安定な 電子配置を また 酸素原子は 7 ネオン 原子 Ne と同じ安定な電子配置に なっている 図 10 水分子のでき方 4.< 電子式 >( 教科書 p58) (1) 元素記号の周囲に価電子を黒点で表した式を 1 電子式 という 電子式で 原子を表した際 共有結合に使われる電子の数が分かりやすくなる (2) 元素記号の 2 上下左右 に価電子を書いていく 価電子の数が 3 5 個以上のとき 2 個で 1 組の 4 電子対 ができる (3) 電子対を作らず 単独で存在する価電子を 5 不対電子対 という (4) 原子どうしが不対電子を出し合い 新しく生じた電子対を 6 共有電子対 という これが共有結合である (5) 共有結合でできた分子内の価電子のうち 共有結合に関係しない電子対を 7 非共有電子対 という
8 化学基礎 27 1 年 ( ) 組 ( ) 番 ( ) 電子式の作り方 (1) 水素分子 (2) 水分子 5.< 構造式と原子価 >( 教科書 p59) (1) 各原子が共有結合に使う価電子 ( 不対電子 ) だけを 1 本の線で表した化学式を 1 構造式 という ( 例 ) 水素 H 2 塩化水素 HCl 塩素 Cl 2 H-H H-Cl Cl-Cl (2) 構造式で表す線を 2 価標 という (3) 各原子から出る価標の数 ( 手の数 ) は 各原子が共有結合に使う価電子の数に等しく その数を原子の 3 原子価 という 原子価 = 手の数 (4) 各原子の手を結ぶことによって共有結合ができ 新しい物質ができる 6.< 二重結合と三重結合 > (1) 共有電子対が 1 対で 原子間の価標が 1 本のものを 4 単結合 という ( 例 ) H 2 : 5 H-H Cl 2 : 6 Cl-Cl H 2 O: 7 H-0-H (2) 共有電子対が 2 対で 原子間の価標が 2 本のものを 8 二重結合 という ( 例 )O 2 : 9 O=O CO 2 : 10 O=C=O (3) 共有電子対が 3 対で 原子間の価標が 3 本のものを 11 三重結合 という ( 例 )N 2 : 12 N N
9 化学基礎 28 1 年 ( ) 組 ( ) 番 ( ) 原子の電子式 (p58 図 11) 族 価電子 の数 < 練習 > 塩素分子 Cl 2 塩化水素 HCl 二酸化炭素 CO2 窒素分子 N2 ができるときの電子式を書 きなさい (1) 塩素分子 (2) 塩化水素分子 (3) 二酸化炭素分子 (4) 窒素分子
10 化学基礎 29 1 年 ( ) 組 ( ) 番 ( ) 7.< 分子の構造 >( 教科書 p60) (1) 構造式は分子の原子のつながり方を平面的に示したものである 実際の分子は立体的 な形をしている 分子分子式電子式構造式分子の形 水素 H 2 直線形 水 H 2 O 折れ線形 アンモニア NH 3 三角錐形 メタン CH 4 正四面体 形 二酸化炭素 CO 2 直線形 エチレン C 2 H 4 平面形 アセチレン C 2 H 2 直線形
11 化学基礎 30 1 年 ( ) 組 ( ) 番 ( ) 配位結合 (p59) (1) 共有結合の1つで 一方の原子の 1 非共有電子対 を共有してできる結び つきを 2 配位結合 という 例 : アンモニウムイオン 例 : オキソニウムイオン 水水素イオンオキソニウムイオン H 2 O H + H 3 O + 電気陰性度 (p61) (1) 共有結合において 原子が共有電子対を引きつける強さのことを 3 電気陰性度 という (2) 一般に 周期表で右上側にある元素 ( 希ガスをのぞく ) ほど電気陰性度は 4 い (3) 原子間の電気陰性度の差により生じる 電荷のかたよりを 5 極性 といい 電荷のかたよりのある分子を 6 極性分子 電荷のかたよりのない分子を 7 無極性分子 という
12 化学基礎 31 1 年 ( ) 組 ( ) 番 ( ) 分子からなる物質の性質 ( 教科書 P61~) 1.< 分子からなる物質 > (1) 室温で 1 気体 水素 酸素 アンモニアなど 2 液体 水 エタノールなど (2) 比較的質量が大きい分子からできている物質は 室温で 3 固体 ( 例 ) ヨウ素 スクロース ( 砂糖 ) など (3) 4 昇華 するものがある ( 例 ) ヨウ素 ドライアイス ナフタレンなど 2.< 分子結晶 > (1) 分子が規則正しく配列した結晶を 5 分子結晶 という (2) 分子結晶の物質は 融点 沸点が 6 低く 7 電気 を通さない 分子からなる身近な物質 ( 教科書 p62) 1.< 無機物質 > (1) 水素 : 分子式 8 H2 最も 9 軽い 気体で 燃えて 10 水 が生じる ロケット燃料などに使用される (2) 酸素 11 O2 空気中に約 21% 含まれる気体 植物の光合成によって作られ 生物の呼吸や物質の酸化とも関係している (3) 窒素 12 N2 空気中に約 78% 含まれる気体 自動車などの排気ガスは酸素 と化合した窒素酸化物 (NO NO 2 ) であり 光化学スモッグや酸性雨といった人体に 影響を及ぼすもの (4) 塩化水素 13 HCl 空気よりも重い無色で刺激臭のある有毒気体 塩 化水素が水に溶けたもの ( 水溶液 ) を 14 塩酸 という 塩酸は金属を溶かし て 15 水素 を発生させる (5) 水 16 H2O 無色の液体 氷も水蒸気も同じ分子式を用いる (6) アンモニア 17 NH3 空気より軽い無色で刺激臭のある有毒気体 水に 溶けやすく 18 アルカリ性 を示す (7) 二酸化炭素 19 CO2 空気よりも重い無色無臭の気体 水に溶けると炭 酸水になり 20 酸性 を示す 石灰水に通すと 21 白くにごる 22 ドライアイス は二酸化炭素の固体である
13 化学基礎 32 1 年 ( ) 組 ( ) 番 ( ) 2.< 有機化合物 >( 教科書 p64) (1) 炭素を含み 燃えてCO 2 とH 2 Oが生じる化合物を 1 有機化合物 という ただし CO CO 2 CaCO 3 などは含めない (2) メタン 分子式 :2 CH4 空気より軽い無色無臭の気体 都市ガスに使 用 (3) エタノール 3 C2H5OH 無色の液体 デンプンやグルコースの発酵 で生じ酒類にふくまれるアルコールのこと 消毒液などに用いられる (4) 酢酸 4 CH3COOH 無色刺激臭の液体 酢に含まれる 合成繊維や 医薬品の原料になる (5) ベンゼン 5 C6H6 無色特異臭の液体 炭素原子が正六角形につな がっており いろんな芳香族化合物の素となる < 練習 > エタノール C 2 H 5 OH 酢酸 CH 3 COOH ベンゼン C 6 H 6 の構造式を考えてみ よう エタノール酢酸ベンゼン 3.< 高分子化合物 > (1) 有機化合物の中で分子が次々と結合して巨大な分子になるものがある これを 9 高分子化合物 という (2) 10 ポリエチレン エチレンが次々に結合したもの プラスチック製品やポ リ袋などができる (3) 11 ポリエチレンテレフタレート テレフタル酸とエチレングリコ一ルが 次々結合したもの ポリエステル繊維やペットボ卜ルなどができる
14 化学基礎 33 1 年 ( ) 組 ( ) 番 ( ) 共有結合の結晶 ( 教科書 p66) 1.< 共有結合の結晶と性質 > (1) 原子間が共有結合によって強く結ばれた結晶を 1 共有結合 の結晶という (2) 共有結合の結晶は基本単位である 2 組成式 で表す 2.< 身近な共有結合の結晶 > (1) 共有結合の結晶は結合が 3 強い ため 融点が 4 高く 水に溶 け 5 にくい また 黒鉛を除いて極めて 6 硬く 電気を通し 7 にくい (2) ダイヤモンド 組成式 :8 C どの炭素原子でも正四面体を作るように結 合している 宝石などに加工される (3) 黒鉛 9 C 3つの炭素原子が結合し 層になるような構造をとる この ため層がはがれやすいので黒鉛は柔らかい また自由電子が存在し 電気を通す 図 24 ダイヤモンドと黒鉛の結晶の違い (4) ケイ素 ( シリコン ) 10 Si 岩石や鉱物の成分元素として 地殼中に酸素に次いで多量に存在する ダイヤモンドと同じ構造をとり 電気を通したり通さなかったりする 10 半導体 としてコンピュータのIC( 集積回路 ) などに利用される (5) 二酸化ケイ素 11 SiO2 石英などの主成分 石英ガラスや光ファイバ一の原料になる 図 27 二酸化ケイ素 SiO 2 の構造モデル
15 化学基礎 34 1 年 ( ) 組 ( ) 番 ( ) C. 金属結合 ( 教科書 p68~) 金属の結合 1.< 金属結合 > (1) 金属原子は規則正しく配列している 金属原子どうしの化学結合を 1 金属結合 という できた金属の結晶 ( 固体の金属 ) を 2 金属結晶 という (2) 金属結合では原子間を自由に動き回る 3 自由電子 が存在し 金属特有の 性質が現れる (3) 金属光沢を持ち 自由電子により 4 電気 や 5 熱 をよく導く 2.< 金属の性質 > (1) 金属を化学式で表すには元素記号をそのまま組成式で表す (2) たたくと広がる 6 展性 や引っ張ると伸びる 7 延性 をもつ 代表的な金属 1.< 鉄 > (1) 元素記号 8 Fe 鉄鉱石を還元して得られる (2) 鉄とクロムCr ニッケルNiの合金 9 ステンレス は錆びにくい 2.< 銅 > (1) 元素記号 10 Cu 黄銅鉱などの銅鉱石を還元して得られる (2) 銅は電気伝導性が高く 比較的安価なため電気器具の部品などに使われる 日本の硬 貨の多くが銅の合金でできている 3.< アルミニウム > (1) 元素記号 11 Al ボーキサイトから精製される (2) 軽くて展性に富むので 1 円硬貨やアルミホイル 缶 鍋 窓枠など様々な用途に用 いられている (3) アルミニウムの合金の 12 ジュラルミン は 軽量で強度も高いので 飛行 機の機体などに利用されている 4.< 水銀 > (1) 元素記号 13 Hg 室温常圧で唯一の 14 液体 金属 蛍光灯や水 銀灯 温度計に利用される (2) 多くの金属と 15 アマルガム と呼ばれる合金をつくる アマルガムは歯に詰める材料に使われていた
16 化学基礎 35 1 年 ( ) 組 ( ) 番 ( ) 物質の構成粒子と物資の分類 まとめ ( 教科書 p71) 構成元素 金属元素の原子 非金属元素の原子 構成粒子原子イオン分子原子 構成粒子間 金属結合 イオン結合 分子間に働く力 共有結合 の結合 ( 比較的強い ) ( 強い ) ( 弱い ) ( 非常に強い ) 物質 ( 固体 ) の 分類 金属結晶イオン結晶分子結晶 共有結合の 結晶 化学式組成式組成式分子式組成式 物質の例 Cu Mg NaCl KNO3 H2 I2 ダイヤモンド 二酸化ケイ素 融点 沸点高低様々一般に高い低い非常に高い 結晶の硬さ硬軟様々硬くてもろい やわらかくても ろい 硬い ( 黒鉛はや わらかい ) 結晶の 電気伝導性 よく通す 通さない ( 液体や水溶液 は通す ) 通さない 通さない ( 黒鉛はよく通 す )
電子配置と価電子 P H 2He 第 4 回化学概論 3Li 4Be 5B 6C 7N 8O 9F 10Ne 周期表と元素イオン 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 価電子数 陽
 電子配置と価電子 P11 1 2 13 14 15 16 17 18 1H 2He 第 4 回化学概論 3Li 4Be 5B 6C 7N 8O 9F 10Ne 周期表と元素イオン 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 1 2 3 4 5 6 7 0 陽性元素陰性元素安定電子を失いやすい電子を受け取りやすい 原子番号と価電子の数 P16 元素の周期表 P17 最外殻の電子配置と周期表
電子配置と価電子 P11 1 2 13 14 15 16 17 18 1H 2He 第 4 回化学概論 3Li 4Be 5B 6C 7N 8O 9F 10Ne 周期表と元素イオン 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 1 2 3 4 5 6 7 0 陽性元素陰性元素安定電子を失いやすい電子を受け取りやすい 原子番号と価電子の数 P16 元素の周期表 P17 最外殻の電子配置と周期表
化学 1( 応用生物 生命健康科 現代教育学部 ) ( 解答番号 1 ~ 29 ) Ⅰ 化学結合に関する ⑴~⑶ の文章を読み, 下の問い ( 問 1~5) に答えよ ⑴ 塩化ナトリウム中では, ナトリウムイオン Na + と塩化物イオン Cl - が静電気的な引力で結び ついている このような陽イ
 化学 1( 応用生物 生命健康科 現代教育学部 ) ( 解答番号 1 ~ 29 ) Ⅰ 化学結合に関する ⑴~⑶ の文章を読み, 下の問い ( 問 1~5) に答えよ ⑴ 塩化ナトリウム中では, ナトリウムイオン Na + と塩化物イオン Cl - が静電気的な引力で結び ついている このような陽イオンと陰イオンの静電気的な引力による結合を 1 1 という ⑵ 2 個の水素原子は, それぞれ1 個の価電子を出し合い,
化学 1( 応用生物 生命健康科 現代教育学部 ) ( 解答番号 1 ~ 29 ) Ⅰ 化学結合に関する ⑴~⑶ の文章を読み, 下の問い ( 問 1~5) に答えよ ⑴ 塩化ナトリウム中では, ナトリウムイオン Na + と塩化物イオン Cl - が静電気的な引力で結び ついている このような陽イオンと陰イオンの静電気的な引力による結合を 1 1 という ⑵ 2 個の水素原子は, それぞれ1 個の価電子を出し合い,
1 1 H Li Be Na M g B A l C S i N P O S F He N Cl A e K Ca S c T i V C Mn Fe Co Ni Cu Zn Ga Ge As Se B K Rb S Y Z Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb T e
 No. 1 1 1 H Li Be Na M g B A l C S i N P O S F He N Cl A e K Ca S c T i V C Mn Fe Co Ni Cu Zn Ga Ge As Se B K Rb S Y Z Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb T e I X e Cs Ba F Ra Hf Ta W Re Os I Rf Db Sg Bh
No. 1 1 1 H Li Be Na M g B A l C S i N P O S F He N Cl A e K Ca S c T i V C Mn Fe Co Ni Cu Zn Ga Ge As Se B K Rb S Y Z Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb T e I X e Cs Ba F Ra Hf Ta W Re Os I Rf Db Sg Bh
1/120 別表第 1(6 8 及び10 関係 ) 放射性物質の種類が明らかで かつ 一種類である場合の放射線業務従事者の呼吸する空気中の放射性物質の濃度限度等 添付 第一欄第二欄第三欄第四欄第五欄第六欄 放射性物質の種類 吸入摂取した 経口摂取した 放射線業 周辺監視 周辺監視 場合の実効線 場合
 1/120 別表第 1(6 8 及び10 関係 ) 放射性物質の種類が明らかで かつ 一種類である場合の放射線業務従事者の呼吸する空気中の放射性物質の濃度限度等 添付 第一欄第二欄第三欄第四欄第五欄第六欄 放射性物質の種類 吸入摂取した 経口摂取した 放射線業 周辺監視 周辺監視 場合の実効線 場合の実効線 務従事者 区域外の 区域外の 量係数 量係数 の呼吸す 空気中の 水中の濃 る空気中 濃度限度
1/120 別表第 1(6 8 及び10 関係 ) 放射性物質の種類が明らかで かつ 一種類である場合の放射線業務従事者の呼吸する空気中の放射性物質の濃度限度等 添付 第一欄第二欄第三欄第四欄第五欄第六欄 放射性物質の種類 吸入摂取した 経口摂取した 放射線業 周辺監視 周辺監視 場合の実効線 場合の実効線 務従事者 区域外の 区域外の 量係数 量係数 の呼吸す 空気中の 水中の濃 る空気中 濃度限度
03J_sources.key
 Radiation Detection & Measurement (1) (2) (3) (4)1 MeV ( ) 10 9 m 10 7 m 10 10 m < 10 18 m X 10 15 m 10 15 m ......... (isotope)...... (isotone)......... (isobar) 1 1 1 0 1 2 1 2 3 99.985% 0.015% ~0% E
Radiation Detection & Measurement (1) (2) (3) (4)1 MeV ( ) 10 9 m 10 7 m 10 10 m < 10 18 m X 10 15 m 10 15 m ......... (isotope)...... (isotone)......... (isobar) 1 1 1 0 1 2 1 2 3 99.985% 0.015% ~0% E
解法 1 原子の性質を周期表で理解する 原子の結合について理解するには まずは原子の種類 (= 元素 ) による性質の違いを知る必要がある 原子の性質は 次の 3 つによって理解することができる イオン化エネルギー = 原子から電子 1 個を取り除くのに必要なエネルギー ( イメージ ) 電子 原子
 解法 1 原子の性質を周期表で理解する 原子の結合について理解するには まずは原子の種類 (= 元素 ) による性質の違いを知る必要がある 原子の性質は 次の 3 つによって理解することができる イオン化エネルギー = 原子から電子 1 個を取り除くのに必要なエネルギー ( イメージ ) 電子 原子 いやだ!! の強さ 電子親和力 = 原子が電子 1 個を受け取ったときに放出するエネルギー ( イメージ
解法 1 原子の性質を周期表で理解する 原子の結合について理解するには まずは原子の種類 (= 元素 ) による性質の違いを知る必要がある 原子の性質は 次の 3 つによって理解することができる イオン化エネルギー = 原子から電子 1 個を取り除くのに必要なエネルギー ( イメージ ) 電子 原子 いやだ!! の強さ 電子親和力 = 原子が電子 1 個を受け取ったときに放出するエネルギー ( イメージ
Taro-化学5 無機化学 最新版
 18 典型元素とその化合物 Ⅰ P oint.43 アルカリ金属元素 1 価電子価のイオン 2 常温で水と激しく反応する強いアルカリ性を示す Na + H2O に保存 3すべての塩は水に溶ける 4 炎色反応を示す Sr Li Ca Na Ba Cu K 5 イオン化傾向が大きい酸化されやすい 力 6 単体 Na は 7 アンモニアソーダ法 で得る ソルベー法 (1) (5) NaCl NaHCO3
18 典型元素とその化合物 Ⅰ P oint.43 アルカリ金属元素 1 価電子価のイオン 2 常温で水と激しく反応する強いアルカリ性を示す Na + H2O に保存 3すべての塩は水に溶ける 4 炎色反応を示す Sr Li Ca Na Ba Cu K 5 イオン化傾向が大きい酸化されやすい 力 6 単体 Na は 7 アンモニアソーダ法 で得る ソルベー法 (1) (5) NaCl NaHCO3
2004 年度センター化学 ⅠB p1 第 1 問問 1 a 水素結合 X HLY X,Y= F,O,N ( ) この形をもつ分子は 5 NH 3 である 1 5 b 昇華性の物質 ドライアイス CO 2, ヨウ素 I 2, ナフタレン 2 3 c 総電子数 = ( 原子番号 ) d CH 4 :6
 004 年度センター化学 ⅠB p 第 問問 a 水素結合 X HLY X,Y= F,O,N ( ) この形をもつ分子は 5 NH である 5 b 昇華性の物質 ドライアイス CO, ヨウ素 I, ナフタレン c 総電子数 = ( 原子番号 ) d CH 4 :6+ 4 = 0個 6+ 8= 4個 7+ 8= 5個 + 7= 8個 4 + 8= 0個 5 8= 6個 4 構造式からアプローチして電子式を書くと次のようになる
004 年度センター化学 ⅠB p 第 問問 a 水素結合 X HLY X,Y= F,O,N ( ) この形をもつ分子は 5 NH である 5 b 昇華性の物質 ドライアイス CO, ヨウ素 I, ナフタレン c 総電子数 = ( 原子番号 ) d CH 4 :6+ 4 = 0個 6+ 8= 4個 7+ 8= 5個 + 7= 8個 4 + 8= 0個 5 8= 6個 4 構造式からアプローチして電子式を書くと次のようになる
< イオン 電離練習問題 > No. 1 次のイオンの名称を書きなさい (1) H + ( ) (2) Na + ( ) (3) K + ( ) (4) Mg 2+ ( ) (5) Cu 2+ ( ) (6) Zn 2+ ( ) (7) NH4 + ( ) (8) Cl - ( ) (9) OH -
 < イオン 電離練習問題 > No. 1 次のイオンの名称を書きなさい (1) + (2) Na + (3) K + (4) Mg 2+ (5) Cu 2+ (6) Zn 2+ (7) N4 + (8) Cl - (9) - (10) SO4 2- (11) NO3 - (12) CO3 2- 次の文中の ( ) に当てはまる語句を 下の選択肢から選んで書きなさい 物質の原子は (1 ) を失ったり
< イオン 電離練習問題 > No. 1 次のイオンの名称を書きなさい (1) + (2) Na + (3) K + (4) Mg 2+ (5) Cu 2+ (6) Zn 2+ (7) N4 + (8) Cl - (9) - (10) SO4 2- (11) NO3 - (12) CO3 2- 次の文中の ( ) に当てはまる語句を 下の選択肢から選んで書きなさい 物質の原子は (1 ) を失ったり
第 11 回化学概論 酸化と還元 P63 酸化還元反応 酸化数 酸化剤 還元剤 金属のイオン化傾向 酸化される = 酸素と化合する = 水素を奪われる = 電子を失う = 酸化数が増加する 還元される = 水素と化合する = 酸素を奪われる = 電子を得る = 酸化数が減少する 銅の酸化酸化銅の還元
 第 11 回化学概論 酸化と還元 P63 酸化還元反応 酸化数 酸化剤 還元剤 金属のイオン化傾向 酸化される = 酸素と化合する = 水素を奪われる = 電子を失う = 酸化数が増加する 還元される = 水素と化合する = 酸素を奪われる = 電子を得る = 酸化数が減少する 銅の酸化酸化銅の還元 2Cu + O 2 2CuO CuO + H 2 Cu + H 2 O Cu Cu 2+ + 2e
第 11 回化学概論 酸化と還元 P63 酸化還元反応 酸化数 酸化剤 還元剤 金属のイオン化傾向 酸化される = 酸素と化合する = 水素を奪われる = 電子を失う = 酸化数が増加する 還元される = 水素と化合する = 酸素を奪われる = 電子を得る = 酸化数が減少する 銅の酸化酸化銅の還元 2Cu + O 2 2CuO CuO + H 2 Cu + H 2 O Cu Cu 2+ + 2e
理工学部無機化学ノート
 2 周期表と元素の性質の周期性 電子配置 通常の長周期型周期表 非金属元素と金属元素 e Cs Ba f Ta W Re Os Ir Pt Au g Tl Pb Bi Po At Rn Fr Ra Rf Db Sg Bh s Mt Ds Rg Cn Fl Lv 元素の大半は金属元素である 14 族や 15 族は 周期が下がるにつれ 性質が大幅に変化することが分かる La Ce Pr Nd Pm Sm
2 周期表と元素の性質の周期性 電子配置 通常の長周期型周期表 非金属元素と金属元素 e Cs Ba f Ta W Re Os Ir Pt Au g Tl Pb Bi Po At Rn Fr Ra Rf Db Sg Bh s Mt Ds Rg Cn Fl Lv 元素の大半は金属元素である 14 族や 15 族は 周期が下がるにつれ 性質が大幅に変化することが分かる La Ce Pr Nd Pm Sm
H1-H4
 42 S H He Li H He Li Be B C N O F Ne Be B C N O F Ne H He Li Be B H H e L i Na Mg Al Si S Cl Ar Na Mg Al Si S Cl Ar C N O F Ne Na Be B C N O F Ne Na K Sc T i V C r K Sc Ti V Cr M n F e C o N i Mn Fe Mg
42 S H He Li H He Li Be B C N O F Ne Be B C N O F Ne H He Li Be B H H e L i Na Mg Al Si S Cl Ar Na Mg Al Si S Cl Ar C N O F Ne Na Be B C N O F Ne Na K Sc T i V C r K Sc Ti V Cr M n F e C o N i Mn Fe Mg
RAA-05(201604)MRA対応製品ver6
 M R A 対 応 製 品 ISO/IEC 17025 ISO/IEC 17025は 試験所及び校正機関が特定の試験又は 校正を実施する能力があるものとして認定を 受けようとする場合の一般要求事項を規定した国際規格 国際相互承認 MRA Mutual Recognition Arrangement 相互承認協定 とは 試験 検査を実施する試験所 検査機関を認定する国際組織として ILAC 国際試験所認定協力機構
M R A 対 応 製 品 ISO/IEC 17025 ISO/IEC 17025は 試験所及び校正機関が特定の試験又は 校正を実施する能力があるものとして認定を 受けようとする場合の一般要求事項を規定した国際規格 国際相互承認 MRA Mutual Recognition Arrangement 相互承認協定 とは 試験 検査を実施する試験所 検査機関を認定する国際組織として ILAC 国際試験所認定協力機構
2 Zn Zn + MnO 2 () 2 O 2 2 H2 O + O 2 O 2 MnO 2 2 KClO 3 2 KCl + 3 O 2 O 3 or 3 O 2 2 O 3 N 2 () NH 4 NO 2 2 O + N 2 ( ) MnO HCl Mn O + CaCl(ClO
 1 [1]. Zn + 2 H + Zn 2+,. K Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au H (H + ),,. [2] ( ) ( ) CO 2, S, SO 2, NH 3 () + () () + () FeS Fe S ( ) + ( ) ( ) + ( ) 2 NH 4 Cl + Ca(OH) 2 Ca O + 2 NH 3,.,,.,,.,.
1 [1]. Zn + 2 H + Zn 2+,. K Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au H (H + ),,. [2] ( ) ( ) CO 2, S, SO 2, NH 3 () + () () + () FeS Fe S ( ) + ( ) ( ) + ( ) 2 NH 4 Cl + Ca(OH) 2 Ca O + 2 NH 3,.,,.,,.,.
RN201602_cs5_0122.indd
 ISSN 1349-1229 No.416 February 2016 2 SPECIAL TOPIC113 SPECIAL TOPIC 113 FACE Mykinso 113 SPECIAL TOPIC IUPAC 11320151231 RI RIBFRILAC 20039Zn30 Bi83 20047113 20054201283 113 1133 Bh107 20082009 113 113
ISSN 1349-1229 No.416 February 2016 2 SPECIAL TOPIC113 SPECIAL TOPIC 113 FACE Mykinso 113 SPECIAL TOPIC IUPAC 11320151231 RI RIBFRILAC 20039Zn30 Bi83 20047113 20054201283 113 1133 Bh107 20082009 113 113
改訂版 セミナー化学基礎 第Ⅰ章
 原子の構成と元素の周期表 原子の構成 ❶ 原子物質を構成する最小の粒子 原子は電気的に中性 元素記号で表される 原子の半径 原子核の半径 ❷ 原子の構成表示 約 3 0 0 m (0. 0.3 nm) 約 0 5 m ( 0 nm) 質量数 = 陽子の数 + 中性子の数原子番号 = 陽子の数 (= 電子の数 ) 陽子の数は, 原子の種類によって決まっている 陽子の数 = 電子の数 陽子の質量 中性子の質量
原子の構成と元素の周期表 原子の構成 ❶ 原子物質を構成する最小の粒子 原子は電気的に中性 元素記号で表される 原子の半径 原子核の半径 ❷ 原子の構成表示 約 3 0 0 m (0. 0.3 nm) 約 0 5 m ( 0 nm) 質量数 = 陽子の数 + 中性子の数原子番号 = 陽子の数 (= 電子の数 ) 陽子の数は, 原子の種類によって決まっている 陽子の数 = 電子の数 陽子の質量 中性子の質量
2014 年度大学入試センター試験解説 化学 Ⅰ 第 1 問物質の構成 1 問 1 a 1 g に含まれる分子 ( 分子量 M) の数は, アボガドロ定数を N A /mol とすると M N A 個 と表すことができる よって, 分子量 M が最も小さい分子の分子数が最も多い 分 子量は, 1 H
 01 年度大学入試センター試験解説 化学 Ⅰ 第 1 問物質の構成 1 問 1 a 1 g に含まれる分子 ( 分子量 M) の数は, アボガドロ定数を N A /mol とすると M N A 個 と表すことができる よって, 分子量 M が最も小さい分子の分子数が最も多い 分 子量は, 1 = 18 N = 8 3 6 = 30 Ne = 0 5 = 3 6 l = 71 となり,1 が解答 (
01 年度大学入試センター試験解説 化学 Ⅰ 第 1 問物質の構成 1 問 1 a 1 g に含まれる分子 ( 分子量 M) の数は, アボガドロ定数を N A /mol とすると M N A 個 と表すことができる よって, 分子量 M が最も小さい分子の分子数が最も多い 分 子量は, 1 = 18 N = 8 3 6 = 30 Ne = 0 5 = 3 6 l = 71 となり,1 が解答 (
2_R_新技術説明会(佐々木)
 % U: 6.58%, Np, Am:.5%, Pu:.% 5.8% Cs 6.5% Sr %.9%Mo 8.74% Tc.9% TODA C 8 H 7 C 8 H 7 N CH C CH N CH O C C 8 H 7 O N MIDOA C 8 H 7 DOODA NTA + HN(C 8 H 7 ) + H O DCC + SOCl + HN(C 8 H 7 ) + Cl TODA (TODA)
% U: 6.58%, Np, Am:.5%, Pu:.% 5.8% Cs 6.5% Sr %.9%Mo 8.74% Tc.9% TODA C 8 H 7 C 8 H 7 N CH C CH N CH O C C 8 H 7 O N MIDOA C 8 H 7 DOODA NTA + HN(C 8 H 7 ) + H O DCC + SOCl + HN(C 8 H 7 ) + Cl TODA (TODA)
元素分析
 : このマークが付してある著作物は 第三者が有する著作物ですので 同著作物の再使用 同著作物の二次的著作物の創作等については 著作権者より直接使用許諾を得る必要があります (PET) 1 18 1 18 H 2 13 14 15 16 17 He 1 2 Li Be B C N O F Ne 3 4 5 6 7 8 9 10 Na Mg 3 4 5 6 7 8 9 10 11 12 Al Si P
: このマークが付してある著作物は 第三者が有する著作物ですので 同著作物の再使用 同著作物の二次的著作物の創作等については 著作権者より直接使用許諾を得る必要があります (PET) 1 18 1 18 H 2 13 14 15 16 17 He 1 2 Li Be B C N O F Ne 3 4 5 6 7 8 9 10 Na Mg 3 4 5 6 7 8 9 10 11 12 Al Si P
<4D F736F F F696E74202D A E90B6979D89C8816B91E63195AA96EC816C82DC82C682DF8D758DC03189BB8A7795CF89BB82C68CB48E AA8E E9197BF2E >
 中学 2 年理科まとめ講座 第 1 分野 1. 化学変化と原子 分子 物質の成り立ち 化学変化 化学変化と物質の質量 基本の解説と問題 講師 : 仲谷のぼる 1 物質の成り立ち 物質のつくり 物質をつくる それ以上分けることができない粒を原子という いくつかの原子が結びついてできたものを分子という いろいろな物質のうち 1 種類の原子からできている物質を単体 2 種類以上の原子からできている物質を化合物という
中学 2 年理科まとめ講座 第 1 分野 1. 化学変化と原子 分子 物質の成り立ち 化学変化 化学変化と物質の質量 基本の解説と問題 講師 : 仲谷のぼる 1 物質の成り立ち 物質のつくり 物質をつくる それ以上分けることができない粒を原子という いくつかの原子が結びついてできたものを分子という いろいろな物質のうち 1 種類の原子からできている物質を単体 2 種類以上の原子からできている物質を化合物という
第3類危険物の物質別詳細 練習問題
 第 3 類危険物の物質別詳細練習問題 問題 1 第 3 類危険物の一般的な消火方法として 誤っているものは次のうちいくつあるか A. 噴霧注水は冷却効果と窒息効果があるので 有効である B. 乾燥砂は有効である C. 分子内に酸素を含むので 窒息消火法は効果がない D. 危険物自体は不燃性なので 周囲の可燃物を除去すればよい E. 自然発火性危険物の消火には 炭酸水素塩類を用いた消火剤は効果がある
第 3 類危険物の物質別詳細練習問題 問題 1 第 3 類危険物の一般的な消火方法として 誤っているものは次のうちいくつあるか A. 噴霧注水は冷却効果と窒息効果があるので 有効である B. 乾燥砂は有効である C. 分子内に酸素を含むので 窒息消火法は効果がない D. 危険物自体は不燃性なので 周囲の可燃物を除去すればよい E. 自然発火性危険物の消火には 炭酸水素塩類を用いた消火剤は効果がある
Taro-bussitu_T1
 P 気体の性質 ~ 気体の発生 次の表の ~4 にあてはまる言葉を後のア ~ シから選び, それぞれ記号で答えなさい 酸素二酸化炭素水素アンモニア窒素 空気より 4 少し軽い 水に 5 6 7 8 9 その他 0 4 ~4の選択肢 ア. もっとも軽いイ. 軽いウ. 少し重いエ. 重い 5~9の選択肢 オ. 溶けにくいカ. 少し溶けるキ. 溶けやすい 0~4の選択肢 ク. 他の物が燃えるのを助けるケ.
P 気体の性質 ~ 気体の発生 次の表の ~4 にあてはまる言葉を後のア ~ シから選び, それぞれ記号で答えなさい 酸素二酸化炭素水素アンモニア窒素 空気より 4 少し軽い 水に 5 6 7 8 9 その他 0 4 ~4の選択肢 ア. もっとも軽いイ. 軽いウ. 少し重いエ. 重い 5~9の選択肢 オ. 溶けにくいカ. 少し溶けるキ. 溶けやすい 0~4の選択肢 ク. 他の物が燃えるのを助けるケ.
Microsoft PowerPoint - 基礎化学4revPart1b [互換モード]
![Microsoft PowerPoint - 基礎化学4revPart1b [互換モード] Microsoft PowerPoint - 基礎化学4revPart1b [互換モード]](/thumbs/101/152457308.jpg) 化学結合と分 の形 なぜ原 と原 はつながるのかなぜ分 はきまった形をしているのか化学結合の本質を理解しよう 分子の形と電子状態には強い相関がある! 原子 分子 基礎化学 ( 化学結合論 構造化学 量子化学 ) 電子配置分子の形強い相関関係 ( 電子状態 ) ( 立体構造 ) 分子の性質 ( 反応性 物性 ) 先端化学 ( 分子設計 機能化学 ) 機能 分子の形と電子配置の基礎的理解 基礎 ( 簡単
化学結合と分 の形 なぜ原 と原 はつながるのかなぜ分 はきまった形をしているのか化学結合の本質を理解しよう 分子の形と電子状態には強い相関がある! 原子 分子 基礎化学 ( 化学結合論 構造化学 量子化学 ) 電子配置分子の形強い相関関係 ( 電子状態 ) ( 立体構造 ) 分子の性質 ( 反応性 物性 ) 先端化学 ( 分子設計 機能化学 ) 機能 分子の形と電子配置の基礎的理解 基礎 ( 簡単
jhs-science1_05-02ans
 気体の発生と性質 (1 1 次の文章の ( に当てはまる言葉を書くか 〇でかこみなさい (1 気体には 水にとけやすいものと ものがある また 空気より (1 密度 が大きい ( 重い ものと 小さい ( 軽い ものがある (2 水に ( とけやすい 気体は水上で集められる 空気より 1 が ( 大きい 小さい 気体は下方 ( 大きい 小さい 気体は上方で それぞれ集められる (3 酸素の中に火のついた線香を入れると
気体の発生と性質 (1 1 次の文章の ( に当てはまる言葉を書くか 〇でかこみなさい (1 気体には 水にとけやすいものと ものがある また 空気より (1 密度 が大きい ( 重い ものと 小さい ( 軽い ものがある (2 水に ( とけやすい 気体は水上で集められる 空気より 1 が ( 大きい 小さい 気体は下方 ( 大きい 小さい 気体は上方で それぞれ集められる (3 酸素の中に火のついた線香を入れると
高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ
![高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ 高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ](/thumbs/94/118405200.jpg) 高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ溶質の20% 溶液 100gと30% 溶液 200gを混ぜると質量 % はいくらになるか ( 有効数字
高 1 化学冬期課題試験 1 月 11 日 ( 水 ) 実施 [1] 以下の問題に答えよ 1)200g 溶液中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 整数 ) 2)200g 溶媒中に溶質が20g 溶けている この溶液の質量 % はいくらか ( 有効数字 2 桁 ) 3) 同じ溶質の20% 溶液 100gと30% 溶液 200gを混ぜると質量 % はいくらになるか ( 有効数字
2019 年度大学入試センター試験解説 化学 第 1 問問 1 a 塩化カリウムは, カリウムイオン K + と塩化物イオン Cl - のイオン結合のみを含む物質であり, 共有結合を含まない ( 答 ) 1 1 b 黒鉛の結晶中では, 各炭素原子の 4 つの価電子のうち 3 つが隣り合う他の原子との
 219 年度大学入試センター試験解説 化学 第 1 問問 1 a 塩化カリウムは, カリウムイオン K + と塩化物イオン Cl - のイオン結合のみを含む物質であり, 共有結合を含まない ( 答 ) 1 1 b 黒鉛の結晶中では, 各炭素原子の 4 つの価電子のうち 3 つが隣り合う他の原子との共有結合に使われ, 残りの 1 つは結晶を構成する層上を自由に移動している そのため, 黒鉛は固体の状態で電気をよく通す
219 年度大学入試センター試験解説 化学 第 1 問問 1 a 塩化カリウムは, カリウムイオン K + と塩化物イオン Cl - のイオン結合のみを含む物質であり, 共有結合を含まない ( 答 ) 1 1 b 黒鉛の結晶中では, 各炭素原子の 4 つの価電子のうち 3 つが隣り合う他の原子との共有結合に使われ, 残りの 1 つは結晶を構成する層上を自由に移動している そのため, 黒鉛は固体の状態で電気をよく通す
36 th IChO : - 3 ( ) , G O O D L U C K final 1
 36 th ICh - - 5 - - : - 3 ( ) - 169 - -, - - - - - - - G D L U C K final 1 1 1.01 2 e 4.00 3 Li 6.94 4 Be 9.01 5 B 10.81 6 C 12.01 7 N 14.01 8 16.00 9 F 19.00 10 Ne 20.18 11 Na 22.99 12 Mg 24.31 Periodic
36 th ICh - - 5 - - : - 3 ( ) - 169 - -, - - - - - - - G D L U C K final 1 1 1.01 2 e 4.00 3 Li 6.94 4 Be 9.01 5 B 10.81 6 C 12.01 7 N 14.01 8 16.00 9 F 19.00 10 Ne 20.18 11 Na 22.99 12 Mg 24.31 Periodic
2011年度 化学1(物理学科)
 014 年度スペシャルプログラム (1/17) 酸 塩基 : 酸 塩基の定義を確認する No.1 1 酸と塩基の定義に関する以下の文章の正を答えよ 場合は 間違いを指摘せよ 文章正指摘 1 酸と塩基の定義はアレニウスとブレンステッド ローリーの 種類である ルイスの定義もある アレニウスの定義によれば 酸とは H を含むものである 水に溶けて 電離して H+ を出すものである 3 アレニウスの定義によれば
014 年度スペシャルプログラム (1/17) 酸 塩基 : 酸 塩基の定義を確認する No.1 1 酸と塩基の定義に関する以下の文章の正を答えよ 場合は 間違いを指摘せよ 文章正指摘 1 酸と塩基の定義はアレニウスとブレンステッド ローリーの 種類である ルイスの定義もある アレニウスの定義によれば 酸とは H を含むものである 水に溶けて 電離して H+ を出すものである 3 アレニウスの定義によれば
Taro-化学3 酸塩基 最新版
 11 酸 塩基の反応 P oint.29 酸 塩基 ブレンステッドの酸 塩基 酸 水素イオンを 物質 塩基 水素イオンを 物質 NH3 + H2O NH4 + + OH - 酸 塩基の性質 1 リトマス紙 2 フェノールフタレイン溶液 3BTB 液 4 メチルオレンジ 5 金属と反応 6 味 7 水溶液中に存在するイオン 酸 塩基 酸 塩基の分類 1 価数による分類 1 価 2 価 3 価 酸 塩基
11 酸 塩基の反応 P oint.29 酸 塩基 ブレンステッドの酸 塩基 酸 水素イオンを 物質 塩基 水素イオンを 物質 NH3 + H2O NH4 + + OH - 酸 塩基の性質 1 リトマス紙 2 フェノールフタレイン溶液 3BTB 液 4 メチルオレンジ 5 金属と反応 6 味 7 水溶液中に存在するイオン 酸 塩基 酸 塩基の分類 1 価数による分類 1 価 2 価 3 価 酸 塩基
木村の理論化学小ネタ 熱化学方程式と反応熱の分類発熱反応と吸熱反応化学反応は, 反応の前後の物質のエネルギーが異なるため, エネルギーの出入りを伴い, それが, 熱 光 電気などのエネルギーの形で現れる とくに, 化学変化と熱エネルギーの関
 熱化学方程式と反応熱の分類発熱反応と吸熱反応化学反応は, 反応の前後の物質のエネルギーが異なるため, エネルギーの出入りを伴い, それが, 熱 光 電気などのエネルギーの形で現れる とくに, 化学変化と熱エネルギーの関係を扱う化学の一部門を熱化学という 発熱反応反応前の物質のエネルギー 大ネルギ熱エネルギーー小エ反応後の物質のエネルギー 吸熱反応 反応後の物質のエネルギー 大ネルギー熱エネルギー小エ反応前の物質のエネルギー
熱化学方程式と反応熱の分類発熱反応と吸熱反応化学反応は, 反応の前後の物質のエネルギーが異なるため, エネルギーの出入りを伴い, それが, 熱 光 電気などのエネルギーの形で現れる とくに, 化学変化と熱エネルギーの関係を扱う化学の一部門を熱化学という 発熱反応反応前の物質のエネルギー 大ネルギ熱エネルギーー小エ反応後の物質のエネルギー 吸熱反応 反応後の物質のエネルギー 大ネルギー熱エネルギー小エ反応前の物質のエネルギー
IS(A3) 核データ表 ( 内部転換 オージェ電子 ) No.e1 By IsoShieldJP 番号 核種核種半減期エネルギー放出割合核種番号通番数値単位 (kev) (%) 核崩壊型 娘核種 MG H β-/ce K A
 IS(A3)- 284 - No.e1 核種核種半減期エネルギー放出割合核種通番数値単位 (kev) (%) 1 1 1 MG-28 20.915 H 29.08 27.0000 β-/ce K Al-28 2 1 2 MG-28 20.915 H 30.64 2.6000 β-/ce L Al-28 3 2 1 SC-44M 58.6 H 270.84 0.0828 EC/CE CA-44 4 2
IS(A3)- 284 - No.e1 核種核種半減期エネルギー放出割合核種通番数値単位 (kev) (%) 1 1 1 MG-28 20.915 H 29.08 27.0000 β-/ce K Al-28 2 1 2 MG-28 20.915 H 30.64 2.6000 β-/ce L Al-28 3 2 1 SC-44M 58.6 H 270.84 0.0828 EC/CE CA-44 4 2
イオン化傾向 イオン化傾向 1 金属の単体はいずれも酸化されて陽イオンになりうる 金属のイオンのなりやすさを表したものをイオン化傾向という イオン化傾向 K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au e- を出してイオンになりやすい酸化されやすい イ
 イオン化傾向 イオン化傾向 金属の単体はいずれも酸化されて陽イオンになりうる 金属のイオンのなりやすさを表したものをイオン化傾向という イオン化傾向 K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au e- を出してイオンになりやすい酸化されやすい イオンになりにくい酸化されにくい イオン化傾向の覚え方 K かそう Ca か Na な Mg ま Al あ
イオン化傾向 イオン化傾向 金属の単体はいずれも酸化されて陽イオンになりうる 金属のイオンのなりやすさを表したものをイオン化傾向という イオン化傾向 K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au e- を出してイオンになりやすい酸化されやすい イオンになりにくい酸化されにくい イオン化傾向の覚え方 K かそう Ca か Na な Mg ま Al あ
SIサイエンス株式会社 stable isotope metal
 12 マグネシウム Magnesium 24 Mg 酸化物 78.99 99.7 12 マグネシウム Magnesium 25 Mg 酸化物 10.0 97.0 12 マグネシウム Magnesium 26 Mg 酸化物 11.01 97.0 12 マグネシウム Potassium 39 K 塩化物 93.11 99.97 12 マグネシウム Potassium 40 K 塩化物 0.011 2.10
12 マグネシウム Magnesium 24 Mg 酸化物 78.99 99.7 12 マグネシウム Magnesium 25 Mg 酸化物 10.0 97.0 12 マグネシウム Magnesium 26 Mg 酸化物 11.01 97.0 12 マグネシウム Potassium 39 K 塩化物 93.11 99.97 12 マグネシウム Potassium 40 K 塩化物 0.011 2.10
無機化学 II 2018 年度期末試験 1. 窒素を含む化合物にヒドラジンと呼ばれる化合物 (N2H4, 右図 ) がある. この分子に関し, 以下の問いに答えよ.( 計 9 点 ) (1) N2 分子が 1 mol と H2 分子が 2 mol の状態と, ヒドラジン 1 mol となっている状態
 無機化学 II 2018 年度期末試験 1. 窒素を含む化合物にヒドラジンと呼ばれる化合物 (N2H4, 右図 ) がある. この分子に関し, 以下の問いに答えよ.( 計 9 点 ) (1) N2 分子が 1 mol と H2 分子が 2 mol の状態と, ヒドラジン 1 mol となっている状態を比較すると, どちらの分子がどの程度エネルギーが低いか (= 安定か ) を平均結合エンタルピーから計算して答えよ.
無機化学 II 2018 年度期末試験 1. 窒素を含む化合物にヒドラジンと呼ばれる化合物 (N2H4, 右図 ) がある. この分子に関し, 以下の問いに答えよ.( 計 9 点 ) (1) N2 分子が 1 mol と H2 分子が 2 mol の状態と, ヒドラジン 1 mol となっている状態を比較すると, どちらの分子がどの程度エネルギーが低いか (= 安定か ) を平均結合エンタルピーから計算して答えよ.
<連載講座>アルマイト従事者のためのやさしい化学(XVII)--まとめと問題 (1)
 アルマイト従事者のためのやさしい化学 (ⅩⅦ) - まとめと問題 1- 野口駿雄 Ⅰ. はじめに前号までに化学の基礎 アルミニウム表面処理に使用されている前処理液 ( 特にアルカリ溶液 ) 及び硫酸電解液や蓚酸電解液の分析方法について その手順を 使用する分析用器具を図示し また簡単な使用方法を付け加えながら示し 初心者でもその図を見ながら順を追って操作を行えば それぞれの分析が出来るように心がけ
アルマイト従事者のためのやさしい化学 (ⅩⅦ) - まとめと問題 1- 野口駿雄 Ⅰ. はじめに前号までに化学の基礎 アルミニウム表面処理に使用されている前処理液 ( 特にアルカリ溶液 ) 及び硫酸電解液や蓚酸電解液の分析方法について その手順を 使用する分析用器具を図示し また簡単な使用方法を付け加えながら示し 初心者でもその図を見ながら順を追って操作を行えば それぞれの分析が出来るように心がけ
基礎化学 Ⅰ 第 5 講原子量とモル数 第 5 講原子量とモル数 1 原子量 (1) 相対質量 まず, 大きさの復習から 原子 ピンポン玉 原子の直径は, 約 1 億分の 1cm ( 第 1 講 ) 原子とピンポン玉の関係は, ピンポン玉と地球の関係と同じくらいの大きさです 地球 では, 原子 1
 第 5 講原子量とモル数 1 原子量 (1) 相対質量 まず, 大きさの復習から 原子 ピンポン玉 原子の直径は, 約 1 億分の 1cm ( 第 1 講 ) 原子とピンポン玉の関係は, ピンポン玉と地球の関係と同じくらいの大きさです 地球 では, 原子 1 つの質量は? 水素原子は,0.167 10-23 g 酸素原子は,2.656 10-23 g 炭素原子は,1.993 10-23 g 原子の質量は,
第 5 講原子量とモル数 1 原子量 (1) 相対質量 まず, 大きさの復習から 原子 ピンポン玉 原子の直径は, 約 1 億分の 1cm ( 第 1 講 ) 原子とピンポン玉の関係は, ピンポン玉と地球の関係と同じくらいの大きさです 地球 では, 原子 1 つの質量は? 水素原子は,0.167 10-23 g 酸素原子は,2.656 10-23 g 炭素原子は,1.993 10-23 g 原子の質量は,
i ( 23 ) ) SPP Science Partnership Project ( (1) (2) 2010 SSH
 i 1982 2012 ( 23 ) 30 1998 ) 2002 2006 2009 1999 2009 10 2004 SPP Science Partnership Project 2004 2005 2009 ( 29 2010 (1) (2) 2010 SSH ii ph 21 2006 10 B5 A5 2014 2 2014 2 iii 21 1962 1969 1987 1992 2005
i 1982 2012 ( 23 ) 30 1998 ) 2002 2006 2009 1999 2009 10 2004 SPP Science Partnership Project 2004 2005 2009 ( 29 2010 (1) (2) 2010 SSH ii ph 21 2006 10 B5 A5 2014 2 2014 2 iii 21 1962 1969 1987 1992 2005
Slide 1
 3. 溶解 沈殿反応 天然水の化学組成 大陸地殻表層 (mg kg ) 河川水 (mg kg ) Al 77.4.5 Fe 3.9.4 Ca 9.4 3.4 Na 5.7 5. 8.6.3 Mg 3.5 3.4 Andrews et al. (3) An introduction to Environmental Chemistry 天然水の特徴 天然水の金属イオンは主に岩石の風化により生じる ただし
3. 溶解 沈殿反応 天然水の化学組成 大陸地殻表層 (mg kg ) 河川水 (mg kg ) Al 77.4.5 Fe 3.9.4 Ca 9.4 3.4 Na 5.7 5. 8.6.3 Mg 3.5 3.4 Andrews et al. (3) An introduction to Environmental Chemistry 天然水の特徴 天然水の金属イオンは主に岩石の風化により生じる ただし
K 吸収端 XAFS 用標準試料 Ti Ti-foil 金属箔 縦 1.3 cm 横 1.3 cm 厚さ 3 µm TiO2 anatase ペレット φ 7 mm 厚さ 0.5 mm 作製日 TiO2 rutile ペレット φ 7 mm 厚さ 0.5 mm 作製日 2017.
 あいち SR BL5S1 硬 X 線 XAFS ビームライン Ⅰ 標準試料リスト 周期表のリンクをクリックすると 各元素の標準試料リストに飛びます 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga
あいち SR BL5S1 硬 X 線 XAFS ビームライン Ⅰ 標準試料リスト 周期表のリンクをクリックすると 各元素の標準試料リストに飛びます 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga
Word Pro - matome_7_酸と塩基.lwp
 酸と 酸と 酸 acid 亜硫酸 pka =.6 pka =.9 酸 acid ( : 酸, すっぱいもの a : 酸の, すっぱい ) 酸性 p( ) 以下 酸っぱい味 ( 酸味 ) を持つ リトマス ( ) BTB( ) 金属と反応して ( ) を発生 ( 例 )Z l Zl リン酸 P pka =.5 pka =. pka =.8 P P P P P P P 酸性のもと 水素イオン 塩化水素
酸と 酸と 酸 acid 亜硫酸 pka =.6 pka =.9 酸 acid ( : 酸, すっぱいもの a : 酸の, すっぱい ) 酸性 p( ) 以下 酸っぱい味 ( 酸味 ) を持つ リトマス ( ) BTB( ) 金属と反応して ( ) を発生 ( 例 )Z l Zl リン酸 P pka =.5 pka =. pka =.8 P P P P P P P 酸性のもと 水素イオン 塩化水素
木村の化学重要問題集 015 解答編解説補充 第 4 周期の遷移元素がとる酸化数酸化数 Sc Ti 4 V 4 5 Cr Mn Fe Co 4 5 Ni 4 Cu 1 d 軌道と 4s 軌道のエネルギー差がわずかなので, 酸化により抜けるのは d 軌道と
 木村の化学重要問題集 015 解答編解説補充 10. 非金属元素 ( 周期表を含む ) 156. 元素の周期表 第 4 周期の遷移元素 ( 第 1 遷移元素 ) の電子配置と酸化数 第 4 周期の遷移元素 ( 黄色塗りつぶし ) の電子配置 原子番号 元素記号 電子殻と電子軌道 K L M N 1s s p s p d 4s 4p 4d 4f 19 K 6 6 1 0 Ca 6 6 1 Sc 6 6
木村の化学重要問題集 015 解答編解説補充 10. 非金属元素 ( 周期表を含む ) 156. 元素の周期表 第 4 周期の遷移元素 ( 第 1 遷移元素 ) の電子配置と酸化数 第 4 周期の遷移元素 ( 黄色塗りつぶし ) の電子配置 原子番号 元素記号 電子殻と電子軌道 K L M N 1s s p s p d 4s 4p 4d 4f 19 K 6 6 1 0 Ca 6 6 1 Sc 6 6
FdData理科3年
 FdData 中間期末 : 中学理科 3 年 [ 酸 アルカリとイオン ] [ 問題 ](1 学期期末 ) 次の各問いに答えよ (1) 塩酸の中に含まれている 酸 に共通するイオンは何か 1 イオンの名称を答えよ 2 また, このイオンの記号を書け (2) 水酸化ナトリウム水溶液の中に含まれている アルカリ に共通するイオンは何か 1 イオンの名称を答えよ 2 また, このイオンの記号を答えよ [
FdData 中間期末 : 中学理科 3 年 [ 酸 アルカリとイオン ] [ 問題 ](1 学期期末 ) 次の各問いに答えよ (1) 塩酸の中に含まれている 酸 に共通するイオンは何か 1 イオンの名称を答えよ 2 また, このイオンの記号を書け (2) 水酸化ナトリウム水溶液の中に含まれている アルカリ に共通するイオンは何か 1 イオンの名称を答えよ 2 また, このイオンの記号を答えよ [
化学基礎 化学 化学基礎 化学 ( 全問必答 ) 第 1 問次の各問い ( 問 1~ 6 ) に答えよ 解答番号 1 ~ 8 ( 配点 25) 問 1 次の a ~ c に当てはまるものを, それぞれの解答群 1~4 のうちから一つずつ 選べ a Al 3+ と物質量の比 2 :3 で化合物をつくる
 ( 全問必答 ) 第 1 問次の各問い ( 問 1~ 6 ) に答えよ 解答番号 1 ~ 8 ( 配点 5) 問 1 次の a ~ c に当てはまるものを, それぞれの解答群 1~4 のうちから一つずつ 選べ a Al + と物質量の比 : で化合物をつくる多原子イオン 1 1 塩化物イオン 酸化物イオン 硫酸イオン 4 リン酸イオン b 水溶液を白金線につけ, ガスバーナーの外炎に入れると, 黄色の炎が見ら
( 全問必答 ) 第 1 問次の各問い ( 問 1~ 6 ) に答えよ 解答番号 1 ~ 8 ( 配点 5) 問 1 次の a ~ c に当てはまるものを, それぞれの解答群 1~4 のうちから一つずつ 選べ a Al + と物質量の比 : で化合物をつくる多原子イオン 1 1 塩化物イオン 酸化物イオン 硫酸イオン 4 リン酸イオン b 水溶液を白金線につけ, ガスバーナーの外炎に入れると, 黄色の炎が見ら
2. 分子の形
 基礎現代化学 ~ 第 4 回 ~ 分子の形と異性体 教養学部統合自然科学科 小島憲道 2014.04.30 第 1 章原子 1 元素の誕生 2 原子の電子構造と周期性第 2 章分子の形成 1 化学結合と分子の形成 2 分子の形と異性体第 3 章光と分子 1 分子の中の電子 2 物質の色の起源 3 分子を測る第 4 章化学反応 1 気相の反応 液相の反応 2 分子を創る第 5 章分子の集団 1 分子間に働く力
基礎現代化学 ~ 第 4 回 ~ 分子の形と異性体 教養学部統合自然科学科 小島憲道 2014.04.30 第 1 章原子 1 元素の誕生 2 原子の電子構造と周期性第 2 章分子の形成 1 化学結合と分子の形成 2 分子の形と異性体第 3 章光と分子 1 分子の中の電子 2 物質の色の起源 3 分子を測る第 4 章化学反応 1 気相の反応 液相の反応 2 分子を創る第 5 章分子の集団 1 分子間に働く力
FdData理科3年
 FdData 中間期末 : 中学理科 1 年化学 [ 気体総合 ] パソコン タブレット版へ移動 [ 各気体の製法 ] [ 問題 ](3 学期 ) 次の各問いに答えよ (1) 二酸化マンガンにオキシドールを加えると発生する気体は何か (2) 亜鉛にうすい塩酸を加えると発生する気体は何か (3) 発泡入浴剤に湯を加えて発生した気体を石灰水に通したら, 石灰水が白くにごった 発生した気体は何か (4)
FdData 中間期末 : 中学理科 1 年化学 [ 気体総合 ] パソコン タブレット版へ移動 [ 各気体の製法 ] [ 問題 ](3 学期 ) 次の各問いに答えよ (1) 二酸化マンガンにオキシドールを加えると発生する気体は何か (2) 亜鉛にうすい塩酸を加えると発生する気体は何か (3) 発泡入浴剤に湯を加えて発生した気体を石灰水に通したら, 石灰水が白くにごった 発生した気体は何か (4)
はじめて学ぶ化学
 章末問題の解答 1 章 1. 物体として同じ形をしているものは (a), 物質として同じものは (b) と (c) 2. 5 µm = 5 10 6 m = 5 10 3 mm = 5 10 4 cm 3. (20 mm)/(5.0 µm) = (20 mm)/(5.0 10 3 mm) = 4.0 10 3 4.0 10 3 個. 4. 4.5 g = 4.5 10 3 kg = 4.5 10 3
章末問題の解答 1 章 1. 物体として同じ形をしているものは (a), 物質として同じものは (b) と (c) 2. 5 µm = 5 10 6 m = 5 10 3 mm = 5 10 4 cm 3. (20 mm)/(5.0 µm) = (20 mm)/(5.0 10 3 mm) = 4.0 10 3 4.0 10 3 個. 4. 4.5 g = 4.5 10 3 kg = 4.5 10 3
CuSO POINT S 2 Ni Sn Hg Cu Ag Zn 2 Cu Cu Cu OH 2 Cu NH CuSO 4 5H 2O Ag Ag 2O Ag 2CrO4 Zn ZnS ZnO 2+ Fe Fe OH 2 Fe 3+ Fe OH 3 2 Cu Cu OH 2 Ag Ag
 CuSO POINT S 2 Ni Sn Hg Cu Ag Zn 2 CuCu Cu OH 2 Cu NH 3 4 2 CuSO 4 5H 2O AgAg 2O Ag 2CrO4 ZnZnS ZnO 2+ Fe Fe OH 2 Fe 3+ Fe OH 3 2 Cu Cu OH 2 Ag Ag 2O Cl Cl AgCl PbCl 2 Ag Cl AgCl Pb 2 2Cl PbCl2 Cl Hg22
CuSO POINT S 2 Ni Sn Hg Cu Ag Zn 2 CuCu Cu OH 2 Cu NH 3 4 2 CuSO 4 5H 2O AgAg 2O Ag 2CrO4 ZnZnS ZnO 2+ Fe Fe OH 2 Fe 3+ Fe OH 3 2 Cu Cu OH 2 Ag Ag 2O Cl Cl AgCl PbCl 2 Ag Cl AgCl Pb 2 2Cl PbCl2 Cl Hg22
 MP-AES ICP-QQQ Agilent 5100 ICP-OES Agilent 5100 (SVDV) ICP-OES (DSC) 1 5100 SVDV ICP-OES VistaChip II CCD Agilent 7900 ICP-MS 7700 / 10 7900 ICP-MS ICP-MS FTIR Agilent 7900 ICP-MS Agilent Cary 7000 (UMS)
MP-AES ICP-QQQ Agilent 5100 ICP-OES Agilent 5100 (SVDV) ICP-OES (DSC) 1 5100 SVDV ICP-OES VistaChip II CCD Agilent 7900 ICP-MS 7700 / 10 7900 ICP-MS ICP-MS FTIR Agilent 7900 ICP-MS Agilent Cary 7000 (UMS)
フォルハルト法 NH SCN の標準液または KSCN の標準液を用い,Ag または Hg を直接沈殿滴定する方法 および Cl, Br, I, CN, 試料溶液に Fe SCN, S 2 を指示薬として加える 例 : Cl の逆滴定による定量 などを逆滴定する方法をいう Fe を加えた試料液に硝酸
 沈殿滴定とモール法 沈殿滴定沈殿とは溶液に試薬を加えたり加熱や冷却をしたとき, 溶液から不溶性固体が分離する現象, またはその不溶性固体を沈殿という 不溶性固体は, 液底に沈んでいいても微粒子 ( コロイド ) として液中を浮遊していても沈殿と呼ばれる 沈殿滴定とは沈殿が生成あるいは消失する反応を利用した滴定のことをいう 沈殿が生成し始めた点, 沈殿の生成が完了した点, または沈殿が消失した点が滴定の終点となる
沈殿滴定とモール法 沈殿滴定沈殿とは溶液に試薬を加えたり加熱や冷却をしたとき, 溶液から不溶性固体が分離する現象, またはその不溶性固体を沈殿という 不溶性固体は, 液底に沈んでいいても微粒子 ( コロイド ) として液中を浮遊していても沈殿と呼ばれる 沈殿滴定とは沈殿が生成あるいは消失する反応を利用した滴定のことをいう 沈殿が生成し始めた点, 沈殿の生成が完了した点, または沈殿が消失した点が滴定の終点となる
Taro-renshu1
 1 覚えたい元素記号と化学式何度も繰り返して覚えよう! 元素記号 [ ] は原子番号を示す 44! これだけ覚えれば, 大学入試も完璧です [1] 水素 H [16] 硫黄 ( イオウ ) S 臭素 Br [2] ヘリウム He [17] 塩素 Cl クリプトン Kr [3] リチウム Li [18] アルゴン Ar ストロンチウム Sr [4] ベリリウム Be [19] カリウム K 銀 Ag
1 覚えたい元素記号と化学式何度も繰り返して覚えよう! 元素記号 [ ] は原子番号を示す 44! これだけ覚えれば, 大学入試も完璧です [1] 水素 H [16] 硫黄 ( イオウ ) S 臭素 Br [2] ヘリウム He [17] 塩素 Cl クリプトン Kr [3] リチウム Li [18] アルゴン Ar ストロンチウム Sr [4] ベリリウム Be [19] カリウム K 銀 Ag
コロイド化学と界面化学
 x 25 1 kg 1 kg = 1 l mmol dm -3 ----- 1000 mg CO 2 -------------------------------------250 mg Li + --------------------------------1 mg Sr 2+ -------------------- 10
x 25 1 kg 1 kg = 1 l mmol dm -3 ----- 1000 mg CO 2 -------------------------------------250 mg Li + --------------------------------1 mg Sr 2+ -------------------- 10
化学I
 化学 I 第 4 章 分子の構造 ( その 2) http://acbio2.acbio.u-fukui.ac.jp/indphy/hisada/chemistryi/ 授業計画 1 回物質観の進歩と自然科学の発展 2 回原子の電子構造 - 電子, 陽子, 原子量 - 3 回水素原子の電子スペクトル 4 回 Bohr の水素原子模型 5 回物質の波動性 6 回量子数 7 回原子の電子配置と周期律表
化学 I 第 4 章 分子の構造 ( その 2) http://acbio2.acbio.u-fukui.ac.jp/indphy/hisada/chemistryi/ 授業計画 1 回物質観の進歩と自然科学の発展 2 回原子の電子構造 - 電子, 陽子, 原子量 - 3 回水素原子の電子スペクトル 4 回 Bohr の水素原子模型 5 回物質の波動性 6 回量子数 7 回原子の電子配置と周期律表
登録プログラムの名称 登録番号 初回登録日 最新交付日 登録された事業所の名称及び所在地 問い合わせ窓口 JCSS JCSS 年 12 月 1 日 2018 年 5 月 23 日公益社団法人日本アイソトープ協会川崎技術開発センター 神奈川県川崎市川崎区殿町三丁目
 登録プログラムの名称 登録番号 初回登録日 最新交付日 登録された事業所の名称及び所在地 問い合わせ窓口 JCSS JCSS0061 1995 年 12 月 1 日 2018 年 5 月 23 日公益社団法人日本アイソトープ協会川崎技術開発センター 210-0821 神奈川県川崎市川崎区殿町三丁目 25 番 20 号法人番号 7010005018674 研究開発課 Tel: 044-589-5494
登録プログラムの名称 登録番号 初回登録日 最新交付日 登録された事業所の名称及び所在地 問い合わせ窓口 JCSS JCSS0061 1995 年 12 月 1 日 2018 年 5 月 23 日公益社団法人日本アイソトープ協会川崎技術開発センター 210-0821 神奈川県川崎市川崎区殿町三丁目 25 番 20 号法人番号 7010005018674 研究開発課 Tel: 044-589-5494
危険物取扱者 乙種第4類 基礎物理・基礎化学 練習問題1
 危険物取扱者乙種第 4 類 基礎物理 基礎化学練習問題 1 問題 1 水の説明として 間違っているものは次のうちどれか 1. 水の蒸発熱は非常に大きいので 消火には適さない 2. 水の分子式は H2O である 3. 水は 4 で体積が最小となる 4. 水はガソリンと混ぜると下に沈む 5. 1 気圧 4 の水が 比重 1 と定められている 問題 2 酸化と還元の説明で 間違っているものは次のうちどれか
危険物取扱者乙種第 4 類 基礎物理 基礎化学練習問題 1 問題 1 水の説明として 間違っているものは次のうちどれか 1. 水の蒸発熱は非常に大きいので 消火には適さない 2. 水の分子式は H2O である 3. 水は 4 で体積が最小となる 4. 水はガソリンと混ぜると下に沈む 5. 1 気圧 4 の水が 比重 1 と定められている 問題 2 酸化と還元の説明で 間違っているものは次のうちどれか
木村の有機化学小ネタ セルロース系再生繊維 再生繊維セルロースなど天然高分子物質を化学的処理により溶解後, 細孔から押し出し ( 紡糸 という), 再凝固させて繊維としたもの セルロース系の再生繊維には, ビスコースレーヨン, 銅アンモニア
 セルロース系再生繊維 再生繊維セルロースなど天然高分子物質を化学的処理により溶解後, 細孔から押し出し ( 紡糸 という), 再凝固させて繊維としたもの セルロース系の再生繊維には, ビスコースレーヨン, 銅アンモニアレーヨンがあり, タンパク質系では, カゼイン, 大豆タンパク質, 絹の糸くず, くず繭などからの再生繊維がある これに対し, セルロースなど天然の高分子物質の誘導体を紡糸して繊維としたものを半合成繊維と呼び,
セルロース系再生繊維 再生繊維セルロースなど天然高分子物質を化学的処理により溶解後, 細孔から押し出し ( 紡糸 という), 再凝固させて繊維としたもの セルロース系の再生繊維には, ビスコースレーヨン, 銅アンモニアレーヨンがあり, タンパク質系では, カゼイン, 大豆タンパク質, 絹の糸くず, くず繭などからの再生繊維がある これに対し, セルロースなど天然の高分子物質の誘導体を紡糸して繊維としたものを半合成繊維と呼び,
untitled
 NPO 2006( ) 11 14 ( ) (2006/12/3) 1 50% % - - (CO+H2) ( ) 6 44 1) --- 2) ( CO H2 ) 2 3 3 90 3 3 2 3 2004 ( ) 1 1 4 1 20% 5 ( ) ( ) 2 6 MAWERA ) MAWERA ( ) ( ) 7 6MW -- 175kW 8 ( ) 900 10 2 2 2 9 -- - 10
NPO 2006( ) 11 14 ( ) (2006/12/3) 1 50% % - - (CO+H2) ( ) 6 44 1) --- 2) ( CO H2 ) 2 3 3 90 3 3 2 3 2004 ( ) 1 1 4 1 20% 5 ( ) ( ) 2 6 MAWERA ) MAWERA ( ) ( ) 7 6MW -- 175kW 8 ( ) 900 10 2 2 2 9 -- - 10
CERT化学2013前期_問題
 [1] から [6] のうち 5 問を選んで解答用紙に解答せよ. いずれも 20 点の配点である.5 問を超えて解答した場合, 正答していれば成績評価に加算する. 有効数字を適切に処理せよ. 断りのない限り大気圧は 1013 hpa とする. 0 C = 273 K,1 cal = 4.184 J,1 atm = 1013 hpa = 760 mmhg, 重力加速度は 9.806 m s 2, 気体
[1] から [6] のうち 5 問を選んで解答用紙に解答せよ. いずれも 20 点の配点である.5 問を超えて解答した場合, 正答していれば成績評価に加算する. 有効数字を適切に処理せよ. 断りのない限り大気圧は 1013 hpa とする. 0 C = 273 K,1 cal = 4.184 J,1 atm = 1013 hpa = 760 mmhg, 重力加速度は 9.806 m s 2, 気体
FdData理科3年
 FdData 中間期末 : 中学理科 3 年 : 中和 [ 中和とイオン数の変化 ] [ 問題 ](2 学期中間 ) 次の図は A 液に B 液を加えたときのようすを示している A 液は塩酸,B 液は水酸化ナトリウム水溶液である (1) 1~4 の水溶液はそれぞれ何性か (2) 4 の水溶液にフェノールフタレイン溶液を加えると何色になるか (3) 塩酸 (A 液 ) に水酸化ナトリウム水溶液 (B
FdData 中間期末 : 中学理科 3 年 : 中和 [ 中和とイオン数の変化 ] [ 問題 ](2 学期中間 ) 次の図は A 液に B 液を加えたときのようすを示している A 液は塩酸,B 液は水酸化ナトリウム水溶液である (1) 1~4 の水溶液はそれぞれ何性か (2) 4 の水溶液にフェノールフタレイン溶液を加えると何色になるか (3) 塩酸 (A 液 ) に水酸化ナトリウム水溶液 (B
FdText理科1年
 中学理科 3 年 : 酸とアルカリ [ http://www.fdtext.com/dat/ ] [ 要点 ] 酸の性質 青色リトマスを赤に変える BTB 溶液を黄色に変える あえん金属 ( 亜鉛, マグネシウム, 鉄など ) と反応して水素を発生させる アルカリの性質 赤色リトマスを青色に変える BTB 溶液を青色に変える フェノールフタレイン溶液を赤色に変える ひふタンパク質をとかす ( 皮膚につけるとぬるぬるする
中学理科 3 年 : 酸とアルカリ [ http://www.fdtext.com/dat/ ] [ 要点 ] 酸の性質 青色リトマスを赤に変える BTB 溶液を黄色に変える あえん金属 ( 亜鉛, マグネシウム, 鉄など ) と反応して水素を発生させる アルカリの性質 赤色リトマスを青色に変える BTB 溶液を青色に変える フェノールフタレイン溶液を赤色に変える ひふタンパク質をとかす ( 皮膚につけるとぬるぬるする
物理化学I-第12回(13).ppt
 I- 12-1 11 11.1 2Mg(s) + O 2 (g) 2MgO(s) [Mg 2+ O 2 ] Zn(s) + Cu 2+ (aq) Zn 2+ (aq) + Cu(s) - 2Mg(s) 2Mg 2+ (s) + 4e +) O 2 (g) + 4e 2O 2 (s) 2Mg(s) + O 2 (g) 2MgO(s) Zn(s) Zn 2+ (aq) + 2e +) Cu 2+ (aq)
I- 12-1 11 11.1 2Mg(s) + O 2 (g) 2MgO(s) [Mg 2+ O 2 ] Zn(s) + Cu 2+ (aq) Zn 2+ (aq) + Cu(s) - 2Mg(s) 2Mg 2+ (s) + 4e +) O 2 (g) + 4e 2O 2 (s) 2Mg(s) + O 2 (g) 2MgO(s) Zn(s) Zn 2+ (aq) + 2e +) Cu 2+ (aq)
JAJP
 Agilent 7500ce ORS ICP-MS Glenn Woods Agilent Technologies Ltd. 5500 Lakeside, Cheadle Royal Business Park Stockport UK Agilent 7500ce ICP-MS 5 7500ce (ORS) 1 ORS 7500ce ORS ICP-MS ( ) 7500 ICP-MS (27.12
Agilent 7500ce ORS ICP-MS Glenn Woods Agilent Technologies Ltd. 5500 Lakeside, Cheadle Royal Business Park Stockport UK Agilent 7500ce ICP-MS 5 7500ce (ORS) 1 ORS 7500ce ORS ICP-MS ( ) 7500 ICP-MS (27.12
Microsoft Word - 酸塩基
 化学基礎実験 : 酸 塩基と (1) 酸と塩基 の基本を学び の実験を通してこれらの事柄に関する認識を深めます さらに 緩衝液の性質に ついて学び 緩衝液の 変化に対する緩衝力を実験で確かめます 化学基礎実験 : 酸 塩基と 酸と塩基 水の解離 HCl H Cl - 塩酸 塩素イオン 酸 強酸 ヒドロニウムイオン H 3 O H O H OH - OH ー [H ] = [OH - ]= 1-7 M
化学基礎実験 : 酸 塩基と (1) 酸と塩基 の基本を学び の実験を通してこれらの事柄に関する認識を深めます さらに 緩衝液の性質に ついて学び 緩衝液の 変化に対する緩衝力を実験で確かめます 化学基礎実験 : 酸 塩基と 酸と塩基 水の解離 HCl H Cl - 塩酸 塩素イオン 酸 強酸 ヒドロニウムイオン H 3 O H O H OH - OH ー [H ] = [OH - ]= 1-7 M
現場での微量分析に最適 シリーズ Spectroquant 試薬キットシリーズ 専用装置シリーズ 主な測定項目 下水 / 廃水 アンモニア 亜硝酸 硝酸 リン酸 TNP COD Cr 重金属 揮発性有機酸 陰イオン / 陽イオン界面活性剤 等 上水 / 簡易水道 残留塩素 アンモニア 鉄 マンガン
 現場での微量分析に最適 シリーズ Spectroquant 試薬キットシリーズ 専用装置シリーズ 主な測定項目 下水 / 廃水 アンモニア 亜硝酸 硝酸 リン酸 TNP COD Cr 重金属 揮発性有機酸 陰イオン / 陽イオン界面活性剤 等 上水 / 簡易水道 残留塩素 アンモニア 鉄 マンガン カドミウム 鉛 六価クロム シアン化物等 飲料 用水管理 残留塩素 鉄 マンガン 等 ボイラー シリカ
現場での微量分析に最適 シリーズ Spectroquant 試薬キットシリーズ 専用装置シリーズ 主な測定項目 下水 / 廃水 アンモニア 亜硝酸 硝酸 リン酸 TNP COD Cr 重金属 揮発性有機酸 陰イオン / 陽イオン界面活性剤 等 上水 / 簡易水道 残留塩素 アンモニア 鉄 マンガン カドミウム 鉛 六価クロム シアン化物等 飲料 用水管理 残留塩素 鉄 マンガン 等 ボイラー シリカ
化学I
 化学 I 第 3 章 化学結合 ( その 2) http://acbio2.acbio.u-fukui.ac.jp/indphy/hisada/chemistryi/ 補講の予定 6 月 18 日 ( 金 )4 限 (118M 講義室 ) 7 月 2 日 ( 金 )3 限 (115M 講義室 ) 7 月 16 日 ( 金 )3 限 (118M 講義室 ) 7 月 23 日 ( 金 )3 限 (118M
化学 I 第 3 章 化学結合 ( その 2) http://acbio2.acbio.u-fukui.ac.jp/indphy/hisada/chemistryi/ 補講の予定 6 月 18 日 ( 金 )4 限 (118M 講義室 ) 7 月 2 日 ( 金 )3 限 (115M 講義室 ) 7 月 16 日 ( 金 )3 限 (118M 講義室 ) 7 月 23 日 ( 金 )3 限 (118M
木村の化学重要問題集 01 解答編解説補充 H S H HS ( 第 1 電離平衡 ) HS H S ( 第 電離平衡 ) そこで溶液を中性または塩基性にすることにより, つまり [ H ] を小さくすることにより, 上の電離平衡を右に片寄らせ,[ S ] を大きくする 193. 陽イオン分析 配位
![木村の化学重要問題集 01 解答編解説補充 H S H HS ( 第 1 電離平衡 ) HS H S ( 第 電離平衡 ) そこで溶液を中性または塩基性にすることにより, つまり [ H ] を小さくすることにより, 上の電離平衡を右に片寄らせ,[ S ] を大きくする 193. 陽イオン分析 配位 木村の化学重要問題集 01 解答編解説補充 H S H HS ( 第 1 電離平衡 ) HS H S ( 第 電離平衡 ) そこで溶液を中性または塩基性にすることにより, つまり [ H ] を小さくすることにより, 上の電離平衡を右に片寄らせ,[ S ] を大きくする 193. 陽イオン分析 配位](/thumbs/91/107310906.jpg) 木村の化学重要問題集 01 解答編解説補充 1. 無機物質の性質 反応 187. 気体の製法と性質補足ネスラー試薬とアンモニアの反応 1.. ネスラー試薬 [ HgI ] の調製 KI KI Hg ¾¾ HgI ¾¾ [ HgI ] 赤色沈殿. ネスラー試薬とアンモニアの反応 [ HgI ] ( NH ) [ ] NH HgI ( 微量 : 黄色, 多量 : 赤褐色 ) 190. 陽イオンの分離と性質
木村の化学重要問題集 01 解答編解説補充 1. 無機物質の性質 反応 187. 気体の製法と性質補足ネスラー試薬とアンモニアの反応 1.. ネスラー試薬 [ HgI ] の調製 KI KI Hg ¾¾ HgI ¾¾ [ HgI ] 赤色沈殿. ネスラー試薬とアンモニアの反応 [ HgI ] ( NH ) [ ] NH HgI ( 微量 : 黄色, 多量 : 赤褐色 ) 190. 陽イオンの分離と性質
Microsoft PowerPoint - D.酸塩基(2)
 D. 酸塩基 (2) 1. 多塩基酸の ph 2. 塩の濃度と ph 3. 緩衝溶液と ph 4. 溶解度積と ph 5. 酸塩基指示薬 D. 酸塩基 (2) 1. 多塩基酸の ph 1. 多塩基酸の ph (1) 硫酸 H 2 SO 4 ( 濃度 C) 硫酸 H 2 SO 4 は2 段階で電離する K (C) (C) K a1 [H+ ][HSO 4 ] [H 2 SO 4 ] 10 5 第 1
D. 酸塩基 (2) 1. 多塩基酸の ph 2. 塩の濃度と ph 3. 緩衝溶液と ph 4. 溶解度積と ph 5. 酸塩基指示薬 D. 酸塩基 (2) 1. 多塩基酸の ph 1. 多塩基酸の ph (1) 硫酸 H 2 SO 4 ( 濃度 C) 硫酸 H 2 SO 4 は2 段階で電離する K (C) (C) K a1 [H+ ][HSO 4 ] [H 2 SO 4 ] 10 5 第 1
スライド 1
 無機化学 II 第 3 回 化学結合 本日のポイント 分子軌道 原子が近づく 原子軌道が重なる 軌道が重なると, 原子軌道が組み合わさって 分子軌道 というものに変化 ( 分子に広がる ) 結合性軌道と反結合性軌道 軌道の重なりが大きい = エネルギー変化が大 分子軌道に電子が詰まった時に, 元の原子よりエネルギーが下がるなら結合を作る. 混成軌道と原子価結合法 ( もっと単純な考え方 ) わかりやすく,
無機化学 II 第 3 回 化学結合 本日のポイント 分子軌道 原子が近づく 原子軌道が重なる 軌道が重なると, 原子軌道が組み合わさって 分子軌道 というものに変化 ( 分子に広がる ) 結合性軌道と反結合性軌道 軌道の重なりが大きい = エネルギー変化が大 分子軌道に電子が詰まった時に, 元の原子よりエネルギーが下がるなら結合を作る. 混成軌道と原子価結合法 ( もっと単純な考え方 ) わかりやすく,
スライド 1
 基礎無機化学第 10 回 分子構造と結合 (II) 結合長, 結合の強さ, ケテラーの三角形,VSEPR 本日のポイント 結合長と結合の強さ結合が強い方が結合が短い. 周期表の下の方ほど結合は弱い. 非共有電子対の反発があると結合は弱い. 分極した結合は強い. ケテラーの三角形結合している原子の電気陰性度を見て, 金属結合 共有結合 イオン結合を区別. VSEPR: 分子全体の形を単純な規則で予想結合の電子対同士は反発する.
基礎無機化学第 10 回 分子構造と結合 (II) 結合長, 結合の強さ, ケテラーの三角形,VSEPR 本日のポイント 結合長と結合の強さ結合が強い方が結合が短い. 周期表の下の方ほど結合は弱い. 非共有電子対の反発があると結合は弱い. 分極した結合は強い. ケテラーの三角形結合している原子の電気陰性度を見て, 金属結合 共有結合 イオン結合を区別. VSEPR: 分子全体の形を単純な規則で予想結合の電子対同士は反発する.
スライド 1
 基礎無機化学第 8 回 原子パラメーター (II) 電子親和力, 電気陰性度, 分極率 本日のポイント 電子親和力 : 追加の電子の受け取りやすさ基本的に周期表の右の方が大きいハロゲンあたりで最大, 希ガスでは負 電気陰性度 : 結合を作った時の電子を引っ張る強さ値が大きいと, 結合相手から電子を引っ張る値の差の大きい原子間での結合 イオン的イオン化エネルギーと電子親和力の平均に近い 分極率 : 電子の分布がどのくらい変化しやすいか周期表の左,
基礎無機化学第 8 回 原子パラメーター (II) 電子親和力, 電気陰性度, 分極率 本日のポイント 電子親和力 : 追加の電子の受け取りやすさ基本的に周期表の右の方が大きいハロゲンあたりで最大, 希ガスでは負 電気陰性度 : 結合を作った時の電子を引っ張る強さ値が大きいと, 結合相手から電子を引っ張る値の差の大きい原子間での結合 イオン的イオン化エネルギーと電子親和力の平均に近い 分極率 : 電子の分布がどのくらい変化しやすいか周期表の左,
Microsoft Word - basic_15.doc
 分析の原理 15 電位差測定装置の原理と応用 概要 電位差測定法は 溶液内の目的成分の濃度 ( 活量 ) を作用電極と参照電極の起電力差から測定し 溶液中のイオン濃度や酸化還元電位の測定に利用されています また 滴定と組み合わせて当量点の決定を電極電位変化より行う電位差滴定法もあり 電気化学測定法の一つとして古くから研究 応用されています 本編では 電位差測定装置の原理を解説し その応用装置である
分析の原理 15 電位差測定装置の原理と応用 概要 電位差測定法は 溶液内の目的成分の濃度 ( 活量 ) を作用電極と参照電極の起電力差から測定し 溶液中のイオン濃度や酸化還元電位の測定に利用されています また 滴定と組み合わせて当量点の決定を電極電位変化より行う電位差滴定法もあり 電気化学測定法の一つとして古くから研究 応用されています 本編では 電位差測定装置の原理を解説し その応用装置である
Crystals( 光学結晶 ) 価格表 台形状プリズム (ATR 用 ) (\, 税別 ) 長さ x 幅 x 厚み KRS-5 Ge ZnSe (mm) 再研磨 x 20 x 1 62,400 67,200 40,000 58,000
 Crystals( 光学結晶 ) 2011.01.01 価格表 台形状プリズム (ATR 用 ) (\, 税別 ) 長さ x 幅 x 厚み KRS-5 Ge ZnSe (mm) 45 60 再研磨 45 60 45 60 50 x 20 x 1 62,400 67,200 40,000 58,000 58,000 88,000 88,000 50 x 20 x 2 58,000 58,000 40,000
Crystals( 光学結晶 ) 2011.01.01 価格表 台形状プリズム (ATR 用 ) (\, 税別 ) 長さ x 幅 x 厚み KRS-5 Ge ZnSe (mm) 45 60 再研磨 45 60 45 60 50 x 20 x 1 62,400 67,200 40,000 58,000 58,000 88,000 88,000 50 x 20 x 2 58,000 58,000 40,000
Taro-renshu2
 1 覚えたい元素記号と化学式 元素名を見て元素記号が書けるように, 元素記号を見て元素名が書けるように, 何度も繰り返して覚えてしまおう 元素記号は, 一文字目は大文字の活字体で書く 二文字目は小文字で書くが 筆記体で書いてもよい 数字の1とまぎらわしいので, 小文字の l は筆記体で書いた方がよい 元素記号を覚えたら, 次に 1H から 20Ca までを周期表の形で書けるようにしよう * 語呂合わせで順番を覚えるとよい
1 覚えたい元素記号と化学式 元素名を見て元素記号が書けるように, 元素記号を見て元素名が書けるように, 何度も繰り返して覚えてしまおう 元素記号は, 一文字目は大文字の活字体で書く 二文字目は小文字で書くが 筆記体で書いてもよい 数字の1とまぎらわしいので, 小文字の l は筆記体で書いた方がよい 元素記号を覚えたら, 次に 1H から 20Ca までを周期表の形で書けるようにしよう * 語呂合わせで順番を覚えるとよい
イオンクロマトグラフィー ION CHROMATOGRAPHY イオンクロマトグラフィー 陰イオン分析用カラム (IC-2010 専用 ) TSKgel SuperIC-Anion HS TSKgel SuperIC-AZ TSKgel SuperIC-AP P.122 P.123 TSKgel S
 陰イオン分析用カラム (IC- 専用 ) TSKgel SuperIC-Anion HS TSKgel SuperIC-AZ TSKgel SuperIC-AP P. P. TSKgel SuperIC-Anion 陽イオン分析用カラム (IC- 専用 ) TSKgel SuperIC-Cation HS Ⅱ TSKgel SuperIC-Cation HS P. P. TSKgel SuperIC-CR
陰イオン分析用カラム (IC- 専用 ) TSKgel SuperIC-Anion HS TSKgel SuperIC-AZ TSKgel SuperIC-AP P. P. TSKgel SuperIC-Anion 陽イオン分析用カラム (IC- 専用 ) TSKgel SuperIC-Cation HS Ⅱ TSKgel SuperIC-Cation HS P. P. TSKgel SuperIC-CR
 2 1 7 - TALK ABOUT 21 μ TALK ABOUT 21 Ag As Se 2. 2. 2. Ag As Se 1 2 3 4 5 6 7 8 9 1 1 2 3 4 5 6 7 8 9 1 1 2 3 4 5 6 7 8 9 1 Sb Ga Te 2. Sb 2. Ga 2. Te 1 2 3 4 5 6 7 8 9 1 1 2 3 4 5 6 7 8 9 1 1 2 3 4
2 1 7 - TALK ABOUT 21 μ TALK ABOUT 21 Ag As Se 2. 2. 2. Ag As Se 1 2 3 4 5 6 7 8 9 1 1 2 3 4 5 6 7 8 9 1 1 2 3 4 5 6 7 8 9 1 Sb Ga Te 2. Sb 2. Ga 2. Te 1 2 3 4 5 6 7 8 9 1 1 2 3 4 5 6 7 8 9 1 1 2 3 4
Microsoft Word - 化学系演習 aG.docx
 有機化学反応の基礎 () 芳香族化合物 ) 芳香族化合物の性質 ベンゼンに代表される芳香族化合物は 環構造を構成する原子すべてが p 軌道をもち 隣同士の原子間で p 軌道が重なり合うことができるので 電子が非局在化 ( 共鳴安定化 ) している 芳香族性をもつため 求電子付加反応ではなく求電子置換反応を起こしやすい 全ての炭素が sp ² 混成 π 結合 p 軌道 π 電子がドーナツ状に分布し 極めて安定
有機化学反応の基礎 () 芳香族化合物 ) 芳香族化合物の性質 ベンゼンに代表される芳香族化合物は 環構造を構成する原子すべてが p 軌道をもち 隣同士の原子間で p 軌道が重なり合うことができるので 電子が非局在化 ( 共鳴安定化 ) している 芳香族性をもつため 求電子付加反応ではなく求電子置換反応を起こしやすい 全ての炭素が sp ² 混成 π 結合 p 軌道 π 電子がドーナツ状に分布し 極めて安定
Microsoft PowerPoint プレゼン資料(基礎)Rev.1.ppt [互換モード]
![Microsoft PowerPoint プレゼン資料(基礎)Rev.1.ppt [互換モード] Microsoft PowerPoint プレゼン資料(基礎)Rev.1.ppt [互換モード]](/thumbs/104/162320494.jpg) プレゼン資料 腐食と電気防食 本資料は当社独自の技術情報を含みますが 公開できる範囲としています より詳細な内容をご希望される場合は お問い合わせ よりご連絡願います 腐食とは何か? 金属材料は金や白金などの一部の貴金属を除き, 自然界にそのままの状態で存在するものではありません 多くは酸化物や硫化物の形で存在する鉱石から製造して得られるものです 鉄の場合は鉄鉱石を原料として精錬することにより製造されます
プレゼン資料 腐食と電気防食 本資料は当社独自の技術情報を含みますが 公開できる範囲としています より詳細な内容をご希望される場合は お問い合わせ よりご連絡願います 腐食とは何か? 金属材料は金や白金などの一部の貴金属を除き, 自然界にそのままの状態で存在するものではありません 多くは酸化物や硫化物の形で存在する鉱石から製造して得られるものです 鉄の場合は鉄鉱石を原料として精錬することにより製造されます
Microsoft PowerPoint - 02_14OCT2015配付資料.ppt
 化学 Ⅱ 2015 年 10 月 ~2016 年 2 月 水曜日 1 時間目 121M 講義室第 2 回 10 月 1 日イオン結晶, 共有結晶第 8 回目は中間試験ですが,11 月 25 日ではなく,11 月 20 日金曜日 時間目の補講枠を使ってK110 教室で試験を行います したがって 11 月 25 日 ( 水 )1 時間目は授業がありません 充填率 担当教員 : 福井大学大学院工学研究科生物応用化学専攻
化学 Ⅱ 2015 年 10 月 ~2016 年 2 月 水曜日 1 時間目 121M 講義室第 2 回 10 月 1 日イオン結晶, 共有結晶第 8 回目は中間試験ですが,11 月 25 日ではなく,11 月 20 日金曜日 時間目の補講枠を使ってK110 教室で試験を行います したがって 11 月 25 日 ( 水 )1 時間目は授業がありません 充填率 担当教員 : 福井大学大学院工学研究科生物応用化学専攻
