相談品目の薬価基準追補収載のお知らせ
|
|
|
- ありおき たかぎ
- 7 years ago
- Views:
Transcription
1 薬価基準追補収載 ( 新薬 ) のお知らせ 平成 30 年 4 月 17 日公益社団法人福岡県薬剤師会薬事情報センター厚労省は新医薬品の薬価基準追補収載を平成 30 年 4 月 17 日に告示した 4 月 18 日から適用する 内用薬 毒 : 毒薬, 劇 : 劇薬, 処 : 処方箋医薬品, 麻 : 麻薬, 生 : 生物由来製品分類医薬品名 ( 会社名 ) 規格 単位薬価 ( 円 ) 規制備考 ( 成分, 薬効 ) 218 アトーゼット配合錠 LD HD 235 グーフィス錠 5mg (MSD) (EA ファーマ ~ エーザイ ) 1T 1T 5mg,1T ( エロビキシバットとして ) 処 処 エゼチミブ / アトルバスタチンカルシウム水和物小腸コレステロールトランスポータ阻害薬 / HMG-CoA 還元酵素阻害薬配合剤エゼチミブアトルバスタチンとして LD 10mg 10mg HD 10mg 20mg 適応は 高コレステロール血症 家族性高コレステロール血症 成人は 1 日 1 回 1 錠 ( エゼチミブ / アトルバスタチンとして10mg/10mg 又は10mg/20mg) を食後に投与 重篤な肝機能障害者及び肝代謝能が低下していると考えられる患者 ( 急性肝炎 慢性肝炎の急性増悪 肝硬変 肝癌 黄疸 ) 妊婦又は妊娠している可能性のある婦人及び授乳婦 テラプレビル オムビタスビル パリタプレビル リトナビルを投与中の患者は禁忌 腎機能に関する臨床検査値に異常が認められる患者に 本剤とフィブラート系薬剤を併用する場合には 治療上やむを得ないと判断される場合にのみ併用する 新医薬品に係わる処方日数制限 (1 回 14 日分まで ) はない エロビキシバット水和物胆汁酸トランスポーター阻害薬 適応は 慢性便秘症 ( 器質的疾患による便秘を除く ) 成人は 10mgを1 日 1 回食前に投与 なお 症状により適宜増減するが 最高用量は1 日 15mgとする 薬剤性及び症候性の便秘に対する使用経験はない 投与中は腹痛や下痢があらわれるおそれがあるので 症状に応じて減量 休薬又は中止を考慮し 本剤を漫然と継続投与しないよう 定期的に本剤の投与継続の必要性を検討する 腫瘍 ヘルニア等による腸閉塞が確認されている又は疑われる患者は禁忌 P- 糖蛋白質の阻害作用を有する 回腸末端部の上皮細胞に発現している胆汁酸トランスポーター (IBAT) を阻害し 胆汁酸の再吸収を抑制することで 大腸管腔内に流入する胆汁酸の量を増加させる 胆汁酸は 大腸管腔内に水分および電解質を分泌させ さらに消化管運動を亢進させるため 本剤の便秘治療効果が発現する
2 622 サチュロ錠 100mg ( ヤンセンファーマ ) 449 シダキュアスギ花粉舌下錠 2,000JAU 5,000JAU ( 鳥居 ) 232 ネキシウム懸濁用顆粒分包 10mg 20mg 100mg,1T ( ベダキリンとして ) 2,000JAU, 1T 5,000JAU, 1T 10mg,1 包 20mg,1 包 21, 劇処ベダキリンフマル酸塩結核化学療法剤 適応菌種 : 本剤に感性の結核菌適応症 : 多剤耐性肺結核成人は 投与開始から2 週間は1 日 1 回 400mg を食直後に投与 その後 3 週以降は 1 回 200mgを週 3 回 48 時間以上の間隔をあけて食直後に投与 必ず感受性を有する既存の抗結核薬 3 剤以上に本剤を上乗せして併用する 投与期間は原則として6ヶ月で この期間を超えて使用する場合 リスクとベネフィットを考慮して投与の継続を慎重に判断する QT 延長があらわれるおそれがあるので 投与開始前及び投与中は定期的に心電図検査等を行い リスクとベネフィットを考慮して本剤の投与を慎重に判断する CYP3A4 により代謝される 結核菌のATP 合成酵素を阻害して抗菌活性を示す 本剤に対する耐性菌発現を防ぐため 結核症の治療に十分な知識と経験を持つ医師又はその指導のもとで投与し 適正使用に努める 投与は 製造販売業者が行うRAP(Responsible Access Program) に登録された医師 薬剤師のいる登録医療機関 薬局において 登録患者に対して行う 製造販売後一定期間は 全症例を対象に使用成績調査を実施する スギ花粉エキス原末処 適応は スギ花粉症 ( 減感作療法 ) 通常 投与開始後 1 週間は 舌下錠 2,000JAU を1 日 1 回 1 錠 投与 2 週目以降は 舌下錠 5,000JAUを1 日 1 回 1 錠 舌下にて1 分間保持した後 飲み込む その後 5 分間は うがいや飲食を控える 初回投与時は医師の監督のもと 投与後少なくとも30 分間は患者を安静な状態に保たせ 十分な観察を行う また ショック アナフィラキシー等の発現時に救急処置のとれる準備をしておく 低出生体重児 新生児 乳児又は5 歳未満の幼児に対する安全性は未確立 ( 使用経験がない ) 吸湿性のため 使用直前に乾いた指でブリスターシートから取り出す 舌下投与による減感作療法に関する十分な知識 経験をもつ医師によってのみ処方 使用されるとともに 本剤のリスク等について十分に管理 説明できる医師 医療機関のもとでのみ用いられ 薬局においては調剤前に当該医師 医療機関を確認した上で調剤する 新剤形 ( 既発売品は 舌下液 皮下注 ) 処 エソメプラゾールマグネシウム水和物プロトンポンプ阻害薬 適応は 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 逆流性食道炎 非びらん性胃食道逆流症 ( 分
3 ( アストラゼネカ ~ 第一三共 ) 429 リムパーザ錠 100mg 150mg ( アストラゼネカ ) 117 レキサルティ錠 1mg 2mg ( 大塚 ) ( エソメプラゾールとして ) 100mg,1T 150mg,1T 1mg,1T 2mg,1T 3, , 劇処 劇処 包 10mgのみ ) Zollinger-Ellison 症候群 非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 下記におけるヘリコバクター ピロリの除菌の補助 胃潰瘍 十二指腸潰瘍 胃 MALTリンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 顆粒分包 10mg 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger-Ellison 症候群 逆流性食道炎 非びらん性胃食道逆流症において 1 歳以上の幼児及び小児への適応あり 顆粒分包 20mg 胃潰瘍 十二指腸潰瘍 吻合部潰瘍 Zollinger-Ellison 症候群 逆流性食道炎において 体重 20kg 以上の幼児及び小児への適応あり 約 15mLの水に懸濁し 2~3 分置いて粘性が増してからの服用が望ましい 懸濁後は30 分以内に服用する 新剤形 ( 既発売品はカプゼル ) 新医薬品に係わる処方日数制限 (1 回 14 日分まで ) はない オラパリブ抗悪性腫瘍薬 ポリアデノシン5 二リン酸リボースポリメラーゼ (PARP) 阻害薬 適応は 白金系抗悪性腫瘍剤感受性の再発卵巣癌における維持療法 成人は 300mgを1 日 2 回 投与 なお 患者の状態により適宜減量する 100mg 錠と150mg 錠の生物学的同等性は示されていないため 300mgを投与する際には100mg 錠を使用しない 副作用が発現した場合には 基準を考慮して 休薬 減量する 腎機能障害者では 本剤の血中濃度が上昇するとの報告があるため 減量を考慮するとともに 患者の状態をより慎重に観察し 有害事象の発現に十分注意する 他の抗悪性腫瘍剤との併用について 有効性 安全性は未確立 主にCYP3Aにより代謝される PARPは DNA 一本鎖切断修復の主要酵素で オラパリブはヒトPARP-1 及びPARP-2に対して阻害作用を示し DNAの二本鎖切断修復機構である相同組換え修復が機能していない癌細胞に選択的に作用し 細胞死に導く 専門の医師 医療機関が投与し インフォームド コンセントを取得する 一定数の症例に係るデータが集積されるまでの間は 全症例を対象に使用成績調査を実施する ブレクスピプラゾール抗精神病薬 適応は 統合失調症 成人は 1 日 1 回 1mgから投与を開始した後 4 日以上の間隔をあけて増量し 1 日 1 回 2 mgを投与
4 外用薬 4 1 日量 4mg を超える用量での安全性は未確立 ( 使用経験が少ない ) CYP2D6 阻害剤 ( キニジン パロキセチン等 ) 及び / 又は強い CYP3A4 阻害剤 ( イトラコナゾール クラリスロマイシン等 ) を併用する場合及び CYP2D6 の活性が欠損していることが判明している患者 (Poor Metabolizer) では 本剤の血漿中濃度が上昇するおそれがあるため 用法 用量の調節を行う 高度腎機能障害者 ( クレアチニンクリアランスが 30mL/min 未満 ) 又は中等度から重度の肝機能障害者 (Child-Pugh 分類 B 又は C) では 本剤の血漿中濃度が上昇するおそれがあるため 減量又は投与間隔の延長等を考慮し 投与に際しては患者の状態を慎重に観察する 主として CYP3A4 及び CYP2D6 で代謝される セロトニン 5-HT 1A 受容体部分アゴニスト作用 セロトニン 5-HT 2A 受容体アンタゴニスト作用及びドパミン D 2 受容体部分アゴニスト作用を併せ持ち ( セロトニン - ドパミンアクティビティモジュレーター :SDAM) これらの薬理作用が臨床における有用性に寄与しているものと考えられる 分類医薬品名 ( 会社名 ) 規格 単位薬価 ( 円 ) 規制備考 ( 成分, 薬効 ) 449 アレサガテープ 4mg 8mg 注射薬 ( 久光 ) 4mg,1 枚 8mg,1 枚 処 エメダスチンフマル酸塩適応は アレルギー性鼻炎 成人は 1 回 4mg を胸部 上腕部 背部又は腹部のいずれかに貼付し 24 時間毎に貼り替える なお 症状に応じて 1 回 8mg に増量できる 眠気を催すことがあるので 自動車の運転等に従事させない 4mg 使用時と比べ 8mg 使用時には眠気の発現率が高い傾向があるため 眠気等の発現に特に注意する 貼付箇所を毎回変更する 途中で剥がれ落ちた場合は 直ちに新たな本剤を貼付する また 次の貼り替え予定時間には新たな本剤に貼り替える 新剤形 ( 既発売品はカプセル ) 分類医薬品名 ( 会社名 ) 規格 単位薬価 ( 円 ) 規制備考 ( 成分, 薬効 ) 429 イストダックス点滴静注用 10mg ( セルジーン ) 10mg,1 瓶 ( 溶解液付 ) ( 調製時の損失を考慮し過量充塡 ) 109,753 劇処ロミデプシン抗悪性腫瘍薬 ヒストン脱アセチル化酵素 (HDAC) 阻害薬 適応は 再発又は難治性の末梢性 T 細胞リンパ腫 成人は 14mg/ m2 ( 体表面積 ) を 日目に 4 時間かけて点滴静注した後 休薬 (16 ~28 日目 ) する この 28 日間を 1 サイクルとして投与を繰り返す なお 患者の状態により適宜減量する 専用溶解用液 2.2mL で溶解したときに 5mg/mL となる
5 219 イブリーフ静注 20mg ( 千寿 ~ 武田 ) 20mg,2mL, 1 瓶 ( イブプロフェンとして ) 13,012 処 5 他の抗悪性腫瘍剤との併用における有効性 安全性は未確立 肝機能障害者では 本剤の血中濃度が上昇する報告があるため 減量を考慮するとともに 患者の状態をより慎重に観察し 有害事象の発現に十分注意する 副作用が発現した場合には 基準を目安に 休薬 減量又は投与中止を考慮する 妊婦又は妊娠している可能性のある女性は禁忌 妊娠する可能性のある女性及びパートナーが妊娠する可能性のある男性には 本剤投与中及び投与終了後一定期間は 適切な避妊を行うよう指導する 主にCYP3Aにより代謝される ヒストン脱アセチル化酵素 (HDAC) の活性を阻害により ヒストン等の脱アセチル化が阻害され 細胞周期停止及びアポトーシス誘導が生じることにより 腫瘍増殖が抑制されると推測されている 詳細な作用機序は未解明 専門の医師 医療機関が投与し インフォームド コンセントを取得する イブプロフェン L-リシン適応は 未熟児動脈管開存症で保存療法 ( 水分制限 利尿剤投与等 ) が無効の場合 未熟性を伴う新生児に対して投与する 通常 3 回 初回は10mg/kg 2 回目及び3 回目は5mg/kgを15 分以上かけて24 時間間隔で静脈内投与 (1) 投与時間の上限は1 時間を目安とする (2) 無尿又は著しい乏尿 ( 尿量 :0.6mL/h/kg 未満 ) が明らかな場合は2 回目又は3 回目の投与を行わない (3) 初回又は2 回目の投与後 動脈管の閉鎖が得られた場合は 再開通の可能性と副作用のリスクを慎重に検討した上で投与継続の要否を検討する (4) 希釈して投与する場合は 日本薬局方ブドウ糖注射液 (5 又は10%) 又は日本薬局方生理食塩液を用いる (5) 中心静脈栄養と同じ静脈ラインで投与する際は 中心静脈栄養を中断し 日本薬局方ブドウ糖注射液 (5 又は10%) 又は日本薬局方生理食塩液を本剤の投与前後 15 分間かけて静脈内投与する 動脈管依存性の先天性心疾患のある患者 重篤な腎機能障害者 高度の黄疸のある患者 消化管出血のある患者 壊死性腸炎又はその疑いのある患者 頭蓋内出血のある患者 血小板減少症の患者 血液凝固障害のある患者は禁忌 主としてCYP2C9で代謝される 詳細な作用機序は不明だが プロスタグランジンの合成酵素阻害作用によるものと考えられる 一定数の症例に係るデータが集積されるまでの間は 全症例を対象に使用成績調査を実施する
6 429 テセントリク点滴静注 1200mg ( 中外 ) 449 デュピクセント皮下注 300mg シリンジ ( サノフィ ) 1,200mg, 20mL,1 瓶 300mg,2mL 1 筒 625,567 劇処生 81,640 劇処生 アテゾリズマブ ( 遺伝子組換え ) 抗悪性腫瘍薬 抗 PD-L1ヒト化モノクローナル抗体 適応は 切除不能な進行 再発の非小細胞肺癌 成人は 1 回 1200mgを60 分かけて3 週間間隔で点滴静注 なお 初回投与の忍容性が良好であれば 2 回目以降の投与時間は30 分間まで短縮できる 他の抗悪性腫瘍薬との併用および 化学療法未治療患者 術後補助化学療法における有効性 安全性は未確立 投与時には本剤 20mLを注射筒で抜き取り 日局生理食塩液約 250mLに添加し点滴静注する 副作用が発現した場合には 基準を目安に 本剤の休薬等を考慮する 間質性肺疾患があらわれ死亡に至った症例も報告されているので 初期症状 ( 呼吸困難 咳嗽 発熱等 ) の確認及び胸部 X 線検査の実施等 患者の状態を十分に観察する 異常が認められた場合には投与を中止し 副腎皮質ホルモン剤の投与等の適切な処置を行う ヒト PD-L1 に対するヒト化モノクローナル抗体で PD-L1 とその受容体である PD-1 との結合を阻害すること等により がん抗原特異的な T 細胞の細胞傷害活性を増強し 腫瘍の増殖を抑制する 専門の医師 医療機関が投与し インフォームド コンセントを取得する 一定数の症例に係るデータが集積されるまでの間は 全症例を対象に使用成績調査を実施する デュピルマブ ( 遺伝子組換え ) ヒト型抗ヒトIL-4/13 受容体モノクローナル抗体 適応は 既存治療で効果不十分なアトピー性皮膚炎 成人は 初回に600mg を皮下投与し その後は 1 回 300mgを2 週間隔で皮下投与する ステロイド外用剤やタクロリムス外用剤等の抗炎症外用剤による適切な治療を一定期間施行しても 十分な効果が得られず 強い炎症を伴う皮疹が広範囲に及ぶ患者に用いる 原則として 本剤投与時にはアトピー性皮膚炎の病変部位の状態に応じて抗炎症外用剤を併用する 本剤投与時も保湿外用剤を継続使用する 投与部位は 腹部 大腿部 上腕部 注射部位反応が報告されているので 投与毎に注射部位を変える 寄生虫感染患者は本剤の投与開始前に寄生虫感染を治療する 患者が本剤投与中に寄生虫に感染し 抗寄生虫薬による治療が無効な場合には 本剤投与を一時中止する 本剤による治療反応は 通常投与開始から16 週までには得られる 16 週までに治療反応が得られない場合は 投与中止を考慮する 小児等に対する有効性 安全性は未確立 ( 使 6
7 811 ナルベイン注 2mg 20mg ( 第一三共プロファーマ ~ 第一三共 ) 2mg,1mL, 1 管 20mg,2mL, 1 管 ( ヒドロモルフォンとして ) 725 6,340 劇処麻 用経験がない ) ヒトインターロイキン-4 及びインターロイキン-13 受容体の複合体が共有しているIL-4 受容体 αサブユニットに特異的に結合することにより IL-4 及びIL-13の両シグナル伝達を阻害する IL-4 及びIL-13はアトピー性皮膚炎の病態において重要な役割を担う2 型サイトカインである ヒドロモルフォン塩酸塩選択的 μオピオイド受容体作動薬 適応は 中等度から高度の疼痛を伴う各種癌における鎮痛 成人は 1 日 0.5~25mgを持続静脈内又は持続皮下投与 なお 症状に応じて適宜増減する 1. 注 20mg 使用時 20mg 注射液 (1.0% 製剤 ) は 2mg 注射液 (0.2% 製剤 ) の5 倍濃度であるので 製剤の切り替えは 持続注入器の注入速度 注入量を慎重に設定し 過量投与とならないように注意して使用する 2. 持続投与時 (1) 初回投与 : オピオイド鎮痛剤による治療の有無を考慮して初回投与量を設定する 1) オピオイド鎮痛剤を使用していない患者 : 1 日 0.5~1.0mgから開始し 鎮痛効果及び副作用の発現状況を観察しながら用量調節を行う 2) オピオイド鎮痛剤を使用している患者 : 他のオピオイド鎮痛剤から本剤に変更する場合には 前治療薬の投与量等を考慮し 投与量を決める 本剤の1 日用量は ヒドロモルフォンとして モルヒネ注射剤 1 日用量の1/8 量を目安とする 3) ヒドロモルフォン経口剤を使用している患者 : ヒドロモルフォン経口剤から本剤に変更する場合には ヒドロモルフォン経口剤 1 日用量の1/5 量を本剤の1 日用量の目安とする 4) フェンタニル貼付剤を使用している患者 : フェンタニル貼付剤剥離後にフェンタニルの血中濃度が50% に減少するまで17 時間以上かかることから 剥離直後の本剤の使用は避け 本剤の使用を開始するまでに フェンタニルの血中濃度が適切な濃度に低下するまでの時間をあけるとともに 本剤の低用量から投与することを考慮する (2) 増量 : 本剤投与開始後は患者の状態を観察し 適切な鎮痛効果が得られ副作用が最小となるよう用量調整を行う 増量の目安は 1 日用量の25~50% 増とする (3) 減量 : 連用中における急激な減量は 退薬症候があらわれることがあるので行わない 副作用等により減量する場合は 患者の状態を観察しながら慎重に行う (4) 投与の中止 : 退薬症候の発現を防ぐために徐々に減量する 7
8 229 ファセンラ皮下注 30mg シリンジ ( アストラゼネカ ) 423 ベスポンサ点滴静注用 1mg ( ファイザー ) 30mg,1mL, 1 筒 1mg,1 瓶 351,535 劇処生 1,307,092 毒処生 8 3. 臨時追加投与として本剤を使用する場合疼痛が増強した場合や鎮痛効果が得られている患者で突発性の疼痛が発現した場合は 直ちに本剤の1 日用量の1/24 量 (1 時間量相当分 ) を目安とし早送りによる臨時追加投与を行い 鎮痛を図る ただし 臨時追加投与を連続して行う場合は 呼吸抑制等の副作用の発現に注意する 主にグルクロン酸抱合により代謝される 新剤形 ( 既発売品は 即放錠 徐放錠 ) ベンラリズマブ ( 遺伝子組換え ) ヒト化抗 IL-5 受容体 αモノクローナル抗体 適応は 気管支喘息 ( 既存治療によっても喘息症状をコントロールできない難治の患者に限る ) 成人は 1 回 30mgを 初回 4 週後 8 週後に皮下に注射し 以降 8 週間隔で皮下注射 投与部位は 上腕部 大腿部 腹部 投与毎に注射部位を変える 1. 高用量の吸入ステロイド薬とその他の長期管理薬を併用しても 全身性ステロイド薬の投与等が必要な喘息増悪をきたす患者に本剤を追加して投与する 2. 投与前の血中好酸球数が多いほど本剤の気管支喘息増悪発現に対する抑制効果が大きい傾向が認められている また 投与前の血中好酸球数が少ない患者では 十分な気管支喘息増悪抑制効果が得られない可能性がある 本剤の作用機序及び臨床試験で認められた投与前の血中好酸球数と有効性の関係を十分に理解し 患者の血中好酸球数を考慮した上で 適応患者の選択を行う 小児等に対する安全性は未確立 寄生虫感染患者は本剤の投与開始前に寄生虫感染を治療する 患者が本剤投与中に寄生虫に感染し 抗寄生虫薬による治療が無効な場合には 本剤投与の一時中止を考慮する 好酸球及び好塩基球の細胞表面に特異的に発現しているヒトインターロイキン5 受容体 α (IL-5Rα) に特異的かつ高親和性で結合し かつ Fcドメインのフコース欠損により ナチュラルキラー細胞等のエフェクター細胞上のFcγRIIIaに高い親和性を示すために 抗体依存性細胞傷害活性が増強され IL-5Rαを発現する好酸球及び好塩基球のアポトーシスを誘導する イノツズマブオゾガマイシン ( 遺伝組換え ) 抗悪性腫瘍薬 抗腫瘍性抗生物質結合抗 CD22 モノクローナル抗体 適応は 再発又は難治性のCD22 陽性の急性リンパ性白血病 成人は 1 日目は0.8mg/m 2 ( 体表面積 ) 8 及び15 日目は0.5mg/m 2 ( 体表面積 ) を1 日 1 回 1 時間以上かけて点滴静脈内投与した後 休薬する 1サイクル目は21~28 日間 2サ
9 9 イクル目以降は 28 日間を 1 サイクルとし 投与を繰り返す 投与サイクル数は造血幹細胞移植 (HSCT) の施行予定を考慮して決定する なお 患者の状態により適宜減量する 1. 1 サイクル目の期間は原則 21 日間とするが 寛解 ( 血球数の回復の有無を問わない ) が得られた場合は 28 日間まで延長できる また 寛解 ( 血球数の回復の有無を問わない ) が得られた場合 2 サイクル目以降の 1 日目の投与量は 0.5mg/m 2 ( 体表面積 ) とする なお 骨髄中の芽球が 5% 未満で 末梢血中の白血病芽球及び髄外病変が消失した場合に 寛解 ( 血球数の回復の有無を問わない ) が得られたと判断する 2. 本剤の投与サイクル数は 以下のとおり (1)HSCT の施行を予定している場合投与サイクル数の増加に応じて HSCT 施行後の静脈閉塞性肝疾患 (VOD)/ 類洞閉塞症候群 (SOS) の発現リスクが高まるおそれがあるので 本剤の効果が得られる最小限のサイクル数とする 治療上やむを得ないと判断される場合を除き 3 サイクル終了までに投与を中止する (2)HSCT の施行を予定していない場合 6 サイクルまで投与を繰り返すことができる ただし 3 サイクル終了までに本剤の効果が得られない場合には 投与を中止する 3. 本剤を 7 サイクル以上投与した際の有効性 安全性は未確立 4. 副作用により本剤を休薬 減量 中止する場合には 基準を考慮する なお 減量を行った場合は 再度増量しない 他の抗悪性腫瘍剤との併用について有効性 安全性は未確立 VOD/SOS を含む肝障害があらわれることがあり 死亡に至った例も報告されているので 定期的に肝機能検査を行うとともに 患者の状態を十分に観察し VOD/SOS を含む肝障害の徴候や症状の発現に注意する 本剤投与による HSCT 施行後の全生存期間への影響は 既存の化学療法と同程度ではない可能性が示唆されていることから HSCT の施行を予定している患者に対する本剤の投与については 本剤以外の治療の実施を十分検討した上で 慎重に判断する CD22 抗原を発現した白血病細胞に結合し細胞内に取り込まれた後に 加水分解を受けて生じた N- アセチル -γ- カリケアマイシンジメチルヒドラジドのジスルフィド結合が還元的に開裂され活性体となり DNA 二本鎖を切断することにより腫瘍増殖抑制作用を示す 専門の医師 医療機関が投与し インフォームド コンセントを取得する 一定数の症例に係るデータが集積されるまでの間は 全症例を対象に使用成績調査を実施する
10 10
厚生労働省告示024号/平成22年1月22日告示/平成22年1月22日施行
 厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
用法・用量DB
 データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
使用薬剤の薬価(薬価基準)の一部改正等について(厚生労働省保険局医療課:H )
 事務連絡 平成 30 年 4 月 17 日 別記関係団体御中 厚生労働省保険局医療課 使用薬剤の薬価 ( 薬価基準 ) の一部改正等について 標記について 別添のとおり地方厚生 ( 支 ) 局医療課長 都道府県民生主管部 ( 局 ) 国 民健康保険主管課 ( 部 ) 長及び都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管 課 ( 部 ) 長あて通知しましたのでお知らせいたします [ 別記
事務連絡 平成 30 年 4 月 17 日 別記関係団体御中 厚生労働省保険局医療課 使用薬剤の薬価 ( 薬価基準 ) の一部改正等について 標記について 別添のとおり地方厚生 ( 支 ) 局医療課長 都道府県民生主管部 ( 局 ) 国 民健康保険主管課 ( 部 ) 長及び都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管 課 ( 部 ) 長あて通知しましたのでお知らせいたします [ 別記
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
中医協総 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適
 中医協総 - 3 3 1. 3. 2 7 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適用に係る今後の対応について 再生医療等製品の保険適用に関する当面の間の対応 薬事法改正後に承認 ( 条件
中医協総 - 3 3 1. 3. 2 7 再生医療等製品の医療保険上の取扱いについて 再生医療等製品の保険適用に係る取扱いについては 平成 26 年 11 月 5 日の中医協総会において 以下のとおり了承されたところ < 平成 26 年 11 月 5 日中医協総 -2-1( 抜粋 )> 1. 保険適用に係る今後の対応について 再生医療等製品の保険適用に関する当面の間の対応 薬事法改正後に承認 ( 条件
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
< F2D F289BF8AEE8F808D908EA CA926D>
 保医発 0912 第 1 号平成 23 年 9 月 12 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 使用薬剤の薬価 ( 薬価基準 ) 等の一部改正について 使用薬剤の薬価( 薬価基準 ) ( 平成 20 年厚生労働省告示第 60 号
保医発 0912 第 1 号平成 23 年 9 月 12 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 使用薬剤の薬価 ( 薬価基準 ) 等の一部改正について 使用薬剤の薬価( 薬価基準 ) ( 平成 20 年厚生労働省告示第 60 号
<4D F736F F D DC58F4994C5817A53544C2094E789BA928D5F8AB38ED28CFC834B F94CC94848CB392C78B4C C5292E646F63>
 ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
< F2D C D838A8BDB92CA926D2E6A7464>
 保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
<4D F736F F D DC58F4994C5817A54524D5F8AB38ED28CFC88E396F B CF8945C8CF889CA92C789C1816A5F3294C52E646
 患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
第1回肝炎診療ガイドライン作成委員会議事要旨(案)
 資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
患者向医薬品ガイド 2019 年 5 月改訂 デュピクセント皮下注 300mg シリンジ この薬は? 販売名一般名含有量 (1 製剤中 ) デュピクセント皮下注 300mg シリンジ Dupixent 300mg Syringe for S.C. Injection デュピルマブ ( 遺伝子組換え
 患者向医薬品ガイド 2019 年 5 月改訂 デュピクセント皮下注 300mg シリンジ この薬は? 販売名一般名含有量 (1 製剤中 ) デュピクセント皮下注 300mg シリンジ Dupixent 300mg Syringe for S.C. Injection デュピルマブ ( 遺伝子組換え ) Dupilumab(Genetical Recombination) 300mg 患者向医薬品ガイドについて
患者向医薬品ガイド 2019 年 5 月改訂 デュピクセント皮下注 300mg シリンジ この薬は? 販売名一般名含有量 (1 製剤中 ) デュピクセント皮下注 300mg シリンジ Dupixent 300mg Syringe for S.C. Injection デュピルマブ ( 遺伝子組換え ) Dupilumab(Genetical Recombination) 300mg 患者向医薬品ガイドについて
5_使用上の注意(37薬効)Web作業用.indd
 34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
PT51_p69_77.indd
 臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
 一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
この薬を使う前に 確認すべきことは? 患者さんや家族の方はこの薬の効果や注意すべき点などについて十分理解できるまで説明を受けてください 説明に同意した場合に使用が開始されます 次の人は この薬を使用することはできません 過去にイストダックス点滴静注用に含まれる成分で過敏な反応を経験したことがある人
 患者向医薬品ガイド 2017 年 8 月作成 イストダックス点滴静注用 10mg この薬は? 販売名一般名含有量 (1バイアル中) イストダックス点滴静注用 10mg Istodax Injection 10mg ロミデプシン Romidepsin 11mg 患者向医薬品ガイドについて 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と 重大な副作用の早期発見などに役立てていただくために作成したものです
患者向医薬品ガイド 2017 年 8 月作成 イストダックス点滴静注用 10mg この薬は? 販売名一般名含有量 (1バイアル中) イストダックス点滴静注用 10mg Istodax Injection 10mg ロミデプシン Romidepsin 11mg 患者向医薬品ガイドについて 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と 重大な副作用の早期発見などに役立てていただくために作成したものです
ポプスカイン0.75% 注シリンジ 75mg /10 院 Popscaine 75mg /10 院 / 筒 丸石 薬価 円 / 筒 効 硬膜外麻酔 用 ( 注 )1 回 150mg ( 本剤として20 院 ) までを硬膜外腔に投与 禁 大量出血やショック状態, 注射部位またはその周辺に
 神経系に作用する薬剤 局所麻酔薬 ( エステル型 ) ( プロカイン塩酸塩 ) プロカニン注 0.5% Procanine 25mg /5 院 / 管 光 薬価 92.00 円 /A 効 浸潤麻酔 用 ( 注 )1 回 1000mgの範囲内で使用 ( 基準最高用量 :1 回 1000mg ). 必要に応じアドレナリン ( 濃度 1:10 万 ~ 20 万 ) を添加 禁 メトヘモグロビン血症, 本剤の成分又は安息香酸エステル
神経系に作用する薬剤 局所麻酔薬 ( エステル型 ) ( プロカイン塩酸塩 ) プロカニン注 0.5% Procanine 25mg /5 院 / 管 光 薬価 92.00 円 /A 効 浸潤麻酔 用 ( 注 )1 回 1000mgの範囲内で使用 ( 基準最高用量 :1 回 1000mg ). 必要に応じアドレナリン ( 濃度 1:10 万 ~ 20 万 ) を添加 禁 メトヘモグロビン血症, 本剤の成分又は安息香酸エステル
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
したことによると考えられています 4. ピロリ菌の検査法ピロリ菌の検査法にはいくつかの種類があり 内視鏡を使うものとそうでないものに大きく分けられます 前者は 内視鏡を使って胃の組織を採取し それを材料にしてピロリ菌の有無を調べます 胃粘膜組織を顕微鏡で見てピロリ菌を探す方法 ( 鏡検法 ) 先に述
 ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
2018 年 10 月 4 日放送 第 47 回日本皮膚アレルギー 接触皮膚炎学会 / 第 41 回皮膚脈管 膠原病研究会シンポジウム2-6 蕁麻疹の病態と新規治療法 ~ 抗 IgE 抗体療法 ~ 島根大学皮膚科 講師 千貫祐子 はじめに蕁麻疹は膨疹 つまり紅斑を伴う一過性 限局性の浮腫が病的に出没
 2018 年 10 月 4 日放送 第 47 回日本皮膚アレルギー 接触皮膚炎学会 / 第 41 回皮膚脈管 膠原病研究会シンポジウム2-6 蕁麻疹の病態と新規治療法 ~ 抗 IgE 抗体療法 ~ 島根大学皮膚科 講師 千貫祐子 はじめに蕁麻疹は膨疹 つまり紅斑を伴う一過性 限局性の浮腫が病的に出没する疾患であり 多くは痒みを伴います 日本皮膚科学会の 2011 年版の蕁麻疹診療ガイドラインでは 蕁麻疹及び血管性浮腫を
2018 年 10 月 4 日放送 第 47 回日本皮膚アレルギー 接触皮膚炎学会 / 第 41 回皮膚脈管 膠原病研究会シンポジウム2-6 蕁麻疹の病態と新規治療法 ~ 抗 IgE 抗体療法 ~ 島根大学皮膚科 講師 千貫祐子 はじめに蕁麻疹は膨疹 つまり紅斑を伴う一過性 限局性の浮腫が病的に出没する疾患であり 多くは痒みを伴います 日本皮膚科学会の 2011 年版の蕁麻疹診療ガイドラインでは 蕁麻疹及び血管性浮腫を
ロミプレート 患者用冊子 特発性血小板減少性紫斑病の治療を受ける患者さんへ
 はじめ に 特発性血小板減少性紫斑病 ITP は血小板が減少し その 結果として出血の危険が高まる病気で 国が指定する難病 特定疾患 の対象になっています 慢性に経過する病気の性格上 治療の目標は出血を防ぐ ことです 血小板数が5万/μL以上であれば通常は出血の危険はほと んどありませんので 定期的に血小板数と出血症状をみな がら経過を観察します ロミプレートは 慢性 ITP の治療において 新たな作用で
はじめ に 特発性血小板減少性紫斑病 ITP は血小板が減少し その 結果として出血の危険が高まる病気で 国が指定する難病 特定疾患 の対象になっています 慢性に経過する病気の性格上 治療の目標は出血を防ぐ ことです 血小板数が5万/μL以上であれば通常は出血の危険はほと んどありませんので 定期的に血小板数と出血症状をみな がら経過を観察します ロミプレートは 慢性 ITP の治療において 新たな作用で
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり
![食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり 食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり](/thumbs/91/105740782.jpg) くすりのしおり内服剤 2013 年 11 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : グラクティブ錠 12.5mg 主成分 : シタグリプチンリン酸塩水和物 (Sitagliptin phosphate hydrate) 剤形
くすりのしおり内服剤 2013 年 11 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : グラクティブ錠 12.5mg 主成分 : シタグリプチンリン酸塩水和物 (Sitagliptin phosphate hydrate) 剤形
150800247.indd
 ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
STEP 1 検査値を使いこなすために 臨床検査の基礎知識 検査の目的は大きく 2 つ 基準範囲とは 95% ( 図 1) 図 1 基準範囲の考え方 2
 STEP 1 検査値を使いこなすために 臨床検査の基礎知識 検査の目的は大きく 2 つ 基準範囲とは 95% ( 図 1) 100 5 図 1 基準範囲の考え方 2 STEP 1 血算 2 押さえておきたい検査の特徴 1 血算 項目略称基準範囲 白血球数 (white blood cell count) WBC 3.3 ~ 8.6 10 3 /μl 好中球数 (neutrophil) Neut 40.0
STEP 1 検査値を使いこなすために 臨床検査の基礎知識 検査の目的は大きく 2 つ 基準範囲とは 95% ( 図 1) 100 5 図 1 基準範囲の考え方 2 STEP 1 血算 2 押さえておきたい検査の特徴 1 血算 項目略称基準範囲 白血球数 (white blood cell count) WBC 3.3 ~ 8.6 10 3 /μl 好中球数 (neutrophil) Neut 40.0
「 」 説明および同意書
 EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
相談品目の薬価基準追補収載のお知らせ
 薬価基準追補収載 ( 新薬 ) のお知らせ 平成 29 年 8 月 29 日公益社団法人福岡県薬剤師会薬事情報センター 厚労省は新医薬品の薬価基準追補収載を平成 29 年 8 月 29 日に告示した 8 月 30 日から適用する 内用薬 劇 : 劇薬, 処 : 処方箋医薬品, 特生 : 特定生物由来製品分類医薬品名 ( 会社名 ) 規格 単位薬価 ( 円 ) 規制備考 ( 成分, 薬効 ) 625
薬価基準追補収載 ( 新薬 ) のお知らせ 平成 29 年 8 月 29 日公益社団法人福岡県薬剤師会薬事情報センター 厚労省は新医薬品の薬価基準追補収載を平成 29 年 8 月 29 日に告示した 8 月 30 日から適用する 内用薬 劇 : 劇薬, 処 : 処方箋医薬品, 特生 : 特定生物由来製品分類医薬品名 ( 会社名 ) 規格 単位薬価 ( 円 ) 規制備考 ( 成分, 薬効 ) 625
ハイゼントラ20%皮下注1g/5mL・2g/10mL・4g/20mL
 CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
スライド 1
 1. 血液の中に存在する脂質 脂質異常症で重要となる物質トリグリセリド ( 中性脂肪 :TG) 動脈硬化に深く関与する 脂質の種類 トリグリセリド :TG ( 中性脂肪 ) リン脂質 遊離脂肪酸 特徴 細胞の構成成分 ホルモンやビタミン 胆汁酸の原料 動脈硬化の原因となる 体や心臓を動かすエネルギーとして利用 皮下脂肪として貯蔵 動脈硬化の原因となる 細胞膜の構成成分 トリグリセリド ( 中性脂肪
1. 血液の中に存在する脂質 脂質異常症で重要となる物質トリグリセリド ( 中性脂肪 :TG) 動脈硬化に深く関与する 脂質の種類 トリグリセリド :TG ( 中性脂肪 ) リン脂質 遊離脂肪酸 特徴 細胞の構成成分 ホルモンやビタミン 胆汁酸の原料 動脈硬化の原因となる 体や心臓を動かすエネルギーとして利用 皮下脂肪として貯蔵 動脈硬化の原因となる 細胞膜の構成成分 トリグリセリド ( 中性脂肪
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg 有効成分 ボノプラザンフマル酸塩 製造販売業者 武田薬品工業株式会社 薬効分類 提出年月 2018 年 4 月 1.1. 安全性検討事項 重要
 タケキャブ錠 10 mg タケキャブ錠 20 mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は 武田薬品工業株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません 武田薬品工業株式会社 タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg
タケキャブ錠 10 mg タケキャブ錠 20 mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は 武田薬品工業株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません 武田薬品工業株式会社 タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg
10,000 L 30,000 50,000 L 30,000 50,000 L 図 1 白血球増加の主な初期対応 表 1 好中球増加 ( 好中球 >8,000/μL) の疾患 1 CML 2 / G CSF 太字は頻度の高い疾患 32
 白血球増加の初期対応 白血球増加が 30,000~50,000/μL 以上と著明であれば, 白血病の可能性が高い すぐに専門施設 ( ) に紹介しよう ( 図 1) 白血球増加があれば, まず発熱など感染症を疑う症状 所見に注目しよう ( 図 1) 白血球増加があれば, 白血球分画を必ずチェックしよう 成熟好中球 ( 分葉核球や桿状核球 ) 主体の増加なら, 反応性好中球増加として対応しよう ( 図
白血球増加の初期対応 白血球増加が 30,000~50,000/μL 以上と著明であれば, 白血病の可能性が高い すぐに専門施設 ( ) に紹介しよう ( 図 1) 白血球増加があれば, まず発熱など感染症を疑う症状 所見に注目しよう ( 図 1) 白血球増加があれば, 白血球分画を必ずチェックしよう 成熟好中球 ( 分葉核球や桿状核球 ) 主体の増加なら, 反応性好中球増加として対応しよう ( 図
スライド 1
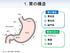 1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
Microsoft PowerPoint - __________________________ ppt
 日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん
 米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
アトピー性皮膚炎の治療目標 アトピー性皮膚炎の治療では 以下のような状態になることを目指します 1 症状がない状態 あるいはあっても日常生活に支障がなく 薬物療法もあまり必要としない状態 2 軽い症状はあっても 急に悪化することはなく 悪化してもそれが続かない状態 2 3
 第1版 を 使用される患者さんへ 監修 自治医科大学臨床医学部門皮膚科学教授 大槻 マミ太 郎 先 生 CONTENTS 医療機関名 アトピー性皮膚炎の治療目標 2 アトピー性皮膚炎の原因 4 アトピー性皮膚炎の治療 5 新しい 治療薬 デュピクセント とは 6 投与できる方 できない方 注意が必要な方 7 喘息等のアレルギー性疾患をお持ちの方への注意点 8 SAJP.DUP.18.02.0390
第1版 を 使用される患者さんへ 監修 自治医科大学臨床医学部門皮膚科学教授 大槻 マミ太 郎 先 生 CONTENTS 医療機関名 アトピー性皮膚炎の治療目標 2 アトピー性皮膚炎の原因 4 アトピー性皮膚炎の治療 5 新しい 治療薬 デュピクセント とは 6 投与できる方 できない方 注意が必要な方 7 喘息等のアレルギー性疾患をお持ちの方への注意点 8 SAJP.DUP.18.02.0390
より詳細な情報を望まれる場合は 担当の医師または薬剤師におたずねください また 患者向医薬品ガイド 医療専門家向けの 添付文書情報 が医薬品医療機器総合機構のホームページに掲載されています
 くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認され
 ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
症例報告書の記入における注意点 1 必須ではない項目 データ 斜線を引くこと 未取得 / 未測定の項目 2 血圧平均値 小数点以下は切り捨てとする 3 治験薬服薬状況 前回来院 今回来院までの服薬状況を記載する服薬無しの場合は 1 日投与量を 0 錠 とし 0 錠となった日付を特定すること < 演習
 ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果
 2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
2017 年 9 月 画像診断部 中央放射線科 造影剤投与マニュアル ver 2.0 本マニュアルは ESUR 造影剤ガイドライン version 9.0(ESUR: 欧州泌尿生殖器放射線学会 ) などを参照し 前マニュアルを改訂して作成した ( 前マニュアル作成 2014 年 3 月 今回の改訂
 2017 年 9 月 画像診断部 中央放射線科 造影剤投与マニュアル ver 2.0 本マニュアルは ESUR 造影剤ガイドライン version 9.0(ESUR: 欧州泌尿生殖器放射線学会 ) などを参照し 前マニュアルを改訂して作成した ( 前マニュアル作成 2014 年 3 月 今回の改訂 2017 年 8 月 ) 新たなエビデンスの報告や運用上困難な場合は適宜変更を加える 1. 造影剤アレルギーの既往を有する患者への対応
2017 年 9 月 画像診断部 中央放射線科 造影剤投与マニュアル ver 2.0 本マニュアルは ESUR 造影剤ガイドライン version 9.0(ESUR: 欧州泌尿生殖器放射線学会 ) などを参照し 前マニュアルを改訂して作成した ( 前マニュアル作成 2014 年 3 月 今回の改訂 2017 年 8 月 ) 新たなエビデンスの報告や運用上困難な場合は適宜変更を加える 1. 造影剤アレルギーの既往を有する患者への対応
60 秒でわかるプレスリリース 2006 年 4 月 21 日 独立行政法人理化学研究所 敗血症の本質にせまる 新規治療法開発 大きく前進 - 制御性樹状細胞を用い 敗血症の治療に世界で初めて成功 - 敗血症 は 細菌などの微生物による感染が全身に広がって 発熱や機能障害などの急激な炎症反応が引き起
 60 秒でわかるプレスリリース 2006 年 4 月 21 日 独立行政法人理化学研究所 敗血症の本質にせまる 新規治療法開発 大きく前進 - 制御性樹状細胞を用い 敗血症の治療に世界で初めて成功 - 敗血症 は 細菌などの微生物による感染が全身に広がって 発熱や機能障害などの急激な炎症反応が引き起こされる病態です 免疫力が低下している場合に 急性腎盂腎炎や肺炎 急性白血病 肝硬変 悪性腫瘍などさまざまな疾患によって誘発され
60 秒でわかるプレスリリース 2006 年 4 月 21 日 独立行政法人理化学研究所 敗血症の本質にせまる 新規治療法開発 大きく前進 - 制御性樹状細胞を用い 敗血症の治療に世界で初めて成功 - 敗血症 は 細菌などの微生物による感染が全身に広がって 発熱や機能障害などの急激な炎症反応が引き起こされる病態です 免疫力が低下している場合に 急性腎盂腎炎や肺炎 急性白血病 肝硬変 悪性腫瘍などさまざまな疾患によって誘発され
プラザキサ服用上の注意 1. プラザキサは 1 日 2 回内服を守る 自分の判断で服用を中止し ないこと 2. 飲み忘れた場合は 同日中に出来るだけ早く1 回量を服用する 次の服用までに 6 時間以上あけること 3. 服用し忘れた場合でも 2 回量を一度に服用しないこと 4. 鼻血 歯肉出血 皮下出
 プラザキサ服用上の注意 1. プラザキサは 1 日 2 回内服を守る 自分の判断で服用を中止し ないこと 2. 飲み忘れた場合は 同日中に出来るだけ早く1 回量を服用する 次の服用までに 6 時間以上あけること 3. 服用し忘れた場合でも 2 回量を一度に服用しないこと 4. 鼻血 歯肉出血 皮下出血 血尿 血便などの異常出血が出現 した場合は直ちに病院に連絡して下さい ( 088-622-7788)
プラザキサ服用上の注意 1. プラザキサは 1 日 2 回内服を守る 自分の判断で服用を中止し ないこと 2. 飲み忘れた場合は 同日中に出来るだけ早く1 回量を服用する 次の服用までに 6 時間以上あけること 3. 服用し忘れた場合でも 2 回量を一度に服用しないこと 4. 鼻血 歯肉出血 皮下出血 血尿 血便などの異常出血が出現 した場合は直ちに病院に連絡して下さい ( 088-622-7788)
