目次 頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7. 使用目的及び使用状況
|
|
|
- たつぞう あると
- 5 years ago
- Views:
Transcription
1 ( 案 ) 動物用医薬品評価書 セファゾリン 2012 年 12 月 食品安全委員会肥料 飼料等専門調査会
2 目次 頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7. 使用目的及び使用状況 6 Ⅱ. 安全性に係る知見の概要 7 1. 薬物動態試験 ( 吸収 分布 代謝 排泄試験 ) 7 (1) 薬物動態試験 ( ラット ) 7 (2) 薬物動態試験 ( ウサギ ) 7 (3) 薬物動態試験 ( イヌ ) 8 (4) 薬物動態試験 ( 牛 ) 8 (5) 薬物動態試験 ( 羊 ) 9 (6) 薬物動態試験 ( 山羊 ) 10 (7) 代謝試験 ( ヒト イヌ及び馬 ) 10 (8) 代謝試験 (in vitro 牛糞尿中における分解) 残留態試験 10 (1) 残留試験 ( 牛 ) 10 (2) 残留試験 ( 羊及び山羊 ) 遺伝毒性試験 急性毒性試験 亜急性毒性試験 14 (1)3 か月間亜急性毒性試験 ( ラット 経口投与 ) 14 (2)1 か月間亜急性毒性試験 ( ラット 腹腔内投与 ) 参考データ 15 (3)3 か月間及び 6 か月間亜急性毒性試験 ( ラット 皮下投与 ) 参考データ 15 (4)1 か月間亜急性毒性試験 ( イヌ 静脈内投与 ) 参考データ 15 (5)3 か月間及び 6 か月間亜急性毒性試験 ( イヌ 皮下投与 ) 参考データ 慢性毒性及び発がん性試験 16 1
3 7. 生殖発生毒性試験 16 (1) 生殖発生毒性試験 ( ラット 経口投与 ) 16 (2) 生殖発生毒性試験 ( マウス ラット及びウサギ 皮下投与 ) 参考データ 16 (3) 生殖発生毒性試験 ( マウス ラット及びウサギ 皮下及び静脈内投与 ) 参考データ 対象動物を用いた試験 17 (1) 安全性試験 ( 牛 乳房内投与 ) 17 (2) 安全性試験 ( 羊及び山羊 乳房内投与 ) その他の試験 18 (1) 腎臓に対する作用 18 (2) 皮膚感作性試験 18 (3) 抗原性について 18 (4) 眼粘膜刺激性試験 微生物学的影響に関する試験 18 (1) 臨床分離菌に対する MIC 18 (2)EMEA 評価書における知見 19 Ⅲ. 食品健康影響評価 19 1.EMEA における評価 毒性学的 ADI について 微生物学的 ADI について 20 4.ADI の設定について 21 EMEA における各種試験の無毒性量 22 別紙 : 検査値等略称 23 参照 24 2
4 審議の経緯 2005 年 11 月 29 日暫定基準告示 ( 参照 1) 2009 年 3 月 10 日厚生労働大臣から残留基準設定に係る食品健康影響評価について要請 ( 厚生労働省発食安第 号 ) 関係資料の接受 2009 年 3 月 12 日第 277 回食品安全委員会 ( 要請事項説明 ) 2012 年 4 月 24 日第 55 回肥料 飼料等専門調査会 2012 年 12 月 17 日第 458 回食品安全委員会 ( 報告 ) xxxx 年 xx 月 xx 日から xx 月 xx 日国民からのご意見 情報の募集 xxxx 年 xx 月 xx 日動物用医薬品専門調査会座長より食品安全委員会委員長へ報告 xxxx 年 xx 月 xx 日第 xxx 回食品安全委員会 ( 同日付で厚生労働大臣に通知 ) 食品安全委員会委員名簿 (2009 年 6 月 30 日まで ) (2011 年 1 月 6 日まで ) (2012 年 6 月 30 日まで ) 見上彪 ( 委員長 ) 小泉直子 ( 委員長 ) 小泉直子 ( 委員長 ) 小泉直子 ( 委員長代理 *) 見上彪 ( 委員長代理 *) 熊谷進 ( 委員長代理 *) 長尾拓 長尾拓 長尾拓 野村一正 野村一正 野村一正 畑江敬子 畑江敬子 畑江敬子 廣瀬雅雄 ** 廣瀬雅雄 廣瀬雅雄 本間清一 村田容常 村田容常 * :2007 年 2 月 1 日から **:2007 年 4 月 1 日から * :2009 年 7 月 9 日から * :2011 年 1 月 13 日から (2012 年 7 月 1 日から ) 熊谷進 ( 委員長 ) 佐藤洋 ( 委員長代理 ) 山添康 ( 委員長代理 ) 三森国敏 ( 委員長代理 ) 石井克枝上安平淑子村田容常 3
5 食品安全委員会肥料 飼料等専門調査会専門委員名簿 (2011 年 9 月 30 日まで ) (2011 年 10 月 1 日から ) 唐木英明 ( 座長 ) 唐木英明 ( 座長 ) 酒井健夫 ( 座長代理 ) 津田修治 ( 座長代理 ) 青木宙 高橋和彦 青木宙 高橋和彦 秋葉征夫 舘田一博 秋葉征夫 舘田一博 池 康嘉 津田修治 池 康嘉 戸塚恭一 今井俊夫 戸塚恭一 今井俊夫 細川正清 江馬眞 細川正清 江馬眞 宮島敦子 桑形麻樹子宮島敦子 桑形麻樹子山中典子 下位香代子元井葭子 下位香代子吉田敏則 高木篤也 吉田敏則 4
6 要約 セファロスポリン系の抗生物質である セファゾリン (CAS No ) について EMEA 評価書等を用いて食品健康影響評価を実施した 評価に用いた試験成績は 薬物動態試験 ( ラット ウサギ イヌ 牛 羊及び山羊 ) 残留試験 ( 牛 羊及び山羊 ) 遺伝毒性試験 急性毒性試験 亜急性毒性試験( ラット及びイヌ ) 生殖発生毒性試験( ラット ) 微生物学的影響に関する試験等の成績である セファゾリンは 各種遺伝毒性試験においていずれも陰性の結果が得られているため 生体にとって問題となる遺伝毒性を示さないと考えられ また structural alert がないとされていることから 発がん性に関するデータは示されていないが 遺伝毒性発がん物質ではないと考えられ ADI を設定することが可能であると判断した 各種毒性試験で得られた最小の無毒性量 (NOAEL) は 妊娠ラットを用いた経口投与による生殖発生毒性試験から得られた母動物への影響 ( 下痢 ) 及び胎児体重の減少に基づく 10 mg/kg 体重 / 日であった この NOAEL に安全係数 1,000( 種差 10 個体差 10 並びに慢性毒性試験及び発がん性試験が実施されていないことを考慮した追加の 10) を適用し 毒性学的 ADI は 0.01 mg/kg 体重 / 日と設定することが適切であると考えた 現時点において国際的コンセンサスが得られている VICH の式に基づいて算出された微生物学的 ADI( mg/kg 体重 / 日 ) は 毒性学的 ADI(0.01 mg/kg 体重 / 日 ) よりも小さく 毒性学的影響についても勘案していると考えられることから セファゾリンの ADI を mg/kg 体重 / 日と設定した 5
7 Ⅰ. 評価対象動物用医薬品の概要 1. 用途抗菌剤 2. 有効成分の一般名和名 : セファゾリン英名 :Cefazolin 3. 化学名 CAS (No ) 英名 :(6R,7R)-3-[[(5-Methyl-1,3,4-thiadiazol-2-yl)thio]methyl]-8-oxo-7-[(1Htetrazol-1-ylacetyl)amino]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid 4. 分子式 C 14 H 14 N 8 O 4 S 3 5. 分子量 構造式 N N N N O N H O H H N S S S CH 3 COOH N N ( 参照 2) 7. 使用目的及び使用状況セファゾリンは 第一世代のセファロスポリン系抗生物質で 主に家畜における一般的な乳房炎病原菌を含むグラム陽性細菌に抗菌活性を示す 作用機序は 細菌の細胞壁ペプチドグリカンの生合成阻害であり 殺菌的に作用する ( 参照 3) セファゾリンは 国内外で動物用及びヒト用医薬品として使用されている 日本では 動物用医薬品としては セファゾリンを有効成分とする牛の乳房炎を適応症とした乳房注入剤及びセファゾリンナトリウム又はその水和物を有効成分とする牛の細菌性肺炎 細菌性下痢症等を適応症とした静脈内及び筋肉内投与の注射剤が承認されている なお ポジティブリスト制度導入に伴う残留基準値 1 が設定されている ( 参照 1) 1 平成 17 年厚生労働省告示第 499 号によって定められた残留基準値 ( 参照 1) 6
8 Ⅱ. 安全性に係る知見の概要本評価書では EMEA 評価書等をもとに セファゾリンの毒性に関する主な知見を整理した 検査値等略称は別紙に記載した 1. 薬物動態試験 ( 吸収 分布 代謝 排泄試験 ) セファゾリンの経口投与後の吸収はわずかで ラットでは約 5% である 乳房内投与後の吸収もわずかで 血漿及び組織に低濃度でみられるのみである セファゾリンの Vd は約 0.2 L/kg 体重である ( 参照 4) セファゾリンの Vd は 調べられたほとんどの種で 0.2 L/kg 体重程度である セファゾリンの筋肉内又は皮下投与量の大部分が 投与後 24 時間以内に腎臓を経て排泄される ( 参照 5) (1) 薬物動態試験 ( ラット ) ラット (3 匹 ) の筋肉内投与 (20 mg/kg 体重 ) 試験では 投与 30 分後に血中 C max (70 µg/ml) に達し 投与後 24 時間の尿中から 82% が回収された ラット (3 匹 ) に皮下投与 (20 mg/kg 体重 ) すると 投与 30 分後に血中 C max (64 µg/ml) に達し 投与後 24 時間の尿中から 75% が回収された ( 参照 6) ラットに 14 C 標識したセファゾリンを投与 (10 mg/kg 体重 投与経路不明 ) し 投与後一定時間ごとに尿及び胆汁を採取しオートラジオグラフィー バイオオートグラフィー及び逆同位体希釈分析を行った 尿及び胆汁中に排泄された放射活性物質の 80~90% が未変化体で 未変化体に相当するスポットのみが検出された 以上の結果から セファゾリンは 体内に吸収された後 ほとんど代謝されることなく未変化体のまま排泄されると考えられた ( 参照 6) (2) 薬物動態試験 ( ウサギ ) 1 静脈内投与試験ウサギ (4 匹 ) を用いた静脈内投与 (20 mg/kg 体重 ) 試験では 投与 5 分後の平均血中濃度は 166 µg/ml であった 消失は速やかで 2 時間後の血中にはほとんど抗菌活性は認められなかった 投与 3 時間後までに 1,000 µg/ml を超える濃度が尿中から検出されたが その後は速やかに減少し 投与 6~24 時間後までの尿には痕跡が認められる程度であった ( 参照 6) 2 筋肉内投与及び皮下投与試験ウサギ (4 匹 ) を用いた筋肉内投与 (20 mg/kg 体重 ) 試験では 投与 30 分後に血中 C max (72 µg/ml) に達した 投与後 24 時間の尿中から 97% が回収された ( 参照 6) 7
9 ウサギ (4 匹 ) を用いた皮下投与 (20 mg/kg 体重 ) 試験では 投与 30 分後に血中 C max (33 µg/ml) に達し 3 時間後まで比較的高めの濃度で推移した 皮下投与は他の投与方法と異なった結果を示した 投与 24 時間後までに尿中から 76% が回収された ( 参照 6) (3) 薬物動態試験 ( イヌ ) イヌ (5 匹 ) の筋肉内投与 (10 mg/kg 体重 ) 試験では 投与 30 分後に血中 C max (23 µg/ml) に達した 投与後 24 時間の尿中から 80% が回収された ( 参照 6) (4) 薬物動態試験 ( 牛 ) 1 筋肉内投与及び静脈内投与試験牛にセファゾリンを筋肉内及び静脈内に単回投与 (40 mg/kg 体重 ) し 血清 糞及び尿中の濃度を経時的に測定した 血清中濃度は 筋肉内投与では 1 時間後に血中 C max (67 µg/ml) に達し 静脈内投与では 15 分後に血中 C max (95 µg/ml) に達した後 両投与群とも急速に減衰した 主たる排泄経路は尿中で 筋肉及び静脈内投与 48 時間後の糞尿中への総排泄率は それぞれ 81 及び 95% であった 両投与群ともに その約 90% が投与 4 時間後までに排泄された セファゾリンは 急速に吸収 排泄され 投与経路による差は認められなかった ( 参照 6) 泌乳牛にセファゾリンを単回静脈内投与 ( 及び 10 mg/kg 体重 ) し 血清中及び乳汁中濃度を経時的に測定した 血清中セファゾリン濃度は いずれの用量においても投与 30 分後以降に漸減し 投与 180 分後には 0.12~0.62 µg/ml の値を示した 乳汁中濃度は漸増し 投与 180 分後には 0.09~0.31 µg/ml の値を示した ( 参照 6) 2 乳房内投与試験牛 ( ホルスタイン種 5 頭 ) を用い 乾乳開始時にセファゾリンを乳房内投与 (4 分房 250 mg( 力価 )/ 分房 ) し 経時的に血漿中及び尿中濃度を測定した 血漿では いずれの検体からもセファゾリンは検出されなかった 尿中からは 各供試牛で投与 7 日後まで検出されたが (0.10~1.26 µg/ml) 投与 14 日後以降は 1 例を除き検出限界未満となった 投与 35 日後には全て検出限界未満となった 尿中セファゾリン濃度及び尿量 ( 推定値 :31 ml/kg 体重 / 日 ) より尿中排泄量は 総投与量の 18%( 平均 ) と算出された さらに 尿中の代謝物について TLC 及びバイオオートグラフィーを用いて調べたが 代謝物は検出されなかった ( 参照 6) 泌乳牛 ( ホルスタイン種 3 又は 5 頭 / 群 ) を用い セファゾリンを 3 日間乳房内投与 8
10 (2 分房 150 又は 600 mg( 力価 )/ 分房 / 日 ) し 経時的に血漿中及び尿中濃度を測定した 150 mg 投与群の血漿中濃度は 1 回目投与 3 時間後の 3 例中 2 例で 0.07 及び 0.14 µg/ml であったが それ以外の検体では全て検出限界 (0.05 µg/ml) 未満であった 尿中濃度は 1 回目投与 3 時間後に最高値 ( 及び 11.2 µg/ml) に達した後漸減した 3 回目投与では 6 時間後に最高値 ( 及び 7.2 µg/ml) 達した後漸減した 平均尿中排泄量は 総投与量の 38% であった 600 mg 投与群の血漿中濃度は 1 回目投与 3~9 時間後の全ての検体において検出 (0.06~0.58 µg/ml) されたが 投与 24 時間後には全て検出限界 (0.05 µg/ml) 未満となった 3 回目投与では 3~9 時間後の 5 例中 2 例又は 5 例中 3 例で 0.05~0.12 µg/ml 検出されたが それ以降は全て検出限界 (0.05 µg/ml) 未満となった 尿中濃度は 1 回目投与 3~9 時間後に最高値 (72~>100 µg/ml) に達し 24 時間後には濃度低下が確認された 3 回目投与では 6~9 時間後に最高値 (48~86 µg/ml) となり 72 時間まで検出された 平均尿中排泄量は 総投与量の 77% であった さらに 尿中の代謝物について TLC 及びバイオオートグラフィーを用いて検討したが 代謝物は検出されなかった ( 参照 6) 泌乳牛 (5 頭 ) を用い セファゾリンを 3 日間乳房内投与 (2 分房 600 mg( 力価 )/ 分房 / 日 ) し 経時的にセファゾリンの乳汁中濃度を測定した 最終投与 24 時間後までは 高濃度 (10~>100 µg/ml) であったが その後は急激に減少し 72 時間後では 1 頭で検出限界付近の値が検出された以外は全て検出限界 (0.05 µg/ml) 未満となった 未投与の分房からは 検出されなかった 乳中セファゾリン濃度と乳量から乳中排泄量を算出したところ 総投与量の 17%( 平均 ) と算出された ( 参照 6) 泌乳牛 (3 頭 ) を用い セファゾリンを 3 日間乳房内投与 (2 分房 150 mg( 力価 )/ 分房 / 日 ) し 経時的にセファゾリンの乳汁中濃度を測定した 最終投与後 72 時間以降は検出されなかった また 未投与の分房からは検出されなかった ( 参照 5) 泌乳牛 (5 頭 ) に 3 日間乳房内投与 (4 分房 150 mg( 力価 )/ 分房 / 日 ) を行った場合も 上記 2 分房投与の場合とほぼ同様の結果が得られた ( 検出限界 :0.05 µg/ml) ( 参照 6) (5) 薬物動態試験 ( 羊 ) 羊 ( 雌 乾乳期 ) にセファゾリンを単回乳房内投与 (250 mg/ 分房 推奨用量 ) した 血漿中濃度は 投与 4~7 日後に C max (0.040~0.103 µg/ml) に達し 投与 14 日後以降は定量限界 (0.020~0.025 µg/ml) 未満となった 尿中の濃度も投与 4~7 日後に最高値 (113~218 µg/ml) を示した 投与 21 日後においてもなお 5 例中 2 例の尿中から低濃度でセファゾリンが検出され 低い速度で乳房から吸収されていたことを示している 21 日間の試験期間における尿中回収率の推定値は投与量の 74~138% の範囲であった 9
11 セファゾリンの濃度は HPLC とバイオアッセイによりほぼ同様の結果が得られた ( 参照 5) (6) 薬物動態試験 ( 山羊 ) 山羊 ( 雌 乾乳期 ) にセファゾリンを単回乳房内投与 (250 mg/ 分房 推奨用量 ) した 血漿中濃度は 投与 4~24 時間後に C max (0.047 ~0.102 µg/ml) に達した セファゾリンは 投与 7 日後の 1 サンプルでなお測定可能であったが 投与 14 日後以降では検出されなかった 尿中濃度は投与 1 日後に最高値を示した (38~131 µg/ml) 投与 14 日後には 全ての検体で定量限界 (0.025 µg/ml) 未満となった 21 日間の試験期間における尿中回収率の推定値は 投与量の 21~54% の範囲であった セファゾリンの濃度は HPLC とバイオアッセイによりほぼ同様の結果が得られた ( 参照 5) (7) 代謝試験 ( ヒト イヌ及び馬 ) セファゾリンの代謝は 調べられたほとんどの動物及びヒトにおいて極めてわずかな程度である セファゾリン非経口投与後のヒト イヌ及び馬においては ほぼ 100% が変化を受けず 24 時間以内に尿中に排泄された 代謝物はほとんど生じないと考えられた ( 参照 3) 羊及び山羊においては 放射標識物質を用いた残留試験が行われていないため 組織中の総残留に対するセファゾリンの割合は不明である しかしながら セファゾリンの代謝は 調べられた全ての動物種において極めてわずかな程度であるので 投与動物における組織残留は未変化体であると推測された ( 参照 5) (8) 代謝試験 (in vitro 牛糞尿中における分解) 牛の糞 尿及び糞尿等量混合物にセファゾリンを 5,000 ppm の濃度で添加し 25 に保存して分解の程度を調べた 尿では 保存 14 日後で力価残存率は 28% を示したが 糞及び糞尿混合物では それぞれ 2 及び 5 日後には添加したセファゾリンの 90% 以上が分解された ( 参照 6) 2. 残留態試験 (1) 残留試験 ( 牛 ) 1 乳房内投与試験 ( 泌乳期 ) 泌乳牛 (3 頭 / 群 ) にセファゾリンを単回乳房内投与 (4 分房 450 及び 900 mg( 力価 )/ 分房 ) し 組織 ( 血漿 脂肪 筋肉 肝臓 腎臓 小腸及び乳房 ) 中残留を経時的に調べた 同様の試験を 2 施設で実施した 両投与群ともに投与 2 日後には乳房を除く各組織で検出限界 (0.05 µg/ml) 未満となった ( 参照 6) 10
12 泌乳牛 (3 頭 / 群 ) にセファゾリンを単回乳房内投与 (3 分房 450 及び 900 mg( 力価 )/ 分房 ) し 被験牛の乳汁中セファゾリン濃度を経時的に測定した 同様の試験を 2 施設で実施した 450 mg 投与群では投与 60 時間後 900 mg 投与群では投与 72 時間後には乳汁中にセファゾリンが検出されなくなった 無投与分房からは検出されず 投与分房からのセファゾリンの移行は認められなかった ( 検出限界 :0.05 µg/ml) ( 参照 6) 泌乳牛に泌乳期用セファゾリン製剤を乳房内投与 (4 分房 300 mg/ 分房 2 回の連続する搾乳のそれぞれの直後に投与 推奨用量 ) した後 混合乳における残留を調べた 最終投与後 7 回目の搾乳では 50 µg/l 未満であり 8 回目の搾乳では 25 µg/l 未満であった 組織では セファゾリンは最終投与 3 時間後に腎臓及び肝臓のみでみられ 24 時間後には腎臓のみに極めて低濃度認められた ( 参照 4 5) 泌乳牛 ( ホルスタイン種 5 頭 ) にセファゾリンを 3 日間乳房内投与 (4 分房 150 mg( 力価 )/ 分房 / 日 ) し 最終投与 及び 5 日後に組織中濃度を測定した 最終投与 1 及び 2 日後の乳房 (1.80 及び 0.29 µg/kg) に残留が認められたが その他の組織及びそれ以降の検体からは検出されなかった ( 参照 6) 2 乳房内投与試験 ( 乾乳期 ) 牛 ( ホルスタイン種 5 頭 ) を用い 乾乳開始時にセファゾリンを単回乳房内投与 (4 分房 250 mg/ 分房 ) し 投与 3, 及び 60 日後に組織中濃度を測定した 投与 3 日後の腎臓 小腸 肝臓 心臓 筋肉及び乳房で 及び 54 mg/kg 15 日後の乳房で 0.59 mg/kg の残留が認められたが それ以外の組織及びそれ以降の検体からは検出されなかった ( 参照 6) 牛 ( ホルスタイン種 5 頭 ) を用い 乾乳開始時にセファゾリンを単回乳房内投与 (4 分房 250 mg/ 分房 ) し 5 頭は乾乳期間中から分娩 10 日後まで経時的に乳汁中濃度を測定した 投与 1 から 14 日後までは いずれの分房からもセファゾリンが 0.12~68 mg/l の濃度で検出され 28 日後には一部で検出 (0.05~0.10 mg/l) されたが ほとんどの分房で検出限界 (0.05 mg/l) 未満となり 35 日目以降の乾乳期間中にはいずれの乳汁からも検出されなかった ( 表 1) 別の 5 頭を用い 分娩直後から分娩 10 日後まで測定した試験では 分娩後いずれの乳汁からもセファゾリンは検出されなかった ( 参照 6) 11
13 表 1 乾乳牛におけるセファゾリンの乳房内単回投与後の乳汁中残留濃度 (mg/l) 被験牛分房投与前 投与後日数 ( 日 ) 右前 < * 5.4 <0.05 <0.05 右後 < * 4.8 <0.05 <0.05 左前 < * 5.0 <0.05 <0.05 左後 < * <0.05 右前 < <0.05 <0.05 右後 < <0.05 <0.05 左前 < <0.05 <0.05 左後 < <0.05 <0.05 右前 < <0.05 <0.05 右後 < <0.05 <0.05 左前 < <0.05 <0.05 左後 < <0.05 <0.05 右前 < <0.05 <0.05 右後 < <0.05 左前 < <0.05 <0.05 左後 < <0.05 <0.05 右前 < <0.05 <0.05 右後 < <0.05 左前 < <0.05 左後 < <0.05 <0.05 *: 投与 10 日後 乾乳牛に乾乳期用市販製剤を単回乳房内投与 (4 分房 250 mg/ 分房 推奨用量 ) し 残留試験を実施した 乳汁中の残留は 投与 7 日後の 3,500~16,500 µg/l から 14 日後の 40~1,400 µg/l まで低下した 21 日後には 12 分房中の 1 分房の乳汁中から検出された 1,400 µg/l を除いて 定量限界 (25 µg/l) 未満 ~600 µg/l となった 分娩前の乾乳 28~40 日に投与した牛では 分娩後初回及び 2 回目の搾乳時に採取した乳汁中に残留は検出されなかった 乾乳期での投与 21 日後に採取した可食組織では 残留は検出されなかった ( 参照 4 5) 3 筋肉内投与試験子牛 (3 頭 / 群 ) にセファゾリンを 5 日間筋肉内投与 (20 及び 40 mg( 力価 )/kg 体重 / 日 ) し 組織 ( 血清 筋肉 肝臓 腎臓 脂肪 小腸 注射部位等 ) 中残留について経時的に調べた 同様の試験を 2 施設で実施した 腎臓で最も長くセファゾリンの残留がみられたが 最終投与 3 日後には全ての被験組織で検出されなくなった ( 検出限界 :0.05 mg/kg) ( 参照 6) 12
14 泌乳牛 (3 頭 / 群 ) にセファゾリンを 5 日間筋肉内投与 (20 及び 40 mg( 力価 )/kg 体重 / 日 ) し 乳汁中濃度を経時的に測定した 同様の試験を 2 施設で実施した 20 mg( 力価 )/kg 体重 / 日群では 最終投与日の夕方に全例で検出 (0.29~0.35 mg/l) されたが投与 1 日後の朝は検出限界 (0.05 mg/l) 未満であった 40 mg( 力価 )/kg 体重 / 日群では 最終投与 1 日後の朝に 6 例中 4 例で検出 (0.08~0.11 mg/l) されたが 最終投与 1 日後の夕方には 全て検出限界未満となった ( 参照 6) (2) 残留試験 ( 羊及び山羊 ) 雌羊及び雌山羊にセファゾリンを単回乳房内投与 (250 mg / 分房 推奨用量 ) した試験では 投与 21 日後の可食組織中のセファゾリン濃度は HPLC の定量限界 (50 µg/kg) 未満であった ( 参照 5) 乾乳期の雌羊及び雌山羊に セファゾリンを単回乳房内投与 (250 mg / 分房 推奨用量 ) し 分娩後最初の 3 回の搾乳で採取した乳汁においては セファゾリン濃度は全て定量限界未満であった この試験に用いた雌羊の乾乳期の長さは 平均 137 日 (70~173 日 ) で 雌山羊では 76 日 (69~95 日 ) であった ( 参照 5) 3. 遺伝毒性試験セファゾリンの遺伝毒性に関する各種 in vitro 及び in vivo 試験の結果を表 2 及び 3 に示した ( 参照 6) 表 2 in vitro 試験 検査項目 試験対象 用量 結果 復帰突然変異 Salmonella typhimurium 0.5~50 μg/plate 試験 TA1535 TA1537 TA1538 (±S9) TA98 TA100 Escherichia coli WP2 uvra S.typhimurium TA1535 TA1537 TA1538 E. coli WP2uvrA S. typhimurium TA98 TA μg/plate (±S9) μg/ml (±S9) 陰性 陰性 陰性 表 3 in vivo 試験検査項目 試験対象 用量 結果 小核試験 Crj:BDF 1 雄マウス 1,250 2,500 5,000 mg/kg 体重 腹腔内単回投与 (24 時間 ) 陰性 13
15 in vitro 及び in vivo の遺伝毒性試験の結果はいずれも陰性である また EMEA ではマウスリンフォーマ細胞を用いた試験において陰性の結果が得られたとしている ( 参照 4) これらのことから セファゾリンは生体にとって問題となる遺伝毒性はないものと考えられた 4. 急性毒性試験各種動物におけるセファゾリンの急性毒性試験の結果を表 4 に示した 表 4 各種動物におけるセファゾリンの急性毒性試験結果 (LD 50 ) 動物種 投与経路 LD 50 (mg/kg)(95% 信頼限界 ) 雄雌 経口 >11,000 >11,000 腹腔内 6,200 (5,700~6,700) 6,200 (5,300~7,400) マウス 静脈内 5,400 (4,800~6,100) 5,000 (4,100~6,000) 静脈内 >2,000 皮下 7,600 (6,500~8,900) 9,000 経口 >11,000 >11,000 腹腔内 7,400 (6,200~8,900) 7,600 (6,200~9,300) ラット 静脈内 3,300 (2,900~3,700) 3,000 (2,400~3,700) 静脈内 >2,000 皮下 11,000( 推定値 ) 10,000( 推定値 ) ウサギ 静脈内 2,500 皮下 >6,000 イヌ 静脈内 2,200 皮下 4,000 経口及び非経口の急性毒性は非常に低く 経口の LD 50 はマウス及びラットで 11,000 mg/kg 体重より大きく 静脈内投与による LD 50 は両者ともに 2,000 mg/kg 体重より大きかった ( 参照 4 6) 5. 亜急性毒性試験 (1)3 か月間亜急性毒性試験 ( ラット 経口投与 ) ラット (SD 系 雌雄各 10 匹 / 群 ) を用い セファゾリン水溶液の強制経口投与 ( 及び 2,000 mg/kg 体重 / 日 ) による 90 日間の反復経口投与毒性試験が実施された 200 mg/kg 体重 / 日投与群において盲腸腫大及び下痢が観察されたが 20 mg/kg 体重 / 日投与群では認められなかった ( 参照 4 7) 本試験における NOAEL は 20 mg/kg 体重 / 日と考えられた 14
16 なお 盲腸腫大については抗生物質の投与による腸内細菌叢の変動に伴う変化であり げっ歯類等の盲腸の特異性を考慮すると 毒性学的意義に乏しい変化と判断された (2)1 か月間亜急性毒性試験 ( ラット 腹腔内投与 ) 参考データ ラット (SD 系 雌雄各 10 匹 / 群 ) を用いセファゾリンを 1 か月間腹腔内投与 ( ,000 2,000 及び 4,000 mg/kg 体重 / 日 ) した 一般状態の観察 体重測定 尿検査及び血液化学的検査を行い 投与終了後は 剖検 臓器重量の測定及び病理組織学的検査を実施した 全投与群で 軟便 盲腸重量増加及び ALT の低下がみられた 500 mg/kg 体重 / 日以上投与群の雌では WBC 増加及び脾臓重量増加がみられ 1,000 mg/kg 体重 / 日以上投与群では腹部膨満及び腹部筋弛緩がみられた 投与中止により いずれの反応も速やかに消失した これらの反応は 抗生物質の多量投与に起因するものと考えられた 主要臓器に病理組織学的な変化は認められなかった ( 参照 6) (3)3 か月間及び 6 か月間亜急性毒性試験 ( ラット 皮下投与 ) 参考データ ラット (SD 系 雌雄各 10 匹 / 群 ) を用いセファゾリンを 3 か月間 ( ,000 2,000 及び 4,000 mg/kg 体重 / 日 ) 及び 6 か月間 ( ,000 及び 2,000 mg/kg 体重 ) 皮下投与した また 同系ラット ( 雌雄各 6 匹 / 群 ) を用い 3 か月間 ( ,000 2,000 及び 4,000 mg/kg 体重 / 日 ) 皮下投与した後 投与を中止し 7 週間観察した 一般状態の観察 体重測定 尿検査及び血液化学的検査を行い 投与終了後は 剖検 臓器重量の測定及び病理組織学的検査を実施した 全投与群で 軟便 盲腸重量増加 ALT の低下 注射部位の出血並びにそれに伴う炎症反応及び造血反応がみられ 1,000 mg/kg 体重 / 日以上投与群では腹部筋弛緩がみられた 投与中止により いずれの反応も速やかに消失した これらの反応は 抗生物質の多量投与又は投与液が高張であることに起因するものと考えられた 主要臓器に病理組織学的な変化は認められなかった ( 参照 6) (4)1 か月間亜急性毒性試験 ( イヌ 静脈内投与 ) 参考データ イヌ ( ビーグル種 雌雄各 2 匹又は 3 匹 / 群 ) を用いてセファゾリンを 1 か月間静脈内投与 ( 及び 500 mg/kg 体重 / 日 ) し 亜急性毒性試験を実施した 一般状態の観察 体重測定 尿検査及び血液化学的検査を行い 投与終了後は 剖検 臓器重量の測定及び病理組織学的検査を実施した 全投与群で ALT の低下及び肺気腫の剖検所見がみられ 125 mg/kg 体重 / 日以上投与群では嘔吐がみられた 250 mg/kg 体重 / 日以上投与群では肝臓及び腎臓の重量増加がみられ 500 mg/kg 体重 / 日以上投与群では軟便及び下痢がみられた これらの反応は 抗生物質の多量投与に起因すると考えられ 嘔吐の原因は明らかではないが セファゾリンの大量投与によるものと考えられた 主要臓器に病理組織学的な変化は認められなかった ( 参照 6) 15
17 (5)3 か月間及び 6 か月間亜急性毒性試験 ( イヌ 皮下投与 ) 参考データ イヌ ( ビーグル種 雌雄各 2 匹又は 3 匹 / 群 ) を用いセファゾリンを 3 か月間 ( 及び 1,000 mg/kg 体重 / 日 ) 及び 6 か月間 ( 及び 500 mg/kg 体重 / 日 ) 皮下投与し 亜急性毒性試験を実施した また 3 か月間皮下投与 (1,000 mg/kg 体重 / 日 ) したイヌを 最終投与後 1 か月間観察した 3 か月間試験の全投与群で ALT 及び Alb の低下 肝臓及び腎臓の重量増加並びに炎症反応及び造血反応がみられ 500 mg/kg 体重 / 日以上投与群では嘔吐及び体重減少がみられた 6 か月間試験の全投与群で ALT の低下 WBC の増加及び胸腺重量の低下がみられ 250 mg/kg 体重 / 日以上投与群では嘔吐がみられた 投与中止により いずれの反応も速やかに消失した 嘔吐の原因は明らかではないが セファゾリンの大量投与によるものと考えられた 主要臓器に病理組織学的な変化は認められなかった ( 参照 6) 6. 慢性毒性及び発がん性試験慢性毒性及び発がん性に関するデータは示されていない EMEA ではセファゾリンには structural alert がないこと 反復投与試験において前がん病変がみられないこと及び変異原性試験の結果から セファゾリンには発がん性がないと考えられたとしている ( 参照 4) 7. 生殖発生毒性試験 (1) 生殖発生毒性試験 ( ラット 経口投与 ) 妊娠ラット (Crl:CD(SD)BR VAF/plus 21~24 匹 / 群 ) を用い セファゾリン水溶液の強制経口投与 ( 及び 1,000 mg/kg 体重 / 日 ) により生殖発生毒性試験が実施された 母動物への影響 ( 下痢及び盲腸腫大 ) 並びに同腹児数及び胎児体重の減少が認められた これらの胎児への影響は 母動物への影響がみられた群に認められ 母動物への影響により二次的に発生した可能性も考えられた ( 参照 4 7) 本試験における母動物 ( 及び胎児 ) に対する NOAEL は 10 mg/kg 体重 / 日と考えられた なお 盲腸腫大については セファゾリンの投与による腸内細菌叢の変動に伴うものであり げっ歯類等の盲腸の特異性を考慮すると 毒性学的意義に乏しい変化と判断された (2) 生殖発生毒性試験 ( マウス ラット及びウサギ 皮下投与 ) 参考データ 生殖に対するセファゾリンの影響は マウス ラット及びウサギを用い SegmentⅠ Ⅱ 及びⅢ 試験により調べられた 皮下投与されたセファゾリンは ラットにおける雌雄の生殖能力や児動物の出生後の発育に影響しなかった セファゾリンは 皮下投与後 マウス及びウサギにおいて催奇形性を示さなかった ( 参照 4) 16
18 (3) 生殖発生毒性試験 ( マウス ラット及びウサギ 皮下及び静脈内投与 ) 参考データ マウス (ICR-JCL 系 ) 及びラット (SD-JCL 系 ) を用い マウスにおいてはセファゾリンを妊娠 7 日から 6 日間皮下投与 (500 1,000 2,000 及び 4,000 mg/kg 体重 / 日 ) 又は静脈内投与 ( 及び 1,000 mg/kg 体重 / 日 ) し また ラットには妊娠 9 日から 6 日間皮下投与 ( ,000 及び 2,000 mg/kg 体重 / 日 ) を行った マウスについては出生後の哺育について観察した また 日本白色種ウサギの未経産動物を用い 妊娠 8 日から 9 日間皮下投与 (64 及び 125 mg/kg 体重 / 日 ) を行った 妊娠母体の体重推移 着床数 胎児死亡率 胎児奇形発現率 胎児の泌尿生殖器異常 骨格異常 出生後の異常及び出生後の哺育に特記すべき異常所見は認められなかった ( 参照 5) 8. 対象動物を用いた試験 (1) 安全性試験 ( 牛 乳房内投与 ) 泌乳牛 (5 頭 / 群 ) を用い セファゾリンを 3 日間乳房内投与 (2 分房 600 mg/ 分房 / 日 ) し 安全性試験を実施した 一般状態の観察 分房別乳量測定 乳汁検査 血液学的及び血液生化学的検査を行い 供試牛 5 頭中 2 頭については 最終投与 3 日後にと殺し 各種臓器の剖検及び乳房の病理組織学的検査を行った 一般状態 泌乳状態及び乳汁検査では 全例に異常が認められなかった 血液学的及び血液生化学的検査においては 試験期間中に各項目について若干の変動がみられたが 一定した傾向は認められなかった 剖検では 検査した各臓器に異常はみられず 乳房の組織学的検査においても被験物質に起因すると考えられる異常所見は認められなかった 泌乳牛 (3 頭 / 群 ) を用い セファゾリンを単回乳房内投与 (4 分房 対照群 : 生理食塩液 試験群 :900 mg( 力価 )/ 分房 常用量の 2 倍量 ) し 安全性試験を実施した 対照群及び試験群ともに死亡例はなく 一般状態 乳量 体重 血液学的検査 血液生化学的検査 尿検査及び乳汁検査において 被験物質に起因すると考えられる異常所見は認められなかった ( 参照 6) (2) 安全性試験 ( 羊及び山羊 乳房内投与 ) セファゾリン製剤を単回乳房内投与 (250 mg/ 分房 推奨用量 ) した セファゾリンは羊及び山羊において局所的及び全身的に十分に耐容性があった ( 参照 5) 17
19 9. その他の試験 (1) 腎臓に対する作用ウサギ (NZW 種 雄 5 匹 / 群 ) にセファゾリンを静脈内投与 (200 mg/kg 体重 ) し 投与 2 3 及び 4 日後に BUN 及び Cre 濃度を測定し 投与 4 日後には 剖検及び病理組織学的検査を行った BUN 及び Cre 濃度に セファゾリン投与による変動は認められなかった 剖検では 軽度の腎皮質病変及び中等度の萎縮が認められ 病理組織学的検査では 軽度の尿細管拡張及び壊死が観察された ( 参照 8) (2) 皮膚感作性試験モルモットを用いたマキシミゼーション試験において セファゾリンは感作性を示さなかった ( 参照 4) (3) 抗原性についてセファゾリンの抗原性とベンジルペニシリン及びセファロリジンとの免疫学的交差性について検討した セファゾリンは ペニシリン系及び他のセファロスポリン系抗生物質と同様 そのタンパク結合物で免疫した実験動物において特異沈降抗体及び血球凝集抗体を産生した しかし セファゾリンとベンジルペニシリン アンピシリン及びセファロリジンとの交差性は弱かった セファゾリンの試験管内直接クームス反応を他の抗生物質と比較検討した結果 反応の陽性度はセファロチン ベンジルペニシリン セファロリジン セファゾリンの順で セファゾリンが最も低かった ( 参照 6) (4) 眼粘膜刺激性試験ウサギ ( 日本白色在来種 ) にセファゾリンを点眼し 局所麻酔作用 ( 角膜反射 ) 瞳孔影響及び眼粘膜刺激性について検討した セファゾリンに局所麻酔性はなく 瞳孔影響も示さず 眼粘膜刺激性も持たないと判断された ( 参照 6) 10. 微生物学的影響に関する試験 (1) 臨床分離菌に対する MIC 平成 18 年度食品安全確保総合調査 動物用抗菌性物質の微生物学的影響についての調査 ( 平成 18 年 9 月 ~ 平成 19 年 3 月 ) において ヒト臨床分離株等に対するセファゾリンの約 CFU/spot における MIC が調べられている ( 表 5) ( 参照 9) 18
20 表 5 ヒト腸内細菌に対する MIC 50 菌名 株数 最小発育阻止濃度 (µg/ml) MIC 50 範囲 通性嫌気性菌 Escherichia coli ~32 Enterococcus sp ~128 嫌気性菌 Bacteroides sp. 30 >128 64~>128 Fusobacterium sp ~16 Bifidobacterium sp ~16 Eubacterium sp ~>128 Clostridium sp ~32 Peptococcus sp./peptostreptococcus sp ~64 Prevotella sp ~>128 Lactobacillus sp ~64 Propionibacterium sp ~1 調査された菌種のうち 最も低い MIC 50 が報告されているのは Peptococcus sp. /Peptostreptococcus sp. 及び Prevotella sp.( 0.06 µg/ml) であった 本調査の結果から MIC calc2 は µg/ml( mg/ml) と算出された ( 参照 9) (2)EMEA 評価書における知見ヒトの腸内細菌叢由来の 10 種の細菌 (10~20 株 / 種 ) に対する活性データから 最も感受性の高かった種に基づいて セファゾリンのヒト腸内細菌叢に対する抗菌活性の NOEL 2.0 mg/l が設定された ( 参照 4) Ⅲ. 食品健康影響評価 1.EMEA における評価毒性学的 ADI は ラットの経口投与による生殖発生毒性試験における母動物毒性に関する NOEL(10 mg/kg 体重 ) に安全係数 100 を適用し 0.1 mg/kg 体重 / 日と設定している ( 参照 4 5) 微生物学的 ADI については ヒト腸内細菌叢の最も感受性の高い菌種に対する MIC 50 の mg/ml を用い 菌濃度の影響に対する補正係数 2 ヒト糞便量 150 ml ヒト体重 60 kg 腸内細菌叢が暴露される分画として 1 を適用し CVMP の算出式により 下記のとおり算定している ( 参照 4) 2 試験薬に活性のある最も関連のある属の平均 MIC50 の 90% 信頼限界の下限値 19
21 ADI = 0.002* 1 2* 2 150* 3 1* 4 60* 5 =0.01 mg/kg 体重 / 日 =600 µg/ 人 / 日 *1: ヒト腸内細菌叢の最も感受性の高い種に対する MIC50 の最頻値 :0.002 mg/ml *2: 菌濃度の影響に対する補正のため係数 2 を使用する *3: ヒト糞便量 ;150 ml *4: 摂取セファゾリンの全量が微生物学的に活性のある形態で腸管に留まるとして腸内細菌叢が暴露される分画を 1 とする *5: ヒト体重 ;60 kg EMEA では セファゾリンの毒性が低いため ADI はヒトの腸内細菌叢に対する影響に基づくのが妥当と判断し セファゾリンの ADI は 微生物学的 ADI に基づき 0.01 mg/kg 体重 / 日と設定している ( 参照 5) 2. 毒性学的 ADI についてセファゾリンは 各種遺伝毒性試験においていずれも陰性の結果が得られており 生体にとって問題となる遺伝毒性を示さないと考えられること及びセファゾリンには structural alert がないとされていることから 発がん性に関するデータは示されていないが 遺伝毒性発がん物質ではないと考えられ ADI を設定することが可能であると判断した 各種毒性試験のうち 何らかの毒性影響が認められた試験で最小の NOAEL は 妊娠ラットを用いた経口投与による生殖発生毒性試験から得られた母動物への影響 ( 下痢 ) 及び胎児体重の減少に基づく 10 mg/kg 体重 / 日であった 毒性学的 ADI を設定するに当たっては この NOAEL に安全係数として種差 10 個体差 10 慢性毒性試験及び発がん性試験が実施されていないことを考慮した追加の 10 の 1,000 を適用し 毒性学的 ADI は 0.01 mg/kg 体重 / 日と設定することが適切であると考えられた 3. 微生物学的 ADI について平成 18 年度食品安全確保総合調査 動物用抗菌性物質の微生物学的影響についての調査 により 詳細な知見が得られており この結果から VICH ガイドラインに基づいて微生物学的 ADI を算出することができる セファゾリンの MIC calc は mg/ml 結腸内容物に 220 g/ 日 微生物が利用可能な経口用量の分画 ( 細菌が暴露される分画 ) に 1 ヒト体重 60 kg を適用し VICH の算出式により 以下のとおり算定された 20
22 ADI = * 1 220* 2 1* 3 60* 4 = mg/kg 体重 / 日 *1:MICcalc *2: 結腸内容物 (g) *3: 微生物が利用可能な経口用量の分画 : セファゾリンの経口投与における糞中回収率等に関する知見が得られていないため 係数を 1 とする *4: ヒトの体重 (kg) 4.ADI の設定について微生物学的 ADI( mg/kg 体重 / 日 ) は 毒性学的 ADI(0.01 mg/kg 体重 / 日 ) よりも小さく 毒性学的影響についても勘案していると考えられることから セファゾリンの ADI としては mg/kg 体重 / 日と設定することが適当であると判断した 以上より セファゾリンの食品健康影響評価については ADI として次の値を採用することが適当と考えられる セファゾリン mg/kg 体重 / 日 暴露量については 当評価結果を踏まえ暫定基準値の見直しを行う際に確認することとする 21
23 表 6 EMEA における各種試験の無毒性量動物種試験投与量 (mg/kg 体重 / 日 ) NOEL(mg/kg 体重 / 日 ) 等 ラット 3か月間 (90 日間 ) ,000 亜急性毒性試験 ( 経口投与 ) イヌ 毒性学的 ADI 3 か月間 (90 日間 ) 亜急性毒性試験 250 ( 皮下投与 ) 生殖発生毒性試験 ,000 ( 経口投与 ) 3 か月間亜急性毒性 試験 ( 皮下投与 ) 6 か月間慢性毒性試 験 ( 皮下投与 ) 毒性学的 ADI の設定根拠 微生物学的 ADI 0.1 mg/kg 体重 / 日 SF:100 ラット生殖発生毒性試験 10 mg/kg 体重 / 日 0.01 mg/kg 体重 / 日 20 下痢 盲腸肥大 NOEL 設定できず腸管内での影響 ( 盲腸肥大 ) 10 下痢 盲腸肥大 250 投与による影響なし 250 投与による影響なし 微生物学的 ADI の設定根拠 MIC 50 :2.0 µg/ml(cvmp 算出式 ) ADI 0.01 mg/kg 体重 / 日 22
24 別紙: 検査値等略称 略称等 名称 ADI 一日摂取許容量 Alb アルビミン ALT アラニンアミノトランスフェラーゼ [= グルタミン酸ピルビン酸トランスアミナーゼ (GPT)] BUN 血液尿素窒素 CFU コロニー形成単位 C max Cre CVMP EMEA HPLC LD 50 MIC MIC 50 MRL NOAEL NOEL TLC Vd VICH WBC 最高濃度クレアチニン欧州医薬品審査庁動物用医薬品委員会欧州医薬品審査庁高速液体クロマトグラフィー半数致死量最小発育阻止濃度 50% 最小発育阻止濃度最大残留基準値無毒性量最大無作用量薄層クロマトグラフィー分布容積動物用医薬品の承認審査資料の調和に関する国際協力会議白血球数 23
25 参照 1. 食品 添加物等の規格基準 ( 昭和 34 年厚生省告示第 370 号 ) の一部を改正する件 ( 平成 17 年 11 月 29 日付 厚生労働省告示第 499 号 ) 2. The Merck Index, 14 th Edition, 生化学辞典第 3 版 ( 株 ) 東京化学同人 4. EMEA: COMMITTEE FOR VETERINARY MEDICINAL PRODUCTS, CEFAZOLIN, SUMMARY REPORT, EMEA: COMMITTEE FOR VETERINARY MEDICINAL PRODUCTS, CEFAZOLIN (extension to sheep and goats), SUMMARY REPORT, シェリング プラウアニマルヘルス株式会社 : 平成 20 年度残留基準見直しに関する資料 ( 医薬品承認申請資料概要より抽出 ) 7. EMEA: 問合せに対する回答 (2009, 未公表 ) 8. Kim JM, Ha JR, Oh SW, Kim HG, Lee JM, Kim BO, et al.: Comparison of In vivo nephrotoxicity in the rabbit by a Pyrrolidinyl-Thio Carbapenem CW J Microbiol Biotechnoi 2008, Nov; 18(11) p 食品安全委員会 : 平成 18 年度食品安全確保総合調査 動物用抗菌性物質の微生物学的影響についての調査 24
目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等 4 5. 開発の経緯 4 Ⅱ. 安全性に係る知見の概要 4 1. ヒト
 ( 案 ) 動物用医薬品評価書 ガミスロマイシンを有効成分 とする牛の注射剤 ( ザクトラン ) 2014 年 5 月 食品安全委員会肥料 飼料等専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等 4 5. 開発の経緯
( 案 ) 動物用医薬品評価書 ガミスロマイシンを有効成分 とする牛の注射剤 ( ザクトラン ) 2014 年 5 月 食品安全委員会肥料 飼料等専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等 4 5. 開発の経緯
目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7. 使用目的及び使用状況 6
 動物用医薬品評価書 リンコマイシン 2012 年 1 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7. 使用目的及び使用状況 6 Ⅱ. 安全性に係る知見の概要
動物用医薬品評価書 リンコマイシン 2012 年 1 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7. 使用目的及び使用状況 6 Ⅱ. 安全性に係る知見の概要
( 案 ) 対象外物質 評価書 アルギニン 2012 年 2 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質
 ( 案 ) 対象外物質 評価書 アルギニン 2012 年 2 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次 頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 2
( 案 ) 対象外物質 評価書 アルギニン 2012 年 2 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次 頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 2
目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 3 要約... 4 Ⅰ. 評価対象動物用医薬品の概要 用途 有効成分の一般名 化学名 分子式 分子
 資料 7-2 動物用医薬品評価書 アプラマイシン 2013 年 7 月 食品安全委員会 目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 3 要約... 4 Ⅰ. 評価対象動物用医薬品の概要... 5 1. 用途... 5 2. 有効成分の一般名... 5 3. 化学名... 5 4. 分子式... 5 5. 分子量... 5
資料 7-2 動物用医薬品評価書 アプラマイシン 2013 年 7 月 食品安全委員会 目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 3 要約... 4 Ⅰ. 評価対象動物用医薬品の概要... 5 1. 用途... 5 2. 有効成分の一般名... 5 3. 化学名... 5 4. 分子式... 5 5. 分子量... 5
目次頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会動物用医薬品専門調査会専門委員名簿... 5 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 5 要約... 7 Ⅰ. 評価対象動物用医薬品の概要 用途 有効成分の一般名... 8
 ( 案 ) 動物用医薬品評価書 セファピリン 2018 年 7 月 食品安全委員会肥料 飼料等専門調査会 目次頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会動物用医薬品専門調査会専門委員名簿... 5 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 5 要約... 7 Ⅰ. 評価対象動物用医薬品の概要... 8 1. 用途... 8 2. 有効成分の一般名...
( 案 ) 動物用医薬品評価書 セファピリン 2018 年 7 月 食品安全委員会肥料 飼料等専門調査会 目次頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会動物用医薬品専門調査会専門委員名簿... 5 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 5 要約... 7 Ⅰ. 評価対象動物用医薬品の概要... 8 1. 用途... 8 2. 有効成分の一般名...
( 案 ) 対象外物質 評価書 チアミン 2013 年 1 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質
 ( 案 ) 対象外物質 評価書 チアミン 2013 年 1 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 2 要約...
( 案 ) 対象外物質 評価書 チアミン 2013 年 1 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 2 要約...
目次 頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 2 要約... 3 Ⅰ. 評価対象動物用医薬品の概要 主剤 効能 効果 用法 用量 添加剤等 開発
 ( 案 ) 動物用医薬品評価書 塩酸セフチオフルを有効成分とする牛及び豚の注射剤 ( エクセネル RTU) 2015 年 3 月 食品安全委員会肥料 飼料等専門調査会 目次 頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 2 要約... 3 Ⅰ. 評価対象動物用医薬品の概要... 4 1. 主剤... 4 2. 効能 効果... 4
( 案 ) 動物用医薬品評価書 塩酸セフチオフルを有効成分とする牛及び豚の注射剤 ( エクセネル RTU) 2015 年 3 月 食品安全委員会肥料 飼料等専門調査会 目次 頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 2 要約... 3 Ⅰ. 評価対象動物用医薬品の概要... 4 1. 主剤... 4 2. 効能 効果... 4
目次頁 審議の経緯... 6 食品安全委員会委員名簿... 6 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 7 食品安全委員会農薬専門調査会専門委員名簿... 7 要約... 9 Ⅰ. 評価対象動物用医薬品 飼料添加物及び農薬の概要 用途 有効成分の一
 別添 動物用医薬品 飼料添加物及び農薬評価書 オキシテトラサイクリン クロルテトラサイクリン及びテトラサイクリン ( 第 2 版 ) 2013 年 11 月 食品安全委員会 目次頁 審議の経緯... 6 食品安全委員会委員名簿... 6 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 7 食品安全委員会農薬専門調査会専門委員名簿... 7 要約... 9 Ⅰ. 評価対象動物用医薬品 飼料添加物及び農薬の概要...
別添 動物用医薬品 飼料添加物及び農薬評価書 オキシテトラサイクリン クロルテトラサイクリン及びテトラサイクリン ( 第 2 版 ) 2013 年 11 月 食品安全委員会 目次頁 審議の経緯... 6 食品安全委員会委員名簿... 6 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 7 食品安全委員会農薬専門調査会専門委員名簿... 7 要約... 9 Ⅰ. 評価対象動物用医薬品 飼料添加物及び農薬の概要...
目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会動物用医薬品専門調査会専門委員名簿... 2 要約... 3 Ⅰ. 評価対象動物用医薬品の概要 主剤 効能 効果 用法 用量 添加剤等 開発の
 ( 案 ) 動物用医薬品評価書過酸化水素を有効成分とするふぐ目魚類及びすずき目魚類の外部寄生虫駆除剤 ( ムシオチール ) 2018 年 3 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会動物用医薬品専門調査会専門委員名簿... 2 要約... 3 Ⅰ. 評価対象動物用医薬品の概要... 4 1. 主剤... 4 2. 効能
( 案 ) 動物用医薬品評価書過酸化水素を有効成分とするふぐ目魚類及びすずき目魚類の外部寄生虫駆除剤 ( ムシオチール ) 2018 年 3 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会動物用医薬品専門調査会専門委員名簿... 2 要約... 3 Ⅰ. 評価対象動物用医薬品の概要... 4 1. 主剤... 4 2. 効能
< 別紙 1: 検査値等略称 > 略称 名称 A/G 比 アルブミン / グロブリン比 ADI 一日摂取許容量 ALT アラニンアミノトランスフェラーゼ ATPase adenosine triphosphatase アデノシントリフォスファターゼ AUC 血中薬物濃度 時間曲線下面積 Cmax E
 < 別紙 1: 検査値等略称 > 略称 名称 A/G 比 アルブミン / グロブリン比 ADI 一日摂取許容量 ALT アラニンアミノトランスフェラーゼ ATPase adenosine triphosphatase アデノシントリフォスファターゼ AUC 血中薬物濃度 時間曲線下面積 Cmax ECL ELISA EMEA FPIA GC/MS Glu 最高濃度 Enterochromaffin-like
< 別紙 1: 検査値等略称 > 略称 名称 A/G 比 アルブミン / グロブリン比 ADI 一日摂取許容量 ALT アラニンアミノトランスフェラーゼ ATPase adenosine triphosphatase アデノシントリフォスファターゼ AUC 血中薬物濃度 時間曲線下面積 Cmax ECL ELISA EMEA FPIA GC/MS Glu 最高濃度 Enterochromaffin-like
目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量
 資料 1-2 動物用医薬品評価書 オルビフロキサシン 2013 年 10 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6.
資料 1-2 動物用医薬品評価書 オルビフロキサシン 2013 年 10 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6.
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
テイカ製薬株式会社 社内資料
 テイカ製薬株式会社社内資料 アレルギー性結膜炎治療剤トラニラスト点眼液.5% TS TRANILAST Ophthalmic Solution.5% TS 生物学的同等性に関する資料 発売元 : 興和株式会社 製造販売元 : テイカ製薬株式会社 9 年 月作成 TSTR5BE9 ラット及びモルモットアレルギー性結膜炎モデルにおける生物学的同等性試験 Ⅰ. 試験の目的トラニラスト点眼液.5% TS および標準製剤の生物学的同等性をラット受動感作アレルギー性結膜炎モデル及びモルモット能動感作アレルギー性結膜炎モデルを用い薬力学的に検討した
テイカ製薬株式会社社内資料 アレルギー性結膜炎治療剤トラニラスト点眼液.5% TS TRANILAST Ophthalmic Solution.5% TS 生物学的同等性に関する資料 発売元 : 興和株式会社 製造販売元 : テイカ製薬株式会社 9 年 月作成 TSTR5BE9 ラット及びモルモットアレルギー性結膜炎モデルにおける生物学的同等性試験 Ⅰ. 試験の目的トラニラスト点眼液.5% TS および標準製剤の生物学的同等性をラット受動感作アレルギー性結膜炎モデル及びモルモット能動感作アレルギー性結膜炎モデルを用い薬力学的に検討した
目次 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 食品安全委員会動物用医薬品専門調査会確認評価部会委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5.
 動物用医薬品評価書 エチプロストントロメタミン 2007 年 5 月 (2009 年 1 月一部改訂 ) 食品安全委員会 目次 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 食品安全委員会動物用医薬品専門調査会確認評価部会委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4.
動物用医薬品評価書 エチプロストントロメタミン 2007 年 5 月 (2009 年 1 月一部改訂 ) 食品安全委員会 目次 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 食品安全委員会動物用医薬品専門調査会確認評価部会委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4.
目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 3 要約... 4 Ⅰ. 評価対象動物用医薬品及び飼料添加物の概要 用途 有効成分の一般名 化学名 分子式...
 ( 案 ) 動物用医薬品 飼料添加物評価書 モランテル 2013 年 6 月 食品安全委員会肥料 飼料等専門調査会 目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 3 要約... 4 Ⅰ. 評価対象動物用医薬品及び飼料添加物の概要... 5 1. 用途... 5 2. 有効成分の一般名... 5 3. 化学名... 5 4.
( 案 ) 動物用医薬品 飼料添加物評価書 モランテル 2013 年 6 月 食品安全委員会肥料 飼料等専門調査会 目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 3 要約... 4 Ⅰ. 評価対象動物用医薬品及び飼料添加物の概要... 5 1. 用途... 5 2. 有効成分の一般名... 5 3. 化学名... 5 4.
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
<4D F736F F D DF82B58E9197BF E D89BF8F9188C494BD896694C52E646F63>
 ( 案 ) 資料 対象外物質 評価書 チアミン 0 年 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 年法律第 号 ) 第 条第 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次 頁 審議の経緯... 食品安全委員会委員名簿... 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 要約... Ⅰ. 評価対象動物用医薬品及び飼料添加物の概要...
( 案 ) 資料 対象外物質 評価書 チアミン 0 年 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 年法律第 号 ) 第 条第 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次 頁 審議の経緯... 食品安全委員会委員名簿... 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 要約... Ⅰ. 評価対象動物用医薬品及び飼料添加物の概要...
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
( 問 ) 日本の現代の食生活等において 健康への影響に気をつけなければならないと考える項目はどれですか? その必要が大きい順に 10 個選んでください 1. 病原性微生物 2. ふぐ毒 キノコの毒等の自然毒 3. 農薬の残留 4. 食品添加物 5. 動物用医薬品の畜産物への残留 6. アクリルアミ
 資料 4 食品安全委員会における農薬の食品健康影響評価について 内閣府食品安全委員会事務局 ( 問 ) 日本の現代の食生活等において 健康への影響に気をつけなければならないと考える項目はどれですか? その必要が大きい順に 10 個選んでください 1. 病原性微生物 2. ふぐ毒 キノコの毒等の自然毒 3. 農薬の残留 4. 食品添加物 5. 動物用医薬品の畜産物への残留 6. アクリルアミド クロロプロパノール等
資料 4 食品安全委員会における農薬の食品健康影響評価について 内閣府食品安全委員会事務局 ( 問 ) 日本の現代の食生活等において 健康への影響に気をつけなければならないと考える項目はどれですか? その必要が大きい順に 10 個選んでください 1. 病原性微生物 2. ふぐ毒 キノコの毒等の自然毒 3. 農薬の残留 4. 食品添加物 5. 動物用医薬品の畜産物への残留 6. アクリルアミド クロロプロパノール等
資料3 農薬の気中濃度評価値の設定について(案)
 資料 3 農薬の気中濃度評価値の設定について ( 案 ) 1. 気中濃度評価値の定義及び算出方法 1.1. 本事業における定義気中濃度評価値とは 人の健康を保護する観点から 街路樹や公園などで使用される農薬による人の健康への影響を評価する際の目安として 吸入毒性試験成績を基に適切な安全幅を見込んで設定する 一般に 気中濃度評価値以下の濃度であれば 人の健康に好ましくない影響が起きることはないと考えられる
資料 3 農薬の気中濃度評価値の設定について ( 案 ) 1. 気中濃度評価値の定義及び算出方法 1.1. 本事業における定義気中濃度評価値とは 人の健康を保護する観点から 街路樹や公園などで使用される農薬による人の健康への影響を評価する際の目安として 吸入毒性試験成績を基に適切な安全幅を見込んで設定する 一般に 気中濃度評価値以下の濃度であれば 人の健康に好ましくない影響が起きることはないと考えられる
一般薬理試験及び毒性試験 2. 毒性試験 (1) 単回投与毒性試験 ( マウス イヌ サル ) 33) 動物種 投与経路 投与量 (mg/kg) 概略の致死量 (mg/kg) マウス 経口 2000 雌雄 :>2000 腹腔内 300 雌雄 :300 経口 750 雌雄 :>750 腹腔内 500
 枢神経系影響なし心血管系一般薬理試験及び毒性試験 1. 一般薬理試験 32) 試験項目 動物種 ( 性 動物数 ) 投与経路投与量主な結果 評価中一般状態 体温及び自発運動量に及ぼす作用 (Irwin 法 ) ( 雄 4 ) 30 100 300mg/kg herg 電流に及ぼす作用 ( ホールセルパッチクランプ法 ) herg 発現ヒト胎児腎細胞株 HEK293 in vitro 4 20 100μmol/L
枢神経系影響なし心血管系一般薬理試験及び毒性試験 1. 一般薬理試験 32) 試験項目 動物種 ( 性 動物数 ) 投与経路投与量主な結果 評価中一般状態 体温及び自発運動量に及ぼす作用 (Irwin 法 ) ( 雄 4 ) 30 100 300mg/kg herg 電流に及ぼす作用 ( ホールセルパッチクランプ法 ) herg 発現ヒト胎児腎細胞株 HEK293 in vitro 4 20 100μmol/L
加工デンプン(栄養学的観点からの検討)
 加工デンプン ( 栄養学的観点からの検討 ) 加工デンプンは 未加工デンプンが有する物理化学的性状を変化させ 利便性の拡大を図るために加工処理を施したものであり 通常 未加工デンプンに代わるものとして用いられる デンプンは三大栄養素の一つである炭水化物の摂取源であることから 炭水化物の摂取量 加工デンプンの摂取量 加工デンプンの体内動態 ( 消化酵素分解率 ) から 加工デンプンの食品への使用について栄養学的観点からの検討を行う
加工デンプン ( 栄養学的観点からの検討 ) 加工デンプンは 未加工デンプンが有する物理化学的性状を変化させ 利便性の拡大を図るために加工処理を施したものであり 通常 未加工デンプンに代わるものとして用いられる デンプンは三大栄養素の一つである炭水化物の摂取源であることから 炭水化物の摂取量 加工デンプンの摂取量 加工デンプンの体内動態 ( 消化酵素分解率 ) から 加工デンプンの食品への使用について栄養学的観点からの検討を行う
<4D F736F F D A837B D89BF8F C4816A2E2E646F63>
 資料 ( 案 ) 対象外物質 評価書 リボフラビン 0 年 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 年法律第 号 ) 第 条第 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 1 1 1 1 1 1 1 1 0 1 0 1 目次頁 審議の経緯... 食品安全委員会委員名簿... 食品安全委員会肥料 飼料等専門調査会専門委員名簿...
資料 ( 案 ) 対象外物質 評価書 リボフラビン 0 年 月 食品安全委員会肥料 飼料等専門調査会 食品衛生法 ( 昭和 年法律第 号 ) 第 条第 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 1 1 1 1 1 1 1 1 0 1 0 1 目次頁 審議の経緯... 食品安全委員会委員名簿... 食品安全委員会肥料 飼料等専門調査会専門委員名簿...
シプロフロキサシン錠 100mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを
 シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等 4 5. 開発の経緯 4 Ⅱ. 安全性に係る知見の概要 5 1. ヒト
 ( 案 ) 動物用医薬品評価書 ラクトフェリンを有効成分とする牛の乳房注入剤 ( マストラック ) 2012 年 2 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等 4 5. 開発の経緯
( 案 ) 動物用医薬品評価書 ラクトフェリンを有効成分とする牛の乳房注入剤 ( マストラック ) 2012 年 2 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等 4 5. 開発の経緯
( 案 ) 動物用医薬品評価書 フロルフェニコール及びフルニキシンメグルミンを有効成分とする牛の注射剤 ( レスフロール ) 2015 年 8 月 食品安全委員会動物用医薬品専門調査会食品安全委員会肥料 飼料等専門調査会
 ( 案 ) 動物用医薬品評価書 フロルフェニコール及びフルニキシンメグルミンを有効成分とする牛の注射剤 ( レスフロール ) 2015 年 8 月 食品安全委員会動物用医薬品専門調査会食品安全委員会肥料 飼料等専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿 2 要約 4 I. 評価対象動物用医薬品の概要
( 案 ) 動物用医薬品評価書 フロルフェニコール及びフルニキシンメグルミンを有効成分とする牛の注射剤 ( レスフロール ) 2015 年 8 月 食品安全委員会動物用医薬品専門調査会食品安全委員会肥料 飼料等専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿 2 要約 4 I. 評価対象動物用医薬品の概要
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
2012 年 2 月 29 日放送 CLSI ブレイクポイント改訂の方向性 東邦大学微生物 感染症学講師石井良和はじめに薬剤感受性試験成績を基に誰でも適切な抗菌薬を選択できるように考案されたのがブレイクポイントです 様々な国の機関がブレイクポイントを提唱しています この中でも 日本化学療法学会やアメ
 2012 年 2 月 29 日放送 CLSI ブレイクポイント改訂の方向性 東邦大学微生物 感染症学講師石井良和はじめに薬剤感受性試験成績を基に誰でも適切な抗菌薬を選択できるように考案されたのがブレイクポイントです 様々な国の機関がブレイクポイントを提唱しています この中でも 日本化学療法学会やアメリカ臨床検査標準委員会 :Clinical and Laboratory Standards Institute
2012 年 2 月 29 日放送 CLSI ブレイクポイント改訂の方向性 東邦大学微生物 感染症学講師石井良和はじめに薬剤感受性試験成績を基に誰でも適切な抗菌薬を選択できるように考案されたのがブレイクポイントです 様々な国の機関がブレイクポイントを提唱しています この中でも 日本化学療法学会やアメリカ臨床検査標準委員会 :Clinical and Laboratory Standards Institute
Microsoft Word - 評価書 ホスホマイシン doc
 動物用医薬品評価書 ホスホマイシン 2010 年 4 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7.
動物用医薬品評価書 ホスホマイシン 2010 年 4 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 要約 5 Ⅰ. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7.
目次 頁 審議の経緯... 4 食品安全委員会委員名簿... 4 食品安全委員会動物用医薬品専門調査会専門委員名簿... 5 要約... 6 Ⅰ. 評価対象動物用医薬品の概要 用途 7 2. 有効成分の一般名 7 3. 化学名 7 4. 分子式 7 5. 分子量 7 6. 構造式 7
 ( 案 ) 動物用医薬品評価書 モネパンテル ( 第 2 版 ) 2017 年 12 月 食品安全委員会動物用医薬品専門調査会 目次 頁 審議の経緯... 4 食品安全委員会委員名簿... 4 食品安全委員会動物用医薬品専門調査会専門委員名簿... 5 要約... 6 Ⅰ. 評価対象動物用医薬品の概要... 7 1. 用途 7 2. 有効成分の一般名 7 3. 化学名 7 4. 分子式 7 5. 分子量
( 案 ) 動物用医薬品評価書 モネパンテル ( 第 2 版 ) 2017 年 12 月 食品安全委員会動物用医薬品専門調査会 目次 頁 審議の経緯... 4 食品安全委員会委員名簿... 4 食品安全委員会動物用医薬品専門調査会専門委員名簿... 5 要約... 6 Ⅰ. 評価対象動物用医薬品の概要... 7 1. 用途 7 2. 有効成分の一般名 7 3. 化学名 7 4. 分子式 7 5. 分子量
フェバンテルの食品健康影響評価について(案)
 チルミコシン 1. 概要 (1) 品目名 : チルミコシン (Tilmicosin) (2) 用途 : 我が国においては牛及び豚の肺炎の治療チルミコシンはマクロライド系抗生物質であり 牛における Pasteurella multocida Mannheimia (Pasteurella) haemolytica Mycoplasma bovis M. bovirhinis M. dispar 及び
チルミコシン 1. 概要 (1) 品目名 : チルミコシン (Tilmicosin) (2) 用途 : 我が国においては牛及び豚の肺炎の治療チルミコシンはマクロライド系抗生物質であり 牛における Pasteurella multocida Mannheimia (Pasteurella) haemolytica Mycoplasma bovis M. bovirhinis M. dispar 及び
あった AUCtはで ± ng hr/ml で ± ng hr/ml であった 2. バイオアベイラビリティの比較およびの薬物動態パラメータにおける分散分析の結果を Table 4 に示した また 得られた AUCtおよび Cmaxについてとの対数値
 モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに
 ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
資料4-4 木酢液の検討状況について
 資料 4-4 木酢液の検討状況について 木酢液の薬効 薬害 安全性等に係る検討に関し 第 6 回及び第 8 回合同 会合において 以下のとおり整理された 安全性 薬効 薬害に係る試験の実施 ( 論点 ) 第 6 回合同会合において検討した結果 変異原性試験 ( 復帰突然変異原性試験 ) の結果について指摘があった また 1) 木酢液 に含まれるホルムアルデヒドについては IARC( 国際ガン研究機関
資料 4-4 木酢液の検討状況について 木酢液の薬効 薬害 安全性等に係る検討に関し 第 6 回及び第 8 回合同 会合において 以下のとおり整理された 安全性 薬効 薬害に係る試験の実施 ( 論点 ) 第 6 回合同会合において検討した結果 変異原性試験 ( 復帰突然変異原性試験 ) の結果について指摘があった また 1) 木酢液 に含まれるホルムアルデヒドについては IARC( 国際ガン研究機関
目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 3 要約 4 Ⅰ. 評価対象動物用医薬品の概要 5 1. 用途 5 2. 有効成分の一般名 5 3. 化学名 5 4. 分子式 5 5. 分子量 5 6. 構造式 5 7. 使用目的及び使用状況 5
 動物用医薬品評価書 プロペタンホス 2013 年 8 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 3 要約 4 Ⅰ. 評価対象動物用医薬品の概要 5 1. 用途 5 2. 有効成分の一般名 5 3. 化学名 5 4. 分子式 5 5. 分子量 5 6. 構造式 5 7. 使用目的及び使用状況 5 Ⅱ. 安全性に係る知見の概要
動物用医薬品評価書 プロペタンホス 2013 年 8 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 3 要約 4 Ⅰ. 評価対象動物用医薬品の概要 5 1. 用途 5 2. 有効成分の一般名 5 3. 化学名 5 4. 分子式 5 5. 分子量 5 6. 構造式 5 7. 使用目的及び使用状況 5 Ⅱ. 安全性に係る知見の概要
生殖発生毒性試験の実施時期について
 S5(R3) Informal 医薬品の生殖発生毒性試験法 ( 改訂 ) 日本製薬工業協会 ICH プロジェクト委員会 S5(R3) Informal WG トピックリーダー藤原道夫 1 本日の内容 1. リスボンInformal WG 対面会議開催に至る経緯 2. ミネアポリス会議以後の活動 3. S5(R3) コンセプトペーパーの変遷 4. S5(R3) に向けて検討されるべき事項 5. S5(R3)
S5(R3) Informal 医薬品の生殖発生毒性試験法 ( 改訂 ) 日本製薬工業協会 ICH プロジェクト委員会 S5(R3) Informal WG トピックリーダー藤原道夫 1 本日の内容 1. リスボンInformal WG 対面会議開催に至る経緯 2. ミネアポリス会議以後の活動 3. S5(R3) コンセプトペーパーの変遷 4. S5(R3) に向けて検討されるべき事項 5. S5(R3)
記載データ一覧 品目名 製造販売業者 BE 品質再評価 1 マグミット錠 250mg 協和化学工業 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 # 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 # 5 酸化マグネシ
 医療用医薬品最新品質情報集 ( ブルーブック ) 2017.7.7 初版 有効成分 酸化マグネシウム 品目名 ( 製造販売業者 ) 1 マグミット錠 250mg 協和化学工業 後発医薬品 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 5 酸化マグネシウム錠 250mg ケンエー
医療用医薬品最新品質情報集 ( ブルーブック ) 2017.7.7 初版 有効成分 酸化マグネシウム 品目名 ( 製造販売業者 ) 1 マグミット錠 250mg 協和化学工業 後発医薬品 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 5 酸化マグネシウム錠 250mg ケンエー
PowerPoint プレゼンテーション
 第 2 回サラシア属植物シンポジウム講演要旨平成 21 年 8 月 25 日近畿大学において サラシア属植物エキス含有飲料の食後血糖上昇抑制効果と長期摂取および過剰摂取の安全性の検討 平成 21 年 8 月 25 日 企画室北林広巳 1 サラシアエキスの有効性と安全性 サラシア属植物含有飲料について 有効性試験 安全性試験の結果をご報告いたします 注 ) TB0018 コタラノール L はサラシア属植物エキス含有飲料を指します
第 2 回サラシア属植物シンポジウム講演要旨平成 21 年 8 月 25 日近畿大学において サラシア属植物エキス含有飲料の食後血糖上昇抑制効果と長期摂取および過剰摂取の安全性の検討 平成 21 年 8 月 25 日 企画室北林広巳 1 サラシアエキスの有効性と安全性 サラシア属植物含有飲料について 有効性試験 安全性試験の結果をご報告いたします 注 ) TB0018 コタラノール L はサラシア属植物エキス含有飲料を指します
目次頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会動物用医薬品専門調査会専門委員名簿... 3 要約... 4 I. 評価対象動物用医薬品の概要 用途 有効成分の一般名 化学名 分子式 分子量
 ( 案 ) 動物用医薬品評価書 ベタメタゾン 2017 年 11 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会動物用医薬品専門調査会専門委員名簿... 3 要約... 4 I. 評価対象動物用医薬品の概要... 5 1. 用途... 5 2. 有効成分の一般名... 5 3. 化学名... 5 4. 分子式... 5 5.
( 案 ) 動物用医薬品評価書 ベタメタゾン 2017 年 11 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会動物用医薬品専門調査会専門委員名簿... 3 要約... 4 I. 評価対象動物用医薬品の概要... 5 1. 用途... 5 2. 有効成分の一般名... 5 3. 化学名... 5 4. 分子式... 5 5.
参考1中酪(H23.11)
 - 1- 参考 1 - 2- - 3- - 4- - 5- - 6- - 7- - 8- 別添 1 牛乳の比重増加要因の解析 国立大学法人帯広畜産大学畜産フィールド科学センター准教授木田克弥 背景 乳および乳製品の成分規格等に関する省令 ( 乳等省令 ) において 生乳の比重は 1.28-1.34 に規定されている 一方 乳牛の遺伝的改良 ( 乳量および乳成分率の向上 ) に成果として 昨今の生乳の比重は増加傾向にあり
- 1- 参考 1 - 2- - 3- - 4- - 5- - 6- - 7- - 8- 別添 1 牛乳の比重増加要因の解析 国立大学法人帯広畜産大学畜産フィールド科学センター准教授木田克弥 背景 乳および乳製品の成分規格等に関する省令 ( 乳等省令 ) において 生乳の比重は 1.28-1.34 に規定されている 一方 乳牛の遺伝的改良 ( 乳量および乳成分率の向上 ) に成果として 昨今の生乳の比重は増加傾向にあり
目次 頁 審議の経緯 4 食品安全委員会委員名簿 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 第 73 回肥料 飼料等専門調査会専門参考人名簿 4 食品安全委員会農薬専門調査会専門委員名簿 5 要約 6 Ⅰ. 評価対象農薬 飼料添加物の概要 7 1. 用途 7 2. 有効成分の一般名
 ( 案 ) 飼料添加物 農薬評価書 エトキシキン 2013 年 9 月 食品安全委員会肥料 飼料等専門調査会 食品安全委員会農薬専門調査会 目次 頁 審議の経緯 4 食品安全委員会委員名簿 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 第 73 回肥料 飼料等専門調査会専門参考人名簿 4 食品安全委員会農薬専門調査会専門委員名簿 5 要約 6 Ⅰ. 評価対象農薬 飼料添加物の概要 7 1.
( 案 ) 飼料添加物 農薬評価書 エトキシキン 2013 年 9 月 食品安全委員会肥料 飼料等専門調査会 食品安全委員会農薬専門調査会 目次 頁 審議の経緯 4 食品安全委員会委員名簿 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿 4 第 73 回肥料 飼料等専門調査会専門参考人名簿 4 食品安全委員会農薬専門調査会専門委員名簿 5 要約 6 Ⅰ. 評価対象農薬 飼料添加物の概要 7 1.
目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 I. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等 4 5. 開発の経緯及び使用状況 4 II. 安全性に係る知見の概要
 ( 案 ) 動物用医薬品評価書 クエン酸モサプリドを有効成分とする馬の強制経口投与剤 ( プロナミド散 1%) 2014 年 8 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 I. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等
( 案 ) 動物用医薬品評価書 クエン酸モサプリドを有効成分とする馬の強制経口投与剤 ( プロナミド散 1%) 2014 年 8 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 I. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等
Microsoft Word 意見募集用 サーコバック.doc
 ( 案 ) 動物用医薬品評価書 豚サーコウイルス (2 型 ) 感染症不活化ワクチン ( 油性アジュバント加懸濁用液 )( サーコバック ) 2008 年 3 月 食品安全委員会動物用医薬品専門調査会 目次 頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3.
( 案 ) 動物用医薬品評価書 豚サーコウイルス (2 型 ) 感染症不活化ワクチン ( 油性アジュバント加懸濁用液 )( サーコバック ) 2008 年 3 月 食品安全委員会動物用医薬品専門調査会 目次 頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3.
有害性総合評価
 別冊 6 初期リスク評価書 No.55( 初期 ) ニトロメタン (Nitromethane) 目次 本文 1 別添 1 有害性総合評価表 6 別添 2 有害性評価書 9 別添 3 ばく露作業報告集計表 20 別添 4 測定分析法 21 2011 年 7 月 厚生労働省 化学物質のリスク評価検討会 1 物理的性状等 (1) 化学物質の基本情報名称 : ニトロメタン別名 :Nitrocarbol 化学式
別冊 6 初期リスク評価書 No.55( 初期 ) ニトロメタン (Nitromethane) 目次 本文 1 別添 1 有害性総合評価表 6 別添 2 有害性評価書 9 別添 3 ばく露作業報告集計表 20 別添 4 測定分析法 21 2011 年 7 月 厚生労働省 化学物質のリスク評価検討会 1 物理的性状等 (1) 化学物質の基本情報名称 : ニトロメタン別名 :Nitrocarbol 化学式
目次 頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 2 要約... 4 Ⅰ. 評価対象動物用医薬品及び飼料添加物の概要 用途 有効成分の一般名 化学名 分子式...
 資料 7-4 ( 参考資料 ) 動物用医薬品 飼料添加物 対象外物質 評価書 カルシフェロール及び 25- ヒドロキシコレカルシフェロール 2014 年 7 月 食品安全委員会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次 頁 審議の経緯... 2 食品安全委員会委員名簿...
資料 7-4 ( 参考資料 ) 動物用医薬品 飼料添加物 対象外物質 評価書 カルシフェロール及び 25- ヒドロキシコレカルシフェロール 2014 年 7 月 食品安全委員会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次 頁 審議の経緯... 2 食品安全委員会委員名簿...
第2章マウスを用いた動物モデルに関する研究
 . ホルムアルデヒドおよびトルエン吸入曝露によるマウスのくしゃみ様症状の定量 およびトルエン代謝物の測定 研究協力者 : 欅田尚樹 嵐谷奎一 ( 産業医科大学産業保健学部 ) (1) 研究要旨ホルムアルデヒド曝露により特異的にくしゃみの増加が観察されたが トルエン曝露でくしゃみの誘発はなかった トルエンの曝露指標として 尿中代謝産物である馬尿酸を測定した 曝露直後には高く翌日には正常レベルに戻っており
. ホルムアルデヒドおよびトルエン吸入曝露によるマウスのくしゃみ様症状の定量 およびトルエン代謝物の測定 研究協力者 : 欅田尚樹 嵐谷奎一 ( 産業医科大学産業保健学部 ) (1) 研究要旨ホルムアルデヒド曝露により特異的にくしゃみの増加が観察されたが トルエン曝露でくしゃみの誘発はなかった トルエンの曝露指標として 尿中代謝産物である馬尿酸を測定した 曝露直後には高く翌日には正常レベルに戻っており
PEGIFNα2b 目次 (1 of 2) 略語一覧表 毒性試験の概要文
 ペグインターフェロンアルファ 2b( 遺伝子組換え ) 第 2 部 CTD の概要 (6) 非臨床試験の概要文及び概要表 6 毒性試験の概要文 シェリング プラウ株式会社 PEGIFNα2b 目次 (1 of 2) 略語一覧表........................................................................... 1 2.6.6 毒性試験の概要文...............................................................
ペグインターフェロンアルファ 2b( 遺伝子組換え ) 第 2 部 CTD の概要 (6) 非臨床試験の概要文及び概要表 6 毒性試験の概要文 シェリング プラウ株式会社 PEGIFNα2b 目次 (1 of 2) 略語一覧表........................................................................... 1 2.6.6 毒性試験の概要文...............................................................
リスクコミュニケーションのための化学物質ファクトシート 2012年版
 trans1,2 ジクロロエチレン 別 名 :1,2 DCE trans1,2dce PRTR 政令番号 :224 ( 旧政令番号 :1119) CAS 番 号 :156605 構 造 式 : trans1,2ジクロロエチレンは 副生成物や分解物として生成され この物質としての用途はないと考えられます 2009 年度の PRTR データでは 環境中への排出量は約 8.5 トンでした すべてが事業所から排出されたもので
trans1,2 ジクロロエチレン 別 名 :1,2 DCE trans1,2dce PRTR 政令番号 :224 ( 旧政令番号 :1119) CAS 番 号 :156605 構 造 式 : trans1,2ジクロロエチレンは 副生成物や分解物として生成され この物質としての用途はないと考えられます 2009 年度の PRTR データでは 環境中への排出量は約 8.5 トンでした すべてが事業所から排出されたもので
平成 31 年 3 月 14 日中央環境審議会土壌農薬部会農薬小委員会 ( 第 69 回 ) イソプロカルブ (MIPC) 資料 資料 5-2 安全性評価資料 イソプロカルブ (MIPC) 2019 年 2 月 環境省水 大気環境局土壌環境課農薬環境管理室 1
 イソプロカルブ (MIPC) 資料 資料 - 安全性評価資料 イソプロカルブ (MIPC) 0 年 月 環境省水 大気環境局土壌環境課農薬環境管理室 イソプロカルブ (MIPC) 資料 目次 Ⅰ. 評価対象農薬の概要.... 物質概要.... 作用機構等.... 各種物性... Ⅱ. 試験結果概要.... 動物体内運命試験... () ラット... 吸収... 体内分布... 代謝... 排泄....
イソプロカルブ (MIPC) 資料 資料 - 安全性評価資料 イソプロカルブ (MIPC) 0 年 月 環境省水 大気環境局土壌環境課農薬環境管理室 イソプロカルブ (MIPC) 資料 目次 Ⅰ. 評価対象農薬の概要.... 物質概要.... 作用機構等.... 各種物性... Ⅱ. 試験結果概要.... 動物体内運命試験... () ラット... 吸収... 体内分布... 代謝... 排泄....
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2012 年 1 月 25 日放送 歯性感染症における経口抗菌薬療法 東海大学外科学系口腔外科教授金子明寛 今回は歯性感染症における経口抗菌薬療法と題し歯性感染症からの分離菌および薬 剤感受性を元に歯性感染症の第一選択薬についてお話し致します 抗菌化学療法のポイント歯性感染症原因菌は嫌気性菌および好
 2012 年 1 月 25 日放送 歯性感染症における経口抗菌薬療法 東海大学外科学系口腔外科教授金子明寛 今回は歯性感染症における経口抗菌薬療法と題し歯性感染症からの分離菌および薬 剤感受性を元に歯性感染症の第一選択薬についてお話し致します 抗菌化学療法のポイント歯性感染症原因菌は嫌気性菌および好気性菌の複数菌感染症です 嫌気性菌の占める割合が 高くおよそ 2:1 の頻度で検出されます 嫌気性菌では
2012 年 1 月 25 日放送 歯性感染症における経口抗菌薬療法 東海大学外科学系口腔外科教授金子明寛 今回は歯性感染症における経口抗菌薬療法と題し歯性感染症からの分離菌および薬 剤感受性を元に歯性感染症の第一選択薬についてお話し致します 抗菌化学療法のポイント歯性感染症原因菌は嫌気性菌および好気性菌の複数菌感染症です 嫌気性菌の占める割合が 高くおよそ 2:1 の頻度で検出されます 嫌気性菌では
目次 審議の経緯... 4 食品安全委員会委員名簿... 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 4 要約... 6 Ⅰ. 評価対象動物用医薬品の概要 用途 有効成分の一般名 化学名 分子式 分子量.
 動物用医薬品評価書 クロラムフェニコール 2014 年 3 月 食品安全委員会 目次 審議の経緯... 4 食品安全委員会委員名簿... 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 4 要約... 6 Ⅰ. 評価対象動物用医薬品の概要... 7 1. 用途... 7 2. 有効成分の一般名... 7 3. 化学名... 7 4. 分子式... 7 5. 分子量... 7 6. 構造式...
動物用医薬品評価書 クロラムフェニコール 2014 年 3 月 食品安全委員会 目次 審議の経緯... 4 食品安全委員会委員名簿... 4 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 4 要約... 6 Ⅰ. 評価対象動物用医薬品の概要... 7 1. 用途... 7 2. 有効成分の一般名... 7 3. 化学名... 7 4. 分子式... 7 5. 分子量... 7 6. 構造式...
(41)
 資料 10-2 対象外物質 評価書 グリセリン酢酸脂肪酸エステル 2015 年 5 月 食品安全委員会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会農薬専門調査会専門委員名簿... 2 要約...
資料 10-2 対象外物質 評価書 グリセリン酢酸脂肪酸エステル 2015 年 5 月 食品安全委員会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会農薬専門調査会専門委員名簿... 2 要約...
Microsoft PowerPoint - 補足資料(セット版-2).ppt
 食品に残留する農薬等について ( 補足資料 ) 1 残留農薬規制の仕組み関係 2 1 基準値の決め方 ( 食品残留農薬の例 ) 個々の農薬毎に 登録保留基準や諸外国の基準を考慮して検討する 農薬 A 基準値 (ppm) 参考基準国 小麦 1 海外 (EU) はくさい 1 国内 ( 作物残留試験 ) みかん 茶 0.5 2 Codex( 柑橘類 ) 登録保留基準 3 基準値の決め方ー 2 理論最大一日摂取量方式
食品に残留する農薬等について ( 補足資料 ) 1 残留農薬規制の仕組み関係 2 1 基準値の決め方 ( 食品残留農薬の例 ) 個々の農薬毎に 登録保留基準や諸外国の基準を考慮して検討する 農薬 A 基準値 (ppm) 参考基準国 小麦 1 海外 (EU) はくさい 1 国内 ( 作物残留試験 ) みかん 茶 0.5 2 Codex( 柑橘類 ) 登録保留基準 3 基準値の決め方ー 2 理論最大一日摂取量方式
<4D F736F F D D834A D38CA995E58F57817A8F4390B32E646F63>
 ( 案 ) 動物用医薬品評価書 ベンゾカイン 2008 年 2 月 食品安全委員会動物用医薬品専門調査会 目次 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 食品安全委員会動物用医薬品専門調査会確認評価部会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 用途 4 2. 有効成分の一般名 4 3. 化学名 4 4. 分子式 4
( 案 ) 動物用医薬品評価書 ベンゾカイン 2008 年 2 月 食品安全委員会動物用医薬品専門調査会 目次 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 食品安全委員会動物用医薬品専門調査会確認評価部会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 用途 4 2. 有効成分の一般名 4 3. 化学名 4 4. 分子式 4
目次頁 審議の経緯... 食品安全委員会委員名簿... 食品安全委員会動物用医薬品専門調査会専門委員名簿... 要約... I. 評価対象動物用医薬品の概要.... 用途.... 有効成分の一般名.... 化学名.... 分子式.... 分子量.... 構造式.... 使用目的及び使
 第 0 回動物用医薬品専門調査会 ( 公開 ) 資料 資料 ( 案 ) 動物用医薬品評価書 ベタメタゾン 事務局より 第 0 回会合でお示しした修文は反映しております 第 0 回会合またはその後修正 追記した部分については 赤字で修正しております 0 年 月 食品安全委員会動物用医薬品専門調査会 0 0 0 0 目次頁 審議の経緯... 食品安全委員会委員名簿... 食品安全委員会動物用医薬品専門調査会専門委員名簿...
第 0 回動物用医薬品専門調査会 ( 公開 ) 資料 資料 ( 案 ) 動物用医薬品評価書 ベタメタゾン 事務局より 第 0 回会合でお示しした修文は反映しております 第 0 回会合またはその後修正 追記した部分については 赤字で修正しております 0 年 月 食品安全委員会動物用医薬品専門調査会 0 0 0 0 目次頁 審議の経緯... 食品安全委員会委員名簿... 食品安全委員会動物用医薬品専門調査会専門委員名簿...
トリアムシノロンアセトニド マキュエイド硝子体内注用 40mg 医薬品製造販売承認事項一部変更承認申請書 添付資料 CTD 第 2 部 ( 資料概要 ) 2.6 非臨床試験の概要文及び概要表 薬物動態試験の概要文 わかもと製薬株式会社 1
 トリアムシノロンアセトニド マキュエイド硝子体内注用 40mg 医薬品製造販売承認事項一部変更承認申請書 添付資料 CTD 第 2 部 ( 資料概要 ) 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 わかもと製薬株式会社 1 2.6.4 薬物動態試験の概要文マキュエイド硝子体内注用 目次 2.6.4 薬物動態試験の概要文... 4 2.6.4.1 まとめ... 4 2.6.4.2
トリアムシノロンアセトニド マキュエイド硝子体内注用 40mg 医薬品製造販売承認事項一部変更承認申請書 添付資料 CTD 第 2 部 ( 資料概要 ) 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 わかもと製薬株式会社 1 2.6.4 薬物動態試験の概要文マキュエイド硝子体内注用 目次 2.6.4 薬物動態試験の概要文... 4 2.6.4.1 まとめ... 4 2.6.4.2
<4D F736F F F696E74202D2097D58FB08E8E8CB1838F815B834E F197D58FB E96D8816A66696E616C CF68A4A2E >
 再生医療等製品の非臨床安全性評価の考え方 ex vivo 遺伝子治療を中心に 独立行政法人医薬品医療機器総合機構 (PMDA) 再生医療製品等審査部 真木一茂 様式 1-B 第 24 回日本遺伝子細胞治療学会学術集会 CO I 開示 発表者名 : 真木一茂 演題発表に関連し 開示すべき CO I 関係にある企業などはありません 2 1 本日の話 1.Ex vivo 遺伝子治療について 2. 治験開始に必要な非臨床試験
再生医療等製品の非臨床安全性評価の考え方 ex vivo 遺伝子治療を中心に 独立行政法人医薬品医療機器総合機構 (PMDA) 再生医療製品等審査部 真木一茂 様式 1-B 第 24 回日本遺伝子細胞治療学会学術集会 CO I 開示 発表者名 : 真木一茂 演題発表に関連し 開示すべき CO I 関係にある企業などはありません 2 1 本日の話 1.Ex vivo 遺伝子治療について 2. 治験開始に必要な非臨床試験
動物用医薬品評価書 モキシデクチン ( 第 2 版 ) 2014 年 3 月 食品安全委員会
 動物用医薬品評価書 モキシデクチン ( 第 2 版 ) 2014 年 3 月 食品安全委員会 目次頁 審議の経緯 4 食品安全委員会委員名簿 4 食品安全委員会動物用医薬品専門調査会専門委員名簿 5 要約 6 Ⅰ. 評価対象動物用医薬品の概要 7 1. 用途 7 2. 有効成分の一般名 7 3. 化学名 7 4. 分子式 7 5. 分子量 7 6. 構造式 7 7. 使用目的及び使用状況 7 Ⅱ.
動物用医薬品評価書 モキシデクチン ( 第 2 版 ) 2014 年 3 月 食品安全委員会 目次頁 審議の経緯 4 食品安全委員会委員名簿 4 食品安全委員会動物用医薬品専門調査会専門委員名簿 5 要約 6 Ⅰ. 評価対象動物用医薬品の概要 7 1. 用途 7 2. 有効成分の一般名 7 3. 化学名 7 4. 分子式 7 5. 分子量 7 6. 構造式 7 7. 使用目的及び使用状況 7 Ⅱ.
豚丹毒 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 23 年 2 月 8 日 ( 告示第 358 号 ) 新規追加 1 定義シードロット規格に適合した豚丹毒菌の培養菌液を不活化し アルミニウムゲルアジュバントを添加したワクチンである 2 製法 2.1 製造用株 名称豚丹
 豚丹毒 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 23 年 2 月 8 日 ( 告示第 358 号 ) 新規追加 1 定義シードロット規格に適合した豚丹毒菌の培養菌液を不活化し アルミニウムゲルアジュバントを添加したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚丹毒菌多摩 96 株 ( 血清型 2 型 ) 又はこれと同等と認められた株 2.1.2 性状感受性豚に接種すると
豚丹毒 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 23 年 2 月 8 日 ( 告示第 358 号 ) 新規追加 1 定義シードロット規格に適合した豚丹毒菌の培養菌液を不活化し アルミニウムゲルアジュバントを添加したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚丹毒菌多摩 96 株 ( 血清型 2 型 ) 又はこれと同等と認められた株 2.1.2 性状感受性豚に接種すると
目次頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会動物用医薬品専門調査会専門委員名簿... 3 食品安全委員会動物用医薬品専門調査会確認評価部会専門委員名簿... 5 第 198 回食品安全委員会動物用医薬品専門調査会専門参考人名簿... 5 要約... 6 I. 評価対
 ( 案 ) 動物用医薬品評価書 ジシクラニル 2017 年 6 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会動物用医薬品専門調査会専門委員名簿... 3 食品安全委員会動物用医薬品専門調査会確認評価部会専門委員名簿... 5 第 198 回食品安全委員会動物用医薬品専門調査会専門参考人名簿... 5 要約... 6 I. 評価対象動物用医薬品の概要...
( 案 ) 動物用医薬品評価書 ジシクラニル 2017 年 6 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会動物用医薬品専門調査会専門委員名簿... 3 食品安全委員会動物用医薬品専門調査会確認評価部会専門委員名簿... 5 第 198 回食品安全委員会動物用医薬品専門調査会専門参考人名簿... 5 要約... 6 I. 評価対象動物用医薬品の概要...
抗菌薬の殺菌作用抗菌薬の殺菌作用には濃度依存性と時間依存性の 2 種類があり 抗菌薬の効果および用法 用量の設定に大きな影響を与えます 濃度依存性タイプでは 濃度を高めると濃度依存的に殺菌作用を示します 濃度依存性タイプの抗菌薬としては キノロン系薬やアミノ配糖体系薬が挙げられます 一方 時間依存性
 2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
(2) 健康成人の血漿中濃度 ( 反復経口投与 ) 9) 健康成人男子にスイニー 200mgを1 日 2 回 ( 朝夕食直前 ) 7 日間反復経口投与したとき 血漿中アナグリプチン濃度は投与 2 日目には定常状態に達した 投与 7 日目における C max 及びAUC 0-72hの累積係数はそれぞれ
 1. 血漿中濃度 (1) 健康成人の血漿中濃度 ( 単回経口投与 ) 8) 健康成人男子にスイニー 100mg 又は200mgを空腹時に単回経口投与したときの血漿中アナグリプチン濃度は 投与後約 1~ 2 時間で C maxに達した後 二相性の消失を示し t 1/2αは約 2 時間 t 1/2βは約 6 時間であった C max 及びAUC0- は投与量の増加に伴って増加した 血漿中アナグリプチン濃度推移
1. 血漿中濃度 (1) 健康成人の血漿中濃度 ( 単回経口投与 ) 8) 健康成人男子にスイニー 100mg 又は200mgを空腹時に単回経口投与したときの血漿中アナグリプチン濃度は 投与後約 1~ 2 時間で C maxに達した後 二相性の消失を示し t 1/2αは約 2 時間 t 1/2βは約 6 時間であった C max 及びAUC0- は投与量の増加に伴って増加した 血漿中アナグリプチン濃度推移
資料4-3 木酢液の検討状況について
 資料 -3 木酢液の論点整理 < これまでの合同会合の審議における論点 > 木酢液には 高濃度のホルムアルデヒドが含まれる可能性がある ( 実際に 3,ppm のホルムアルデヒドが検出されたサンプルがあった ) ホルムアルデヒドを含む物質の安全性については慎重に審議するべきであり ホルムアルデヒド低減化のための木酢液の製造方法等を検討する必要がある 今回関係団体からホルムアルデヒドを低減化するための木酢液の製造方法が提案されているが
資料 -3 木酢液の論点整理 < これまでの合同会合の審議における論点 > 木酢液には 高濃度のホルムアルデヒドが含まれる可能性がある ( 実際に 3,ppm のホルムアルデヒドが検出されたサンプルがあった ) ホルムアルデヒドを含む物質の安全性については慎重に審議するべきであり ホルムアルデヒド低減化のための木酢液の製造方法等を検討する必要がある 今回関係団体からホルムアルデヒドを低減化するための木酢液の製造方法が提案されているが
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7
![審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7 審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7](/thumbs/92/110490968.jpg) 審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
よる感染症は これまでは多くの有効な抗菌薬がありましたが ESBL 産生菌による場合はカルバペネム系薬でないと治療困難という状況になっています CLSI 標準法さて このような薬剤耐性菌を患者検体から検出するには 微生物検査という臨床検査が不可欠です 微生物検査は 患者検体から感染症の原因となる起炎
 2014 年 7 月 9 日放送 薬剤耐性菌の動向と最近の CLSI 標準法の変更点 順天堂大学 臨床検査部係長 三澤 成毅 薬剤耐性菌の動向まず 薬剤耐性菌の動向についてお話しします 薬剤耐性菌の歴史は 1940 年代に抗菌薬の第一号としてペニシリンが臨床応用された頃から始まったと言えます 以来 新しい抗菌薬の開発 導入と これに対する薬剤耐性菌の出現が繰り返され 今日に至っています 薬剤耐性菌の近年の特徴は
2014 年 7 月 9 日放送 薬剤耐性菌の動向と最近の CLSI 標準法の変更点 順天堂大学 臨床検査部係長 三澤 成毅 薬剤耐性菌の動向まず 薬剤耐性菌の動向についてお話しします 薬剤耐性菌の歴史は 1940 年代に抗菌薬の第一号としてペニシリンが臨床応用された頃から始まったと言えます 以来 新しい抗菌薬の開発 導入と これに対する薬剤耐性菌の出現が繰り返され 今日に至っています 薬剤耐性菌の近年の特徴は
馬ロタウイルス感染症 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した馬ロタウイルス (A 群 G3 型 ) を同規格に適合した株化細胞で増殖させて得たウイルス液を不活化し アジュバント
 馬ロタウイルス感染症 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した馬ロタウイルス (A 群 G3 型 ) を同規格に適合した株化細胞で増殖させて得たウイルス液を不活化し アジュバントを添加したワクチンである 2 製法 2.1 製造用株 2.1.1 名称馬ロタウイルス Ho-5MA 株又はこれと同等と認められた株
馬ロタウイルス感染症 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した馬ロタウイルス (A 群 G3 型 ) を同規格に適合した株化細胞で増殖させて得たウイルス液を不活化し アジュバントを添加したワクチンである 2 製法 2.1 製造用株 2.1.1 名称馬ロタウイルス Ho-5MA 株又はこれと同等と認められた株
(5) 適用方法及び用量 カナマイシンの使用対象動物及び使用方法等を以下に示す 1 国内での使用方法 医薬品対象動物及び使用方法休薬期間 硫酸カナマイシン を有効成分とする 注射剤 硫酸カナマイシン を有効成分とする 鼻腔内投与剤 硫酸カナマイシン 及びベンジルペニ シリンプロカイン を有効成分とす
 カナマイシン ( 案 ) 今般の残留基準の検討については 食品中の動物用医薬品等のポジティブリスト制度導入時に新たに設定された基準値 ( いわゆる暫定基準 ) の見直しについて 食品安全委員会において食品健康影響評価がなされたことを踏まえ 農薬 動物用医薬品部会において審議を行い 以下の報告を取りまとめるものである 1. 概要 (1) 品目名 : カナマイシン [ Kanamycin ] (2) 用途
カナマイシン ( 案 ) 今般の残留基準の検討については 食品中の動物用医薬品等のポジティブリスト制度導入時に新たに設定された基準値 ( いわゆる暫定基準 ) の見直しについて 食品安全委員会において食品健康影響評価がなされたことを踏まえ 農薬 動物用医薬品部会において審議を行い 以下の報告を取りまとめるものである 1. 概要 (1) 品目名 : カナマイシン [ Kanamycin ] (2) 用途
医療用医薬品最新品質情報集 ( ブルーブック ) 初版有効成分リトドリン塩酸塩 品目名 ( 製造販売業者 ) 後発医薬品 品目名 ( 製造販売業者 ) 先発医薬品 効能 効果用法 用量添加物 1) 解離定数 (25 ) 1) 溶解度 (37 ) 1 ウテロン錠 5mg サンド 2
 医療用医薬品最新品質情報集 ( ブルーブック ) 2018.7.13 初版有効成分リトドリン塩酸塩 品目名 ( 製造販売業者 ) 後発医薬品 品目名 ( 製造販売業者 ) 先発医薬品 効能 効果用法 用量添加物 1) 解離定数 (25 ) 1) 溶解度 (37 ) 1 ウテロン錠 5mg サンド 2 塩酸リトドリン錠 5mg YD 陽進堂 3 リトドリン錠 5mg PP ポーラファルマ 4 ルテオニン錠
医療用医薬品最新品質情報集 ( ブルーブック ) 2018.7.13 初版有効成分リトドリン塩酸塩 品目名 ( 製造販売業者 ) 後発医薬品 品目名 ( 製造販売業者 ) 先発医薬品 効能 効果用法 用量添加物 1) 解離定数 (25 ) 1) 溶解度 (37 ) 1 ウテロン錠 5mg サンド 2 塩酸リトドリン錠 5mg YD 陽進堂 3 リトドリン錠 5mg PP ポーラファルマ 4 ルテオニン錠
目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 要約 5 I. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7. 使用目的及び使用状況 6
 資料 8-2 動物用医薬品評価書 メロキシカム ( 第 2 版 ) 2014 年 10 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 要約 5 I. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7. 使用目的及び使用状況
資料 8-2 動物用医薬品評価書 メロキシカム ( 第 2 版 ) 2014 年 10 月 食品安全委員会 目次頁 審議の経緯 3 食品安全委員会委員名簿 3 食品安全委員会動物用医薬品専門調査会専門委員名簿 4 要約 5 I. 評価対象動物用医薬品の概要 6 1. 用途 6 2. 有効成分の一般名 6 3. 化学名 6 4. 分子式 6 5. 分子量 6 6. 構造式 6 7. 使用目的及び使用状況
2.7.3(5 群 ) 呼吸器感染症臨床的有効性グレースビット 錠 細粒 表 (5 群 )-3 疾患別陰性化率 疾患名 陰性化被験者数 / 陰性化率 (%) (95%CI)(%) a) 肺炎 全体 91/ (89.0, 98.6) 細菌性肺炎 73/ (86
 2.7.3(5 群 ) 呼吸器感染症臨床的有効性グレースビット 錠 細粒 表 2.7.3.3.2(5 群 )-2 原因菌別臨床効果 原因菌 肺炎 慢性呼吸器病変の二次感染 急性上気道感染症群 5 群合計 単独菌 83 82(98.8) 67 61(91.0) 14 14(100) 164 157(95.7) 複数菌 (2 種 ) 14 14(100) 7 7(100) 2 2 23 23(100)
2.7.3(5 群 ) 呼吸器感染症臨床的有効性グレースビット 錠 細粒 表 2.7.3.3.2(5 群 )-2 原因菌別臨床効果 原因菌 肺炎 慢性呼吸器病変の二次感染 急性上気道感染症群 5 群合計 単独菌 83 82(98.8) 67 61(91.0) 14 14(100) 164 157(95.7) 複数菌 (2 種 ) 14 14(100) 7 7(100) 2 2 23 23(100)
グルコースは膵 β 細胞内に糖輸送担体を介して取り込まれて代謝され A T P が産生される その結果 A T P 感受性 K チャンネルの閉鎖 細胞膜の脱分極 電位依存性 Caチャンネルの開口 細胞内 Ca 2+ 濃度の上昇が起こり インスリンが分泌される これをインスリン分泌の惹起経路と呼ぶ イ
 薬効薬理 1. 作用機序 アナグリプチンはジペプチジルペプチダーゼ -4(DPP-4) の競合的かつ可逆的な選択的阻害剤である インクレチンであるグルカゴン様ペプチド-1(GL P-1) 及びグルコース依存性インスリン分泌刺激ポリペプチド (GI P) は グルコース依存的なインスリン分泌促進作用やグルカゴン分泌抑制作用等 ( 主にGLP-1の作用 ) を有するが 24) DPP-4により分解されて活性を失う
薬効薬理 1. 作用機序 アナグリプチンはジペプチジルペプチダーゼ -4(DPP-4) の競合的かつ可逆的な選択的阻害剤である インクレチンであるグルカゴン様ペプチド-1(GL P-1) 及びグルコース依存性インスリン分泌刺激ポリペプチド (GI P) は グルコース依存的なインスリン分泌促進作用やグルカゴン分泌抑制作用等 ( 主にGLP-1の作用 ) を有するが 24) DPP-4により分解されて活性を失う
Microsoft Word - 資料1【決定(差し替え)】調査結果報告書 調査会後修正
 資料 1 調査結果報告書 平成 25 年 12 月 2 日 独立行政法人医薬品医療機器総合機構 システアミン塩酸塩を配合した洗い流すヘアセット料の安全性に関する調査 I. 品目の概要 [ 対象 ] システアミン塩酸塩を配合した洗い流すヘアセット料 [ 効能の範囲 ] 髪型を整え 保持する等 [ 用法 ] 頭髪に塗布し 髪型を整える操作を行い その後洗浄する等 [ 備考 ] 特になし [ 調査担当部
資料 1 調査結果報告書 平成 25 年 12 月 2 日 独立行政法人医薬品医療機器総合機構 システアミン塩酸塩を配合した洗い流すヘアセット料の安全性に関する調査 I. 品目の概要 [ 対象 ] システアミン塩酸塩を配合した洗い流すヘアセット料 [ 効能の範囲 ] 髪型を整え 保持する等 [ 用法 ] 頭髪に塗布し 髪型を整える操作を行い その後洗浄する等 [ 備考 ] 特になし [ 調査担当部
医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など ) 医薬品候補物質のスクリーニン
 特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
特定保健用食品の表示許可制度専門調査会 (H23.2.28) 資料 5 再審査制度 再評価制度について 厚生労働省医薬食品局審査管理課 医薬品の基礎研究から承認審査 市販後までの主なプロセス 基礎研究 非臨床試験 動物試験等 品質の評価安全性の評価有効性の評価 候補物質の合成方法等を確立 最適な剤型の設計 一定の品質を確保するための規格及び試験方法などの確立 有効期間等の設定 ( 長期安定性試験など
菌種 報告年 株数 MIC(μg/mL) Range MIC50 MIC > ( 幾何平均 ) C.tropicalis >
 生物学的同等性試験におけるイトリゾール カプセル 50 のロット間での統計学 的有意差が本剤の有効性及び安全性に与える影響について イトリゾール カプセル 50 は,1993 年に内臓真菌症 ( 深在性真菌症 ), 深在性皮膚真菌症及び表在性皮膚真菌症を適応症として承認され, その後,1999 年に爪白癬等の適応を追加,2004 年及び 2006 年にはそれぞれ爪白癬のパルス療法および注射剤からの切り替えとしての新用法
生物学的同等性試験におけるイトリゾール カプセル 50 のロット間での統計学 的有意差が本剤の有効性及び安全性に与える影響について イトリゾール カプセル 50 は,1993 年に内臓真菌症 ( 深在性真菌症 ), 深在性皮膚真菌症及び表在性皮膚真菌症を適応症として承認され, その後,1999 年に爪白癬等の適応を追加,2004 年及び 2006 年にはそれぞれ爪白癬のパルス療法および注射剤からの切り替えとしての新用法
日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 名称日本脳炎ウイル
 日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 2.1.1 名称日本脳炎ウイルス中山株薬検系又はこれと同等と認められた株 2.1.2 性状豚腎初代細胞で増殖し がちょう 鶏初生ひな及びはとの赤血球を凝集する
日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 2.1.1 名称日本脳炎ウイルス中山株薬検系又はこれと同等と認められた株 2.1.2 性状豚腎初代細胞で増殖し がちょう 鶏初生ひな及びはとの赤血球を凝集する
<4D F736F F F696E74202D20834F E815B8E9197BF2E B8CDD8AB B83685D>
 抗菌剤 ( グラファイター ) のご紹介 株式会社 TYK 炭素材料研究所 5097795 岐阜県恵那市明智町 1614 TEL 057354449 FAX 057354438 Email : koukin@tyk.jp 無機銀系抗菌剤 ( グラファイター ) 性状 構造式 (AgLi) 1.4 Al 0.4 Ti 1.6 (P 4 ) 3 外観 白色微粉末 真比重 3.0 平均粒径 0.8μm ph
抗菌剤 ( グラファイター ) のご紹介 株式会社 TYK 炭素材料研究所 5097795 岐阜県恵那市明智町 1614 TEL 057354449 FAX 057354438 Email : koukin@tyk.jp 無機銀系抗菌剤 ( グラファイター ) 性状 構造式 (AgLi) 1.4 Al 0.4 Ti 1.6 (P 4 ) 3 外観 白色微粉末 真比重 3.0 平均粒径 0.8μm ph
目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 2 食品安全委員会農薬専門調査会専門委員名簿... 2 要約... 5 Ⅰ. 評価対象農薬 動物用医薬品及び飼料添加物の概要 用途 一般名... 6
 ( 案 ) 対象外物質 評価書 コリン 2013 年 5 月 食品安全委員会肥料 飼料等専門調査会 食品安全委員会農薬専門調査会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿...
( 案 ) 対象外物質 評価書 コリン 2013 年 5 月 食品安全委員会肥料 飼料等専門調査会 食品安全委員会農薬専門調査会 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 3 項の規定に基づき 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質 目次頁 審議の経緯... 2 食品安全委員会委員名簿... 2 食品安全委員会肥料 飼料等専門調査会専門委員名簿...
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
トリルフルアニド(案)
 平成 27 年 1 月 23 日 薬事 食品衛生審議会 食品衛生分科会長岸玲子殿 薬事 食品衛生審議会食品衛生分科会 農薬 動物用医薬品部会長大野泰雄 薬事 食品衛生審議会食品衛生分科会 農薬 動物用医薬品部会報告について 平成 26 年 12 月 15 日付け厚生労働省発食安 1215 第 1 号をもって諮問された 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 1 項の規定に基づくモサプリドに係る食品規格
平成 27 年 1 月 23 日 薬事 食品衛生審議会 食品衛生分科会長岸玲子殿 薬事 食品衛生審議会食品衛生分科会 農薬 動物用医薬品部会長大野泰雄 薬事 食品衛生審議会食品衛生分科会 農薬 動物用医薬品部会報告について 平成 26 年 12 月 15 日付け厚生労働省発食安 1215 第 1 号をもって諮問された 食品衛生法 ( 昭和 22 年法律第 233 号 ) 第 11 条第 1 項の規定に基づくモサプリドに係る食品規格
名称未設定-4
 Page 1 沈降インフルエンザワクチン H5N1 生研 1mL 第 2 部 ( モジュール 2):CTD の概要 ( サマリー ) 2.6 非臨床試験の概要文及び概要表 2.6.6 毒性試験の概要文 デンカ生研株式会社 沈降インフルエンザワクチン H5N1 生研 2.6.6 毒性試験の概要文 Page 2 沈降インフルエンザワクチン H5N1 生研 2.6.6 毒性試験の概要文 Page 3 目
Page 1 沈降インフルエンザワクチン H5N1 生研 1mL 第 2 部 ( モジュール 2):CTD の概要 ( サマリー ) 2.6 非臨床試験の概要文及び概要表 2.6.6 毒性試験の概要文 デンカ生研株式会社 沈降インフルエンザワクチン H5N1 生研 2.6.6 毒性試験の概要文 Page 2 沈降インフルエンザワクチン H5N1 生研 2.6.6 毒性試験の概要文 Page 3 目
2006 年 3 月 3 日放送 抗菌薬の適正使用 市立堺病院薬剤科科長 阿南節子 薬剤師は 抗菌薬投与計画の作成のためにパラメータを熟知すべき 最初の抗菌薬であるペニシリンが 実質的に広く使用されるようになったのは第二次世界大戦後のことです それまで致死的な状況であった黄色ブドウ球菌による感染症に
 2006 年 3 月 3 日放送 抗菌薬の適正使用 市立堺病院薬剤科科長 阿南節子 薬剤師は 抗菌薬投与計画の作成のためにパラメータを熟知すべき 最初の抗菌薬であるペニシリンが 実質的に広く使用されるようになったのは第二次世界大戦後のことです それまで致死的な状況であった黄色ブドウ球菌による感染症に対して ペニシリンは劇的な効果を発揮しました しかし その後ペニシリンが広範囲に使用されたことによって
2006 年 3 月 3 日放送 抗菌薬の適正使用 市立堺病院薬剤科科長 阿南節子 薬剤師は 抗菌薬投与計画の作成のためにパラメータを熟知すべき 最初の抗菌薬であるペニシリンが 実質的に広く使用されるようになったのは第二次世界大戦後のことです それまで致死的な状況であった黄色ブドウ球菌による感染症に対して ペニシリンは劇的な効果を発揮しました しかし その後ペニシリンが広範囲に使用されたことによって
緑膿菌 Pseudomonas aeruginosa グラム陰性桿菌 ブドウ糖非発酵 緑色色素産生 水まわりなど生活環境中に広く常在 腸内に常在する人も30%くらい ペニシリンやセファゾリンなどの第一世代セフェム 薬に自然耐性 テトラサイクリン系やマクロライド系抗生物質など の抗菌薬にも耐性を示す傾
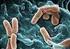 2 緑膿菌 Pseudomonas aeruginosa グラム陰性桿菌 ブドウ糖非発酵 緑色色素産生 水まわりなど生活環境中に広く常在 腸内に常在する人も30%くらい ペニシリンやセファゾリンなどの第一世代セフェム 薬に自然耐性 テトラサイクリン系やマクロライド系抗生物質など の抗菌薬にも耐性を示す傾向が強い 多剤耐性緑膿菌は5類感染症定点把握疾患 赤痢菌属 グラム陰性通性嫌気性桿菌 腸内細菌科
2 緑膿菌 Pseudomonas aeruginosa グラム陰性桿菌 ブドウ糖非発酵 緑色色素産生 水まわりなど生活環境中に広く常在 腸内に常在する人も30%くらい ペニシリンやセファゾリンなどの第一世代セフェム 薬に自然耐性 テトラサイクリン系やマクロライド系抗生物質など の抗菌薬にも耐性を示す傾向が強い 多剤耐性緑膿菌は5類感染症定点把握疾患 赤痢菌属 グラム陰性通性嫌気性桿菌 腸内細菌科
薬物動態試験の概要文
 アマージ錠 2.5mg 製造販売承認申請 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.5 薬物動態試験概要表 グラクソ スミスクライン株式会社 目次 頁 2.6.4. 薬物動態試験の概要文 1 2.6.4.1. まとめ 1 2.6.4.2. 分析法 4 2.6.4.2.1. 被験物質 4 2.6.4.2.2. 分析方法 4 2.6.4.3. 吸収
アマージ錠 2.5mg 製造販売承認申請 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.5 薬物動態試験概要表 グラクソ スミスクライン株式会社 目次 頁 2.6.4. 薬物動態試験の概要文 1 2.6.4.1. まとめ 1 2.6.4.2. 分析法 4 2.6.4.2.1. 被験物質 4 2.6.4.2.2. 分析方法 4 2.6.4.3. 吸収
目次 頁 表一覧...3 図一覧...4 略号及び用語の定義 まとめ 単回投与 ( 急性 ) 毒性 反復投与毒性 遺伝毒性 がん原性
 カンサイダス点滴静注用 50mg カンサイダス点滴静注用 70mg 第 2 部 ( モジュール 2) CTD の概要 ( サマリー ) - 毒性 - MSD 株式会社 目次 頁 表一覧...3 図一覧...4 略号及び用語の定義...5 2.6.6.1 まとめ...6 2.6.6.1.1 単回投与 ( 急性 ) 毒性...6 2.6.6.1.2 反復投与毒性...7 2.6.6.1.3 遺伝毒性...10
カンサイダス点滴静注用 50mg カンサイダス点滴静注用 70mg 第 2 部 ( モジュール 2) CTD の概要 ( サマリー ) - 毒性 - MSD 株式会社 目次 頁 表一覧...3 図一覧...4 略号及び用語の定義...5 2.6.6.1 まとめ...6 2.6.6.1.1 単回投与 ( 急性 ) 毒性...6 2.6.6.1.2 反復投与毒性...7 2.6.6.1.3 遺伝毒性...10
<4D F736F F D204E6F2E342D F28DDC91CF90AB8BDB82C982C282A282C482CC C668DDA94C5816A F315F372E646F63>
 薬剤耐性菌についての Q&A 農林水産省 動物医薬品検査所 検査第二部抗生物質製剤検査室 初版 第二版 平成 21 年 11 月 24 日 平成 22 年 1 月 7 日 目 次 I. 抗菌性物質 3 1. 抗菌性物質とは? 2. 家畜における抗菌性物質の使用目的は? 3. 動物用医薬品として使われている抗菌性物質の種類を教えてください II. 薬剤耐性 ( 一般 ) 4 1. 薬剤耐性菌とは? 2.
薬剤耐性菌についての Q&A 農林水産省 動物医薬品検査所 検査第二部抗生物質製剤検査室 初版 第二版 平成 21 年 11 月 24 日 平成 22 年 1 月 7 日 目 次 I. 抗菌性物質 3 1. 抗菌性物質とは? 2. 家畜における抗菌性物質の使用目的は? 3. 動物用医薬品として使われている抗菌性物質の種類を教えてください II. 薬剤耐性 ( 一般 ) 4 1. 薬剤耐性菌とは? 2.
目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会添加物専門調査会専門委員名簿... 4 第 1 章総則... 5 第 1 指針作成に至る背景... 5 第 2 定義... 5 第 3 目的... 7 第 4 添加物の食品健康影響評価に際しての考え方... 7 第 5
 添加物に関する食品健康影響評価指針 2010 年 5 月 食品安全委員会 目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会添加物専門調査会専門委員名簿... 4 第 1 章総則... 5 第 1 指針作成に至る背景... 5 第 2 定義... 5 第 3 目的... 7 第 4 添加物の食品健康影響評価に際しての考え方... 7 第 5 評価に必要な資料等の考え方...
添加物に関する食品健康影響評価指針 2010 年 5 月 食品安全委員会 目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会添加物専門調査会専門委員名簿... 4 第 1 章総則... 5 第 1 指針作成に至る背景... 5 第 2 定義... 5 第 3 目的... 7 第 4 添加物の食品健康影響評価に際しての考え方... 7 第 5 評価に必要な資料等の考え方...
目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要 4 1. 主剤 4 2. 効能 効果 4 3. 用法 用量 4 4. 添加剤等 4 5. 開発の経緯 4 Ⅱ. 安全性に係る知見の概要 5 1. ヒト
 ( 案 ) 動物用医薬品評価書 マイコプラズマ ハイオニューモニエ感染症 ( カルボキシビニルポリマーアジュバント 油性アジュバント加 ) 不活化ワクチン ( レスピフェンド MH-One FDAH) 2013 年 1 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要
( 案 ) 動物用医薬品評価書 マイコプラズマ ハイオニューモニエ感染症 ( カルボキシビニルポリマーアジュバント 油性アジュバント加 ) 不活化ワクチン ( レスピフェンド MH-One FDAH) 2013 年 1 月 食品安全委員会動物用医薬品専門調査会 目次頁 審議の経緯 2 食品安全委員会委員名簿 2 食品安全委員会動物用医薬品専門調査会専門委員名簿 2 要約 3 Ⅰ. 評価対象動物用医薬品の概要
家畜における薬剤耐性菌の制御 薬剤耐性菌の実態把握 対象菌種 食中毒菌 耐性菌の特徴 出現の予防 79
 項目 薬剤耐性 (AMR) 対策アクションプランについて 耐性菌の基礎知識 薬剤耐性モニタリング (JVARM) の成績 コリスチン耐性について 薬剤耐性菌のリスク分析 動物用医薬品の慎重使用について 78 家畜における薬剤耐性菌の制御 薬剤耐性菌の実態把握 対象菌種 食中毒菌 耐性菌の特徴 出現の予防 79 薬剤耐性菌の広まり 選 択 圧 抗 菌 剤 使 用 によ る 薬剤耐性菌 ( 遺伝子 )
項目 薬剤耐性 (AMR) 対策アクションプランについて 耐性菌の基礎知識 薬剤耐性モニタリング (JVARM) の成績 コリスチン耐性について 薬剤耐性菌のリスク分析 動物用医薬品の慎重使用について 78 家畜における薬剤耐性菌の制御 薬剤耐性菌の実態把握 対象菌種 食中毒菌 耐性菌の特徴 出現の予防 79 薬剤耐性菌の広まり 選 択 圧 抗 菌 剤 使 用 によ る 薬剤耐性菌 ( 遺伝子 )
成分名 エステルガム 英名 Ester Gum CAS No 収載公定書 薬添規 A TOXNET DATABASE への リンク 投与経路用途一般外用剤粘着剤 粘着増強剤 基
 成分名 エステルガム 英名 Ester Gum CAS No. 20633-97-0 収載公定書 薬添規 A TOXNET DATABASE への https://chem.nlm.nih.gov/chemidplus/rn/20633-97-0 リンク 投与経路用途一般外用剤粘着剤 粘着増強剤 基剤経皮その他の外用口腔咀嚼歯科外用及び口中用 JECFA の評価 (1996 年, 第 46 回 )
成分名 エステルガム 英名 Ester Gum CAS No. 20633-97-0 収載公定書 薬添規 A TOXNET DATABASE への https://chem.nlm.nih.gov/chemidplus/rn/20633-97-0 リンク 投与経路用途一般外用剤粘着剤 粘着増強剤 基剤経皮その他の外用口腔咀嚼歯科外用及び口中用 JECFA の評価 (1996 年, 第 46 回 )
ルグリセロールと脂肪酸に分解され吸収される それらは腸上皮細胞に吸収されたのちに再び中性脂肪へと生合成されカイロミクロンとなる DGAT1 は腸管で脂質の再合成 吸収に関与していることから DGAT1 KO マウスで認められているフェノタイプが腸 DGAT1 欠如に由来していることが考えられる 実際
 学位論文の内容の要旨 論文提出者氏名 津田直人 論文審査担当者 主査下門顕太郎副査吉田雅幸横関博雄 論文題目 Intestine-Targeted DGAT1 Inhibition Improves Obesity and Insulin Resistance without Skin Aberrations in Mice ( 論文内容の要旨 ) < 要旨 > Diacylglycerol O-acyltransferase
学位論文の内容の要旨 論文提出者氏名 津田直人 論文審査担当者 主査下門顕太郎副査吉田雅幸横関博雄 論文題目 Intestine-Targeted DGAT1 Inhibition Improves Obesity and Insulin Resistance without Skin Aberrations in Mice ( 論文内容の要旨 ) < 要旨 > Diacylglycerol O-acyltransferase
審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]
![審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ] 審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]](/thumbs/91/105024304.jpg) 審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
薬物動態試験 : 単回投与後の組織分布 ( その3) 薬物動態試験 : 反復投与後の組織分布 薬物動態試験 : 反復投与後の組織分布 ( 続き ) 薬物動態試験 : 反復投与後の組織分布 ( 続き )...
 2.6.5 目次 2.6.5...4 2.6.5.1 薬物動態試験 : 一覧表 ( その1)...4 2.6.5.1 薬物動態試験 : 一覧表 ( その2)...5 2.6.5.1 薬物動態試験 : 一覧表 ( その3)...6 2.6.5.1 薬物動態試験 : 一覧表 ( その4)...7 2.6.5.1 薬物動態試験 : 一覧表 ( その5)...8 2.6.5.2 薬物動態試験 : 分析方法及びバリデーション試験
2.6.5 目次 2.6.5...4 2.6.5.1 薬物動態試験 : 一覧表 ( その1)...4 2.6.5.1 薬物動態試験 : 一覧表 ( その2)...5 2.6.5.1 薬物動態試験 : 一覧表 ( その3)...6 2.6.5.1 薬物動態試験 : 一覧表 ( その4)...7 2.6.5.1 薬物動態試験 : 一覧表 ( その5)...8 2.6.5.2 薬物動態試験 : 分析方法及びバリデーション試験
トピロリック錠 インタビューフォーム
 Ⅸ. 非臨床試験に関する項目 1. 薬理試験 (1) 薬効薬理試験 ( Ⅵ. 薬効薬理に関する項目 参照 ) (2) 副次的薬理試験 該当資料なし 42) (3) 安全性薬理試験 試験項目 動物種 / 系統投与経路 ( 例数 ) 投与量 特記すべき所見 中枢神経系 一般状態 体温及び自発運動量に及ぼす作用 (Irwin 法 ) ラット / Wistar( 雄 4) herg 電流に及ぼす作用 herg
Ⅸ. 非臨床試験に関する項目 1. 薬理試験 (1) 薬効薬理試験 ( Ⅵ. 薬効薬理に関する項目 参照 ) (2) 副次的薬理試験 該当資料なし 42) (3) 安全性薬理試験 試験項目 動物種 / 系統投与経路 ( 例数 ) 投与量 特記すべき所見 中枢神経系 一般状態 体温及び自発運動量に及ぼす作用 (Irwin 法 ) ラット / Wistar( 雄 4) herg 電流に及ぼす作用 herg
豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株
 豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚繁殖 呼吸障害症候群ウイルス JJ1882 株又はこれと同等と認められた株 2.1.2
豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚繁殖 呼吸障害症候群ウイルス JJ1882 株又はこれと同等と認められた株 2.1.2
( 案 ) 飼料添加物評価書 Bacillus licheniformis JPBL001 株が生産するアルカリ性プロテアーゼを原体とする飼料添加物 2018 年 2 月 食品安全委員会肥料 飼料等専門調査会
 ( 案 ) 飼料添加物評価書 Bacillus licheniformis JPBL001 株が生産するアルカリ性プロテアーゼを原体とする飼料添加物 2018 年 2 月 食品安全委員会肥料 飼料等専門調査会 目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 3 要約... 4 Ⅰ. 評価対象飼料添加物の概要... 5 1. 原体...
( 案 ) 飼料添加物評価書 Bacillus licheniformis JPBL001 株が生産するアルカリ性プロテアーゼを原体とする飼料添加物 2018 年 2 月 食品安全委員会肥料 飼料等専門調査会 目次 頁 審議の経緯... 3 食品安全委員会委員名簿... 3 食品安全委員会肥料 飼料等専門調査会専門委員名簿... 3 要約... 4 Ⅰ. 評価対象飼料添加物の概要... 5 1. 原体...
CD1 data
 測定方法 ( ラット マウス共通 一部の系統でのみ測定されている項目も含む ) 血液学的検査 測定条件 絶食 : 約 16 時間 麻酔 : ネンブタール腹腔内投与 採血部位 : 後大静脈 抗凝固剤 :EDTA-2Na(WBC RBC HGB HCT MCV MCH MCHC PLT) EDTA-2K( 網状赤血球 白血球百分比検査 ) クエン酸 Na( 凝固系検査 ) 測定機器 : セルタック α(
測定方法 ( ラット マウス共通 一部の系統でのみ測定されている項目も含む ) 血液学的検査 測定条件 絶食 : 約 16 時間 麻酔 : ネンブタール腹腔内投与 採血部位 : 後大静脈 抗凝固剤 :EDTA-2Na(WBC RBC HGB HCT MCV MCH MCHC PLT) EDTA-2K( 網状赤血球 白血球百分比検査 ) クエン酸 Na( 凝固系検査 ) 測定機器 : セルタック α(
アントシアニン
 肝機能改善効果を有する 紫サツマイモジュースの開発 1. 紫サツマイモ について ( アントシアニンの構造等 ). 紫サツマイモ アントシアニンの体内吸収性 3. 紫サツマイモ の有効性とメカニズム アントシアニン アヤムラサキ について 商品特性 : 1. 紫サツマイモ アヤムラサキ の搾汁を 100% 使用したサツマイモ搾汁飲料. 着色料 甘味料不使用 3. 食物繊維 0.4g (15mLあたり)
肝機能改善効果を有する 紫サツマイモジュースの開発 1. 紫サツマイモ について ( アントシアニンの構造等 ). 紫サツマイモ アントシアニンの体内吸収性 3. 紫サツマイモ の有効性とメカニズム アントシアニン アヤムラサキ について 商品特性 : 1. 紫サツマイモ アヤムラサキ の搾汁を 100% 使用したサツマイモ搾汁飲料. 着色料 甘味料不使用 3. 食物繊維 0.4g (15mLあたり)

