厚生労働省医薬 生活衛生局 情報の概要 357 No. 医薬品等対策情報の概要頁 1 重篤副作用疾患別対応マニュアル改定事業について ( その 2 ) 厚生労働省では, 平成 17 年度から平成 22 年度にかけて 重篤副作用疾患別対応マニュアル を作成しており, 平成 28 年度からは, 最新の知
|
|
|
- ちかこ にばし
- 5 years ago
- Views:
Transcription
1 重篤副作用疾患別対応マニュアル改定事業について ( その 2) 3 2. 医薬品副作用被害救済制度の概要と制度への協力のお願いについて 7 3. 使用上の注意の改訂について ( その 297) アマンタジン塩酸塩他 (13 件 ) 市販直後調査の対象品目一覧 27 この医薬品 医療機器等安全性情報は, 厚生労働省において収集された副作用等の情報を基に, 医薬品 医療機器等のより安全な使用に役立てていただくために, 医療関係者に対して情報提供されるものです 医薬品 医療機器等安全性情報は, 独立行政法人医薬品医療機器総合機構ホームページ ( 又は厚生労働省ホームページ ( からも入手可能です 配信一覧はコチラ PMDA メディナビでどこよりも早く安全性情報を入手できます 厚生労働省 PMDA からの安全性に関する必須情報をメールで配信しています 登録いただくと 本情報も発表当日に入手可能です 登録はコチラ 平成 30 年 (2018 年 )10 月 厚生労働省医薬 生活衛生局 連絡先 東京都千代田区霞が関 厚生労働省医薬 生活衛生局医薬安全対策課 ( 直通 ) ( 内線 )2755,2754,2756 (Fax)
2 厚生労働省医薬 生活衛生局 情報の概要 357 No. 医薬品等対策情報の概要頁 1 重篤副作用疾患別対応マニュアル改定事業について ( その 2 ) 厚生労働省では, 平成 17 年度から平成 22 年度にかけて 重篤副作用疾患別対応マニュアル を作成しており, 平成 28 年度からは, 最新の知見等を踏まえた改定を進めているところです 本号では, 平成 29 年度の改訂作業の進捗状況について紹介します 3 2 医薬品副作用被害救済制度の概要と制度への協力のお願いについて 医薬品副作用被害救済制度について, 平成 29 年度の一般国民における認知率が低いことから, 本制度の周知のため, その概要について紹介します 7 3 アマンタジン塩酸塩他 (13 件 ) 使用上の注意の改訂について ( その 297) 21 4 市販直後調査の対象品目一覧平成 30 年 8 月末日現在, 市販直後調査の対象品目を紹介します 27 : 緊急安全性情報の配布 : 安全性速報の配布 : 使用上の注意の改訂 : 症例の紹介 厚生労働大臣への副作用等報告は, 医薬関係者の業務です 医師, 歯科医師, 薬剤師等の医薬関係者は, 医薬品, 医療機器や再生医療等製品による副作用, 感染症, 不具合を知ったときは, 直接又は当該医薬品等の製造販売業者を通じて厚生労働大臣へ報告してください なお, 薬局及び医薬品の販売の従事者も医薬関係者として, 副作用等を報告することが求められています
3 企業から提供自覚症状などから重大な副作用を早期に 労省患者 家族厚提供診断法 1 重篤副作用疾患別対応マニュアル改定事業について ( その2) 1. 重篤副作用疾患別対応マニュアルの改定について 重篤副作用疾患別対応マニュアル は, 平成 17 年度から平成 22 年度にかけて, 学術論文, 各種ガイ ドライン, 厚生労働科学研究事業報告書, 独立行政法人医薬品医療機器総合機構の保健福祉事業報告書 等を参考に, 厚生労働省の委託により, 関係学会においてマニュアル作成委員会を組織し, 一般社団法 人日本病院薬剤師会とともに議論を重ねて作成されたマニュアル案をもとに, 重篤副作用総合対策検討 会で検討され取りまとめられたものであり, これまでに合計 75 疾患について作成されています 平成 28 年度からは, 最新の知見等を踏まえたマニュアルの改定に着手しているところです 1 重篤副作用疾患別対応マニュアル改定 平成 17 年度から 22 年度までに作成した重篤副作用疾患別対応マニュアル ( 計 75 疾患 ) について 医療現場等における副作用の早期発見 早期対応に資するよう 最新の知見を踏まえた改定 更新を行う ( 優先順位をつけ 平成 28 年度から 5 年計画で全体を見直す ) 関係学会 副作用疾患ごとに専門の学会に協力を依頼 重篤副作用総合対策検討会 ( 厚生労働省 ) 臨床検査値 発生までの服薬期間 典型症例 マニュアル (計75疾患初期症状副作用疾リスク因子患)重篤副作用疾患別対応ごと患者向け説明文書 医師等 副作用対応能力の向上 自覚症状から副作用の早期発見 治療法 発見できるような患者及び家族の方向けの情報や 医療関係者向けの診断方法及び対処方法などを記載 PMDAウェブサイト上で情報! 医薬品医療機器総合機構 (PMDA) 企業 類薬の未然の安全対策新薬の開発時のリスク低減 1 医薬品医療機器等安全性情報 No.348 ( 医薬品 医療機器等安全性情報 No 年 10 月
4 2. 改定の進捗 平成 29 年度には, 以下のマニュアルについて改定作業を行い, 平成 30 年 5 月 31 日に開催された重篤副 作用総合対策検討会での検討を経て取りまとめられ,6 月に公表されました 平成 29 年度に新規作成又は改定されたマニュアル 作成学会 マニュアル名 区分 日本皮膚科学会 多形紅斑 新規作成 日本腎臓学会 急性腎障害 ( 急性尿細管壊死 ) 改定 間質性腎炎 ( 尿細管間質性腎炎 ) ネフローゼ症候群血管炎による腎障害 (ANCA 関連含む ) 腎性尿崩症腫瘍崩壊症候群低カリウム血症 改定改定改定改定改定新規作成 日本糖尿病学会高血糖改定 低血糖 改定 日本口腔外科学会骨吸収抑制薬に関連する顎骨壊死 顎骨骨髄炎改定 日本整形外科学会骨粗鬆症改定 分野別の概要は次の通りです (1) 皮膚科分野皮膚科分野では, 多形紅斑 のマニュアルの新規作成を行いました 多形紅斑は, 重症薬疹であるスティーヴンス ジョンソン症候群とは異なり, ステロイドの大量投与や免疫グロブリンの大量投与などの強力な治療を必要としない疾患です しかし, 重症型では, 発熱や粘膜疹を伴うことからスティーヴンス ジョンソン症候群との鑑別が必要であり, それについて, 臨床的, 病理組織学的に解説しています 既存のスティーヴンス ジョンソン症候群のマニュアルでは多形紅斑との皮膚の病理組織的な違いが記載されておりますが, 多形紅斑の臨床症状についての詳細な記載や組織像がありませんでした また, 多形紅斑の治療についても既存マニュアルには記載がありませんので, 今回, 新しい多型紅斑のマニュアルで対応しています (2) 腎臓分野腎臓分野では, 分野全体の見直しを行い, 既存のマニュアル構成を改めて, 急性腎障害 ( 急性尿細管壊死 ), 間質性腎炎( 尿細管間質性腎炎 ), ネフローゼ症候群, 血管炎による腎障害 (ANCA 関連含む ), 腎性尿崩症, 腫瘍崩壊症候群 及び 低カリウム血症 の7マニュアルとしました 内容についても日本腎臓学会の 薬剤性腎障害診療ガイドライン (2016 年 ) 2018 年 10 月 -4- 医薬品 医療機器等安全性情報 No.357
5 も踏まえ, これまでの 急性腎不全 が 急性腎障害 (AKI),Acute Kidney Injuryという国際的な疾患名 概念に変わったことなどを受けて改定しています 腎疾患治療において, 多様な薬剤性電解質異常が起こりますが, その中でも低カリウム血症は気付かれにくく, 慢性に経過することによって腎障害を促進することがあるため, 注意を喚起すべきとの観点から, 新規のマニュアルとして, 低カリウム血症が作成されています (3) 代謝 内分泌代謝 内分泌分野では 高血糖 及び 低血糖 のマニュアルの改定を行いました 高血糖に関しては, 近年上市された免疫チェックポイント阻害薬により, 非常にまれながら劇症 1 型糖尿病が発症することを受け, 免疫チェックポイント阻害薬に関する注意喚起を行う事を中心として改定が行われ, 関連の記載や当該薬剤により発症した劇症 1 型糖尿病の症例が加えられています 低血糖に関しては, 日本糖尿病学会により実施された, 重症低血糖の背景に関する全国調査を踏まえ, 改定が行われています この調査により, 重症低血糖が起こる背景として, 高齢者であること, 厳格な血糖コントロールを達成していること,SU 剤を使っていること等が大きなリスクファクターであることが判明しており, これを踏まえた記載が行われています また, 高血糖及び低血糖の発症は高齢者に多いことから, 両マニュアルの 患者の皆様へ のパートにおいて, 本人のみならず家族あるいは介護者に対するメッセージを加えるべきとの観点からの改定も行っています (4) 口腔口腔分野では, 骨吸収抑制薬に関連する顎骨壊死 顎骨骨髄炎 のマニュアルが改定されました 従前のマニュアル名は ビスホスホネート系薬剤による顎骨壊死 でしたが, ビスホスホネート系薬剤ではない骨吸収抑制薬の登場や, この登場を踏まえた2016 年の日本口腔外科学会によるポジションペーパーの改編を元に, 改定されています 骨への侵襲的歯科治療が最大のリスクファクターとされていたところに, 抜歯以外のものに関しては特にリスクファクターにならないと明記した点や, 累積投与量が重要である点などの最近の知見を盛り込んだり, 症状に関連する写真を追加したりする等, 内容の更新と充実が図られています (5) 骨骨分野では, 骨粗鬆症 の改定を行いました 初版は, 平成 21 年 5 月に作成されていますが, 当時は副作用の原因薬剤として経口ステロイドを中心に記載をされていましたところ, その後海外において性ホルモン低下療法として, アロマターゼ阻害薬, アンドロゲン遮断療法に伴う骨量減少に対するガイドライン, ポジションステートメントが出されたことを踏まえ, 改定を行っています また, 日本骨代謝学会が2014 年に, ステロイド性骨粗鬆症の管理と治療ガイドラインを改訂したことを受け, 治療方法の記載を更新したほか, 最近の知見を取り込んだ改定を行っています 医薬品 医療機器等安全性情報 No 年 10 月
6 (6) その他 ( 各分野共通の事項 ) 今回のマニュアル改定に合わせ, 医薬品副作用被害救済制度に関する記載も追加しています 各マニュアルにおける冒頭の 本マニュアルについて の項の最後に医薬品副作用被害救済制度についての説明を追記し, マニュアル末尾に参考 3として医薬品副作用被害救済制度の過去 5 年の支給件数, 参考 4として医薬品副作用被害救済制度の解説を記載しました 3. おわりに 平成 30 年度も引き続きマニュアルの改定を行ってまいります マニュアルについては厚生労働省及び PMDA のウェブサイト 2 に掲載しておりますので, 是非ご活用下さい 2 厚生労働省重篤副作用疾患別対応マニュアルウェブサイト ( PMDA 重篤副作用疾患別対応マニュアル ( 医療従事者向け ) ウェブサイト ( 年 10 月 -6- 医薬品 医療機器等安全性情報 No.357
7 2 医薬品副作用被害救済制度の概要と制度への協力のお願いについて 1. はじめに 医薬品副作用被害救済制度 ( 以下 本救済制度 という ) は, 医薬品が適正に使用されたにもかかわらず副作用が発生し, それによる疾病, 障害等の健康被害を受けた方を迅速に救済することを目的として, 医薬品等製造販売業者の社会的責任に基づく拠出金等を財源とする公的制度として昭和 55 年に創設されました また, 生物由来製品についても同様に, 適正に使用されたにもかかわらず, 生物由来製品を介してウイルス等に感染し, それによる疾病, 障害等の健康被害を受けた方を迅速に救済することを目的として, 生物由来製品感染等被害救済制度 が平成 16 年に創設されております さらに, 平成 26 年 11 月 25 日より, 再生医療等製品の副作用及び再生医療等製品を介した感染等についても, これらの救済制度の対象となっています 本救済制度では, 昭和 55 年の制度創設から平成 29 年度末までに21,507 件の支給決定がなされています 注 1) 2. 医薬品副作用被害救済制度に関する認知度 本救済制度について, 平成 29 年度一般国民における本救済制度の認知率は 知っている 10.3%, 名 前は聞いたことがある 22.3%, 合計 32.6% であり, 医薬品の副作用による健康被害を受けながらも本救 済制度の存在を知らないために請求に至らない方がいることと思われます 一方, 医療関係者における認知率は 知っている 62.3%, 名前は聞いたことがある 22.2%, 合計 84.5% であり, 職種別では, 医師が 93.5%, 薬剤師が 98.3%, 看護師が 62.5%, 歯科医師が 83.0% となって います 制度を認知している医療関係者のうち, 請求手続に関わったことがある人の割合は, 全体で 9.4%, 医師が 10.2%, 薬剤師が 12.6%, 看護師が 6.0%, 歯科医師が 5.4% となっています また, 平成 28 年 4 月から, 救済給付に係る全ての請求書様式に 救済制度に関する情報の入手経路 についての欄 ( 医 師 歯科医師 薬剤師 その他の医療機関職員 新聞 TV 等 その他 から選択 ) が設けられ ており, 救済制度に関する情報の入手経路の把握が行われたところ, 平成 29 年度における回答は, 医師 512 件 (34.0%), その他 ( インターネット )220 件 (14.6%), 新聞 TV 等 171 件 (11.4%), 薬剤師 136 件 注 2) (9.0%) の順 ( 重複回答あり ) となりました 医療関係者におかれましては, 医薬品や再生医療等製品の副作用により健康被害を受けた方々に対し て, 本救済制度を活用していただけるよう, 本救済制度について情報提供していただくと共に, 健康被 害者の請求に当たり, 診断書の作成等にご協力ください 医薬品 医療機器等安全性情報 No 年 10 月
8 3. 本救済制度における支給 不支給決定の状況について 本救済制度における請求件数, 支給件数は, 平成 25 年度から平成 29 年度までの年次推移は図 1のとおりとなっており, 平成 29 年度の請求件数は1,491 件, 支給件数は1,305 件, 不支給件数は298 件でした また, 不支給理由の内訳は, 図 2のとおりです また, 独立行政法人医薬品医療機器総合機構 ( 以下 PMDA という ) が申請を受理してから決定を申請者に通知するまでの標準的事務処理期間注 3) については, 目標を支給 不支給等を決定した件数のうち6カ月以内を60% 以上としており, 平成 29 年度の実績は69.3% でした 図 1 医薬品副作用被害救済の支給件数と不支給件数 ( 平成 25 年度 ~ 平成 29 年度 ) 請求件数 支給件数 不支給件数 平成 25 年度 平成 26 年度 平成 27 年度 平成 28 年度 平成 29 年度 ( グラフの説明 ) 件数は請求者ベースであり, 最初の請求時以降に再び同一の原因による請求があった場合は1 件として計上する 請求の受理から支給決定まで一定の時間を要するため, 年度内における請求件数と支給 不支給件数の合計は一致するものではない 2018 年 10 月 -8- 医薬品 医療機器等安全性情報 No.357
9 図 2 平成 25 年度 ~ 平成 29 年度の不支給理由の内訳 不支給決定件数の割合 4. 副作用救済給付の対象となる健康被害とは 副作用救済給付の対象となる健康被害は, 医薬品又は再生医療等製品 ( 以下 医薬品等 という ) を適正に使用したにもかかわらず発生した副作用による疾病 ( 入院を必要とする程度のもの ), 障害 ( 日常生活が著しく制限される程度の状態のもの ) 又は死亡です なお, 対象となる医薬品等については, 病院 診療所で処方又は使用されたもの, 薬局などで購入したもののいずれも救済の対象となりますが, 抗がん剤, 免疫抑制剤等, 一部に本救済制度から除外となるものもあります また, 疾病に対する医療費の請求等には医療費の支給の対象となる費用の支払いが行われたときから5 年以内といった請求期限があります 詳細については,PMDAのホームページ ( html) に掲載されていますのでご参照ください [ 救済給付の種類と給付額 ( 平成 30 年 4 月 1 日現在 )] 医療費 ( 健康保険等による給付の額を除いた自己負担分 ) 副作用による疾病の治療に要した費用を実費補償するものです 医療手当 ( 月額 34,400~36,400 円 ) 副作用による疾病の治療に伴う医療費以外の負担に着目して給付されるものです 障害年金 (1 級 : 年額 2,767,200 円,2 級 : 年額 2,214,000 円 ) 副作用により一定程度の障害の状態にある18 歳以上の人の生活補償等を目的として給付されるものです 障害児養育年金 (1 級 : 年額 865,200 円,2 級 : 年額 692,400 円 ) 副作用により一定程度の障害の状態にある18 歳未満の人を養育する人に対して給付されるものです 遺族年金 (2,420,400 円 ) 医薬品 医療機器等安全性情報 No 年 10 月
10 生計維持者が副作用により死亡した場合に, その遺族の生活の立て直し等を目的として給付されるものです 遺族一時金 (7,261,200 円 ) 生計維持者以外の人が副作用により死亡した場合に, その遺族に対する見舞等を目的として給付されるものです 葬祭料 (206,000 円 ) 副作用により死亡した人の葬祭を行うことに伴う出費に着目して給付されるものです [ 救済給付が認められた事例 ] < 事例 1> 月経困難症治療剤により深部静脈血栓症が生じ, 医療費 医療手当が給付された事例 20 代女性, ヤーズ配合錠 ( ドロスピレノン エチニルエストラジオールベータデクス ) を使用後, 肺血栓塞栓症, 深部静脈血栓症が生じ, 入院加療を行った 医療費 医療手当が支給された < 事例 2> X 線造影剤によりアナフィラキシーショックが生じ, 医療費 医療手当 遺族一時金 葬祭料が給付された事例 50 代男性, イオパミロン注 ( イオパミロール ) を使用後, アナフィラキシーショックが生じ死亡に至った 医療費 医療手当 遺族一時金 葬祭料が支給された < 事例 3> 鎮けい剤により薬剤性過敏症症候群が生じ, 医療費 医療手当 障害年金が給付された事例 50 代男性, トランコロン配合錠 ( メペンゾラート臭化物, フェノバルビタール ) を使用後, 薬剤性過敏症症候群 (DIHS) を生じ, 続発した閉塞性細気管支炎による呼吸機能障害となり, 医療費 医療手当 障害年金が支給された < 事例 4> 一般用医薬品により中毒性表皮壊死症が生じ, 医療費 医療手当が給付された事例 30 代男性, バファリン A を使用後, 中毒性表皮壊死症 ( ライエル症候群 ) が生じ, 入院加療を行った 医療費 医療手当が支給された 5. 医薬品の使用方法が適正と認められなかった事例について 平成 25 年度から平成 29 年度までの不支給件数 1,354 件注 4) のうち, そのおよそ5 分の1は医薬品の使用目的又は使用方法が適正とは認められないために不支給となっています ( 図 2) ここでは, 直近 (1 年余り ) において使用方法が適正と認められなかった理由について, 添付文書の記載内容又は具体的な事例を挙げて紹介します 使用方法が適正と認められなかった事例が多い主な医薬品は表 1のとおりです 2018 年 10 月 -10- 医薬品 医療機器等安全性情報 No.357
11 表 1 医薬品の使用方法が適正と認められなかった事例数 ( 平成 25 年度 ~ 平成 29 年度 ) 原因医薬品名 平成 25 年度 平成 26 年度 平成 27 年度 平成 28 年度 平成 29 年度 計 ( 件 ) ラモトリギン チアマゾール 炭酸リチウム その他 計 ( 件 ) (1) 承認された用法及び用量を遵守せず使用された事例承認された用法及び用量を遵守せず使用された事例としては, ラモトリギン ( ラミクタール錠 ) が多数を占めています 医療関係者におかれましては, 添付文書を再度確認し, 用法及び用量に留意して使用していただくようお願いします < 事例 > ラモトリギンによる薬剤性過敏症症候群の事例 10 代女性, ラミクタール錠をてんかんに用い, バルプロ酸ナトリウムを併用する処方において,1 日 50mg 連日投与から開始されたため, 適正使用とは認められませんでした ラモトリギンに関する不適正使用についてラモトリギンについては, 用法及び用量を超えて本剤を投与した場合に皮膚障害の発現率が高くなります そのため投与開始時及び漸増時の用量, 隔日投与, 漸増時期など用法及び用量で遵守すべき事項については,2015 年 2 月の安全性速報 ( ブルーレター ) を始め, 様々な方法で注意喚起しています このような注意喚起にもかかわらず, 副作用を生じたとして請求され, 適正な使用とは認められず不支給となった事例は, 未だに後を絶ちません これらの不適正使用が理由で救済されなかった事例の多くは, 投与開始時又は維持用量までの漸増時の用量が過量, あるいは増量時期を早めて投与されていました ラモトリギンの用法及び用量は, 効能 効果や併用する薬剤により投与量や増量間隔が細かく規定されておりますので, 使用する際は, 添付文書を十分に確認するようにお願いします 以下では, てんかん患者に用いる場合 ( 成人 ) を例示しますが, 添付文書では, 他の用法の場合も規定されています 医薬品 医療機器等安全性情報 No 年 10 月
12 てんかん患者に用いる場合 : 成人ラミクタール錠添付文書 2017 年 3 月改訂より 図 3 ラモトリギンの併用薬の例 併用薬 あり なし ラモトリギン単独療法表 22 バルプロ酸ナトリウム 併用なし 併用あり 表 21 ラモトリギンの代謝に影響を及ぼさない薬剤 アリピプラゾール プレガバリン オランザピン リチウム ゾニサミド レベチラセタム ガバペンチン ペランパネル トピラマート ラコサミド シメチジン 併用なし ラモトリギンの代謝を促進する薬剤 フェニトイン カルバマゼピン フェノバルビタール プリミドン リファンピシン ロピナビル リトナビル配合剤 併用なし 併用あり 併用あり 表 22 表 23 上記以外で てんかん治療に用いる薬剤 併用あり 表 21 表 2 ラモトリギンの投与開始時の用量 1 2 週目 3 4 週目 5 週目 ~ 維持期 1 25mg を 2 日に 1 回 25mg/ 日 1~2 週間毎に 25~50mg/ 日ずつ漸増 100~200mg/ 日 1 2 週目 3 4 週目 5 週目 6 週目 ~ 維持期 2 25mg/ 日 50mg/ 日 100mg/ 日 1~2 週間毎に最大 100mg/ 日ずつ漸増 100~200mg/ 日 1 2 週目 3 4 週目 5 週目 ~ 維持期 3 50mg/ 日 100mg/ 日 1~2 週間毎に最大 100mg/ 日ずつ漸増 200~400mg/ 日 2018 年 10 月 -12- 医薬品 医療機器等安全性情報 No.357
13 (2) 必要な検査が実施されていない事例医薬品の使用に当たり添付文書で規定された検査が未実施であった場合, 使用方法が適正とは認められません 副作用を早期に発見し重篤化を回避するためには, 適切な検査の実施と, 検査の必要性を患者に理解していただけるように説明することが重要と考えられますので, 医療関係者におかれましては, 添付文書の記載事項を再度ご確認いただきますようお願いします < 事例 1> チクロピジン塩酸塩による汎血球減少症の事例 80 代男性, チクロピジン塩酸塩の服用開始から, 発熱の持続と汎血球減少が認められた 35 日後まで, 血液検査が一度も実施されていなかったため, 適正使用とは認められませんでした チクロピジン塩酸塩の添付文書における記載状況 ( 一部抜粋 ) 警告 血栓性血小板減少性紫斑病 (TTP), 無顆粒球症, 重篤な肝障害等の重大な副作用が主に投与開始後 2ヵ月以内に発現し, 死亡に至る例も報告されている [ 重大な副作用 の項参照] 投与開始後 2ヵ月間は, 特に上記副作用の初期症状の発現に十分留意し, 原則として2 週に1 回, 血球算定 ( 白血球分画を含む ), 肝機能検査を行い, 上記副作用の発現が認められた場合には, ただちに投与を中止し, 適切な処置を行うこと 本剤投与中は, 定期的に血液検査を行い, 上記副作用の発現に注意すること 重大な副作用 無顆粒球症 ( 初期症状 : 発熱, 咽頭痛, 倦怠感等 ) 無顆粒球症があらわれることがある ( 特に投与開始後 2ヵ月以内 ) ので, 観察を十分に行い, 初期症状が認められた場合には, ただちに投与を中止し, 血液検査 ( 血球算定等 ) および適切な処置を行うこと < 事例 2> フェノフィブラートによる薬物性肝障害の事例 30 代男性, リピディル錠 ( フェノフィブラート ) の投与開始後, 肝機能障害が認められるまでの 56 日 間, 肝機能検査が一度も実施されていなかったため, 適正使用とは認められませんでした リピディル錠の添付文書における記載状況 ( 一部抜粋 ) 禁忌 肝障害のある患者 [ 肝障害を悪化させることがある ] 重要な基本的注意 AST(GOT),ALT(GPT),γ-GTP,LDH,ALPの上昇, 黄疸, 並びに肝炎があらわれることがあるので, 肝機能検査は投与開始 3カ月後までは毎月, その後は3カ月ごとに行うこと 重大な副作用 肝障害 (0.1 5% 未満 ): 肝炎や黄疸,AST(GOT),ALT(GPT) 等の著しい上昇を伴う肝機能障害があらわれることがあるので, 定期的に肝機能検査を行うなど観察を十分に行い, 異常が認められた場合には投与を中止し, 適切な処置を行うこと 医薬品 医療機器等安全性情報 No 年 10 月
14 (3) 禁忌 及び 原則禁忌 に該当する患者に使用された事例 禁忌 及び 原則禁忌 に該当する患者であるにもかかわらず医薬品を使用し, 適正ではないとされた事例もあります 医療関係者におかれましては, 患者の原疾患 合併症, アレルギー歴, 副作用歴又は他院での服用歴等を十分に考慮した上で, 医薬品を適正に使用していただきますようお願いします < 事例 1> ミコナゾール ゲル剤とワーファリンの併用の事例 80 代男性, ワーファリン錠を継続内服中のところ, フロリードゲル経口用 ( ミコナゾール ゲル剤 ) が併用され,PT-INRが著しく上昇し, 血液凝固異常及び脳出血が生じました これらの医薬品は併用禁忌であるため, 適正使用とは認められませんでした ミコナゾール ゲル剤の添付文書における記載状況 ( 一部抜粋 ) 禁忌 ワルファリンカリウム, ピモジド, キニジン, トリアゾラム, シンバスタチン, アゼルニジピン, ニソルジピン, ブロナンセリン, エルゴタミン酒石酸塩, ジヒドロエルゴタミンメシル酸塩, リバーロキサバン, アスナプレビル, ロミタピドメシル酸塩を投与中の患者 ( 相互作用 の項参照) 併用禁忌 薬剤名等ワルファリンカリウムワーファリン臨床症状 措置方法ワルファリンの作用が増強し, 重篤な出血あるいは著しいINR 上昇があらわれることがある また, 併用中止後も, ワルファリンの作用が遷延し重篤な出血を来したとの報告もある 患者がワルファリンの治療を必要とする場合は, ワルファリンの治療を優先し, 本剤を投与しないこと 機序 危険因子ミコナゾールがワルファリンの代謝酵素であるチトクロームP-450を阻害することによると考えられる < 事例 2> アルベカシン硫酸塩による慢性腎不全の急性憎悪の事例 80 代男性 高齢で糖尿病性腎症があり, 腎機能が低下しているにもかかわらず, アルベカシン硫酸塩注射液が1 日 200mgにて連日使用されており, 慢性腎不全の急性憎悪が生じたため, 適正使用とは認められませんでした アルベカシン硫酸塩注射液の添付文書における記載状況 ( 一部抜粋 ) 原則禁忌 腎障害のある患者 [ 高い血中濃度が持続し, 腎障害が悪化するおそれがあり, また, 第 8 脳神経障害等の副作用が強くあらわれるおそれがある 薬物動態 の項参照 ] 用法及び用量 成人への投与 2018 年 10 月 -14- 医薬品 医療機器等安全性情報 No.357
15 通常, 成人にはアルベカシン硫酸塩として,1 日 1 回 150~200mg( 力価 ) を30 分 ~2 時間かけて点滴静注する 必要に応じ,1 日 150~200mg( 力価 ) を2 回に分けて点滴静注することもできる また, 静脈内投与が困難な場合, アルベカシン硫酸塩として,1 日 150~200mg( 力価 ) を1 回又は2 回に分けて筋肉内注射することもできる なお, 年齢, 体重, 症状により適宜増減する 重要な基本的注意 急性腎不全等の重篤な腎障害があらわれることがあるので, 投与中は腎機能検査を行うなど慎重に投与すること 特に高齢者や重篤な基礎疾患 合併症を有する患者では, 投与量の設定等にも十分留意し, 患者の状態を観察しながら, 慎重に投与すること (4) 医師の指示によらず, 自己判断で服用した事例医師の処方により使用される医療用医薬品を, 医師の指示に従わず自己判断で服用した場合, 又は本人以外の家族又は知人に処方された医療用医薬品を服用した場合は, 使用目的及び使用方法が適正とは認められません 医療関係者におかれましては, 患者が適切に医薬品を服用できるよう, 投与日又は服薬条件及び服用量等について口頭でも具体的に指示するなど, 確実なご指導をお願いします < 事例 > メシル酸ガレノキサシン水和物による皮膚粘膜眼症候群の事例 30 代男性 感冒症状等を認めたため, 以前医師から処方されたジェニナック錠 ( メシル酸ガレノキサ シン水和物 ) の残薬を自己判断にて服用したため, 適正使用とは認められませんでした (5) その他の添付文書の記載を遵守しないで使用された事例添付文書における効能 効果外の使用について, 患者選択に必要な検査 診断基準等や適切な用法 用量等が明らかになっておらず, 使用にあたり安全性が担保されていない事例, 患者選択にあたり使用上の注意喚起がなされているにもかかわらず, 守られていない事例, 使用中止等の注意喚起がなされているにもかかわらず, 使用が継続されている事例も, 使用方法が適正とは認められませんでした 医療関係者におかれましては, 添付文書の記載を改めて確認していただきますようお願いします < 事例 1> ボノサップパックによる多形紅斑の事例 50 代男性, 内視鏡検査が実施されずにヘリコバクター ピロリ感染胃炎と診断され, ボノサップパッ クが使用されたため, 適正使用とは認められませんでした ボノサップパックの添付文書における記載状況 ( 一部抜粋 ) 効能又は効果 < 適応菌種 > アモキシシリン, クラリスロマイシンに感性のヘリコバクター ピロリ < 適応症 > 胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃におけるヘリコバクター ピロリ感染症, ヘリコバクター ピロリ感染胃炎 医薬品 医療機器等安全性情報 No 年 10 月
16 効能 効果に関連する使用上の注意 ヘリコバクター ピロリ感染胃炎に用いる際には, ヘリコバクター ピロリが陽性であること及び 内視鏡検査によりヘリコバクター ピロリ感染胃炎であることを確認すること < 事例 2> ブシラミンによるネフローゼ症候群の事例 70 代男性, リマチル錠 ( ブシラミン ) の使用中に尿蛋白の異常及び血清アルブミン値の上昇が認められていたにも関わらず, その後さらに検査値が悪化し下腿浮腫の訴えがありネフローゼ症候群の発症が疑われるまで医薬品の投与が継続されたため, 適正使用とは認められませんでした リマチル錠の添付文書における記載状況 ( 一部抜粋 ) 禁忌 腎障害のある患者 [ ネフローゼ症候群等の重篤な腎障害を起こすおそれがある ] 重要な基本的注意 本剤投与前には必ず血液, 腎機能, 肝機能等の検査を実施すること 投与中は臨床症状を十分に観察するとともに, 毎月 1 回血液及び尿検査等の臨床検査を行うこと なお, 臨床検査のうち白血球数, 血小板数及び尿蛋白の検査値が下記のいずれかの値を示したときは, 投与を中止し, 適切な処置を行うこと 重大な副作用 急性腎不全 ( 頻度不明 ), ネフローゼ症候群 ( 膜性腎症等 )(0.1%): 急性腎不全, ネフローゼ症候群 ( 膜性腎症等 ) があらわれることがあるので, 投与中は毎月 1 回尿検査等を実施し ( 2. 重要な基本的注意 の項参照 ), 異常が認められた場合には直ちに投与を中止し, 適切な処置を行うこと 医療関係者におかれましては, あらためて添付文書の記載を確認し, 適正使用に努めていただくよう お願いします 医薬品の適正使用に関するお知らせ 6. 医薬品副作用被害救済制度に関する情報の入手先 本救済制度及び生物由来製品感染等被害救済制度の詳細については,PMDAのホームページ( に掲載されていますのでご参照ください また, 同ホームページには患者向け資材が用意されていますので, 制度の普及にご活用ください 請求に必要な書類は下記よりダウンロードでき, パソコン等で作成できます なお, パソコン等で作成した場合は, 紙による提出と共に電子ファイルをCD 等の電子媒体へコピーしたものを添付いただきますようご協力をお願いします 診断書及び投薬 使用証明書の記載は医薬品の使用が適切であったのか等, 判定を行う上で重要な情 2018 年 10 月 -16- 医薬品 医療機器等安全性情報 No.357
17 報となりますので, 可能な限り具体的に記入してください 診断書の記載要領も掲載しておりますので, ご活用ください なお, 以下に掲げる場合には救済給付の対象になりませんので, ご留意ください ア. 法定予防接種を受けたことによるものである場合 ( 予防接種法に基づく予防接種健康被害救済制 度がある ) ただし, 任意に予防接種を受けた場合は対象となります 注 5) イ. 製造販売業者など, 他に損害賠償の責任を有する者が明らかな場合 ウ. 救命のためやむを得ず通常の使用量を超えて使用したことによる健康被害で, その発生があらか 注 6) じめ認識されていた等の場合 エ. 使用目的 方法が適正と認められない場合 ( 厚生労働大臣が承認した効能効果以外の目的で使用した場合や添付文書の使用上の注意に従わ ずに使用された場合など ) オ. 対象除外医薬品等による健康被害の場合 対象除外医薬品 : 1 がんその他の特殊疾病に使用されることが目的とされている医薬品であって, 厚生労働大臣 の指定するもの ( 抗がん剤, 免疫抑制剤など ) 2 人体に直接使用されないものや薬理作用のないもの等, 副作用被害発現の可能性が考えられ ない医薬品 ( 殺虫剤, 殺菌消毒剤, 体外診断薬など ) カ. 軽度な健康被害 ( 入院を要すると認められる場合に必要な程度の医療を受けていない場合等 ) や 注 7) 障害の程度が規定の等級に該当しない場合 又は 日常生活に著しい制限を受ける程度の障 害の状態 (2 級 ) に当たらない場合 キ. 請求期限が経過している場合 ク. その他, 厚生労働省の薬事 食品衛生審議会における, 医学 薬学的判定において認められなかっ た場合 疾病, 障害等が医薬品等の副作用によるものとは考えがたいと判定された場合 ( 医薬品等によ り発現したものとは認められないため ) 提出された書類の不足等のため, 因果関係, 適正目的 適正使用がなされたか否かといった判 定ができない場合 ( 判定不能 ) 7. おわりに 医薬品等の使用に当たっては, 添付文書で必要な注意喚起を十分に確認し, 適正に使用していただきますよう, お願いします 医薬品等の副作用によると疑われる健康被害が生じても, 適正な使用でなかった場合, 本救済制度による健康被害者の救済が行われないことがあります 一方, 適応外使用の場合であっても, ガイドラインに記載されているなど医療現場で広く知られているものは救済対象となる場合もあります 副作用等が発生した場合, また, 副作用について相談を受けた場合, その健康被害が本救済制度の対象になると思われたときには, 本救済制度を患者又は家族等に紹介していただくとともに, 請求に必要 医薬品 医療機器等安全性情報 No 年 10 月
18 な診断書等の作成していただきますよう, 引き続き格段のご協力をお願いします 本救済制度の詳細は, 以下のホームページをご参照ください 本救済制度の相談窓口は以下のとおりです ( 生物由来製品感染等被害救済制度についても同様 ) 独立行政法人医薬品医療機器総合機構救済制度相談窓口電話番号 : ( フリーダイヤル ) 受付時間 : 月 金 ( 祝日 年末年始を除く ) 午前 9 時 午後 5 時 kyufu@pmda.go.jp 注 1) 平成 29 年度医薬品副作用被害救済制度に関する認知度調査 による 注 2) 平成 29 事業年度業務報告 ( 独立行政法人医薬品医療機器総合機構 ) による 注 3) 請求から支給 不支給決定までの事務処理期間のうち, 医学 薬学的判断等のため, 請求者又は医療機関等に対して追加 補足資料及び調査が必要とされ, 事務処理を行うことができなかった期間等を除いたもの 注 4) 件数は請求者ベースであり, 最初の請求時以降に再び同一の原因による請求があった場合も1 件として計上する 注 5) 損害賠償の責任を有する者 とは, 典型的には, 変異した医薬品や異物が混入した医薬品等のいわゆる不良医薬品による事故の責任者等を指します 注 6) 発生した医薬品の副作用被害について社会通念上あらかじめ被害者の受忍が求められる場合 ここで想定されている受忍の典型例の構成要素は次のようなものです 1 医薬品が救命救急の状況で使用されること 2 代替する治療方法がないこと 3 医薬品が通常の使用量を超えて使用されること 4 医薬品の副作用による健康被害の発生の可能性があらかじめ認識されていたこと 5 4であらかじめ認識されていた医薬品の副作用による健康被害が発生したこと 個別の事例が受忍を求める場合に該当するか否かの判断はこの受忍の典型例に照らし, 受忍を求めることについて, 社会通念上これと同程度の妥当性が必要とされるものです この場合, 必ずしもここに上げた五つの要件のすべてを満たしていなくても他の状況, 要因等も踏まえて, 総合的な見地からこの典型例に準ずると認められるかどうか判断すべきものです 注 7) 障害の状態が, 日常生活の用を自分ですることができない程度の障害の状態(1 級 ) 又は 日常生活に著しい制限を受ける程度の障害の状態 (2 級 ) に当たらない 2018 年 10 月 -18- 医薬品 医療機器等安全性情報 No.357
19 医薬品副作用被害救済制度によるヒトパピローマウイルスワクチンに関する救済の取り組みについて 1. はじめに平成 27 年 9 月 17 日にヒトパピローマウイルスワクチン ( 以下 HPVワクチン という ) に関する厚生科学審議会予防接種 ワクチン分科会副反応検討部会及び薬事 食品衛生審議会医薬品等安全対策部会安全対策調査会の合同会議が行われ, その際に報告された国による全国規模の追跡調査の結果, 様々な症状に苦しんでいる方がおり, 日常生活や学校生活に悩みを抱えている方がいるという実情も明らかになりました この結果を踏まえ, 医薬品副作用被害救済制度においては,HPVワクチン接種後に生じた症状について, 健康被害を訴え請求された方に対しては速やかに救済に係る審査を行うと共に, 救済制度について周知するよう努めてまいりました 平成 29 年 9 月末までにHPV ワクチン接種との因果関係が否定できないとして救済制度の対象となった方は, 審査した計 436 人中,274 人となっています 厚生労働省では, 今後とも患者の方々に寄り添いながら必要な支援を行うとともに, 速やかに救済に関する審査を実施いたします 2. 子宮頸がん等ワクチン接種緊急促進事業 による健康被害の救済について当該事業で該当するワクチンを接種された方注 ) については, 救済の審査の結果, 健康被害が医薬品の副作用 ( 副反応 ) によるとされ, 例えば通院により治療を受けた場合など, 入院治療を必要とする程度の医療に該当しない場合であっても, 公益財団法人予防接種リサーチセンターにおいて医療費 医療手当の支援が受けられる可能性があります 当該事業による接種で生じた健康被害で初めて医療費 医療手当の支援を受ける場合には, まず医薬品副作用被害救済制度への救済給付請求が必要となりますので, 請求者の手続 ( 診断書の作成等 ) にご協力いただきますようよろしくお願いいたします 注 ) 平成 22 年 11 月 26 日から平成 25 年 3 月 31 日の期間中に HPV ワクチンの接種を受けた中学校 1 年生 (13 歳相当 )~ 高校 1 年生 (16 歳相当 ) の女子は対象の可能性があります 3.HPV ワクチン等に係る医薬品副作用被害救済制度への救済給付請求に際して必要となる資料に関する留意事項について厚生労働省は平成 28 年 1 月 14 日に救済給付請求に際して必要となる資料に関する留意事項に関する事務連絡を発出しました 以下, 事務連絡を記載しますのでご確認ください 1. 診断書について (1) 診断書の作成については, 入院, 通院を問わず, 請求したい健康被害に係る医療に関するもののみでよく, また, 受診した全ての医療機関に診断書の作成を依頼する必要はありません (2) 診断書については, ワクチン接種との因果関係を判断するための情報, 例えば, ワクチンの接種日, 症状の発症までの経過に関する情報が重要であり, 可能な範囲で記載されたもの 医薬品 医療機器等安全性情報 No 年 10 月
20 を提出することで差し支えありません なお, 診断書の作成を依頼した医療機関での治療以外の情報 ( 例えば, 症状がはっきりとせず複数の医療機関を受診した期間の診療に関する情報や, その受診のきっかけとなった症状など ) を含めても差し支えありません その際には, 他の医療機関に関する情報が分かる資料 ( 住所, 電話番号, 受診日, カルテ番号, 担当医, 受診のきっかけとなった症状等の情報 ) を, 医療機関ではなく請求する方が作成したものや, 一部の情報のみのものでも差し支えありませんので, できるだけ添付くださいますようご協力ください 2. 投薬 使用証明書について (1) 診断書の作成を依頼した医師又は医療機関でワクチンを接種した場合には, 投薬証明書は不要です (2) 可能であれば, ワクチン接種前の予診票, 又はその他参考になる資料 ( 例えば検温結果, 問診又は診察事項など ) を添付いただくようご依頼ください 平成 28 年 1 月 14 日付安全対策課事務連絡 子宮頸がん等ワクチン接種緊急促進事業 に基づく接 種に係る医薬品副作用被害救済制度への救済給付請求に際して必要となる資料に関する留意事項に ついて より ( 参考 ) 平成 27 年 9 月 30 日付通知 ヒトパピローマウイルス感染症の予防接種後に症状が生じた方に対する相談 支援体制の充実について ( 健発 0930 第 7 号,27 文科ス第 419 号 ) 平成 27 年 10 月 22 日付健康課 安全対策課事務連絡 子宮頸がん等ワクチン接種緊急促進事業 に基づく接種に係る医薬品副作用被害救済制度の請求期限の周知について ( 依頼 ) 平成 27 年 12 月 1 日付健康課事務連絡 子宮頸がん等ワクチン接種緊急促進事業による健康被害の救済について ( 依頼 ) 平成 28 年 1 月 14 日付安全対策課事務連絡 子宮頸がん等ワクチン接種緊急促進事業 に基づく接種に係る医薬品副作用被害救済制度への救済給付請求に際して必要となる資料に関する留意事項について 平成 28 年 1 月 15 日付通知 独立行政法人医薬品医療機器総合機構が実施する健康被害救済制度に関する協力依頼について ( 薬生副 0115 第 1 号, 薬生安 0115 第 1 号 ) HPV ワクチン副反応被害判定調査会の設置について 年 10 月 -20- 医薬品 医療機器等安全性情報 No.357
21 3 使用上の注意の改訂について ( その297) 平成 30 年 8 月 21 日及び 9 月 18 日に改訂を指導した医薬品の使用上の注意について, 改訂内容, 主な該当販売名 等をお知らせします 1 [ 販売名 ] [ 重要な基本的注意 ] 抗パーキンソン剤, 精神神経用剤, 抗ウイルス剤アマンタジン塩酸塩 [ 副作用 ( 重大な副作用 )] シンメトレル錠 50mg, 同錠 100mg, 同細粒 10%( サンファーマ株式会社 ) 他 A 型インフルエンザウイルス感染症 に本剤を用いる場合 抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず, インフルエンザ罹患時 には, 異常行動を発現した例が報告されている 異常行動による転落等の万が一の事故を防止するための予防的な対応として,1 異常行動 の発現のおそれがあること,2 自宅において療養を行う場合, 少なくとも発熱から 2 日間, 保護者等は転落等の事故に対する防止対策を講じること, について患者 家族に対し説明 を行うこと なお, 転落等の事故に至るおそれのある重度の異常行動については, 就学以降の小児 未 成年者の男性で報告が多いこと, 発熱から 2 日間以内に発現することが多いこと, が知ら れている 意識障害 ( 昏睡を含む ), 精神症状 ( 幻覚, 妄想, せん妄, 錯乱等 ), 痙攣, ミオクロヌス, 異常行動 : 意識障害 ( 昏睡を含む ), 精神症状 ( 幻覚, 妄想, せん妄, 錯乱等 ), 痙攣, ミ オクロヌスがみられることがある このような場合には減量又は投与を中止するなど適切 な処置を行うこと 特に腎機能が低下している患者においてあらわれやすいので注意する こと 因果関係は不明であるものの, インフルエンザ罹患時には, 転落等に至るおそれの ある異常行動 ( 急に走り出す, 徘徊する等 ) があらわれることがある 医薬品 医療機器等安全性情報 No 年 10 月
22 2 [ 販売名 ] [ 重要な基本的注意 ] 抗ウイルス剤オセルタミビルリン酸塩 [ 副作用 ( 重大な副作用 )] タミフルカプセル 75, 同ドライシロップ 3%( 中外製薬株式会社 ) 他 抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず, インフルエンザ罹患時 には, 異常行動を発現した例が報告されている 異常行動による転落等の万が一の事故を防止するための予防的な対応として,1 異常行動 の発現のおそれがあること,2 自宅において療養を行う場合, 少なくとも発熱から 2 日間, 保護者等は転落等の事故に対する防止対策を講じること, について患者 家族に対し説明 を行うこと なお, 転落等の事故に至るおそれのある重度の異常行動については, 就学以降の小児 未 成年者の男性で報告が多いこと, 発熱から 2 日間以内に発現することが多いこと, が知ら れている 精神 神経症状, 異常行動 : 精神 神経症状 ( 意識障害, 譫妄, 幻覚, 妄想, 痙攣等 ) が あらわれることがあるので, 観察を十分に行い, 異常が認められた場合には投与を中止し, 症状に応じて適切な処置を行うこと 因果関係は不明であるものの, インフルエンザ罹患 時には, 転落等に至るおそれのある異常行動 ( 急に走り出す, 徘徊する等 ) があらわれる ことがある 3 [ 販売名 ] [ 重要な基本的注意 ] 抗ウイルス剤 1 ザナミビル水和物 2 ラニナミビルオクタン酸エステル水和物 [ 副作用 ( 重大な副作用 )] 1 リレンザ ( グラクソ スミスクライン株式会社 ) 2 イナビル吸入粉末剤 20mg( 第一三共株式会社 ) 抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず, インフルエンザ罹患時 には, 異常行動を発現した例が報告されている 異常行動による転落等の万が一の事故を防止するための予防的な対応として,1 異常行動 の発現のおそれがあること,2 自宅において療養を行う場合, 少なくとも発熱から 2 日間, 保護者等は転落等の事故に対する防止対策を講じること, について患者 家族に対し説明 を行うこと なお, 転落等の事故に至るおそれのある重度の異常行動については, 就学以降の小児 未 成年者の男性で報告が多いこと, 発熱から 2 日間以内に発現することが多いこと, が知ら れている 異常行動 : 因果関係は不明であるものの, インフルエンザ罹患時には, 転落等に至るおそ れのある異常行動 ( 急に走り出す, 徘徊する等 ) があらわれることがある 2018 年 10 月 -22- 医薬品 医療機器等安全性情報 No.357
23 4 [ 販売名 ] [ 重要な基本的注意 ] 抗ウイルス剤バロキサビルマルボキシル [ 副作用 ( 重大な副作用 )] ゾフルーザ錠 10mg, 同錠 20mg( 塩野義製薬株式会社 ) 抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず, インフルエンザ罹患時 には, 異常行動を発現した例が報告されている 異常行動による転落等の万が一の事故を防止するための予防的な対応として,1 異常行動 の発現のおそれがあること,2 自宅において療養を行う場合, 少なくとも発熱から 2 日間, 保護者等は転落等の事故に対する防止対策を講じること, について患者 家族に対し説明 を行うこと なお, 転落等の事故に至るおそれのある重度の異常行動については, 就学以降の小児 未 成年者の男性で報告が多いこと, 発熱から 2 日間以内に発現することが多いこと, が知ら れている 異常行動 : 因果関係は不明であるものの, インフルエンザ罹患時には, 転落等に至るおそ れのある異常行動 ( 急に走り出す, 徘徊する等 ) があらわれることがある 5 [ 販売名 ] [ 重要な基本的注意 ] 抗ウイルス剤ファビピラビル [ 副作用 ( 重大な副作用 )] アビガン錠 200mg( 富山化学工業株式会社 ) 抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず, インフルエンザ罹患時 には, 異常行動を発現した例が報告されている 異常行動による転落等の万が一の事故を防止するための予防的な対応として,1 異常行動 の発現のおそれがあること,2 自宅において療養を行う場合, 少なくとも発熱から 2 日間, 保護者等は転落等の事故に対する防止対策を講じること, について患者 家族に対し説明 を行うこと なお, 転落等の事故に至るおそれのある重度の異常行動については, 就学以降の小児 未 成年者の男性で報告が多いこと, 発熱から 2 日間以内に発現することが多いこと, が知ら れている 異常行動 : 因果関係は不明であるものの, インフルエンザ罹患時には, 転落等に至るおそ れのある異常行動 ( 急に走り出す, 徘徊する等 ) があらわれることがある 医薬品 医療機器等安全性情報 No 年 10 月
24 6 [ 販売名 ] [ 重要な基本的注意 ] 抗ウイルス剤ペラミビル水和物 [ 副作用 ( 重大な副作用 )] ラピアクタ点滴静注液バッグ 300mg, 同点滴静注液バイアル 150mg( 塩野義製薬株式会社 ) 抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず, インフルエンザ罹患時 には, 異常行動を発現した例が報告されている 異常行動による転落等の万が一の事故を防止するための予防的な対応として,1 異常行動 の発現のおそれがあること,2 自宅において療養を行う場合, 少なくとも発熱から 2 日間, 保護者等は転落等の事故に対する防止対策を講じること, について患者 家族に対し説明 を行うこと なお, 転落等の事故に至るおそれのある重度の異常行動については, 就学以降の小児 未 成年者の男性で報告が多いこと, 発熱から 2 日間以内に発現することが多いこと, が知ら れている 異常行動 : 因果関係は不明であるものの, インフルエンザ罹患時には, 転落等に至るおそ れのある異常行動 ( 急に走り出す, 徘徊する等 ) があらわれることがある 7 その他の腫瘍用薬塩化ラジウム ( 223 Ra) [ 販売名 ] [ 重要な基本的注意 ] ゾーフィゴ静注 ( バイエル薬品株式会社 ) 化学療法未治療で無症候性又は軽度症候性の骨転移のある去勢抵抗性前立腺癌患者におい て, アビラテロン酢酸エステル及びプレドニゾン ( 国内未承認 )/ プレドニゾロン併用投 与時に本剤群ではプラセボ群と比較して, 死亡率及び骨折の発現率が高い傾向が認められ たことから, 化学療法未治療で無症候性又は軽度症候性の骨転移のある去勢抵抗性前立腺 癌患者に対する本剤とアビラテロン酢酸エステル及びプレドニゾロンの併用投与は推奨さ れない 8 その他の腫瘍用薬スニチニブリンゴ酸塩 [ 販売名 ] [ 副作用 ( 重大な副作用 )] スーテントカプセル 12.5mg( ファイザー株式会社 ) 急性胆嚢炎 : 無石胆嚢炎を含む急性胆嚢炎があらわれることがあるので, 観察を十分に行い, 異常が認められた場合には, 休薬するなど適切な処置を行うこと 2018 年 10 月 -24- 医薬品 医療機器等安全性情報 No.357
25 9 主としてグラム陽性 陰性菌に作用するものその他の抗生物質製剤 1 アンピシリン水和物 2 バカンピシリン塩酸塩 3 アンピシリンナトリウム クロキサシリンナトリウム水和物 [ 販売名 ] [ 副作用 ( 重大な副作用 )] 1 ビクシリンカプセル 250mg, 同ドライシロップ 10%(Meiji Seika ファルマ株式会社 ) 2 ペングッド錠 250mg( 日医工株式会社 ) 3 注射用ビクシリン S100, 同 S500, 同 S1000(Meiji Seika ファルマ株式会社 ) 中毒性表皮壊死融解症 (Toxic Epidermal Necrolysis:TEN), 皮膚粘膜眼症候群 (Stevens- Johnson 症候群 ), 急性汎発性発疹性膿疱症 : 中毒性表皮壊死融解症, 皮膚粘膜眼症候群, 急性汎発性発疹性膿疱症があらわれることがあるので, 観察を十分に行い, このような症 状があらわれた場合には, 投与を中止し, 適切な処置を行うこと 10 主としてグラム陽性 陰性菌に作用するものアンピシリンナトリウム [ 販売名 ] [ 副作用 ( 重大な副作用 )] ビクシリン注射用 0.25g, 同注射用 0.5g, 同注射用 1g, 同注射用 2g(Meiji Seika ファルマ株 式会社 ) 中毒性表皮壊死融解症 (Toxic Epidermal Necrolysis:TEN), 皮膚粘膜眼症候群 (Stevens- Johnson 症候群 ), 急性汎発性発疹性膿疱症 : 中毒性表皮壊死融解症, 皮膚粘膜眼症候群, 急性汎発性発疹性膿疱症があらわれることがあるので, このような症状があらわれた場合 には, 投与を中止し, 適切な処置を行うこと 11 主としてグラム陽性 陰性菌に作用するものスルタミシリントシル酸塩水和物 [ 販売名 ] [ 副作用 ( 重大な副作用 )] ユナシン錠 375mg, 同細粒小児用 10%( ファイザー株式会社 ) 中毒性表皮壊死融解症 (Toxic Epidermal Necrolysis:TEN), 皮膚粘膜眼症候群 (Stevens- Johnson 症候群 ), 急性汎発性発疹性膿疱症, 剥脱性皮膚炎 : 中毒性表皮壊死融解症, 皮膚 粘膜眼症候群, 急性汎発性発疹性膿疱症, 剥脱性皮膚炎があらわれることがあるので, 観 察を十分に行い, このような症状があらわれた場合には投与を中止し, 適切な処置を行う こと 12 その他の抗生物質製剤アンピシリン水和物 クロキサシリンナトリウム水和物 [ 販売名 ] [ 副作用 ( 重大な副作用 )] ビクシリン S 配合錠 (Meiji Seika ファルマ株式会社 ) 中毒性表皮壊死融解症 (Toxic Epidermal Necrolysis:TEN), 皮膚粘膜眼症候群 (Stevens- Johnson 症候群 ), 急性汎発性発疹性膿疱症 : 中毒性表皮壊死融解症, 皮膚粘膜眼症候群, 急性汎発性発疹性膿疱症があらわれることがあるので, このような症状があらわれた場合 には, 投与を中止すること 医薬品 医療機器等安全性情報 No 年 10 月
26 13 抗ウイルス剤ドルテグラビルナトリウム [ 販売名 ] [ 重要な基本的注意 ] [ 副作用 ( 重大な副作用 )] 14 テビケイ錠 50mg( ヴィーブヘルスケア株式会社 ) 肝機能障害, 黄疸があらわれることがあるので, 定期的に肝機能検査を行う等, 観察を十 分に行うこと なお臨床試験において,B 型及び C 型肝炎ウイルス重複感染患者では, ト ランスアミナーゼ上昇又は増悪の発現頻度が非重複感染患者より高かった 肝機能障害, 黄疸 :AST,ALT, ビリルビンの上昇等を伴う肝機能障害, 黄疸があらわれ ることがあるので, 異常が認められた場合には, 投与を中止するなど適切な処置を行うこと 抗ウイルス剤ドルテグラビルナトリウム アバカビル硫酸塩 ラミブジン [ 販売名 ] [ 重要な基本的注意 ] [ 副作用 ( 重大な副作用 )] トリーメク配合錠 ( ヴィーブヘルスケア株式会社 ) 肝機能障害, 黄疸があらわれることがあるので, 定期的に肝機能検査を行う等, 観察を十 分に行うこと なお臨床試験において,B 型及び C 型肝炎ウイルス重複感染患者では, ド ルテグラビルの投与によりトランスアミナーゼ上昇又は増悪の発現頻度が非重複感染患者 より高かった 肝機能障害 黄疸 :AST ALT ビリルンの上昇等を伴う肝機能障害 黄疸があらわれる ことがあるので 異常が認められた場合には 投与を中止するなど適切な処置を行うこと 2018 年 10 月 -26- 医薬品 医療機器等安全性情報 No.357
27 4 市販直後調査の対象品目一覧 一般名販売名 オビヌツズマブ ( 遺伝子組換え ) ガザイバ点滴静注 1,000mg デュルバルマブ ( 遺伝子組換え ) イミフィンジ点滴静注 120mg, 同点滴静注 500mg イピリムマブ ( 遺伝子組換え ) *1 ヤーボイ点滴静注液 50mg ニボルマブ ( 遺伝子組換え ) オプジーボ点滴静注 20mg, 同点滴静注 100mg テジゾリドリン酸エステルシベクトロ錠 200mg, 同点滴静注用 200mg コンドリアーゼヘルニコア椎間板注用 1.25 単位ホスラブコナゾール L-リシンエタノール付加物ネイリンカプセル100mg カナキヌマブ ( 遺伝子組換え ) *2 イラリス皮下注用 150mg, 同皮下注射液 150mg ( 平成 30 年 8 月末日現在 ) : 平成 30 年 8 月 1 日以降に市販直後調査が開始された品目 製造販売業者名 中外製薬 ( 株 ) アストラゼネカ ( 株 ) ブリストル マイヤーズスクイブ ( 株 ) 小野薬品工業 ( 株 ) バイエル薬品 ( 株 ) 生化学工業 ( 株 ) 佐藤製薬 ( 株 ) ノバルティスファーマ ( 株 ) 市販直後調査開始年月日 平成 30 年 8 月 29 日 平成 30 年 8 月 29 日 平成 30 年 8 月 21 日 平成 30 年 8 月 21 日 平成 30 年 8 月 21 日 平成 30 年 8 月 1 日 平成 30 年 7 月 27 日 平成 30 年 7 月 2 日 オラパリブ *3 アストラゼネカ ( 株 ) 平成 30 年 7 月 2 日リムパーザ錠 100mg, 同錠 150mg スギ花粉エキス シダキュアスギ花粉舌下錠 2,000JAU, 同花粉舌下錠 5,000JAU イブプロフェン L- リシン イブリーフ静注用 20mg ラサギリンメシル酸塩 アジレクト錠 0.5mg, 同錠 1mg シロリムス ラパリムスゲル 0.2% ペマフィブラート パルモディア錠 0.1mg ミガーラスタット塩酸塩 ガラフォルドカプセル 123mg レテルモビル プレバイミス錠 240mg, 同点滴静注 240mg 鳥居薬品 ( 株 ) 千寿製薬 ( 株 ) 武田薬品工業 ( 株 ) ノーベルファーマ ( 株 ) 興和 ( 株 ) Amicus Therapeutics( 株 ) MSD( 株 ) 平成 30 年 6 月 29 日 平成 30 年 6 月 14 日 平成 30 年 6 月 11 日 平成 30 年 6 月 6 日 平成 30 年 6 月 1 日 平成 30 年 5 月 30 日 平成 30 年 5 月 28 日 医薬品 医療機器等安全性情報 No 年 10 月
28 メポリズマブ ( 遺伝子組換え ) *4 ヌーカラ皮下注用 100mg イピリムマブ ( 遺伝子組換え ) ヤーボイ点滴静注液 50mg ニボルマブ ( 遺伝子組換え ) オプジーボ点滴静注 20mg, 同点滴静注 100mg *5 A 型ボツリヌス毒素 ボトックス注用 50 単位, 同注用 100 単位 *6 トファシチニブクエン酸塩 ゼルヤンツ錠 5mg エミシズマブ ( 遺伝子組換え ) ヘムライブラ皮下注 30mg, 同皮下注 60mg, 同皮下注 90mg, 同皮下注 105mg, 同皮下注 150mg グセルクマブ ( 遺伝子組換え ) トレムフィア皮下注 100mg シリンジ エボカルセト オルケディア錠 1mg, 同錠 2mg ヒドロモルフォン塩酸塩 ナルベイン注 2mg, 同注 20mg ベダキリンフマル酸塩 サチュロ錠 100mg エゼチミブ / アトルバスタチンカルシウム水和物 アトーゼット配合錠 LD, 同配合錠 HD デュピルマブ ( 遺伝子組換え ) デュピクセント皮下注 300mg シリンジ エロビキシバット水和物 グーフィス錠 5mg オラパリブ リムパーザ錠 100mg, 同錠 150mg イノツズマブオゾガマイシン ( 遺伝子組換え ) ベスポンサ点滴静注用 1mg ベンラリズマブ ( 遺伝子組換え ) ファセンラ皮下注 30mg シリンジ ブレクスピプラゾール レキサルティ錠 1mg, 同錠 2mg アテゾリズマブ ( 遺伝子組換え ) テセントリク点滴静注 1,200mg ロミデプシン イストダックス点滴静注用 10mg バロキサビルマルボキシル ゾフルーザ錠 10mg, 同錠 20mg グラクソ スミスクライン ( 株 ) ブリストル マイヤーズスクイブ ( 株 ) 小野薬品工業 ( 株 ) グラクソ スミスクライン ( 株 ) ファイザー ( 株 ) 中外製薬 ( 株 ) ヤンセンファーマ ( 株 ) 協和発酵キリン ( 株 ) 第一三共プロファーマ ( 株 ) ヤンセンファーマ ( 株 ) MSD( 株 ) サノフィ ( 株 ) EA ファーマ ( 株 ) アストラゼネカ ( 株 ) ファイザー ( 株 ) アストラゼネカ ( 株 ) 大塚製薬 ( 株 ) 中外製薬 ( 株 ) セルジーン ( 株 ) 塩野義製薬 ( 株 ) 平成 30 年 5 月 25 日平成 30 年 5 月 25 日平成 30 年 5 月 25 日平成 30 年 5 月 25 日平成 30 年 5 月 25 日平成 30 年 5 月 22 日平成 30 年 5 月 22 日平成 30 年 5 月 22 日平成 30 年 5 月 16 日平成 30 年 5 月 8 日平成 30 年 4 月 23 日平成 30 年 4 月 23 日平成 30 年 4 月 19 日平成 30 年 4 月 18 日平成 30 年 4 月 18 日平成 30 年 4 月 18 日平成 30 年 4 月 18 日平成 30 年 4 月 18 日平成 30 年 4 月 18 日平成 30 年 3 月 14 日 *1: 根治切除不能又は転移性の腎細胞癌 *2: 既存治療で効果不十分な全身型若年性特発性関節炎 *3: がん化学療法歴のあるBRCA 遺伝子変異陽性かつHER2 陰性の手術不能又は再発乳癌 *4: 既存治療で効果不十分な好酸球性多発血管炎性肉芽腫症 *5: 痙攣性発声障害 *6: 中等症から重症の潰瘍性大腸炎の寛解導入及び維持療法 ( 既存治療で効果不十分な場合に限る ) 2018 年 10 月 -28- 医薬品 医療機器等安全性情報 No.357
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
Microsoft Word - 日薬連宛抗インフル薬通知(写).doc
 薬生安発 0821 第 1 号 平成 3 0 年 8 月 2 1 日 日本製薬団体連合会 安全性委員会委員長 殿 厚生労働省医薬 生活衛生局医薬安全対策課長 抗インフルエンザウイルス薬の 使用上の注意 の改訂について 平成 30 年度第 1 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会 ( 平成 30 年 5 月 16 日開催 ) 及び平成 30 年度第 4 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会
薬生安発 0821 第 1 号 平成 3 0 年 8 月 2 1 日 日本製薬団体連合会 安全性委員会委員長 殿 厚生労働省医薬 生活衛生局医薬安全対策課長 抗インフルエンザウイルス薬の 使用上の注意 の改訂について 平成 30 年度第 1 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会 ( 平成 30 年 5 月 16 日開催 ) 及び平成 30 年度第 4 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
2 抗インフルエンザウイルス薬と異常行動の議論と今後の予定 平成 21 年に取りまとめられた報告書以降の知見を改めて報告書にまとめ 以下の議論がなされた 平成 21 年以降の非臨床研究及び 10 年に及ぶ疫学研究の科学的な知見を総括し 以下の事実から タミフル服用のみに異常行動と明確な因果関係がある
 抗インフルエンザウイルス薬の安全対策について 資料 1-7-1 平成 30 年 8 月 3 日医薬安全対策課 1 経緯 平成 19 年 タミフル を服用した中学生の転落死 2 例が大きく報道 タミフル服用と異常行動との因果関係は不明だが 異常行動の発現のおそれを医療機関へ注意喚起 併せて 予防的措置として 10 代患者の原則使用差し控え措置を実施 ( 添付文書の警告欄に追記 ) 当時 タミフルの他
抗インフルエンザウイルス薬の安全対策について 資料 1-7-1 平成 30 年 8 月 3 日医薬安全対策課 1 経緯 平成 19 年 タミフル を服用した中学生の転落死 2 例が大きく報道 タミフル服用と異常行動との因果関係は不明だが 異常行動の発現のおそれを医療機関へ注意喚起 併せて 予防的措置として 10 代患者の原則使用差し控え措置を実施 ( 添付文書の警告欄に追記 ) 当時 タミフルの他
厚生労働省医薬 生活衛生局 情報の概要 355 No. 医薬品等対策情報の概要頁 1 免疫抑制剤の妊婦等に関する禁忌の見直しについて 厚生労働省では, 平成 17 年 10 月から国立成育医療研究センターに 妊娠と薬情報センター を設置し, 相談業務及び調査業務を実施しており, 平成 28 年から集
 355 1. 免疫抑制剤の妊婦等に関する禁忌の見直しについて 3 2. 市販直後調査の対象品目一覧 7 ( 参考資料 )GPSP 省令の改正と製造販売後調査等について 9 この医薬品 医療機器等安全性情報は, 厚生労働省において収集された副作用等の情報を基に, 医薬品 医療機器等のより安全な使用に役立てていただくために, 医療関係者に対して情報提供されるものです 医薬品 医療機器等安全性情報は, 独立行政法人医薬品医療機器総合機構ホームページ
355 1. 免疫抑制剤の妊婦等に関する禁忌の見直しについて 3 2. 市販直後調査の対象品目一覧 7 ( 参考資料 )GPSP 省令の改正と製造販売後調査等について 9 この医薬品 医療機器等安全性情報は, 厚生労働省において収集された副作用等の情報を基に, 医薬品 医療機器等のより安全な使用に役立てていただくために, 医療関係者に対して情報提供されるものです 医薬品 医療機器等安全性情報は, 独立行政法人医薬品医療機器総合機構ホームページ
Microsoft Word - 薬食安発1128第9号
 薬食安発 1128 第 9 号 各都道府県衛生主幹部 ( 局 ) 長殿 ( 公印省略 ) 抗インフルエンザウイルス薬の使用上の注意に関する注意喚起の徹底 について 抗インフルエンザウイルス薬投与後の異常行動の発現につきまして 平成 26 年 10 月 29 日に開催された薬事 食品衛生審議会医薬品等安全対策部会安全対策調査会において 新たに得られた情報も踏まえ評価され これまでと同様の注意喚起を引き続き徹底することが適当とされました
薬食安発 1128 第 9 号 各都道府県衛生主幹部 ( 局 ) 長殿 ( 公印省略 ) 抗インフルエンザウイルス薬の使用上の注意に関する注意喚起の徹底 について 抗インフルエンザウイルス薬投与後の異常行動の発現につきまして 平成 26 年 10 月 29 日に開催された薬事 食品衛生審議会医薬品等安全対策部会安全対策調査会において 新たに得られた情報も踏まえ評価され これまでと同様の注意喚起を引き続き徹底することが適当とされました
改訂の理由及び調査の結果直近 3 年度の国内副作用症例の集積状況 転帰死亡症例 アモキシシリン水和物及びクラブラン酸カリウム アモキシシリン水和物の国内症例が集積したことから 専門委員の意見も踏まえた調査の結果 改訂することが適切と判断した 血小板減少関連症例 1 アモキシシリン水和物 3 例 (
 アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
Microsoft Word - 案1 (写).docx
 薬生安発 1118 第 8 号 都道府県 各保健所設置市衛生主管部 ( 局 ) 長殿 特別区 抗インフルエンザウイルス薬の使用上の注意に関する注意喚起の徹底について 抗インフルエンザウイルス薬投与後の異常行動の発現につきまして 本年 11 月 4 日に開催された薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会において 新たに得られた情報も踏まえ評価され これまでと同様の注意喚起を引き続き徹底することが適当とされました
薬生安発 1118 第 8 号 都道府県 各保健所設置市衛生主管部 ( 局 ) 長殿 特別区 抗インフルエンザウイルス薬の使用上の注意に関する注意喚起の徹底について 抗インフルエンザウイルス薬投与後の異常行動の発現につきまして 本年 11 月 4 日に開催された薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会において 新たに得られた情報も踏まえ評価され これまでと同様の注意喚起を引き続き徹底することが適当とされました
審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7
![審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7 審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7](/thumbs/92/110490968.jpg) 審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
301128_課_薬生薬審発1128第1号_ニボルマブ(遺伝子組換え)製剤の最適使用推進ガイドラインの一部改正について
 薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
Microsoft Word - 案9公益社団法人日本医師会長 .docx
 都道府県医師会長 日医発第 959 号 ( 法安 119) 平成 28 年 12 月 5 日 日本医師会 会長横倉義武 抗インフルエンザウイルス薬の使用上の注意に関する注意喚起の徹底について 今般 抗インフルエンザウイルス薬投与後の異常行動の発現について 平成 28 年 11 月 4 日に開催された薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会において新たに得られた情報も踏まえて評価した結果
都道府県医師会長 日医発第 959 号 ( 法安 119) 平成 28 年 12 月 5 日 日本医師会 会長横倉義武 抗インフルエンザウイルス薬の使用上の注意に関する注意喚起の徹底について 今般 抗インフルエンザウイルス薬投与後の異常行動の発現について 平成 28 年 11 月 4 日に開催された薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会において新たに得られた情報も踏まえて評価した結果
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
< F2D C D838A8BDB92CA926D2E6A7464>
 保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
Microsoft Word - LIA RMP_概要ver2.docx
 リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
(事務連絡)公知申請に係る前倒し保険適用通知
 保医発 0425 第 1 号 平成 30 年 4 月 25 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において
保医発 0425 第 1 号 平成 30 年 4 月 25 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において
Press Release 平成 29 年 11 月 27 日 照会先 医薬 生活衛生局医薬安全対策課安全使用推進室長江野英夫 ( 内線 :2755) 課長補佐大井恒宏 ( 内線 :2748) ( 代表 )03(5253)1111 ( 直通 )03(3595)2435 報道関係者各位 小児 未成年者
 Press Release 平成 29 年 11 月 27 日 照会先 医薬 生活衛生局医薬安全対策課安全使用推進室長江野英夫 ( 内線 :2755) 課長補佐大井恒宏 ( 内線 :2748) ( 代表 )03(5253)1111 ( 直通 )03(3595)2435 報道関係者各位 小児 未成年者がインフルエンザにかかった時は 異常行動にご注意下さい インフルエンザにかかった時には 抗インフルエンザウイルス薬の種類や服用の有
Press Release 平成 29 年 11 月 27 日 照会先 医薬 生活衛生局医薬安全対策課安全使用推進室長江野英夫 ( 内線 :2755) 課長補佐大井恒宏 ( 内線 :2748) ( 代表 )03(5253)1111 ( 直通 )03(3595)2435 報道関係者各位 小児 未成年者がインフルエンザにかかった時は 異常行動にご注意下さい インフルエンザにかかった時には 抗インフルエンザウイルス薬の種類や服用の有
から (3) までの具体的な予定については添付 2 の図のとおりですので申し添 えます
 薬生安発 0704 第 2 号 平成 29 年 7 月 4 日 ( 別記 1) 殿 厚生労働省医薬 生活衛生局安全対策課長 コデインリン酸塩水和物又はジヒドロコデインリン酸塩を含む医薬品の 使用上の注意 改訂の周知について ( 依頼 ) 平素より医薬品の適正使用 安全対策にご協力いただき誠にありがとうございます 今般 コデインリン酸塩水和物又はジヒドロコデインリン酸塩 ( 以下 コデイン類 という
薬生安発 0704 第 2 号 平成 29 年 7 月 4 日 ( 別記 1) 殿 厚生労働省医薬 生活衛生局安全対策課長 コデインリン酸塩水和物又はジヒドロコデインリン酸塩を含む医薬品の 使用上の注意 改訂の周知について ( 依頼 ) 平素より医薬品の適正使用 安全対策にご協力いただき誠にありがとうございます 今般 コデインリン酸塩水和物又はジヒドロコデインリン酸塩 ( 以下 コデイン類 という
日医発第437(法安23)
 都道府県医師会長殿 日医発第 853 号 ( 法安 132) 平成 29 年 12 月 7 日 日本医師会会長横倉義武 抗インフルエンザウイルス薬の使用上の注意に関する注意喚起の徹底について 抗インフルエンザウイルス薬投与後の異常行動の発現につきましては 本年 11 月 9 日に開催された薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会において 新たに得られた情報も踏まえ評価され 引き続き
都道府県医師会長殿 日医発第 853 号 ( 法安 132) 平成 29 年 12 月 7 日 日本医師会会長横倉義武 抗インフルエンザウイルス薬の使用上の注意に関する注意喚起の徹底について 抗インフルエンザウイルス薬投与後の異常行動の発現につきましては 本年 11 月 9 日に開催された薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会において 新たに得られた情報も踏まえ評価され 引き続き
<4D F736F F D208D B B835896F2938A975E82CC8D6C82A695FB2E646F63>
 事務連絡平成 21 年 5 月 28 日 都道府県 各 保健所設置市 衛生主管部 ( 局 ) 特別区 感染症対策担当者及び新型インフルエンザ対策担当者殿 厚生労働省新型インフルエンザ対策推進本部事務局 新型インフルエンザの診療等に関する情報 ( 抗インフルエンザ薬の予防投与の考え方等 ) に係る Q&A の送付について 平成 21 年 5 月 3 日付新型インフルエンザ対策推進本部事務連絡 新型インフルエンザの診療等に関する情報
事務連絡平成 21 年 5 月 28 日 都道府県 各 保健所設置市 衛生主管部 ( 局 ) 特別区 感染症対策担当者及び新型インフルエンザ対策担当者殿 厚生労働省新型インフルエンザ対策推進本部事務局 新型インフルエンザの診療等に関する情報 ( 抗インフルエンザ薬の予防投与の考え方等 ) に係る Q&A の送付について 平成 21 年 5 月 3 日付新型インフルエンザ対策推進本部事務連絡 新型インフルエンザの診療等に関する情報
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
Microsoft Word - 奈良県GQP-GVPガイドライン doc
 三. 安全確保措置の実施に関する手順 1. 目的安全確保措置の実施に関する手順の目的を記載する < 記載例 > 本手順は GVP 省令の第 9 条に基づき 安全確保措置の実施を適正かつ円滑に行うために必要な手順を定めるものである 2. 適用範囲安全確保措置の実施に関する手順の適用範囲を記載する < 記載例 > 本手順書は 二. 安全管理情報の検討及びその結果に基づく安全確保措置の立案に関する手順 で立案された安全確保措置の決定
三. 安全確保措置の実施に関する手順 1. 目的安全確保措置の実施に関する手順の目的を記載する < 記載例 > 本手順は GVP 省令の第 9 条に基づき 安全確保措置の実施を適正かつ円滑に行うために必要な手順を定めるものである 2. 適用範囲安全確保措置の実施に関する手順の適用範囲を記載する < 記載例 > 本手順書は 二. 安全管理情報の検討及びその結果に基づく安全確保措置の立案に関する手順 で立案された安全確保措置の決定
審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]
![審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ] 審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]](/thumbs/91/105024304.jpg) 審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
Microsoft Word - 2-① 補償ガイドライン平成27年版(本文)Ver3.1.1.do
 1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
1. 総則 被験者の健康被害補償に関するガイドライン Ver. 3 Ver. 3. 1 Ver. 3. 1.1 : 2 0 1 5 ( 平成 2 7 ) 年 8 月 1 8 日 : 2 0 1 5 ( 平成 2 7 ) 年 1 2 月 2 1 日 : 2 0 1 6 ( 平成 2 8 ) 年 1 2 月 2 0 日 1-1 本ガイドラインは 医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年厚生省令第
<4D F736F F D2082A8926D82E782B995B68F D815B838B8FF E31312E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
医薬品たるコンビネーション製品の不具合報告等に関する Q&A [ 用いた略語 ] 法 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 施行規則 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則 ( 昭和 36 年
![医薬品たるコンビネーション製品の不具合報告等に関する Q&A [ 用いた略語 ] 法 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 施行規則 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則 ( 昭和 36 年 医薬品たるコンビネーション製品の不具合報告等に関する Q&A [ 用いた略語 ] 法 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和 35 年法律第 145 号 ) 施行規則 : 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律施行規則 ( 昭和 36 年](/thumbs/91/107149459.jpg) 事務連絡 平成 29 年 6 月 9 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬 生活衛生局安全対策課 コンビネーション製品の副作用等報告に関する Q&A について の改訂について コンビネーション製品の副作用等報告に関するQ&Aについては コンビネーション製品の副作用等報告に関するQ&Aについて ( 平成 26 年 10 月 31 日付け厚生労働省医薬食品局安全対策課事務連絡
事務連絡 平成 29 年 6 月 9 日 各都道府県衛生主管部 ( 局 ) 薬務主管課御中 厚生労働省医薬 生活衛生局安全対策課 コンビネーション製品の副作用等報告に関する Q&A について の改訂について コンビネーション製品の副作用等報告に関するQ&Aについては コンビネーション製品の副作用等報告に関するQ&Aについて ( 平成 26 年 10 月 31 日付け厚生労働省医薬食品局安全対策課事務連絡
<4D F736F F D2082A8926D82E782B995B68F C D815B838B43505F4F E31302E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
Microsoft PowerPoint - 【配布資料】28予防接種従事者研修
 予防接種制度の概要について 3 目的 伝染のおそれがある疾病の発生及びまん延を予防するために公衆衛生の見地から予防接種の実施その他必要な措置を講ずることにより 国民の健康の保持に寄与する 予防接種による健康被害の迅速な救済を図る 予防接種の実施 予防接種法の概要 ( その 1) 対象疾病 A 類疾病 ( 主に集団予防 重篤な疾患の予防に重点 本人に努力義務 接種勧奨有り ) ジフテリア 百日せき 急性灰白髄炎
予防接種制度の概要について 3 目的 伝染のおそれがある疾病の発生及びまん延を予防するために公衆衛生の見地から予防接種の実施その他必要な措置を講ずることにより 国民の健康の保持に寄与する 予防接種による健康被害の迅速な救済を図る 予防接種の実施 予防接種法の概要 ( その 1) 対象疾病 A 類疾病 ( 主に集団予防 重篤な疾患の予防に重点 本人に努力義務 接種勧奨有り ) ジフテリア 百日せき 急性灰白髄炎
< F2D CF6926D905C90BF82C98C5782E992CA926D88C4>
 保医発 1031 第 1 号平成 24 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において 別添 1の7
保医発 1031 第 1 号平成 24 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において 別添 1の7
301226更新 (薬局)平成29 年度に実施した個別指導指摘事項(溶け込み)
 平成 29 年度に実施した個別指導において保険薬局に改善を求めた主な指摘事項 東海北陸厚生局 目次 Ⅰ 調剤全般に関する事項 1 処方せんの取扱い 1 2 処方内容に関する薬学的確認 1 3 調剤 1 4 調剤済処方せんの取扱い 1 5 調剤録等の取扱い 2 Ⅱ 調剤技術料に関する事項 1 調剤料 2 2 一包化加算 2 3 自家製剤加算 2 Ⅲ 薬剤管理料に関する事項 1 薬剤服用歴管理指導料 2
平成 29 年度に実施した個別指導において保険薬局に改善を求めた主な指摘事項 東海北陸厚生局 目次 Ⅰ 調剤全般に関する事項 1 処方せんの取扱い 1 2 処方内容に関する薬学的確認 1 3 調剤 1 4 調剤済処方せんの取扱い 1 5 調剤録等の取扱い 2 Ⅱ 調剤技術料に関する事項 1 調剤料 2 2 一包化加算 2 3 自家製剤加算 2 Ⅲ 薬剤管理料に関する事項 1 薬剤服用歴管理指導料 2
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能
 医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
診療科 17 診療科 病床数 494 床 (ICU3 床 HCU5 床 無菌病室 1 床含む ) 病棟数 9 病棟 ( 一般病棟入院基本料 7:1) 外来患者数 1302 人 / 日 入院患者 437 人 / 日 地域がん診療連携拠点病院 病院機能評価認定病院 (Ver5.0) 平成 22 年度実績
 副作用被害救済制度への薬剤師のかかわり JA 札幌厚生病院薬剤部谷口亮央 診療科 17 診療科 病床数 494 床 (ICU3 床 HCU5 床 無菌病室 1 床含む ) 病棟数 9 病棟 ( 一般病棟入院基本料 7:1) 外来患者数 1302 人 / 日 入院患者 437 人 / 日 地域がん診療連携拠点病院 病院機能評価認定病院 (Ver5.0) 平成 22 年度実績 副作用発現時の対応方法 当院における副作用発現時の流れについて
副作用被害救済制度への薬剤師のかかわり JA 札幌厚生病院薬剤部谷口亮央 診療科 17 診療科 病床数 494 床 (ICU3 床 HCU5 床 無菌病室 1 床含む ) 病棟数 9 病棟 ( 一般病棟入院基本料 7:1) 外来患者数 1302 人 / 日 入院患者 437 人 / 日 地域がん診療連携拠点病院 病院機能評価認定病院 (Ver5.0) 平成 22 年度実績 副作用発現時の対応方法 当院における副作用発現時の流れについて
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり
![食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり 食欲不振 全身倦怠感 皮膚や白目が黄色くなる [ 肝機能障害 黄疸 ] 尿量減少 全身のむくみ 倦怠感 [ 急性腎不全 ] 激しい上腹部の痛み 腰背部の痛み 吐き気 [ 急性膵炎 ] 発熱 から咳 呼吸困難 [ 間質性肺炎 ] 排便の停止 腹痛 腹部膨満感 [ 腸閉塞 ] 手足の筋肉の痛み こわばり](/thumbs/91/105740782.jpg) くすりのしおり内服剤 2013 年 11 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : グラクティブ錠 12.5mg 主成分 : シタグリプチンリン酸塩水和物 (Sitagliptin phosphate hydrate) 剤形
くすりのしおり内服剤 2013 年 11 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : グラクティブ錠 12.5mg 主成分 : シタグリプチンリン酸塩水和物 (Sitagliptin phosphate hydrate) 剤形
日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI 関連の企業などはありません
 医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全性検討事項 重要な特定されたリスク 頁 重要な潜在
 アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開
![審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開 審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開](/thumbs/53/31072016.jpg) 審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
より詳細な情報を望まれる場合は 担当の医師または薬剤師におたずねください また 患者向医薬品ガイド 医療専門家向けの 添付文書情報 が医薬品医療機器総合機構のホームページに掲載されています
 くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
④資料2ー2
 平成 30 年 7 月 5 日第 4 回医薬品医療機器制度部会資料 2-2 平成 30 年 7 月 5 日 第 4 回厚生科学審議会医薬品医療機器制度部会提出資料 薬剤師 薬局による取り組み ( 事例 ) 公益社団法人日本薬剤師会 Japan Pharmaceutical Association All Rights Reserved. 1 1. 患者に適した薬剤への処方変更につなげたケース ケース小児患者インフルエンザの疑いで診療所を受診抗インフルエンザ吸入薬
平成 30 年 7 月 5 日第 4 回医薬品医療機器制度部会資料 2-2 平成 30 年 7 月 5 日 第 4 回厚生科学審議会医薬品医療機器制度部会提出資料 薬剤師 薬局による取り組み ( 事例 ) 公益社団法人日本薬剤師会 Japan Pharmaceutical Association All Rights Reserved. 1 1. 患者に適した薬剤への処方変更につなげたケース ケース小児患者インフルエンザの疑いで診療所を受診抗インフルエンザ吸入薬
Microsoft Word _ソリリス点滴静注300mg 同意説明文書 aHUS-ICF-1712.docx
 患者様同意説明文書 非典型溶血性尿毒症症候群 (ahus) ソリリスの投与開始前に 医師または医療従事者から ソリリスを投与される方へ (ahus) 及び 患者安全性カード に従ってこの薬の安全性 有効性の説明 髄膜炎菌ワクチン等の接種の必要性及び患者様のデータの取扱いの説明を十分に理解できるまで受け さらにこの 患者様同意説明文書 の記載に従ってご確認ください 担当医師または医療従事者は 患者様にこの薬を投与する場合
患者様同意説明文書 非典型溶血性尿毒症症候群 (ahus) ソリリスの投与開始前に 医師または医療従事者から ソリリスを投与される方へ (ahus) 及び 患者安全性カード に従ってこの薬の安全性 有効性の説明 髄膜炎菌ワクチン等の接種の必要性及び患者様のデータの取扱いの説明を十分に理解できるまで受け さらにこの 患者様同意説明文書 の記載に従ってご確認ください 担当医師または医療従事者は 患者様にこの薬を投与する場合
01-02(先-1)(別紙1-1)血清TARC迅速測定法を用いた重症薬疹の早期診断
 様式第 5 号 先 - 1 29.12.7 先進医療の内容 ( 概要 ) 別紙 1-1 先進医療の名称 : 血清 TARC 迅速測定法を用いた重症薬疹の早期診断適応症 : 重症あるいは重症化の可能性があると判断した汎発型皮疹の患者で かつ薬疹が疑われるもの 1 先進性 重症薬疹として知られている Stevens-Johnson 症候群 (SJS), 中毒性表皮壊死症 (TEN) は死亡率が高く なかでも
様式第 5 号 先 - 1 29.12.7 先進医療の内容 ( 概要 ) 別紙 1-1 先進医療の名称 : 血清 TARC 迅速測定法を用いた重症薬疹の早期診断適応症 : 重症あるいは重症化の可能性があると判断した汎発型皮疹の患者で かつ薬疹が疑われるもの 1 先進性 重症薬疹として知られている Stevens-Johnson 症候群 (SJS), 中毒性表皮壊死症 (TEN) は死亡率が高く なかでも
<4D F736F F D DB782B58AB782A6817A5F32342E342E31365F96F28DDC8E7482CC F8BC696B182CC906982DF95FB5F E312E305F2E646F63>
 薬剤師の病棟業務の進め方 (Ver.1.0) 一般社団法人日本病院薬剤師会 平成 24 年 4 月 16 日 1. はじめに 長寿社会の到来 疾病構造の変化や意識の変化に伴い 国民の医療ニーズは高度化 多様化している また 科学技術の進歩により 医療技術も高度化し専門化している 薬剤師の職能も大きく拡大し 薬剤師の活動する場も 病棟等広範囲にわたるようになり 患者の薬物治療における有効性の担保と安全性の確保
薬剤師の病棟業務の進め方 (Ver.1.0) 一般社団法人日本病院薬剤師会 平成 24 年 4 月 16 日 1. はじめに 長寿社会の到来 疾病構造の変化や意識の変化に伴い 国民の医療ニーズは高度化 多様化している また 科学技術の進歩により 医療技術も高度化し専門化している 薬剤師の職能も大きく拡大し 薬剤師の活動する場も 病棟等広範囲にわたるようになり 患者の薬物治療における有効性の担保と安全性の確保
改訂後 ⑴ 依存性連用により薬物依存を生じることがあるので 観察を十分に行い 用量及び使用期間に注意し慎重に投与すること また 連用中における投与量の急激な減少ないし投与の中止により 痙攣発作 せん妄 振戦 不眠 不安 幻覚 妄想等の離脱症状があらわれることがあるので 投与を中止する場合には 徐々に
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ ETIZOLAM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること 注 1) 注意 - 習慣性あり注 2) 注意 - 医師等の処方箋により使用すること 向精神薬 習慣性医薬品注 1) 注 2) 処方箋医薬品 注 1) 注意 - 習慣性あり注 2) 注意 - 医師等の処方箋により使用すること 2017
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ ETIZOLAM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること 注 1) 注意 - 習慣性あり注 2) 注意 - 医師等の処方箋により使用すること 向精神薬 習慣性医薬品注 1) 注 2) 処方箋医薬品 注 1) 注意 - 習慣性あり注 2) 注意 - 医師等の処方箋により使用すること 2017
医療費 医療手当を請求することができる方 昭和 55 年 5 月 1 日以後に医薬品を適正に使用したにもかかわらず その医薬品の副作用 によるものとみられる疾病 ( 入院治療を必要とする程度 ) について医療を受けた方は医療費 と医療手当を請求することができます 請求の手続 医療費 医療手当を請求し
 副作用救済給付用 医療費 医療手当 請求の手引き 独立行政法人医薬品医療機器総合機構 医療費 医療手当を請求することができる方 昭和 55 年 5 月 1 日以後に医薬品を適正に使用したにもかかわらず その医薬品の副作用 によるものとみられる疾病 ( 入院治療を必要とする程度 ) について医療を受けた方は医療費 と医療手当を請求することができます 請求の手続 医療費 医療手当を請求しようとする方は
副作用救済給付用 医療費 医療手当 請求の手引き 独立行政法人医薬品医療機器総合機構 医療費 医療手当を請求することができる方 昭和 55 年 5 月 1 日以後に医薬品を適正に使用したにもかかわらず その医薬品の副作用 によるものとみられる疾病 ( 入院治療を必要とする程度 ) について医療を受けた方は医療費 と医療手当を請求することができます 請求の手続 医療費 医療手当を請求しようとする方は
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
スライド 0
 Drug Safety Information 使用上の注意の改訂指示 年月日 2013 年 7 月 9 日 販売名 ( 承認取得者 ) インヴェガ錠 3mg 同錠 6mg 同錠 9mg( ヤンセンファーマ ) 成分名 パリペリドン 効能 効果 統合失調症 改訂の概要 類薬 ( リスペリドン ) における重大な副作用 の項に記載のある 麻痺性イレウス を削除し 重大な副作用 の項に 麻痺性イレ ウス
Drug Safety Information 使用上の注意の改訂指示 年月日 2013 年 7 月 9 日 販売名 ( 承認取得者 ) インヴェガ錠 3mg 同錠 6mg 同錠 9mg( ヤンセンファーマ ) 成分名 パリペリドン 効能 効果 統合失調症 改訂の概要 類薬 ( リスペリドン ) における重大な副作用 の項に記載のある 麻痺性イレウス を削除し 重大な副作用 の項に 麻痺性イレ ウス
 医薬品の使用上の注意の改訂について ( 平成 14 年 6 月 5 日 ) ( 医薬安発第 0605002 号 ) ( 各都道府県衛生主管部 ( 局 ) 長あて厚生労働省医薬局安全対策課長通知 ) 医薬品の安全対策については 日頃よりご尽力いただいているところでありますが 今般 別添のとおり日本製薬団体連合会安全性委員会委員長あて通知及び連絡したので ご承知願います 医薬品の使用上の注意の改訂について
医薬品の使用上の注意の改訂について ( 平成 14 年 6 月 5 日 ) ( 医薬安発第 0605002 号 ) ( 各都道府県衛生主管部 ( 局 ) 長あて厚生労働省医薬局安全対策課長通知 ) 医薬品の安全対策については 日頃よりご尽力いただいているところでありますが 今般 別添のとおり日本製薬団体連合会安全性委員会委員長あて通知及び連絡したので ご承知願います 医薬品の使用上の注意の改訂について
Microsoft Word - オーソ_201302_Final.docx
 医薬品の適正使用に欠かせない情報です 必ずお読みください H24-11 平成 25 年 2 月 / ( ノルエチステロン エチニルエストラジオール錠 ) 使用上の注意改訂のご案内 製造販売元ヤンセンファーマ株式会社 / 発売元持田製薬株式会社 この度 オーソ 777-21 錠 / オーソ M-21 錠の 使用上の注意 を改訂致しましたので ご案内申し上げます 今後のご使用に際しましては 下記内容にご留意くださいますようお願い致します
医薬品の適正使用に欠かせない情報です 必ずお読みください H24-11 平成 25 年 2 月 / ( ノルエチステロン エチニルエストラジオール錠 ) 使用上の注意改訂のご案内 製造販売元ヤンセンファーマ株式会社 / 発売元持田製薬株式会社 この度 オーソ 777-21 錠 / オーソ M-21 錠の 使用上の注意 を改訂致しましたので ご案内申し上げます 今後のご使用に際しましては 下記内容にご留意くださいますようお願い致します
資料 2-4 イソプロピルアンチピリン製剤の安全対策について 平成 23 年 6 月 23 日平成 23 年度薬事 食品衛生審議会医薬品等安全対策部会安全対策調査会 ( 第 2 回 ) 1. イソプロピルアンチピリン製剤の安全性に係る調査結果報告書 ( 別紙 ) 1 ページ
 資料 2-4 イソプロピルアンチピリン製剤の安全対策について 平成 23 年 6 月 23 日平成 23 年度薬事 食品衛生審議会医薬品等安全対策部会安全対策調査会 ( 第 2 回 ) 1. イソプロピルアンチピリン製剤の安全性に係る調査結果報告書 ( 別紙 ) 1 ページ 別紙 調査結果報告書 平成 23 年 6 月 13 日 独立行政法人医薬品医療機器総合機構 I. 品目の概要 [ 販売名 ]
資料 2-4 イソプロピルアンチピリン製剤の安全対策について 平成 23 年 6 月 23 日平成 23 年度薬事 食品衛生審議会医薬品等安全対策部会安全対策調査会 ( 第 2 回 ) 1. イソプロピルアンチピリン製剤の安全性に係る調査結果報告書 ( 別紙 ) 1 ページ 別紙 調査結果報告書 平成 23 年 6 月 13 日 独立行政法人医薬品医療機器総合機構 I. 品目の概要 [ 販売名 ]
( 注意 ) 1 用紙の規格は 日本工業規格 A 列 4 番とする 2 1~3 の欄は 申請に係る疾病について医療を受けた者の氏名 性別 生 現住所及び電話番号を記入する 3 4~11 の欄は PMDA( 独立行政法人医薬品医療機器総合機構 ) から障害児養育年金 障害年金の認定において疾病に係る医
 様式第 1 号 1 ふりがな氏名 救済給付申請書 (PMDA 既請求分 ) 男 女 2 生 年 月 日 3 現住所電話番号 電話番号 ( 自宅 ) ( 携帯 ) PMDA から障害児養育年金 障害年金の認定において疾病に係る医療の期間が示されている方のみ 4~11 も記入 4 世帯主氏名 5 受けた予防接種の種類 7 医療保険等の種類 9 医療を受けた医療機関の名称及び所在地 健保 国保その他 6
様式第 1 号 1 ふりがな氏名 救済給付申請書 (PMDA 既請求分 ) 男 女 2 生 年 月 日 3 現住所電話番号 電話番号 ( 自宅 ) ( 携帯 ) PMDA から障害児養育年金 障害年金の認定において疾病に係る医療の期間が示されている方のみ 4~11 も記入 4 世帯主氏名 5 受けた予防接種の種類 7 医療保険等の種類 9 医療を受けた医療機関の名称及び所在地 健保 国保その他 6
一について第一に 感染症の予防及び感染症の患者に対する医療に関する法律(平成十年法律第百十四号 以下 感染症法 という )第十二条の規定に基づき 後天性免疫不全症候群(以下 エイズという )の患者及びその病原体を保有している者であって無症状のもの(以下 HIV感染者 という )(以下 エイズの患者等
 平成十一年八月十日受領答弁第三七号衆議院議員家西悟君提出血液製剤による感染被害の救済に関する質問に対し 別紙答弁書を送付する 内閣衆質一四五第三七号平成十一年八月十日衆議院議長伊宗一郎殿内閣総理大臣小渕恵三 一について第一に 感染症の予防及び感染症の患者に対する医療に関する法律(平成十年法律第百十四号 以下 感染症法 という )第十二条の規定に基づき 後天性免疫不全症候群(以下 エイズという )の患者及びその病原体を保有している者であって無症状のもの(以下
平成十一年八月十日受領答弁第三七号衆議院議員家西悟君提出血液製剤による感染被害の救済に関する質問に対し 別紙答弁書を送付する 内閣衆質一四五第三七号平成十一年八月十日衆議院議長伊宗一郎殿内閣総理大臣小渕恵三 一について第一に 感染症の予防及び感染症の患者に対する医療に関する法律(平成十年法律第百十四号 以下 感染症法 という )第十二条の規定に基づき 後天性免疫不全症候群(以下 エイズという )の患者及びその病原体を保有している者であって無症状のもの(以下
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
インフルエンザ定点以外の医療機関用 ( 別記様式 1) インフルエンザに伴う異常な行動に関する調査のお願い インフルエンザ定点以外の医療機関用 インフルエンザ様疾患罹患時及び抗インフルエンザ薬使用時に見られた異常な行動が 医学的にも社会的にも問題になっており 2007 年より調査をお願いしております
 ( 別記様式 1) インフルエンザに伴う異常な行動に関する調査のお願い インフルエンザ様疾患罹患時及び抗インフルエンザ薬使用時に見られた異常な行動が 医学的にも社会的にも問題になっており 2007 年より調査をお願いしております 厚生労働省では 引き続き その背景に関する実態把握をいたしたく 川崎市健康安全研究所により研究を行うこととしておりますので 以下のとおり 当該研究にかかる調査へのご協力をお願いします
( 別記様式 1) インフルエンザに伴う異常な行動に関する調査のお願い インフルエンザ様疾患罹患時及び抗インフルエンザ薬使用時に見られた異常な行動が 医学的にも社会的にも問題になっており 2007 年より調査をお願いしております 厚生労働省では 引き続き その背景に関する実態把握をいたしたく 川崎市健康安全研究所により研究を行うこととしておりますので 以下のとおり 当該研究にかかる調査へのご協力をお願いします
を追加する (2) 実施要領通知の報告様式別紙 1 医薬品安全性情報報告書 及び同報告様式別紙 2 医療機器安全性情報報告書 を別添のとおり変更する
 薬食発 0311 第 1 号平成 25 年 3 月 11 日 各都道府県知事殿 厚生労働省医薬食品局長 医薬品 医療機器等安全性情報報告制度 の報告における電子メールの活用について 薬事法 ( 昭和 35 年法律第 145 号 以下 法 という ) 第 77 条の 4 の 2 第 2 項の規定に基づく 医療機関等からの医薬品又は医療機器についての副作用 感染症及び不具合報告 ( 以下 副作用等報告
薬食発 0311 第 1 号平成 25 年 3 月 11 日 各都道府県知事殿 厚生労働省医薬食品局長 医薬品 医療機器等安全性情報報告制度 の報告における電子メールの活用について 薬事法 ( 昭和 35 年法律第 145 号 以下 法 という ) 第 77 条の 4 の 2 第 2 項の規定に基づく 医療機関等からの医薬品又は医療機器についての副作用 感染症及び不具合報告 ( 以下 副作用等報告
厚生労働省告示024号/平成22年1月22日告示/平成22年1月22日施行
 厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
( 別添 ) 御意見 該当箇所 一般用医薬品のリスク区分 ( 案 ) のうち イブプロフェン ( 高用量 )(No.4) について 意見内容 <イブプロフェン ( 高用量 )> 本剤は 低用量製剤 ( 最大 400mg/ 日 ) と比べても製造販売後調査では重篤な副作用の報告等はない 一方で 今まで
 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第三十六条の七第一項第一号及び第二号の規定に基づき厚生労働大臣が指定する第一類医薬品及び第二類医薬品 の一部改正に係る意見の募集について に対して寄せられた御意見について 厚生労働省医薬 生活衛生局安全対策課 1. 意見募集期間 : 平成 28 年 6 月 3 日 ( 金 ) から平成 28 年 7 月 2 日 ( 土 ) まで 2. 提出意見数
医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律第三十六条の七第一項第一号及び第二号の規定に基づき厚生労働大臣が指定する第一類医薬品及び第二類医薬品 の一部改正に係る意見の募集について に対して寄せられた御意見について 厚生労働省医薬 生活衛生局安全対策課 1. 意見募集期間 : 平成 28 年 6 月 3 日 ( 金 ) から平成 28 年 7 月 2 日 ( 土 ) まで 2. 提出意見数
( Drug Information News )
 (Drug Information News) NO.406 2018 年 10 月 徳山医師会病院薬局 TEL:0834-31-7716 FAX:0834-32-5349 e-mail:yaku2@tokuyamaishikai.com 薬局ウェフ サイト http://hospital.tokuyamaishikai.com/introduce_list/ より 薬局 をクリック 今回より DI
(Drug Information News) NO.406 2018 年 10 月 徳山医師会病院薬局 TEL:0834-31-7716 FAX:0834-32-5349 e-mail:yaku2@tokuyamaishikai.com 薬局ウェフ サイト http://hospital.tokuyamaishikai.com/introduce_list/ より 薬局 をクリック 今回より DI
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
6. 引用文献 参考資料 1) 日本臨床腫瘍学会. 腫瘍崩壊症候群 (TLS) 診療ガイダンス. 金原出版 ) Cairo, M. S., et al. Tumour lysis syndrome: new therapeutic strategies and classificat
 6. 引用文献 参考資料 1) 日本臨床腫瘍学会. 腫瘍崩壊症候群 (TLS) 診療ガイダンス. 金原出版. 01. ) Cairo, M. S., et al. Tumour lysis syndrome: new therapeutic strategies and classification. British Journal of Haematology, 17(1), 11, 004. )
6. 引用文献 参考資料 1) 日本臨床腫瘍学会. 腫瘍崩壊症候群 (TLS) 診療ガイダンス. 金原出版. 01. ) Cairo, M. S., et al. Tumour lysis syndrome: new therapeutic strategies and classification. British Journal of Haematology, 17(1), 11, 004. )
2. 検討 ~ 医療に関する事故の特殊性など (1) 医師等による医療行為における事故 医師等が患者に対してどのような医療行為を施すべきかという判断は 医師等の医学的な専門知識 技能に加え 医師等の経験 患者の体質 その時の患者の容態 使用可能な医療機器等の設備等に基づきなされるものである ( 個別
 資料 1 消費者安全調査委員会による事故等原因調査等の進め方について ( 議論のたたき台 ) ~ 医療に関する事故の考え方 ~ 1. 前提 消費者安全調査委員会の調査対象医療に関する事故については 消費者安全法に規定する生命又は身体の被害に係る消費者事故等に当たり得ることから その場合は 消費者安全調査委員会が行う事故等原因調査等の対象になる 消費者安全調査委員会の役割生命又は身体の被害に係る消費者事故等の原因を究明し
資料 1 消費者安全調査委員会による事故等原因調査等の進め方について ( 議論のたたき台 ) ~ 医療に関する事故の考え方 ~ 1. 前提 消費者安全調査委員会の調査対象医療に関する事故については 消費者安全法に規定する生命又は身体の被害に係る消費者事故等に当たり得ることから その場合は 消費者安全調査委員会が行う事故等原因調査等の対象になる 消費者安全調査委員会の役割生命又は身体の被害に係る消費者事故等の原因を究明し
都道府県医師会医療安全担当理事殿 ( 法安 56) 平成 27 年 8 月 5 日 日本医師会常任理事今村定臣 酵素電極法を用いた血糖測定に使用する医療機器及び体外診断用医薬品に係る 使用上の注意 の改訂について グルコース分析装置 自己検査用グルコース測定器及び自動分析装置等並びに血液検査用グルコ
 都道府県医師会医療安全担当理事殿 ( 法安 56) 平成 27 年 8 月 5 日 日本医師会常任理事今村定臣 酵素電極法を用いた血糖測定に使用する医療機器及び体外診断用医薬品に係る 使用上の注意 の改訂について グルコース分析装置 自己検査用グルコース測定器及び自動分析装置等並びに血液検査用グルコースキット及び自己検査用グルコースキット ( 測定項目として血糖値を有する医療機器または体外診断用医薬品
都道府県医師会医療安全担当理事殿 ( 法安 56) 平成 27 年 8 月 5 日 日本医師会常任理事今村定臣 酵素電極法を用いた血糖測定に使用する医療機器及び体外診断用医薬品に係る 使用上の注意 の改訂について グルコース分析装置 自己検査用グルコース測定器及び自動分析装置等並びに血液検査用グルコースキット及び自己検査用グルコースキット ( 測定項目として血糖値を有する医療機器または体外診断用医薬品
分類
 高脂血症用剤 MSD= バイエル薬品 アトーゼット配合錠 LD 872189 2189101F1020 アトーゼット配合錠 HD 872189 2189101F2026 エゼチミブ / アトルバスタチンカルシウム水和物 1 錠 177.00 小腸コレステロールトランスポーター阻害剤 / HMG-CoA 還元酵素阻害剤配合剤 1 日 1 回 1 錠を食後に経口投与 1 錠 177.00 高コレステロール血症
高脂血症用剤 MSD= バイエル薬品 アトーゼット配合錠 LD 872189 2189101F1020 アトーゼット配合錠 HD 872189 2189101F2026 エゼチミブ / アトルバスタチンカルシウム水和物 1 錠 177.00 小腸コレステロールトランスポーター阻害剤 / HMG-CoA 還元酵素阻害剤配合剤 1 日 1 回 1 錠を食後に経口投与 1 錠 177.00 高コレステロール血症
アレルギー疾患対策基本法 ( 平成二十六年六月二十七日法律第九十八号 ) 最終改正 : 平成二六年六月一三日法律第六七号 第一章総則 ( 第一条 第十条 ) 第二章アレルギー疾患対策基本指針等 ( 第十一条 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条
 アレルギー疾患対策基本法 ( 平成二十六年六月二十七日法律第九十八号 ) 最終改正 : 平成二六年六月一三日法律第六七号 第一章総則 ( 第一条 第十条 ) 第二章アレルギー疾患対策基本指針等 ( 第十一条 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条 第十五条 ) 第二節アレルギー疾患医療の均てん化の促進等 ( 第十六条 第十七条 ) 第三節アレルギー疾患を有する者の生活の質の維持向上
アレルギー疾患対策基本法 ( 平成二十六年六月二十七日法律第九十八号 ) 最終改正 : 平成二六年六月一三日法律第六七号 第一章総則 ( 第一条 第十条 ) 第二章アレルギー疾患対策基本指針等 ( 第十一条 第十三条 ) 第三章基本的施策第一節アレルギー疾患の重症化の予防及び症状の軽減 ( 第十四条 第十五条 ) 第二節アレルギー疾患医療の均てん化の促進等 ( 第十六条 第十七条 ) 第三節アレルギー疾患を有する者の生活の質の維持向上
2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び
![2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び 2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び](/thumbs/91/105459093.jpg) - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
150800247.indd
 ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
< 追補 > ココデル虎の巻 平成 27 年度版 過去問題集 解説 2016 年 3 月 試験問題作成に関する手引き 正誤表対応 ここでは 2016 年 3 月に発表された正誤表による 手引き 修正で 影響のある過去問の 解説をまとめています 手引き 正誤表で影響のある( あるいは関連する ) 問題
 < 追補 > ココデル虎の巻 平成 27 年度版 過去問題集 解説 2016 年 3 月 試験問題作成に関する手引き 正誤表対応 ここでは 2016 年 3 月に発表された正誤表による 手引き 修正で 影響のある過去問の 解説をまとめています 手引き 正誤表で影響のある( あるいは関連する ) 問題第 2 章 : 問 27 問 30 問 31 問 32 第 4 章 : 問 70 問 71 問 74
< 追補 > ココデル虎の巻 平成 27 年度版 過去問題集 解説 2016 年 3 月 試験問題作成に関する手引き 正誤表対応 ここでは 2016 年 3 月に発表された正誤表による 手引き 修正で 影響のある過去問の 解説をまとめています 手引き 正誤表で影響のある( あるいは関連する ) 問題第 2 章 : 問 27 問 30 問 31 問 32 第 4 章 : 問 70 問 71 問 74
Taro-01_告示(本文)案分
 厚生労働省告示第三百十二号厚生労働大臣が指定する病院の病棟における療養に要する費用の額の算定方法(平成二十年厚生労働省告示第九十三号)第一項第五号及び別表の規定に基づき 厚生労働大臣が定める傷病名 手術19 処置等及び定義副傷病名及び厚生労働大臣が指定する病院の病棟における療養に要する費用の額の算定方法第一項第五号の規定に基づき厚生労働大臣が別に定める者の一部を改正する告示を次のように定め 平成三十年八月二十九日から適用する
厚生労働省告示第三百十二号厚生労働大臣が指定する病院の病棟における療養に要する費用の額の算定方法(平成二十年厚生労働省告示第九十三号)第一項第五号及び別表の規定に基づき 厚生労働大臣が定める傷病名 手術19 処置等及び定義副傷病名及び厚生労働大臣が指定する病院の病棟における療養に要する費用の額の算定方法第一項第五号の規定に基づき厚生労働大臣が別に定める者の一部を改正する告示を次のように定め 平成三十年八月二十九日から適用する
企業等からの資金提供状況報告 ( 平成 29 年 4 月 ~ 平成 30 年 3 月分 ) 1. 受託研究等 (1) 受託研究 総件数 286 件 総額 259,135 千円 (2) 共同研究 総件数 2 件 総額 0 千円 (3) 受託事業 共同事業 総件数 6 件 総額 2,060 千円 2.
 企業等からの資金提供状況報告 ( 平成 29 年 4 月 ~ 平成 30 年 3 月分 ) 1. 受託研究等 (1) 受託研究 総件数 286 件 総額 259,135 千円 (2) 共同研究 総件数 2 件 総額 0 千円 (3) 受託事業 共同事業 総件数 6 件 総額 2,060 千円 2. 寄附金等 (1) 奨学寄附金総件数 473 件総額 217,439 千円 (2) 現物寄附総件数 0
企業等からの資金提供状況報告 ( 平成 29 年 4 月 ~ 平成 30 年 3 月分 ) 1. 受託研究等 (1) 受託研究 総件数 286 件 総額 259,135 千円 (2) 共同研究 総件数 2 件 総額 0 千円 (3) 受託事業 共同事業 総件数 6 件 総額 2,060 千円 2. 寄附金等 (1) 奨学寄附金総件数 473 件総額 217,439 千円 (2) 現物寄附総件数 0
薬事法における病院及び医師に対する主な規制について 特定生物由来製品に係る説明 ( 法第 68 条の 7 平成 14 年改正 ) 特定生物由来製品の特性を踏まえ 製剤のリスクとベネフィットについて患者に説明を行い 理解を得るように努めることを これを取り扱う医師等の医療関係者に義務づけたもの ( 特
 薬事法における病院及び医師に対する主な規制について 情報の提供等 ( 法第 77 条の 3 第 2 項及び第 3 項 第 2 項 : 昭和 54 年改正 第 3 項 : 平成 6 年改正 ) 医薬品の製造販売業者等が行う医薬品又は医療機器の適正な使用のために必要な情報の収集に協力するよう努めることを また 医薬品及び医療機器の適正な使用を確保するため 医薬品の製造販売業者等から提供される情報の活用その他必要な情報の収集
薬事法における病院及び医師に対する主な規制について 情報の提供等 ( 法第 77 条の 3 第 2 項及び第 3 項 第 2 項 : 昭和 54 年改正 第 3 項 : 平成 6 年改正 ) 医薬品の製造販売業者等が行う医薬品又は医療機器の適正な使用のために必要な情報の収集に協力するよう努めることを また 医薬品及び医療機器の適正な使用を確保するため 医薬品の製造販売業者等から提供される情報の活用その他必要な情報の収集
保険薬局におけるハイリスク薬取り扱い時の注意点
 薬剤師の病棟業務の進め方 (Ver.1.2) 一般社団法人日本病院薬剤師会 平成 28 年 6 月 4 日 1. はじめに 長寿社会の到来 疾病構造の変化や意識の変化に伴い 国民の医療ニーズは多様化している また 科学技術の進歩により 医療技術も高度化し専門化している 薬剤師の職能も大きく拡大し 薬剤師の活動する場も 病棟や外来等広範囲にわたるようになり 患者の薬物療法における有効性の担保と安全性の確保
薬剤師の病棟業務の進め方 (Ver.1.2) 一般社団法人日本病院薬剤師会 平成 28 年 6 月 4 日 1. はじめに 長寿社会の到来 疾病構造の変化や意識の変化に伴い 国民の医療ニーズは多様化している また 科学技術の進歩により 医療技術も高度化し専門化している 薬剤師の職能も大きく拡大し 薬剤師の活動する場も 病棟や外来等広範囲にわたるようになり 患者の薬物療法における有効性の担保と安全性の確保
Microsoft PowerPoint - 薬物療法専門薬剤師制度_症例サマリー例_HP掲載用.pptx
 薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
改訂後改訂前 << 効能 効果に関連する使用上の注意 >> 関節リウマチ 1. 過去の治療において 少なくとも1 剤の抗リウマチ薬 ( 生物製剤を除く ) 等による適切な治療を行っても 疾患に起因する明らかな症状が残る場合に投与すること 2. 本剤とアバタセプト ( 遺伝子組換え ) の併用は行わな
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
サーバリックス の効果について 1 サーバリックス の接種対象者は 10 歳以上の女性です 2 サーバリックス は 臨床試験により 15~25 歳の女性に対する HPV 16 型と 18 型の感染や 前がん病変の発症を予防する効果が確認されています 10~15 歳の女児および
 1 2 3 4 5 子宮頸がんと発がん性ヒトパピローマウイルス 1 子宮頸がんは 子宮頸部 ( 子宮の入り口 ) にできるがんで 20~30 代で急増し 日本では年間約 15,000 人の女性が発症していると報告されています 子宮頸がんは 初期の段階では自覚症状がほとんどないため しばしば発見が遅れてしまいます がんが進行すると 不正出血や性交時の出血などがみられます 2 子宮頸がんは 発がん性 HPVというウイルスの感染が原因で引き起こされる病気です
1 2 3 4 5 子宮頸がんと発がん性ヒトパピローマウイルス 1 子宮頸がんは 子宮頸部 ( 子宮の入り口 ) にできるがんで 20~30 代で急増し 日本では年間約 15,000 人の女性が発症していると報告されています 子宮頸がんは 初期の段階では自覚症状がほとんどないため しばしば発見が遅れてしまいます がんが進行すると 不正出血や性交時の出血などがみられます 2 子宮頸がんは 発がん性 HPVというウイルスの感染が原因で引き起こされる病気です
要旨 平成 30 年 2 月 21 日新潟県福祉保健部 インターフェロンフリー治療に係る診断書を作成する際の注意事項 インターフェロンフリー治療の助成対象は HCV-RNA 陽性の C 型慢性肝炎又は Child-Pugh 分類 A の C 型代償性肝硬変で 肝がんの合併のない患者です 助成対象とな
 要旨 平成 30 年 2 月 21 日新潟県福祉保健部 インターフェロンフリー治療に係る診断書を作成する際の注意事項 インターフェロンフリー治療の助成対象は HCV-RNA 陽性の C 型慢性肝炎又は Child-Pugh 分類 A の C 型代償性肝硬変で 肝がんの合併のない患者です 助成対象となる薬剤 セログループ ( ジェノタイプ ) 診断名 治療期間は以下のとおりです 薬剤名セログループ (
要旨 平成 30 年 2 月 21 日新潟県福祉保健部 インターフェロンフリー治療に係る診断書を作成する際の注意事項 インターフェロンフリー治療の助成対象は HCV-RNA 陽性の C 型慢性肝炎又は Child-Pugh 分類 A の C 型代償性肝硬変で 肝がんの合併のない患者です 助成対象となる薬剤 セログループ ( ジェノタイプ ) 診断名 治療期間は以下のとおりです 薬剤名セログループ (
p
 2016.9.1 p23-25 80 4 6 29 1 3 3 1 2 3 3 40 30 20 10 0 -- PIO-NET 54 4 282-289 2013 PIONET) BMJ Open. 5(11):e009038 2015 Highly probable, 9% probable, 28%, 22% Highly possible, 32% Possible, 9%,
2016.9.1 p23-25 80 4 6 29 1 3 3 1 2 3 3 40 30 20 10 0 -- PIO-NET 54 4 282-289 2013 PIONET) BMJ Open. 5(11):e009038 2015 Highly probable, 9% probable, 28%, 22% Highly possible, 32% Possible, 9%,
PT51_p69_77.indd
 臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
なお,PMDA メディナビでパスワードを設定済の方は, 共通のパスワードとなります (4) 登録完了 ( 図 2 ステップ 3) なお, 登録後, ログイン時は (1) で表示される画面で, ログイン画面へ をクリックし, メー ルアドレス及びパスワードを入力してください 図 1 PMDA メディナ
 2 マイ医薬品集作成サービス について 独立行政法人医薬品医療機器総合機構 (PMDA) では,PMDAメディナビ( 医薬品医療機器情報配信サービス ) にご登録いただいている方がご利用いただける登録 利用無料の追加機能として, マイ医薬品作成サービス を提供しています あらかじめ情報が必要な医薬品を登録しておけば, 添付文書情報等の最新情報を一覧で管理 閲覧することができる大変便利なサービスです
2 マイ医薬品集作成サービス について 独立行政法人医薬品医療機器総合機構 (PMDA) では,PMDAメディナビ( 医薬品医療機器情報配信サービス ) にご登録いただいている方がご利用いただける登録 利用無料の追加機能として, マイ医薬品作成サービス を提供しています あらかじめ情報が必要な医薬品を登録しておけば, 添付文書情報等の最新情報を一覧で管理 閲覧することができる大変便利なサービスです
<4D F736F F F696E74202D202888F38DFC AB38ED28FEE95F182CC8BA4974C82C98AD682B782E B D B2E >
 // 広島県地域保健対策協議会医薬品の適正使用検討特別委員会講演会 患者情報の共有に関するアンケート ( 平成 年 月 ~ 月実施 ) 薬剤師 /,0 医師 / 歯科医師 0/ 看護師 / ( 訪問看護ステーション ) 薬剤師 Ⅰ- 薬剤師 Ⅰ- 医師 歯科医師と共有すると有用な情報は? 医師 歯科医師と共有することができるとしたら, 副作用の早期発見や未然防止, 医薬品の適正使用のために有用なのは?
// 広島県地域保健対策協議会医薬品の適正使用検討特別委員会講演会 患者情報の共有に関するアンケート ( 平成 年 月 ~ 月実施 ) 薬剤師 /,0 医師 / 歯科医師 0/ 看護師 / ( 訪問看護ステーション ) 薬剤師 Ⅰ- 薬剤師 Ⅰ- 医師 歯科医師と共有すると有用な情報は? 医師 歯科医師と共有することができるとしたら, 副作用の早期発見や未然防止, 医薬品の適正使用のために有用なのは?
5_使用上の注意(37薬効)Web作業用.indd
 34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
医療連携ガイドライン改
 睡眠医療入門キットのご紹介 厚生労働省委託研究 睡眠医療における医療機関連携ガイドラインの有効性検証に関する研究 班主任研究者 : 清水徹男 ( 秋田大学教授 日本睡眠学会理事長 ) 睡眠医療入門キット ( 入門キット ) の目的は 睡眠医療の専門家ではない医師が睡眠障害の初期診断を行い 適切な医療連携を行うための指針を提供することです このキットは スクリーニングガイドライン と 医療連携ガイドライン
睡眠医療入門キットのご紹介 厚生労働省委託研究 睡眠医療における医療機関連携ガイドラインの有効性検証に関する研究 班主任研究者 : 清水徹男 ( 秋田大学教授 日本睡眠学会理事長 ) 睡眠医療入門キット ( 入門キット ) の目的は 睡眠医療の専門家ではない医師が睡眠障害の初期診断を行い 適切な医療連携を行うための指針を提供することです このキットは スクリーニングガイドライン と 医療連携ガイドライン
改訂の理由及び調査の結果直近 3 年度の国内副作用症例の集積状況 転帰死亡症例 国内症例が集積したことから専門委員の意見も踏まえた調査の結果 改訂することが適切と判断した 低カルニチン血症関連症例 16 例 死亡 0 例
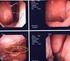 ピボキシル基を有する抗菌薬の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1セフカペンピボキシ 1フロモックス小児用細粒 100mg 同錠ル塩酸塩水和物 75mg 同錠 100mg( 塩野義製薬株式 2セフジトレンピボキ会社 ) 他シル 2メイアクト MS 小児用細粒 10% 同 3セフテラムピボキシ MS 錠 100mg(Meiji Seika
ピボキシル基を有する抗菌薬の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1セフカペンピボキシ 1フロモックス小児用細粒 100mg 同錠ル塩酸塩水和物 75mg 同錠 100mg( 塩野義製薬株式 2セフジトレンピボキ会社 ) 他シル 2メイアクト MS 小児用細粒 10% 同 3セフテラムピボキシ MS 錠 100mg(Meiji Seika
医科_第20次(追加)審査情報提供(広報用)
 第 20 次審査情報提供事例 ( 医科 ) 追加 平成 31 年 4 月 22 日提供分 社会保険診療報酬支払基金 審査情報提供事例について 審査支払機関における診療報酬請求に関する審査は 健康保険法 療養担当規則 診療報酬点数表及び関係諸通知等を踏まえ各審査委員会の医学的 歯科医学的見解に基づいて行われています 一方 審査の公平 公正性に対する関係方面からの信頼を確保するため 審査における一般的な取扱いについて広く関係者に情報提供を行い
第 20 次審査情報提供事例 ( 医科 ) 追加 平成 31 年 4 月 22 日提供分 社会保険診療報酬支払基金 審査情報提供事例について 審査支払機関における診療報酬請求に関する審査は 健康保険法 療養担当規則 診療報酬点数表及び関係諸通知等を踏まえ各審査委員会の医学的 歯科医学的見解に基づいて行われています 一方 審査の公平 公正性に対する関係方面からの信頼を確保するため 審査における一般的な取扱いについて広く関係者に情報提供を行い
レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14 回 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 29 年 10 月 1.1. 安全性検討事項 重要な特
 レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
標準的な健診・保健指導の在り方に関する検討会
 第 3 章保健指導対象者の選定と階層化 (1) 保健指導対象者の選定と階層化の基準 1) 基本的考え方生活習慣病の予防を期待できる内臓脂肪症候群 ( メタボリックシンドローム ) の選定及び階層化や 生活習慣病の有病者 予備群を適切に減少させることができたかを的確に評価するために 保健指導対象者の選定及び階層化の標準的な数値基準が必要となる 2) 具体的な選定 階層化の基準 1 内臓脂肪型肥満を伴う場合の選定内臓脂肪蓄積の程度を判定するため
第 3 章保健指導対象者の選定と階層化 (1) 保健指導対象者の選定と階層化の基準 1) 基本的考え方生活習慣病の予防を期待できる内臓脂肪症候群 ( メタボリックシンドローム ) の選定及び階層化や 生活習慣病の有病者 予備群を適切に減少させることができたかを的確に評価するために 保健指導対象者の選定及び階層化の標準的な数値基準が必要となる 2) 具体的な選定 階層化の基準 1 内臓脂肪型肥満を伴う場合の選定内臓脂肪蓄積の程度を判定するため
厚生労働省医薬 生活衛生局 情報の概要 354 No. 医薬品等対策情報の概要頁 1 高齢者の医薬品適正使用の指針 ( 総論編 ) について 平成 29 年 4 月に 高齢者医薬品適正使用検討会 を設置し, 高齢者の薬物療法の安全対策を推進するために, 安全性確保に必要な事項の調査 検討を進めていま
 354 1. 高齢者の医薬品適正使用の指針 ( 総論編 ) について 3 2. 重要な副作用等に関する情報 9 1 1 ペグフィルグラスチム ( 遺伝子組換え ) 9 2 フィルグラスチム ( 遺伝子組換え ) 他バイオ後続品 9 3 レノグラスチム ( 遺伝子組換え ) 9 3. 使用上の注意の改訂について ( その 295) アミオダロン塩酸塩他 (4 件 ) 12 4. 市販直後調査の対象品目一覧
354 1. 高齢者の医薬品適正使用の指針 ( 総論編 ) について 3 2. 重要な副作用等に関する情報 9 1 1 ペグフィルグラスチム ( 遺伝子組換え ) 9 2 フィルグラスチム ( 遺伝子組換え ) 他バイオ後続品 9 3 レノグラスチム ( 遺伝子組換え ) 9 3. 使用上の注意の改訂について ( その 295) アミオダロン塩酸塩他 (4 件 ) 12 4. 市販直後調査の対象品目一覧
ハイゼントラ20%皮下注1g/5mL・2g/10mL・4g/20mL
 CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
( 別添 ) インフルエンザに伴う異常な行動に関する報告基準 ( 報告基準 ) ( 重度調査 ) インフルエンザ様疾患と診断され かつ 重度の異常な行動を示した患者につき ご報告ください ( 軽度調査 ) インフルエンザ様疾患と診断され かつ 軽度の異常な行動を示した患者につき ご報告ください イン
 ( 別記様式 2) インフルエンザに伴う異常な行動に関する調査のお願い インフルエンザ定点医療機関用 インフルエンザ様疾患罹患時及び抗インフルエンザ薬使用時に見られた異常な行動が 医学的にも社会的にも問題になっており 2007 年より調査をお願いしております 厚生労働省では 引き続きその背景に関する実態把握をいたしたく 川崎市健康安全研究所により研究を行うこととしておりますので 以下のとおり 当該研究にかかる調査へのご協力をお願いします
( 別記様式 2) インフルエンザに伴う異常な行動に関する調査のお願い インフルエンザ定点医療機関用 インフルエンザ様疾患罹患時及び抗インフルエンザ薬使用時に見られた異常な行動が 医学的にも社会的にも問題になっており 2007 年より調査をお願いしております 厚生労働省では 引き続きその背景に関する実態把握をいたしたく 川崎市健康安全研究所により研究を行うこととしておりますので 以下のとおり 当該研究にかかる調査へのご協力をお願いします
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
規制改革会議公開討論資料
 規制改革会議第 4 回医療タスクフォース ヒアリング資料 テーマ : 医薬品のインターネット販売に係る環境整備について 平成 20 年 9 月 12 日厚生労働省 今回の薬事法改正の経緯 平成 17 年 12 月 医薬品販売制度改正検討部会 報告 平成 18 年 3 月 薬事法の一部を改正する法律案 国会提出 以降 参議院本会議 趣旨説明 質疑 参議院厚生労働委員会質疑 3 回 ( 参考人質疑を含む
規制改革会議第 4 回医療タスクフォース ヒアリング資料 テーマ : 医薬品のインターネット販売に係る環境整備について 平成 20 年 9 月 12 日厚生労働省 今回の薬事法改正の経緯 平成 17 年 12 月 医薬品販売制度改正検討部会 報告 平成 18 年 3 月 薬事法の一部を改正する法律案 国会提出 以降 参議院本会議 趣旨説明 質疑 参議院厚生労働委員会質疑 3 回 ( 参考人質疑を含む
