参 考 直近約 3 年 3ヶ月 ( 平成 25 年 4 月 ~ 平成 28 年 7 月 ) の副作用報告であって, 因果関係が否定できないもの 免疫性壊死性ミオパチー関連症例 11 例 ( うち死亡 0 例 ) 2 50 例 61 例 ( うち死亡 0 例 ) 企業が推計した過去 1 年間の推定使用
|
|
|
- きょうすけ しんまつ
- 5 years ago
- Views:
Transcription
1 4 重要な副作用等に関する情報 平成 28 年 10 月 18 日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について, 改訂内容等ととも に改訂の根拠となった症例の概要等に関する情報を紹介します 1 1 アトルバスタチンカルシウム水和物 2 シンバスタチン 3 ピタバスタチンカルシウム水和物 4 プラバスタチンナトリウム 5 フルバスタチンナトリウム 6 ロスバスタチンカルシウム 1リピトール錠 5mg, 同錠 10mg( アステラス製薬 ) 他 2リポバス錠 5, 同錠 10, 同錠 20(MSD) 他 3リバロ錠 1mg, 同錠 2mg, 同錠 4mg, 同 OD 錠 1mg, 同 OD 錠 2mg, 同 OD 錠 4mg( 興和 ) 他販売名 ( 会社名 ) 4メバロチン錠 5, 同錠 10, 同細粒 0.5%, 同細粒 1%( 第一三共 ) 他 5ローコール錠 10mg, 同錠 20mg, 同錠 30mg( ノバルティスファーマ ) 他 6クレストール錠 2.5mg, 同錠 5mg, 同 OD 錠 2.5mg, 同 OD 錠 5mg( アストラゼネカ ) 薬効分類等高脂血症用剤 効能又は効果 1,3,5,6 高コレステロール血症, 家族性高コレステロール血症 2,4 高脂血症, 家族性高コレステロール血症 使用上の注意( 下線部追加改訂部分 ) [ 重要な基本近位筋脱力,CK(CPK) 高値, 炎症を伴わない筋線維の壊死, 抗 HMG-CoA 還元酵素 (HMGCR) 的注意 ] 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ, 投与後も持続する例が報告されているので, 患者の状態を十分に観察すること なお, 免疫抑制剤投与により改善がみられたとの報告例がある [ 副作用免疫性壊死性ミオパチー : 免疫性壊死性ミオパチーがあらわれることがあるので, 観察を ( 重大な副作用 )] 十分に行い, 異常が認められた場合には投与をし, 適切な処置を行うこと 22 医薬品 医療機器等安全性情報 No.338
2 参 考 直近約 3 年 3ヶ月 ( 平成 25 年 4 月 ~ 平成 28 年 7 月 ) の副作用報告であって, 因果関係が否定できないもの 免疫性壊死性ミオパチー関連症例 11 例 ( うち死亡 0 例 ) 2 50 例 61 例 ( うち死亡 0 例 ) 企業が推計した過去 1 年間の推定使用患者数 :1 約 360 万人 2 約 41 万人 3 約 195 万人 4 約 165 万人 5 約 25 万人 6 約 542 万人販売開始 :1 平成 12 年 5 月 2 平成 3 年 12 月 3リバロ錠 1mg, 同錠 2mg: 平成 15 年 9 月リバロ錠 4mg: 平成 24 年 6 月リバロOD 錠 1mg, 同 OD 錠 2mg: 平成 25 年 7 月リバロOD 錠 4mg: 平成 25 年 12 月 4 平成元年 10 月 5 平成 15 年 6 月 6 平成 17 年 4 月 7 アムロジピンベシル酸塩 アトルバスタチンカルシウム水和物 販売名 ( 会社名 )7 カデュエット配合錠 1 番, 同 2 番, 同 3 番, 同 4 番 ( ファイザー ) 他 薬効分類等その他の循環器官用薬 効能又は効果 7 本剤 ( アムロジピン アトルバスタチン配合剤 ) は, アムロジピン及びアトルバスタチンによる治療が適切である以下の患者に使用する 高血圧症又は狭心症と, 高コレステロール血症又は家族性高コレステロール血症を併発している患者 使用上の注意( 下線部追加改訂部分 ) [ 重要な基本近位筋脱力,CK(CPK) 高値, 炎症を伴わない筋線維の壊死, 抗 HMG-CoA 還元酵素 (HMGCR) 的注意 ] 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ, 投与後も持続する例が報告されているので, 患者の状態を十分に観察すること なお, 免疫抑制剤投与により改善がみられたとの報告例がある [ 副作用免疫性壊死性ミオパチー : 免疫性壊死性ミオパチーがあらわれることがあるので, 観察を ( 重大な副作用 )] 十分に行い, 異常が認められた場合には投与をし, 適切な処置を行うこと 参 考 直近約 3 年 3ヶ月 ( 平成 25 年 4 月 ~ 平成 28 年 7 月 ) の副作用報告であって, 因果関係が否定できないもの 免疫性壊死性ミオパチー関連症例 70 例企業が推計した過去 1 年間の推定使用患者数 :7 約 38 万人販売開始 :7 平成 21 年 12 月 医薬品 医療機器等安全性情報 No
3 クレストール錠 No. 性 年齢 患者 症例の概要 使用理由 ( 合併症 ) 1 男 80 代 高コレステロール血症, 高脂血症 ( 骨折 ) 1 日投与量投与期間 2. 5 mg 1 回 / 2 日不明 2. 5 mg 1 回 / 日約 1 年間 免疫性壊死性ミオパチー 発現約 3 年以上前 ( 投与開始日 ) 発現約 1 年前発現約 4 ヶ月前投与 16 日前 投与約 3 年後 ( 発現日 ) 発現同月 ( 投与日 ) 約 2 ヶ月後 85 日後 89 日後約 3 ヶ月後 ( 入院 3 週目 ) 112 日後 114 日後 133 日後 約 6 ヶ月後 副作用 経過及び処置 本剤 2.5mg 1 回 / 2 日 ( 隔日投与 ) 開始 他にシロドシン, マニジピン塩酸塩 (10mg 2 回 / 日 ), トリメブチンマレイン酸塩 100mg, ベネキサート塩酸塩ベータデクス 200mg, テプレノン 50mg, 非ピリン系感冒剤, 大腸菌死菌 ヒドロコルチゾン, オキセサゼイン, ラベプラゾールナトリウム (1 回 / 日 ) を併用 3 ヶ月に 1 度血液検査を実施 本剤 2. 5 mg 1 回 / 日に増量 健診では異常なし ALT:27 IU/L,AST:26 IU/L 他院 A での血液検査で, 肝酵素上昇 (AST:301 IU/L,ALT: 251 IU/L) 歩きにくくなった 歩行時ふらつきがあり, 徐々に筋力低下を認め, 杖がないと頻繁に転倒するようになった 歩行障害を自覚 立位をとっていると両殿部のおもだるさが出現した 他院 A 消化器内科紹介受診 ( 腹部エコー, 腹部 CT で正常範囲内 ( W N L )) 本剤による副作用を考慮し内服するも徐々に悪化 また病院玄関から診察室までは一度休憩が必要であった 他院 A に物理療法で通院しながら, 当院整形外科にも通院継続し, トラマドール塩酸塩 アセトアミノフェン配合剤やプレガバリンを内服していた 当院整形外科受診 C 3/ 4-6/ 7 の脊柱管狭窄と C 6/ 7 の椎間板へルニア指摘されるも, 筋力低下なく, 経過観察となる 中枢疾患の除外のため神経内科に紹介, 初診 両下肢近位筋の軽度筋力低下, 両下肢の浮腫が著明であり, 低蛋白, 深部静脈血栓症, 心不全などの検査を実施するも異常なく,RS 3 PE などのリウマチ疾患を考慮しリウマチ内科へコンサルト リウマチ内科での血液検査で CK 高値 (7,874IU/L) を指摘され, 多発筋炎 (PM) ミオパチーの疑いで精査入院 入院時は歩行可能であった 肩関節痛はなかった もともと痔核があり, 入院時も大きな痔核脱出あり 大腸菌死菌 ヒドロコルチゾン座薬 1 日 2 回投与開始 胃カメラで潰瘍指摘なし 多発筋炎 (PM) の疑いで神経内科転科となる 高度の筋痛を伴う四肢近位筋優位の筋力低下 筋萎縮が急速に進行し, 座位保持不能で, 嚥下不能構音障害高度で聞きとれない状態となる 疼痛が非常に強いこと, 身体所見や血液検査で炎症背景が見られないこと ( 体温上昇もなし ), スタチン内服後 3 年経過していることから, 多発筋炎でなくスタチン関連のミオパチーなどを考え, 筋生検を実施 筋生検の結果, 臨床症状と同様, 筋組織に炎症細胞浸潤を認めず, 活動性壊死再生像があることから, 壊死性ミオパチーの診断 抗 ARS 抗体, 抗 SRP 抗体は陰性 痔核が縮小し, 疼痛 脱出はみられなくなる ステロイドパルスを 2 クール実施するも治療に対する反応は乏しかった 免疫グロブリン大量療法 (IVIg) 実施 (IVIg 開始後 3 日目 ) 劇的に疼痛が消失 (IVIg 開始後 4 週目 ) CPK 正常化 徐々に筋力および筋量も回復 疼痛や筋力低下を認めなかったが,CPK が 800 台まで悪化した 2 回目の IVIg を実施 手掌, 体幹, 上肢にそう痒, 落屑, 軽度の発赤を伴う皮疹が出現 ステロイド軟膏とエピナスチン塩酸塩で経過観察 CPK は 200 未満まで改善 嚥下障害構音障害も全快 上下肢近位筋の筋力低下が軽度残り, 階段昇降が不完全 ( リハビリは実施中 ) であった 24 医薬品 医療機器等安全性情報 No.338
4 日時不明 252 日後約 8 ヶ月後 256 日後 約 10 ヶ月後 2 回目の IVIg を実施 手掌, 体幹, 上肢にそう痒, 落屑, 軽度の発赤を伴う皮疹が出現 ステロイド軟膏とエピナスチン塩酸塩で経過観察 CPK は 200 未満まで改善 嚥下障害構音障害も全快 上下肢近位筋の筋力低下が軽度残り, 階段昇降が不完全 ( リハビリは実施中 ) であった 壊死性ミオパチー改善とともに日常生活動作 (ADL) が上がり, 両上肢が OverUse となり, 両肩関節疼痛が出現 当院整形外科にて関節にリドカインおよびステロイド関節注射 プロトンポンプ阻害薬再開とした 黒色便なし 退院前に両肩関節内にリドカインとステロイドの局注 歩行可能となった 退院 リハビリ目的で他院 B に転院 1 日 2 回の大腸菌死菌 ヒドロコルチゾンの継続を依頼 退院時の ADL は上下肢近位筋 :-1 程度, 歩行は歩行器で安定歩行可能, 動揺性歩行なし, 遠位筋の筋力低下を認めず 嚥下障害構音障害を認めず 膀胱直腸障害を認めず 他院 C に抗 SRP 抗体, 抗 HMGCR 抗体測定依頼 ( 筋病理も同時依頼 ) し, 抗 HMGCR 陽性であったため, 抗 HMGCR 抗体陽性ミオパチーと確定診断した 年齢とパルス無効を考慮し, ステロイドの内服は行わず 抗 HMGCR 抗体陽性ミオパチーは回復したが, ミオパチー ( 筋力低下 ) の後遺症あり 他院 B から退院 臨床検査値 検査項目 単位 85 日後 116 日後 144 日後 約 6 ヶ月後 約 6 ヶ月後 (2 回目 ) CPK IU/L 7, 台 200 未満 日後 抗 HMGCR 抗体 ( 222 日後 ) 方法 ELISA 法 結果 陽性 併用薬 : シロドシン, マニジピン塩酸塩, トリメブチンマレイン酸塩, ベネキサート塩酸塩ベータデクス, テプレノン, 非ピリン系感冒剤, 大腸菌死菌 ヒドロコルチゾン, オキセサゼイン, ラベプラゾールナトリウム 2 ウステキヌマブ ( 遺伝子組換え ) 販売名 ( 会社名 ) ステラーラ皮下注 45mg シリンジ ( ヤンセンファーマ ) 薬効分類等他に分類されない代謝性医薬品 効能又は効果 既存治療で効果不十分な下記疾患尋常性乾癬, 関節症性乾癬 使用上の注意( 下線部追加改訂部分 ) [ 副作用 ( 重大な副作用 )] 間質性肺炎 : 間質性肺炎があらわれることがあるので, 咳嗽, 呼吸困難, 発熱, 肺音の異常 ( 捻髪音 ) 等が認められた場合には, 速やかに胸部 X 線, 胸部 CT, 血清マーカー等の検査を実 施すること 間質性肺炎が疑われた場合には投与をし, 副腎皮質ホルモン剤の投与等の適切な処置を行うこと 参 考 直近約 3 年 4ヶ月 ( 平成 25 年 4 月 ~ 平成 28 年 8 月 ) の副作用報告であって, 因果関係が否定できないもの 間質性肺炎関連症例 6 例 ( うち死亡 0 例 ) 企業が推計した過去 1 年間の推定使用患者数 : 約 3800 人 販売開始 : 平成 23 年 3 月 医薬品 医療機器等安全性情報 No
5 症例の概要 No. 性 年齢 患者 使用理由 ( 合併症 ) 1 男乾癬 70 代 ( なし ) 臨床検査値 1 日投与量投与期間 45mg 32 週間 ( 投与間隔不明 ) 間質性肺炎 投与開始日投与開始 32 週後最終投与 52 日後 最終投与 53 日後 最終投与 61 日後 最終投与 63 日後 最終投与 67 日後 最終投与 80 日後 最終投与 87 日後最終投与 94 日後 最終投与 95 日後 副作用 経過及び処置 本剤投与開始 本剤投与 ( 最終投与 ) 皮膚科の定期受診 1 週間ほど前から全身倦怠感と咳嗽の自覚症状の訴えあり 呼吸器内科を受診 胸部 CT 検査所見 : 右肺中葉底部, 下葉外側, 上葉にすりガラス影あり 肺野に淡い粒状影が広範囲に認める 本剤による薬剤性肺炎が疑われた ベンプロペリンリン酸塩を処方 咳嗽の改善なく, 倦怠感も強いため受診し入院 デキストロメトルファン臭化水素酸塩水和物, コデインリン酸塩水和物 ( 頓用 ) 投与開始 ステロイドパルス療法, 人工呼吸器, 酸素投与等の処置はなし 喀痰塗抹 ( グラム染色 ) 及び培養 (+ 感受性試験 ) にて菌は検出されず サイトメガロウイルス関連検査 (PCR 又は血液抗原抗体反応 ) は陰性 経気管支鏡肺生検実施所見 : 一部の肺胞内腔には胞体内にコレステリン間隙を有する異物型巨細胞あり 有意な線維化や間質内への炎症細胞浸潤はなし 気管支肺胞洗浄液検査実施 細胞数 : , リンパ球 :49.1%, 好中球 :0.3%, 好酸球 : 7.0%, 好塩基球 :1.7%, マクロファージ :41.8% エピソード, 画像所見, 気管支鏡検査結果より本剤による薬剤性肺炎と判断 ニューモシスチス関連検査 (PCR) 検査 : 陰性 胸部 CT 検査にて改善を認める 自覚症状もやや改善 帰宅誘発試験施行したが変化なし 抗 Sm 抗体 (<10.0U/mL):( ) 抗 Scl-70 抗体 (<10.0U/mL):( ) 抗 DNA 抗体 (0~6IU/mL):4IU/mL 抗セントロメア抗体 (0~ 10U/mL):<2.0U/mL ARSAb( ):( ) 退院 外来にてフォローとなった 転帰 : 軽快 検査 投与開始 14 週前 最終投与 61 日後 最終投与 84 日後 最終投与 88 日後 最終投与 94 日後 最終投与 116 日後 WBC(/mm 3 ) 6,500 3, ,600 - CRP(mg/dL) KL-6(U/mL) - 1,223 1, ,018 SP-A(ng/mL) SP-D(ng/mL) Pa02(Torr) 併用薬 : なし 26 医薬品 医療機器等安全性情報 No.338
6 3 ニボルマブ ( 遺伝子組換え ) 販売名 ( 会社名 ) オプジーボ点滴静注 20mg, 同点滴静注 100mg( 小野薬品工業 ) 薬効分類等その他の腫瘍用薬 効能又は効果 根治切除不能な悪性黒色腫切除不能な進行 再発の非小細胞肺癌根治切除不能又は転移性の腎細胞癌 使用上の注意( 下線部追加改訂部分 ) [ 重要な基本本剤のT 細胞活性化作用により, 過度の免疫反応に起因すると考えられる様々な疾患や病的注意 ] 態があらわれることがある 観察を十分に行い, 異常が認められた場合には, 過度の免疫反応による副作用の発現を考慮し, 適切な鑑別診断を行うこと 過度の免疫反応による副作用が疑われる場合には, 副腎皮質ホルモン剤の投与等を考慮すること また, 本剤投与終了後に重篤な副作用があらわれることがあるので, 本剤投与終了後も観察を十分に行うこと [ 副作用免疫性血小板減少性紫斑病 : 免疫性血小板減少性紫斑病があらわれることがあるので, 観 ( 重大な副作用 )] 察を十分に行い, 異常が認められた場合には投与をし, 適切な処置を行うこと 重症筋無力症, 心筋炎, 筋炎, 横紋筋融解症 : 重症筋無力症, 心筋炎, 筋炎, 横紋筋融解症があらわれることがあり, これらを合併したと考えられる症例も報告されている 筋力低下, 眼瞼下垂, 呼吸困難, 嚥下障害,CK(CPK) 上昇, 心電図異常, 血中及び尿中ミオグロビン上昇等の観察を十分に行い, 異常が認められた場合には投与をし, 副腎皮質ホルモン剤の投与等の適切な処置を行うこと また, 重症筋無力症によるクリーゼのため急速に呼吸不全が進行することがあるので, 呼吸状態の悪化に十分注意すること 参 考 直近約 3 年 4ヶ月 ( 平成 25 年 4 月 ~ 平成 28 年 8 月 ) の副作用報告であって, 因果関係が否定できないもの 投与終了後の副作用報告症例関連症例 14 例 ( うち死亡 0 例 ) 免疫性血小板減少性紫斑病関連症例 3 例 ( うち死亡 0 例 ) 心筋炎関連症例 3 例 ( うち死亡 1 例 ) 横紋筋融解症関連症例 4 例 ( うち死亡 0 例 ) 企業が推計した過去 1 年間の推定使用患者数 : 約 8200 人 販売開始 : 平成 26 年 9 月 医薬品 医療機器等安全性情報 No
7 症例の概要 ( 免疫性血小板減少性紫斑病関連症例 ) No. 性 年齢 患者 使用理由 ( 合併症 ) 1 女悪性黒色腫 70 代 ( 高血圧, 高脂血症, 髄膜腫 ) 1 日投与量投与期間 2mg/kg 3 週ごとに 2 回 副作用 経過及び処置 免疫性血小板減少性紫斑病, 甲状腺機能亢進症, 甲状腺機能低下, 多発性脳梗塞 投与 1 年 5 ヶ月前投与 1 年 4 ヶ月前投与 1 年 3 ヶ月前投与 7 ヶ月前投与 2 ヶ月前投与開始日 投与 24 日後 ( 投与日 ) 投与 19 日後投与 21 日後 投与 22 日後 投与 23 日後投与 24 日後 投与 25 日後投与 26 日後 投与 28 日後 投与 30 日後投与 31 日後投与 33 日後投与 35 日後 投与 42 日後 投与 43 日後 投与 44 日後投与 45 日後投与 47 日後投与 51 日後 投与 52 日後投与 54 日後 投与 59 日後投与 66 日後投与 132 日後 初診, 悪性黒色腫 ( 原発部位 : 左下肢足底 ( 踵 )) を確認 左足底腫瘍切除術, 左鼠径リンパ節郭清を施行 DAV-feron 療法 6 クール開始 IFN-β 維持療法 (feron 局所療法 )2 クール開始 肺転移, 肺門部リンパ節転移あり, 本剤導入を検討 BRAF 変異陰性 根治切除不能な悪性黒色腫に対し本剤 2 mg/kg を投与 本剤 2 回目投与 甲状腺機能亢進を認めたが自覚症状なく, 本剤継続 処置なし 下肢紫斑と歯肉出血が出現 患者判断にて自宅で経過観察 本剤 3 回目投与のため来院 PLT:2,000/μL と著減を示し, 本剤投与, 緊急入院 血小板濃厚液 10U 投与開始 ( 以降 33 日後まで 10 20U を投与 ) 血液内科にコンサルテーション 歯肉出血がみられる程度で自覚症状なし 甲状腺機能亢進は回復 メチルプレドニゾロン 250mg 投与, プレドニゾロン 40mg/ 日内服を開始 フロセミド投与開始 メチルプレドニゾロン 125mg へ減量 PLT 増加はなく, 免疫グロブリン大量療法 400mg/kg/ 日 5 日間を開始 歯肉出血及び下血 ( 便性状 : 黒色便 + 鮮血 ) 下血のため絶食, 輸液管理, 床上安静管理 軽度倦怠感あり 出血及びステロイド使用に対する保護のためランソプラゾール開始 内視鏡検査で消化管出血の痕跡 Hb 6.8g/dL を示し, 赤血球濃厚液 2U により改善 PLT 2,000/μL と回復なく, ロミプロスチム 60μg/ 日を開始 骨髄検査で異常なし 抗血小板抗体陽性 感染や自己免疫疾患の兆候がなく,ITP と確定診断 倦怠感, 下血は消失 歯肉出血は消失 食事摂取再開 便中ヘリコバクター ピロリ抗原は陰性 ITP の処置としてロミプロスチム 120μg/ 日を投与 ロミプロスチム 120μg/ 日を投与 甲状腺機能低下を認めた 自覚症状なく, レボチロキシン 25μg にて処置 紫斑は消失 呂律が回らない, 発語困難, 右上下肢の軽度麻痺が出現 ヘパリン 単位 / 日を投与開始 MRI 検査にて多発性脳梗塞と診断 PLT 90,000/μL まで回復 プレドニゾロン 30mg/ 日へ減量 発語回復 麻痺は軽快 細かい作業は難しくスプーンによる摂食 ヘパリンの投与を終了 PLT 124,000/μL と十分な血小板レベルに至り,ITP は回復 PLT 120,000/μL まで回復 プレドニゾロンを 25mg/ 日へ減量 消化管出血も落ち着いた 甲状腺機能低下は軽快 多発脳梗塞は回復したが後遺症が残った プレドニゾロンの投与を終了 28 医薬品 医療機器等安全性情報 No.338
8 臨床検査値 検査項目名 投与 12 日前 投与日 21 日後 24 日後 26 日後 33 日後 34 日後 35 日後 43 日後 44 日後 45 日後 59 日後 66 日後 TSH(mU/L) FT3(pg/mL) FT4(ng/dL) WBC( 万個 /μl) RBC( 万個 /μl) Hb(g/dL) PLT( 万個 /μl) CRP(mg/dL) > > Lym(%) APTT(sec) PT(%) PT(INR) FDP(μg/mL) Fib(mg/dL) 血小板表面 IgG < 自己抗体関連検査 > 27 日後実施 抗血小板抗体 : 陽性, 血小板関連免疫グロブリンG (PA-IgG):4460.7ng/10 7 cells, 可溶性インターロイキン2 受容体 (sil-2r):1170u/ml, 抗 SS-A/Ro 抗体 :27.3U/mL, 抗核抗体 (ELISA 法 ):22.8 倍併用薬 : アムロジピンベシル酸塩, プラバスタチンナトリウム 症例の概要 ( 心筋炎関連症例 ) 患者 1 日投与量 No. 性 使用理由投与期間年齢 ( 合併症 ) 2 男 60 代 再発非小細 3mg/kg 心筋炎, 重症筋無力症胞肺癌 ( 胸水 ) 2 週ごとに2 投与 2 年前回投与 1 年 8ヶ月前投与約 1 年 6ヶ月前投与 2 ヶ月前投与開始日投与 14 日後 ( 投与日 ) 投与 14 日後 副作用 経過及び処置 放射線療法 ( 全脳 ),CBDCA+PEM 療法 4 コース施行 PEM 維持療法 5 コース施行 放射線療法 ( 腰椎 ),DTX+BEV 療法 18 コース施行 PET-CT で原疾患の進行を確認 本剤 (3mg/kg) を投与 本剤 2 回目投与 2-3 日前から背部痛, 全身倦怠感, 心筋逸脱酵素上昇, 前胸部 ST 上昇を認め来院 血圧 76/34mmHg, 脈拍 102 回 / 分, SpO 2 :95%, 体温 36.0 構語困難, 意識レベルの低下もあり頭部 / 胸腹部 CT 実施 骨転移 ( 脊椎, 肋骨 ) あり 脳転移なし 両側胸水, 癌性胸膜炎あり 循環機能悪化により入院 緊急心臓カテーテル検査 : 心尖部を中心に asynergy, 下壁は dyssynchronic 心不全に対しカルペリチド持続静注を開始 右眼瞼下垂, 項部硬直, 歩行困難 瞳孔径 :3.5/3.5mm, 対光反射 :+/+, 両側やや緩慢 外眼筋運動検査 : 両眼ともわずかに動く程度 構音障害, 四肢の筋力低下あり 深部腱反射検査 : 四肢とも減弱 消失 本剤による重症筋無力症, 筋炎の診断 ステロイドパルス療法 (3 日間 後療法 (1mg/kg 程度 )) 開始 心電図 :CRBBB type QRS と CLBBB type QRS UCG( 心臓超音波検査 ):IVC( 下大静脈 ) 拡張,φ29mm,TR( 三尖弁逆流 ):1/4,TRPG( 三尖弁圧較差 ):14mmHg PVC 散発に対し β-blocker 投与, ビソプロロール テープ 4mg 貼付 ステロイドパルス 1000mg は著効せず EF( 左室駆出率 )44% IVC ( 下大静脈 ) 拡張 + 心嚢水少量 +, 胸水 + 医薬品 医療機器等安全性情報 No
9 投与 15 日後 投与 16 日後投与 17 日後投与 19 日後 投与 22 日後 投与 26 日後投与 27 日後 投与 28 日後投与 30 日後投与 33 日後投与 34 日後投与 37 日後投与 40 日後投与 43 日後 投与 46 日後 投与 49 日後投与 55 日後 投与 63 日後 超音波検査 ):IVC( 下大静脈 ) 拡張,φ29mm,TR( 三尖弁逆流 ):1/4,TRPG( 三尖弁圧較差 ):14mmHg PVC 散発に対し β-blocker 投与, ビソプロロール テープ 4mg 貼付 ステロイドパルス 1000mg は著効せず EF( 左室駆出率 )44% IVC ( 下大静脈 ) 拡張 + 心嚢水少量 +, 胸水 + 無脈性心室頻拍となり除細動で自己心拍再開 薬剤性心筋炎による心室性不整脈と考えアミオダロン持続静注開始 心室頻拍, 循環破綻したため PCPS( 経皮的心肺補助法 )/ IABP( 大動脈内バルーンパンピング ) サポート開始 心筋生検実施 気管内挿管, 人工呼吸開始 本剤による重症心筋炎, 重症筋無力症と診断 血漿交換開始 ステロイドパルス療法及び血漿交換を施行 プレドニゾロン 60mg/ 日内服及び血漿交換を施行 重症筋無力症に対し IVIg( 免疫グロブリン大量療法 ) を施行 心筋炎に対して on-off test を施行し,DOA DOB( ドパミン ドブタミン ) を補助併用し, 自己心収縮の改善が見られ,PCPS を抜去 心拍数 血圧とも安定, 経過に問題なし high rate の持続性 VT あり, 血圧も著明に低下, 除細動にて洞調律化した プレドニゾロン 50mg/ 日内服 血液培養にてブドウ球菌検出, 喀痰培養にて Pseudomonas aeruginosa:3+ SBT/ABPC CAZ を投与 バンコマイシンを投与開始 プレドニゾロン 4 0mg を投与 気管切開を施行 プレドニゾロン 30mg を投与 呼吸器内科へ転科 プレドニゾロン 2 0mg を投与 プレドニゾロン 10mg を投与 血圧低下が続いたため CV から酢酸リンゲル液全開滴下, ノルアドレナリン 3A+ 生食 47mL を 5mL/hr で開始 TR:-,MR:-, AR:-, 右心系拡大目立ち,IVC 拡張 プレドニゾロン 1000mg 投与開始 脳波検査 : 低振幅の徐波, 全体に同程度の振幅あり, 広範な大脳障害と考えられた パルス継続は不可能と判断しプレドニゾロン 60mg に減量 血液培養でカンジダ検出 カンジダ菌血症に対してミカファンギンナトリウム 150mg/ 日を投与開始 自発呼吸が減少し強制換気に変更 VF となり, 胸骨圧迫, AED 装着, アドレナリン投与したが, 心筋炎に伴う致死的な不整脈により患者死亡 重症筋無力症は後遺症ありと判定された 臨床検査値 検査項目名投与開始日 14 日後 27 日後 43 日後 63 日後 CPK(IU/L) 26 9, CK-MB(U/L) CRP(mg/dL) WBC( 万個 /μl) Neu(%) Eos(%) Lym(%) PLT( 万個 /μl) AST(IU/L) ALT(IU/L) LDH(IU/L) 267 2, IgG(mg/dL) - 1, IgM(mg/dL) 尿蛋白半定量 (mg/dl) トロポニン I (ng/ml) < 心筋生検の組織検査 >( 投与 15 日後 ) 病理組織学的所見 : 高度の急性心筋炎像 ( 部位不詳 ) 免疫組織化学的所見 :CD3,CD45RO 陽性 T 細胞が多数 抗 PD-1 抗体投与後の自己免疫性心筋炎の可能性あり 併用薬 : アトルバスタチンカルシウム水和物, トラセミド, 非ピリン系感冒剤 30 医薬品 医療機器等安全性情報 No.338
10 症例の概要 ( 横紋筋融解症関連症例 ) No. 性 年齢 患者 使用理由 ( 合併症 ) 3 女 再発非小細 70 代 胞肺癌 ( なし ) 臨床検査値 検査項目名 1 日投与量投与期間 3mg/kg 2 週ごとに 2 回 投与 7 日前 投与日 副作用 経過及び処置 横紋筋融解症,CPK 増加, 好酸球数増加, 筋炎 日時不明投与 4 ヶ月前投与 1 ヶ月前投与開始日 投与 14 日後 ( 投与日 ) 投与 14 日後 日時不明投与 17 日後 投与 20 日後投与 42 日後投与 45 日後 投与 52 日後 14 日後 17 日後 < 自己抗体関連検査 >( 年月日不明 ) 抗 Jo- 1 抗体 : 陰性, 抗 ARS 抗体 : 陰性併用薬 : 耐性乳酸菌製剤 (3), ブロチゾラム 非小細胞肺癌を認めた 化学療法 (CBDCA+PEM) 施行 化学療法 (CBDCA+PEM) 終了 PD となり, 切除不能な進行 再発の非小細胞肺癌に対し, 本剤 3mg/kg を投与 本剤 2 回目投与 本剤 3 回目投与前検査で,CPK, 好酸球,LDH,AST, ALT の上昇及び筋肉痛の症状あり 本剤による筋炎, 横紋筋融解症の疑いで入院 処置として補液投与, 経過観察 本剤は 筋 MRI 所見 : エコー信号あり 補液では CPK, 肝機能値の改善が認められなかった ステロイドパルス療法 (3 日間 ) を施行 経口プレドニゾロン 40mg/ 日を投与開始 CPK は正常値に近づき, 好酸球上昇は軽快 CPK は正常値まで低下, 筋肉痛も消失 CPK 上昇, 横紋筋融解症, 筋炎は回復 経口プレドニゾロンを減量 引き続き外来でステロイド減量するとし, 患者退院 プレドニゾロンを 15mg/ 日まで減量 21 日後 24 日後 28 日後 31 日後 38 日後 42 日後 45 日後 52 日後 CPK(IU/L) 46-8,382 8,631 1, LDH(IU/L) ,199 1,477 1,310 1, Neu(%) AST(IU/L) ALT(IU/L) WBC( 万個 /μl) Eos(%) CK-MB(IU/L) BUN(mg/dL) Cr(mg/dL) 尿潜血 ( ) - (2+) (2+) (+/ ) ( ) ( ) ( ) ( ) - ( ) ( ) 医薬品 医療機器等安全性情報 No
臨床検査値 検査項目名 投与 12 日前 投与日 21 日後 24 日後 26 日後 33 日後 34 日後 35 日後 43 日後 44 日後 45 日後 59 日後 66 日後 TSH(mU/L) FT3(pg/mL
 症例の概要 ( 免疫性血小板減少性紫斑病関連症例 ) 1 女悪性黒色腫 70 代 ( 高血圧, 高脂血症, 髄膜腫 ) 2mg/kg 3 週ごとに 2 回 免疫性血小板減少性紫斑病, 甲状腺機能亢進症, 甲状腺機能低下, 多発性脳梗塞 投与 1 年 5 ヶ月前投与 1 年 4 ヶ月前投与 1 年 3 ヶ月前投与 7 ヶ月前投与 2 ヶ月前投与開始日 投与 24 日後 ( 投与日 ) 投与 19 日後投与
症例の概要 ( 免疫性血小板減少性紫斑病関連症例 ) 1 女悪性黒色腫 70 代 ( 高血圧, 高脂血症, 髄膜腫 ) 2mg/kg 3 週ごとに 2 回 免疫性血小板減少性紫斑病, 甲状腺機能亢進症, 甲状腺機能低下, 多発性脳梗塞 投与 1 年 5 ヶ月前投与 1 年 4 ヶ月前投与 1 年 3 ヶ月前投与 7 ヶ月前投与 2 ヶ月前投与開始日 投与 24 日後 ( 投与日 ) 投与 19 日後投与
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
301128_課_薬生薬審発1128第1号_ニボルマブ(遺伝子組換え)製剤の最適使用推進ガイドラインの一部改正について
 薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生年月日 住所 M T S H 西暦 電話番号 年月日 ( ) - 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 ( ) - 家族構成 ( ) - ( ) - ( ) - ( ) - 担当医情報 医
 佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
2 重要な副作用等に関する情報 平成 22 年 10 月 26 日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について, 改訂内容等ととも に改訂の根拠となった症例の概要等に関する情報を紹介いたします 1 荊芥連翹湯, 二朮湯 販売名 ( 会社名 ) 薬効分類等 効能 効果 荊芥連翹湯ツ
 2 重要な副作用等に関する情報 平成 22 年 10 月 26 日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について, 改訂内容等ととも に改訂の根拠となった症例の概要等に関する情報を紹介いたします 1 荊芥連翹湯, 二朮湯 販売名 ( 会社名 ) 薬効分類等 効能 効果 荊芥連翹湯ツムラ荊芥連翹湯エキス顆粒 ( 医療用 )( ツムラ ) KTS 荊芥連翹湯エキス顆粒 ( 建林松鶴堂
2 重要な副作用等に関する情報 平成 22 年 10 月 26 日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について, 改訂内容等ととも に改訂の根拠となった症例の概要等に関する情報を紹介いたします 1 荊芥連翹湯, 二朮湯 販売名 ( 会社名 ) 薬効分類等 効能 効果 荊芥連翹湯ツムラ荊芥連翹湯エキス顆粒 ( 医療用 )( ツムラ ) KTS 荊芥連翹湯エキス顆粒 ( 建林松鶴堂
症例報告書の記入における注意点 1 必須ではない項目 データ 斜線を引くこと 未取得 / 未測定の項目 2 血圧平均値 小数点以下は切り捨てとする 3 治験薬服薬状況 前回来院 今回来院までの服薬状況を記載する服薬無しの場合は 1 日投与量を 0 錠 とし 0 錠となった日付を特定すること < 演習
 ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
ロミプレート 患者用冊子 特発性血小板減少性紫斑病の治療を受ける患者さんへ
 はじめ に 特発性血小板減少性紫斑病 ITP は血小板が減少し その 結果として出血の危険が高まる病気で 国が指定する難病 特定疾患 の対象になっています 慢性に経過する病気の性格上 治療の目標は出血を防ぐ ことです 血小板数が5万/μL以上であれば通常は出血の危険はほと んどありませんので 定期的に血小板数と出血症状をみな がら経過を観察します ロミプレートは 慢性 ITP の治療において 新たな作用で
はじめ に 特発性血小板減少性紫斑病 ITP は血小板が減少し その 結果として出血の危険が高まる病気で 国が指定する難病 特定疾患 の対象になっています 慢性に経過する病気の性格上 治療の目標は出血を防ぐ ことです 血小板数が5万/μL以上であれば通常は出血の危険はほと んどありませんので 定期的に血小板数と出血症状をみな がら経過を観察します ロミプレートは 慢性 ITP の治療において 新たな作用で
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
新規文書1
 1 338 1. ミコナゾールとワルファリンカリウムの併用による相互作用について 3 2. 糖尿病治療薬ピオグリタゾン塩酸塩含有製剤による膀胱癌に係る安全対策について 8 3. 妊娠と薬情報センターについて 16 4. 重要な副作用等に関する情報 22 プラバスタチンナトリウム, フルバスタチンナトリウム, ロスバスタチンカルシウム, アムロジピンベシル酸塩 アトルバスタチンカルシウム水和物 22
1 338 1. ミコナゾールとワルファリンカリウムの併用による相互作用について 3 2. 糖尿病治療薬ピオグリタゾン塩酸塩含有製剤による膀胱癌に係る安全対策について 8 3. 妊娠と薬情報センターについて 16 4. 重要な副作用等に関する情報 22 プラバスタチンナトリウム, フルバスタチンナトリウム, ロスバスタチンカルシウム, アムロジピンベシル酸塩 アトルバスタチンカルシウム水和物 22
<4D F736F F D DC58F4994C5817A53544C2094E789BA928D5F8AB38ED28CFC834B F94CC94848CB392C78B4C C5292E646F63>
 ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
改訂現行 ( 削除部分 : 破線 ) 5) 免疫性血小板減少性紫斑病関連記載なし免疫性血小板減少性紫斑病 ( 頻度不明 ) があらわれることがあるので 観察を十分に行い 異常が認められた場合にはを中止し 適切な処置を行うこと 6) 肝機能障害 肝炎 5) 肝機能障害 肝炎 ( 変更なし ) 7) 甲
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2016 年 10 月 製造販売 プロモーション提携 OPDIVO ニボルマブ ( 遺伝子組換え ) 製剤 電話 :0120-080-340 ( オプジーボ / ヤーボイ専用ダイヤル ) 注 ) 注意 医師等の処方箋により使用すること このたび 標記製品の 使用上の注意 を改訂致しましたのでお知らせ申し上げます
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2016 年 10 月 製造販売 プロモーション提携 OPDIVO ニボルマブ ( 遺伝子組換え ) 製剤 電話 :0120-080-340 ( オプジーボ / ヤーボイ専用ダイヤル ) 注 ) 注意 医師等の処方箋により使用すること このたび 標記製品の 使用上の注意 を改訂致しましたのでお知らせ申し上げます
10,000 L 30,000 50,000 L 30,000 50,000 L 図 1 白血球増加の主な初期対応 表 1 好中球増加 ( 好中球 >8,000/μL) の疾患 1 CML 2 / G CSF 太字は頻度の高い疾患 32
 白血球増加の初期対応 白血球増加が 30,000~50,000/μL 以上と著明であれば, 白血病の可能性が高い すぐに専門施設 ( ) に紹介しよう ( 図 1) 白血球増加があれば, まず発熱など感染症を疑う症状 所見に注目しよう ( 図 1) 白血球増加があれば, 白血球分画を必ずチェックしよう 成熟好中球 ( 分葉核球や桿状核球 ) 主体の増加なら, 反応性好中球増加として対応しよう ( 図
白血球増加の初期対応 白血球増加が 30,000~50,000/μL 以上と著明であれば, 白血病の可能性が高い すぐに専門施設 ( ) に紹介しよう ( 図 1) 白血球増加があれば, まず発熱など感染症を疑う症状 所見に注目しよう ( 図 1) 白血球増加があれば, 白血球分画を必ずチェックしよう 成熟好中球 ( 分葉核球や桿状核球 ) 主体の増加なら, 反応性好中球増加として対応しよう ( 図
頭頚部がん1部[ ].indd
![頭頚部がん1部[ ].indd 頭頚部がん1部[ ].indd](/thumbs/92/108881798.jpg) 1 1 がん化学療法を始める前に がん化学療法を行うときは, その目的を伝え なぜ, 化学療法を行うか について患者の理解と同意を得ること ( インフォームド コンセント ) が必要である. 病理組織, 病期が決定したら治療計画を立てるが, がん化学療法を治療計画に含める場合は以下の場合である. 切除可能であるが, 何らかの理由で手術を行わない場合. これには, 導入として行う場合と放射線療法との併用で化学療法を施行する場合がある.
1 1 がん化学療法を始める前に がん化学療法を行うときは, その目的を伝え なぜ, 化学療法を行うか について患者の理解と同意を得ること ( インフォームド コンセント ) が必要である. 病理組織, 病期が決定したら治療計画を立てるが, がん化学療法を治療計画に含める場合は以下の場合である. 切除可能であるが, 何らかの理由で手術を行わない場合. これには, 導入として行う場合と放射線療法との併用で化学療法を施行する場合がある.
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
「 」 説明および同意書
 EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
3. 発症時の尿中 Cペプチド<10µg/day, または, 空腹時血清 Cペプチド<0.3ng/mLかつグルカゴン負荷後 ( または食後 2 時間 ) 血清 Cペプチド<0.5ng/mLである *: 劇症 1 型糖尿病発症前に耐糖能異常が存在した場合は, 必ずしもこの数字は該当しない < 参考所見
 1 ニボルマブ ( 遺伝子組換え ) 製剤使用時の劇症 1 型糖尿病に関する周知について 1. はじめに ニボルマブ ( 遺伝子組換え ) 製剤 ( 以下, 本剤 という ) は, 販売名オプジーボ点滴静注 20mg, 同点滴静注 100mgとして, 平成 26 年 7 月に 根治切除不能な悪性黒色腫 を効能 効果として製造販売の承認を取得し, 同年 9 月に発売となりました 本剤による1 型糖尿病については,
1 ニボルマブ ( 遺伝子組換え ) 製剤使用時の劇症 1 型糖尿病に関する周知について 1. はじめに ニボルマブ ( 遺伝子組換え ) 製剤 ( 以下, 本剤 という ) は, 販売名オプジーボ点滴静注 20mg, 同点滴静注 100mgとして, 平成 26 年 7 月に 根治切除不能な悪性黒色腫 を効能 効果として製造販売の承認を取得し, 同年 9 月に発売となりました 本剤による1 型糖尿病については,
TTP 治療ガイド ( 第二版 ) 作成厚生労働科学研究費補助金難治性疾患政策研究事業 血液凝固異常症等に関する研究班 ( 主任研究者村田満 ) 血栓性血小板減少性紫斑病 (thrombotic thrombocytopenic purpura:ttp) は 緊急に治療を必要とする致死的疾患である
 TTP 治療ガイド ( 第二版 ) 作成厚生労働科学研究費補助金難治性疾患政策研究事業 血液凝固異常症等に関する研究班 ( 主任研究者村田満 ) 血栓性血小板減少性紫斑病 (thrombotic thrombocytopenic purpura:ttp) は 緊急に治療を必要とする致死的疾患である 原因不明の血小板減少と溶血性貧血を認めた場合に本疾患を疑うことが重要である 指定難病の診断基準では ADAMTS13
TTP 治療ガイド ( 第二版 ) 作成厚生労働科学研究費補助金難治性疾患政策研究事業 血液凝固異常症等に関する研究班 ( 主任研究者村田満 ) 血栓性血小板減少性紫斑病 (thrombotic thrombocytopenic purpura:ttp) は 緊急に治療を必要とする致死的疾患である 原因不明の血小板減少と溶血性貧血を認めた場合に本疾患を疑うことが重要である 指定難病の診断基準では ADAMTS13
1)表紙14年v0
 NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
症例の概要 1 女 40 代 尋常性乾癬 併用薬 : 情報なし 300mg 200 日間 潰瘍性大腸炎 本剤投与約 2 年前 本剤投与 12 日前投与開始日投与 57 日目投与約 5 ヶ月目 (123~153 日目 ) 投与 193 日目 投与 200 日目最終投与 11 日後最終投与 14 日後最
 3 重要な等に関する情報 平成 30 年 10 月 23 日に改訂を指導した医薬品の使用上の注意のうち重要な等について, 改訂内容等ととも に改訂の根拠となった症例の概要等に関する情報を紹介します 1 セクキヌマブ ( 遺伝子組換え ) 販売名 ( 会社名 ) コセンティクス皮下注 150mgシリンジ, 同皮下注 150mgペン ( ノバルティスファーマ株式会社 ) 薬効分類等他に分類されない代謝性医薬品既存治療で効果不十分な下記疾患効能又は効果尋常性乾癬,
3 重要な等に関する情報 平成 30 年 10 月 23 日に改訂を指導した医薬品の使用上の注意のうち重要な等について, 改訂内容等ととも に改訂の根拠となった症例の概要等に関する情報を紹介します 1 セクキヌマブ ( 遺伝子組換え ) 販売名 ( 会社名 ) コセンティクス皮下注 150mgシリンジ, 同皮下注 150mgペン ( ノバルティスファーマ株式会社 ) 薬効分類等他に分類されない代謝性医薬品既存治療で効果不十分な下記疾患効能又は効果尋常性乾癬,
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
最適使用推進ガイドライン_ニボルマブ_悪性胸膜中皮腫
 参考 7 最適使用推進ガイドライン ニボルマブ ( 遺伝子組換え ) ( 販売名 : オプジーボ点滴静注 20 mg オプジーボ点滴静注 100 mg オプジーボ点滴静注 240mg) ~ 悪性胸膜中皮腫 ~ 平成 30 年 8 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴 作用機序 P3 3. 臨床成績 P4 4. 施設について P6 5. 投与対象となる患者
参考 7 最適使用推進ガイドライン ニボルマブ ( 遺伝子組換え ) ( 販売名 : オプジーボ点滴静注 20 mg オプジーボ点滴静注 100 mg オプジーボ点滴静注 240mg) ~ 悪性胸膜中皮腫 ~ 平成 30 年 8 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴 作用機序 P3 3. 臨床成績 P4 4. 施設について P6 5. 投与対象となる患者
06_改訂のお知らせ & MR勉強用資料作成
 性年齢 1 男 50 代 胸膜悪性中皮腫 ( リンパ節転移, 胸水, 石綿肺症, 間質性肺疾患, 慢性閉塞性肺疾患 ) 940mg 5 週おきに 2 クール 感染症 ( 肺炎 ) 既往歴 喫煙歴あり(40 本 / 日 20 年 ), アスベスト曝露歴あり 投与 8 日前 葉酸製剤の投与開始 投与 7 日前 ビタミン B 12 剤の投与開始 投与 3 日前 聴診所見 : 異常あり 投与 1 日前 SpO
性年齢 1 男 50 代 胸膜悪性中皮腫 ( リンパ節転移, 胸水, 石綿肺症, 間質性肺疾患, 慢性閉塞性肺疾患 ) 940mg 5 週おきに 2 クール 感染症 ( 肺炎 ) 既往歴 喫煙歴あり(40 本 / 日 20 年 ), アスベスト曝露歴あり 投与 8 日前 葉酸製剤の投与開始 投与 7 日前 ビタミン B 12 剤の投与開始 投与 3 日前 聴診所見 : 異常あり 投与 1 日前 SpO
研究協力施設における検討例 病理解剖症例 80 代男性 東京逓信病院症例 1 検討の概要ルギローシスとして矛盾しない ( 図 1) 臨床診断 慢性壊死性肺アスペルギルス症 臨床経過概要 30 年前より糖尿病で当院通院 12 年前に狭心症で CABG 施行 2 年前にも肺炎で入院したが 1 年前に慢性
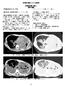 研究協力施設における検討例 病理解剖症例 80 代男性 東京逓信病院症例 1 検討の概要ルギローシスとして矛盾しない ( 図 1) 臨床診断 慢性壊死性肺アスペルギルス症 臨床経過概要 30 年前より糖尿病で当院通院 12 年前に狭心症で CABG 施行 2 年前にも肺炎で入院したが 1 年前に慢性壊死性肺アスペルギルス症の診断となる 1 か月前にも肺炎で入院し 軽快退院したが 1 週間後より呼吸状態が再び悪化して再入院
研究協力施設における検討例 病理解剖症例 80 代男性 東京逓信病院症例 1 検討の概要ルギローシスとして矛盾しない ( 図 1) 臨床診断 慢性壊死性肺アスペルギルス症 臨床経過概要 30 年前より糖尿病で当院通院 12 年前に狭心症で CABG 施行 2 年前にも肺炎で入院したが 1 年前に慢性壊死性肺アスペルギルス症の診断となる 1 か月前にも肺炎で入院し 軽快退院したが 1 週間後より呼吸状態が再び悪化して再入院
平成 30 年 8 月 10 日 リポバス錠 5, 10, 20 アトーゼット配合錠 LD, MSD 株式会社 HD 競合品目 1 クレストール錠 クレストールOD 錠 アストラゼネカ 競合品目 2 リピトール錠 アステラス製薬 競合品目 3 リバロ錠 リバロOD 錠 興和 自社製品を除いた同効品で
 平成 30 年 8 月 7 日 リピトール錠 5mg リピトール錠 10mg アステラス製薬株式会社 競合品目 1 クレストール錠 2.5mg クレストール錠 5mg クレストールOD 錠 2.5mg クレストールOD 錠 5mg( ロスバスタチンカルシウム ) 競合品目 2 リバロ錠 1mg リバロ錠 2mg リバロ錠 4mg ( ピタバスタチンカルシウム ) 競合品目 3 メバロチン錠 5 メバロチン錠
平成 30 年 8 月 7 日 リピトール錠 5mg リピトール錠 10mg アステラス製薬株式会社 競合品目 1 クレストール錠 2.5mg クレストール錠 5mg クレストールOD 錠 2.5mg クレストールOD 錠 5mg( ロスバスタチンカルシウム ) 競合品目 2 リバロ錠 1mg リバロ錠 2mg リバロ錠 4mg ( ピタバスタチンカルシウム ) 競合品目 3 メバロチン錠 5 メバロチン錠
33 NCCN Guidelines Version NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) 非ホジキンリンパ腫 2015 年第 2 版 NCCN.or
 33 NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) 2015 年第 2 版 NCCN.org NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) の Lugano
33 NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) 2015 年第 2 版 NCCN.org NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) の Lugano
300828_課_薬生薬審発0828第1号_デュルバルマブ(遺伝子組換え)製剤の最適使用推進ガイドライン(非小細胞肺癌)について
 薬生薬審発 0828 第 1 号平成 3 0 年 8 月 2 8 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) デュルバルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 ) について 経済財政運営と改革の基本方針 2016( 平成 28 年 6 月 2 日閣議決定 ) において 革新的医薬品の使用の最適化推進を図ることが盛り込まれたことを受けて
薬生薬審発 0828 第 1 号平成 3 0 年 8 月 2 8 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) デュルバルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 ) について 経済財政運営と改革の基本方針 2016( 平成 28 年 6 月 2 日閣議決定 ) において 革新的医薬品の使用の最適化推進を図ることが盛り込まれたことを受けて
スライド 1
 1. 血液の中に存在する脂質 脂質異常症で重要となる物質トリグリセリド ( 中性脂肪 :TG) 動脈硬化に深く関与する 脂質の種類 トリグリセリド :TG ( 中性脂肪 ) リン脂質 遊離脂肪酸 特徴 細胞の構成成分 ホルモンやビタミン 胆汁酸の原料 動脈硬化の原因となる 体や心臓を動かすエネルギーとして利用 皮下脂肪として貯蔵 動脈硬化の原因となる 細胞膜の構成成分 トリグリセリド ( 中性脂肪
1. 血液の中に存在する脂質 脂質異常症で重要となる物質トリグリセリド ( 中性脂肪 :TG) 動脈硬化に深く関与する 脂質の種類 トリグリセリド :TG ( 中性脂肪 ) リン脂質 遊離脂肪酸 特徴 細胞の構成成分 ホルモンやビタミン 胆汁酸の原料 動脈硬化の原因となる 体や心臓を動かすエネルギーとして利用 皮下脂肪として貯蔵 動脈硬化の原因となる 細胞膜の構成成分 トリグリセリド ( 中性脂肪
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
改訂の理由及び調査の結果直近 3 年度の国内副作用症例の集積状況 転帰死亡症例 アモキシシリン水和物及びクラブラン酸カリウム アモキシシリン水和物の国内症例が集積したことから 専門委員の意見も踏まえた調査の結果 改訂することが適切と判断した 血小板減少関連症例 1 アモキシシリン水和物 3 例 (
 アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
1. 重篤な不正出血の発現状況 ( 患者背景 ) (1) 患者背景 ( 子宮腺筋症 子宮筋腫合併例の割合 ) 重篤な不正出血発現例の多くは子宮腺筋症を合併する症例でした 重篤な不正出血を発現した 54 例中 48 例 (88.9%) は 子宮腺筋症を合併する症例でした また 子宮腺筋症 子宮筋腫のい
 - 適正使用のお願い - をより安全にお使い頂くために ( 重篤な不正出血について ) 2013 年 5 月 持田製薬株式会社 < ディナゲスト錠 1mg をより安全にお使い頂くためのお願い > ディナゲスト錠 1mg は 2008 年 1 月に子宮内膜症治療剤として販売開始以降 重篤な不正出血発現例が 54 例報告されております (2013 年 4 月 1 日時点 ) このうち 患者背景として 48
- 適正使用のお願い - をより安全にお使い頂くために ( 重篤な不正出血について ) 2013 年 5 月 持田製薬株式会社 < ディナゲスト錠 1mg をより安全にお使い頂くためのお願い > ディナゲスト錠 1mg は 2008 年 1 月に子宮内膜症治療剤として販売開始以降 重篤な不正出血発現例が 54 例報告されております (2013 年 4 月 1 日時点 ) このうち 患者背景として 48
<4D F736F F D DC58F4994C5817A54524D5F8AB38ED28CFC88E396F B CF8945C8CF889CA92C789C1816A5F3294C52E646
 患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
患者向医薬品ガイド
 この薬は? 販売名 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド プラバスタチン Na 錠 5mg CMX プラバスタチン Na 錠 10mg CMX プラバスタチン Na 錠 5mg CMX PRAVASTATIN Na TABLETS 5mg CMX プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 2018 年 2 月作成 プラバスタチン
この薬は? 販売名 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド プラバスタチン Na 錠 5mg CMX プラバスタチン Na 錠 10mg CMX プラバスタチン Na 錠 5mg CMX PRAVASTATIN Na TABLETS 5mg CMX プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 2018 年 2 月作成 プラバスタチン
糖尿病経口薬 QOL 研究会研究 1 症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12
 症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12 患者背景同意取得時から試験開始までの状況について記入 性別 男 女 年齢生年月日 歳 西暦年月日 身長. cm 体重. kg 腹囲. cm 糖尿病罹病期間 西暦年月 ~ 現在 喫煙 合併症 あり なし飲酒 あり
症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12 患者背景同意取得時から試験開始までの状況について記入 性別 男 女 年齢生年月日 歳 西暦年月日 身長. cm 体重. kg 腹囲. cm 糖尿病罹病期間 西暦年月 ~ 現在 喫煙 合併症 あり なし飲酒 あり
< F2D C D838A8BDB92CA926D2E6A7464>
 保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
タフィンラーカプセル50mg/75mg、メキニスト錠0.5mg/2mg 添付文書改訂のお知らせ
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 添付文書改訂のお知らせ 製造販売 2018 年 7 月 このたび 標記製品の効能又は効果の一部変更承認に伴い 添付文書の記載内容を改訂いたしましたのでお知らせいたします 今後のご使用に際しましてご参照下さいますようお願い申し上げます 効能又は効果 ( タフィンラーカプセル メキニスト錠共通 ) 改訂後 (2018 年 7 月改訂 ) 効能又は効果
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 添付文書改訂のお知らせ 製造販売 2018 年 7 月 このたび 標記製品の効能又は効果の一部変更承認に伴い 添付文書の記載内容を改訂いたしましたのでお知らせいたします 今後のご使用に際しましてご参照下さいますようお願い申し上げます 効能又は効果 ( タフィンラーカプセル メキニスト錠共通 ) 改訂後 (2018 年 7 月改訂 ) 効能又は効果
10038 W36-1 ワークショップ 36 関節リウマチの病因 病態 2 4 月 27 日 ( 金 ) 15:10-16:10 1 第 5 会場ホール棟 5 階 ホール B5(2) P2-203 ポスタービューイング 2 多発性筋炎 皮膚筋炎 2 4 月 27 日 ( 金 ) 12:4
 10001 P1-089 ポスタービューイング 1 関節リウマチの治療 :DMARDs NSAIDs 4 月 26 日 ( 木 ) 13:20-14:40 - ポスター 展示会場ホール E B2 階 ホール E 10002 P2-041 ポスタービューイング 2 関節リウマチの治療評価と予測 2 4 月 27 日 ( 金 ) 12:40-14:00 - ポスター 展示会場ホール E B2 階 ホール
10001 P1-089 ポスタービューイング 1 関節リウマチの治療 :DMARDs NSAIDs 4 月 26 日 ( 木 ) 13:20-14:40 - ポスター 展示会場ホール E B2 階 ホール E 10002 P2-041 ポスタービューイング 2 関節リウマチの治療評価と予測 2 4 月 27 日 ( 金 ) 12:40-14:00 - ポスター 展示会場ホール E B2 階 ホール
PT51_p69_77.indd
 臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
STEP 1 検査値を使いこなすために 臨床検査の基礎知識 検査の目的は大きく 2 つ 基準範囲とは 95% ( 図 1) 図 1 基準範囲の考え方 2
 STEP 1 検査値を使いこなすために 臨床検査の基礎知識 検査の目的は大きく 2 つ 基準範囲とは 95% ( 図 1) 100 5 図 1 基準範囲の考え方 2 STEP 1 血算 2 押さえておきたい検査の特徴 1 血算 項目略称基準範囲 白血球数 (white blood cell count) WBC 3.3 ~ 8.6 10 3 /μl 好中球数 (neutrophil) Neut 40.0
STEP 1 検査値を使いこなすために 臨床検査の基礎知識 検査の目的は大きく 2 つ 基準範囲とは 95% ( 図 1) 100 5 図 1 基準範囲の考え方 2 STEP 1 血算 2 押さえておきたい検査の特徴 1 血算 項目略称基準範囲 白血球数 (white blood cell count) WBC 3.3 ~ 8.6 10 3 /μl 好中球数 (neutrophil) Neut 40.0
患者向医薬品ガイド
 この薬は? 販売名 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2018 年 11 月更新 Pravastatin Sodium Tablets 5mg Chemiphar プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて Pravastatin Sodium Tablets 10mg Chemiphar プラバスタチンナトリウム
この薬は? 販売名 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2018 年 11 月更新 Pravastatin Sodium Tablets 5mg Chemiphar プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて Pravastatin Sodium Tablets 10mg Chemiphar プラバスタチンナトリウム
耐性菌届出基準
 37 ペニシリン耐性肺炎球菌感染症 (1) 定義ペニシリン G に対して耐性を示す肺炎球菌による感染症である (2) 臨床的特徴小児及び成人の化膿性髄膜炎や中耳炎で検出されるが その他 副鼻腔炎 心内膜炎 心嚢炎 腹膜炎 関節炎 まれには尿路生殖器感染から菌血症を引き起こすこともある 指定届出機関の管理者は 当該指定届出機関の医師が (2) の臨床的特徴を有する者を診察した結果 症状や所見からペニシリン耐性肺炎球菌感染症が疑われ
37 ペニシリン耐性肺炎球菌感染症 (1) 定義ペニシリン G に対して耐性を示す肺炎球菌による感染症である (2) 臨床的特徴小児及び成人の化膿性髄膜炎や中耳炎で検出されるが その他 副鼻腔炎 心内膜炎 心嚢炎 腹膜炎 関節炎 まれには尿路生殖器感染から菌血症を引き起こすこともある 指定届出機関の管理者は 当該指定届出機関の医師が (2) の臨床的特徴を有する者を診察した結果 症状や所見からペニシリン耐性肺炎球菌感染症が疑われ
プラザキサ服用上の注意 1. プラザキサは 1 日 2 回内服を守る 自分の判断で服用を中止し ないこと 2. 飲み忘れた場合は 同日中に出来るだけ早く1 回量を服用する 次の服用までに 6 時間以上あけること 3. 服用し忘れた場合でも 2 回量を一度に服用しないこと 4. 鼻血 歯肉出血 皮下出
 プラザキサ服用上の注意 1. プラザキサは 1 日 2 回内服を守る 自分の判断で服用を中止し ないこと 2. 飲み忘れた場合は 同日中に出来るだけ早く1 回量を服用する 次の服用までに 6 時間以上あけること 3. 服用し忘れた場合でも 2 回量を一度に服用しないこと 4. 鼻血 歯肉出血 皮下出血 血尿 血便などの異常出血が出現 した場合は直ちに病院に連絡して下さい ( 088-622-7788)
プラザキサ服用上の注意 1. プラザキサは 1 日 2 回内服を守る 自分の判断で服用を中止し ないこと 2. 飲み忘れた場合は 同日中に出来るだけ早く1 回量を服用する 次の服用までに 6 時間以上あけること 3. 服用し忘れた場合でも 2 回量を一度に服用しないこと 4. 鼻血 歯肉出血 皮下出血 血尿 血便などの異常出血が出現 した場合は直ちに病院に連絡して下さい ( 088-622-7788)
膿疱性乾癬の効能追加 ( 承認事項の 部変更承認 ) に伴う改訂 改訂内容 ( 該当部のみ抜粋 ) 警告 1.~3. 4. 関節リウマチ患者では, 本剤の治療を行う前に, 少なくとも 1 剤の抗リウマチ薬等の使用を十分勘案すること. また, 本剤についての十分な知識とリウマチ治療の経験をもつ医師が使
 - 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
- 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
【参考6】オプジーボ(胃癌)最適使用推進ガイドライン
 参考 6 最適使用推進ガイドライン ニボルマブ ( 遺伝子組換え ) ( 販売名 : オプジーボ点滴静注 20 mg オプジーボ点滴静注 100 mg オプジーボ点滴静注 240 mg) ~ 胃癌 ~ 平成 29 年 9 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴 作用機序 P3 3. 臨床成績 P4 4. 施設について P7 5. 投与対象となる患者
参考 6 最適使用推進ガイドライン ニボルマブ ( 遺伝子組換え ) ( 販売名 : オプジーボ点滴静注 20 mg オプジーボ点滴静注 100 mg オプジーボ点滴静注 240 mg) ~ 胃癌 ~ 平成 29 年 9 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴 作用機序 P3 3. 臨床成績 P4 4. 施設について P7 5. 投与対象となる患者
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
患者向医薬品ガイド
 この薬は? 販売名 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2017 年 1 月作成 Pravastatin Tablets 5mg CHEMIPHAR 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて Pravastatin Tablets 10mg CHEMIPHAR 10mg 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と
この薬は? 販売名 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2017 年 1 月作成 Pravastatin Tablets 5mg CHEMIPHAR 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて Pravastatin Tablets 10mg CHEMIPHAR 10mg 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と
BA_kanen_QA_zenpan_kani_univers.indd
 その他 B 型肝炎 15% C 型肝炎 68% 41 706 168 66 19 12 肝 には の か 脂肪肝 の で る () という も りま の く い 肝 の肝細胞のなかに 脂肪の く がこ なにたまっ いま 類洞 正常な肝臓 腸管からの栄養や不要物が流れていく 肝細胞 正常な肝臓 脂肪肝の始まり 類洞 腸管からの栄養や不要物が流れていく 類洞 過剰な脂質 糖質の流入 肝細胞 肝細胞のなかに中性脂肪がたまり始める
その他 B 型肝炎 15% C 型肝炎 68% 41 706 168 66 19 12 肝 には の か 脂肪肝 の で る () という も りま の く い 肝 の肝細胞のなかに 脂肪の く がこ なにたまっ いま 類洞 正常な肝臓 腸管からの栄養や不要物が流れていく 肝細胞 正常な肝臓 脂肪肝の始まり 類洞 腸管からの栄養や不要物が流れていく 類洞 過剰な脂質 糖質の流入 肝細胞 肝細胞のなかに中性脂肪がたまり始める
( 別添 2) 重要 2019 年 5 月 号 安全性速報 ベージニオ 錠 50mg 100mg 150mg による重篤な間質性肺疾患について 2018 年 11 月 30 日の発売開始以降, 市販直後調査中の 2019 年 5 月 14 日までの間に, 本剤使用患者において間質性肺疾患
 ( 別添 2) 重要 2019 年 5 月 19-01 号 安全性速報 ベージニオ 錠 50mg 100mg 150mg による重篤な間質性肺疾患について 2018 年 11 月 30 日の発売開始以降, 市販直後調査中の 2019 年 5 月 14 日までの間に, 本剤使用患者において間質性肺疾患の重篤な症例が 14 例報告されました このうち 3 例は, 死亡に至った症例として報告されています
( 別添 2) 重要 2019 年 5 月 19-01 号 安全性速報 ベージニオ 錠 50mg 100mg 150mg による重篤な間質性肺疾患について 2018 年 11 月 30 日の発売開始以降, 市販直後調査中の 2019 年 5 月 14 日までの間に, 本剤使用患者において間質性肺疾患の重篤な症例が 14 例報告されました このうち 3 例は, 死亡に至った症例として報告されています
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
 64 は認められなかった 術前に施行したIVIgの効 きた 特に 小児例では血漿交換は肉体的侵襲が 果が明らかでなかったため 2月20日より単純血 大きく Blood Accessも難iしいことから1 IVIg 漿交換を施行した 第1回施行直後より 開瞼3 mmまで可能となり 眼球運動も改善 3回目終了 が推奨されてきている11 12 後より水分経口摂取開始 4回目終了後には人工 呼吸器から離脱が可能となり著明な改善効果を認
64 は認められなかった 術前に施行したIVIgの効 きた 特に 小児例では血漿交換は肉体的侵襲が 果が明らかでなかったため 2月20日より単純血 大きく Blood Accessも難iしいことから1 IVIg 漿交換を施行した 第1回施行直後より 開瞼3 mmまで可能となり 眼球運動も改善 3回目終了 が推奨されてきている11 12 後より水分経口摂取開始 4回目終了後には人工 呼吸器から離脱が可能となり著明な改善効果を認
85歳(141
 日本腎臓病薬物療法学会ホームページ原稿 (2012.10.30) 腎機能低下患者での感染症治療への関わり 平成紫川会小倉記念病院薬剤部町田聖治 (ICD) 腎機能低下患者での感染症治療への関わりについて 2 症例 (Ⅰ 尿路感染症への関わり Ⅱ 術後感染症への関わり ) の提示を行う 患者の背景 臓器症別鑑別から抗菌薬の選択を行い 腎機能低下患者での投与量 投与方法について医師と協議した内容や経緯を紹介する
日本腎臓病薬物療法学会ホームページ原稿 (2012.10.30) 腎機能低下患者での感染症治療への関わり 平成紫川会小倉記念病院薬剤部町田聖治 (ICD) 腎機能低下患者での感染症治療への関わりについて 2 症例 (Ⅰ 尿路感染症への関わり Ⅱ 術後感染症への関わり ) の提示を行う 患者の背景 臓器症別鑑別から抗菌薬の選択を行い 腎機能低下患者での投与量 投与方法について医師と協議した内容や経緯を紹介する
バイエル薬品工業 改訂のお知らせネクサバール錠
 医薬品の適正使用に欠かせない情報です. 必ずお読み下さい. 使用上の注意改訂のお知らせ No.2010-23 注 ) 注意 - 医師等の処方せんにより使用すること 2010 年 11 月 このたび, 標記製品の 使用上の注意 を下記のとおり改訂致しましたのでお知らせ申し上げます. 今後のご使用に際しましては 使用上の注意 に十分ご留意賜りますようお願い申し上げます. なお, このたびの改訂添付文書を封入した製品がお手元に届くまでには若干の日数を要すると思われますので,
医薬品の適正使用に欠かせない情報です. 必ずお読み下さい. 使用上の注意改訂のお知らせ No.2010-23 注 ) 注意 - 医師等の処方せんにより使用すること 2010 年 11 月 このたび, 標記製品の 使用上の注意 を下記のとおり改訂致しましたのでお知らせ申し上げます. 今後のご使用に際しましては 使用上の注意 に十分ご留意賜りますようお願い申し上げます. なお, このたびの改訂添付文書を封入した製品がお手元に届くまでには若干の日数を要すると思われますので,
がん登録実務について
 平成 28 年度東京都がん登録説明会資料 2-1 がん登録届出実務について (1) 1. 届出対象 2. 届出候補見つけ出し 3. 診断日 4. 届出票の作成例示 東京都地域がん登録室 1 1. 届出対象 1 原発部位で届出 2 入院 外来を問わず 当該腫瘍に対して 自施設を初診し 診断あるいは治療の対象 ( 経過観察を含む ) となった腫瘍を届出 3 届出対象となった腫瘍を 1 腫瘍 1 届出の形で届出
平成 28 年度東京都がん登録説明会資料 2-1 がん登録届出実務について (1) 1. 届出対象 2. 届出候補見つけ出し 3. 診断日 4. 届出票の作成例示 東京都地域がん登録室 1 1. 届出対象 1 原発部位で届出 2 入院 外来を問わず 当該腫瘍に対して 自施設を初診し 診断あるいは治療の対象 ( 経過観察を含む ) となった腫瘍を届出 3 届出対象となった腫瘍を 1 腫瘍 1 届出の形で届出
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
ポプスカイン0.75% 注シリンジ 75mg /10 院 Popscaine 75mg /10 院 / 筒 丸石 薬価 円 / 筒 効 硬膜外麻酔 用 ( 注 )1 回 150mg ( 本剤として20 院 ) までを硬膜外腔に投与 禁 大量出血やショック状態, 注射部位またはその周辺に
 神経系に作用する薬剤 局所麻酔薬 ( エステル型 ) ( プロカイン塩酸塩 ) プロカニン注 0.5% Procanine 25mg /5 院 / 管 光 薬価 92.00 円 /A 効 浸潤麻酔 用 ( 注 )1 回 1000mgの範囲内で使用 ( 基準最高用量 :1 回 1000mg ). 必要に応じアドレナリン ( 濃度 1:10 万 ~ 20 万 ) を添加 禁 メトヘモグロビン血症, 本剤の成分又は安息香酸エステル
神経系に作用する薬剤 局所麻酔薬 ( エステル型 ) ( プロカイン塩酸塩 ) プロカニン注 0.5% Procanine 25mg /5 院 / 管 光 薬価 92.00 円 /A 効 浸潤麻酔 用 ( 注 )1 回 1000mgの範囲内で使用 ( 基準最高用量 :1 回 1000mg ). 必要に応じアドレナリン ( 濃度 1:10 万 ~ 20 万 ) を添加 禁 メトヘモグロビン血症, 本剤の成分又は安息香酸エステル
<4D F736F F D F E AB38ED B >
 患者向医薬品ガイド 2018 年 1 月作成 プラバスタチンナトリウム錠 陽進 5mg プラバスタチンナトリウム錠 陽進 10mg この薬は? 販売名 一般名 含有量 (1 錠中 ) プラバスタチンナトリウム錠 陽進 5mg PRAVASTATIN SODIUM TABLETS プラバスタチンナトリウム Pravastatin Sodium プラバスタチンナトリウム錠 陽進 10mg PRAVASTATIN
患者向医薬品ガイド 2018 年 1 月作成 プラバスタチンナトリウム錠 陽進 5mg プラバスタチンナトリウム錠 陽進 10mg この薬は? 販売名 一般名 含有量 (1 錠中 ) プラバスタチンナトリウム錠 陽進 5mg PRAVASTATIN SODIUM TABLETS プラバスタチンナトリウム Pravastatin Sodium プラバスタチンナトリウム錠 陽進 10mg PRAVASTATIN
この薬を使う前に 確認すべきことは? 次の人は この薬を使用することはできません 過去に NikP に含まれる成分で過敏症のあった人 妊婦または妊娠している可能性のある人および授乳中の人 次の人は 慎重に使う必要があります 使い始める前に医師または薬剤師にその旨を告げてください 肝臓に重篤な障害のあ
 患者向医薬品ガイド 2018 年 11 月更新 5 mg NikP この薬は? 一般名 含有量 (1 錠中 ) Pravastatin Sodium Tablets 5mg プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて Pravastatin Sodium Tablets 10mg プラバスタチンナトリウム 10mg 患者向医薬品ガイドは
患者向医薬品ガイド 2018 年 11 月更新 5 mg NikP この薬は? 一般名 含有量 (1 錠中 ) Pravastatin Sodium Tablets 5mg プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて Pravastatin Sodium Tablets 10mg プラバスタチンナトリウム 10mg 患者向医薬品ガイドは
<4D F736F F D208BA38D DA81458BA38D878AE98BC6838A E646F6378>
 平成 26 年 10 月 14 日 ジャディアンス錠 平成 25 年 10 月 8 日 ( 錠 25mg) 日本ベーリンガー 品目 10mg, 同錠 25mg 年月日 平成 25 年 12 月 13 日 ( 錠 10mg) 者名 インゲルハイム株式会社 薬事分科会審議参加規程における, 上記品目に係る競合品目, 競合企業及びその選定理由は以下のとおりです 競合品目 1 競合品目 2 競合品目 3 スーグラ錠
平成 26 年 10 月 14 日 ジャディアンス錠 平成 25 年 10 月 8 日 ( 錠 25mg) 日本ベーリンガー 品目 10mg, 同錠 25mg 年月日 平成 25 年 12 月 13 日 ( 錠 10mg) 者名 インゲルハイム株式会社 薬事分科会審議参加規程における, 上記品目に係る競合品目, 競合企業及びその選定理由は以下のとおりです 競合品目 1 競合品目 2 競合品目 3 スーグラ錠
情報提供の例
 145 ヒアルロン酸 2( 肝硬変 ) 平成 22 年 6 月 21 日新規 平成 26 年 9 月 22 日更新 平成 30 年 2 月 26 日更新 取扱い原則として 肝硬変に対するヒアルロン酸は認められない 取扱いを定めた理由 肝硬変 では 既に肝の線維化が認められるものであり ヒアルロン酸の測定は 疾患の経過観察の参考とならない 39 リウマトイド因子 (RF)
145 ヒアルロン酸 2( 肝硬変 ) 平成 22 年 6 月 21 日新規 平成 26 年 9 月 22 日更新 平成 30 年 2 月 26 日更新 取扱い原則として 肝硬変に対するヒアルロン酸は認められない 取扱いを定めた理由 肝硬変 では 既に肝の線維化が認められるものであり ヒアルロン酸の測定は 疾患の経過観察の参考とならない 39 リウマトイド因子 (RF)
Microsoft Word - シンポニー_201307_お知らせ文書_Ver01.docx
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意 改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2013 年 7 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品の 使用上の注意 を一部改訂致しましたので お知らせ申し上げます 今後のご使用に際しましては 下記の改訂部分にご留意の上
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意 改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2013 年 7 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品の 使用上の注意 を一部改訂致しましたので お知らせ申し上げます 今後のご使用に際しましては 下記の改訂部分にご留意の上
Microsoft Word - オーソ_201302_Final.docx
 医薬品の適正使用に欠かせない情報です 必ずお読みください H24-11 平成 25 年 2 月 / ( ノルエチステロン エチニルエストラジオール錠 ) 使用上の注意改訂のご案内 製造販売元ヤンセンファーマ株式会社 / 発売元持田製薬株式会社 この度 オーソ 777-21 錠 / オーソ M-21 錠の 使用上の注意 を改訂致しましたので ご案内申し上げます 今後のご使用に際しましては 下記内容にご留意くださいますようお願い致します
医薬品の適正使用に欠かせない情報です 必ずお読みください H24-11 平成 25 年 2 月 / ( ノルエチステロン エチニルエストラジオール錠 ) 使用上の注意改訂のご案内 製造販売元ヤンセンファーマ株式会社 / 発売元持田製薬株式会社 この度 オーソ 777-21 錠 / オーソ M-21 錠の 使用上の注意 を改訂致しましたので ご案内申し上げます 今後のご使用に際しましては 下記内容にご留意くださいますようお願い致します
脂質異常症を診断できる 高尿酸血症を診断できる C. 症状 病態の経験 1. 頻度の高い症状 a 全身倦怠感 b 体重減少 体重増加 c 尿量異常 2. 緊急を要する病態 a 低血糖 b 糖尿性ケトアシドーシス 高浸透圧高血糖症候群 c 甲状腺クリーゼ d 副腎クリーゼ 副腎不全 e 粘液水腫性昏睡
 糖尿病 内分泌内科 ( 必修 1 ヶ月 ) GIO(General Instructive Objective: 一般目標 ) 医学及び医療の果たすべき社会的役割を認識しつつ 診療を受ける者に対応する医師としての人格をかん養し 一般的な診療において頻繁にかかる負傷または疾病に適切に対応できるよう 基本的な診療能力を身に付ける SBO(Specific Behavioral. Objectives:
糖尿病 内分泌内科 ( 必修 1 ヶ月 ) GIO(General Instructive Objective: 一般目標 ) 医学及び医療の果たすべき社会的役割を認識しつつ 診療を受ける者に対応する医師としての人格をかん養し 一般的な診療において頻繁にかかる負傷または疾病に適切に対応できるよう 基本的な診療能力を身に付ける SBO(Specific Behavioral. Objectives:
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ステロイド療法薬物療法としてはステロイド薬の全身療法が基本になります 発症早期すなわち発症後 7 日前後までに開始することが治療効果 副作用抑制の観点から望ましいと考えられす 表皮剥離が全身に及んだ段階でのステロイド薬開始は敗血症等感染症を引き起こす可能性が高まります プレドニゾロンまたはベタメタゾ
 2017 年 9 月 21 日放送 第 80 回日本皮膚科学会東京支部学術大会 8 シンポジウム 8-4 SJS/TEN の治療指針 2016 の概要 昭和大学皮膚科 教授末木博彦 はじめにスティーヴンス ジョンソン症候群 SJS と中毒性表皮壊死症 TEN の治療指針は 2016 年の重症多形滲出性紅斑 SJS TEN 診療ガイドライン策定を機に改訂されました 本日はその内容についてご説明いたします
2017 年 9 月 21 日放送 第 80 回日本皮膚科学会東京支部学術大会 8 シンポジウム 8-4 SJS/TEN の治療指針 2016 の概要 昭和大学皮膚科 教授末木博彦 はじめにスティーヴンス ジョンソン症候群 SJS と中毒性表皮壊死症 TEN の治療指針は 2016 年の重症多形滲出性紅斑 SJS TEN 診療ガイドライン策定を機に改訂されました 本日はその内容についてご説明いたします
スライド 1
 大腸がんの治療戦略と緩和医療 新病院外来化学療法室 がん診療推進室 カウンター W C W C W C 倉庫 調剤 拡大キャンサーボード 外来 外来 外来 外来 松山赤十字病院臨床腫瘍科 白石猛 本日の話題 1, 大腸がんの治療戦略 2, 切除不能大腸がんの化学療法の適応 3, 緩和医療 大腸がんの治療戦略 進行度に合わせた治療戦略 ( ガイドライン ) 1, 原発巣の評価 : CF, 注腸検査 (RAS
大腸がんの治療戦略と緩和医療 新病院外来化学療法室 がん診療推進室 カウンター W C W C W C 倉庫 調剤 拡大キャンサーボード 外来 外来 外来 外来 松山赤十字病院臨床腫瘍科 白石猛 本日の話題 1, 大腸がんの治療戦略 2, 切除不能大腸がんの化学療法の適応 3, 緩和医療 大腸がんの治療戦略 進行度に合わせた治療戦略 ( ガイドライン ) 1, 原発巣の評価 : CF, 注腸検査 (RAS
この薬を使う前に 確認すべきことは? 次の人は この薬を使用することはできません 過去に TCK に含まれる成分で過敏症のあった人 妊婦または妊娠している可能性のある人および授乳中の人 次の人は 原則として この薬を使用することはできません 腎臓の機能に関する臨床検査値に異常が認められる人でフィブラ
 この薬は? 販売名 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2018 年 1 月更新 PRAVASTATIN Na Tablets プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて PRAVASTATIN Na Tablets プラバスタチンナトリウム 10mg 患者向医薬品ガイドは 患者の皆様や家族の方などに
この薬は? 販売名 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2018 年 1 月更新 PRAVASTATIN Na Tablets プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて PRAVASTATIN Na Tablets プラバスタチンナトリウム 10mg 患者向医薬品ガイドは 患者の皆様や家族の方などに
診療科 血液内科 ( 専門医取得コース ) 到達目標 血液悪性腫瘍 出血性疾患 凝固異常症の診断から治療管理を含めた血液疾患一般臨床を豊富に経験し 血液専門医取得を目指す 研修日数 週 4 日 6 ヶ月 ~12 ヶ月 期間定員対象評価実技診療知識 1 年若干名専門医取得前の医師業務内容やサマリの確認
 血液内科 ( 専門医取得コース ) 血液悪性腫瘍 出血性疾患 凝固異常症の診断から治療管理を含めた血液疾患一般臨床を豊富に経験し 血液専門医取得を目指す 週 4 日 6 ヶ月 ~12 ヶ月 1 年若干名専門医取得前の医師業務内容やサマリの確認骨髄穿刺 腰椎穿刺など外来 講義 研究会発表 症例検討 教授回診骨髄採取手術 外来 17:00~ 17:30~ 移植カンファレンス カンファレンス 抄読会 骨髄スメア検鏡会
血液内科 ( 専門医取得コース ) 血液悪性腫瘍 出血性疾患 凝固異常症の診断から治療管理を含めた血液疾患一般臨床を豊富に経験し 血液専門医取得を目指す 週 4 日 6 ヶ月 ~12 ヶ月 1 年若干名専門医取得前の医師業務内容やサマリの確認骨髄穿刺 腰椎穿刺など外来 講義 研究会発表 症例検討 教授回診骨髄採取手術 外来 17:00~ 17:30~ 移植カンファレンス カンファレンス 抄読会 骨髄スメア検鏡会
2017 年 2 月 1 日放送 ウイルス性肺炎の現状と治療戦略 国立病院機構沖縄病院統括診療部長比嘉太はじめに肺炎は実地臨床でよく遭遇するコモンディジーズの一つであると同時に 死亡率も高い重要な疾患です 肺炎の原因となる病原体は数多くあり 極めて多様な病態を呈します ウイルス感染症の診断法の進歩に
 2017 年 2 月 1 日放送 ウイルス性肺炎の現状と治療戦略 国立病院機構沖縄病院統括診療部長比嘉太はじめに肺炎は実地臨床でよく遭遇するコモンディジーズの一つであると同時に 死亡率も高い重要な疾患です 肺炎の原因となる病原体は数多くあり 極めて多様な病態を呈します ウイルス感染症の診断法の進歩に伴い 肺炎におけるウイルスの重要性が注目されてきました 本日のお話では 成人におけるウイルス性肺炎の疫学と診断の現状
2017 年 2 月 1 日放送 ウイルス性肺炎の現状と治療戦略 国立病院機構沖縄病院統括診療部長比嘉太はじめに肺炎は実地臨床でよく遭遇するコモンディジーズの一つであると同時に 死亡率も高い重要な疾患です 肺炎の原因となる病原体は数多くあり 極めて多様な病態を呈します ウイルス感染症の診断法の進歩に伴い 肺炎におけるウイルスの重要性が注目されてきました 本日のお話では 成人におけるウイルス性肺炎の疫学と診断の現状
されており これらの保菌者がリザーバーとして感染サイクルに関与している可能性も 考えられています 臨床像ニューモシスチス肺炎の 3 主徴は 発熱 乾性咳嗽 呼吸困難です その他のまれな症状として 胸痛や血痰なども知られています 身体理学所見には乏しく 呼吸音は通常正常です HIV 感染者に合併したニ
 2012 年 4 月 4 日放送 ニューモシスチス肺炎の診断と治療 東京医科大学八王子医療センター感染症科教授藤井毅はじめにニューモシスチス肺炎は Pneumocystis jirovecii( ニューモシスチスイロベチイ ) を病原微生物とする 主に細胞性免疫が著明に低下した状態で発症する日和見感染症です AIDS 関連日和見感染症の代表的疾患ですが その他にもステロイドや免疫抑制剤の長期使用 抗
2012 年 4 月 4 日放送 ニューモシスチス肺炎の診断と治療 東京医科大学八王子医療センター感染症科教授藤井毅はじめにニューモシスチス肺炎は Pneumocystis jirovecii( ニューモシスチスイロベチイ ) を病原微生物とする 主に細胞性免疫が著明に低下した状態で発症する日和見感染症です AIDS 関連日和見感染症の代表的疾患ですが その他にもステロイドや免疫抑制剤の長期使用 抗
Microsoft PowerPoint - 薬物療法専門薬剤師制度_症例サマリー例_HP掲載用.pptx
 薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
院内がん登録における発見経緯 来院経路 発見経緯がん発見のきっかけとなったもの 例 ) ; を受けた ; 職場の健康診断または人間ドックを受けた 他疾患で経過観察中 ; 別の病気で受診中に偶然 がん を発見した ; 解剖により がん が見つかった 来院経路 がん と診断された時に その受診をするきっ
 15 年 12 月時点 院内がん登録統計 (13 年 ) 登録対象 当院で診断された または治療された がん 当院で がん と判明した場合や他施設から がん の治療のためにされた場合に登録 診断された時点で登録を行うため 治療実績 手術件数などとは件数が異なります 例 )A さんは X 医院で胃がんと診断され 治療のために当院に来院された 胃がん を登録 1 腫瘍 1 登録 1 人が複数の部位に がん
15 年 12 月時点 院内がん登録統計 (13 年 ) 登録対象 当院で診断された または治療された がん 当院で がん と判明した場合や他施設から がん の治療のためにされた場合に登録 診断された時点で登録を行うため 治療実績 手術件数などとは件数が異なります 例 )A さんは X 医院で胃がんと診断され 治療のために当院に来院された 胃がん を登録 1 腫瘍 1 登録 1 人が複数の部位に がん
2017 年 8 月 9 日放送 結核診療における QFT-3G と T-SPOT 日本赤十字社長崎原爆諫早病院副院長福島喜代康はじめに 2015 年の本邦の新登録結核患者は 18,820 人で 前年より 1,335 人減少しました 新登録結核患者数も人口 10 万対 14.4 と減少傾向にあります
 2017 年 8 月 9 日放送 結核診療における QFT-3G と T-SPOT 日本赤十字社長崎原爆諫早病院副院長福島喜代康はじめに 2015 年の本邦の新登録結核患者は 18,820 人で 前年より 1,335 人減少しました 新登録結核患者数も人口 10 万対 14.4 と減少傾向にありますが 本邦の結核では高齢者結核が多いのが特徴です 結核診療における主な検査法を示します ( 図 1) 従来の細菌学的な抗酸菌の塗抹
2017 年 8 月 9 日放送 結核診療における QFT-3G と T-SPOT 日本赤十字社長崎原爆諫早病院副院長福島喜代康はじめに 2015 年の本邦の新登録結核患者は 18,820 人で 前年より 1,335 人減少しました 新登録結核患者数も人口 10 万対 14.4 と減少傾向にありますが 本邦の結核では高齢者結核が多いのが特徴です 結核診療における主な検査法を示します ( 図 1) 従来の細菌学的な抗酸菌の塗抹
この薬を使う前に 確認すべきことは? 次の人は この薬を使用することはできません 過去にプラバスタチン Na 錠 NS に含まれる成分で過敏症のあった人 妊婦または妊娠している可能性のある人および授乳中の人 次の人は 慎重に使う必要があります 使い始める前に医師または薬剤師にその旨を告げてください
 この薬は? 販売名 一般名 含有量 (1 錠中 ) プラバスタチン Na 錠 5mg NS プラバスタチン Na 錠 10mg NS プラバスタチン Na 錠 5mg NS Pravastatin Na Tablets 5mg NS プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイド 2018 年 11 月更新 プラバスタチン Na
この薬は? 販売名 一般名 含有量 (1 錠中 ) プラバスタチン Na 錠 5mg NS プラバスタチン Na 錠 10mg NS プラバスタチン Na 錠 5mg NS Pravastatin Na Tablets 5mg NS プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイド 2018 年 11 月更新 プラバスタチン Na
本書の読み方 使い方 ~ 各項目の基本構成 ~ * 本書は主に外来の日常診療で頻用される治療薬を取り上げています ❶ 特徴 01 HMG-CoA 代表的薬剤ピタバスタチン同種同効薬アトルバスタチン, ロスバスタチン HMG-CoA 還元酵素阻害薬は主に高 LDL コレステロール血症の治療目的で使 用
 本書の読み方 使い方 ~ 各項目の基本構成 ~ * 本書は主に外来の日常診療で頻用される治療薬を取り上げています ❶ 特徴 01 HMG-CoA 代表的薬剤ピタバスタチン同種同効薬アトルバスタチン, ロスバスタチン HMG-CoA 還元酵素阻害薬は主に高 LDL コレステロール血症の治療目的で使 用される その強力なコレステロール低下作用と, コレステロール低下作用を 介さない作用 ( 血管内皮機能改善作用,
本書の読み方 使い方 ~ 各項目の基本構成 ~ * 本書は主に外来の日常診療で頻用される治療薬を取り上げています ❶ 特徴 01 HMG-CoA 代表的薬剤ピタバスタチン同種同効薬アトルバスタチン, ロスバスタチン HMG-CoA 還元酵素阻害薬は主に高 LDL コレステロール血症の治療目的で使 用される その強力なコレステロール低下作用と, コレステロール低下作用を 介さない作用 ( 血管内皮機能改善作用,
反映改訂案_2018年11月更新_プラバスタチン錠「タナベ」)
 患者向医薬品ガイド 2018 年 11 月更新 この薬は? 一般名 PRAVASTATIN SODIUM Tablets 5mg プラバスタチンナトリウム Pravastatin Sodium PRAVASTATIN SODIUM Tablets 10mg 含有量 (1 錠中 ) 5mg 10mg 患者向医薬品ガイドについて 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と
患者向医薬品ガイド 2018 年 11 月更新 この薬は? 一般名 PRAVASTATIN SODIUM Tablets 5mg プラバスタチンナトリウム Pravastatin Sodium PRAVASTATIN SODIUM Tablets 10mg 含有量 (1 錠中 ) 5mg 10mg 患者向医薬品ガイドについて 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と
患者向医薬品ガイド
 患者向医薬品ガイド 2018 年 2 月更新 この薬は? 販売名 一般名 含有量 (1 錠中 ) メバレクト錠 5mg メバレクト錠 10mg メバレクト錠 5mg Mevalect Tablets 5mg 日局プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium メバレクト錠 10mg Mevalect Tablets 10mg 日局プラバスタチンナトリウム
患者向医薬品ガイド 2018 年 2 月更新 この薬は? 販売名 一般名 含有量 (1 錠中 ) メバレクト錠 5mg メバレクト錠 10mg メバレクト錠 5mg Mevalect Tablets 5mg 日局プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium メバレクト錠 10mg Mevalect Tablets 10mg 日局プラバスタチンナトリウム
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
改訂後改訂前 << 効能 効果に関連する使用上の注意 >> 関節リウマチ 1. 過去の治療において 少なくとも1 剤の抗リウマチ薬 ( 生物製剤を除く ) 等による適切な治療を行っても 疾患に起因する明らかな症状が残る場合に投与すること 2. 本剤とアバタセプト ( 遺伝子組換え ) の併用は行わな
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
<4D F736F F D204A4F544E D8E8094BB92E88B4C985E8F DCE88C88FE3816A >
 法的脳死判定記録書 (の者に脳死判定を行う場合 ) この記録書では 法的脳死判定を実施しながら 下線部に必要事項を記入し 該当するチェックボックス ( ) に 印を入れること ができます 省令第 5 条第 1 項 脳死判定を受けた者 氏名 住所 性別 生年月日年月日生歳 である 脳死判定を承諾した家族 代表者氏名 住所 脳死判定を受けた者との続柄 脳死判定を受けた者及び家族の意思 ( ア~ウのいずれか
法的脳死判定記録書 (の者に脳死判定を行う場合 ) この記録書では 法的脳死判定を実施しながら 下線部に必要事項を記入し 該当するチェックボックス ( ) に 印を入れること ができます 省令第 5 条第 1 項 脳死判定を受けた者 氏名 住所 性別 生年月日年月日生歳 である 脳死判定を承諾した家族 代表者氏名 住所 脳死判定を受けた者との続柄 脳死判定を受けた者及び家族の意思 ( ア~ウのいずれか
はじめに この 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 は を服用される患者さんが 服用状況 体調の変化 検査結果の経過などを記録するための冊子です は 催奇形性があり サリドマイドの同類薬です は 胎児 ( お腹の赤ちゃん ) に障害を起こす可能性があります 生まれてくる赤ちゃんに
 を服用される方へ 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 使用開始日年月日 ( 冊目 ) はじめに この 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 は を服用される患者さんが 服用状況 体調の変化 検査結果の経過などを記録するための冊子です は 催奇形性があり サリドマイドの同類薬です は 胎児 ( お腹の赤ちゃん ) に障害を起こす可能性があります 生まれてくる赤ちゃんに被害を及ぼすことがないよう
を服用される方へ 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 使用開始日年月日 ( 冊目 ) はじめに この 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 は を服用される患者さんが 服用状況 体調の変化 検査結果の経過などを記録するための冊子です は 催奇形性があり サリドマイドの同類薬です は 胎児 ( お腹の赤ちゃん ) に障害を起こす可能性があります 生まれてくる赤ちゃんに被害を及ぼすことがないよう
日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI 関連の企業などはありません
 医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
患者向医薬品ガイド
 この薬は? 販売名 一般名 含有量 (1 錠中 ) プラバスタチン Na 錠 5mg EE プラバスタチン Na 錠 10mg EE プラバスタチン Na 錠 5mg EE Pravastatin Na tab.5mg EE プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイド 2017 年 2 月作成 プラバスタチン Na 錠 10mg
この薬は? 販売名 一般名 含有量 (1 錠中 ) プラバスタチン Na 錠 5mg EE プラバスタチン Na 錠 10mg EE プラバスタチン Na 錠 5mg EE Pravastatin Na tab.5mg EE プラバスタチンナトリウム 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイド 2017 年 2 月作成 プラバスタチン Na 錠 10mg
この薬を使う前に 確認すべきことは? 次の人は この薬を使用することはできません 過去にプラバスタチン Na 錠に含まれる成分で過敏症のあった人 妊婦または妊娠している可能性のある人および授乳中の人 次の人は 慎重に使う必要があります 使い始める前に医師または薬剤師にその旨を告げてください 肝臓に重
 この薬は? 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2018 年 12 月更新 プラバスタチン Na 錠 5mg プラバスタチン Na 錠 10mg プラバスタチン Na 錠 5mg PRAVASTATIN SODIUM TABLETS 5mg TOWA 5mg プラバスタチンナトリウム Pravastatin Sodium プラバスタチン Na 錠 10mg PRAVASTATIN SODIUM
この薬は? 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2018 年 12 月更新 プラバスタチン Na 錠 5mg プラバスタチン Na 錠 10mg プラバスタチン Na 錠 5mg PRAVASTATIN SODIUM TABLETS 5mg TOWA 5mg プラバスタチンナトリウム Pravastatin Sodium プラバスタチン Na 錠 10mg PRAVASTATIN SODIUM
人間ドック結果報告書 1/5 ページ 所属 : 株式会社 ケンコウタロウ健康太郎 様 性別 / 年齢 男性 / 49 歳 生年月日 昭和 40 年 3 月 17 日 受診日 平成 26 年 5 月 2 日 受診コース 人間ドック ( 胃カメラ ) 問診項目 今回前回前々回平成 26 年 5 月 2
 人間ドック結果報告書 1/5 ページ 所属 : 株式会社 ケンコウタロウ健康太郎 様 性別 / 年齢 男性 / 49 歳 生年月日 昭和 40 年 3 月 17 日 受診日 平成 26 年 5 月 2 日 受診コース 人間ドック ( 胃カメラ ) 問診項目 血圧 服薬なし 服薬なし 服薬なし 服薬歴 血糖 服薬なし 服薬なし 服薬なし 脂質 服薬なし 服薬なし 服薬なし 喫煙歴 いいえ いいえ いいえ
人間ドック結果報告書 1/5 ページ 所属 : 株式会社 ケンコウタロウ健康太郎 様 性別 / 年齢 男性 / 49 歳 生年月日 昭和 40 年 3 月 17 日 受診日 平成 26 年 5 月 2 日 受診コース 人間ドック ( 胃カメラ ) 問診項目 血圧 服薬なし 服薬なし 服薬なし 服薬歴 血糖 服薬なし 服薬なし 服薬なし 脂質 服薬なし 服薬なし 服薬なし 喫煙歴 いいえ いいえ いいえ
プラバスタチンNa錠5mg/10mg「MED」201703
 この薬は? 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2017 年 3 月作成 Pravastatin Na Tablets 5mg プラバスタチンナトリウム Pravastatin Sodium Pravastatin Na Tablets 10mg 患者向医薬品ガイドについて 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と 重大な副作用の早期発見などに役立てていただくために作成したものです
この薬は? 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2017 年 3 月作成 Pravastatin Na Tablets 5mg プラバスタチンナトリウム Pravastatin Sodium Pravastatin Na Tablets 10mg 患者向医薬品ガイドについて 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と 重大な副作用の早期発見などに役立てていただくために作成したものです
第 90 回 MSGR トピック : 急性冠症候群 LDL-C Ezetimibe 発表者 : 山田亮太 ( 研修医 ) コメンテーター : 高橋宗一郎 ( 循環器内科 ) 文献 :Ezetimibe Added to Statin Theraphy after Acute Coronary Syn
 第 90 回 MSGR トピック : 急性冠症候群 LDL-C Ezetimibe 発表者 : 山田亮太 ( 研修医 ) コメンテーター : 高橋宗一郎 ( 循環器内科 ) 文献 :Ezetimibe Added to Statin Theraphy after Acute Coronary Syndromes Christopher P. Cannon, et al. N Engl J Med 2015;
第 90 回 MSGR トピック : 急性冠症候群 LDL-C Ezetimibe 発表者 : 山田亮太 ( 研修医 ) コメンテーター : 高橋宗一郎 ( 循環器内科 ) 文献 :Ezetimibe Added to Statin Theraphy after Acute Coronary Syndromes Christopher P. Cannon, et al. N Engl J Med 2015;
<4D F736F F D2082A8926D82E782B995B68F C D815B838B43505F4F E31302E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
95_財団ニュース.indd
 NO. 95 平成 21 年 7 月 1 日発行 No.95 日本リウマチ財団ニュース 表 1 ACR-EULAR 関節リウマチ診断基準 分類基準 試案 eular 2009, 岡田正人 訳 上を診断とするかはこれから決 score 0 22 34 定され また この項目と点数 0 6 印象も受けるが 時代とともに PIP,MCP,MTP, 手関節 4箇所以上非対称性 4箇所以上対称性 10
NO. 95 平成 21 年 7 月 1 日発行 No.95 日本リウマチ財団ニュース 表 1 ACR-EULAR 関節リウマチ診断基準 分類基準 試案 eular 2009, 岡田正人 訳 上を診断とするかはこれから決 score 0 22 34 定され また この項目と点数 0 6 印象も受けるが 時代とともに PIP,MCP,MTP, 手関節 4箇所以上非対称性 4箇所以上対称性 10
目次 1. はじめに P2 2. 本剤の特徴, 作用機序 P3 3. 臨床成績 P4 4. 施設について P8 5. 投与対象となる患者 P10 6. 投与に際して留意すべき事項 P12 1
 参考 最適使用推進ガイドライン デュルバルマブ ( 遺伝子組換え ) ( 販売名 : イミフィンジ点滴静注 120 mg イミフィンジ点滴静注 500 mg) ~ 非小細胞肺癌 ~ 平成 30 年 8 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴, 作用機序 P3 3. 臨床成績 P4 4. 施設について P8 5. 投与対象となる患者 P10
参考 最適使用推進ガイドライン デュルバルマブ ( 遺伝子組換え ) ( 販売名 : イミフィンジ点滴静注 120 mg イミフィンジ点滴静注 500 mg) ~ 非小細胞肺癌 ~ 平成 30 年 8 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴, 作用機序 P3 3. 臨床成績 P4 4. 施設について P8 5. 投与対象となる患者 P10
 ~ 副腎に腫瘍がある といわれたら ~ 副腎腫瘍? そもそも 副腎って何? 小さいけれど働き者の 副腎 副腎は 左右の腎臓の上にある臓器です 副腎皮質ホルモンやカテコラミンと呼ばれる 生命や血圧を維持するために欠かせない 重要なホルモンを分泌している大切な臓器です 副腎 副腎 NEXT ホルモンって 何? 全身を調整する大切な ホルモン 特定の臓器 ( 内分泌臓器 ) から血液の中に出てくる物質をホルモンと呼びます
~ 副腎に腫瘍がある といわれたら ~ 副腎腫瘍? そもそも 副腎って何? 小さいけれど働き者の 副腎 副腎は 左右の腎臓の上にある臓器です 副腎皮質ホルモンやカテコラミンと呼ばれる 生命や血圧を維持するために欠かせない 重要なホルモンを分泌している大切な臓器です 副腎 副腎 NEXT ホルモンって 何? 全身を調整する大切な ホルモン 特定の臓器 ( 内分泌臓器 ) から血液の中に出てくる物質をホルモンと呼びます
 一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
この薬を使う前に 確認すべきことは? 次の人は この薬を使用することはできません 過去に アメル に含まれる成分で過敏な反応を経験したことがある人 妊婦または妊娠している可能性のある人および授乳中の人 次の人は 原則として この薬を使用することはできません 腎臓の機能に関する臨床検査値に異常が認めら
 この薬は? 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2017 年 4 月作成 PRAVASTATIN Na Tablets 5mg AMEL 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて PRAVASTATIN Na Tablets 10mg AMEL 10mg 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と
この薬は? 一般名 含有量 (1 錠中 ) 患者向医薬品ガイド 2017 年 4 月作成 PRAVASTATIN Na Tablets 5mg AMEL 5mg プラバスタチンナトリウム Pravastatin Sodium 患者向医薬品ガイドについて PRAVASTATIN Na Tablets 10mg AMEL 10mg 患者向医薬品ガイドは 患者の皆様や家族の方などに 医療用医薬品の正しい理解と
150800247.indd
 ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
1 女 40 代 肺動脈性肺高血圧症 ( 慢性心不全 ) 臨床検査値 89ng/kg/min 61.4ng/kg/min 中止 甲状腺機能亢進症 アレルギー歴 : アモキシシリン水和物 ( 症状全身発疹 ) 既往歴 : 子宮体がん, 喘息, 橋本病, カテーテル感染, 右心不全 投与 10 年 7
 3 重要な等に関する情報 平成 29 年 5 月 30 日に改訂を指導した医薬品の使用上の注意のうち重要な等について, 改訂内容等ととも に改訂の根拠となった症例の概要等に関する情報を紹介します 1 トレプロスチニル 販売名 ( 会社名 ) トレプロスト注射液 20mg, 同注射液 50mg 同注射液 100mg, 同注射液 200mg( 持田製薬株式会社 ) 薬効分類等その他の循環器官用薬 効能又は効果肺動脈性肺高血圧症
3 重要な等に関する情報 平成 29 年 5 月 30 日に改訂を指導した医薬品の使用上の注意のうち重要な等について, 改訂内容等ととも に改訂の根拠となった症例の概要等に関する情報を紹介します 1 トレプロスチニル 販売名 ( 会社名 ) トレプロスト注射液 20mg, 同注射液 50mg 同注射液 100mg, 同注射液 200mg( 持田製薬株式会社 ) 薬効分類等その他の循環器官用薬 効能又は効果肺動脈性肺高血圧症
ハイゼントラ20%皮下注1g/5mL・2g/10mL・4g/20mL
 CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
2009年8月17日
 医師 2,000 人超の調査結果を多数掲載中です https://www.facebook.com/medpeer 2013 年 8 月 1 日 メドピア株式会社 マイコプラズマ感染症診断における迅速診断キットの使用状況 について 半数以上はキットを使用していない 医師約 6 万人が参加する医師専用サイト MedPeer ( メドピア https://medpeer.jp/) を運営するメドピア 株式会社
医師 2,000 人超の調査結果を多数掲載中です https://www.facebook.com/medpeer 2013 年 8 月 1 日 メドピア株式会社 マイコプラズマ感染症診断における迅速診断キットの使用状況 について 半数以上はキットを使用していない 医師約 6 万人が参加する医師専用サイト MedPeer ( メドピア https://medpeer.jp/) を運営するメドピア 株式会社
殺細胞性抗癌剤の副作用と発現時期 国立がん研究センターがん情報サービスより引用 herapy.html
 広島市立広島市民病院地域がん診療連携拠点病院 (K-net) 平成 30 年 1 月 18 日 ( 木 ) 第 74 回医療者がん研修会 新しい 免疫チェックポイント阻害剤について 免疫チェックポイント阻害薬のすべて Part2 ( 副作用編 ) 腫瘍内科岩本康男 殺細胞性抗癌剤の副作用と発現時期 国立がん研究センターがん情報サービスより引用 https://ganjoho.jp/public/dia_tre/attention/chemotherapy/about_chemot
広島市立広島市民病院地域がん診療連携拠点病院 (K-net) 平成 30 年 1 月 18 日 ( 木 ) 第 74 回医療者がん研修会 新しい 免疫チェックポイント阻害剤について 免疫チェックポイント阻害薬のすべて Part2 ( 副作用編 ) 腫瘍内科岩本康男 殺細胞性抗癌剤の副作用と発現時期 国立がん研究センターがん情報サービスより引用 https://ganjoho.jp/public/dia_tre/attention/chemotherapy/about_chemot
九州支部卒後研修会症例
 血液検査研修会 ( 第 25 回 ) 検査の異常から探る! 造血器腫瘍へのアプローチ 症例提示 症例 1~8 - 症例発表者 - 症例 1 藤崎恵熊本医療センター 症例 2 荒木敏造浜の町病院 症例 3 古城剛鹿児島大学病院 症例 4 佐々木高太郎都城健康サービスセンター 症例 5 矢田佳愛 大分県立病院 症例 6 下田博臣 健康保険諫早総合病院 症例 7 堤陽子 佐賀県医療センター好生館 症例 8
血液検査研修会 ( 第 25 回 ) 検査の異常から探る! 造血器腫瘍へのアプローチ 症例提示 症例 1~8 - 症例発表者 - 症例 1 藤崎恵熊本医療センター 症例 2 荒木敏造浜の町病院 症例 3 古城剛鹿児島大学病院 症例 4 佐々木高太郎都城健康サービスセンター 症例 5 矢田佳愛 大分県立病院 症例 6 下田博臣 健康保険諫早総合病院 症例 7 堤陽子 佐賀県医療センター好生館 症例 8
患者 ID: 氏名 : ピロリ菌外来説明文書 1. ピロリ菌はいつ誰によって発見されたのでしょうかピロリ菌はオーストラリアのウォレンとマーシャルによって 1983 年ヒトの胃の中から発見されました その後 ピロリ菌がヒトの胃に与える様々な影響が解明
 ピロリ菌外来 についてのお知らせ ( 平成 21 年 11 月開設 ) 平成 21 年 11 月より当院消化器内科外来において 保険適応のない方についてピロリ菌の判定 除菌を目的とする ピロリ菌外来を実施してきましたが 平成 26 年 4 月からは 内視鏡検査を 6 ヶ月以内に行った方については 原則すべての患者において保険診療でピロリ菌の除菌ができるようになりました しかしながら 保険診療では除菌治療は
ピロリ菌外来 についてのお知らせ ( 平成 21 年 11 月開設 ) 平成 21 年 11 月より当院消化器内科外来において 保険適応のない方についてピロリ菌の判定 除菌を目的とする ピロリ菌外来を実施してきましたが 平成 26 年 4 月からは 内視鏡検査を 6 ヶ月以内に行った方については 原則すべての患者において保険診療でピロリ菌の除菌ができるようになりました しかしながら 保険診療では除菌治療は
1 8 ぜ 表2 入院時検査成績 2 諺齢 APTT ALP 1471U I Fib 274 LDH 2971U 1 AT3 FDP alb 4 2 BUN 16 Cr K4 O Cl g dl O DLST 許 皇磯 二 図1 入院時胸骨骨髄像 低形成で 異常細胞は認め
 1 8 ぜ 表2 入院時検査成績 2 諺齢 APTT ALP 1471U I Fib 274 LDH 2971U 1 AT3 FDP 125 6 7 alb 4 2 BUN 16 Cr K4 O Cl g dl O 7 137 DLST 許 皇磯 二 図1 入院時胸骨骨髄像 低形成で 異常細胞は認められない PAIgG 177 3ng 107 cell meq 1 砂糖水試験 一 Fe 236 μg
1 8 ぜ 表2 入院時検査成績 2 諺齢 APTT ALP 1471U I Fib 274 LDH 2971U 1 AT3 FDP 125 6 7 alb 4 2 BUN 16 Cr K4 O Cl g dl O 7 137 DLST 許 皇磯 二 図1 入院時胸骨骨髄像 低形成で 異常細胞は認められない PAIgG 177 3ng 107 cell meq 1 砂糖水試験 一 Fe 236 μg
