悪性黒色腫の治療に個別化医療で貢献 - 抗悪性腫瘍剤 /BRAF 阻害剤 ゼルボラフ コバス BRAF V600 変異検出キット 説明会 - 中外製薬株式会社ロシュ ダイアグノスティックス株式会社
|
|
|
- のぶあき ふじがわ
- 5 years ago
- Views:
Transcription
1 悪性黒色腫の治療に個別化医療で貢献 - 抗悪性腫瘍剤 /BRAF 阻害剤 ゼルボラフ コバス BRAF V600 変異検出キット 説明会 - 中外製薬株式会社ロシュ ダイアグノスティックス株式会社
2 将来見通し 本プレゼンテーションには 中外製薬の事業及び展望に関する将来見通しが含まれていますが いずれも 既存の情報や様々な動向についての中外製薬による現時点での分析を反映しています 実際の業績は 事業に及ぼすリスクや不確定な事柄により現在の見通しと異なることもあります 本プレゼンテーションには 医薬品 ( 開発品を含む ) に関する情報が含まれていますが それらは宣伝 広告や医学的なアドバイスを目的とするものではありません 1
3 ゼルボラフ について 中外製薬株式会社ゼルボラフライフサイクルリーダー水井啓広
4 ゼルボラフ とは F. Hoffmann-La Roche 社およびPlexxikon Inc. が共同開発した BRAF V600キナーゼを選択的に阻害することにより抗腫瘍効果を発揮する低分子の分子標的薬 一般名 : ベムラフェニブ (Vemurafenib) (JAN) 分子量 : 化学名 : N-{3-[5-(4-Chlorophenyl) -1H-pyrrolo[2,3-b]pyridin-3-carbonyl] -2,4-difluorophenyl}propane-1-sulfonamide 3
5 ゼルボラフ 開発の経緯 年月海外国内 2006 年 11 月 2009 年 9 月 2010 年 1 月 2011 年 8 月 2012 年 2 月 2012 年 9 月 Roche 社および Plexxikon 社第 Ⅰ 相臨床試験 (PLX06-02 [BRIM1] 試験 ) 開始 第 Ⅱ 相臨床試験 (NP22657 [BRIM2] 試験 ) 開始 第 Ⅲ 相臨床試験 (NO25026 [BRIM3] 試験 ) 開始 米国で BRAF V600E 変異を有する治癒切除不能又は再発悪性黒色腫 に対する承認取得 欧州で BRAF V600 変異を有する治癒切除不能又は再発悪性黒色腫 に対する承認取得 2014 年 4 月 承認申請 2014 年 12 月 製造販売承認取得 中外製薬第 Ⅰ/Ⅱ 相臨床試験 (JO28178 試験 ) 開始 希少疾病用医薬品に指定 BRAF V600 変異の有無の検出は コバス BRAF V600 変異検出キットを用いて行う 米国では本剤のコンパニオン診断薬として (2011 年 8 月 ) EU では in vitro での診断薬として (2011 年 8 月 ) 承認されている 4
6 BRAF V600 変異キナーゼに対する選択性 (in vitro) 各種キナーゼに対するベムラフェニブの阻害活性 キナーゼ IC50 (nmol/l) BRAF V600E 8 CRAF 16 ARAF 29 BRAF WT 39 SRMS 18 ACK1 19 MAP4K5 (KHS1) 51 FGR 63 BRK 202 LCK 218 NEK FYN 533 KIT 538 BLK 547 LYNB 599 KDR 723 YES1 800 WNK3 877 STK3 (MST2) 891 LYNA 995 BRAF 変異 Source ATP (μmol/l) IC50 (nmol/l) V600E * Baculo 100 9, 9.9 V600A * Baculo , 14 V600D E. coli V600G Baculo V600K E. coli V600K Baculo V600M E. coli V600M Baculo V600R E. coli V600R Baculo K601E E. coli K601E Baculo T599I Baculo F595L Baculo E586K Baculo G464V Baculo 10 3 G469A Baculo 10 7 * 2 試験の結果 BRAF 変異キナーゼに対するベムラフェニブの阻害活性 承認時評価資料 5
7 BRAF V600 変異発現がん細胞における作用機序 増殖因子 正常な RAS RAF シグナル伝達 1) BRAF V600 変異発現がん細胞のシグナル伝達経路 2, 3) BRAF V600 変異発現がん細胞のシグナル伝達に対するベムラフェニブの阻害作用 3-5) 受容体型チロシンキナーゼ RAS-GTP BRAF BRAF V600 BRAF V600 ベムラフェニブ MEK MEK MEK ERK ERK ERK 細胞の正常な増殖および生存 細胞の増殖促進および生存助長 細胞の増殖抑制および細胞死の誘導 イメージ図 1) Garnett MJ, et al. Cancer Cell 2004, 6: ) Wan PTC, et al. Cell 2004, 116: ) Poulikakos PI, et al. Nature 2010, 464: ) Bollag G, et al. Nature 2010, 467: ) Yang H, et al. Cancer Res 2010, 70:
8 製剤について 規制区分 劇薬 処方箋医薬品注 ) 注 ) 注意 - 医師等の処方箋により使用すること貯法室温保存 吸湿注意 (PTP 包装のまま保存すること ) 使用期限 2 年 ( 包装に表示の使用期限内に使用すること ) 長径短径厚さ質量 約 19.1mm 約 9.7mm 約 7.4mm 870mg 2014 年 12 月 ( 第 1 版 ) 添付文書より作成 7
9 効能 効果 効能 効果 BRAF 遺伝子変異を有する根治切除不能な悪性黒色腫 < 効能 効果に関連する使用上の注意 > 1. 十分な経験を有する病理医又は検査施設における検査により BRAF 遺伝子変異が確認された患者に投与すること 検査にあたっては 承認された体外診断薬を用いること 2. 臨床成績 の項の内容を熟知し 本剤の有効性及び安全性を十分に理解した上で適応患者の選択を行うこと 3. 本剤の術後補助化学療法における有効性及び安全性は確立していない 2014 年 12 月 ( 第 1 版 ) 添付文書より作成 8
10 用法 用量 用法 用量 通常 成人にはベムラフェニブとして1 回 960mgを1 日 2 回経口投与する < 用法 用量に関連する使用上の注意 > 1. 副作用が発現した場合には 表 1の規定を参考にして減量 休薬すること ただし 有棘細胞癌 ( 皮膚の扁平上皮癌 ) 又は新たな原発性悪性黒色腫が発現した場合には 外科的切除等の適切な処置を行った上で 減量 休薬することなく治療の継続を可能とする また QT 間隔延長が発現した場合には 表 2の規定を参考にして減量 休薬すること 2. 食後に本剤を投与した場合 Cmax 及びAUCが増加するとの報告がある 食事の影響を避けるため 食事の1 時間前から食後 2 時間までの間の服用は避けることが望ましい ( 薬物動態 の項参照) 3. 他の抗悪性腫瘍剤との併用について 有効性及び安全性は確立していない 表 1 表 2 については添付文書を参照のこと 2014 年 12 月 ( 第 1 版 ) 添付文書より作成 9
11 承認条件 1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全症例を対象に使用成績調査を実施することにより 本剤使用患者の背景を把握するとともに 本剤の安全性及び有効性に関するデータを早期に収集し 本剤の適正使用に必要な措置を講じること 2014 年 12 月 ( 第 1 版 ) 添付文書より作成 10
12 コバス BRAF V600 変異検出キット ロシュ ダイアグノスティックス株式会社遺伝子検査部マネジャー小川徹 11
13 コンパニオン診断薬とは コバス BRAF V600 変異検出キット は ゼルボラフ のコンパニオン診断薬 研究用試薬 (RUO; Research Use Only) 体外診断用医薬品 (IVD; in vitro diagnostics) コンパニオン診断薬 (CoDx; Companion Diagnostics ) < コンパニオン診断薬 > 1 効果がより期待される患者を特定するため 2 特定の副作用が発現するおそれの高い患者を特定するため 3 用法 用量の最適化又は投与中止の判断を適切に実施するため 12
14 コバス BRAF V600 変異検出キットとはゼルボラフ の適応判定に使用 ゼルボラフ? 根治切除不能悪性黒色腫患者 コバス BRAF V600 変異検出キット ゼルボラフ の悪性黒色腫患者への適応を判定するためには コバス BRAF V600 変異検出キット を用いた遺伝子検査を行う必要がある コバス BRAF V600 変異検出キット 以外の遺伝子検査や免疫染色などでは ゼルボラフ の適応判定は行えない 13
15 添付文書上の各記載 コバス BRAF V600 変異検出キット 使用目的 癌組織から抽出したゲノム DNA 中の BRAF 遺伝子変異 (V600E) の検出 ( ベムラフェニブの悪性黒色腫患者への適応を判定するための補助に用いる ) ゼルボラフ 錠 < 効能 効果に関連する使用上の注意 > 十分な経験を有する病理医又は検査施設における検査により BRAF 遺伝子変異が確認された患者に投与すること 検査にあたっては 承認された体外診断薬を用いること 臨床成績 注 8) コンパニオン診断薬として製造販売承認されているコバス BRAF V600 変異検出キットを用いて検査された コバス BRAF V600 変異検出キット 添付文書より作成 ゼルボラフ 錠 240mg 添付文書より作成 14
16 BRAF V600 変異検出のための試薬 装置 コバス DNA サンプルプレパレーションキット (FFPE) コバス BRAF V600 変異検出キット cobas 4800 System z480 核酸抽出試薬増幅 検出試薬増幅 検出装置 15
17 コバス BRAF V600 変異検出キット製品スペック コバス BRAF V600 変異検出キット 使用目的 癌組織から抽出したゲノム DNA 中の BRAF 遺伝子変異 (V600E) の検出 ( ベムラフェニブの悪性腫瘍患者への適応を判定するための補助に用いる ) 変異検出の範囲エクソン 15 コドン 600 検体種核酸必要量方法感度装置 ホルマリン固定 パラフィン包埋 (FFPE) 組織 1 検体あたり125 ng リアルタイムPCR 抽出 DNA 中に5% の変異がある場合に検出可能 cobas 4800 z480 v2.1 以上 z480 処理能力 /run 94 検体 (8 バッチ / キット ) コバス BRAF V600 変異検出キット 添付文書より作成 16
18 測定 BRAF 遺伝子のエクソン 15 に位置するコドン 600 の変異を検出 BRAF 遺伝子 コドン エクソン : タンパク質に翻訳される領域イントロン : 翻訳されない領域 コドン各アミノ酸に対応する 3 塩基の配列 BRAF 蛋白質は 766 個のアミノ酸で構成されている 悪性黒色腫の多くは 遺伝子変異により 600 番目のアミノ酸であるバリン (V) が グルタミン酸 (E) アスパラギン酸 (D) リジン (K) などに変化している 本キットは V600E に加え V600D と K とも交差反応性を示す ロシュ ダイアグノスティックス社資料 17
19 4 key steps Step 1 Step 2 (1) H&E staining & tumor content determination Macro-dissect, if < 50% tumor content by area Sample Preparation Kit Genomic DNA isolation DNA quantification Step 4 Step 3 Standardized reporting Automated analysis PCR setup Harkanwal Halait, et al, Diagn Mol Pathol Volume 21, Number 1, March
20 測定結果のレポート 測定結果は自動的に解析され 定型フォームでレポートされる 測定バッチの情報 ( 測定日 キットのロット ) などが記載される コントロールのアッセイが成立していたことが確認できる 変異の有無が確認できる ( 変異のタイプは確認できない ) 19
21 Doing now what patients need next 20
22 ゼルボラフ 錠 製造販売後安全対策 中外製薬株式会社ファーマコビジランス部吉田真
23 説明内容 1. 安全対策実施の理由 2. 承認条件に基づく安全対策 医薬品リスク管理計画に基づく安全対策の実施 全症例を対象とした製造販売後調査の実施 3. その他の安全対策への取り組み 4. まとめ 22
24 1. 安全対策実施の理由 国内での治験症例が極めて限られている 国内第 Ⅰ/Ⅱ 相試験の投与例数は 11 例と限られているため 本剤の使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを早期に収集し 本剤の適正使用に必要な措置を講じる必要があります 有棘細胞癌 QT 間隔延長等の重篤な副作用発現の可能性がある 副作用発現状況 対処方法等の 適正使用に必要な情報を 医療関係者 患者さんに確実に提供する必要があります 化学療法に精通し 本剤のリスク等についても十分に管理できる医療機関 医師のもとでの投与となるよう 使用条件を設定する必要があります 製造販売後において 安全対策を厳重に行うことが 本剤の適正使用のために必要です 23
25 1. 安全対策実施の理由 添付文書 : 警告 警告 本剤は 緊急時に十分対応できる医療施設において がん化学療法に十分な知識 経験を持つ医師のもとで 本剤の使用が適切と判断される症例についてのみ投与すること また 治療開始に先立ち 患者又はその家族に有効性及び危険性を十分説明し 同意を得てから投与すること 添付文書 : 禁忌 禁忌( 次の患者には投与しないこと ) 本剤の成分に対し過敏症の既往歴のある患者 24
26 2. 承認条件に基づく安全対策 医薬品リスク管理計画書 (RMP) に基づく安全対策の実施医薬品リスク管理計画を策定の上 適切に実施すること 全症例を対象とした製造販売後調査の実施国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを早期に収集し 本剤の適正使用に必要な措置を講じること 25
27 2. 承認条件に基づく安全対策 医薬品リスク管理計画書 (RMP) 重要な特定されたリスク 重要な潜在的リスク 重要な不足情報 安全性検討事項 有棘細胞癌 有棘細胞癌以外の二次性悪性腫瘍 肝障害 光線過敏症 QT 間隔延長 皮膚障害 過敏症 眼障害 ( ブドウ膜炎等 ) RAS 遺伝子変異を有する悪性腫瘍の進行 顔面神経麻痺 骨髄抑制 消化管ポリープ 特になし 26
28 2. 承認条件に基づく安全対策 - 医薬品リスク管理計画に基づく安全対策の実施 医薬品リスク管理計画書 (RMP) 医薬品安全性監視活動 リスク最小化活動 通常 (1) 個別症例の収集 評価 (2) 研究報告 ( 文献等 ) (3) 外国措置報告 (4) 重篤有害事象の定期的シグナル検出及び評価 通常 添付文書の作成 ( 改訂 ) 患者さん向け医薬品ガイドの作成 ( 改訂 ) 追加 市販直後調査 特定使用成績調査 ( 全例調査 ) 製造販売後臨床試験 追加 市販直後調査による情報提供 医療関係者への情報提供 ( 適正使用ガイド ) 患者さんへの情報提供 ( 患者さん向けハンドブック ) 27
29 2. 承認条件に基づく安全対策 - 医薬品リスク管理計画に基づく安全対策の実施 医薬品安全性監視活動 : 市販直後調査 承認 発売開始 納入 納入から 2 週 発売開始から 6 カ月 納入前 MR 訪問説明 協力依頼 中外製薬 MR による協力依頼 定期的な情報提供 注意喚起 (1 回 /2 週 ) 発売開始からの6カ月間実施 医薬情報担当者が定期的に医療機関を訪問し 副作用発現についての情報収集 ならびに定期的な情報提供を実施 28
30 2. 承認条件に基づく安全対策 - 医薬品リスク管理計画に基づく安全対策の実施 リスク最小化活動 : 情報提供 医療従事者向けパンフレット 患者さん向けパンフレット 29
31 2. 承認条件に基づく安全対策 - 全症例を対象とした製造販売後調査の実施 調査目的 本剤の使用実態下での長期 (24 カ月 ) の観察における以下の事項の把握 副作用の発現率 未知の副作用 全生存期間 (OS) 安全性 有効性に影響を与えると考えられる要因 調査対象 登録期間中に本剤を使用したすべての患者さん 重点調査項目 有棘細胞癌 有棘細胞癌以外の二次性悪性腫瘍 QT 間隔延長 肝障害 皮膚障害 過敏症 調査予定症例数 500 例 症例登録期間 販売開始日 ~72 カ月 ( 登録症例数が調査予定症例数に到達した後も 全例調査に関する承認条件が解除されるまでは 症例の登録を継続 ) 30
32 3. その他の安全対策への取り組み 施設 使用予定医師に関する要件の確認 投与対象患者さんの慎重な選定 緊急時連絡カードの運用 31
33 3. その他の安全対策への取り組み 施設要件 施設 使用予定医師に関する要件の確認 1. 薬剤 ( ゼルボラフ ) で定める安全対策に理解 協力が得られている施設 2. 使用患者に状態悪化等があった場合 適切に緊急搬送 緊急処置を行うことができる施設 3. 自施設又は提携施設にて心電図検査及び循環器医による診断 評価が可能であり 緊急時の処置が可能である施設 4. 自施設又は提携施設にて眼科医による診断 評価が可能であり 適切な処置が可能である施設 5. 皮膚悪性腫瘍学会の所属医師又は皮膚悪性腫瘍指導専門医が在籍し治療に携わることが可能である施設 6. 治療中に有棘細胞癌 (cuscc) 等の皮膚腫瘍が発現した場合 自施設で外科的切除 病理診断を適切に実施可能である施設 7. 自施設又は検査会社にて体外診断薬として承認されたBRAF 遺伝子検査が可能である施設 8. 自施設又は提携施設にて二次発癌の評価 診断として以下の検査等を実施可能である施設 [CT 検査 X 線検査 MRI 検査 消化器内視鏡検査 頭頸部検査 婦人科検査 ] 医師要件 1. 中外製薬担当者の定期訪問が可能な医師 2. 本剤の安全対策に協力が可能な医師 3. 悪性黒色腫の手術又は化学療法の治療経験を有する医師 32
34 3. その他の安全対策への取り組み 投与対象患者さんの慎重な選定 33
35 3. その他の安全対策への取り組み 緊急時連絡カードの運用 ゼルボラフの調剤を受ける際には必ず本カードの提示が必要となります 本剤の処方時に主治医より患者さんに本カードの交付をお願いしています [ 表面 : 発現時に連絡を要する副作用 ] [ 裏面 : 緊急連絡先 ] 34
36 4. まとめ 安全対策実施の理由 国内での治験症例が極めて限られている 重篤な副作用発現の可能性がある 安全確保のための取り組み 承認条件に基づく安全対策 医薬品リスク管理計画に基づく安全対策の実施 全症例を対象とした製造販売後調査の実施 その他の安全対策への取り組み 35
37 悪性黒色腫の概要と ベムラフェニブ臨床試験 国立がん研究センター中央病院皮膚腫瘍科科長山﨑直也
38 主な皮膚悪性腫瘍の特徴 基底細胞癌 basal cell carcinoma 有棘細胞癌 squamous cell carcinoma 悪性黒色腫 ( メラノーマ ) malignant melanoma 乳房外 Paget 病 Paget disease 紫外線などが誘因となり 高齢者の顔面に好発 転移はまれで 生命予後は良好 治療は外科的切除が基本 角化細胞の悪性増殖による癌 露光部に好発 硬い結節でしばしば壊死 潰瘍化し悪臭を伴う 治療は外科的切除とリンパ節郭清 放射線療法 抗悪性腫瘍薬投与 日光角化症や Bowen 病が発生母地となることが多い リンパ行性 血行性に転移しやすい すべての皮膚腫瘍の 4% を占めるにすぎないが 皮膚腫瘍により死亡する患者の 80% を占め きわめて悪性度の高い癌腫の一つ 治療は外科的切除 放射線療法 化学療法 分子標的治療 免疫療法 アポクリン腺由来の表皮内癌 外陰部や肛門部 腋窩に好発 治療は外科的切除が原則 清水宏. あたらしい皮膚科学第 2 版 ( 中山書店 ) 2011, p , , 457 より作表 37
39 女性( 人 /10 万人 年 ) 性メラノーマの罹患率 死亡率 : 人種別 全人種 白人 男 黒人 アジア人 / 太平洋諸島の住民 アメリカインディアン / アラスカ原住民 ヒスパニック 非ヒスパニック (%) 罹患率 (2007~2011 年 ) (%) 死亡率 (2006~2010 年 ) SEER18 Registry data set を SEER Stat ver8.0.1 を用いて解析 SEER Stat Fact Sheets: Melanoma of the Skin( 38
40 日本におけるメラノーマの死亡数 (1972~2013 年 ) 700 (1972~2013 年までの死亡の総数 ) 数( 人 ) 男性女性総数 (8,448) (7,548) (15,996) 死 厚生労働大臣官房統計情報部. 人口動態統計, 1972~2013 亡( 年 )
41 メラノーマ病期分類 (UICC 2002) の割合 切除不能 Stage 切除可能 Stage 4% 8% 9% 9% 11% Tis 18% Stage Ia Stage Ib Stage Ⅱa Stage Ⅱb 13% Stage Ⅱc Stage Ⅲa Stage Ⅲb Stage Ⅲc 9% Stage Ⅳ 10% 9% Fujisawa Y et al. Skin Cancer 2008;
42 診療アルゴリズム皮膚悪性腫瘍診療ガイドライン 発生予防危険因子スクリーニング 臨床所見ダーモスコピー 臨床診断困難 生検 診断確定 組織診断 術前検査 化学療法対象 遠隔転移なし 遠隔転移あり Tis, T1a * DTIC 原発巣切除 T1b 以上 ** センチネルリンパ節転移なし 臨床的なリンパ節転移なし 原発巣切除 + センチネルリンパ節生検 センチネルリンパ節転移あり 術後補助療法 経過観察 臨床的なリンパ節転移あり 原発巣切除 + 根治的リンパ節郭清 ( 小数個の転移 )( 肝転移のみ ) 転移巣の外科的切除 肝動注臨床試験放射線緩和ケア DTIC: ダカルバジン * Tis:melanoma in situ ( 上皮内黒色腫 ) 病変 T1a:Tumor thickness 1mm 以下 潰瘍なし レベル Ⅲ 以下 のすべての条件を満たす原発巣 ** T1b 以上 :Tumor thickness 1mm 超 あるいは潰瘍あり あるいはレベル Ⅳ 以上の原発巣 日本皮膚科学会作成皮膚悪性腫瘍診療ガイドライン ( 41
43 メラノーマの治療成績 化学療法にきわめて抵抗性で 進行期メラノーマの標準薬とされる DTIC( ダカルバジン ) も奏効率は10~20% 程度である 放射線治療にも概して抵抗性である 年版 UICC 病期別にみた日本人メラノーマ患者の生存曲線 病期 Ⅰ(n=264) 90% 全生存率 (%) 期間 ( 月 ) 病期 Ⅱ(n=295) 72% 病期 Ⅲ(n=155) 54% 病期 Ⅳ(n=87) 7% 病期 Ⅰ p< 病期 Ⅱ p= 病期 Ⅲ p< 病期 Ⅳ (log-rank 検定 ) Ishihara K, et al. Int J Clin Oncol 2008, 13: 斎田俊明ほか編著. 皮膚科サブスペシャリティーシリーズ 1 冊でわかる皮膚がん ( 文光堂 ) 2011, p
44 メラノーマの病型分類 (Clark 分類 ) 結節型黒色腫 (Nodular melanoma:nm) 表在拡大型黒色腫 (Superficial spreading melanoma:ssm) 末端黒子型黒色腫 (Acral lentiginous melanoma:alm) 悪性黒子型黒色腫 (Lentigo maligna melanoma:lmm) 個別性の異型メラノサイト 異型メラノサイトの胞巣 あたらしい皮膚科学第 2 版 ( 中山書店 ) 2011, p 斎田俊明ほか編著. 皮膚科サブスペシャリティーシリーズ 1 冊でわかる皮膚がん ( 文光堂 ) 2011, p222,
45 メラノーマの病型別頻度 結節型 (NM) 表在拡大型 (SSM) 末端黒子型 (ALM) 悪性黒子型 (LMM) 粘膜 日本 1) 11.5% 25.7% 49.0% 10.0% 3.8% (%) 1.0% 米国 2) 14.0% 63.0% 12.0% 9.0% (%) 1) 日本皮膚悪性腫瘍学会編. 皮膚悪性腫瘍取扱い規約第 2 版 ( 金原出版 ) 2010, p ) 藤澤康弘, 大塚藤男. 日本臨牀 2013, 71(Suppl 4):
46 メラノーマの遺伝子異常 メラノーマの主なシグナル伝達経路と各遺伝子異常の頻度 1) PTEN 不活性化 30%~50% RAS RTK 増殖因子 NRAS 変異 15% GPCR α γ β GNAQ 変異ブドウ膜メラノーマ患者の 50% 細胞膜 細胞質 PI3K RAF BRAF 変異 50%~70% ( 国内 :30%~40%) 2,3) GEFT 増幅 30% Akt1 IκB MEK1/2 MPK1 RAC PAK RHO ROCK mtor NFκB ERK1/2 LIMK MLC 翻訳 転写 (CDK4 CCND1 BCL2) 生存 増殖 転移 血管新生 1) Bello DM, et al: Cancer Control 20: , ) Ashida A., et al.: J Dermatol Sci. 66 (3): , ) Yamazaki N., et al.: Melanoma Res. 25 (1): 9-14,
47 診療アルゴリズム皮膚悪性腫瘍診療ガイドライン 発生予防危険因子スクリーニング 臨床所見ダーモスコピー 臨床診断困難 生検 診断確定 組織診断 術前検査 化学療法対象 Tis, T1a * 遠隔転移なし 遠隔転移あり DTIC ニボルマブベムラフェニブ 原発巣切除 T1b 以上 ** センチネルリンパ節転移なし 臨床的なリンパ節転移なし 原発巣切除 + センチネルリンパ節生検 センチネルリンパ節転移あり 術後補助療法 経過観察 臨床的なリンパ節転移あり 原発巣切除 + 根治的リンパ節郭清 ( 小数個の転移 )( 肝転移のみ ) 転移巣の外科的切除 肝動注臨床試験放射線緩和ケア DTIC: ダカルバジン * Tis:melanoma in situ ( 上皮内黒色腫 ) 病変 T1a:Tumor thickness 1mm 以下 潰瘍なし レベル Ⅲ 以下 のすべての条件を満たす原発巣 ** T1b 以上 :Tumor thickness 1mm 超 あるいは潰瘍あり あるいはレベル Ⅳ 以上の原発巣 日本皮膚科学会作成皮膚悪性腫瘍診療ガイドライン ( 46
48 海外第 Ⅲ 相臨床試験 (NO25026[BRIM3] 試験 ) 試験デザイン 化学療法歴のない BRAF V600 変異を有する注 1) 根治切除不能な Ⅲ 期 /Ⅳ 期の悪性黒色腫患者 (n=675) 層別因子 : 地域 ECOG PS 転移状態分類 LDH R 1:1 ベムラフェニブ 960mg/ 回 1 日 2 回連日経口投与 (n=337) ダカルバジン注 2) 1,000mg/m 2 iv 3 週毎 (n=338) PD PD 注 1) コンパニオン診断薬として製造販売承認されているコバス BRAF V600 変異検出キットを用いて検査された 注 2) この用法 用量は 本邦においては承認されていない 主要評価項目 :PFS OS 副次評価項目 : 奏効率 奏効期間 奏効までの期間 安全性など 有効性の効果判定は主治医判定のみ 承認時評価資料 Chapman PB, et al. N Engl J Med 2011, 364:
49 患者背景海外第 Ⅲ 相臨床試験 (NO25026[BRIM3] 試験 ) ダカルバジン群 (n=338) ベムラフェニブ群 (n=337) 男性 181 (54%) 200 (59%) 年齢中央値 ( 範囲 ) 52.5 歳 (17-86 歳 ) 56.0 歳 (21-86 歳 ) 転移状態分類 Ⅳ 期 :M1a Ⅳ 期 :M1b Ⅳ 期 :M1c 切除不能 ⅢC 期 病型表在拡大型悪性黒子型末端黒子型結節型その他 ECOG PS 0 1 血清 LDH 基準値内高値 40 (12%) 65 (19%) 220 (65%) 13 (4%) 109 (32%) 5 (1%) 3 (<1%) 78 (23%) 143 (42%) 230 (68%) 108 (32%) 196 (58%) 142 (42%) 34 (10%) 62 (18%) 221 (66%) 20 (6%) 104 (31%) 1 (<1%) 1 (<1%) 78 (23%) 153 (45%) 229 (68%) 108 (32%) 195 (58%) 142 (42%) 承認時評価資料 Chapman PB, et al. N Engl J Med 2011, 364:
50 無増悪生存期間 ( 主要解析時 ) 海外第 Ⅲ 相臨床試験 (NO25026[BRIM3] 試験 ) 無増悪生存 率 期間 ベムラフェニブ群 (n=275) ダカルバジン群 (n=274) HR 0.26(95%CI ) p< 非層別 log-rank 検定 リスク患者数 ダカルバジン群 ベムラフェニブ群 イベント数 104 (37.8%) 182 (66.4%) 12 ( 月 ) 主治医判定 RECIST ver. 1.1 カットオフ日 :2010 年 12 月 30 日 承認時評価資料 Chapman PB, et al. N Engl J Med 2011, 364:
51 全生存期間 ( 主要解析時 ) 海外第 Ⅲ 相臨床試験 (NO25026[BRIM3] 試験 ) ベムラフェニブ群 (n=336) ダカルバジン群 (n=336) HR 0.37(95%CI ) p< 非層別 log-rank 検定 イベント数 43 (12.8%) 75 (22.3%) 全生存0 0.6 率 期間 リスク患者数 ダカルバジン群 ベムラフェニブ群 カットオフ日 :2010 年 12 月 30 日 承認時評価資料 Chapman PB, et al. N Engl J Med 2011, 364: ( 月 ) 50
52 奏効率 奏効期間 ( 主要解析時 ) 海外第 Ⅲ 相臨床試験 (NO25026[BRIM3] 試験 ) ダカルバジン群 (n=220) ベムラフェニブ群 (n=219) p 値 (Schouten χ 2 検定 ) 奏効例数奏効率 (95% CI) %( ) %( ) < CR PR SD PD 0 (0.0%) 12 (5.5%) 53 (24.1%) 103 (46.8%) 2 (0.9%) 104 (47.5%) 81 (37.0%) 23 (10.5%) 奏効期間中央値 (95% CI) NR (4.60-NR) 5.49 ヵ月 ( ) NR: 未到達 カットオフ日 :2010 年 12 月 30 日 承認時評価資料 Chapman PB, et al. N Engl J Med 2011, 364:
53 腫瘍長径和のベースラインからの変化率 ( 主要解析時 ) 海外第 Ⅲ 相臨床試験 (NO25026[BRIM3] 試験 ) ベムラフェニブ群 (n=209) からの変化ベースライン 率50 (%) 転移状態分類切除不能 ⅢC 期 Ⅳ 期 :M1a Ⅳ 期 :M1b Ⅳ 期 :M1c n=219 奏効例数 ( 例 ) 106 奏効率 (%) 48.4 CR( 例 ) 2 PR( 例 ) 104 奏効までの期間中央値 ( 月 ) 1.45 ダカルバジン群 (n=158) からの変化ベースライン 率50 (%) 転移状態分類切除不能 ⅢC 期 Ⅳ 期 : M1a Ⅳ 期 : M1b Ⅳ 期 : M1c n=220 奏効例数 ( 例 ) 12 奏効率 (%) 5.5 CR( 例 ) 0 PR( 例 ) 12 奏効までの期間中央値 ( 月 ) 2.72 カットオフ日 :2010 年 12 月 30 日 Chapman PB, et al. N Engl J Med 2011, 364:
54 安全性 ( 主要解析時 ) 海外第 Ⅲ 相臨床試験 (NO25026[BRIM3] 試験 ) 全 Grade Grade 3 以上の有害事象 Grade 4 の有害事象 Grade 5 の有害事象重篤な有害事象投与中止に至った有害事象休薬または用量変更に至った有害事象すべての死亡 * 病勢進行以外による死亡 ゼルボラフに特徴的な有害事象皮膚有棘細胞癌発疹光線過敏症関節痛疲労肝機能検査値異常 QT 間隔延長 * 最終投与から 28 日以内 ダカルバジン群 (n=289) における解析 ダカルバジン群 (n=282) 253 (89.7%) 86 (30.5%) 22 (7.8%) 6 (2.1%) 45 (16.0%) 12 (4.3%) 44 (15.6%) 16 (5.5%) 1 (0.3%) 1 (0.4%) 10 (3.5%) 10 (3.5%) 9 (3.2%) 108 (38.3%) 13 (4.6%) 16 (5.7%) ベムラフェニブ群 (n=336) 326 (97.0%) 168 (50.0%) 13 (3.9%) 6 (1.8%) 110 (32.7%) 19 (5.7%) 129 (38.4%) 22 (6.5%) 4 (1.2%) 62 (18.5%) 202 (60.1%) 124 (36.9%) 165 (49.1%) 138 (41.1%) 59 (17.6%) 28 (8.3%) カットオフ日 :2010 年 12 月 30 日 承認時評価資料 Chapman PB, et al. N Engl J Med 2011, 364:
55 有害事象 ( 発現率 10% 以上 ) 海外第 Ⅲ 相臨床試験 (NO25026[BRIM3] 試験 ) ダカルバジン群 (n=282) ベムラフェニブ群 (n=336) 全 Grade Grade 3 以上 全 Grade Grade 3 以上 有害事象がみられた患者 253 (89.7%) 86 (30.5%) 326 (97.0%) 168 (50.0%) 悪心 115 (40.8%) 5 (1.8%) 101 (30.1%) 4 (1.2%) 疲労 87 (30.9%) 5 (1.8%) 112 (33.3%) 6 (1.8%) 関節痛 9 (3.2%) 2 (0.7%) 165 (49.1%) 11 (3.3%) 発疹 3 (1.1%) (36.0%) 28 (8.3%) 脱毛症 6 (2.1%) (34.8%) 1 (0.3%) 下痢 34 (12.1%) 1 (0.4%) 84 (25.0%) 2 (0.6%) 嘔吐 67 (23.8%) 3 (1.1%) 50 (14.9%) 4 (1.2%) 光線過敏性反応 10 (3.5%) (30.1%) 9 (2.7%) 頭痛 26 (9.2%) - 72 (21.4%) 2 (0.6%) 便秘 65 (23.0%) - 32 (9.5%) - 発熱 25 (8.9%) 2 (0.7%) 59 (17.6%) 2 (0.6%) 掻痒症 4 (1.4%) - 74 (22.0%) 5 (1.5%) 食欲減退 20 (7.1%) - 53 (15.8%) - 過角化 (19.9%) 4 (1.2%) 末梢性浮腫 13 (4.6%) - 50 (14.9%) 1 (0.3%) 四肢痛 17 (6.0%) 5 (1.8%) 45 (13.4%) 1 (0.3%) 皮膚乳頭腫 (18.5%) 1 (0.3%) 皮膚乾燥 3 (1.1%) - 54 (16.1%) - 味覚異常 9 (3.2%) - 44 (13.1%) - 筋肉痛 4 (1.4%) - 39 (11.6%) - 紅斑 4 (1.4%) - 38 (11.3%) - 皮膚有棘細胞癌 1 (0.4%) 1 (0.4%) 40 (11.9%) 38 (11.3%) 好中球減少症 32 (11.3%) 24 (8.5%) 2 (0.6%) 1 (0.3%) 事象名は MedDRA ver 重症度判定は NCI-CTCAE ver. 4.0 による カットオフ日 :2010 年 12 月 30 日承認時評価資料 Chapman PB, et al. N Engl J Med 2011, 364:
56 まとめ海外第 Ⅲ 相臨床試験 (NO25026[BRIM3] 試験 ) 化学療法歴のない BRAF V600 変異を有する根治切除不能な Ⅲ 期 / Ⅳ 期の悪性黒色腫患者に対し 標準療法のダカルバジンに比べてベムラフェニブは OS PFS および奏効率を有意に改善した ダカルバジン群に対して 病勢増悪または死亡のリスクは 74% 減少し PFS を有意に延長した ダカルバジン群に対して 死亡リスクは 63% 減少し OS を有意に延長した 奏効率は ダカルバジン群 (5.5%) に比べてベムラフェニブ群 (48.4%) で有意に高かった ベムラフェニブの投与は概ね忍容性があり 有害事象の多くは休薬もしくは用量変更を行うことで対処可能であった 承認時評価資料 Chapman PB, et al. N Engl J Med 2011, 364:
57 国内第 Ⅰ/Ⅱ 相臨床試験 (JO28178 試験 ) 試験デザイン BRAF V600 変異を有する注 ) 根治切除不能な悪性黒色腫患者 (n=11) ステップ 1 ベムラフェニブ 960mg/ 回 1 日 2 回連日経口投与 (n=3) ステップ 2 ベムラフェニブ 960mg/ 回 1 日 2 回連日経口投与 (n=8) 有効性解析対象 : ステップ2の8 例安全性解析対象 : ステップ1+2の11 例 効果安全性評価委員会ステップ 1 症例の安全性を確認 ステップ1 (n=3) 主要評価項目 : 初期安全性 副次評価項目 : 腫瘍縮小効果 安全性 薬物動態 用量強度 ステップ2 (n=8) 主要評価項目 : 奏効率 (IRC * 判定 ) 副次評価項目 : 奏効期間 (IRC 判定 ) 病勢コントロール率 (IRC 判定 ) PFS (IRC 判定 ) OS 安全性など 注 ) コンパニオン診断薬として製造販売承認されているコバス BRAF V600 変異検出キットを用いて検査された * IRC: 効果判定委員会 承認時評価資料 56
58 患者背景 ( ステップ 1 2) 国内第 Ⅰ/Ⅱ 相臨床試験 (JO28178 試験 ) ステップ 1(n=3) ステップ (n=8) 男性 2 (66.7%) 1 (12.5%) 年齢中央値 ( 範囲 ) 51.0 歳 (38-68 歳 ) 45.0 歳 (23-62 歳 ) 再発時の臨床病期 病型 ECOG PS 0 1 血清 LDH Ⅲ 期 Ⅳ 期 表在拡大型悪性黒子型末端黒子型結節型その他 基準値内高値 前治療歴ありダカルバジン ( 単剤または併用療法 ) n=2-2 (100.0%) 1 (33.3%) - 1 (33.3%) - 1 (33.3%) 3 (100.0%) - 3 (100.0%) - 3 (100.0%) 3 (100.0%) n=7 1 (14.3%) 6 (85.7%) 2 (25.0%) 1 (12.5%) 1 (12.5%) 1 (12.5%) 3 (37.5%) 6 (75.0%) 2 (25.0%) 5 (62.5%) 3 (37.5%) 7 (87.5%) 6 (75.0%) 承認時評価資料 57
59 有効性のまとめ ( ステップ 2) 国内第 Ⅰ/Ⅱ 相臨床試験 (JO28178 試験 ) 解析対象例数奏効例数 最良総合効果 CR PR SD NE IRC 判定 8 例 6 例 0 例 6 例 1 例 1 例 奏効期間 中央値 * ( 日 ) [95% CI] ** 59.0 [56.0-NR] 奏効までの期間 中央値 * ( 日 ) [95% CI] 29.0 [ ] PFS 中央値 * ( 日 ) [95% CI] ** NR [84.0-NR] OS 中央値 * ( 日 ) [95% CI] ** NR [116.0-NR] RECIST ver. 1.1 カットオフ日 :2013 年 8 月 29 日 NR: 未到達 * Kaplan-Meier 法で推定 ** Brookmeyer and Crowley 法で 95%CI を算出 承認時評価資料 58
60 安全性 ( ステップ 1 2) 国内第 Ⅰ/Ⅱ 相臨床試験 (JO28178 試験 ) 全 Grade Grade 1 の有害事象 Grade 2 の有害事象 Grade 3 の有害事象 Grade 4 以上の有害事象重篤な有害事象投与中止に至った有害事象休薬または用量変更に至った有害事象すべての死亡 * 病勢進行以外による死亡 ベムラフェニブに特徴的な有害事象皮膚有棘細胞癌発疹光線過敏症関節痛疲労肝機能障害 QT 間隔延長 カットオフ日 :2013 年 8 月 29 日 * 最終投与から 28 日以内 ベムラフェニブ (n=11) 11 (100%) 11 (100%) 7 (63.6%) 3 (27.3%) - 1 (9.1%) - 6 (54.5%) 1 (9.1%) (90.9%) 3 (27.3%) 10 (90.9%) 6 (54.5%) 5 (45.5%) 3 (27.3%) 承認時評価資料 59
61 有害事象 ( 発現率 10% 以上 )( ステップ 1 2) 国内第 Ⅰ/Ⅱ 相臨床試験 (JO28178 試験 ) 全 Grade Grade 3 以上 有害事象がみられた患者 11 (100.0%) 3 (27.3%) 関節痛 10 (90.9%) - 筋肉痛 7 (63.6%) - 脱毛症 7 (63.6%) - 発疹 5 (45.5%) - 斑状丘疹状皮疹 5 (45.5%) 1 (9.1%) 食欲減退 4 (36.4%) - 疲労 4 (36.4%) - 肝障害 3 (27.3%) 1 (9.1%) 手掌 足底発赤知覚不倦怠感 3 (27.3%) - 全症候群 2 (18.2%) - 光線過敏性反応 3 (27.3%) - 掌蹠角皮症 2 (18.2%) - 口腔咽頭痛 3 (27.3%) - 心電図 QT 延長 2 (18.2%) - 紅斑 3 (27.3%) - 皮膚乳頭腫 2 (18.2%) - 頭痛 3 (27.3%) - 末梢性浮腫 2 (18.2%) - 嘔吐 2 (18.2%) - 事象名はMedDRA ver 重症度判定はNCI-CTCAE ver. 4.03による カットオフ日 :2013 年 8 月 29 日 全 Grade Grade 3 以上 発熱 3 (27.3%) - 鼻咽頭炎 3 (27.3%) - 稗粒腫 3 (27.3%) - 不眠症 3 (27.3%) - 味覚異常 3 (27.3%) - 悪心 2 (18.2%) - 過角化 2 (18.2%) - 紫斑 2 (18.2%) - 承認時評価資料 60
62 まとめ国内第 Ⅰ/Ⅱ 相臨床試験 (JO28178 試験 ) BRAF V600 変異を有する根治切除不能な悪性黒色腫患者 ( 日本人 ) を対象に ベムラフェニブ 960mg/ 回 1 日 2 回連日経口投与の有効性および安全性を検討した ステップ 2 における IRC 判定による奏効例数は 6 例であり 臨床的に意義のある効果が確認された ベムラフェニブは 日本人の悪性黒色腫患者に対しても有効性が期待できると考えられた 安全性解析対象集団 ( ステップ 1+ ステップ 2) において 投与中止に至った有害事象は認められず 忍容性を示した 承認時評価資料 61
63 中外製薬 : 広報 IR 部 お問い合わせ先 報道関係者の皆様 : メディアリレーションズグループ Tel : pr@chugai-pharm.co.jp 担当 : 原田 荒木 吉村 三義 投資家の皆様 : インベスターリレーションズグループ Tel : ir@chugai-pharm.co.jp 担当 : 笹井 櫻井 清水 時田 ロシュ ダイアグノスティックス 報道関係者の皆様 : 総合企画管理部門広報グループ Tel : tokyo.pr@roche.com 担当 : 荒川 川口
環境変化への業界側取組 ~CU制度に係るパイロット試験での経験から~
 環境変化への業界側取組 ~CU 制度に係るパイロット試験での経験から ~ 中外製薬株式会社オンコロジーライフサイクルマネジメント部水井啓広 2015.6.20 本日の内容 ベムラフェニブについて CU制度に係るパイロット試験 Expand Access Program : EAP EAP概略 EAP実施における製薬会社側の課題 今後に向けて 製薬会社への影響 当局やアカデミアとの連携の重要性 1 ベムラフェニブとは
環境変化への業界側取組 ~CU 制度に係るパイロット試験での経験から ~ 中外製薬株式会社オンコロジーライフサイクルマネジメント部水井啓広 2015.6.20 本日の内容 ベムラフェニブについて CU制度に係るパイロット試験 Expand Access Program : EAP EAP概略 EAP実施における製薬会社側の課題 今後に向けて 製薬会社への影響 当局やアカデミアとの連携の重要性 1 ベムラフェニブとは
タフィンラーカプセル50mg/75mg、メキニスト錠0.5mg/2mg 添付文書改訂のお知らせ
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 添付文書改訂のお知らせ 製造販売 2018 年 7 月 このたび 標記製品の効能又は効果の一部変更承認に伴い 添付文書の記載内容を改訂いたしましたのでお知らせいたします 今後のご使用に際しましてご参照下さいますようお願い申し上げます 効能又は効果 ( タフィンラーカプセル メキニスト錠共通 ) 改訂後 (2018 年 7 月改訂 ) 効能又は効果
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 添付文書改訂のお知らせ 製造販売 2018 年 7 月 このたび 標記製品の効能又は効果の一部変更承認に伴い 添付文書の記載内容を改訂いたしましたのでお知らせいたします 今後のご使用に際しましてご参照下さいますようお願い申し上げます 効能又は効果 ( タフィンラーカプセル メキニスト錠共通 ) 改訂後 (2018 年 7 月改訂 ) 効能又は効果
PowerPoint プレゼンテーション
 コンパニオン診断の現状 ~ 肺がんを例に ~ 2017 年 7 月 29 日 個別化医療に必要なコンパニオン診断薬 コンパニオン診断薬 ~ 肺癌治療を例に ~ NGS によるコンパニオン診断システム 個別化医療の概念 効果と安全性の両面で優れた治療法として世界的に関心が高まっており 特にがん治療などにおいて 今後の中心的役割を担うものと考えられています 薬剤投与前にバイオマーカーと呼ばれる特定の分子や遺伝子を診断し
コンパニオン診断の現状 ~ 肺がんを例に ~ 2017 年 7 月 29 日 個別化医療に必要なコンパニオン診断薬 コンパニオン診断薬 ~ 肺癌治療を例に ~ NGS によるコンパニオン診断システム 個別化医療の概念 効果と安全性の両面で優れた治療法として世界的に関心が高まっており 特にがん治療などにおいて 今後の中心的役割を担うものと考えられています 薬剤投与前にバイオマーカーと呼ばれる特定の分子や遺伝子を診断し
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
性黒色腫は本邦に比べてかなり高く たとえばオーストラリアでは悪性黒色腫の発生率は日本の 100 倍といわれており 親戚に一人は悪性黒色腫がいるくらい身近な癌といわれています このあと皮膚癌の中でも比較的発生頻度の高い基底細胞癌 有棘細胞癌 ボーエン病 悪性黒色腫について本邦の統計データを詳しく紹介し
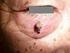 2012 年 12 月 6 日放送 第 111 回日本皮膚科学会総会 5 教育講演 20-1 皮膚腫瘍の最新疫学データ 筑波大学大学院皮膚科 講師藤澤康弘 はじめに皮膚癌は国立がん研究センターがとりまとめている全国集計データでも年々増加の一途をたどっており なかでも高齢者の患者の増加が目立ちます 日常の皮膚科診療でも遭遇する機会が今後も増え続けることから その発生状況を知っておくことは役に立つと思います
2012 年 12 月 6 日放送 第 111 回日本皮膚科学会総会 5 教育講演 20-1 皮膚腫瘍の最新疫学データ 筑波大学大学院皮膚科 講師藤澤康弘 はじめに皮膚癌は国立がん研究センターがとりまとめている全国集計データでも年々増加の一途をたどっており なかでも高齢者の患者の増加が目立ちます 日常の皮膚科診療でも遭遇する機会が今後も増え続けることから その発生状況を知っておくことは役に立つと思います
悪性黒色腫(メラノーマ)薬物療法の手引き version
 一般社団法人日本皮膚悪性腫瘍学会 悪性黒色腫 ( メラノーマ ) 薬物療法の手引き version1. 2019 2014 年における免疫チェックポイント阻害薬である抗 PD-1 抗体ニボルマブと低分子性分子標的薬である BRAF 阻害薬ベムラフェニブの相次ぐ製造販売承認に端を発する新規薬剤の開発の成功と実地臨床への応用によって 進行期の悪性黒色腫に対する薬物療法は画期的かつ急激な変革期を迎えた このような薬物療法の進化を受けて
一般社団法人日本皮膚悪性腫瘍学会 悪性黒色腫 ( メラノーマ ) 薬物療法の手引き version1. 2019 2014 年における免疫チェックポイント阻害薬である抗 PD-1 抗体ニボルマブと低分子性分子標的薬である BRAF 阻害薬ベムラフェニブの相次ぐ製造販売承認に端を発する新規薬剤の開発の成功と実地臨床への応用によって 進行期の悪性黒色腫に対する薬物療法は画期的かつ急激な変革期を迎えた このような薬物療法の進化を受けて
1)表紙14年v0
 NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
<4D F736F F D2089BB8A7797C C B B835888E790AC8C7689E6>
 2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
0238 モダンメディア 61 巻 8 号 2015[ 臨床検査アップデート ] Up date Detection of BRAF V600 in melanoma う宇 はらひさし原久 Hisashi UHARA はじめに 2014 年 12 月にコンパニオン診断薬 コバス BRAF V600
![0238 モダンメディア 61 巻 8 号 2015[ 臨床検査アップデート ] Up date Detection of BRAF V600 in melanoma う宇 はらひさし原久 Hisashi UHARA はじめに 2014 年 12 月にコンパニオン診断薬 コバス BRAF V600 0238 モダンメディア 61 巻 8 号 2015[ 臨床検査アップデート ] Up date Detection of BRAF V600 in melanoma う宇 はらひさし原久 Hisashi UHARA はじめに 2014 年 12 月にコンパニオン診断薬 コバス BRAF V600](/thumbs/102/152968649.jpg) 0238 モダンメディア 61 巻 8 号 2015[ 臨床検査アップデート ] Up date Detection of BRAF V600 in melanoma う宇 はらひさし原久 Hisashi UHARA はじめに 2014 年 12 月にコンパニオン診断薬 コバス BRAF V600 変異検出キット が根治切除不能な悪性黒色腫患者に対する検査法として承認され 本年 2 月より発売された
0238 モダンメディア 61 巻 8 号 2015[ 臨床検査アップデート ] Up date Detection of BRAF V600 in melanoma う宇 はらひさし原久 Hisashi UHARA はじめに 2014 年 12 月にコンパニオン診断薬 コバス BRAF V600 変異検出キット が根治切除不能な悪性黒色腫患者に対する検査法として承認され 本年 2 月より発売された
本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制 3. 遺伝子パネルを用いた NGS コンパニオン診断システム 1 2 規制上の取扱い 評価の考え方 2
 わが国での NGS 診断パネル承認の考え方 独立行政法人医薬品医療機器総合機構上席審議役 ( 機器審査等担当 ) 佐藤岳幸 本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制 3. 遺伝子パネルを用いた NGS コンパニオン診断システム 1 2 規制上の取扱い 評価の考え方 2 本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制
わが国での NGS 診断パネル承認の考え方 独立行政法人医薬品医療機器総合機構上席審議役 ( 機器審査等担当 ) 佐藤岳幸 本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制 3. 遺伝子パネルを用いた NGS コンパニオン診断システム 1 2 規制上の取扱い 評価の考え方 2 本日の講演内容 1. PMDA コンパニオン診断薬 WG 2. 本邦におけるコンパニオン診断薬の規制
一次サンプル採取マニュアル PM 共通 0001 Department of Clinical Laboratory, Kyoto University Hospital その他の検体検査 >> 8C. 遺伝子関連検査受託終了項目 23th May EGFR 遺伝子変異検
 Department of Clinical Laboratory, Kyoto University Hospital 6459 8. その他の検体検査 >> 8C. 遺伝子関連検査受託終了項目 23th May. 2017 EGFR 遺伝子変異検査 ( 院内測定 ) c-erbb/egfr [tissues] 基本情報 8C051 c-erbb/egfr JLAC10 診療報酬 分析物 識別材料測定法
Department of Clinical Laboratory, Kyoto University Hospital 6459 8. その他の検体検査 >> 8C. 遺伝子関連検査受託終了項目 23th May. 2017 EGFR 遺伝子変異検査 ( 院内測定 ) c-erbb/egfr [tissues] 基本情報 8C051 c-erbb/egfr JLAC10 診療報酬 分析物 識別材料測定法
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
<4D F736F F D2091E D A8CC48B7A8AED93E089C8>
 BRAF 変異陽性肺癌の最近の話題 ( 責京都 学医学部附属病院呼吸器内科阪森優 ) はじめに近年 細胞肺癌において がんを 配している原因遺伝 (Oncogenic driver mutations) の同定が 治療における重要な要素となっている 例えば EGFR 遺伝 変異に対して アファチニブ ゲフィチニブ エルロチニブ ALK 融合遺伝 に対してクリゾチニブ セリチニブ アレクチニブといった薬剤が登場し
BRAF 変異陽性肺癌の最近の話題 ( 責京都 学医学部附属病院呼吸器内科阪森優 ) はじめに近年 細胞肺癌において がんを 配している原因遺伝 (Oncogenic driver mutations) の同定が 治療における重要な要素となっている 例えば EGFR 遺伝 変異に対して アファチニブ ゲフィチニブ エルロチニブ ALK 融合遺伝 に対してクリゾチニブ セリチニブ アレクチニブといった薬剤が登場し
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
関係があると報告もされており 卵巣明細胞腺癌において PI3K 経路は非常に重要であると考えられる PI3K 経路が活性化すると mtor ならびに HIF-1αが活性化することが知られている HIF-1αは様々な癌種における薬理学的な標的の一つであるが 卵巣癌においても同様である そこで 本研究で
 ( 様式甲 5) 氏 名 髙井雅聡 ( ふりがな ) ( たかいまさあき ) 学 位 の 種 類 博士 ( 医学 ) 学位授与番号 甲 第 号 学位審査年月日 平成 27 年 7 月 8 日 学位授与の要件 学位規則第 4 条第 1 項該当 Crosstalk between PI3K and Ras pathways via 学位論文題名 Protein Phosphatase 2A in human
( 様式甲 5) 氏 名 髙井雅聡 ( ふりがな ) ( たかいまさあき ) 学 位 の 種 類 博士 ( 医学 ) 学位授与番号 甲 第 号 学位審査年月日 平成 27 年 7 月 8 日 学位授与の要件 学位規則第 4 条第 1 項該当 Crosstalk between PI3K and Ras pathways via 学位論文題名 Protein Phosphatase 2A in human
頭頚部がん1部[ ].indd
![頭頚部がん1部[ ].indd 頭頚部がん1部[ ].indd](/thumbs/92/108881798.jpg) 1 1 がん化学療法を始める前に がん化学療法を行うときは, その目的を伝え なぜ, 化学療法を行うか について患者の理解と同意を得ること ( インフォームド コンセント ) が必要である. 病理組織, 病期が決定したら治療計画を立てるが, がん化学療法を治療計画に含める場合は以下の場合である. 切除可能であるが, 何らかの理由で手術を行わない場合. これには, 導入として行う場合と放射線療法との併用で化学療法を施行する場合がある.
1 1 がん化学療法を始める前に がん化学療法を行うときは, その目的を伝え なぜ, 化学療法を行うか について患者の理解と同意を得ること ( インフォームド コンセント ) が必要である. 病理組織, 病期が決定したら治療計画を立てるが, がん化学療法を治療計画に含める場合は以下の場合である. 切除可能であるが, 何らかの理由で手術を行わない場合. これには, 導入として行う場合と放射線療法との併用で化学療法を施行する場合がある.
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
症例報告書の記入における注意点 1 必須ではない項目 データ 斜線を引くこと 未取得 / 未測定の項目 2 血圧平均値 小数点以下は切り捨てとする 3 治験薬服薬状況 前回来院 今回来院までの服薬状況を記載する服薬無しの場合は 1 日投与量を 0 錠 とし 0 錠となった日付を特定すること < 演習
 ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生年月日 住所 M T S H 西暦 電話番号 年月日 ( ) - 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 ( ) - 家族構成 ( ) - ( ) - ( ) - ( ) - 担当医情報 医
 佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
学位論文の内容の要旨 論文提出者氏名 小川憲人 論文審査担当者 主査田中真二 副査北川昌伸 渡邉守 論文題目 Clinical significance of platelet derived growth factor -C and -D in gastric cancer ( 論文内容の要旨 )
 学位論文の内容の要旨 論文提出者氏名 小川憲人 論文審査担当者 主査田中真二 副査北川昌伸 渡邉守 論文題目 Clinical significance of platelet derived growth factor -C and -D in gastric cancer ( 論文内容の要旨 ) < 要旨 > platelet derived growth factor (PDGF 血小板由来成長因子)-C,
学位論文の内容の要旨 論文提出者氏名 小川憲人 論文審査担当者 主査田中真二 副査北川昌伸 渡邉守 論文題目 Clinical significance of platelet derived growth factor -C and -D in gastric cancer ( 論文内容の要旨 ) < 要旨 > platelet derived growth factor (PDGF 血小板由来成長因子)-C,
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん
 米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
ペムブロリズマブ ( 遺伝子組換え ) 注射剤 2.7 臨床概要 臨床的有効性 ORR 海外 001 試験 パート D パート D では 治験担当医師がベースライン時点で測定可能病変ありとし 独立中央判定
 2.7.3.3.2.3 ORR 2.7.3.3.2.3.1 海外 001 試験 2.7.3.3.2.3.1.1 パート D パート D では 治験担当医師がベースライン時点で測定可能病変ありとし 独立中央判定機関ではなしと判定された患者が11 例 (10.7%) であったため FAS は APaT 集団とは異なる FAS BOR の解析結果を治験総括報告書第 2 版 [ 資料 5.3.5.2.1.2:
2.7.3.3.2.3 ORR 2.7.3.3.2.3.1 海外 001 試験 2.7.3.3.2.3.1.1 パート D パート D では 治験担当医師がベースライン時点で測定可能病変ありとし 独立中央判定機関ではなしと判定された患者が11 例 (10.7%) であったため FAS は APaT 集団とは異なる FAS BOR の解析結果を治験総括報告書第 2 版 [ 資料 5.3.5.2.1.2:
がん登録実務について
 平成 28 年度東京都がん登録説明会資料 2-1 がん登録届出実務について (1) 1. 届出対象 2. 届出候補見つけ出し 3. 診断日 4. 届出票の作成例示 東京都地域がん登録室 1 1. 届出対象 1 原発部位で届出 2 入院 外来を問わず 当該腫瘍に対して 自施設を初診し 診断あるいは治療の対象 ( 経過観察を含む ) となった腫瘍を届出 3 届出対象となった腫瘍を 1 腫瘍 1 届出の形で届出
平成 28 年度東京都がん登録説明会資料 2-1 がん登録届出実務について (1) 1. 届出対象 2. 届出候補見つけ出し 3. 診断日 4. 届出票の作成例示 東京都地域がん登録室 1 1. 届出対象 1 原発部位で届出 2 入院 外来を問わず 当該腫瘍に対して 自施設を初診し 診断あるいは治療の対象 ( 経過観察を含む ) となった腫瘍を届出 3 届出対象となった腫瘍を 1 腫瘍 1 届出の形で届出
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
Microsoft Word - LIA RMP_概要ver2.docx
 リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14 回 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 29 年 10 月 1.1. 安全性検討事項 重要な特
 レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
して広く用いられてきました この Clark 分類に異を唱えたのが Bernard Ackerman であります Ackerman は 1980 年に発表した malignant melanoma: a unifying concept と題する論文において Clark らの病型分類は無意味であると
 2010 年 5 月 20 日放送第 73 回日本皮膚科学会東部支部学術大会 4 シンポジウム3より メラノーマ研究の進歩と課題 信州大学名誉教授斎田俊明 はじめに欧米白人の世界では暫く前からメラノーマ患者の急増が大きな問題となっておりますが 我が国でもメラノーマ患者は着実に増加しております 厚生労働省の人口動態統計によれば メラノーマによる死亡患者数は この 30 年間で約 5 倍に増加しております
2010 年 5 月 20 日放送第 73 回日本皮膚科学会東部支部学術大会 4 シンポジウム3より メラノーマ研究の進歩と課題 信州大学名誉教授斎田俊明 はじめに欧米白人の世界では暫く前からメラノーマ患者の急増が大きな問題となっておりますが 我が国でもメラノーマ患者は着実に増加しております 厚生労働省の人口動態統計によれば メラノーマによる死亡患者数は この 30 年間で約 5 倍に増加しております
<4D F736F F D20838A838A815B83588E9197BF B837B E8E8CB18C8B89CA82F094AD955C E646F6378>
 各位 2014 年 11 月 19 日 PD-1 免疫チェックポイント阻害薬として初めて第 3 相臨床試験での全生存期間の改善を示した未治療の進行期悪性黒色腫患者に対してオプジーボ ( ニボルマブ ) と化学療法を比較する試験結果について ニュージャージー州プリンストン 2014 年 11 月 16 日 ) ブリストル マイヤーズスクイブ社 (NYSE: BMY) は本日 未治療の BRAF 野生型の進行期悪性黒色腫患者
各位 2014 年 11 月 19 日 PD-1 免疫チェックポイント阻害薬として初めて第 3 相臨床試験での全生存期間の改善を示した未治療の進行期悪性黒色腫患者に対してオプジーボ ( ニボルマブ ) と化学療法を比較する試験結果について ニュージャージー州プリンストン 2014 年 11 月 16 日 ) ブリストル マイヤーズスクイブ社 (NYSE: BMY) は本日 未治療の BRAF 野生型の進行期悪性黒色腫患者
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
本日の内容 1. 本邦におけるコンパニオン診断システムの規制 2. NGSを用いたコンパニオン診断システム 1 規制上の取扱い 2 評価の考え方と検討課題 3. NGSを用いた遺伝子検査システムに関連した課題 2
 次世代シークエンサーを用いたコンパニオン診断システムの開発における課題と今後の方向性について 独立行政法人医薬品医療機器総合機構体外診断薬審査室柳原玲子 本日の内容 1. 本邦におけるコンパニオン診断システムの規制 2. NGSを用いたコンパニオン診断システム 1 規制上の取扱い 2 評価の考え方と検討課題 3. NGSを用いた遺伝子検査システムに関連した課題 2 PMDA 横断的基準作成等プロジェクトチーム
次世代シークエンサーを用いたコンパニオン診断システムの開発における課題と今後の方向性について 独立行政法人医薬品医療機器総合機構体外診断薬審査室柳原玲子 本日の内容 1. 本邦におけるコンパニオン診断システムの規制 2. NGSを用いたコンパニオン診断システム 1 規制上の取扱い 2 評価の考え方と検討課題 3. NGSを用いた遺伝子検査システムに関連した課題 2 PMDA 横断的基準作成等プロジェクトチーム
学位論文の内容の要旨 論文提出者氏名 佐藤雄哉 論文審査担当者 主査田中真二 副査三宅智 明石巧 論文題目 Relationship between expression of IGFBP7 and clinicopathological variables in gastric cancer (
 学位論文の内容の要旨 論文提出者氏名 佐藤雄哉 論文審査担当者 主査田中真二 副査三宅智 明石巧 論文題目 Relationship between expression of IGFBP7 and clinicopathological variables in gastric cancer ( 論文内容の要旨 ) < 要旨 > Insulin-like growth factor ( 以下 IGF)
学位論文の内容の要旨 論文提出者氏名 佐藤雄哉 論文審査担当者 主査田中真二 副査三宅智 明石巧 論文題目 Relationship between expression of IGFBP7 and clinicopathological variables in gastric cancer ( 論文内容の要旨 ) < 要旨 > Insulin-like growth factor ( 以下 IGF)
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
Microsoft Word - tmp_input.doc
 アバスチン 2.7.3 臨床的有効性の概要 Page 19 2.7.3.2.4 NO16966 試験 (FOLFOX-4 療法及び XELOX 療法との併用による無作為化比較試験, 一次治療 ) 本試験は転移性結腸 直腸癌の一次治療例を対象とした第 Ⅲ 相臨床試験であり, 当初,XELOX 療法 (L-OHP/ カペシタビン ) と FOLFOX-4 療法 (L-OHP/5-FU/LV) の非盲検比較試験として開始されたが
アバスチン 2.7.3 臨床的有効性の概要 Page 19 2.7.3.2.4 NO16966 試験 (FOLFOX-4 療法及び XELOX 療法との併用による無作為化比較試験, 一次治療 ) 本試験は転移性結腸 直腸癌の一次治療例を対象とした第 Ⅲ 相臨床試験であり, 当初,XELOX 療法 (L-OHP/ カペシタビン ) と FOLFOX-4 療法 (L-OHP/5-FU/LV) の非盲検比較試験として開始されたが
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
DRAFT#9 2011
 報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
適正使用のお願い この適正使用ガイドは ゼルボラフ 錠 240mg( 以下ゼルボラフ ) を適正に使用していただくため 適正な患者選択のために必要な検査 発現する可能性のある副作用とその対策について解説したものです ゼルボラフの使用に際しましては 最新版の製品添付文書及び本適正使用ガイドを熟読の上
 適正使用のお願い この適正使用ガイドは ゼルボラフ 錠 240mg( 以下ゼルボラフ ) を適正に使用していただくため 適正な患者選択のために必要な検査 発現する可能性のある副作用とその対策について解説したものです ゼルボラフの使用に際しましては 最新版の製品添付文書及び本適正使用ガイドを熟読の上 適正使用をお願い致します ゼルボラフ ( 一般名 : ベムラフェニブ ) は 600 番目のコドンに変異を有する
適正使用のお願い この適正使用ガイドは ゼルボラフ 錠 240mg( 以下ゼルボラフ ) を適正に使用していただくため 適正な患者選択のために必要な検査 発現する可能性のある副作用とその対策について解説したものです ゼルボラフの使用に際しましては 最新版の製品添付文書及び本適正使用ガイドを熟読の上 適正使用をお願い致します ゼルボラフ ( 一般名 : ベムラフェニブ ) は 600 番目のコドンに変異を有する
販売名 ベージニオ 錠に係る医薬品リスク管理計画書 (RMP) の概要 ベージニオ錠 50mg ベージニオ錠 100mg ベージニオ錠 150mg 有効成分 アベマシクリブ 製造販売業者 日本イーライリリー株式会社 薬効分類 提出年月 平成 30 年 9 月 ( 別紙様式 ) 1.1
 ベージニオ錠 50mg ベージニオ錠 100mg ベージニオ錠 150mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は日本イーライリリー株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 日本イーライリリー株式会社 販売名 ベージニオ 錠に係る医薬品リスク管理計画書 (RMP) の概要 ベージニオ錠 50mg ベージニオ錠 100mg
ベージニオ錠 50mg ベージニオ錠 100mg ベージニオ錠 150mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は日本イーライリリー株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 日本イーライリリー株式会社 販売名 ベージニオ 錠に係る医薬品リスク管理計画書 (RMP) の概要 ベージニオ錠 50mg ベージニオ錠 100mg
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
第71巻5・6号(12月号)/投稿規定・目次・表2・奥付・背
 μ μ μ μ μ γ 1 4 3 クリゾチニブが奏効した PS 不良 ALK 肺癌の1例 図2 入院時胸部 CT a 左鎖骨上窩 縦隔リンパ節腫大を認めた 矢印 b 左腕頭静脈から上大静脈内まで続く血栓 を認めた 矢印 c 左下葉に腫瘤影を認めた d 右肺に内部に空洞を伴う結節影を多数認めた 矢印 率は蛍光 in situ ハイブリダイゼーション FISH 法で 6 8 1 5 であり ALK 蛋白の免疫組織化学染色
μ μ μ μ μ γ 1 4 3 クリゾチニブが奏効した PS 不良 ALK 肺癌の1例 図2 入院時胸部 CT a 左鎖骨上窩 縦隔リンパ節腫大を認めた 矢印 b 左腕頭静脈から上大静脈内まで続く血栓 を認めた 矢印 c 左下葉に腫瘤影を認めた d 右肺に内部に空洞を伴う結節影を多数認めた 矢印 率は蛍光 in situ ハイブリダイゼーション FISH 法で 6 8 1 5 であり ALK 蛋白の免疫組織化学染色
70 頭頸部放射線療法 放射線化学療法
 頭頸部放射線療法 放射線化学療法の患者への歯科治療 口腔ケア (1) 総論 1) 頭頸部の放射線 化学放射線療法の特徴 2) 頭頸部がん放射線療法による口腔への影響 3) 頭頸部放射線療法における歯科の役割 (2) 放射線治療による口腔合併症 ( 有害事象 ) と対処 1) 局所療法と急性 晩期障害 2) 口腔粘膜炎 3) 口腔乾燥症 4) 歯性感染症 カンジダ性口内炎 5) 味覚異常 6) 放射線性骨髄炎
頭頸部放射線療法 放射線化学療法の患者への歯科治療 口腔ケア (1) 総論 1) 頭頸部の放射線 化学放射線療法の特徴 2) 頭頸部がん放射線療法による口腔への影響 3) 頭頸部放射線療法における歯科の役割 (2) 放射線治療による口腔合併症 ( 有害事象 ) と対処 1) 局所療法と急性 晩期障害 2) 口腔粘膜炎 3) 口腔乾燥症 4) 歯性感染症 カンジダ性口内炎 5) 味覚異常 6) 放射線性骨髄炎
改訂前 用法 用量 多発性骨髄腫デキサメタゾンとの併用において 通常 成人にはレナリドミドとして 1 日 1 回 25 mg を 21 日間連日経口投与した後 7 日間休薬する これを 1 サイクルとして投与を繰り返す なお 患者の状態により適宜減量する 5 番染色体長腕部欠失を伴う骨髄異形成症候群
 レブラミド カプセル 2.5mg 5mg 医薬品の適正使用に欠かせない情報です 必ずお読みください 平成 29 年 3 月 効能 効果 及び 用法 用量 の一部変更 使用上の注意改訂のお知らせ 製造販売元 : セルジーン株式会社 この度 標記製品について 効能 効果 を 再発又は難治性の成人 T 細胞白血病リンパ腫 とする承認事項一部変更が承認されたことに伴い 効能 効果 及び 用法 用量 を追加し
レブラミド カプセル 2.5mg 5mg 医薬品の適正使用に欠かせない情報です 必ずお読みください 平成 29 年 3 月 効能 効果 及び 用法 用量 の一部変更 使用上の注意改訂のお知らせ 製造販売元 : セルジーン株式会社 この度 標記製品について 効能 効果 を 再発又は難治性の成人 T 細胞白血病リンパ腫 とする承認事項一部変更が承認されたことに伴い 効能 効果 及び 用法 用量 を追加し
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認され
 ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
 一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
販売名 製造販売業者 ジャクスタピッドカプセル 5mg 10mg 20mg に係る医薬品リスク管理計画書 (RMP) の概要 ジャクスタピッドカプセル 5mg 10mg 20mg AEGERION PHARMACEUTICALS 株式会社提出年月 有効成分 ロミタピドメシル酸塩 薬効分類 87218
 ジャクスタピッドカプセル 5mg ジャクスタピッドカプセル 10mg ジャクスタピッドカプセル 20mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は AEGERION PHARMACEUTICALS 株式 会社にあります 当該情報を適正使用以外の営利目的に利用することはできません AEGERION PHARMACEUTICALS 株式会社 販売名 製造販売業者
ジャクスタピッドカプセル 5mg ジャクスタピッドカプセル 10mg ジャクスタピッドカプセル 20mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は AEGERION PHARMACEUTICALS 株式 会社にあります 当該情報を適正使用以外の営利目的に利用することはできません AEGERION PHARMACEUTICALS 株式会社 販売名 製造販売業者
<303491E592B BC92B08AE02E786C73>
 ( 注意 ) : 複数選択 : 単一選択 * 複数治療がある場合は 別シートをご利用下さい 担癌状態の評価 今回の血清採取時 ( 登録時または追跡調査時 ) に担癌状態 ( がんが存在する状態 ) か ( 医師への確認を はい いいえ 前提として下さい ) はい の場合( 複数回答可 ) 手術前 非根治手術後 手術不能 化学療法または放射線治療中 もしくは治療後 ホルモン療法中もしくは治療後 治療後の再燃
( 注意 ) : 複数選択 : 単一選択 * 複数治療がある場合は 別シートをご利用下さい 担癌状態の評価 今回の血清採取時 ( 登録時または追跡調査時 ) に担癌状態 ( がんが存在する状態 ) か ( 医師への確認を はい いいえ 前提として下さい ) はい の場合( 複数回答可 ) 手術前 非根治手術後 手術不能 化学療法または放射線治療中 もしくは治療後 ホルモン療法中もしくは治療後 治療後の再燃
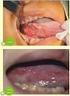
2010 年 12 月 2 日放送第 109 回日本皮膚科学会総会 9 教育講演 19 メラノーマのすべて より メラノーマの早期診断と治療方針 岡田整形外科 皮膚科 眼科髙田実はじめに悪性黒色腫は転移しやすく 悪性度の高いがんとして恐れられていますが 他のがんと同じく早期発見 早期治療が適切に行わ
 2010 年 12 月 2 日放送第 109 回日本皮膚科学会総会 9 教育講演 19 メラノーマのすべて より メラノーマの早期診断と治療方針 岡田整形外科 皮膚科 眼科髙田実はじめに悪性黒色腫は転移しやすく 悪性度の高いがんとして恐れられていますが 他のがんと同じく早期発見 早期治療が適切に行われればほぼ 100% 治癒させることが可能です 本稿では悪性黒色腫の早期診断のポイントと病期別の治療指針についてお話いたします
2010 年 12 月 2 日放送第 109 回日本皮膚科学会総会 9 教育講演 19 メラノーマのすべて より メラノーマの早期診断と治療方針 岡田整形外科 皮膚科 眼科髙田実はじめに悪性黒色腫は転移しやすく 悪性度の高いがんとして恐れられていますが 他のがんと同じく早期発見 早期治療が適切に行われればほぼ 100% 治癒させることが可能です 本稿では悪性黒色腫の早期診断のポイントと病期別の治療指針についてお話いたします
法医学問題「想定問答」(記者会見後:平成15年 月 日)
 平成 28 年 5 月 26 日 肺がんに対する新たな分子標的治療を発見! 本研究成果のポイント 肺がんのうち 5% 程度を占める KRAS( 1) 遺伝子変異肺がんは, 上皮間葉移行 ( 2) 状態により上皮系と間葉系の 2 種類に分類される KRAS 遺伝子変異を有する肺がんに対し現在臨床試験中の MEK 阻害薬は, 投与後に細胞表面受容体を活性化することにより効果が減弱され, 活性化される細胞表面受容体は上皮間葉移行状態により異なる
平成 28 年 5 月 26 日 肺がんに対する新たな分子標的治療を発見! 本研究成果のポイント 肺がんのうち 5% 程度を占める KRAS( 1) 遺伝子変異肺がんは, 上皮間葉移行 ( 2) 状態により上皮系と間葉系の 2 種類に分類される KRAS 遺伝子変異を有する肺がんに対し現在臨床試験中の MEK 阻害薬は, 投与後に細胞表面受容体を活性化することにより効果が減弱され, 活性化される細胞表面受容体は上皮間葉移行状態により異なる
ケブザラ皮下注 150mg/200mg シリンジに係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 ケブザラ皮下注 150mg シリンジ 2 ケブザラ皮下注 200mg シリンジ 有効成分 サリルマブ ( 遺伝子組換え ) 製造販売業者 サノフィ株式会社 薬効分類 399 提出年月 平成
 ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジに係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 ケブザラ皮下注 150mg シリンジ
ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジに係る医薬品リスク管理計画書 (RMP) の概要 販売名 1 ケブザラ皮下注 150mg シリンジ
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
ケブザラ皮下注 150mg/200mg シリンジ ケブザラ皮下注 150mg/200mg オートインジェクターに係る医薬品リスク管理計画書 (RMP) の概要 販売名 製造販売業者 1 ケブザラ皮下注 150mg シリンジ 2 ケブザラ皮下注 200mg シリンジ 3 ケブザラ皮下注 150mg オ
 ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジケブザラ皮下注 150mgオートインジェクターケブザラ皮下注 200mgオートインジェクターに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジ
ケブザラ皮下注 150mgシリンジケブザラ皮下注 200mgシリンジケブザラ皮下注 150mgオートインジェクターケブザラ皮下注 200mgオートインジェクターに係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はサノフィ株式会社にあります 当該情報を適正使用以外の営利目的で利用することはできません サノフィ株式会社 ケブザラ皮下注 150mg/200mg シリンジ
「 」 説明および同意書
 EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
がんの治療
 資料 1-1 がんの治療 1 がんとは 正常な細胞は 増殖や分裂が制御され 増えすぎないようになっている がんは 制御が外れ 制限なく増殖するようになった細胞のこと がん細胞は 体の異なる場所に 転移 したり 臓器の境を越えて 浸潤 する がんが進行すると 死亡に至る 日本人の死因のトップである ( 昭和 56 年から ) 高齢者に多い 国立がん研究センターがん対策情報センターホームページより抜粋
資料 1-1 がんの治療 1 がんとは 正常な細胞は 増殖や分裂が制御され 増えすぎないようになっている がんは 制御が外れ 制限なく増殖するようになった細胞のこと がん細胞は 体の異なる場所に 転移 したり 臓器の境を越えて 浸潤 する がんが進行すると 死亡に至る 日本人の死因のトップである ( 昭和 56 年から ) 高齢者に多い 国立がん研究センターがん対策情報センターホームページより抜粋
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
Microsoft Word - sa_niflec_ doc
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
TITLE IN HERE, ARIAL 14 BOLD, CAPS
 報道関係者各位 アストラゼネカ株式会社 アストラゼネカ 本邦初のステージ III 非小細胞肺がんにおける抗 PD-L1 抗体 イミフィンジ ( デュルバルマブ ) の販売を開始 アストラゼネカ株式会社 ( 本社 : 大阪市北区 代表取締役社長 : ステファン ヴォックスストラム 以下 アストラゼネカ ) は本日 切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法 を効能 効果とした
報道関係者各位 アストラゼネカ株式会社 アストラゼネカ 本邦初のステージ III 非小細胞肺がんにおける抗 PD-L1 抗体 イミフィンジ ( デュルバルマブ ) の販売を開始 アストラゼネカ株式会社 ( 本社 : 大阪市北区 代表取締役社長 : ステファン ヴォックスストラム 以下 アストラゼネカ ) は本日 切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法 を効能 効果とした
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
1. Caov-3 細胞株 A2780 細胞株においてシスプラチン単剤 シスプラチンとトポテカン併用添加での殺細胞効果を MTS assay を用い検討した 2. Caov-3 細胞株においてシスプラチンによって誘導される Akt の活性化に対し トポテカンが影響するか否かを調べるために シスプラチ
 ( 様式甲 5) 学位論文内容の要旨 論文提出者氏名 論文審査担当者 主査 朝日通雄 恒遠啓示 副査副査 瀧内比呂也谷川允彦 副査 勝岡洋治 主論文題名 Topotecan as a molecular targeting agent which blocks the Akt and VEGF cascade in platinum-resistant ovarian cancers ( 白金製剤耐性卵巣癌における
( 様式甲 5) 学位論文内容の要旨 論文提出者氏名 論文審査担当者 主査 朝日通雄 恒遠啓示 副査副査 瀧内比呂也谷川允彦 副査 勝岡洋治 主論文題名 Topotecan as a molecular targeting agent which blocks the Akt and VEGF cascade in platinum-resistant ovarian cancers ( 白金製剤耐性卵巣癌における
301128_課_薬生薬審発1128第1号_ニボルマブ(遺伝子組換え)製剤の最適使用推進ガイドラインの一部改正について
 薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
シダキュアスギ舌下錠 2,000JAU 5,000JAU に係る医薬品リスク管理計画書 (RMP) の概要 販売名 シダキュアスギ舌下錠 2,000JAU,5,000JAU 有効成分 スギ花粉エキス原末 承認取得者名 鳥居薬品株式会社 薬効分類 提出年月 平成 30 年 8 月 1.1.
 シダキュアスギ舌下錠 2,000JAU シダキュアスギ舌下錠 5,000JAU に係る医薬品リスク管理計画書 本資料に記載された情報に関する権利及び内容についての責任は 鳥居薬品株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 鳥居薬品株式会社 1 シダキュアスギ舌下錠 2,000JAU 5,000JAU に係る医薬品リスク管理計画書 (RMP) の概要 販売名 シダキュアスギ舌下錠
シダキュアスギ舌下錠 2,000JAU シダキュアスギ舌下錠 5,000JAU に係る医薬品リスク管理計画書 本資料に記載された情報に関する権利及び内容についての責任は 鳥居薬品株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 鳥居薬品株式会社 1 シダキュアスギ舌下錠 2,000JAU 5,000JAU に係る医薬品リスク管理計画書 (RMP) の概要 販売名 シダキュアスギ舌下錠
がん化学(放射線)療法レジメン申請書
 申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名呼吸器外科がん腫 ( コード ) 診療科長名 申請医師名 審査区分 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区分使用分類適応分類
申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名呼吸器外科がん腫 ( コード ) 診療科長名 申請医師名 審査区分 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区分使用分類適応分類
300828_課_薬生薬審発0828第1号_デュルバルマブ(遺伝子組換え)製剤の最適使用推進ガイドライン(非小細胞肺癌)について
 薬生薬審発 0828 第 1 号平成 3 0 年 8 月 2 8 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) デュルバルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 ) について 経済財政運営と改革の基本方針 2016( 平成 28 年 6 月 2 日閣議決定 ) において 革新的医薬品の使用の最適化推進を図ることが盛り込まれたことを受けて
薬生薬審発 0828 第 1 号平成 3 0 年 8 月 2 8 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) デュルバルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 ) について 経済財政運営と改革の基本方針 2016( 平成 28 年 6 月 2 日閣議決定 ) において 革新的医薬品の使用の最適化推進を図ることが盛り込まれたことを受けて
より詳細な情報を望まれる場合は 担当の医師または薬剤師におたずねください また 患者向医薬品ガイド 医療専門家向けの 添付文書情報 が医薬品医療機器総合機構のホームページに掲載されています
 くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
(事務連絡)公知申請に係る前倒し保険適用通知
 保医発 0425 第 1 号 平成 30 年 4 月 25 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において
保医発 0425 第 1 号 平成 30 年 4 月 25 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において
がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2013/6/17 受付番号 診療科名 脳神経外科 がん腫 ( コード ) 診療科長名 申請医師名 レジメン登録ナンバー 登録申請日 審査区分 ( 下記をチェックしてください ) 登
 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2013/6/17 受付番号 診療科名 脳神経外科 がん腫 ( コード ) 診療科長名 申請医師名 レジメン登録ナンバー 登録申請日 審査区分 ( 下記をチェックしてください ) 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります
がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2013/6/17 受付番号 診療科名 脳神経外科 がん腫 ( コード ) 診療科長名 申請医師名 レジメン登録ナンバー 登録申請日 審査区分 ( 下記をチェックしてください ) 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります
審議結果報告書 平成 30 年 3 月 8 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] タフィンラーカプセル50 mg 同カプセル75 mg [ 一 般 名 ] ダブラフェニブメシル酸塩 [ 申請者名 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 12 月 5 日
![審議結果報告書 平成 30 年 3 月 8 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] タフィンラーカプセル50 mg 同カプセル75 mg [ 一 般 名 ] ダブラフェニブメシル酸塩 [ 申請者名 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 12 月 5 日 審議結果報告書 平成 30 年 3 月 8 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] タフィンラーカプセル50 mg 同カプセル75 mg [ 一 般 名 ] ダブラフェニブメシル酸塩 [ 申請者名 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 12 月 5 日](/thumbs/95/123835541.jpg) 審議結果報告書 平成 30 年 3 月 8 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] タフィンラーカプセル50 mg 同カプセル75 mg [ 一 般 名 ] ダブラフェニブメシル酸塩 [ 申請者名 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 12 月 5 日 [ 審議結果 ] 平成 30 年 3 月 2 日に開催された医薬品第二部会において 本品目の一部変更承認申請を承認して差し支えないとされ
審議結果報告書 平成 30 年 3 月 8 日医薬 生活衛生局医薬品審査管理課 [ 販 売 名 ] タフィンラーカプセル50 mg 同カプセル75 mg [ 一 般 名 ] ダブラフェニブメシル酸塩 [ 申請者名 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 12 月 5 日 [ 審議結果 ] 平成 30 年 3 月 2 日に開催された医薬品第二部会において 本品目の一部変更承認申請を承認して差し支えないとされ
日本内科学会雑誌第96巻第4号
 β 図 1A.rituximab による再発 indolentlymphoma に対する治療成績 (PFS)( 文献 9 より ) 図 1B. 初発濾胞性リンパ腫に対する rituximab による治療成績 ( 評価可能全 49 例の progression-freesurvival, 文献 10 より ) 図 2. 濾胞性リンパ腫に対する rituximab の単剤投与後の rituximab
β 図 1A.rituximab による再発 indolentlymphoma に対する治療成績 (PFS)( 文献 9 より ) 図 1B. 初発濾胞性リンパ腫に対する rituximab による治療成績 ( 評価可能全 49 例の progression-freesurvival, 文献 10 より ) 図 2. 濾胞性リンパ腫に対する rituximab の単剤投与後の rituximab
ス化した さらに 正常から上皮性異形成 上皮性異形成から浸潤癌への変化に伴い有意に発現が変化する 15 遺伝子を同定し 報告した [Int J Cancer. 132(3) (2013)] 本研究では 上記データベースから 特に異形成から浸潤癌への移行で重要な役割を果たす可能性がある
![ス化した さらに 正常から上皮性異形成 上皮性異形成から浸潤癌への変化に伴い有意に発現が変化する 15 遺伝子を同定し 報告した [Int J Cancer. 132(3) (2013)] 本研究では 上記データベースから 特に異形成から浸潤癌への移行で重要な役割を果たす可能性がある ス化した さらに 正常から上皮性異形成 上皮性異形成から浸潤癌への変化に伴い有意に発現が変化する 15 遺伝子を同定し 報告した [Int J Cancer. 132(3) (2013)] 本研究では 上記データベースから 特に異形成から浸潤癌への移行で重要な役割を果たす可能性がある](/thumbs/92/109162399.jpg) 学位論文の内容の要旨 論文提出者氏名 守谷友二朗 論文審査担当者 主査 : 三浦雅彦副査 : 森山啓司 坂本啓 論文題目 The high-temperature requirement factor A3 (HtrA3) is associated with acquisition of the invasive phenotype in oral squamous cell carcinoma
学位論文の内容の要旨 論文提出者氏名 守谷友二朗 論文審査担当者 主査 : 三浦雅彦副査 : 森山啓司 坂本啓 論文題目 The high-temperature requirement factor A3 (HtrA3) is associated with acquisition of the invasive phenotype in oral squamous cell carcinoma
PowerPoint プレゼンテーション
 第 21 回京都乳癌コンセンサス会議 テーマ HER2 陰性再発乳癌の抗がん薬治療 アンケート集計結果 1 回答いただいた御施設 (50 音順 ) 大阪赤十字病院 大津赤十字病院 加藤乳腺クリニック 関西医科大学附属枚方病院 菅典道クリニック 京都医療センター 京都市立病院 京都第一赤十字病院 京都大学医学部附属病院 倉敷中央病院 公立八鹿病院 沢井記念乳腺クリニック 滋賀県立成人病センター 静岡県立がんセンター
第 21 回京都乳癌コンセンサス会議 テーマ HER2 陰性再発乳癌の抗がん薬治療 アンケート集計結果 1 回答いただいた御施設 (50 音順 ) 大阪赤十字病院 大津赤十字病院 加藤乳腺クリニック 関西医科大学附属枚方病院 菅典道クリニック 京都医療センター 京都市立病院 京都第一赤十字病院 京都大学医学部附属病院 倉敷中央病院 公立八鹿病院 沢井記念乳腺クリニック 滋賀県立成人病センター 静岡県立がんセンター
膵臓癌について
 胆 膵領域の悪性腫瘍 ~ 外科の立場から ~ 尾道市立市民病院外科 村田年弘 膵臓癌について 2009 年の死亡数が多い部位は順に 1 位 2 位 3 位 4 位 5 位 男性 肺 胃 肝臓 結腸 膵臓 結腸と直腸を合わせた大腸は3 位 女性 肺 胃 結腸 膵臓 乳房 結腸と直腸を合わせた大腸は1 位 男女計 肺 胃 肝臓 結腸 膵臓 結腸と直腸を合わせた大腸は3 位 年々 膵臓癌の罹患患者は増加している
胆 膵領域の悪性腫瘍 ~ 外科の立場から ~ 尾道市立市民病院外科 村田年弘 膵臓癌について 2009 年の死亡数が多い部位は順に 1 位 2 位 3 位 4 位 5 位 男性 肺 胃 肝臓 結腸 膵臓 結腸と直腸を合わせた大腸は3 位 女性 肺 胃 結腸 膵臓 乳房 結腸と直腸を合わせた大腸は1 位 男女計 肺 胃 肝臓 結腸 膵臓 結腸と直腸を合わせた大腸は3 位 年々 膵臓癌の罹患患者は増加している
試験デザイン :n=152 試験開始前に第 VIII 因子製剤による出血時止血療法を受けていた患者群を 以下のい ずれかの群に 2:2:1 でランダム化 A 群 (n=36) (n=35) C 群 (n=18) ヘムライブラ 3 mg/kg を週 1 回 4 週間定期投与し その後 1.5 mg/k
 各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
33 NCCN Guidelines Version NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) 非ホジキンリンパ腫 2015 年第 2 版 NCCN.or
 33 NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) 2015 年第 2 版 NCCN.org NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) の Lugano
33 NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) 2015 年第 2 版 NCCN.org NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ) (NCCN 腫瘍学臨床診療ガイドライン ) の Lugano
目次 1. はじめに P2 2. 本剤の特徴, 作用機序 P3 3. 臨床成績 P4 4. 施設について P9 5. 投与対象となる患者 P11 6. 投与に際して留意すべき事項 P13 1
 中医協総 -3-1 3 0. 4. 1 1 最適使用推進ガイドライン ( 案 ) アテゾリズマブ ( 遺伝子組換え ) ( 販売名 : テセントリク点滴静注 1200 mg) ~ 非小細胞肺癌 ~ 平成 年 月 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴, 作用機序 P3 3. 臨床成績 P4 4. 施設について P9 5. 投与対象となる患者 P11 6. 投与に際して留意すべき事項
中医協総 -3-1 3 0. 4. 1 1 最適使用推進ガイドライン ( 案 ) アテゾリズマブ ( 遺伝子組換え ) ( 販売名 : テセントリク点滴静注 1200 mg) ~ 非小細胞肺癌 ~ 平成 年 月 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴, 作用機序 P3 3. 臨床成績 P4 4. 施設について P9 5. 投与対象となる患者 P11 6. 投与に際して留意すべき事項
た 18 歳以上の AD/HD 患者を対象に 日本人を含むアジア人によるプラセボ対照二重盲検比較試験及びその長期継続投与試験が現在実施されており 本剤の製造販売者によれば これらの試験成績に基づき 本剤の成人期 AD/HD 患者への追加適応に関する承認事項一部変更承認申請が行われる予定とされている
 ( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
要望番号 ;Ⅱ-286 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
前立腺癌は男性特有の癌で 米国においては癌死亡者数の第 2 位 ( 約 20%) を占めてい ます 日本でも前立腺癌の罹患率 死亡者数は急激に上昇しており 現在は重篤な男性悪性腫瘍疾患の1つとなって図 1 います 図 1 初期段階の前立腺癌は男性ホルモン ( アンドロゲン ) に反応し増殖します そ
 再発した前立腺癌の増殖を制御する新たな分子メカニズムの発見乳癌治療薬が効果的 発表者筑波大学先端領域学際研究センター教授柳澤純 (junny@agbi.tsukuba.ac.jp TEL: 029-853-7320) ポイント 女性ホルモンが制御する新たな前立腺癌の増殖 細胞死メカニズムを発見 女性ホルモン及び女性ホルモン抑制剤は ERβ 及び KLF5 を通じ FOXO1 の発現量を変化することで前立腺癌の増殖
再発した前立腺癌の増殖を制御する新たな分子メカニズムの発見乳癌治療薬が効果的 発表者筑波大学先端領域学際研究センター教授柳澤純 (junny@agbi.tsukuba.ac.jp TEL: 029-853-7320) ポイント 女性ホルモンが制御する新たな前立腺癌の増殖 細胞死メカニズムを発見 女性ホルモン及び女性ホルモン抑制剤は ERβ 及び KLF5 を通じ FOXO1 の発現量を変化することで前立腺癌の増殖
(別添様式)
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後 予測因子および副作用発現の危険因子についての探索的研究 (JACCRO GC-07AR) という臨床研究について説明したものです この文書と私の説明のな かで わかりにくいと
 StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
StageⅢ 治癒切除胃癌症例における TS-1 術後補助化学療法の 予後予測因子および副作用発現の危険因子についての 探索的研究 (JACCRO GC-07AR) についてのご説明 説明 同意文書 作成日 :2014 年 5 月 27 日 施設名 : 東京医科大学八王子医療センター 1. はじめに ステージティーエスワンこの文書は Stage Ⅲ 治癒切除胃癌症例における TS-1 術後補助化学療法の予後
医科_第20次(追加)審査情報提供(広報用)
 第 20 次審査情報提供事例 ( 医科 ) 追加 平成 31 年 4 月 22 日提供分 社会保険診療報酬支払基金 審査情報提供事例について 審査支払機関における診療報酬請求に関する審査は 健康保険法 療養担当規則 診療報酬点数表及び関係諸通知等を踏まえ各審査委員会の医学的 歯科医学的見解に基づいて行われています 一方 審査の公平 公正性に対する関係方面からの信頼を確保するため 審査における一般的な取扱いについて広く関係者に情報提供を行い
第 20 次審査情報提供事例 ( 医科 ) 追加 平成 31 年 4 月 22 日提供分 社会保険診療報酬支払基金 審査情報提供事例について 審査支払機関における診療報酬請求に関する審査は 健康保険法 療養担当規則 診療報酬点数表及び関係諸通知等を踏まえ各審査委員会の医学的 歯科医学的見解に基づいて行われています 一方 審査の公平 公正性に対する関係方面からの信頼を確保するため 審査における一般的な取扱いについて広く関係者に情報提供を行い
No.18-43
 各位 2018 年 6 月 4 日 エーザイ株式会社 Merck & Co., Inc., Kenilworth, N.J., U.S.A. レンビマ と キイトルーダ との併用療法について 4 がん腫に対する最新の研究成果を米国臨床腫瘍学会年次総会において発表 切除不能な肝細胞がん および頭頸部扁平上皮がんに対する レンビマ と キイトルーダ との併用療法による初めてのデータを発表 ( 切除不能な肝細胞がんに対してはチロシンキナーゼ阻害剤と腫瘍免疫療法による初の全身併用療法をめざす
各位 2018 年 6 月 4 日 エーザイ株式会社 Merck & Co., Inc., Kenilworth, N.J., U.S.A. レンビマ と キイトルーダ との併用療法について 4 がん腫に対する最新の研究成果を米国臨床腫瘍学会年次総会において発表 切除不能な肝細胞がん および頭頸部扁平上皮がんに対する レンビマ と キイトルーダ との併用療法による初めてのデータを発表 ( 切除不能な肝細胞がんに対してはチロシンキナーゼ阻害剤と腫瘍免疫療法による初の全身併用療法をめざす
Microsoft PowerPoint - 薬物療法専門薬剤師制度_症例サマリー例_HP掲載用.pptx
 薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
<4D F736F F D20838A838A815B83588E9197BF D B837B89A295C D815B837D905C90BF E646F637
 各位 2014 年 10 月 2 日 ブリストル マイヤーズスクイブ社 オプジーボ ( 一般名 : ニボルマブ ) について 米国および欧州での規制当局における複数のマイルストーン達成を発表 ブリストル マイヤーズスクイブ社は 9 月 26 日 ( 米国現地時間 ) オプジーボ ( 一般名 : ニボルマブ ) について 米国および欧州での規制当局における複数のマイルストーンを達成したことを発表しました
各位 2014 年 10 月 2 日 ブリストル マイヤーズスクイブ社 オプジーボ ( 一般名 : ニボルマブ ) について 米国および欧州での規制当局における複数のマイルストーン達成を発表 ブリストル マイヤーズスクイブ社は 9 月 26 日 ( 米国現地時間 ) オプジーボ ( 一般名 : ニボルマブ ) について 米国および欧州での規制当局における複数のマイルストーンを達成したことを発表しました
CTD 第 2 部 2.7 臨床概要 臨床的有効性 MSD 株式会社
 CTD 第 2 部 MSD 株式会社 目次 頁 表一覧... 3 図一覧... 6 付録一覧... 9 略号及び用語の定義... 13... 14 2.7.3.1 背景及び概観... 14 2.7.3.1.1 臨床試験の概要... 16 2.7.3.1.1.1 海外 001 試験... 16 2.7.3.1.1.2 海外 002 試験... 20 2.7.3.1.1.3 海外 006 試験... 24
CTD 第 2 部 MSD 株式会社 目次 頁 表一覧... 3 図一覧... 6 付録一覧... 9 略号及び用語の定義... 13... 14 2.7.3.1 背景及び概観... 14 2.7.3.1.1 臨床試験の概要... 16 2.7.3.1.1.1 海外 001 試験... 16 2.7.3.1.1.2 海外 002 試験... 20 2.7.3.1.1.3 海外 006 試験... 24
目次 1. はじめに P2 2. 本剤の特徴 作用機序 P3 3. 臨床成績 P4 4. 施設について P8 5. 投与対象となる患者 P10 6. 投与に際して留意すべき事項 P11 1
 参考 3 最適使用推進ガイドライン ニボルマブ ( 遺伝子組換え ) ( 販売名 : オプジーボ点滴静注 20 mg オプジーボ点滴静注 100 mg オプジーボ点滴静注 240 mg) ~ 頭頸部癌 ~ 平成 29 年 3 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴 作用機序 P3 3. 臨床成績 P4 4. 施設について P8 5. 投与対象となる患者
参考 3 最適使用推進ガイドライン ニボルマブ ( 遺伝子組換え ) ( 販売名 : オプジーボ点滴静注 20 mg オプジーボ点滴静注 100 mg オプジーボ点滴静注 240 mg) ~ 頭頸部癌 ~ 平成 29 年 3 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴 作用機序 P3 3. 臨床成績 P4 4. 施設について P8 5. 投与対象となる患者
博士の学位論文審査結果の要旨
 博士の学位論文審査結果の要旨 申請者氏名 稲荷均 横浜市立大学大学院医学研究科外科治療学 審査員 主査横浜市立大学大学院医学研究科教授矢尾正祐 副査横浜市立大学大学院医学研究科講師成井一隆 副査横浜市立大学大学院医学研究科講師仙石徹 学位論文 : 転移性乳癌における EZH2 発現の臨床的意義 Expression of enhancer of zeste homolog 2 correlates
博士の学位論文審査結果の要旨 申請者氏名 稲荷均 横浜市立大学大学院医学研究科外科治療学 審査員 主査横浜市立大学大学院医学研究科教授矢尾正祐 副査横浜市立大学大学院医学研究科講師成井一隆 副査横浜市立大学大学院医学研究科講師仙石徹 学位論文 : 転移性乳癌における EZH2 発現の臨床的意義 Expression of enhancer of zeste homolog 2 correlates
学位論文の内容の要旨 論文提出者氏名 神谷綾子 論文審査担当者 主査北川昌伸副査田中真二 石川俊平 論文題目 Prognostic value of tropomyosin-related kinases A, B, and C in gastric cancer ( 論文内容の要旨 ) < 要旨
 学位論文の内容の要旨 論文提出者氏名 神谷綾子 論文審査担当者 主査北川昌伸副査田中真二 石川俊平 論文題目 Prognostic value of tropomyosin-related kinases A, B, and C in gastric cancer ( 論文内容の要旨 ) < 要旨 > Trk 受容体は腫瘍の成長において重要な役割を果たし 癌治療の重要なターゲットと考えられている 我々は胃癌における
学位論文の内容の要旨 論文提出者氏名 神谷綾子 論文審査担当者 主査北川昌伸副査田中真二 石川俊平 論文題目 Prognostic value of tropomyosin-related kinases A, B, and C in gastric cancer ( 論文内容の要旨 ) < 要旨 > Trk 受容体は腫瘍の成長において重要な役割を果たし 癌治療の重要なターゲットと考えられている 我々は胃癌における
10 年相対生存率 全患者 相対生存率 (%) (Period 法 ) Key Point 1 の相対生存率は 1998 年以降やや向上した 日本で
 151 10 年相対生存率 全患者 相対生存率 (%) 82 76 79 61 60 53 52 51 46 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 44 40 43 Key Point 1 の相対生存率は 1998 年以降やや向上した 日本でパクリタキセル カルボプラチン併用療法が標準治療となった時期と一致する 0 1 2 3 4 5
151 10 年相対生存率 全患者 相対生存率 (%) 82 76 79 61 60 53 52 51 46 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 44 40 43 Key Point 1 の相対生存率は 1998 年以降やや向上した 日本でパクリタキセル カルボプラチン併用療法が標準治療となった時期と一致する 0 1 2 3 4 5
2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び
![2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び 2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び](/thumbs/91/105459093.jpg) - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
Microsoft PowerPoint - 印刷用 DR.松浦寛 K-net配布資料.ppt [互換モード]
![Microsoft PowerPoint - 印刷用 DR.松浦寛 K-net配布資料.ppt [互換モード] Microsoft PowerPoint - 印刷用 DR.松浦寛 K-net配布資料.ppt [互換モード]](/thumbs/91/106069805.jpg) 医療者がん研修会 もっと知りたい食道がん治療 2014 年 11 月 20 日 ( 木 ) 食道癌の 放射線治療を もっと知ってみませんか? 広島市立広島市民病院放射線治療科松浦寛司 食道がん治療のアルゴリズム Stage 0 Stage I Stage II, III (T1b-T3) Stage III (T4), IVa Stage IVb 術前化学療法術前化学放射線療法 内視鏡的治療 外科治療
医療者がん研修会 もっと知りたい食道がん治療 2014 年 11 月 20 日 ( 木 ) 食道癌の 放射線治療を もっと知ってみませんか? 広島市立広島市民病院放射線治療科松浦寛司 食道がん治療のアルゴリズム Stage 0 Stage I Stage II, III (T1b-T3) Stage III (T4), IVa Stage IVb 術前化学療法術前化学放射線療法 内視鏡的治療 外科治療
目次 1. はじめに P2 2. 本剤の特徴, 作用機序 P3 3. 臨床成績 P4 4. 施設について P8 5. 投与対象となる患者 P10 6. 投与に際して留意すべき事項 P12 1
 参考 最適使用推進ガイドライン デュルバルマブ ( 遺伝子組換え ) ( 販売名 : イミフィンジ点滴静注 120 mg イミフィンジ点滴静注 500 mg) ~ 非小細胞肺癌 ~ 平成 30 年 8 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴, 作用機序 P3 3. 臨床成績 P4 4. 施設について P8 5. 投与対象となる患者 P10
参考 最適使用推進ガイドライン デュルバルマブ ( 遺伝子組換え ) ( 販売名 : イミフィンジ点滴静注 120 mg イミフィンジ点滴静注 500 mg) ~ 非小細胞肺癌 ~ 平成 30 年 8 月 ( 平成 30 年 11 月改訂 ) 厚生労働省 目次 1. はじめに P2 2. 本剤の特徴, 作用機序 P3 3. 臨床成績 P4 4. 施設について P8 5. 投与対象となる患者 P10
