未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会武田薬品工業株式会社社 名 要望番号 III-4-16 成分名 ( 一般名 ) ランソプラゾール 販売名 タケプロン OD 錠 15 及びタケプロン OD 錠 30 タケプロンカプセル 15 及びタケプロンカプ
|
|
|
- ちえこ かむら
- 4 years ago
- Views:
Transcription
1 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会武田薬品工業株式会社社 名 要望番号 III-4-16 成分名 ( 一般名 ) ランソプラゾール 販売名 タケプロン OD 錠 15 及びタケプロン OD 錠 30 タケプロンカプセル 15 及びタケプロンカプセル 30 要望された医薬品 未承認薬 適 応外薬の分 類 ( 該当するものにチェックする ) 未承認薬 2009 年 4 月以降に FDA 又は EMA で承認されたが 国内で承認されていない医薬品 上記以外のもの 適応外薬 医師主導治験や先進医療 B( ただし ICH-GCP を準拠できたものに限る ) にて実施され 結果がまとめられたもの 上記以外のもの 要望内容 効能 効果 ( 要望された効能 効果について記載する ) 用法 用量 ( 要望された用法 用量について記載する ) 下記における小児 未成年者 ( 青年 ) に対するへリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎ランソプラゾール アモキシシリン (AMPC) 及びクラリスロマイシン (CAM) の 3 剤を下表の 1 日量を 1 日 2 回で 1 週間経口投与する この除菌治療に失敗した場合は二除菌療法として CAM をメトロニダゾール (MNZ) に替えた 3 剤を下表の 1 日量を 1 日 2 回で 1 日 2 回 1 週間経口投与する 1
2 15-30kg 未満 kg 未満 ランソプラゾール 30 mg/ 日 60 mg/ 日 AMPC 50 mg/kg/ 日 1500 mg CAM 15 mg/kg/ 日 15 mg/kg/ 日 MNZ 500 mg/ 日 (25 kg 以上 ) 500 mg/ 日 備 考 ( 該当する場合はチェックする ) 40 kg 以上に関しては 成人用量に準じる 通常 成人にはランソプラゾールとして 1 回 30 mg アモ キシシリン水和物として 1 回 750 mg( 力価 ) 及びクラリ スロマイシンとして 1 回 200 mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する なお クラリスロマイシ ンは 必要に応じて適宜増量することができる ただし 1 回 400 mg( 力価 )1 日 2 回を上限とする プロトンポンプインヒビター アモキシシリン水和物及 びクラリスロマイシンの 3 剤投与によるヘリコバクタ ー ピロリの除菌治療が不成功の場合は これに代わる 治療として 小児 (12 歳以上 ) にはアモキシシリン水和 物として 1 回 50 mg/kg( 力価 ) メトロニダゾールとして 1 回 250 mg( 力価 ), 及びランソプラゾールとして 1 回 15 mg(15-30 kg 未満 ) または 30 mg(30-40 kg 未満 ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する 小児に関する要望 ( 特記事項等 ) 希少疾病用医薬品の該当性 ( 推定対象 約 47 万人 < 推定方法 > 患者数 推定方法につ総務省統計局での人口推定では平成 26 年 10 月時点で 12 歳から 19 歳までの日本人は 939 万人であり H. pylori いても記載する ) の感染率を 5% 2) として約 47 万人に H. pylori 感染胃炎の 可能性がある 現在 現在開発中 治験実施中 承認審査中 の 国 内 の 開 発 状 現在開発していない 承認済み 国内開発中止 国内開発なし ( 特記事項等 ) 2
3 況 企 業 と し て の 開 発 の 意 思 医 療 上 の 必 要 性 に 係 る 基 準 へ の 該 当 性 ( 該当するものにチェックし 分類した根拠 あり なし ( 開発が困難とする場合 その特段の理由 ) 1. 適応疾病の重篤性 ア生命に重大な影響がある疾患 ( 致死的な疾患 ) イ病気の進行が不可逆的で 日常生活に著しい影響を及ぼす疾患 ウその他日常生活に著しい影響を及ぼす疾患 エ上記の基準に該当しない ( 上記に分類した根拠 ) H. pylori 感染によって胃粘膜に慢性炎症が惹起され 炎症は除菌による介入がなければ一生涯持続する 感染経過と伴に胃粘膜には萎縮や腸上皮化生が出現し この過程で H. pylori 関連疾患である胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 胃癌などが発症する 胃 十二指腸潰瘍小児ならびに青年期のヒトが H. pylori 感染で胃 十二指腸潰瘍を合併すると, 腹痛, 吐き気, 消化管出血あるいは体重増加不良などの症状がみられる 3) 小児ならびに青年期において十二指腸潰瘍の 83% 胃潰瘍の 44% が H. pylori 感染が原因であり 成人と同様に胃 十二指腸潰瘍の原因として最も重要である 4) 除菌によって胃 十二指腸潰瘍の再発を著明に抑制しないと 再発と治癒を長期に渡って繰り返す 5) 胃 MALT リンパ腫未成人の発症はまれであるが 胃に限局している場合には除菌治療にて 70-80% は寛解となる 5) 放置をするとやがてびまん性大型 B 細胞リンパ腫に転化する場合があり 予後が悪くなる 特発性血小板減少性紫斑病 H. pylori 陽性者の半数は除菌治療によって血小板数の上昇が得られる 5) 除菌に反応しない場合はステロイド治療などに移行する 早期胃癌に対する内視鏡的治療後胃未成人の胃癌発症は H. pylori 感染率の減少に伴い激減している 従って未成人で 3
4 について記載する ) の対象者はまれと思われるが 内視鏡的治療を施行しないと高率に異時癌の発生 が起こる 5) ヘリコバクター ピロリ感染胃炎 思春期は体の成長あるいは運動により鉄分を多く必要とするので 鉄欠乏性貧血 の方では H. pylori 感染率が高く 日常生活で不登校 食欲不振などを招く 6)7) ま た H. pylori 感染胃炎を放置すると胃癌を含む H. pylori 関連疾患の発症に結びつ く わが国における H. pylori 未感染者に比べた現感染者の胃癌リスクは 15 倍以 上 ( 補正のため過小評価 ) 8) 海外では 20 倍以上 9) とされている わが国では H. pylori 陰性胃癌の頻度は 分化型早期胃癌の内視鏡治療症例では 0.42% 10) 未分化型胃癌 を含む内視鏡治療及び外科手術症例では 0.66% 11) と報告されている H. pylori 感染 は 40 歳以下の若年者に生じる胃癌を含め 分化型胃癌 未分化型胃癌のいずれ のリスクも上昇させる 6)12)13) 2. 医療上の有用性 ア既存の療法が国内にない イ欧米の臨床試験において有効性 安全性等が既存の療法と比べて明らかに優れている ウ欧米において標準的療法に位置づけられており 国内外の医療環境の違い等を踏まえても国内における有用性が期待できると考えられる エ上記の基準に該当しない ( 上記に分類した根拠 ) 国内外のガイドラインに記載され すでに多くの治験と有効性が判明しており 可及的速やかに本邦での認可が必要である 日本ヘリコバクター学会の H. pylori 感染の診断と治療のガイドライン 2016 改訂 版 14 では H. pylori 除菌は 胃 十二指腸潰瘍の治癒だけではなく 胃癌を始 めとする H. pylori 関連疾患の治療や予防 さらには感染経路の抑制に役立つ とされており 除菌が強く勧められる疾患として H. pylori 感染胃炎 胃潰瘍 十二指腸潰瘍 早期胃癌に対する内視鏡的治療後胃 胃 MALT リンパ腫などがあ げられている 除菌方法については 成人においては PPI 1 剤に加え アモキシ シリン及びクラリスロマイシンの 3 剤を併用する療法 ( 一次療法 ) で除菌を行い 一次療法による除菌が不成功の場合は これに代わる治療として 一次療法のク ラリスロマイシンをメトロニダゾールに変更した 3 剤併用療法 ( 二次療法 ) が行 われていることから 小児においても 同様の手順で実施すべきと考えられる 胃 十二指腸潰瘍 H. pylori 陽性で NSAID 使用がない胃 十二指腸潰瘍では 除菌治療によって再発 が抑制され 再発を繰り返す潰瘍症からの離脱ができる 5) 日本消化器病学会の消 化性潰瘍診療ガイドライン (2015) 15) では NSAIDs 使用のない H. pylori 陽性の胃 十二指腸潰瘍の第一選択治療は H. pylori 除菌としている 日本小児科学会のガイ ドライン (2005) 16) では 胃潰瘍 十二指腸潰瘍を除菌適用としている 4
5 胃 MALT リンパ腫胃に限局している MALT リンパ腫は除菌治療にて 70-80% は寛解となり 5) 寛解によって長期の良好な予後が期待できる 17) 特発性血小板減少性紫斑病 H. pylori 陽性者の半数は除菌治療によって血小板数の上昇が得られる 5) ガイドラインにおいても特発性血小板減少性紫斑病の第一選択とされている 18) 早期胃癌に対する内視鏡的治療後胃除菌治療による早期胃癌内視鏡治療後の異時再発を 1/3 に抑制される 19)20) ヘリコバクター ピロリ感染胃炎 H. pylori 除菌によって 胃粘膜炎症の改善に伴う胃粘膜萎縮の改善効果や腸上皮化生の進展抑制効果ひいては胃癌の予防効果が期待される H. pylori 除菌により 組織学的に胃の炎症所見が改善することが報告されている 21)22) H. pylori 除菌により約 1/3 に胃癌発生抑制効果が明らかとなり 19)20) その抑制効果は若年での除菌がより効果的と考えられる スナネズミでは除菌の時期が早いほど その後の胃癌発生が強く抑制されたことが示されている 23) ヒトでは 未分化癌が 80% を占める若年胃癌でも H. pylori 感染との関与が大きい 13) 40 歳代以下の胃癌死亡数は H. pylori 感染率の低下に伴い 1970 年から 2010 年までで 6 分の 1 に減少しており 24) 若年者胃癌においても H. pylori 感染の影響を強く受ける 萎縮が進行する前の早い時期に除菌治療を行うほど 胃癌予防効果が高いことが示されている 25)-28) 青少年期においては胃癌発生までに長い観察期間が必要なため ヒトでは直接証明する成績はないが 動物実験の結果から感染早期の除菌ほど胃癌予防効果は大きいと推測される 従って 29 歳までに除菌を行うと 90% 以上の高い胃癌抑制効果が推測されている 29)-32) さらに若年者における除菌治療における経済効果も優れている試算が出ている 33) また 小児では H. pylori 感染と鉄欠乏性貧血の関 備 考 連性が指摘されており そのような例では除菌治療で貧血の改善が得られる 以下 タイトルが網かけされた項目は 学会等より提出された要望書又は見解 に補足等がある場合にのみ記載 2. 要望内容に係る欧米での承認等の状況 欧米等 6 か 国での承認 状況 ( 該当国にチェックし 該当国の承認内容を記載する ) 米国 英国 独国 仏国 加国 豪州 小児 青年の GERD に対して承認されているが へリコバクター ピロリの除菌の補助としては承認されていない 欧米等 6 か国での承認内容 欧米各国での承認内容 ( 要望内容に関連する箇所に下線 ) 米国販売名 ( 企業名 ) 5
6 効能 効果用法 用量備考英国販売名 ( 企業名 ) 効能 効果用法 用量備考独国販売名 ( 企業名 ) 効能 効果用法 用量備考仏国販売名 ( 企業名 ) 効能 効果用法 用量備考加国販売名 ( 企業名 ) 効能 効果用法 用量備考豪国販売名 ( 企業名 ) 効能 効果用法 用量備考 欧米等 6 か 国での標準 的使用状況 ( 欧米等 6 か国で要望内容に関する承認がない適応外薬についてのみ 該当国にチェックし 該当国の標準的使用内容を記載する ) 米国 英国 独国 仏国 加国 豪州 欧米等 6 か国での標準的使用内容 米 国 欧米各国での標準的使用内容 ( 要望内容に関連する箇所に下線 ) ガイドラ イン名 効能 効 果 ( または効能 効果に関連のある記載箇所 ) Evidence-based Guidelines From ESPGHAN (European Society for Pediatric Gastroenterology, Hepatology,and Nutrition) and NASPGHAN (North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition) for Helicobacter pylori Infection in Children 34) (Recommendation 12) Eradication of the infection is recommended in a child with H pylori infection and PUD. The indication applies also for healed ulcers or a history of PUD. 6
7 用法 用 量 ( または用法 用量に関連のある記載箇所 ) 一次療法及び二次療法 英 国 ガイドラ インの根 拠論文 備考 ガイドラ イン名 効能 効 果 ( または効能 効果に関連のある記載箇所 ) 用法 用 量 ( または用法 用量に関連のある記載箇所 ) ガイドラ インの根 拠論文 備考 Koletzko S, Jones NL, Goodman KJ, Gold B, Rowland M, Cadranel S, Chong S, Colletti RB, Casswall T, Elitsur Y, Guarner J, Kalach N, Madrazo A, Megraud F, Oderda G; H pylori Working Groups of ESPGHAN and NASPGHAN. Evidence-based guidelines from ESPGHAN and NASPGHAN for Helicobacter pylori infection in children. J Pediatr Gastroenterol Nutr Aug;53(2): ESPGHAN と NASPGHAN が共同で更新したガイドラインである 米国と同じ米国と同じ米国と同じ米国と同じ ESPGHAN と NASPGHAN が共同で更新したガイドラインである 7
8 独国仏国加国 ガイドラ イン名 効能 効 果 ( または効能 効果に関連のある記載箇所 ) 用法 用 量 ( または用法 用量に関連のある記載箇所 ) ガイドラ インの根 拠論文 備考 ガイドラ イン名 効能 効 果 ( または効能 効果に関連のある記載箇所 ) 用法 用 量 ( または用法 用量に関連のある記載箇所 ) ガイドラ インの根 拠論文 備考 ガイドラ イン名 効能 効 果 米国と同じ米国と同じ米国と同じ米国と同じ ESPGHAN と NASPGHAN が共同で更新したガイドラインである 米国と同じ米国と同じ米国と同じ米国と同じ ESPGHAN と NASPGHAN が共同で更新したガイドラインである 米国と同じ米国と同じ 8
9 豪 州 ( または効能 効果に関連のある記載箇所 ) 用法 用量 ( または用法 用量に関連のある記載箇所 ) ガイドラインの根拠論文備考ガイドライン名効能 効果 ( または効能 効果に関連のある記載箇所 ) 用法 用量 ( または用法 用量に関連のある記載箇所 ) ガイドラインの根拠論文備考 米国と同じ米国と同じ ESPGHAN と NASPGHAN が共同で更新したガイドラインである 3. 要望内容に係る国内外の公表文献 成書等について 9
10 (1) 無作為化比較試験 薬物動態試験等に係る公表文献としての報告状況 < 文献の検索方法 ( 検索式や検索時期等 ) 検索結果 文献 成書等の選定理由の概略等 > 1) 米国国立衛生研究所 (National Institutes of Health :NIH) の U.S.National Library of Medicine の文献データベースである PubMed ( 1950 ~) を用い検索した ( 検索日 :2016/11/10 検索式は 要望書と同様に以下とした (children & pediatric) & Helicobacter pylori & proton pump inhibitor (("child"[mesh Terms] OR "child"[all Fields] OR "children"[all Fields]) AND ("pediatrics"[mesh Terms] OR "pediatrics"[all Fields] OR "pediatric"[all Fields])) AND ("helicobacter pylori"[mesh Terms] OR ("helicobacter"[all Fields] AND "pylori"[all Fields]) OR "helicobacter pylori"[all Fields]) AND ("proton pump inhibitors"[pharmacological Action] OR "proton pump inhibitors"[mesh Terms] OR ("proton"[all Fields] AND "pump"[all Fields] AND "inhibitors"[all Fields]) OR "proton pump inhibitors"[all Fields] OR ("proton"[all Fields] AND "pump"[all Fields] AND "inhibitor"[all Fields]) OR "proton pump inhibitor"[all Fields]) 検出文献 :115 2) エルゼビアが運営する EMBASE(1974~) を用い検索した 検索日 :2016/12/01 検索式は 小児を対象にランソプラゾール 60 mg/ 日を投与した文献を検索するため 以下の検索式とした 1children or pediatric 2lansoprazole and 2 and 3 検出文献 :25 件 3) 日本の医学中央雑誌刊行会が運営する医学中央雑誌 (1983~) を用い検索した 検索日 :2016/11/10 検索式は 要望書と類似した検索式とした 1 ヘリコバクターピロリ 2Helicobacter pylori 3 ヘリコバクターピロリ感染 4Helicobacter pylori 感染 5 小児 or 子供 6 プロトンポンプ阻害薬 1 or 2 or 3 or 4 and 5 and 6 検出文献 :211 件 以上の検索結果から要望内容に係わる文献を抽出し さらに当社で実施した要望内容に係 わる臨床試験の結果について以下に内容を説明する 10
11 < 海外における臨床試験等 > 1)A Study to Evaluate the Effects of Lansoprazole 15mg or 30mg in Pediatric Subjects With Esophagitis (M97-640). 35) [ 対象 ] 12~17 歳の症候性胃食道逆流症 (sgerd) 患者 [ 目的 ] ランソプラゾール 15 mg 又は 30 mg を 1 日 1 回反復投与した際の安全性 薬物動態及び薬 理学的作用を検討する [ 試験デザイン ] 7 日間の前治療期及び 5 日間の治療期からなる二重盲検群間比較試験 [ 用法 用量 ] ランソプラゾール 15 mg/ 日 5 日間又はランソプラゾール 30 mg/ 日 5 日間 [ 試験結果 ] 投与 5 日目の薬物動態学的パラメータ ( 平均 ±SD) Pharmacokinetic Parameter (unit) N Lansoprazole 15 mg QD N Lansoprazole 30 mg QD N Healthy Adult Subjectsa Tmax (h) ± ± ± 0.8 Cmax b (ng/ml) ± ± ± 419 Dose-normalized Cmax (ng/ml/mg) ± ± ± 14.0 AUCb (ng h/ml) ± ± ± 1797 Dose-normalized AUC (ng h/ml/mg) ± ± ± 59.9 t1/2c (h) ± ± ± 0.52 SD = Standard Deviation a Data obtained from Abbott Drug Metabolism Report No. 32 Overview and summary of the human pharmacokinetics and biopharmaceutics of lansoprazole. b For healthy adult subjects normalized to a 30 mg dose. c Harmonic mean ± pseudo-standard deviation. 12~17 歳の症候性胃食道逆流症 (sgerd) 患者にランソプラゾール 15 mg 又は 30 mg を 1 日 1 回反復投与した際の薬物動態学的パラメータは 健康成人で得られた薬物動態学的 パラメータと同様であった [ 安全性 ] 有害事象の発現率は ランソプラゾール 15 mg 群とランソプラゾール 30 mg 群でそれぞれ 28% 及び 39% であり同様であった 最も多く見られた有害事象は ランソプラゾール 15mg 群で咽頭炎 (6% 2/32) であり ランソプラゾール 30 mg 群では頭痛 (13% 4/31) であ った ほとんどの有害事象は治験薬との因果関係は否定され その程度は軽度または中等 度であった ランソプラゾール 30 mg 群で 1 例に重篤な有害事象がみられ その内容は胸痛の症状を伴 う中等度の胃腸障害 腹痛 及び咳の増加であった 治験薬投与との因果関係は否定され たが 対象疾患の悪化が原因であると考えられた ランソプラゾール 15 mg 群で 1 例 3 日間のランソプラゾール投与後 軽度の末梢浮腫 斑状丘疹 及び蕁麻疹の発生のために中止された 被験者の既往歴に環境アレルギーによ る蕁麻疹を有していたが これらの事象は治験薬投与に関連すると判定された なお 有 11
12 害事象は中止 5 日後に消失した 2)NITROFURAN BASED TRIPLE THERAPY FOR THE ERADCATION OF H. PYLOLY IN CHILDREN. P. Shchherbakov, et al. 36) [ 対象 ] H. pylori 陽性の 7~17 歳の小児 (225 例 ) [ 目的 ] ランソプラゾール / クラリスロマイシン / ニフロキサジドからなる 3 剤併用療法とランソプラゾール / クラリスロマイシン / メトロニダゾールからなる 3 剤併用療法の H. pylori 除菌率を比較検討する [ 試験デザイン ] 非盲検の群間比較試験 [ 用法 用量 ] 7~12 歳 A 群 : ランソプラゾール 60 mg/ 日 +クラリスロマイシン 500 mg/ 日 +Enterofuril 懸濁液 400 mg/ 日 B 群 : ランソプラゾール 60 mg/ 日 +クラリスロマイシン 500 mg/ 日 +メトロニダゾール 500 mg/ 日 12~17 歳 A 群 : ランソプラゾール 60 mg/ 日 +クラリスロマイシン 1000 mg/ 日 +Enterofuril 懸濁液 800 mg/ 日 B 群 : ランソプラゾール 60 mg/ 日 +クラリスロマイシン 1000 mg/ 日 +メトロニダゾール 1000 mg/ 日それぞれ 1 日 2 回 7 日間投与 [ 試験結果 ] 治療 8 週後の 13 C 呼気試験による除菌率は A 群で 86%(91/106) B 群で 72%(86/119) であった (p<0.05) [ 安全性 ] 7~17 歳の H. pylori 感染者 225 例のうち 副作用として A 群で悪心が 8 例 アレルギーが 7 例 下痢が 11 例にみられ B 群でアレルギーが 16 例 悪心が 12 例 下痢が 9 例 味覚異常が 4 例に見られたが 重篤な副作用は報告されなかった 3)A Study to Evaluate the Effects of Lansoprazole in Pediatric Subjects With Esophagitis Treated for Eight to Twelve Weeks (M97-808). 37) [ 対象 ] 1~11 歳の症候性胃食道逆流症患者 [ 目的 ] 1~11 歳の症状を有する症候性胃食道逆流症患者におけるランソプラゾールの 1 日 1 回 (QD) 投与の安全性 薬物動態及び薬力学を評価し 逆流性食道炎の治療におけるラン 12
13 ソプラゾールの有効性を評価する [ 試験デザイン ] 非盲検試験 [ 用法 用量 ] Ⅰ 群 : ランソプラゾール 15 mg 1 日 1 回 ( 30 kg) Ⅱ 群 : ランソプラゾール 30 mg 1 日 1 回 (>30 kg) 8~12 週間投与し 投与 2 週後に症状が残存していた場合に 60 mg/ 日まで増量可 [ 試験結果 ] 結果として 12 例の小児にランソプラゾールが 60 mg/ 日 (1 回 30 mg 1 日 2 回 ) で投与された [ 安全性 ] 60 mg/ 日 (1 回 30 mg 1 日 2 回 ) で投与された 12 例の小児のうち副作用として 1 例に血中ガストリン増加が見られた 重篤な有害事象が 1 例で見られたが治験薬との因果関係は否定された 当該患者は 8 歳男児であり Grade 2 の逆流性食道炎で治験にエントリされ 14 日間のランソプラゾール 30 mg 1 日 1 回投与に続いて 72 日間のランソプラゾール 1 回 30 mg 1 日 2 回投与を受けた 投与開始 7 日目に 当該患者は重度の脱水症状を経験したために 23 時間入院した 治験薬との因果関係は否定され 食中毒による嘔吐や悪心に起因していると考えられた 有害事象は 2 日目 ( 投与開始 8 日目 ) に軽快した 4)Enantioselective disposition of lansoprazole in extensive and poor metabolizers of CYP2C19. Clin Pharmacol Ther. Kim KA, et al. 38) [ 対象 ] CYP2C19 が poor metabolizer 又は extensive metabolizer である健康成人 [ 目的 ] ランソプラゾール 30 mg を 1 日 1 回単回投与した際のエナンチオ選択性の体内動態を検討する [ 試験デザイン ] 単回投与試験 [ 用法 用量 ] ランソプラゾール 30 mg を 1 日 1 回単回投与 [ 試験結果 ] Poor metabolizer (n=6) 又は extensive metabolizer (n=6) のランソプラゾール 30 mg 投与後の薬物動態学的パラメーター ( 平均 ±SD) 13
14 Poor metabolizer (n=6) 又は extensive metabolizer (n=6) のランソプラゾール 30 mg 投与後の 薬物動態学的パラメーター ( 平均 ±SD) における R(+)/S(-) の比率 R(+) の血漿中濃度は一貫して S(-) より高値であった ランソプラゾールの光学異性体の薬物動態は エナンチオ選択性のタンパク結合及び代謝によって影響を受けると考えられる [ 安全性 ] 記載なし 5)A Phase 1, Randomized, Open-Label, Parallel Group, Multicenter Study to Evaluate the Pharmacokinetics and Safety of Dexlansoprazole Modified Release Capsules (30 mg and 60 mg) in Adolescents with Symptomatic Gastroesophageal Reflux Disease (GERD) (T-P ). 39) [ 対象 ] 12~17 歳の症候性胃食道逆流症患者 [ 目的 ] Dexlansoprazole( ラセミ体であるランソプラゾールの R-エナンチオマー ; 国内未承認 ) 30 mg 又は 60 mg を 1 日 1 回反復投与した際の安全性 薬物動態及び薬理学的作用を検討する [ 試験デザイン ] 7 日間の治療期からなる非盲検試験 [ 用法 用量 ] Dexlansoprazole 30 mg/ 日 7 日間又は dexlansoprazole 60 mg/ 日 7 日間 14
15 [ 試験結果 ] 投与 7 日目の薬物動態学的パラメータ ( 平均 ±SD) 12~17 歳と健康成人の薬物動態学的パラメーターの平均値の比較 Dexlansoprazole の一連の曝露量は 投与量と比例の関係に近いものであった 12~17 歳 の症候性胃食道逆流症 (sgerd) 患者に dexlansoprazole 30 mg 又は 60 mg を 1 日 1 回反復 投与した際の薬物動態学的パラメータは 健康成人で得られた薬物動態学的パラメータと 15
16 類似していた [ 安全性 ] 有害事象の発現率は dexlansoprazole 30 mg 群と dexlansoprazole 60 mg 群でそれぞれ 39% 及び 28% であった 最も多く見られた有害事象は dexlansoprazole 30 mg 群で腹痛 (22%; 4/18) dexlansoprazole 60 mg 群では嘔吐及び頭痛 ( それぞれ 11%; 2/18) であり 見られた有害事象の程度はいずれも軽度であった 治験薬との因果関係が否定されなかった有害事象は dexlansoprazole 30 mg 群と dexlansoprazole 60 mg 群でそれぞれ 22% 及び 11% であった 最も多く見られた副作用は dexlansoprazole 30 mg 群で腹痛 ( 22%; 4/18 ) dexlansoprazole 60mg 群では嘔吐 (11%; 2/18) であった 重篤な有害事象及び治験薬の投与を中止した被験者はいなかった 6 ) Dexlansoprazole Delayed-Release Capsules for Healing of Erosive Esophagitis and Maintenance of Healed EE and Relief of Heartburn in Adolescents. (TAK-390MR_207). 40) [ 対象 ] 12~17 歳の逆流性食道炎 (EE) 患者 [ 目的 ] Dexlansoprazole 60mg を 1 日 1 回投与した際の逆流性食道炎の治療の安全性及び有効性を検討すること 並びに dexlansoprazole 30mg を 1 日 1 回反復投与した際の逆流性食道炎の治療維持期の安全性及び有効性を検討する [ 試験デザイン ] 8 週間の逆流性食道炎の治療期 ( 非盲検 ) 後 16 週間の治療維持期 ( 二重盲検 ) からなる試験 [ 用法 用量 ] 治療期 :Dexlansoprazole 60 mg/ 日 8 週間投与治療維持期 :Dexlansoprazole 30 mg/ 日 16 週間投与又はプラセボ [ 試験結果 ] 結果として 62 例に dexlansoprazole 60 mg/ 日が投与された [ 安全性 ] 治療期 :Dexlansoprazole 60 mg/ 日における有害事象の発現率は 61%(38/62) にみられ そのうち 3 例に副作用 ( 胸痛 傾眠 蕁麻疹にそれぞれ 1 例 ) が見られた 重篤な有害事象は 1 例で見られたが治験薬との因果関係は否定された 当該患者は 16 歳であり dexlansoprazole 60 mg 投与後 42 日目に物質乱用が見られたが 治験は継続し 治療期を終え治療維持期に参加した 治験薬との因果関係は否定され 併用薬のパラセタモールに起因していると考えられた < 日本における臨床試験等 > 1) わが国における小児 若年者の Helicobacter pylori 除菌治療の実態と安全性菊地正 悟ら 41) ( 要望された医薬品を用い要望内容を検討した試験報告 ) 16
17 小児に対する Helicobacter pylori 除菌治療は保険適用外であるが実際には 小児期ヘリコバクター ピロリ感染症の診断 治療 および管理指針 などに基づいて除菌治療が行われている 小児科専門医研修施設と日本小児栄養消化器肝臓学会会員に対して 小児 若年者に対する除菌治療の有効性と安全性を検討するため後ろ向き症例調査を実施した 12 歳以上症例 205 例の解析では PAC(PPI+AMPC+CAM) 療法の除菌率は 71.6% PAM(PPI+AMPC+MNZ) 療法は 100% であった 副作用は 13.7% に認めたが重篤なものはなかった 岡山県真庭市では 2013 年に中学 2 年生 3 年生を対象として希望者に尿を用いた H. Pylori 検診 ( ラピラン H. ピロリ抗体 ) を行い 陽性者では二次検診として尿素呼気試験 (UBT) を行った 検診は本人あるいは保護者が希望した医療機関で行った 一次 二次検診ともに陽性であった者のうち 希望者に除菌治療を行った 小児における CAM 耐性率が高いことを考慮して 除菌レジメンは PAM 療法としてランピオンパックを用い 副作用軽減目的としてビオフェルミン R 1 回 1 錠 1 日 2 回 7 日間を併用した 317 名が検診を受け ( 受検率 35.1%) H. Pylori 感染者は 14 名で 全員が治療を希望し 除菌治療を行った 除菌判定は治療終了 6~8 週後に尿素呼気試験で行い 成功率は 100% であった 副作用は 1 名 (7.1%) に軟便 下痢を認めた ICH-GCP 準拠の臨床試験については その旨記載すること (2)Peer-reviewed journal の総説 メタ アナリシス等の報告状況 (3) 教科書等への標準的治療としての記載状況 (4) 学会又は組織等の診療ガイドラインへの記載状況 < 日本におけるガイドライン等 > 1)H. pylori 感染の診断と治療のガイドライン (2016 改訂版 ) 14) 編集 : 日本ヘリコバクター学会ガイドライン作成委員会 提言胃癌予防 :B 青少年期 の項の概要 1. H. pylori 感染のスクリーニング検査は中学生以降であれば可能である解説年少児では 再感染のリスクが高く 抗体測定キットによる感染診断の感度が低い 一方 中学生以降では 抗体による検査も成人と同等の精度であり 感染のスクリーニング検査は中学生以降であれば可能である 中学生は義務教育であるため 自治体による施策として実施する場合 対象の把握が容易であり 高い受診率を期待できるので検査時期としては中学生が効率的と推測される H. pylori 感染と確診された場合は 各地域の医療状況 年齢や体質に依存する除菌治療のベネフィットとリスク 本人や保護者の意向を考慮し できるだけ早期の除菌治療が望ましい なお 現時点では除菌治療は 小児には保険適用の範囲外である 2. 青少年期の除菌治療は次世代への感染対策として有効である 17
18 解説親になるまでに行う対策として 青少年期に除菌治療をすることは 家族内感染を 予防し 次世代への感染対策として非常に有効で わが国では再感染率も少ないことから 確実性も高い (5) 要望内容に係る本邦での臨床試験成績及び臨床使用実態 ( 上記 (1) 以 外 ) について (6) 上記の (1) から (5) を踏まえた要望の妥当性について < 要望効能 効果について > 効能 効果については以下の記載が適当と考える その妥当性について以下に記す 効能 効果 下記におけるヘリコバクター ピロリの除菌の補助胃潰瘍 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡的治療後胃 ヘリコバクター ピロリ感染胃炎 効能 効果の設定の妥当性について 小児の胃潰瘍 十二指腸潰瘍における H. pylori 除菌について ランソプラゾールの使用実態を海外及び国内のガイドライン 文献 成書等により調査したところ 小児へのプロトンポンプインヒビター ( 以下 PPI) アモキシシリン クラリスロマイシンの 3 剤併用療法は Evidence-based Guidelines From ESPGHAN NASPGHAN 34) 及び日本の 小児期ヘリコバクター ピロリ感染症の診断 治療 及び管理指針 16) においても高いエビデンスを根拠に H. pylori の除菌が推奨されている 国内外で広く用いられている実態があり これらの疾患に対する本剤の臨床上の有用性は高く 上記の効能 効果は妥当であると判断した < 要望用法 用量について > 用法 用量については 以下の記載が適当と考える その妥当性について以下に記す 用法 用量 体重 30 kg 以上 40 kg 未満の 12 歳以上の小児 通常 体重 30 kg 以上 40 kg 未満の 12 歳以上の小児には ランソプラゾールとして 1 回 30mg アモキシシリン水和物として 1 回 750 mg( 力価 ) 及びクラリスロマイシンとして 1 回体重 1 kg あたり 7.5 mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する プロトンポンプインヒビター アモキシシリン水和物及びクラリスロマイシンの 3 剤投与によるヘリコバクター ピロリの除菌治療が不成功の場合は これに代わる治療として 通常 ランソプラゾールとして 1 回 30 mg アモキシシリン水和物として 1 回 750 mg ( 力価 ) 及びメトロニダゾールとして 1 回 250 mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する 18
19 体重 30 kg 未満の 12 歳以上の小児 通常 体重 30 kg 未満の 12 歳以上の小児には ランソプラゾールとして 1 回 15 mg アモキシシリン水和物として 1 回 1 kg あたり 25 mg( 力価 ) 及びクラリスロマイシンとして 1 回 1 kg あたり 7.5mg( 力価 ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する プロトンポンプインヒビター アモキシシリン水和物及びクラリスロマイシンの 3 剤投与によるヘリコバクター ピロリの除菌治療が不成功の場合は これに代わる治療として 通常 ランソプラゾールとして 1 回 15 mg アモキシシリン水和物として 1 回 1 kg あたり 25 mg( 力価 ) 及びメトロニダゾールとして 1 回 250 mg( 力価 )( 体重 25 kg 以上の小児に限る ) の 3 剤を同時に 1 日 2 回 7 日間経口投与する 体重 40 kg 以上の 12 歳以上の小児 成人用量に準じる 用法 用量の設定の妥当性について 現在までに臨床試験成績及び臨床使用経験より 以下の知見が得られており ランソプラゾールの用法 用量に関しては 要望内容のとおり用法 用量を設定することが適当と考える 文言については既に承認されている成人での用法 用量の記載に合わせたものとした なお ランソプラゾールと併用する他の製剤については 各製剤への開発要望が別途検討されていると考えられることから 本企業見解においては 要望内容のとおりとしている 1) 3. 要望内容に係る国内外の公表文献 成書等について (1) で記載した報告 は 胃がん予防対策として中学 高校生に対して H. pylori 検診と除菌治療をおこなわれるようになってきた と記述があり 12 歳以上での使用が広まっている また 3. 要望内容に係る国内外の公表文献 成書等について (4) で記載した H. pylori 感染の診断と治療のガイドライン 14) では H. pylori 感染のスクリーニング検査は中学生以降であれば可能である とされており 検査精度の観点においても中学生 (12 歳 ) 以上での使用が望ましいと考えられる 35) で 2) ランソプラゾールは米国で症候性胃食道逆流症及び逆流性食道炎の短期治療で小児適応を有しているが その 1~11 歳児に対する承認用量は体重換算ではなく 体重で層別した固定用量 ( 体重 30 kg 以下 :15 mg/ 回 30kg 超 :30 mg/ 回 ) であり 12 歳以上は成人と同一用量である また 12~17 歳を対象にランソプラゾール 15 mg/ 日 又は 30 mg/ 日を 5 日間投与した海外の臨床試験では その薬物動態及び薬力学的作用は成人と類似していた 35) H. pylori 除菌の補助におけるランソプラゾールの投与目的は 胃内 ph を上昇させて中性領域に近づけることである 成人の逆流性食道炎の治癒の用量が 30 mg/ 回 1 日 1 回であり H. pylori 除菌の補助における用量が 30 mg/ 回 1 日 2 回であることから 米国での症候性胃食道逆流症及び逆流性食道炎の短期治療の体重別の用量 12 19
20 ~17 歳を対象とした海外の臨床試験における薬物動態及び薬力学的作用を参考にすると 体重 30 kg 以下で 15 mg/ 回 30 kg 超で 30 mg/ 回を 1 日 2 回投与することで 除菌補助に必要な胃内 ph の上昇が可能であると推察される なお 国内外の小児ガイドラインで示されている除菌治療の PPI の用量は体重換算となっているが 16)34) 現在発売されている PPI では 体重換算で投与可能な経口製剤はない ランソプラゾールの経口製剤として タケプロンではカプセル及び口腔内崩壊錠 (OD 錠 ) の 15mg 及び 30mg 含有製剤を販売しているが 脱カプセル及び OD 錠を粉砕して使用することを目的とした製剤ではない 3) 欧州で 4 歳を超える小児及び青年の除菌治療として保険適用となっているオメプラゾールの承認用量は 欧米のガイドラインの推奨量とは異なり 体重換算になっておらず kg でオメプラゾール 10 mg/ 回 kg でオメプラゾール 20 mg/ 回である オメプラゾールのヘリコバクター ピロリ除菌に対する成人での承認用量は 20 mg/ 回でありランソプラゾールのそれは 30 mg/ 回であることから これらを基にした比例計算及び上述 2) から 1 回当たりのランソプラゾールの用量を 30 kg 未満で 15 mg 30 kg 以上で 30 mg が妥当と考えた この用量は国内外のガイドラインの 1 回当たりの推奨用量と一致していないが 用量に大きな隔たりは起こっていない 16)34) 4) 上述 2) のように 米国におけるランソプラゾールの 1~11 歳児に対する承認用量は体重換算ではなく 体重で層別した固定用量 ( 体重 30 kg 以下 :15 mg/ 回 30 kg 超 : 30 mg/ 回 ) であり 12 歳以上は成人と同一用量である 本邦において 5 歳及び 11 歳の体重の中央値は それぞれ男で 18 kg 36 kg 女で 18 kg 37 kg とその差は約 2 倍と大きい 一方 12 歳及び 17 歳の体重の中央値は それぞれ男で 42 kg 60 kg 女で 42 kg 51 kg とその増加は緩やかになり 成人の体重へと近づく また ランソプラゾール製剤として タケプロンではカプセル又は OD 錠 (15mg 及び 30mg 含有製剤 ) のみであることから 比較的低体重も存在する 11 歳未満に固定用量を投与するよりも 成人の体重に緩やかに近づく 12 歳以上での投与に限定した方が望ましいと考える なお 12 歳の 3% タイル値は男で 30 kg 女で 31 kg であることから 12 歳以上であれば概ね 30kg 以上の体重を有していると考えられる 42) 5) ランソプラゾール 60 mg/ 日投与時の安全性について 国内では 3. 要望内容に係る国内外の公表文献 成書等について (1) で記載した報告 41) から H. Pylori 感染者 14 例のうち 副作用として軟便 下痢が 1 例に見られた 海外では 7~17 歳の H. Pylori 感染者 225 例のうち 副作用として アレルギーが 23 例 悪心が 20 例 下痢が 11 例 味覚異常が 4 例に見られたが 重篤な副作用は報告されなかった 36) また 11 歳以下の症候性胃食道逆流症を有する 12 例のうち 副作用として血中ガストリン増加が 1 例に見られたが重篤な副作用はなかった 37) さらに ランソプラゾールには光学異性体 ( ランソプラゾール 30 mg 投与後の R 体の AUC は S 体の 5 倍以上あり S 体に比べ R 体が主となっている 38) ) があるが 海外では R 体のみである dexlansoprazole を用いた臨床 20
21 試験が実施されており 60 mg/ 日で 12~17 歳の被験者を対象に投与した試験における投与 7 日目の AUC tau の平均値は 5120 (ng h/ml) を示し 39) ランソプラゾールを 30 mg/ 日で 12~17 歳の被験者を対象に投与した試験における投与後 5 日目の AUC tau の平均値 2490 (ng h/ml) 35) の 2 倍程度であったことから 同年代の被験者にランソプラゾールを 1 回 30 mg 1 日 2 回投与した際の AUC と同程度と考えられた そこで 12~17 歳を対象に海外で実施された逆流性食道炎患者 62 例を対象として dexlansoprazole 60 mg/ 日を 8 週間投与した臨床試験における安全性を参照すると 副作用として 胸痛 傾眠 蕁麻疹がそれぞれに 1 例に見られた 40) これらで報告された副作用は ランソプラゾールの安全性プロファイル上 いずれも既知の副作用であり 新たに認められた副作用はなかった < 臨床的位置づけについて> 小児の胃潰瘍 十二指腸潰瘍における PPI アモキシシリン クラリスロマイシンの 3 剤併用 ( 不成功例に対しては クラリスロマイシンをメトロニダゾールに変更した 3 剤併用 ) の H. pylori 除菌は Evidence-based Guidelines From ESPGHAN NASPGHAN 34) 及び日本の 小児期ヘリコバクター ピロリ感染症の診断 治療 および管理指針 16) においても高いエビデンスを根拠に H. pylori の除菌が推奨されている 欧米も含めて標準的療法に位置づけられている実態があり また 国内 海外で実施された臨床試験において 問題とされる副作用の発現は報告されていないことから 本剤の要望に対する有効性及び安全性は 医学薬学上公知であると判断できる 4. 実施すべき試験の種類とその方法案 特になし 5. 備考 <その他 > 現在 ランソプラゾールの剤形はカプセル及び OD 錠のみであり 小児に利便性の高い細粒等は販売されていない ランソプラゾールにおける H. pylori の除菌治療には ランソプラゾール アモキシシリン及びクラリスロマイシンをパック化したランサップ 400( クラリスロマイシンの 1 日量 400 mg) ランサップ 800( クラリスロマイシンの 1 日量 800 mg) 43 ) ランソプラゾール アモキシシリン及びメトロニダゾールをパック化したランピオンパック 44 ) が販売されている これら薬剤は 固定用量のためすべての小児に用いることは適切ではないが 体重 30 kg 以上かつ 12 歳以上の小児に対しては ランサップ 400 同 800 及びランピオンパックを服薬可能にしておくことは 患者の利便性の観点から有用であると考える 妥当性について ランソプラゾールと併用する他の製剤については 各製剤への開発要望が別途検討されていると考えているが 現時点においては 下記のように考える ランサップ 400 同
22 ランソプラゾール アモキシシリンの用法用量は 本企業見解と同様である 要望書ではクラリスロマイシンは 1 回体重 1 kg あたり 7.5 mg( 力価 ) であることから 30 kg の小児には 1 日あたり 30 kg 7.5 mg/kg 2 回 = 450 mg/ 日を投与することになる 450 mg/ 日は ランサップ 400 に含まれるクラリスロマイシンの 1 日用量 (400 mg) を超えていることから 体重 30 kg 以上かつ 12 歳以上の小児に対してランサップ 400 を使用することは問題ないと考える なお 体重 40 kg 以上かつ 12 歳以上の小児は 成人用量に準じることから 通常用量となるランサップ 400 に加え 必要に応じてランサップ 800 を使用することが可能となる ランピオンパック本製剤に含まれる用法用量は 本企業見解に記載した用法用量と同様であり 体重 30 kg 以上かつ 12 歳以上の小児に対して本剤を使用することは問題ないと考える 6. 参考文献一覧 1)* 人口推計 ( 平成 26 年 10 月 1 日現在 ) 総務省統計局 2) Akamatsu T, Ichikawa S, Okudaira S, et al. Introduction of an examination and treatment for Helicobacter pylori infection in high school health screening. J Gastroenterol Dec;46(12): ) 小児栄養消化器肝臓病学日本小児栄養消化器肝臓学会編集 : 表題胃 十二指腸潰瘍著者名今野武津子. 胃 十二指腸潰瘍 4) Kato S, Nishino Y, Ozawa K, et al. The prevalence of Helicobacter pylori in Japanese children with gastritis or peptic ulcer disease. J Gastroenterol Aug;39(8): ) Asaka M, Kato M, Takahashi S, et al. Guidelines for the management of Helicobacter pylori infection in Japan: 2009 revised edition. Helicobacter. 15: ) Queiroz DM, Harris PR, Sanderson IR, et al. Iron status and Helicobacter pylori infection in symptomatic children: an international multi -centered study. PLoS One Jul 4;8(7):e ) Choe YH, Kim SK, and Hong YC. The relationship between Helicobacter pylori infection and iron deficiency: seroprevalence study in 937 pubescent children. Arch Dis Child Feb;88(2):178. 8) Uemura N, Okamoto S, Yamamoto S, et al. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med 2001;345: ) Ekstrom AM, Held M, Hansson LE et al. Helicobacter pylori in gastric cancer established by CagA immunoblot as a marker of past infection. Gastroenterology 2001;121: ) Ono S, Kato M, Suzuki M, Ishigaki S, Takahashi M, Haneda M, Mabe K, Shimizu Y. Frequency of Helicobacter pylori-negative gastric cancer and gastric mucosal atrophy in a Japanese endoscopic submucosal dissection series including histological, endoscopic and serological atrophy Digestion. 2012; 86: ) Matsuo T, Ito M, Takata S et al. Low prevalence of Helicobacter pylori negative gastric 22
23 cancer among Japanese. Helicobacter. 16: , ) Kikuchi S, Wada O, Nakajima T, et al. Serum anti -Helicobacter pylori antibody and gastric cancer among young adults. Cancer 75: , ) Kikuchi S, Nakajima T, Kobayashi O, et al. Effect of age on the relationship between gastric cancer and Helicobacter pylori. Jpn J Cancer Res 2000;91: )* H. pylori 感染の診断と治療のガイドライン 改訂版 日本ヘリコバクター学会ガイドライン作成委員会先端医学社 15)* 消化性潰瘍診療ガイドライン 年, 日本消化器病学会編南江堂 16) 加藤晴一, 今野武津子, 清水俊明, 豊田茂, 田尻仁, 奥田真珠美, 藤澤卓爾. 小児期ヘリコバクター ピロリ感染症の診断, 治療, および管理指針. 日本小児科学会雑誌 109: , ) Nakamura S, Sugiyama T, Matsumoto T, et al. Long-term clinical outcome of gastric MALT lymphoma after eradication of H. pylori: a multicentre cohort follow-up study of 420 patients in Japan. Gut 2012: 61: ) 藤村欣吾 宮川義隆 倉田義之他. 成人特発性血小板減少性紫斑病治療の参照ガイド. 臨床血液 2012; 53: ) Fukase K, Kato M, Kikuchi S, et al.; Japan Gast Study Group. Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial. Lancet. 2008; 372: ) Yoon SB, Park JM, Lim CH et al. Effect of Helicobacter pylori eradication on metachronous gastric cancer after endoscopic resection of gastric tumors: A meta-analysis. Helicobacter 2014; 19: ) Asaka M, Kato M, Kudo M, et al. Atrophic changes of gastric mucosa are caused by H. pylori infection rather than aging: studies in asymptomatic Japanese adults. Helicobacter 1996; 1: ) Kodama M, Murakami K, Okimoto T, et al. Ten-year prospective follow-up of histological changes at five points on the gastric mucosa as recommended by the updated Sydney system after H. pylori eradication. J Gastroenterol 2012; 47 (4): ) Nozaki K, Shimizu N, Ikehara Y, et al. Effect of early eradication on Helicobacter pylori -related gastric carcinogenesis in Mongolian gerbils. Cancer Sci. 94: , ) 厚生労働省人口動態統計. 25) Take S, Mizuno M, Ishiki K, et al. Baseline gastric mucosal atrophy is a risk factor associated with the development of gastric cancer after Helicobacter pylori eradication therapy in patients with peptic ulcer diseases. J Gastroenterol 42 (Suppl 17): 21-27, ) Wong BC, Lam SK, Wong WM, et al. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA. 2004;291: ) Sugano K, Tack J, Kuipers EJ, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015; 64: ) Kato S, Kikuchi S, Nakajima S. When does gastric atrophy develop in Japanese children? 23
24 Helicobacter. 2008;13: ) IARC Helicobacter pylori Working Group. Helicobacter pylori eradication as a strategy for preventing gastric cancer. Lyon, France: International Agency for Research on Cancer; 2014 (IARC Working Group Reports, No. 8). 30) Asaka M, Kato M, and Graham DY.. Strategy for eliminating gastric cancer in Japan. Helicobacter Dec;15(6): ) Asaka M. A new approach for elimination of gastric cancer deaths in Japan. Int J Cancer. 2013;132: ) Asaka M, Kato M, and Sakamoto N. Roadmap to eliminate gastric cancer with Helicobacter pylori eradication and consecutive surveillance in Japan. J Gastroenterol Jan;49(1): ) 代表加藤元嗣 ; 厚生労働科学研究費補助金 ( がん臨床研究事業 ) ピロリ菌除菌による胃癌予防の経済評価に関する研究 ( 平成 年度 ) 34) Koletzko S, Jones NL, Goodman KJ, et al.; H pylori Working Groups of ESPGHAN and NASPGHAN. Evidence-based guidelines from ESPGHAN and NASPGHAN for Helicobacter pylori infection in children. J Pediatr Gastroenterol Nutr Aug;53(2): )* Final Study Report (M97-640). A Study to Evaluate the Effects of Lansoprazole 15 mg or 30 mg in Pediatric Subjects With Esophagitis. 36)* eposter M1122; Digestive Disease Week, DDW New Orleans, LA United States. 37)* Final Study Report (M97-808). A Study to Evaluate the Effects of Lansoprazole in Pediatric Subjects With Esophagitis Treated for Eight to Twelve Weeks. 38)* Kim KA, Shon JH, Park JY, et al. Enantioselective disposition of lansoprazole in extensive and poor metabolizers of CYP2C19. Clin Pharmacol Ther Jul;72(1): )* FINAL REPORT (T-P ) A Phase 1, Randomized, Open-Label, Parallel Group, Multicenter Study to Evaluate the Pharmacokinetics and Safety of Dexlansoprazole Modified Release Capsules (30 mg and 60 mg) in Adolescents with Symptomatic Gastroesophageal Reflux Disease (GERD) 40)* CLINICAL STUDY REPORT (TAK-390MR_207). Dexlansoprazole Delayed-Release Capsules for Healing of Erosive Esophagitis and Maintenance of Healed EE and Relief of Heartburn in Adolescents. 41)* 奥田真珠美 菊地正悟 間部克裕他. わが国における小児 若年者の Helicobacter pylori 除菌治療の実態と安全性.Helicobacter Research 2016; 20(2): )* 学校保健統計調査 ( 平成 27 年度 ) 総務省統計局 43)* ランサップ 400 同 800 添付文書 2015 年 12 月改訂 ( 第 24 版 ) 44)* ランピオンパック添付文書 2015 月 3 月改訂 ( 第 10 版 ) * 企業見解で引用した参考文献 24
(別添様式)
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会協和発酵キリン株式会社 要要望番号望成分名さ ( 一般名 ) れ販売名た未承認薬 適応医薬品 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) II-23 アモキシシリン水和物パセトシン細粒 10% 未承認薬適応外薬胃潰瘍又は十二指腸潰瘍におけるヘリコバクター
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会協和発酵キリン株式会社 要要望番号望成分名さ ( 一般名 ) れ販売名た未承認薬 適応医薬品 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) II-23 アモキシシリン水和物パセトシン細粒 10% 未承認薬適応外薬胃潰瘍又は十二指腸潰瘍におけるヘリコバクター
要望番号 ;Ⅱ-183 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者学会 ( 該当する ( 学会名 ; 日本感染症学会 ) ものにチェックする ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 8 要望中 ) 要望する医薬品
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者学会 ( 該当する ( 学会名 ; 日本感染症学会 ) ものにチェックする ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 8 要望中 ) 要望する医薬品 要望内容 成分名 ( 一般名 ) 販売名 会社名 国内関連学会 未承認薬 適応 外薬の分類 ( 該当するものにチェックする )
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者学会 ( 該当する ( 学会名 ; 日本感染症学会 ) ものにチェックする ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 8 要望中 ) 要望する医薬品 要望内容 成分名 ( 一般名 ) 販売名 会社名 国内関連学会 未承認薬 適応 外薬の分類 ( 該当するものにチェックする )
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
要望番号 ;Ⅱ-286 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
(別添様式)
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
要望番号 ;Ⅱ 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望 者 ( 該当するものにチェックする ) 優先順位 学会 ( 学会名 ; 日本ペインクリニック学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 2 位 ( 全 4 要望中 )
 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望 者 ( 該当するものにチェックする ) 優先順位 学会 ( 学会名 ; 日本ペインクリニック学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 2 位 ( 全 4 要望中 ) 成分名 ( 一般名 ) 塩酸リドカイン 販売名 0.5%/1%/2% キシロカイン 要望する医薬品要望内容 会社名 国内関連学会
未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望 者 ( 該当するものにチェックする ) 優先順位 学会 ( 学会名 ; 日本ペインクリニック学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 2 位 ( 全 4 要望中 ) 成分名 ( 一般名 ) 塩酸リドカイン 販売名 0.5%/1%/2% キシロカイン 要望する医薬品要望内容 会社名 国内関連学会
(別添様式1)
 未承認薬 適応外薬の要望 ( 別添様式 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本呼吸器学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 2 位 ( 全 6 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 シクロスポリンネオーラルノバルテイス ファーマ ( 選定理由 )
未承認薬 適応外薬の要望 ( 別添様式 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本呼吸器学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 2 位 ( 全 6 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 シクロスポリンネオーラルノバルテイス ファーマ ( 選定理由 )
会社名
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会社名サノフィ アベンティス株式会社要望番号 Ⅱ-110 成分名スピラマイシン Spiramycin ( 一般名 ) Rovamycine 1500000 IE 錠要望され販売名 Rovamycine 1500000 UI 錠た医薬品 Rovamycine3000000 UI 錠 要望内容 未承認薬 適応外薬の分類
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会社名サノフィ アベンティス株式会社要望番号 Ⅱ-110 成分名スピラマイシン Spiramycin ( 一般名 ) Rovamycine 1500000 IE 錠要望され販売名 Rovamycine 1500000 UI 錠た医薬品 Rovamycine3000000 UI 錠 要望内容 未承認薬 適応外薬の分類
要望番号 ;Ⅱ-24 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 8 位 ( 全 33 要望中
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 8 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 amoxicillin-clabulanate
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 8 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 amoxicillin-clabulanate
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
150800247.indd
 ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
ヘリコバクター ピロリ ピロリ菌 感染症について 消化器内科 藤澤 聖 1983 年に胃の粘膜からピロリ菌が発見されて以来様々な研究がなされ ピロリ菌と胃の関係や 種々の病気との関連について明らかになってきました ピロリ菌が胃に感染すると長い年月をかけて 萎縮性胃炎 腸上皮化生という状態を惹き起こし そこから大部分の胃癌が発生すると言われてい ます また胃潰瘍 十二指腸潰瘍や胃 MALT リンパ腫など胃腸疾患のみならず
(別添様式1)
 未承認薬 適応外薬の要望 ( 別添様式 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; ) 患者団体 ( 患者団体名 ; 特定非営利活動法人骨形成不全症協会 ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 1 件要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 パミドロン酸二ナトリウム ( パミドロネート ) アレディアノバルティスファーマ株式会社
未承認薬 適応外薬の要望 ( 別添様式 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; ) 患者団体 ( 患者団体名 ; 特定非営利活動法人骨形成不全症協会 ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 1 件要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 パミドロン酸二ナトリウム ( パミドロネート ) アレディアノバルティスファーマ株式会社
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会エーザイ株式会社社 名 要望番号 Ⅲ-4-14 成分名 ( 一般名 ) ラベプラゾールナトリウム 販売名パリエット錠 5 mg 及びパリエット錠 10 mg 要望された医薬品 未承認薬 適 応外薬の分 類 (
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会エーザイ株式会社社 名 要望番号 Ⅲ-4-14 成分名 ( 一般名 ) ラベプラゾールナトリウム 販売名パリエット錠 5 mg 及びパリエット錠 10 mg 要望された医薬品 未承認薬 適 応外薬の分 類 ( 該当するものにチェックする ) 未承認薬 2009 年 4 月以降に FDA 又は EMA で承認されたが
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会エーザイ株式会社社 名 要望番号 Ⅲ-4-14 成分名 ( 一般名 ) ラベプラゾールナトリウム 販売名パリエット錠 5 mg 及びパリエット錠 10 mg 要望された医薬品 未承認薬 適 応外薬の分 類 ( 該当するものにチェックする ) 未承認薬 2009 年 4 月以降に FDA 又は EMA で承認されたが
未承認の医薬品又は適応の承認要望に関する意見募集について
 ( 別添様式 1-1) 未承認薬の要望 要望者 日本てんかん学会 優先順位 2 位 ( 全 12 要望中 ) 医薬品名 成分名 ルフィナマイド 販売名 Inovelon( 欧州 ) Banzel( 米国 ) 会社名 エーザイ 承認国 欧州 29 カ国 ( 英国 独国 仏国を含む ) 米国 効能 効果 レノックス ガストー症候群 (4 歳以上 ) に伴う発作に対する併用 療法 用法 用量 欧州 小児患者
( 別添様式 1-1) 未承認薬の要望 要望者 日本てんかん学会 優先順位 2 位 ( 全 12 要望中 ) 医薬品名 成分名 ルフィナマイド 販売名 Inovelon( 欧州 ) Banzel( 米国 ) 会社名 エーザイ 承認国 欧州 29 カ国 ( 英国 独国 仏国を含む ) 米国 効能 効果 レノックス ガストー症候群 (4 歳以上 ) に伴う発作に対する併用 療法 用法 用量 欧州 小児患者
13
 未承認薬 適応外薬の要望に対する学会見解 ( 別添様式 ) 1. 要望内容に関連する事項会社名ノバルティス (Novartis) 社要望番号成分名 Artemether Lumefantrine 要望され ( 一般名 ) ( アーテメター ルメファントリン合剤 ) た医薬品 Riamet Tablet( 英 独 仏 豪 ) 販売名 Coartem Tablet( 米 ) 未承認薬 2009 年 4
未承認薬 適応外薬の要望に対する学会見解 ( 別添様式 ) 1. 要望内容に関連する事項会社名ノバルティス (Novartis) 社要望番号成分名 Artemether Lumefantrine 要望され ( 一般名 ) ( アーテメター ルメファントリン合剤 ) た医薬品 Riamet Tablet( 英 独 仏 豪 ) 販売名 Coartem Tablet( 米 ) 未承認薬 2009 年 4
< F2D C D838A8BDB92CA926D2E6A7464>
 保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
保医発 0221 第 31 号平成 25 年 2 月 21 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ヘリコバクター ピロリ感染の診断及び治療に関する取扱いについて の一部改正について 今般 ヘリコバクター ピロリ感染の診断及び治療に使用する医薬品の効能
したことによると考えられています 4. ピロリ菌の検査法ピロリ菌の検査法にはいくつかの種類があり 内視鏡を使うものとそうでないものに大きく分けられます 前者は 内視鏡を使って胃の組織を採取し それを材料にしてピロリ菌の有無を調べます 胃粘膜組織を顕微鏡で見てピロリ菌を探す方法 ( 鏡検法 ) 先に述
 ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
ピロリ菌のはなし ( 上 ) 大阪掖済会病院部長 消化器内科佐藤博之 1. はじめにピロリ菌という言葉を聞いたことがある方も多いと思います ピロリ菌はヒトの胃の中に住む細菌で 胃潰瘍や十二指腸潰瘍に深く関わっていることが明らかにされています 22 年前に発見されてから研究が精力的に進められ 以後 胃潰瘍や十二指腸潰瘍の治療法が大きく様変わりすることになりました 我が国では 2000 年 11 月に胃潰瘍
ンヒビターの 3 剤を同時に 1 日 2 回,7 日間経口投与する 15~30kg 未満 30~40kg 未満 フ ロトンホ ンフ インヒヒ ター 各薬剤の要望書参照 各薬剤の要望書参照 AMPC 50mg/kg/ 日 1500mg/ 日 MNZ 500mg/ 日 500mg/ 日 (25kg 以上
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会塩野義製薬株式会社社 名 要望番号 Ⅲ-4-13 成分名 ( 一般名 ) メトロニダゾール 販売名フラジール内服錠 要望された医薬品 未承認薬 適 応外薬の分 類 ( 該当するものにチェックする ) 未承認薬 2009 年 4 月以降に FDA 又は EMA で承認されたが 国内で承認されていない医薬品 上記以外のもの
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会塩野義製薬株式会社社 名 要望番号 Ⅲ-4-13 成分名 ( 一般名 ) メトロニダゾール 販売名フラジール内服錠 要望された医薬品 未承認薬 適 応外薬の分 類 ( 該当するものにチェックする ) 未承認薬 2009 年 4 月以降に FDA 又は EMA で承認されたが 国内で承認されていない医薬品 上記以外のもの
Microsoft PowerPoint - __________________________ ppt
 日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
日本ヘリコバクター学会のガイドラインについて教えて下さい ピロリ菌を除菌すると胃癌の予防になるのですか? 2009 年 1 月 日本ヘリコバクター学会よりピロリ菌除菌に関するガイドラインが発表されました それによるとピロリ菌に感染している人はすべて除菌を受けることを強く勧められています (%) 12 8 内視鏡治療後の別の胃癌の発生率 除菌しない場合 : 4.1 %/ 年 除菌できた場合 :1.4
<4D F736F F D2082A8926D82E782B995B68F C D815B838B43505F4F E31302E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のランソプラゾールカプセル15mg/30mg トーワ ランソプラゾールOD 錠 15mg/30mg トーワ の 効能 効果 用法 用量 追加が平成 22 年
患者 ID: 氏名 : ピロリ菌外来説明文書 1. ピロリ菌はいつ誰によって発見されたのでしょうかピロリ菌はオーストラリアのウォレンとマーシャルによって 1983 年ヒトの胃の中から発見されました その後 ピロリ菌がヒトの胃に与える様々な影響が解明
 ピロリ菌外来 についてのお知らせ ( 平成 21 年 11 月開設 ) 平成 21 年 11 月より当院消化器内科外来において 保険適応のない方についてピロリ菌の判定 除菌を目的とする ピロリ菌外来を実施してきましたが 平成 26 年 4 月からは 内視鏡検査を 6 ヶ月以内に行った方については 原則すべての患者において保険診療でピロリ菌の除菌ができるようになりました しかしながら 保険診療では除菌治療は
ピロリ菌外来 についてのお知らせ ( 平成 21 年 11 月開設 ) 平成 21 年 11 月より当院消化器内科外来において 保険適応のない方についてピロリ菌の判定 除菌を目的とする ピロリ菌外来を実施してきましたが 平成 26 年 4 月からは 内視鏡検査を 6 ヶ月以内に行った方については 原則すべての患者において保険診療でピロリ菌の除菌ができるようになりました しかしながら 保険診療では除菌治療は
(別添様式)
 未承認薬 適応外薬要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会サノフィ株式会社社 名 要望番号 Ⅲ-3-19 成分名 ( 一般名 ) フルダラビンリン酸エステル 販売名フルダラ静注用 50mg 要望された医薬品 未承認薬 適 応外薬分類 ( 該当するもにチェックする ) 未承認薬 2009 年 4 月以降に FDA 又は EMA で承認されたが 国内で承認されていない医薬品
未承認薬 適応外薬要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会サノフィ株式会社社 名 要望番号 Ⅲ-3-19 成分名 ( 一般名 ) フルダラビンリン酸エステル 販売名フルダラ静注用 50mg 要望された医薬品 未承認薬 適 応外薬分類 ( 該当するもにチェックする ) 未承認薬 2009 年 4 月以降に FDA 又は EMA で承認されたが 国内で承認されていない医薬品
<4D F736F F F696E74202D208E7396AF835A837E B814088DD82AA82F1975C966882C68C9F D838A8BDB82C682CC90ED82A >
 胃がん予防と検診 ピロリ菌との戦い けいあいクリニックク木村正之 2012.01.21 横浜市民セミナー 本日の内容 ピロリ菌の発見 ピロリ菌の感染 ピロリ菌の特徴 ピロリ菌の検査方法 ピロリ菌と胃の病気 ピロリ菌の治療 ( 除菌治療 ) 胃がんの予防 ピロリ菌の発見 細菌は胃内に棲息できない? 胃の中に細菌がすみつくことはありえるのだろうか? ピロリ菌って ピロリ菌の正式名 : ヘリコバクターピロリHelicobacter
胃がん予防と検診 ピロリ菌との戦い けいあいクリニックク木村正之 2012.01.21 横浜市民セミナー 本日の内容 ピロリ菌の発見 ピロリ菌の感染 ピロリ菌の特徴 ピロリ菌の検査方法 ピロリ菌と胃の病気 ピロリ菌の治療 ( 除菌治療 ) 胃がんの予防 ピロリ菌の発見 細菌は胃内に棲息できない? 胃の中に細菌がすみつくことはありえるのだろうか? ピロリ菌って ピロリ菌の正式名 : ヘリコバクターピロリHelicobacter
企業としての開発の意思 医療上の必要性に係る基準 への 該当性 ( 該当するものにチェックし 分類した根拠について記載する ) あり なし ( 開発が困難とする場合 その特段の理由 ) 本件は抗生物質の承認内容にも影響することからオメプラゾールの承認権者のみでの開発は困難である 1. 適応疾病の重篤
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 要望内容 アストラゼネカ株式会社要望番号 II-59 成分名オメプラゾール ( 一般名 ) 販売名オメプラール錠 10 及びオメプラール錠 20 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 要望内容 アストラゼネカ株式会社要望番号 II-59 成分名オメプラゾール ( 一般名 ) 販売名オメプラール錠 10 及びオメプラール錠 20 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
Ⅲ-1-7 ( 別添様式 1) 未承認薬 適応外薬の要望 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児救急医学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 4 位 ( 全 4 要望中 ) 成 分 名 ( 一般名
 Ⅲ-1-7 ( 別添様式 未承認薬 適応外薬の要望 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児救急医学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 4 位 ( 全 4 要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 Ketorolac tromethamine ( 注射液 ) Toradol
Ⅲ-1-7 ( 別添様式 未承認薬 適応外薬の要望 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児救急医学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 4 位 ( 全 4 要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 Ketorolac tromethamine ( 注射液 ) Toradol
<4D F736F F D2082A8926D82E782B995B68F D815B838B8FF E31312E646F63>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加に伴う 使用上の注意 改訂のお知らせ 2010 年 11 月 東和薬品株式会社 このたび 平成 22 年 6 月に承認事項一部変更承認申請をしていました弊社製品のオメプラゾール錠 トーワ 10mg/20mgの 効能 効果 用法 用量 追加が平成 22 年 11 月 15 日付にて 下記の内容で承認されました また承認に伴い
改訂の理由及び調査の結果直近 3 年度の国内副作用症例の集積状況 転帰死亡症例 アモキシシリン水和物及びクラブラン酸カリウム アモキシシリン水和物の国内症例が集積したことから 専門委員の意見も踏まえた調査の結果 改訂することが適切と判断した 血小板減少関連症例 1 アモキシシリン水和物 3 例 (
 アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
アモキシシリン水和物含有製剤の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1 アモキシシリン水和物 1 サワシリンカプセル 125 同カプセ 2 クラブラン酸カリウル 250 同細粒 10% 同錠 250( アム アモキシシリン水ステラス製薬株式会社 ) パセト和物シンカプセル 125 同カプセル 3 ランソプラゾール ア 250 同細粒
た 18 歳以上の AD/HD 患者を対象に 日本人を含むアジア人によるプラセボ対照二重盲検比較試験及びその長期継続投与試験が現在実施されており 本剤の製造販売者によれば これらの試験成績に基づき 本剤の成人期 AD/HD 患者への追加適応に関する承認事項一部変更承認申請が行われる予定とされている
 ( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
要望番号 ;Ⅱ-221 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本神経学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 5 位 ( 全 8 要望中 ) 要望する医薬品
 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本神経学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 5 位 ( 全 8 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ポラプレジンクプロマック細粒 15% ゼリア新薬工業株式会社
未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本神経学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 5 位 ( 全 8 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ポラプレジンクプロマック細粒 15% ゼリア新薬工業株式会社
タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg 有効成分 ボノプラザンフマル酸塩 製造販売業者 武田薬品工業株式会社 薬効分類 提出年月 2018 年 4 月 1.1. 安全性検討事項 重要
 タケキャブ錠 10 mg タケキャブ錠 20 mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は 武田薬品工業株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません 武田薬品工業株式会社 タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg
タケキャブ錠 10 mg タケキャブ錠 20 mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は 武田薬品工業株式会社に帰属するものであり 当該情報を適正使用以外の営利目的に利用することはできません 武田薬品工業株式会社 タケキャブ錠 10 mg 他に係る医薬品リスク管理計画書 (RMP) の概要 ( 別紙様式 ) 販売名 タケキャブ錠 10 mg 同 20 mg
C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法 の有効性 安全性等について 肝炎治療戦略会議報告書平成 23 年 11 月 28 日
 C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法 の有効性 安全性等について 肝炎治療戦略会議報告書平成 23 年 11 月 28 日 C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法の 有効性 安全性等について 1. 有効性及び対象について セログループ 1 のC 型慢性肝炎に対する ペグインターフェロン リバビリン及びテラプレビル3 剤併用療法 ( 以下単に 3 剤併用療法 という
C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法 の有効性 安全性等について 肝炎治療戦略会議報告書平成 23 年 11 月 28 日 C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法の 有効性 安全性等について 1. 有効性及び対象について セログループ 1 のC 型慢性肝炎に対する ペグインターフェロン リバビリン及びテラプレビル3 剤併用療法 ( 以下単に 3 剤併用療法 という
10 年相対生存率 全患者 相対生存率 (%) (Period 法 ) Key Point 1 10 年相対生存率に明らかな男女差は見られない わずかではあ
 (ICD10: C91 C95 ICD O M: 9740 9749, 9800 9999) 全体のデータにおける 治癒モデルの結果が不安定であるため 治癒モデルの結果を示していない 219 10 年相対生存率 全患者 相対生存率 (%) 52 52 53 31 29 31 26 23 25 1993 1997 1998 01 02 06 02 06 (Period 法 ) 21 17 55 54
(ICD10: C91 C95 ICD O M: 9740 9749, 9800 9999) 全体のデータにおける 治癒モデルの結果が不安定であるため 治癒モデルの結果を示していない 219 10 年相対生存率 全患者 相対生存率 (%) 52 52 53 31 29 31 26 23 25 1993 1997 1998 01 02 06 02 06 (Period 法 ) 21 17 55 54
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
<4D F736F F D B8D9197A B408D5C949F8AD B789C193A18CB38E6B2E646F6378>
 第 70 回道南医学会大会特別報告 函館市の中学生におけるピロリ検診の実情と今後のあり方 国立病院機構函館病院院長 加藤元嗣 要旨 函館市では保険福祉行政事業として 中学生のピロリ菌検査が 2016 年度から開始された 函館市内の中学 2 年生に対して 一次検査として尿中 H. pylori 抗体検査 二次検査として尿素呼気試験を行った 感染者は任意に協力医療機関で除菌治療を受ける 協力施設に対して中学生ピロリ検診についてアンケート調査を行った
第 70 回道南医学会大会特別報告 函館市の中学生におけるピロリ検診の実情と今後のあり方 国立病院機構函館病院院長 加藤元嗣 要旨 函館市では保険福祉行政事業として 中学生のピロリ菌検査が 2016 年度から開始された 函館市内の中学 2 年生に対して 一次検査として尿中 H. pylori 抗体検査 二次検査として尿素呼気試験を行った 感染者は任意に協力医療機関で除菌治療を受ける 協力施設に対して中学生ピロリ検診についてアンケート調査を行った
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
PowerPoint プレゼンテーション
 ピロリ菌と胃がん ピロリ菌の早期除菌で 胃がんは予防できる ナポレオンの死因は胃癌だった!? 社内資料 ピロリ菌って何ですか ピロリ菌は正式にはヘリコバクター ピロリという細菌で 1983 年にオーストラリアのウォレンとマーシャルによって発見されました ピロリ菌が胃 十二指腸かいようなどの原因になっていることがわかり ウォレンとマーシャルは 2005 年にノーベル医学生理学賞を受賞しています
ピロリ菌と胃がん ピロリ菌の早期除菌で 胃がんは予防できる ナポレオンの死因は胃癌だった!? 社内資料 ピロリ菌って何ですか ピロリ菌は正式にはヘリコバクター ピロリという細菌で 1983 年にオーストラリアのウォレンとマーシャルによって発見されました ピロリ菌が胃 十二指腸かいようなどの原因になっていることがわかり ウォレンとマーシャルは 2005 年にノーベル医学生理学賞を受賞しています
PT51_p69_77.indd
 臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
臨床講座 特発性血小板減少性紫斑病 ITP の登場によりその危険性は下がりました また これまで 1 ヘリコバクター ピロリの除菌療法 治療の中心はステロイドであり 糖尿病 不眠症 胃炎 ヘリコバクター ピロリ ピロリ菌 は 胃炎や胃 十二指 満月様顔貌と肥満などに悩む患者が多かったのですが 腸潰瘍に深く関わっています ピロリ菌除菌療法により約 受容体作動薬によりステロイドの減量 6 割の患者で 血小板数が
スイッチ OTC 医薬品の候補となる成分についての要望 に対する見解 1. 要望内容に関連する事項 組織名日本消化器病学会 要望番号 H28-11 H28-12 H28-16 成分名 ( 一般名 ) オメプラゾール ランソプラゾール ラベプラゾールオメプラゾール : 胸やけ ( 胃酸の逆流 ) 胃痛
 スイッチ OTC 医薬品の候補となる成分についての要望 に対する見解 1. 要望内容に関連する事項 組織名日本消化器病学会 要望番号 H28-11 H28-12 H28-16 成分名 ( 一般名 ) オメプラゾール ランソプラゾール ラベプラゾールオメプラゾール : 胸やけ ( 胃酸の逆流 ) 胃痛 もたれ むかつき 要望内容 効能 効果 ランソプラゾール : 繰り返しおこる胸やけ ( 食道への胃酸の逆流
スイッチ OTC 医薬品の候補となる成分についての要望 に対する見解 1. 要望内容に関連する事項 組織名日本消化器病学会 要望番号 H28-11 H28-12 H28-16 成分名 ( 一般名 ) オメプラゾール ランソプラゾール ラベプラゾールオメプラゾール : 胸やけ ( 胃酸の逆流 ) 胃痛 もたれ むかつき 要望内容 効能 効果 ランソプラゾール : 繰り返しおこる胸やけ ( 食道への胃酸の逆流
10 年相対生存率 全患者 相対生存率 (%) (Period 法 ) Key Point 1
 (ICD10: C81 85, C96 ICD O M: 9590 9729, 9750 9759) 治癒モデルの推定結果が不安定であったため 治癒モデルの結果を示していない 203 10 年相対生存率 全患者 相対生存率 (%) 71 68 50 53 52 45 47 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 43 38 41 76
(ICD10: C81 85, C96 ICD O M: 9590 9729, 9750 9759) 治癒モデルの推定結果が不安定であったため 治癒モデルの結果を示していない 203 10 年相対生存率 全患者 相対生存率 (%) 71 68 50 53 52 45 47 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 43 38 41 76
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開
![審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開 審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開](/thumbs/53/31072016.jpg) 審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
( 別添様式 ) 未承認薬 適応外薬の要望に対する企業見解 ( 募集対象 (3)) 1. 要望内容に関連する事項 会 社 名 大正製薬株式会社 要望された医薬品要望内容 要望番号 成分名 ( 一般名 ) 募集対象の 分類 ( 必ずいずれかにチェックする 複数に該当する場合は 最も適切な 1 つにチェ
 ( 別添様式 ) 未承認薬 適応外薬の要望に対する企業見解 ( 募集対象 (3)) 1. 要望内容に関連する事項 会 社 名 大正製薬株式会社 要望された医薬品要望内容 要望番号 成分名 ( 一般名 ) 募集対象の 分類 ( 必ずいずれかにチェックする 複数に該当する場合は 最も適切な 1 つにチェックする ) ( 要望されたについて記載する ) ( 要望されたについて記載する ) 備 考 IVS-2
( 別添様式 ) 未承認薬 適応外薬の要望に対する企業見解 ( 募集対象 (3)) 1. 要望内容に関連する事項 会 社 名 大正製薬株式会社 要望された医薬品要望内容 要望番号 成分名 ( 一般名 ) 募集対象の 分類 ( 必ずいずれかにチェックする 複数に該当する場合は 最も適切な 1 つにチェックする ) ( 要望されたについて記載する ) ( 要望されたについて記載する ) 備 考 IVS-2
症例報告書の記入における注意点 1 必須ではない項目 データ 斜線を引くこと 未取得 / 未測定の項目 2 血圧平均値 小数点以下は切り捨てとする 3 治験薬服薬状況 前回来院 今回来院までの服薬状況を記載する服薬無しの場合は 1 日投与量を 0 錠 とし 0 錠となった日付を特定すること < 演習
 ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
どのくらいの人がピロリ菌に感染しているのですか? 日本人のピロリ菌感染者は約 3500 万人といわれています 日本では欧米に比べると感染率が高く 特に 50 歳以上の人で感染している割合が高いとされています しかし 衛生環境が整って来た事により若い世代の感染は減少傾向にあります ピロリ菌に感染すると
 ピロリ菌専門外来 ピロリ菌除菌治療の勧め日本ヘリコバクター 学会は ヘリコバクター ピロリ感染の診断と治療のガイドライン (2009 年 ) で すべてのヘリコバクター ピロリ感染者に対し除菌治療を行なうよう推奨致しました しかし ピロリ菌に対する検査 除菌治療の保険適応は 胃 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡治療後 の 4 疾患に限られ 胃がん予防としての
ピロリ菌専門外来 ピロリ菌除菌治療の勧め日本ヘリコバクター 学会は ヘリコバクター ピロリ感染の診断と治療のガイドライン (2009 年 ) で すべてのヘリコバクター ピロリ感染者に対し除菌治療を行なうよう推奨致しました しかし ピロリ菌に対する検査 除菌治療の保険適応は 胃 十二指腸潰瘍 胃 MALT リンパ腫 特発性血小板減少性紫斑病 早期胃癌に対する内視鏡治療後 の 4 疾患に限られ 胃がん予防としての
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
厚生労働省告示024号/平成22年1月22日告示/平成22年1月22日施行
 厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
厚生労働省告示第 206 号 / 平成 30 年 4 月 17 日告示 / 平成 30 年 4 月 18 日施行 区分商品名規格単位会社名成分名効能 効果用法 用量規制等備考 内用薬レキサルティ 1mg1 錠大塚製薬ブレクスピプ統合失調症 通常 にはブレクスピプラゾールとして 1 日 1 回 1mg から投与を開始した後 劇 錠 1mg ラゾール 4 日以上の間隔をあけて増量し 1 日 1 回 2mg
審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]
![審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ] 審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]](/thumbs/91/105024304.jpg) 審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
第1回肝炎診療ガイドライン作成委員会議事要旨(案)
 資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
スライド 1
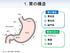 1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
1. 胃の構造 胃の構造 胃底部 胃底部 胃体部 幽門部 胃液の成分ペプシン胃酸粘液 1. 胃の構造 胃の構造と役割 噴門胃底部胃体部幽門部 粘液を分泌胃酸 ( 塩酸 ) ペプシンを分泌胃酸 ( 塩酸 ) ペプシンを分泌ガストリンを血液中に分泌 ペプシン 胃酸 粘液 タンパク質を分解 病原菌の殺菌やペプシノーゲンの活性化 ペプシンや胃酸から胃粘膜を保護 1. 復習 胃の構造と役割 噴門 胃底部 胃体部
<4D F736F F D208BA38D DA81458BA38D878AE98BC6838A E646F6378>
 平成 26 年 10 月 14 日 ジャディアンス錠 平成 25 年 10 月 8 日 ( 錠 25mg) 日本ベーリンガー 品目 10mg, 同錠 25mg 年月日 平成 25 年 12 月 13 日 ( 錠 10mg) 者名 インゲルハイム株式会社 薬事分科会審議参加規程における, 上記品目に係る競合品目, 競合企業及びその選定理由は以下のとおりです 競合品目 1 競合品目 2 競合品目 3 スーグラ錠
平成 26 年 10 月 14 日 ジャディアンス錠 平成 25 年 10 月 8 日 ( 錠 25mg) 日本ベーリンガー 品目 10mg, 同錠 25mg 年月日 平成 25 年 12 月 13 日 ( 錠 10mg) 者名 インゲルハイム株式会社 薬事分科会審議参加規程における, 上記品目に係る競合品目, 競合企業及びその選定理由は以下のとおりです 競合品目 1 競合品目 2 競合品目 3 スーグラ錠
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
DRAFT#9 2011
 報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
用法・用量DB
 データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
シプロフロキサシン錠 100mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを
 シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
先発品とのの相違の一覧 エダラボン点滴静注 30mg 杏林 エダラボン点滴静注 30mg 杏林 脳梗塞急性期に伴う神経症候 日常生活動作障害 機能障害の改善 通常 成人に 1 回 1 管 ( エダラボンとして 30mg) を適当量の生理食塩液等で用時希釈し 30 分かけて 1 日朝夕 2 回の点滴静
 先発品とのの相違の一覧 ( ご注意 ) 赤字は 先発品と異なる です この一覧に掲載している項目は 主に です その他使用上の注意などにつきましては 各製品の添付文書をご参照下さい 用語や文面など 一部異なる場合があります 詳細は各製品の添付文書ご参照ください 2018 年 4 月 4 日 アリピプラゾール OD 錠 3mg/6mg/12mg 杏林 アリピプラゾール OD 錠 3mg 杏林 アリピプラゾール
先発品とのの相違の一覧 ( ご注意 ) 赤字は 先発品と異なる です この一覧に掲載している項目は 主に です その他使用上の注意などにつきましては 各製品の添付文書をご参照下さい 用語や文面など 一部異なる場合があります 詳細は各製品の添付文書ご参照ください 2018 年 4 月 4 日 アリピプラゾール OD 錠 3mg/6mg/12mg 杏林 アリピプラゾール OD 錠 3mg 杏林 アリピプラゾール
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
3. 胃がんの診断について胃透視や上部消化管内視鏡検査により病変を検出するとともに病変の範囲や深さを詳細に観察し 内視鏡検査で採取します生検標本を病理組織学的に診断します 拡大内視鏡検査によりさらに詳細に観察したり 超音波内視鏡検査により病変の深さを観察します また 腹部超音波検査や CT 検査など
 胃がんの予防 ~ ピロリ菌の除菌 ~ 大学病院総合診療内科 今枝博之 1. はじめに我が国における胃がんの死亡率は徐々に減少していますが 年間罹患数は約 11 万人とすべてのがんの約 20% を占め 年間死亡数は約 5 万人といまだに多くみられます 近年 胃に棲息するヘリコバクター ピロリ ( ピロリ菌 ) が胃がんの原因として明らかとなり ピロリ菌の除菌による胃の発がん予防の有用性が報告されています
胃がんの予防 ~ ピロリ菌の除菌 ~ 大学病院総合診療内科 今枝博之 1. はじめに我が国における胃がんの死亡率は徐々に減少していますが 年間罹患数は約 11 万人とすべてのがんの約 20% を占め 年間死亡数は約 5 万人といまだに多くみられます 近年 胃に棲息するヘリコバクター ピロリ ( ピロリ菌 ) が胃がんの原因として明らかとなり ピロリ菌の除菌による胃の発がん予防の有用性が報告されています
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに
 ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
より詳細な情報を望まれる場合は 担当の医師または薬剤師におたずねください また 患者向医薬品ガイド 医療専門家向けの 添付文書情報 が医薬品医療機器総合機構のホームページに掲載されています
 くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
に係る基準 への 該当性 ( 該当するものにチェックし 該当すると考えた根拠について記載する ) イ病気の進行が不可逆的で 日常生活に著しい影響を及ぼす疾患 ウその他日常生活に著しい影響を及ぼす疾患 ( 上記の基準に該当すると考えた根拠 ) 母体がトキソプラズマに感染した場合 胎児感染の危険がある
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 公益社団法人日本産科婦人科学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 4 位 ( 全 13 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 スピラマイシン Rovamycine 錠
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 公益社団法人日本産科婦人科学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 4 位 ( 全 13 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 スピラマイシン Rovamycine 錠
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.6.1 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.1 緒言一般名 : エソメプラゾールマグネシウム水和物 目次 頁 目次... 2 略語及び専門用語一覧表...
はじめに 胃の中に住みつくヘリコバクター ピロリ ( ピロリ菌 ) が発見されたのは 1982 年のことです 以後 今日までにさまざかいようまな研究が進められ ピロリ菌感染が胃炎や消化性潰瘍 ( 胃潰じゅうにしちょうかいよう瘍 十二指腸潰瘍 ) の重要な原因であることが明らかになりました 現在では
 ヘリコバクター じゅうにしちょうピロリと胃 十二指腸 監修 医療法人新生会 高田中央病院 総院長藤岡利生 ( 大分大学名誉教授 ) はじめに 胃の中に住みつくヘリコバクター ピロリ ( ピロリ菌 ) が発見されたのは 1982 年のことです 以後 今日までにさまざかいようまな研究が進められ ピロリ菌感染が胃炎や消化性潰瘍 ( 胃潰じゅうにしちょうかいよう瘍 十二指腸潰瘍 ) の重要な原因であることが明らかになりました
ヘリコバクター じゅうにしちょうピロリと胃 十二指腸 監修 医療法人新生会 高田中央病院 総院長藤岡利生 ( 大分大学名誉教授 ) はじめに 胃の中に住みつくヘリコバクター ピロリ ( ピロリ菌 ) が発見されたのは 1982 年のことです 以後 今日までにさまざかいようまな研究が進められ ピロリ菌感染が胃炎や消化性潰瘍 ( 胃潰じゅうにしちょうかいよう瘍 十二指腸潰瘍 ) の重要な原因であることが明らかになりました
<4D F736F F D2082A8926D82E782B995B68F D815B838B4E618FF931306D E3131>
 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加及び 使用上の注意 改訂のお知らせ 2012 年 11 月 東和薬品株式会社 このたび 平成 24 年 5 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 24 年 11 月 19 日付にて 下記の内容で承認されました また 使用上の注意 の項も改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読みください 効能 効果 用法 用量 追加及び 使用上の注意 改訂のお知らせ 2012 年 11 月 東和薬品株式会社 このたび 平成 24 年 5 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 24 年 11 月 19 日付にて 下記の内容で承認されました また 使用上の注意 の項も改訂致しましたので 併せてお知らせ申し上げます
審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7
![審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7 審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7](/thumbs/92/110490968.jpg) 審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
Ⅲ-1-69 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児栄養消化器肝臓学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位第 1 位 ( 全要望中 ) 成 分 名 (
 Ⅲ-1-69 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児栄養消化器肝臓学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位第 1 位 ( 全要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 ポリエチレングリコール MOVICOL Paediatric Plain
Ⅲ-1-69 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児栄養消化器肝臓学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位第 1 位 ( 全要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 ポリエチレングリコール MOVICOL Paediatric Plain
5_使用上の注意(37薬効)Web作業用.indd
 34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
あった AUCtはで ± ng hr/ml で ± ng hr/ml であった 2. バイオアベイラビリティの比較およびの薬物動態パラメータにおける分散分析の結果を Table 4 に示した また 得られた AUCtおよび Cmaxについてとの対数値
 モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ
![審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ 審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ](/thumbs/92/110667825.jpg) 審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
 資料 3-3 資料 3-7 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 ( 案 ) < 小児 WG> 目次 < > 医療上の必要性の基準に該当すると考えられた品目 本邦における適応外薬アモキシシリン水和物 ( 要望番号 ;34) 1 アンピシリンナトリウム ( 要望番号 ;43) 7 医療上の必要性の高い未承認薬 適応外薬検討会議 医療上の必要性に係る基準 への該当性の評価
資料 3-3 資料 3-7 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 ( 案 ) < 小児 WG> 目次 < > 医療上の必要性の基準に該当すると考えられた品目 本邦における適応外薬アモキシシリン水和物 ( 要望番号 ;34) 1 アンピシリンナトリウム ( 要望番号 ;43) 7 医療上の必要性の高い未承認薬 適応外薬検討会議 医療上の必要性に係る基準 への該当性の評価
別紙
 臨床研究の参加と協力のお願い 中学生に対するピロリ菌検診と除菌治療に関する調査研究 ( 中学生 保護者用説明文書 ) この説明書は 中学生に対するピロリ菌検診と除菌治療に関する調査研究 の内容について説明したものです この研究について十分理解された上で 研究の対象者として研究に参加されるかどうかを決めてください また この研究を途中で辞退してもなんら不利益を受けることはありませんのでご安心ください
臨床研究の参加と協力のお願い 中学生に対するピロリ菌検診と除菌治療に関する調査研究 ( 中学生 保護者用説明文書 ) この説明書は 中学生に対するピロリ菌検診と除菌治療に関する調査研究 の内容について説明したものです この研究について十分理解された上で 研究の対象者として研究に参加されるかどうかを決めてください また この研究を途中で辞退してもなんら不利益を受けることはありませんのでご安心ください
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
(4940 人を 48 ヵ月間追跡した試験 )Kaplan-Meier s 法による解析により 4 年での累積再発率は 7.8% となり 年率 1.9% と計算された 胃潰瘍では 9.3%(2.3%/ 年 ) 十二指腸潰瘍 6.2%(1.6%/ 年 ) 胃十二指腸潰瘍 6.4%(1.6%/ 年 )
 ヘリコバクター ピロリ除菌のパンフレット (111130) 消化性潰瘍患者に対して ピロリ菌の除菌を勧めることもある 一体 どれくらいの効果があるのか デメリットはどの様なものがあるのか 何に注意するべきなのかについて分かりやすく説明する必要がある 自分自身が十分に理解していないと説明できないのだが パンフレットがあれば説明の助けになる 自分で説明しやすいように作ってみることにした その前に 基本的な情報が書いてある資料の整理
ヘリコバクター ピロリ除菌のパンフレット (111130) 消化性潰瘍患者に対して ピロリ菌の除菌を勧めることもある 一体 どれくらいの効果があるのか デメリットはどの様なものがあるのか 何に注意するべきなのかについて分かりやすく説明する必要がある 自分自身が十分に理解していないと説明できないのだが パンフレットがあれば説明の助けになる 自分で説明しやすいように作ってみることにした その前に 基本的な情報が書いてある資料の整理
医療法人原土井病院治験審査委員会
 社会医療法人原土井病院治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名議題及び審議結果を含む主な議論の概要 平成 29 年 2 月 21 日 ( 火曜日 )16 時 12 分から 16 時 59 分社会医療法人原土井病院第 1 会議室朔元則 上﨑典雄 毛戸彰 真名子佐喜子 境一成 関成人 廣瀬禎子 高橋富美 奥田安孝議題 1 1 施設からの審査依頼により 日本ベーリンガーインゲルハイム株式会社の依頼による中等症
社会医療法人原土井病院治験審査委員会 会議の記録の概要 開催日時開催場所出席委員名議題及び審議結果を含む主な議論の概要 平成 29 年 2 月 21 日 ( 火曜日 )16 時 12 分から 16 時 59 分社会医療法人原土井病院第 1 会議室朔元則 上﨑典雄 毛戸彰 真名子佐喜子 境一成 関成人 廣瀬禎子 高橋富美 奥田安孝議題 1 1 施設からの審査依頼により 日本ベーリンガーインゲルハイム株式会社の依頼による中等症
Ⅲ-1-31 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児血液 がん学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 7 位 ( 全 9 要望中 ) 成 分 名 (
 Ⅲ-1-31 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児血液 がん学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 7 位 ( 全 9 要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 クリゾチニブ XALKORI ファイザー株式会社日本血液学会
Ⅲ-1-31 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児血液 がん学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 7 位 ( 全 9 要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 クリゾチニブ XALKORI ファイザー株式会社日本血液学会
Microsoft Word - JAID_JSC 2014 正誤表_ 原稿
 JAID/JSC 感染症治療ガイド 2014 表 記載にりがありましたので, 下記のように追加 訂させていただきます 2016 年 9 月 JAID/JSC 感染症治療ガイド ガイドライン作成委員会 P106 Ⅶ 呼吸器感染症,A-2 院内肺炎 3 Definitive Therapy P. aeruginosa 多剤耐性の場合 CL:5mg/kg 1 回ローディング その 24 時間後に以下の維持用量を開始する
JAID/JSC 感染症治療ガイド 2014 表 記載にりがありましたので, 下記のように追加 訂させていただきます 2016 年 9 月 JAID/JSC 感染症治療ガイド ガイドライン作成委員会 P106 Ⅶ 呼吸器感染症,A-2 院内肺炎 3 Definitive Therapy P. aeruginosa 多剤耐性の場合 CL:5mg/kg 1 回ローディング その 24 時間後に以下の維持用量を開始する
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
<4D F736F F D2082A8926D82E782B995B68F E834E838D838A E3132>
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能 効果 用法 用量 使用上の注意 改訂のお知らせ 2013 年 12 月 東和薬品株式会社 このたび 平成 25 年 8 月に承認事項一部変更承認申請をしていました弊社上記製品の 効能 効果 用法 用量 追加が平成 25 年 11 月 29 日付にて 下記の内容で承認されました また 使用上の注意 を改訂致しましたので 併せてお知らせ申し上げます
10 年相対生存率 全患者 相対生存率 (%) (Period 法 ) Key Point 1 の相対生存率は 1998 年以降やや向上した 日本で
 151 10 年相対生存率 全患者 相対生存率 (%) 82 76 79 61 60 53 52 51 46 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 44 40 43 Key Point 1 の相対生存率は 1998 年以降やや向上した 日本でパクリタキセル カルボプラチン併用療法が標準治療となった時期と一致する 0 1 2 3 4 5
151 10 年相対生存率 全患者 相対生存率 (%) 82 76 79 61 60 53 52 51 46 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 44 40 43 Key Point 1 の相対生存率は 1998 年以降やや向上した 日本でパクリタキセル カルボプラチン併用療法が標準治療となった時期と一致する 0 1 2 3 4 5
2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び
![2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び 2. 改訂内容および改訂理由 2.1. その他の注意 [ 厚生労働省医薬食品局安全対策課事務連絡に基づく改訂 ] 改訂後 ( 下線部 : 改訂部分 ) 10. その他の注意 (1)~(3) 省略 (4) 主に 50 歳以上を対象に実施された海外の疫学調査において 選択的セロトニン再取り込み阻害剤及び](/thumbs/91/105459093.jpg) - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 使用上の注意改訂のお知らせ 2010 年 8 月 製造販売元 選択的セロトニン再取り込み阻害剤 ( 一般名 : パロキセチン塩酸塩水和物 ) 謹啓時下益々ご清栄のこととお慶び申し上げます 平素は 弊社医薬品につきまして格別のご高配を賜り 厚く御礼申し上げます さて この度 の 使用上の注意 を改訂致しましたのでお知らせ申し上げます なお
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
別添 1 抗不安薬 睡眠薬の処方実態についての報告 平成 23 年 11 月 1 日厚生労働省社会 援護局障害保健福祉部精神 障害保健課 平成 22 年度厚生労働科学研究費補助金特別研究事業 向精神薬の処方実態に関する国内外の比較研究 ( 研究代表者 : 中川敦夫国立精神 神経医療研究センタートラン
 別添 抗不安薬 睡眠薬の処方実態についての報告 平成 年 月 日厚生労働省社会 援護局障害保健福祉部精神 障害保健課 平成 年度厚生労働科学研究費補助金特別研究事業 向精神薬の処方実態に関する国内外の比較研究 ( 研究代表者 : 中川敦夫国立精神 神経医療研究センタートランスレーショナル メディカルセンター臨床研究支援室 ) を参考として 抗不安薬 睡眠薬の処方実態について主なポイントをまとめた.
別添 抗不安薬 睡眠薬の処方実態についての報告 平成 年 月 日厚生労働省社会 援護局障害保健福祉部精神 障害保健課 平成 年度厚生労働科学研究費補助金特別研究事業 向精神薬の処方実態に関する国内外の比較研究 ( 研究代表者 : 中川敦夫国立精神 神経医療研究センタートランスレーショナル メディカルセンター臨床研究支援室 ) を参考として 抗不安薬 睡眠薬の処方実態について主なポイントをまとめた.
91_52
 Helicobacter pylori 除菌前後における消化器症状の検討 1 )* 1) 1) 2) 小熊一豪久保定徳野津史彦白石廣照 2) 2) 1) 2) 矢野剛司相原成昭松川正明熊谷一秀 要旨 : 目的 2013 年 2 月より上部消化管内視鏡検査 (EGD) を施行しH. pylori 感染胃炎が疑われた場合にはH. pylori 感染診断検査, 除菌治療が保険収載された.H. pylori
Helicobacter pylori 除菌前後における消化器症状の検討 1 )* 1) 1) 2) 小熊一豪久保定徳野津史彦白石廣照 2) 2) 1) 2) 矢野剛司相原成昭松川正明熊谷一秀 要旨 : 目的 2013 年 2 月より上部消化管内視鏡検査 (EGD) を施行しH. pylori 感染胃炎が疑われた場合にはH. pylori 感染診断検査, 除菌治療が保険収載された.H. pylori
<4D F736F F D2089BB8A7797C C B B835888E790AC8C7689E6>
 2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
図 1 H. pylori と発生 0.4 の発見率となります 図 1 7 さらに H. pylori との発生に関して は組織学的 内視鏡的に詳細に検討されて 図 3 H. pylori と胃粘膜 未感染 表層性胃炎 C います以前は H. pylori が関与するのは分 萎縮性胃炎 軽度萎縮 中
 図 1 H. pylori と発生 0.4 の発見率となります 図 1 7 さらに H. pylori との発生に関して は組織学的 内視鏡的に詳細に検討されて 図 3 H. pylori と胃粘膜 未感染 表層性胃炎 C います以前は H. pylori が関与するのは分 萎縮性胃炎 軽度萎縮 中等度萎縮 高度萎縮 化型だけとされていましたが 実際に はスキルスを起こす未分化型にも関与して いることが分かりましたまた
図 1 H. pylori と発生 0.4 の発見率となります 図 1 7 さらに H. pylori との発生に関して は組織学的 内視鏡的に詳細に検討されて 図 3 H. pylori と胃粘膜 未感染 表層性胃炎 C います以前は H. pylori が関与するのは分 萎縮性胃炎 軽度萎縮 中等度萎縮 高度萎縮 化型だけとされていましたが 実際に はスキルスを起こす未分化型にも関与して いることが分かりましたまた
別紙様式 (Ⅴ)-1-3で補足説明している 掲載雑誌は 著者等との間に利益相反による問題が否定できる 最終製品に関する研究レビュー 機能性関与成分に関する研究レビュー ( サプリメント形状の加工食品の場合 ) 摂取量を踏まえた臨床試験で肯定的な結果が得られている ( その他加工食品及び生鮮食品の場合
 別紙様式 (Ⅴ)-1 機能性の科学的根拠に関する点検表 1. 製品概要商品名アサヒ凹茶 ( ぼこちゃ ) 機能性関与成分名りんごポリフェノール ( りんご由来プロシアニジンとして ) 表示しようとする本品には りんごポリフェノール ( りんご由来プロシア機能性ニジンとして ) が含まれるので 体脂肪が気になる方のお腹の脂肪を減らす機能があります 2. 科学的根拠 臨床試験及び研究レビュー共通事項 (
別紙様式 (Ⅴ)-1 機能性の科学的根拠に関する点検表 1. 製品概要商品名アサヒ凹茶 ( ぼこちゃ ) 機能性関与成分名りんごポリフェノール ( りんご由来プロシアニジンとして ) 表示しようとする本品には りんごポリフェノール ( りんご由来プロシア機能性ニジンとして ) が含まれるので 体脂肪が気になる方のお腹の脂肪を減らす機能があります 2. 科学的根拠 臨床試験及び研究レビュー共通事項 (
256 みならず 未 分 化 型 胃 がん 発 生 にも 関 与 していること 腸 上 皮 化 生 や 体 部 優 勢 胃 炎 は H.pylori 感 染 者 の 中 で も 胃 がんリスクが 高 いことを 示 した また Matsuo ら 9) は 胃 がん 3161 例 について 厳 密 に
 モダンメディア 59 巻 10 号 2013[ 話 題 の 感 染 症 ]255 話 題 の 感 染 症 Helicobacter pyloriと 胃 がん 胃 がん 撲 滅 に 向 けて Helicobacter pylori and gastric cancer for eliminating of gastric cancer いの 井 うえ かず 上 和 Kazuhiko INOUE ひこ
モダンメディア 59 巻 10 号 2013[ 話 題 の 感 染 症 ]255 話 題 の 感 染 症 Helicobacter pyloriと 胃 がん 胃 がん 撲 滅 に 向 けて Helicobacter pylori and gastric cancer for eliminating of gastric cancer いの 井 うえ かず 上 和 Kazuhiko INOUE ひこ
 新潟市ピロリ菌検査 ( 施設 ) 実施要領 新潟市ピロリ菌検査 ( 施設 ) 実施要領 1 目的 ピロリ菌の検査をすることにより, 将来の胃がん発生のリスクの高さを知ることができ, 市民の健康の保 持増進に寄与することを目的とする 2 対 象 者 ⑴ 新潟市に住民票があり,40 歳,45 歳,50 歳及び55 歳の者とする 年齢は, 年度末に達する年齢とする ⑵ 対象者の確認は, 受診券及び健康保険証等により行う
新潟市ピロリ菌検査 ( 施設 ) 実施要領 新潟市ピロリ菌検査 ( 施設 ) 実施要領 1 目的 ピロリ菌の検査をすることにより, 将来の胃がん発生のリスクの高さを知ることができ, 市民の健康の保 持増進に寄与することを目的とする 2 対 象 者 ⑴ 新潟市に住民票があり,40 歳,45 歳,50 歳及び55 歳の者とする 年齢は, 年度末に達する年齢とする ⑵ 対象者の確認は, 受診券及び健康保険証等により行う
要旨 平成 30 年 2 月 21 日新潟県福祉保健部 インターフェロンフリー治療に係る診断書を作成する際の注意事項 インターフェロンフリー治療の助成対象は HCV-RNA 陽性の C 型慢性肝炎又は Child-Pugh 分類 A の C 型代償性肝硬変で 肝がんの合併のない患者です 助成対象とな
 要旨 平成 30 年 2 月 21 日新潟県福祉保健部 インターフェロンフリー治療に係る診断書を作成する際の注意事項 インターフェロンフリー治療の助成対象は HCV-RNA 陽性の C 型慢性肝炎又は Child-Pugh 分類 A の C 型代償性肝硬変で 肝がんの合併のない患者です 助成対象となる薬剤 セログループ ( ジェノタイプ ) 診断名 治療期間は以下のとおりです 薬剤名セログループ (
要旨 平成 30 年 2 月 21 日新潟県福祉保健部 インターフェロンフリー治療に係る診断書を作成する際の注意事項 インターフェロンフリー治療の助成対象は HCV-RNA 陽性の C 型慢性肝炎又は Child-Pugh 分類 A の C 型代償性肝硬変で 肝がんの合併のない患者です 助成対象となる薬剤 セログループ ( ジェノタイプ ) 診断名 治療期間は以下のとおりです 薬剤名セログループ (
2008年10月2日
 2008 年 10 月 16 日 日本小児内分泌学会 成長ホルモン委員会 SGA 性低身長症における GH 治療の実施上の注意 SGA 性低身長症における成長ホルモン (GH) 治療が 2008 年 10 月 16 日に承認されました 詳細については 改訂されたジェノトロピン ( ファイザー株式会社 ) の添付文書により確認して下さい 日本小児内分泌学会では SGA 性低身長症におけるGH 治療に関するガイドライン
2008 年 10 月 16 日 日本小児内分泌学会 成長ホルモン委員会 SGA 性低身長症における GH 治療の実施上の注意 SGA 性低身長症における成長ホルモン (GH) 治療が 2008 年 10 月 16 日に承認されました 詳細については 改訂されたジェノトロピン ( ファイザー株式会社 ) の添付文書により確認して下さい 日本小児内分泌学会では SGA 性低身長症におけるGH 治療に関するガイドライン
2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社 (TPC) 大阪市中央区道修町四丁目 1 番 1 号 治験課題名 : びらん性食道炎の患者を対象にした TAK-438 の 20 mg を 1 日 1 回経口投与したときの有効性及び安全性を 1 日 1 回経口投与
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
