備考 の要望内容 ( 剤 形追加等 ) 2. 要望内容における医療上の必要性について 1. 適応疾病の重篤性本疾患は予後不良な死亡率の高い悪性腫瘍であることから ア生命に重大な影響がある疾患 に該当する 2. 医療上の有用性海外第 Ⅲ 相比較試験 (ABC-02 試験 N Engl J Med 20
|
|
|
- さみら かたいわ
- 5 years ago
- Views:
Transcription
1 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書シスプラチン胆道癌 1. 要望内容の概略について 要望された医薬品 一般名 : シスプラチン販売名 : ブリプラチン注 10mg 同 25mg 同 50mg( ブリストル マイヤーズ株 式会社 ) ランダ注 10mg 同 25mg 同 50mg( 日本化薬株式会社 ) 会社名 : ブリストル マイヤーズ株式会社 日本化薬株式会社 要望者名 日本胆道学会 日本癌治療学会 日本外科学会 胆嚢友の会 厚生労働省厚生労 働科学研究費補助金がん臨床研究事業 ( 第 3 次対がん総合戦略研究事業 ) 切除 不能胆道がんに対する治療法の確立に関する研究 研究班 日本臨床腫瘍学会 東北大学病院腫瘍内科 東北大学加齢医学研究所癌化学療法研究分野 個人 要望内容 効能 効果 胆道癌 用法 用量 < 日本胆道学会 日本癌治療学会 日本外科学会 胆嚢友の会 厚生労働省厚生労働科学研究費補助金がん臨床研究事業 ( 第 3 次対がん総合戦略研究事業 ) 切除不能胆道がんに対する治療法の確立に関する研究 研究班 >< 日本臨床腫瘍学会 >< 東北大学病院腫瘍内科 東北大学加齢医学研究所癌化学療法研究分野 > 胆道癌の場合ゲムシタビン塩酸塩との併用において シスプラチンとして 25mg/m 2 ( 体表面積 ) を60 分かけて点滴静注し 週 1 回投与を2 週連続し 3 週目は休薬する これを1コースとして投与を繰り返す なお 患者の状態により適宜減量する 効能 効果及び 用法 用量以外 < 個人 > シスプラチンとして 25mg/m 2 ( 体表面積 ) を 60 分かけて点滴静注し 週 1 回投与を 2 週連続し 3 週目は休薬する これを 1 コースとして投与を繰り返す 1
2 備考 の要望内容 ( 剤 形追加等 ) 2. 要望内容における医療上の必要性について 1. 適応疾病の重篤性本疾患は予後不良な死亡率の高い悪性腫瘍であることから ア生命に重大な影響がある疾患 に該当する 2. 医療上の有用性海外第 Ⅲ 相比較試験 (ABC-02 試験 N Engl J Med 2010; 362: ) ) の結果 ゲムシタビン単独投与に対して シスプラチン ( 以下 本薬 ) とゲムシタビンの併用投与が予後を改善 ( 全生存期間 (OS) の延長 ) することが示されていることから イ欧米の臨床試験において有効性 安全性等が既存の療法と比べて明らかに優れている に該当する 3. 欧米 4 カ国の承認状況等について (1) 欧米 4カ国の承認状況及び開発状況の有無について 1) 米国効能 効果 PLATINOL( シスプラチン注射剤 USP 準拠 ) は治療薬として 以下のような事項に適用される 転移性精巣腫瘍適切な外科手術もしくは放射線療法 又はその両方をすでに受けた転移性精巣腫瘍患者における他の既承認化学療法剤との確立された併用療法として用いる 転移性卵巣腫瘍適切な外科手術もしくは放射線療法 又はその両方をすでに受けた転移性卵巣腫瘍患者における他の既承認化学療法剤との確立された併用療法として用いる 確立された療法の 1 つは 本剤とシクロホスファミドとの併用である 本剤は単剤療法として 本剤を投与されたことのない患者において標準的化学療法として難治性の転移性卵巣腫瘍の二次治療として適用される 進行膀胱癌 2
3 本剤は 外科手術や放射線療法のような局所療法にはもはや適さない 移行上皮膀胱癌患者における単剤療法として適用される 用法 用量 本剤は緩徐な静脈内注入によって投与する 急速静脈内注射によって本剤を投与してはならない 注意 : 針 または本剤と接触する可能性のあるアルミニウム部品を含む静注セットは 本剤の調製もしくは投与に使用してはならない アルミニウムは本剤と反応し 沈着物の形成と本剤の効力喪失をもたらす 転移性精巣腫瘍精巣癌の治療において他の既承認化学療法剤と併用する場合の本剤の用法 用量 :20mg/m 2 を静脈内に 1 日 1 回 5 日間連続投与し これを 1 クールとする 転移性卵巣腫瘍転移性卵巣腫瘍の治療においてシクロホスファミドと併用する場合の本剤の用法 用量 :75~100mg/m 2 を静脈内に 4 週間毎に 1 回 (1 日目に ) 投与し これを 1 クールとする 本剤と併用する際のシクロホスファミドの用法 用量 :600mg/m 2 を静脈内に 4 週間毎に 1 回 (1 日目に ) 投与する シクロホスファミドの投与方法については 同剤の添付文書を参照すること 併用療法において 本剤とシクロホスファミドは連続して投与する 単剤療法としての本剤の用法 用量 :100mg/m 2 を静脈内に 4 週間毎に 1 回投与し これを 1 クールとする 進行膀胱癌これまでに受けた放射線療法及び ( 又は ) 前化学療法の程度により単剤による 50~70mg/m 2 を静脈内に 3~4 週間毎に 1 回投与し これを 1 クールとする 濃厚な前治療を受けている患者の場合 50mg/m 2 を初回用量とする 1 クールを 4 週間ごとに繰り返すことを推奨する 全患者本剤の投与に先立ち 投与前輸液として 1~2L の輸液を 8~12 時間かけて投与する行うことを推奨する その後 本剤をマンニトール 37.5g 含有の 1/2 又は 1/3 濃度の生理食塩液を含む 5% ブドウ糖 2L に希釈し 3
4 この溶液を 6~8 時間かけて注入する 希釈液を 6 時間以内に使用しない場合は遮光すること その後 24 時間にわたり 適切な輸液及び尿量確保を維持しなければならない 本剤のクールを重ねる際は 血清クレアチニンが 1.5mg/100mL 未満及び ( 又は )BUN 値が 25mg/100mL 未満になるまで投与しないこと クールを重ねる際は循環血液成分が許容できる数値 ( 血小板 : 100,000/mm 3 白血球: 4,000/mm 3 ) になるまで投与しないこと 本剤を継続投与する際は 聴力が正常範囲にあることを聴力検査によって確認してから行うこと 静注用溶液の調製 調製の際の注意本剤粉末の取扱い 及び本剤の溶液の調製は慎重に行うこと 抗癌剤の適正な取扱い及び処分の手順に従うこと この件に関するガイドラインがいくつか公表されている 皮膚曝露のリスクを最小限にするため 本剤注射液を入れたバイアル瓶や静注セットを取り扱うときは必ず 不浸透性の手袋を着用する シスプラチンの偶発的曝露に伴う皮膚反応が生じる可能性がある 手袋の使用を推奨する 本剤の粉末又は溶液が皮膚もしくは粘膜に触れた場合は 直ちに皮膚を石鹸と水で入念に洗い 粘膜を流水で洗う 詳しくは下記の参考文献を参照のこと 承認年月 ( または米 国における開発の有 調製方法 50mg バイアル瓶の内容物を注射用蒸留水 (USP 準拠 )50mL で溶解する 得られた溶液は 1mL につき 本剤を 1mg 含有する 上記のとおり溶解すると 無色 ~ 淡黄色の澄明な溶液が得られる この溶液は静注専用であり 6~8 時間をかけて静脈内注入によって投与すること ( 用法 用量 を参照) 非経口薬剤については その投与前に容器や薬液内に粒子状物質や変色がないかを可能な限り目視検査すること 薬剤師への注意 : 不注意による本剤の過量投与を防ぐよう注意すること 用量が 1 クールあたり 100mg/m 2 を上回る場合は 処方者に問い合わせること バイアル瓶のアルミニウム開封シールには 以下のメッセージが刻印されている 用量が 1 クール当たり 100mg/m 2 を超える場合は医師に問い合わせること 胆道癌の効能 効果については 承認されていない 開発計画の有無は不明 (2010 年 11 月 25 日現在 ) 4
5 無 ) 備考 2) 英国効能 効果用法 用量 本剤は 転移性の非セミノーマ様胚細胞癌 進行及び難治性卵巣癌 進行及び難治性膀胱癌 並びに頭頸部の扁平上皮癌に適応とされる 本剤は 転移性精巣腫瘍の治療において他の抗悪性腫瘍剤との併用により適応とされる シスプラチン ビンブラスチン及びブレオマイシンの併用は 極めて有効であると報告されている 成人及び小児 : 本剤は静脈内注入により 6~8 時間かけて投与する 成人及び小児における本剤の推奨用量は 3~4 週間ごとに 50~ 100mg/m 2 を単回静脈内投与 または 3~4 週間ごとに 15~20mg/m 2 を 1 日 1 回 5 日間連続静注投与する 他の化学療法剤と併用する場合は 用量調節が必要である 本剤の通常用量は 3~4 週間ごとに 20mg/m 2 またはそれ以上である 腎機能障害または骨髄抑制を認める患者には用量を減量すること アルミニウムとの相互作用 : 本剤は金属アルミニウムとの相互作用により 黒い白金沈着物を生じることがある アルミニウムを含有する静注セット 注射針 カテーテル及び注射器は使用しないこと 承認年月 ( または英 国における開発の有 1. 投与前の輸液 : 投与前の輸液は本剤の投与中 ( 及び投与後 ) に利尿を促すため必要である この輸液は 0.9% 食塩液 またはブドウ糖 4% を含有する 1/5 濃度の生理食塩液 (0.18%) のどちらか 2L を 2 時間かけて投与することにより行う 投与前輸液または投与後輸液の終わりの 30 分間に 側枝点滴よりマンニトール 37.5g( すなわち 10% マンニトール注射液 375mL) を投与する 2. シスプラチン注入液の調製 : 1mg/mL のシスプラチン注射液を 0.9% 食塩液 2 L で希釈する 調製液は冷蔵しないこと 3. 投与 : 投与前の輸液に続き シスプラチン注入液を 1~2 時間かけて投与する 6~8 時間かけての さらに長時間の注入によって胃腸及び腎における毒性を軽減する可能性があると報告されている 容器はカバーを被せて遮光すること 使用後 残留内容物を廃棄する 4. 投与後の輸液 : 新たに 0.9% 食塩液 またはブドウ糖 4% を含有する食塩液 (0.18%) のどちらか 2L を 6~12 時間かけて投与するため 静脈内輸液を継続する 胆道癌の効能 効果については 承認されていない 開発計画の有無は不明 (2010 年 11 月 25 日現在 ) 5
6 無 ) 備考 3) 独国効能 効果 - 進行性又は転移性の精巣癌 - 進行性又は転移性の卵巣癌 - 進行性又は転移性の膀胱癌 - 進行性又は転移性の頭頸部の扁平上皮癌 - 進行性又は転移性の非小細胞肺癌 - 進行性又は転移性の小細胞肺癌 用法 用量 シスプラチンは子宮頸癌の治療には放射線治療と併用する シスプラチンは単独又は併用療法にて使用する シスプラチン Teva 1mg/ml 注射用濃縮液は使用前に希釈する 本剤の使用前の希釈に関する注意は項目 6.6 を参照のこと 希釈した溶液は静脈内注入液 ( 以下を参照 ) としてのみ使用する 使用の際には アルミニウム含有の器具 ( 静脈内注入液セット 注射針 カテーテル 注射器 ) がシスプラチンと接触しないように注意する必要がある ( 項目 6.2 を参照 ) 成人及び小児 : シスプラチンの用量は 基礎疾患及び予測される反応のほか シスプラチンが単独療法または併用療法のいずれで使用されるかによっても左右される この用量に関する注意は 成人でも小児でも同じである 単独治療の場合には 次の 2 通りの用量が推奨される : 50~120mg/m²( 体表面積 ) を 3~4 週間おきに 1 回投与 ; 15~20mg/m²/ 日 5 日間の投与を 3~4 週間おきに実施 シスプラチンを併用化学療法として使用する場合は シスプラチンを減量する 常用量が 20mg/m² 以上である場合は 3~4 週間おきに 1 回とする 子宮頸癌の治療では シスプラチンは放射線療法と併用する 常用量は 40mg/m²/ 週とし 投与間隔は 6 週間以上とする 以下の治療クールを開始する前に気をつけるべき警告注意及び予防措置については 項目 4.4 を参照のこと 腎機能障害又は骨髄抑制のみられる患者については 適切な用量に減量する 6
7 調製されたシスプラチン注入液については 取扱い注意 ( 項目 6.6 を参照 ) に従い 調製後 6~8 時間以内に静注投与する シスプラチンを使用する 2~12 時間前及び使用後 6 時間以降に 適切な水分負荷を考慮する シスプラチンの治療中及び治療後に十分な尿量を確保するためには 水分負荷が必要である このような目的のために 以下の溶液を静注投与する : 0.9% 塩化ナトリウム液 0.9% 塩化ナトリウム液と 5% ブドウ糖液 (1:1) の混合液 シスプラチン治療前の水分負荷 : 100~200mL/ 時間の静脈内注入を 6~12 時間かけて行い 少なくとも 合計 1L を注入する シスプラチン投与後の水分負荷 : さらに 2L の静脈内注入を 100~200mL/ 時間の速度で 6~12 時間かけ て行う 承認年月 ( または独国における開発の有無 ) 備考 4) 仏国効能 効果 水分負荷後の尿排泄量が 100~200mL/ 時間より少ない場合は 場合によっては さらに利尿が必要となる この場合は 37.5g の 10% マンニトール溶液 (375mL の 10% マンニトール溶液 ) の静注投与または利尿薬の投与によって正常な腎機能を維持することが可能である マンニトールまたは利尿薬の使用は シスプラチンの用量が 60mg/m 2 ( 体表面積 ) を超える場合に 特に必要となる シスプラチンの注入後は 十分な尿排泄量を確保するために 24 時間にわたって患者に多量の水分を摂取させる必要がある 胆道癌の効能 効果については 承認されていない 開発計画の有無は不明 (2010 年 11 月 25 日現在 ) 精巣癌 卵巣癌 耳鼻咽喉部の癌 食道癌 子宮頸癌 子宮内膜癌 7
8 膀胱癌 類表皮癌 用法 用量 シスプラチンは通常 他の抗悪性腫瘍剤と併用し 多剤併用化学療法として投与されている薬剤である シスプラチン単独療法用量は成人 小児ともに共通の 50~120mg/m 2 ( 体表面積あたり ) であり 静脈内投与に限る 3~6 週間を 1 クールとする 採用される頻度が最も高い方法は以下の 2 通りである 単回注入 5 日間にわたって分割投与本剤投与前に 5% ブドウ糖溶液を少なくとも 1~2L 8~12 時間かけてあらかじめ輸液しておく その後輸液のプロトコールを実施する場合でも 本剤投与は 1 回あたり 30 分 ~2 時間かけて実施すること 本剤投与後 24 時間は 十分な体液量を維持し 十分な利尿を確保すること シスプラチンの用量が適合しているかどうかを確認するために腎機能 聴覚機能 造血機能及び神経機能を定期的に評価すること ( 第 4.3 項 第 4.4 項を参照のこと ) 治療実施サイクルは 3~6 週間間隔をおくこと 併用療法併用する各製剤の性状とその製剤によって引き起こされる毒性を単独投与した場合及び併用投与した場合のいずれも明らかにし そのデータに基づいて本剤の用量を調節すること 注 : シスプラチンはアルミニウムに強く反応して沈殿物を生成し 本剤の作用が消失する このため 注射針など アルミニウムを含有している可能性のある注射用具を使用する場合には特に注意を払う必要がある 投与経路希釈調製した注射剤を静脈内投与すること 血管外漏出が認められた場合には 直ちに投与を中止すること 取り扱い方法 細胞毒性を示す注射剤の調製は必ず 使用する薬剤に関して知識があ り 訓練を受けた専門家が実施する必要があり 環境の保護 特に薬 8
9 承認年月 ( または仏国における開発の有無 ) 備考 剤を取り扱う担当者の保護が保証される環境下で実施すること 調製には 調製のために確保された場所が必要となる その室内は禁煙 飲食禁止とすること 取り扱い担当者は薬剤を取り扱うのに適切な用具を揃えておく必要があり 特に長袖のシャツ 保護マスク 庇なしの帽子 保護メガネ 使い捨ての滅菌済み手袋を用意し 作業台上には保護された空間を確保するほか 廃棄物を収集するための容器及び袋を揃えておく必要がある 吐瀉物の取り扱いには注意を払うこと 妊婦にはあらかじめ注意を促し 細胞毒性物質を取り扱わないようにさせること 容器が割れている場合も同じく 注意を払って取り扱い 汚染廃棄物として処理すること 汚染廃棄物を廃棄する場合には 汚染廃棄物専用のラベル表示がされた硬質の容器に入れて焼却すること 以上の規定は 必要な諸条件を満たし適合性を示す組織作りと併せて 腫瘍学ネットワーク ( 通達 DGS/DH/98 N 98/ 年 3 月 24 日 ) の枞組みのなかで検討すること 胆道癌の効能 効果については 承認されていない 開発計画の有無は不明 (2010 年 11 月 25 日現在 ) (2) 欧米 4 カ国の公的医療保険制度の適用状況について 1) 米国公的医療保険制度に Centers for Medicare & Medicaid Services(CMS) 2) おける記載内容 一般名 シスプラチン 製剤名 cisplatin 剤形 注射剤 効能 効果 胆道癌 用法 用量 記載なし備考 2) 英国公的医療保険制度になしおける記載内容備考 3) 独国公的医療保険制度になしおける記載内容備考 9
10 4) 仏国公的医療保険制度における記載内容備考 なし 4. 要望内容について企業側で実施した海外臨床試験成績について 企業により実施された海外臨床試験はない 5. 要望内容に係る国内外の公表文献 成書等について (1) 無作為化比較試験, 薬物動態試験等の公表論文としての報告状況 代表的な公表論文の概略について 以下に示す (1) ゲムシタビンとの併用投与 海外における報告 1)Gemcitabine alone or in combination with cisplatin in patients with advanced or metastatic cholangiocarcinomas or other biliary tract tumours: a multicentre randomised phase Ⅱ study- The UK ABC-01 Study. Br J Cancer 2009; 101: ) 化学療法歴のない切除不能な局所進行又は転移性の胆道癌 ( 肝内若しくは肝外胆管癌 胆嚢癌 又は乳頭部癌 ) 患者を対象として ゲムシタビン (GEM) 単独投与 (44 例 ) 及び本薬と GEM の併用投与 (42 例 ) の有効性及び安全性を検討する無作為化第 Ⅱ 相試験 (ABC-01 試験 ) が実施された 用法 用量は GEM 単独群で GEM は 1000mg/m 2 の 1 8 及び 15 日目の静脈内投与を 4 週間 (28 日 ) 毎に 6 コースを 本薬と GEM 併用群では本薬 25mg/m 2 及び GEM 1000mg/m 2 の 1 及び 8 日目の静脈内投与を 3 週間 (21 日 ) 毎に 8 コース実施した 有効性について 主要評価項目である 6 ヵ月時点の無増悪生存率 (6 ヵ月 PFS 率 ) は GEM 単独群で 45.5%(95% 信頼区間 (CI):[30.5, 59.3%]) 本薬と GEM 併用群で 57.1%(95%CI: [41.0, 70.3%]) であり 奏効率はそれぞれ 22.6%(7/31 例 ) 及び 27.8%(10/36 例 ) であった 安全性について 10% 以上の頻度で発現した Grade 3 又は 4 の有害事象は GEM 単独群においてビリルビン上昇 (20.5%) 好中球数減少を伴わない感染(15.9%) 並びにトランスアミナーゼ異常及び好中球減少症 ( 各 13.6%) であり 本薬と GEM 併用群では疲労 (28.6%) 好中球数減少を伴わない感染 (19.0%) 血小板減少症 トランスアミナーゼ異常及びビリルビン上昇 ( 各 11.9%) 並びに好中球減少症(14.3%) であった 有害事象による投与中止は GEM 単独群で 2 例 本薬と GEM 併用群の 3 例に認められた ( 注 : 有害事象の詳細は不明 ) なお 死亡に至った有害事象に関する情報は記載されていない 10
11 2)Cisplatin plus Gemcitabine versus Gemcitabine for Biliary Tract Cancer. N Engl J Med 2010; 362: ) 本報告は 前述 1) の第 Ⅱ 相試験 (ABC-01 試験 ) を拡大して実施された無作為化第 Ⅲ 相比較試験 (ABC-02 試験 ) に関する報告であり 本試験は ABC-01 試験と同様の対象患者 410 例 (GEM 単独群 206 例 本薬と GEM 併用群 204 例 )(ABC-01 試験で検討された 86 例を含む ) を対象に実施された 用法 用量は ABC-01 試験と同一の用法 用量にて GEM 単独群は 3 コース 本薬と GEM 併用群は 4 コース実施された 有効性について 主要評価項目は OS とされ 生存期間の中央値 (MST) は GEM 単独群で 8.1 ヵ月 (95%CI:[7.1, 8.7 ヵ月 ]) 本薬と GEM 併用群で 11.7 ヵ月 (95%CI:[9.5, 14.3 ヵ月 ]) であった ( ハザード比 0.64(95%CI:[0.52, 0.80]) p<0.001) また PFS の中央値は GEM 単独群 5.0 ヵ月 本薬と GEM 併用群では 8.0 ヵ月であった 安全性について 10% 以上の頻度で発現した Grade 3 又は 4 の有害事象は GEM 単独群で好中数球減少 (16.6%) 肝機能異常 (27.1%) 疲労 (16.6%) 及び好中球数減少を伴わない感染 (11.6%) であり 本薬と GEM 併用群で白血球数減少 (15.7%) 好中球数減少(25.3%) 肝機能異常 (16.7%) 疲労(18.7%) 及び好中球数減少を伴う感染 (10.1%) であった 本薬と GEM 併用群で本薬によると思われる腎不全で 1 例が死亡した以外 有害事象による投与中止 死亡に関する情報は記載されていない 国内における報告 3)Gemcitabine alone or in combination with cisplatin in patients with biliary tract cancer: a comparative multicentre study in Japan.Br J Cancer 2010; 103: ) 化学療法歴のない切除不能な局所進行又は転移性の胆道癌 ( 肝内若しくは肝外胆管癌 胆嚢癌 又は乳頭部癌 ) 患者 (84 例 ) を対象に ABC-02 試験で検討された投与レジメンの日本人患者での有効性及び安全性を検討する無作為化第 Ⅱ 相試験が実施された 用法 用量は ABC-02 試験と同一の設定とされた 有効性について 主要評価項目である 1 年生存率は GEM 単独群で 31.0%(95%CI:[ 17.0, 44.9%]) 本薬と GEM 併用群で 39.0%(95%CI:[ 23.7, 54.4%]) であった また GEM 単独群及び本薬と GEM 併用群それぞれにおいて 奏効率は 11.9% 及び 19.5% MST は 7.7 ヵ月及び 11.2 ヵ月 PFS の中央値は 3.7 ヵ月及び 5.8 ヵ月であった 安全性について 10% 以上の頻度で発現した Grade 3 以上の有害事象は GEM 単独群で好中球数減少 (38.1%) γ-gtp 増加 (35.7%) 白血球数減少(19.0%) ヘモグロビン減少 AST 上昇 ALT 上昇及び ALP 上昇 ( 各 16.7%) 並びに赤血球減少(14.3%) であり 本薬と GEM 併用群で好中球数減少 (56.1%) 血小板数減少(39.0%) ヘモグロビン減少(36.6%) 赤血球減少 (34.1%) 白血球数減少及び γ-gtp 増加 ( 各 29.3%) ALT 上昇 (24.4%) 並びに AST 上昇及び血中ナトリウム減少 (17.1%) であった 有害事象による投与中止は GEM 単独群で 3 例 本薬と GEM 併用群の 7 例に認められた ( 注 : 有害事象の詳細は不明 ) 有害事象に死 11
12 亡は認められなかった (2) その他 (1) の項に記載した 本薬と GEM との併用投与以外に 本薬単独投与や他の抗悪性腫瘍剤との併用での臨床試験について報告されているが 主なものとして 第 Ⅲ 相試験の報告を以下に示す 1)Phase Ⅲ study of 5FU, etoposide and leucovorin (FELV) compared to epirubicin, cisplatin and 5FU (ECF) in previously untreated patients with advanced biliary cancer. Br J Cancer 2005; 92: ) 化学療法歴のない進行性胆道癌患者 (54 例 ) を対象に 5-FU エトポシド及びロイコボリン併用投与 (FELV) に対する 本薬とエピルビシン及び 5-FU 持続注入併用投与 (ECF) の有効性及び安全性を検討する第 Ⅲ 相比較試験が実施された 用法 用量は ECF は 5FU 200mg/m 2 を 24 週間中心静脈内持続注入 エピルビシン 50mg/m 2 及び本薬 60mg/m 2 を 1 日目に静脈内投与 FELV は 5FU 600mg/m 2 エトポシド 120mg/m 2 及びロイコボリン 60mg/m 2 を 1~3 日目に静脈内投与し 何れのレジメンもこれを 3 週間毎に繰り返した 有効性について 主要評価項目である OS( 中央値 ) は ECF 群で 9.02 ヵ月 (95%CI:[6.46, ヵ月 ]) FELV 群で ヵ月 (95%CI:[9.3, 14.7 ヵ月 ]) であった (p=0.2059) 安全性について 10% 以上の頻度で発現した Grade 3 又は 4 の有害事象は ECF 群で疲労 (56%) 脱毛症 (40%) 貧血及び好中球減少( 各 25.9%) 悪心 嘔吐及び感染( 各 16%) 並びに下痢及び発熱 ( 各 12%) であり FELV 群で脱毛症 (75%) 疲労 (58.3%) 好中球減少 (53.8%) 感染(41.7%) 下痢(12.5%) 及び貧血(11.5%) であった (2)Peer-reviewed journal の総説 メタ アナリシス等の報告状況 代表的な公表論文の概略について 以下に示す 1)Chemotherapy: Gemcitabine alone or plus cisplatin for biliary tract cancer? Nat Rev Clin Oncol 2010; 7: ) 無作為化第 Ⅲ 相比較試験の結果 本薬と GEM の併用投与は GEM 単独投与に比較して 進行性胆道癌患者の病勢コントロール率 PFS 及び OS を 安全性に著変なく有意に改善した このことから 本薬と GEM の併用投与が 進行性胆道癌患者に対する適当な治療選択肢であると考える (3) 教科書等への標準的治療としての記載状況 1)DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology 8th Edition, ) 化学療法の項において 本薬に関して 以下の内容が記載されている 本薬単独投与では有用な試験成績が得られていない 12
13 転移性胆道癌を対象とした化学療法の試験成績として 本薬とエピルビシン及び 5-FU の併用投与 本薬と 5-FU ドキソルビシン及びインターフェロンの併用投与 本薬とカペシタビンの併用投与 本薬とエピルビシン及びカペシタビンの併用投与 本薬とゲムシタビンの併用投与が一覧表に記載されており 本薬とゲムシタビンの併用投与は 単群試験で 21~35% の奏効率と 9~11 ヵ月の生存期間 ( 中央値 ) を示している ゲムシタビンとカペシタビン 又はゲムシタビンと本薬の併用投与は状態の良い人の選択肢として考慮される 2) 新臨床腫瘍学改訂第 2 版 (2009 年 日本臨床腫瘍学会 ) 8) 胆道系がんの治療法の非切除例に対する薬物療法の項において 5-FU 系薬剤や gemcitabine(gem) が key drug として多く用いられており 特に白金系化合物との併用療法が比較的良好な成績を示し期待されてきたが これまで大規模な比較試験がなく標準治療は確立していないとされてきた 2009 年の ASCO において GEM と cisplatin(cddp) の併用療法が GEM 単独療法に比べ明らかな延命効果を有することが英国において実施された第 Ⅲ 相試験で示され わが国で実施された第 Ⅱ 相試験でも同様な成績であった わが国では CDDP が保険未承認だが 本併用療法がグローバルスタンダードと考えられている と記載されている (4) 学会又は組織等の診療ガイドラインへの記載状況 1)NCCN Clinical Practice Guideline in Oncology Hepatobiliary Cancer. V ) 切除不能又は転移性胆道癌の一次治療として 本薬と GEM の併用投与が 標準的治療であるとして推奨されている ( 引用は ABC-02 試験 ) また 当該対象患者に対して フッ化ピリミジン系又は GEM を含む治療が選択肢の一つとして記載されており その中で本薬を含む治療レジメンとして 本薬とカペシタビンの併用投与 本薬と 5-FU の併用投与が記載されている 2)Biliary cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2010; 21(Suppl 5): v ) 切除不能胆道癌の治療の項において 以下の内容が記載されている 進行 転移性胆道癌に対するゲムシタビン単独投与と本薬とゲムシタビンの併用投与を比較検討した第 Ⅲ 相比較試験 (ABC-02 試験 ) の結果 本薬とゲムシタビンの併用群で 明らかな有効性 ( 生存期間延長 ( ハザード比 0.68 p=0.002)) を示し また 臨床的に問題となるような新たな有害事象の発現も見られなかったことから 本薬とゲムシタビンの併用投与は 新しい標準的治療として推奨される 3) 胆道癌診療ガイドライン (2007 年 医学図書出版株式会社 ) 11) 化学療法 CQ-29 有効な化学療法は何か? の項に 以下のように記載されている 13
14 胆道癌では単剤による化学療法の治療効果に限界がみられるため これまで多くの多剤併用療法が試みられてきた 単剤に比べ一般に奏効率が高く 生存期間も長い傾向がみられる 5-FU アントラサイクリン系薬剤 プラチナ系薬剤が組み合わされたレジメンが多いが いずれも標準治療として確立したものはない 最近では GEM を中心としたレジメンが試みられ GEM + cisplatin では奏効率 21~48% 生存期間中央値 4.6~11.0 ヵ月と良好な成績が報告されている ( レベルⅢ) 現在 英国を中心としたグループで GEM 単独と GEM+CDDP 併用の大規模比較試験が行われ 注目されている また 本項の 胆道癌に対する全身化学療法の治療成績 ( 多剤併用 ) の一覧表の中に Platinum-based 治療として 5-FU 等との併用レジメンの成績が記載されており Gemcitabine based 治療として本薬との併用レジメン等の成績が記載されている 6. 本邦での開発状況 ( 経緯 ) 及び使用実態について (1) 要望内容に係る本邦での開発状況 ( 経緯 ) 等について 国内開発なし (2) 要望内容に係る本邦での臨床試験成績及び臨床使用実態について本邦では 5.(1) 無作為化比較試験 薬物動態試験等の公表論文としての報告状況 の項に記載したとおり 胆道癌患者を対象として 本薬と GEM 併用投与の有効性と安全性を検討した第 Ⅱ 相試験成績が報告されている 7. 公知申請の妥当性について (1) 要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価について化学療法歴のない切除不能な進行又は転移性胆道癌患者に対する本薬の有効性は GEM との併用下で 25mg/m 2 の 1 及び 8 日目の静脈内投与を 3 週間 (21 日 ) 毎に繰り返す用法 用量において 国内外の臨床試験で検討されている 各試験の成績の概略は以下のとおりである ( 詳細は 5.(1) 無作為化比較試験 薬物動態試験等の公表論文としての報告状況 の項参照 ) 海外第 Ⅱ 相試験 (ABC-01 試験 ) では 主要評価項目である 6 ヵ月 PFS 率は GEM 単独群で 45.5%(95% 信頼区間 (CI):[30.5, 59.3%]) 本薬と GEM 併用群で 57.1%(95%CI:[41.0, 70.3%]) であり 奏効率はそれぞれ 22.6%(7/31 例 ) 及び 27.8%(10/36 例 ) であった (Br J Cancer 2009; 101: ) ) 海外第 Ⅲ 相試験 (ABC-02 試験 ) では 主要評価項目である生存期間の中央値 (MST) は GEM 単独群で 8.1 ヵ月 (95%CI:[7.1, 8.7 ヵ月 ]) 本薬と GEM 併用群で 11.7 ヵ月 (95%CI: 14
15 [9.5, 14.3 ヵ月 ]) であった ( ハザード比 0.64(95%CI:[0.52, 0.80]) p<0.001)(n Engl J Med 2010; 362: ) ) 国内第 Ⅱ 相試験では 主要評価項目である 1 年生存率は GEM 単独群で 31.0%(95%CI:[ 17.0, 44.9%]) 本薬と GEM 併用群で 39.0%(95%CI:[ 23.7, 54.4%]) であった また GEM 単独群及び本薬と GEM 併用群それぞれにおいて 奏効率は 11.9% 及び 19.5% であった (Br J Cancer 2010; 103: ) ) 以上のとおり 胆道癌患者に対する本薬と GEM の併用投与の有効性は国内外ともに示されていると考える 一方 GEM との併用以外の本薬を含む投与レジメンの有効性について 5-FU カペシタビン等との併用での報告がいくつかあるものの 第 Ⅱ 相試験での検討が殆どであり有効性が検証されたものはなく また 国内外の教科書 ガイドライン等の記載内容からも ABC-02 試験成績に基づき 切除不能又は転移性の胆道癌患者に対する一次治療の標準的治療として本薬と GEM との併用投与が推奨されていると考える 以上より 医療上の必要性の高い未承認薬 適応外薬検討会議 ( 以下 検討会議 ) は 切 除不能又は転移性の胆道癌患者に対する本薬の有効性は GEM との併用下において認知され ているものと考える (2) 要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価について化学療法歴のない切除不能な進行又は転移性胆道癌患者に対する本薬の安全性は GEM との併用下で 25mg/m 2 の 1 及び 8 日目の静脈内投与を 3 週間 (21 日 ) 毎に繰り返す用法 用量において 国内外の臨床試験で検討されている 各試験において 10% 以上の頻度で発現した Grade 3 又は 4 の有害事象の発現状況は以下のとおりである ( 詳細は 5.(1) 無作為化比較試験 薬物動態試験等の公表論文としての報告状況 の項参照 ) 海外第 Ⅱ 相試験 (ABC-01 試験 ) では GEM 単独群においてビリルビン上昇 (20.5%) 好中球減少を伴わない感染 (15.9%) 並びにトランスアミナーゼ異常及び好中球減少症( 各 13.6%) であり 本薬と GEM 併用群では疲労 (28.6%) 好中球減少を伴わない感染(19.0%) 血小板減少症 トランスアミナーゼ異常及びビリルビン上昇 ( 各 11.9%) 並びに好中球減少症 (14.3%) であった (Br J Cancer 2009; 101: ) ) 海外第 Ⅲ 相試験 (ABC-02 試験 ) では GEM 単独群で好中球減少 (16.6%) 肝機能異常 (27.1%) 疲労(16.6%) 及び好中球減少を伴わない感染 (11.6%) であり 本薬と GEM 併用群で白血数球減少 (15.7%) 好中球減少(25.3%) 肝機能異常(16.7%) 疲労(18.7%) 及び好中球減少を伴う感染 (10.1%) であった (N Engl J Med 2010; 362: ) ) 国内第 Ⅱ 相試験では GEM 単独群で好中球減少 (38.1%) γ-gtp 増加 (35.7%) 白血球数減少 (19.0%) ヘモグロビン減少 AST 上昇 ALT 上昇及び ALP 上昇 ( 各 16.7%) 並 15
16 びに赤血球減少 (14.3%) であり 本薬と GEM 併用群で好中球減少 (56.1%) 血小板数減少 (39.0%) ヘモグロビン減少(36.6%) 赤血球減少(34.1%) 白血球数減少及び γ-gtp 増加 ( 各 29.3%) ALT 上昇 (24.4%) 並びに AST 上昇及び血中ナトリウム減少 (17.1%) であった (Br J Cancer 2010; 103: ) ) 以上のとおり 日本人胆道癌患者に本薬と GEM 併用投与した場合 外国人患者と比較して種々の骨髄抑制が高い割合で発現する傾向がみられている しかしながら 本薬と GEM 併用投与において発現する有害事象は骨髄抑制と肝機能異常であり 何れの事象も本薬又は GEM の添付文書において既に注意喚起されている副作用であるため 胆道癌患者でも既承認癌腫と比較して安全性プロファイルに大きな差異はないと考える 以上より 検討会議は がん化学療法に精通した医師により 適切に副作用が管理され 必要に応じて休薬等が適切に実施されるのであれば 日本人の切除不能又は転移性胆道癌患 者に対する本薬と GEM の併用投与は 管理可能と考える (3) 要望内容に係る公知申請の妥当性について日本人の切除不能又は転移性の胆道癌患者に対する本薬の有効性は GEM との併用下において認知されているものと考える ( 7.(1) 要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価について の項参照 ) また 胆道癌患者を対象とした国内第 Ⅱ 相試験で得られた情報より 胆道癌患者でも既承認癌腫と比較して安全性プロファイルに大きな差異はないと考えられたことから がん化学療法に精通した医師により 必要に応じて休薬等が適切に実施され 適切に副作用が管理されるのであれば 日本人の切除不能又は転移性胆道癌患者に対する本薬と GEM の併用投与は 管理可能と考える ( 7.(2) 要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価について の項参照 ) 以上の内容 及び教科書やガイドラインの記載内容を踏まえ 検討会議は切除不能又は転移性の胆道癌患者に対する本薬と GEM の併用投与の有用性は医学薬学上公知と判断可能と考える 8. 効能 効果及び用法 用量等の記載の妥当性について (1) 効能 効果について効能 効果については 効能 効果に関連する使用上の注意とともに以下の設定とすることが妥当と検討会議は考える その妥当性について以下に記す 効能 効果 胆道癌 16
17 効能 効果に関連する使用上の注意 胆道癌での本剤の術後補助化学療法における有効性及び安全性は確立していない 設定の妥当性について 海外第 Ⅲ 相試験 (ABC-02 試験 ) 及び国内第 Ⅱ 相試験の結果 並びに教科書やガイドラインの記載内容から 本薬の投与対象は ABC-02 試験の対象患者と同様に 切除不能又は転移性胆道癌患者 と考える ( 7.(3) 要望内容に係る公知申請の妥当性について の項参照 ) しかし 当該疾患領域において化学療法の対象となる患者は 切除不能又は転移例 と認識可能であり 効能 効果に 切除不能又は転移例 の内容を設定する必要性は少なく 胆道癌 と設定することが適当と考える また 本薬の術後補助化学療法に関する試験成績は得られていないため 効能 効果に関連する使用上の注意の項において 胆道癌の効能 効果が承認されている他の抗悪性腫瘍剤 ( ゲムシタビン及び S-1) と同様に 術後補助化学療法への有効性及び安全性が確立していない旨を設定することが適当と考える (2) 用法 用量について 用法 用量については 以下の設定とすることが妥当と検討会議は考える その妥当性に ついて以下に記す 用法 用量 ゲムシタビン塩酸塩との併用において シスプラチンとして 25mg/m 2 ( 体表面積 ) を 60 分かけて点滴静注し 週 1 回投与を 2 週連続し 3 週目は休薬する これを 1 コースとして投与を繰り返す なお 患者の状態により適宜減量する 設定の妥当性について 海外第 Ⅲ 相試験 (ABC-02 試験 ) 及び国内第 Ⅱ 相試験の結果 並びに教科書やガイドラインの記載内容から ( 7.(3) 要望内容に係る公知申請の妥当性について の項参照 ) 胆道癌患者に対する用法 用量として ABC-02 試験で用いられた用法 用量を設定することが適当と考える 9. 要望内容に係る更なる使用実態調査等の必要性について (1) 要望内容について現時点で国内外のエビデンスまたは臨床使用実態が不足している点の有無について胆道癌患者に対して ゲムシタビンとの併用において本薬の有効性及び安全性が海外第 Ⅲ 相試験 (ABC-02 試験 ) により確認された また 当該試験と同様の用法 用量を用いて行われた国内 17
18 第 Ⅱ 相試験より 日本人患者においても一定の有効性が確認されており また既承認癌腫と比較して安全性プロファイルに大きな差異はないと考えられた ( 7.(3) 要望内容に係る公知申請の妥当性について の項参照 ) したがって 現時点で 追加すべき試験又は調査はないと考える (2) 上記 (1) で臨床使用実態が不足している場合は 必要とされる使用実態調査等の内 容について なし (3) その他 市販後における留意点について なし 10. 備考 なし 11. 参考文献一覧 1) Valle J, Wasan H, Palmer H, et al. Cisplatin plus Gemcitabine versus Gemcitabine for Biliary Tract Cancer. N Engl J Med 2010; 362: ) Centers for Medicare & Medicaid Services( 3) Valle JW, Wasan H, Johnson P, et al. Gemcitabine alone or in combination with cisplatin in patients with advanced or metastatic cholangiocarcinomas or other biliary tract tumours: a multicentre randomised phase Ⅱ study- The UK ABC-01 Study. Br J Cancer 2009; 101: ) Okusaka T, Nakachi K, Fukutomi A, et al. Gemcitabine alone or in combination with cisplatin in patients with biliary tract cancer: a comparative multicentre study in Japan. Br J Cancer 2010; 103: ) Rao S, Cunningham D, Hawkins RE, et al. Phase Ⅲ study of 5FU, etoposide and leucovorin (FELV) compared to epirubicin, cisplatin and 5FU (ECF) in previously untreated patients with advanced biliary cancer. Br J Cancer 2005 ; 92 : ) Scheithauer W. Chemotherapy: Gemcitabine alone or plus cisplatin for biliary tract cancer? Nat Rev Clin Oncol 2010; 7: ) Bartlett DL, Ramanathan RK, Ben-Josef E. Cancer of the Biliary Tree. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, editors. Cancer Principles&Practice of Oncology 8 th edition. Philadelphia: Lippincott Williams & Wilkins ; p ) 日本臨床腫瘍学会編. 31 胆道系がん. 新臨床腫瘍学改訂第 2 版. 東京 : 南江堂 ; 2009: p
19 9) NCCN Clinical Practice Guideline in Oncology. Hepatobiliary Cancer. V ) Eckel F, Brunner T, Jelic S. Biliary cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2010; 21 (Suppl. 5): v ) 胆道癌診療ガイドライン第 1 版 (2007 年医学図書出版株式会社 ) 参考 1) 米国添付文書 (2010 年 9 月 ) 参考 2) 英国添付文書 (2009 年 7 月 13 日 ) 参考 3) 独国添付文書 (2010 年 4 月 ) 参考 4) 仏国添付文書 (2010 年 4 月 6 日 ) 19
要望番号 ;Ⅱ-286 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 33 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 ロペラミドロペミンヤンセンファーマ株式会社
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
要望番号 ;Ⅱ 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望 者 ( 該当するものにチェックする ) 優先順位 学会 ( 学会名 ; 日本ペインクリニック学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 2 位 ( 全 4 要望中 )
 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望 者 ( 該当するものにチェックする ) 優先順位 学会 ( 学会名 ; 日本ペインクリニック学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 2 位 ( 全 4 要望中 ) 成分名 ( 一般名 ) 塩酸リドカイン 販売名 0.5%/1%/2% キシロカイン 要望する医薬品要望内容 会社名 国内関連学会
未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望 者 ( 該当するものにチェックする ) 優先順位 学会 ( 学会名 ; 日本ペインクリニック学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 2 位 ( 全 4 要望中 ) 成分名 ( 一般名 ) 塩酸リドカイン 販売名 0.5%/1%/2% キシロカイン 要望する医薬品要望内容 会社名 国内関連学会
要望番号 ;Ⅱ-183 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者学会 ( 該当する ( 学会名 ; 日本感染症学会 ) ものにチェックする ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 8 要望中 ) 要望する医薬品
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者学会 ( 該当する ( 学会名 ; 日本感染症学会 ) ものにチェックする ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 8 要望中 ) 要望する医薬品 要望内容 成分名 ( 一般名 ) 販売名 会社名 国内関連学会 未承認薬 適応 外薬の分類 ( 該当するものにチェックする )
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者学会 ( 該当する ( 学会名 ; 日本感染症学会 ) ものにチェックする ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 8 要望中 ) 要望する医薬品 要望内容 成分名 ( 一般名 ) 販売名 会社名 国内関連学会 未承認薬 適応 外薬の分類 ( 該当するものにチェックする )
要望番号 ;Ⅱ-24 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 8 位 ( 全 33 要望中
 未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 8 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 amoxicillin-clabulanate
未承認薬 適応外薬の要望 ( 別添様式 ) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 特定非営利活動法人日本臨床腫瘍学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 8 位 ( 全 33 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 amoxicillin-clabulanate
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
医科_第20次(追加)審査情報提供(広報用)
 第 20 次審査情報提供事例 ( 医科 ) 追加 平成 31 年 4 月 22 日提供分 社会保険診療報酬支払基金 審査情報提供事例について 審査支払機関における診療報酬請求に関する審査は 健康保険法 療養担当規則 診療報酬点数表及び関係諸通知等を踏まえ各審査委員会の医学的 歯科医学的見解に基づいて行われています 一方 審査の公平 公正性に対する関係方面からの信頼を確保するため 審査における一般的な取扱いについて広く関係者に情報提供を行い
第 20 次審査情報提供事例 ( 医科 ) 追加 平成 31 年 4 月 22 日提供分 社会保険診療報酬支払基金 審査情報提供事例について 審査支払機関における診療報酬請求に関する審査は 健康保険法 療養担当規則 診療報酬点数表及び関係諸通知等を踏まえ各審査委員会の医学的 歯科医学的見解に基づいて行われています 一方 審査の公平 公正性に対する関係方面からの信頼を確保するため 審査における一般的な取扱いについて広く関係者に情報提供を行い
(別添様式)
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果
![審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果 審査結果 平成 23 年 4 月 11 日 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年 11 月 11 日 [ 審査結果](/thumbs/92/108604766.jpg) 審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
審査報告書 平成 23 年 4 月 11 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりで ある 記 [ 販 売 名 ] ミオ MIBG-I123 注射液 [ 一 般 名 ] 3-ヨードベンジルグアニジン ( 123 I) 注射液 [ 申請者名 ] 富士フイルム RI ファーマ株式会社 [ 申請年月日 ] 平成 22 年
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
(別添様式1)
 未承認薬 適応外薬の要望 ( 別添様式 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本呼吸器学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 2 位 ( 全 6 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 シクロスポリンネオーラルノバルテイス ファーマ ( 選定理由 )
未承認薬 適応外薬の要望 ( 別添様式 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本呼吸器学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 2 位 ( 全 6 要望中 ) 要望する医薬品 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 シクロスポリンネオーラルノバルテイス ファーマ ( 選定理由 )
(別添様式1)
 未承認薬 適応外薬の要望 ( 別添様式 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; ) 患者団体 ( 患者団体名 ; 特定非営利活動法人骨形成不全症協会 ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 1 件要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 パミドロン酸二ナトリウム ( パミドロネート ) アレディアノバルティスファーマ株式会社
未承認薬 適応外薬の要望 ( 別添様式 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; ) 患者団体 ( 患者団体名 ; 特定非営利活動法人骨形成不全症協会 ) 個人 ( 氏名 ; ) 優先順位 1 位 ( 全 1 件要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 パミドロン酸二ナトリウム ( パミドロネート ) アレディアノバルティスファーマ株式会社
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
(事務連絡)公知申請に係る前倒し保険適用通知
 保医発 0425 第 1 号 平成 30 年 4 月 25 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において
保医発 0425 第 1 号 平成 30 年 4 月 25 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において
の状態により適宜減量する 成人 A 法 : 他の抗悪性腫瘍剤との併用において ブスルファンとして 1 回 0.8 mg/kg を生理食塩液又は 5% ブドウ糖液に混和 調製して 2 時間かけて点滴静注する 本剤は 6 時間毎に 1 日 4 回 4 日間投与する なお 年齢 患者の状態により適宜減量す
 審査報告書 平成 30 年 8 月 2 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ブスルフェクス点滴静注用 60 mg [ 一般名 ] ブスルファン [ 申請者 ] 大塚製薬株式会社 [ 申請年月日 ] 平成 30 年 5 月 28 日 [ 剤形 含量 ] 1 バイアル (10 ml)
審査報告書 平成 30 年 8 月 2 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ブスルフェクス点滴静注用 60 mg [ 一般名 ] ブスルファン [ 申請者 ] 大塚製薬株式会社 [ 申請年月日 ] 平成 30 年 5 月 28 日 [ 剤形 含量 ] 1 バイアル (10 ml)
未承認の医薬品又は適応の承認要望に関する意見募集について
 ( 別添様式 1-1) 未承認薬の要望 要望者 日本てんかん学会 優先順位 2 位 ( 全 12 要望中 ) 医薬品名 成分名 ルフィナマイド 販売名 Inovelon( 欧州 ) Banzel( 米国 ) 会社名 エーザイ 承認国 欧州 29 カ国 ( 英国 独国 仏国を含む ) 米国 効能 効果 レノックス ガストー症候群 (4 歳以上 ) に伴う発作に対する併用 療法 用法 用量 欧州 小児患者
( 別添様式 1-1) 未承認薬の要望 要望者 日本てんかん学会 優先順位 2 位 ( 全 12 要望中 ) 医薬品名 成分名 ルフィナマイド 販売名 Inovelon( 欧州 ) Banzel( 米国 ) 会社名 エーザイ 承認国 欧州 29 カ国 ( 英国 独国 仏国を含む ) 米国 効能 効果 レノックス ガストー症候群 (4 歳以上 ) に伴う発作に対する併用 療法 用法 用量 欧州 小児患者
高いと判断できるのは HER2 過剰発現が確認された乳癌患者に対して トラスツズマブ及びタキサン系抗悪性腫瘍剤と併用で用いる場合に限定される と 医療上の必要性の高い未承認薬 適応外薬検討会議 ( 以下 検討会議 ) は判断しており 本報告書では 当該対象患者及び使用方法における有効性及び安全性につ
 資料 5-8 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 ( 案 ) カルボプラチン乳癌 1. 要望内容の概略について 要望された医薬品 一般名 : カルボプラチン販売名 : パラプラチン注射液 50mg 同 150mg 同 450mg 会社名 : ブリストル マイヤーズ株式会社 要望者名 有限責任法人日本乳癌学会 日本臨床腫瘍学会あけぼの神奈川個人要望内容効能 効果乳癌
資料 5-8 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 ( 案 ) カルボプラチン乳癌 1. 要望内容の概略について 要望された医薬品 一般名 : カルボプラチン販売名 : パラプラチン注射液 50mg 同 150mg 同 450mg 会社名 : ブリストル マイヤーズ株式会社 要望者名 有限責任法人日本乳癌学会 日本臨床腫瘍学会あけぼの神奈川個人要望内容効能 効果乳癌
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
がんの治療
 資料 1-1 がんの治療 1 がんとは 正常な細胞は 増殖や分裂が制御され 増えすぎないようになっている がんは 制御が外れ 制限なく増殖するようになった細胞のこと がん細胞は 体の異なる場所に 転移 したり 臓器の境を越えて 浸潤 する がんが進行すると 死亡に至る 日本人の死因のトップである ( 昭和 56 年から ) 高齢者に多い 国立がん研究センターがん対策情報センターホームページより抜粋
資料 1-1 がんの治療 1 がんとは 正常な細胞は 増殖や分裂が制御され 増えすぎないようになっている がんは 制御が外れ 制限なく増殖するようになった細胞のこと がん細胞は 体の異なる場所に 転移 したり 臓器の境を越えて 浸潤 する がんが進行すると 死亡に至る 日本人の死因のトップである ( 昭和 56 年から ) 高齢者に多い 国立がん研究センターがん対策情報センターホームページより抜粋
Microsoft Word - Oxaliplatin HP掲載用修正9-8.docx
 切除不能進行 再発胃癌に対するオキサリプラチンの適応拡大について 日本胃癌学会は オキサリプラチンの切除不能進行 再発胃癌への適応拡大についての要望書を厚生労働省に提出していたが このたび医療上の必要性の高い未承認薬 適応外薬検討会議および薬事 食品衛生審議会での審議を経て 切除不能進行 再発胃癌に対するオキサリプラチンの公知妥当性の事前評価が終了し 平成 26 年 9 月より保険適応の対象となった
切除不能進行 再発胃癌に対するオキサリプラチンの適応拡大について 日本胃癌学会は オキサリプラチンの切除不能進行 再発胃癌への適応拡大についての要望書を厚生労働省に提出していたが このたび医療上の必要性の高い未承認薬 適応外薬検討会議および薬事 食品衛生審議会での審議を経て 切除不能進行 再発胃癌に対するオキサリプラチンの公知妥当性の事前評価が終了し 平成 26 年 9 月より保険適応の対象となった
会社名
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会社名サノフィ アベンティス株式会社要望番号 Ⅱ-110 成分名スピラマイシン Spiramycin ( 一般名 ) Rovamycine 1500000 IE 錠要望され販売名 Rovamycine 1500000 UI 錠た医薬品 Rovamycine3000000 UI 錠 要望内容 未承認薬 適応外薬の分類
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会社名サノフィ アベンティス株式会社要望番号 Ⅱ-110 成分名スピラマイシン Spiramycin ( 一般名 ) Rovamycine 1500000 IE 錠要望され販売名 Rovamycine 1500000 UI 錠た医薬品 Rovamycine3000000 UI 錠 要望内容 未承認薬 適応外薬の分類
がん化学(放射線)療法レジメン申請書
 申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名耳鼻咽喉科がん腫 ( コード ) 診療科長名 申請医師名 審査区分 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区分使用分類適応分類
申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名耳鼻咽喉科がん腫 ( コード ) 診療科長名 申請医師名 審査区分 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区分使用分類適応分類
がん化学(放射線)療法レジメン申請書
 申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名呼吸器外科がん腫 ( コード ) 診療科長名 申請医師名 審査区分 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区分使用分類適応分類
申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名呼吸器外科がん腫 ( コード ) 診療科長名 申請医師名 審査区分 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区分使用分類適応分類
査を実施し 必要に応じ適切な措置を講ずること (2) 本品の警告 効能 効果 性能 用法 用量及び使用方法は以下のとお りであるので 特段の留意をお願いすること なお その他の使用上の注意については 添付文書を参照されたいこと 警告 1 本品投与後に重篤な有害事象の発現が認められていること 及び本品
 薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
薬食機参発 0918 第 4 号薬食安発 0918 第 1 号 ( 別記 ) 殿 テムセル HS 注については 本日 造血幹細胞移植後の急性移植片対宿主病 を効能 効果又は性能として承認したところですが 本品については 治験症例が限られていること 重篤な不具合が発現するリスクがあることから その 使用に当たっての留意事項について 御了知いただくとともに 貴会会員への周知方よろしくお願いします なお
がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2013/6/17 受付番号 診療科名 脳神経外科 がん腫 ( コード ) 診療科長名 申請医師名 レジメン登録ナンバー 登録申請日 審査区分 ( 下記をチェックしてください ) 登
 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2013/6/17 受付番号 診療科名 脳神経外科 がん腫 ( コード ) 診療科長名 申請医師名 レジメン登録ナンバー 登録申請日 審査区分 ( 下記をチェックしてください ) 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります
がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2013/6/17 受付番号 診療科名 脳神経外科 がん腫 ( コード ) 診療科長名 申請医師名 レジメン登録ナンバー 登録申請日 審査区分 ( 下記をチェックしてください ) 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
「 」 説明および同意書
 EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開
![審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開 審査結果 平成 25 年 9 月 27 日 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 審査結果 ] 平成 25 年 4 月 26 日開](/thumbs/53/31072016.jpg) 審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
審査報告書 平成 25 年 9 月 27 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] アナフラニール錠 10 mg 同錠 25 mg [ 一般名 ] クロミプラミン塩酸塩 [ 申請者名 ] アルフレッサファーマ株式会社 [ 申請年月日 ] 平成 25 年 5 月 17 日 [ 剤形 含量 ]
13
 未承認薬 適応外薬の要望に対する学会見解 ( 別添様式 ) 1. 要望内容に関連する事項会社名ノバルティス (Novartis) 社要望番号成分名 Artemether Lumefantrine 要望され ( 一般名 ) ( アーテメター ルメファントリン合剤 ) た医薬品 Riamet Tablet( 英 独 仏 豪 ) 販売名 Coartem Tablet( 米 ) 未承認薬 2009 年 4
未承認薬 適応外薬の要望に対する学会見解 ( 別添様式 ) 1. 要望内容に関連する事項会社名ノバルティス (Novartis) 社要望番号成分名 Artemether Lumefantrine 要望され ( 一般名 ) ( アーテメター ルメファントリン合剤 ) た医薬品 Riamet Tablet( 英 独 仏 豪 ) 販売名 Coartem Tablet( 米 ) 未承認薬 2009 年 4
10 年相対生存率 全患者 相対生存率 (%) (Period 法 ) Key Point 1 の相対生存率は 1998 年以降やや向上した 日本で
 151 10 年相対生存率 全患者 相対生存率 (%) 82 76 79 61 60 53 52 51 46 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 44 40 43 Key Point 1 の相対生存率は 1998 年以降やや向上した 日本でパクリタキセル カルボプラチン併用療法が標準治療となった時期と一致する 0 1 2 3 4 5
151 10 年相対生存率 全患者 相対生存率 (%) 82 76 79 61 60 53 52 51 46 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 44 40 43 Key Point 1 の相対生存率は 1998 年以降やや向上した 日本でパクリタキセル カルボプラチン併用療法が標準治療となった時期と一致する 0 1 2 3 4 5
開発の経緯 ゲムシタビン点滴静注用 200mg 1g サンド は 後発医薬品として開発を企画し 規格及び試験方法を設定 加速試験を行い 平成 22 年 1 月に製造販売承認を取得した ( 薬食発第 号 ( 平成 17 年 3 月 31 日 ) に基づき承認申請 ) 製品の特徴及び有用
 a Novartis company 開発の経緯 ゲムシタビン点滴静注用 200mg 1g サンド は 後発医薬品として開発を企画し 規格及び試験方法を設定 加速試験を行い 平成 22 年 1 月に製造販売承認を取得した ( 薬食発第 0331015 号 ( 平成 17 年 3 月 31 日 ) に基づき承認申請 ) 製品の特徴及び有用性 ゲムシタビンは代謝拮抗剤である ヌクレオシド能動輸送体を介して細胞内に入り
a Novartis company 開発の経緯 ゲムシタビン点滴静注用 200mg 1g サンド は 後発医薬品として開発を企画し 規格及び試験方法を設定 加速試験を行い 平成 22 年 1 月に製造販売承認を取得した ( 薬食発第 0331015 号 ( 平成 17 年 3 月 31 日 ) に基づき承認申請 ) 製品の特徴及び有用性 ゲムシタビンは代謝拮抗剤である ヌクレオシド能動輸送体を介して細胞内に入り
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]
![審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ] 審査結果 平成 26 年 2 月 7 日 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所 [ 申請年月日 ]](/thumbs/91/105024304.jpg) 審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
審査報告書 平成 26 年 2 月 7 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] 1 ヘプタバックス-Ⅱ 2 ビームゲン 同注 0.25mL 同注 0.5mL [ 一般名 ] 組換え沈降 B 型肝炎ワクチン ( 酵母由来 ) [ 申請者名 ] 1 MSD 株式会社 2 一般財団法人化学及血清療法研究所
 一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法 の有効性 安全性等について 肝炎治療戦略会議報告書平成 23 年 11 月 28 日
 C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法 の有効性 安全性等について 肝炎治療戦略会議報告書平成 23 年 11 月 28 日 C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法の 有効性 安全性等について 1. 有効性及び対象について セログループ 1 のC 型慢性肝炎に対する ペグインターフェロン リバビリン及びテラプレビル3 剤併用療法 ( 以下単に 3 剤併用療法 という
C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法 の有効性 安全性等について 肝炎治療戦略会議報告書平成 23 年 11 月 28 日 C 型慢性肝炎に対するテラプレビルを含む 3 剤併用療法の 有効性 安全性等について 1. 有効性及び対象について セログループ 1 のC 型慢性肝炎に対する ペグインターフェロン リバビリン及びテラプレビル3 剤併用療法 ( 以下単に 3 剤併用療法 という
審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7
![審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7 審査結果 平成 26 年 1 月 6 日 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [ 審査結果 ] 平成 25 年 7](/thumbs/92/110490968.jpg) 審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
審査報告書 平成 26 年 1 月 6 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] ダラシン S 注射液 300mg 同注射液 600mg [ 一 般 名 ] クリンダマイシンリン酸エステル [ 申請者名 ] ファイザー株式会社 [ 申請年月日 ] 平成 25 年 8 月 21 日 [
ウム ( 小腸癌 ) に関する事前評価及び提出された資料から 本品目の小腸癌に対する有効性及び安全性は確認されているものと判断する 以上 医薬品医療機器総合機構における審査の結果 本品目については 以下の効能又は効果並びに用法及び用量で承認して差し支えないと判断した [ 効能又は効果 ] 1. レボ
![ウム ( 小腸癌 ) に関する事前評価及び提出された資料から 本品目の小腸癌に対する有効性及び安全性は確認されているものと判断する 以上 医薬品医療機器総合機構における審査の結果 本品目については 以下の効能又は効果並びに用法及び用量で承認して差し支えないと判断した [ 効能又は効果 ] 1. レボ ウム ( 小腸癌 ) に関する事前評価及び提出された資料から 本品目の小腸癌に対する有効性及び安全性は確認されているものと判断する 以上 医薬品医療機器総合機構における審査の結果 本品目については 以下の効能又は効果並びに用法及び用量で承認して差し支えないと判断した [ 効能又は効果 ] 1. レボ](/thumbs/92/110749576.jpg) 審査報告書 平成 30 年 8 月 7 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] 1アイソボリン点滴静注用 25 mg 同点滴静注用 100 mg 2レボホリナート点滴静注用 25 mg NK 同点滴静注用 100 mg NK 3レボホリナート点滴静注用 25 mg NP 同点滴静注用
審査報告書 平成 30 年 8 月 7 日独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] 1アイソボリン点滴静注用 25 mg 同点滴静注用 100 mg 2レボホリナート点滴静注用 25 mg NK 同点滴静注用 100 mg NK 3レボホリナート点滴静注用 25 mg NP 同点滴静注用
(別添様式)
 未承認薬 適応外薬要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会サノフィ株式会社社 名 要望番号 Ⅲ-3-19 成分名 ( 一般名 ) フルダラビンリン酸エステル 販売名フルダラ静注用 50mg 要望された医薬品 未承認薬 適 応外薬分類 ( 該当するもにチェックする ) 未承認薬 2009 年 4 月以降に FDA 又は EMA で承認されたが 国内で承認されていない医薬品
未承認薬 適応外薬要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項会サノフィ株式会社社 名 要望番号 Ⅲ-3-19 成分名 ( 一般名 ) フルダラビンリン酸エステル 販売名フルダラ静注用 50mg 要望された医薬品 未承認薬 適 応外薬分類 ( 該当するもにチェックする ) 未承認薬 2009 年 4 月以降に FDA 又は EMA で承認されたが 国内で承認されていない医薬品
DRAFT#9 2011
 報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
報道関係各位 2019 年 1 月 8 日 ユーシービージャパン株式会社 抗てんかん剤 ビムパット ドライシロップ 10% 及び ビムパット 点滴静注 200mg 製造販売承認のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン また ユーシービーグループを総称して以下 ユーシービー ) は本日 抗てんかん剤 ビムパット ドライシロップ
フッ化ピリミジン
 第 2 回福岡大学病院と院外薬局とのがん治療連携勉強会 フッ化ピリミジン系抗癌剤 福岡大学メディカルホール 2011 年 5 月 18 日福岡大学腫瘍血液感染症内科田中俊裕 1 S-1 胃癌 ( 補助療法 進行再発 ) 大腸癌 ( 進行再発 ) 非小細胞肺癌 ( 進行再発 ) 乳癌 ( 進行再発 ) 膵胆道癌 ( 進行再発 ) 頭頸部癌 Capecitabine 胃癌 ( 進行再発 ) 大腸癌 (
第 2 回福岡大学病院と院外薬局とのがん治療連携勉強会 フッ化ピリミジン系抗癌剤 福岡大学メディカルホール 2011 年 5 月 18 日福岡大学腫瘍血液感染症内科田中俊裕 1 S-1 胃癌 ( 補助療法 進行再発 ) 大腸癌 ( 進行再発 ) 非小細胞肺癌 ( 進行再発 ) 乳癌 ( 進行再発 ) 膵胆道癌 ( 進行再発 ) 頭頸部癌 Capecitabine 胃癌 ( 進行再発 ) 大腸癌 (
がん化学(放射線)療法レジメン申請書
 申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名呼吸器外科がん腫 ( コード ) 診療科長名 申請医師名 審査区 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区使用類適応類
申請期日 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 受付番号 診療科名呼吸器外科がん腫 ( コード ) 診療科長名 申請医師名 審査区 ( 下記をチェックしてください ) レジメン登録ナンバー 登録申請日 登録確認日 通常審査を希望 登録削除日 迅速審査を希望 注 1) 注 1) 迅速審査は患者限定となります がん種レジメン名実施区使用類適応類
< F2D CF6926D905C90BF82C98C5782E992CA926D88C4>
 保医発 1031 第 1 号平成 24 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において 別添 1の7
保医発 1031 第 1 号平成 24 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本日開催の薬事 食品衛生審議会医薬品第二部会において 別添 1の7
緒言
 CERA 2.2 緒言 Page 1 ミルセラ注シリンジ25 μg ミルセラ注シリンジ50 μg ミルセラ注シリンジ75 μg ミルセラ注シリンジ100 μg ミルセラ注シリンジ150 μg ミルセラ注シリンジ200 μg ミルセラ注シリンジ250 μg [ 腎性貧血 ] 第 2 部 CTD の概要 ( サマリー ) 2.2 緒言 中外製薬株式会社 CERA 2.2 緒言 Page 2 目次頁 2.2
CERA 2.2 緒言 Page 1 ミルセラ注シリンジ25 μg ミルセラ注シリンジ50 μg ミルセラ注シリンジ75 μg ミルセラ注シリンジ100 μg ミルセラ注シリンジ150 μg ミルセラ注シリンジ200 μg ミルセラ注シリンジ250 μg [ 腎性貧血 ] 第 2 部 CTD の概要 ( サマリー ) 2.2 緒言 中外製薬株式会社 CERA 2.2 緒言 Page 2 目次頁 2.2
膵臓癌について
 胆 膵領域の悪性腫瘍 ~ 外科の立場から ~ 尾道市立市民病院外科 村田年弘 膵臓癌について 2009 年の死亡数が多い部位は順に 1 位 2 位 3 位 4 位 5 位 男性 肺 胃 肝臓 結腸 膵臓 結腸と直腸を合わせた大腸は3 位 女性 肺 胃 結腸 膵臓 乳房 結腸と直腸を合わせた大腸は1 位 男女計 肺 胃 肝臓 結腸 膵臓 結腸と直腸を合わせた大腸は3 位 年々 膵臓癌の罹患患者は増加している
胆 膵領域の悪性腫瘍 ~ 外科の立場から ~ 尾道市立市民病院外科 村田年弘 膵臓癌について 2009 年の死亡数が多い部位は順に 1 位 2 位 3 位 4 位 5 位 男性 肺 胃 肝臓 結腸 膵臓 結腸と直腸を合わせた大腸は3 位 女性 肺 胃 結腸 膵臓 乳房 結腸と直腸を合わせた大腸は1 位 男女計 肺 胃 肝臓 結腸 膵臓 結腸と直腸を合わせた大腸は3 位 年々 膵臓癌の罹患患者は増加している
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
STEP 1 検査値を使いこなすために 臨床検査の基礎知識 検査の目的は大きく 2 つ 基準範囲とは 95% ( 図 1) 図 1 基準範囲の考え方 2
 STEP 1 検査値を使いこなすために 臨床検査の基礎知識 検査の目的は大きく 2 つ 基準範囲とは 95% ( 図 1) 100 5 図 1 基準範囲の考え方 2 STEP 1 血算 2 押さえておきたい検査の特徴 1 血算 項目略称基準範囲 白血球数 (white blood cell count) WBC 3.3 ~ 8.6 10 3 /μl 好中球数 (neutrophil) Neut 40.0
STEP 1 検査値を使いこなすために 臨床検査の基礎知識 検査の目的は大きく 2 つ 基準範囲とは 95% ( 図 1) 100 5 図 1 基準範囲の考え方 2 STEP 1 血算 2 押さえておきたい検査の特徴 1 血算 項目略称基準範囲 白血球数 (white blood cell count) WBC 3.3 ~ 8.6 10 3 /μl 好中球数 (neutrophil) Neut 40.0
る治療選択肢の一つとして パクリタキセル ( 以下 本薬 ) は ウ欧米において標準的療 法に位置付けられている に該当すると判断した 3. 欧米 4 カ国の承認状況等について (1) 欧米 4カ国の承認状況及び開発状況の有無について 1) 米国効能 効果タキソールは 進行性卵巣癌の第一選択薬及びそ
 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 パクリタキセル 食道癌 1. 要望内容の概略について 要望された医薬品 一般名 : パクリタキセル販売名 : タキソール注射液 30mg 同 100mg 会社名 : ブリストル マイヤーズ株式会社 要望者名 日本食道学会 日本臨床腫瘍学会要望内容効能 効果食道癌 用法 用量 米国 USP-DI ( United States
医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 パクリタキセル 食道癌 1. 要望内容の概略について 要望された医薬品 一般名 : パクリタキセル販売名 : タキソール注射液 30mg 同 100mg 会社名 : ブリストル マイヤーズ株式会社 要望者名 日本食道学会 日本臨床腫瘍学会要望内容効能 効果食道癌 用法 用量 米国 USP-DI ( United States
審査報告書 平成 27 年 2 月 12 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] エルプラット点滴静注液 50mg 同点滴静注液 100mg 同点滴静注 液 200mg [ 一般名
![審査報告書 平成 27 年 2 月 12 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] エルプラット点滴静注液 50mg 同点滴静注液 100mg 同点滴静注 液 200mg [ 一般名 審査報告書 平成 27 年 2 月 12 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] エルプラット点滴静注液 50mg 同点滴静注液 100mg 同点滴静注 液 200mg [ 一般名](/thumbs/97/132848972.jpg) 審査報告書 平成 27 年 2 月 12 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] エルプラット点滴静注液 50mg 同点滴静注液 100mg 同点滴静注 液 200mg [ 一般名 ] オキサリプラチン [ 申請者名 ] 株式会社ヤクルト本社 [ 申請年月日 ] 平成 26 年 10
審査報告書 平成 27 年 2 月 12 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販 売 名 ] エルプラット点滴静注液 50mg 同点滴静注液 100mg 同点滴静注 液 200mg [ 一般名 ] オキサリプラチン [ 申請者名 ] 株式会社ヤクルト本社 [ 申請年月日 ] 平成 26 年 10
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
< F2D A8CF6926D905C90BF82C98C5782E98EE688B5>
 保医発 1031 第 6 号平成 23 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本年 10 月 31 日開催の薬事 食品衛生審議会医薬品第二部会において
保医発 1031 第 6 号平成 23 年 10 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 公知申請に係る事前評価が終了した医薬品の保険上の取扱いについて 本年 10 月 31 日開催の薬事 食品衛生審議会医薬品第二部会において
301128_課_薬生薬審発1128第1号_ニボルマブ(遺伝子組換え)製剤の最適使用推進ガイドラインの一部改正について
 薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
薬生薬審発 1128 第 1 号平成 30 年 1 1 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) ニボルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 悪性黒色腫 頭頸部癌 腎細胞癌 古典的ホ ジキンリンパ腫 胃癌及び悪性胸膜中皮腫 ) の一部改正について 経済財政運営と改革の基本方針
TITLE IN HERE, ARIAL 14 BOLD, CAPS
 報道関係者各位 アストラゼネカ株式会社 アストラゼネカ 本邦初のステージ III 非小細胞肺がんにおける抗 PD-L1 抗体 イミフィンジ ( デュルバルマブ ) の販売を開始 アストラゼネカ株式会社 ( 本社 : 大阪市北区 代表取締役社長 : ステファン ヴォックスストラム 以下 アストラゼネカ ) は本日 切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法 を効能 効果とした
報道関係者各位 アストラゼネカ株式会社 アストラゼネカ 本邦初のステージ III 非小細胞肺がんにおける抗 PD-L1 抗体 イミフィンジ ( デュルバルマブ ) の販売を開始 アストラゼネカ株式会社 ( 本社 : 大阪市北区 代表取締役社長 : ステファン ヴォックスストラム 以下 アストラゼネカ ) は本日 切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法 を効能 効果とした
(別添様式)
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会協和発酵キリン株式会社 要要望番号望成分名さ ( 一般名 ) れ販売名た未承認薬 適応医薬品 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) II-23 アモキシシリン水和物パセトシン細粒 10% 未承認薬適応外薬胃潰瘍又は十二指腸潰瘍におけるヘリコバクター
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会協和発酵キリン株式会社 要要望番号望成分名さ ( 一般名 ) れ販売名た未承認薬 適応医薬品 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) II-23 アモキシシリン水和物パセトシン細粒 10% 未承認薬適応外薬胃潰瘍又は十二指腸潰瘍におけるヘリコバクター
タフィンラーカプセル50mg/75mg、メキニスト錠0.5mg/2mg 添付文書改訂のお知らせ
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 添付文書改訂のお知らせ 製造販売 2018 年 7 月 このたび 標記製品の効能又は効果の一部変更承認に伴い 添付文書の記載内容を改訂いたしましたのでお知らせいたします 今後のご使用に際しましてご参照下さいますようお願い申し上げます 効能又は効果 ( タフィンラーカプセル メキニスト錠共通 ) 改訂後 (2018 年 7 月改訂 ) 効能又は効果
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 添付文書改訂のお知らせ 製造販売 2018 年 7 月 このたび 標記製品の効能又は効果の一部変更承認に伴い 添付文書の記載内容を改訂いたしましたのでお知らせいたします 今後のご使用に際しましてご参照下さいますようお願い申し上げます 効能又は効果 ( タフィンラーカプセル メキニスト錠共通 ) 改訂後 (2018 年 7 月改訂 ) 効能又は効果
第1回肝炎診療ガイドライン作成委員会議事要旨(案)
 資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
効能 効果 エロキサチンは 5- フルオロウラシル (5-FU)/ ロイコボリン (LV) の静脈 内点滴投与と併用し 以下に対して適応とする 原発巣完全切除後の StageⅢ 結腸癌の術後補助化学療法 進行 再発大腸癌の治療 用法 用量 エロキサチン ( 注射用オキサリプラチン ) は癌化学療法剤
 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 オキサリプラチン 小腸癌 1. 要望内容の概略について 要望され た医薬品 一般名 : オキサリプラチン 販売名 : エルプラット点滴静注液 50 mg 同 100 mg 同 200 mg 会社名 : 株式会社ヤクルト本社 要望者名 特定非営利活動法人日本臨床腫瘍学会 要望内容効能 効果小腸癌 用法 用量 他の抗悪性腫瘍剤との併用において
医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 オキサリプラチン 小腸癌 1. 要望内容の概略について 要望され た医薬品 一般名 : オキサリプラチン 販売名 : エルプラット点滴静注液 50 mg 同 100 mg 同 200 mg 会社名 : 株式会社ヤクルト本社 要望者名 特定非営利活動法人日本臨床腫瘍学会 要望内容効能 効果小腸癌 用法 用量 他の抗悪性腫瘍剤との併用において
資料 4-5 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 ( 案 ) ノギテカン塩酸塩卵巣癌 1. 要望内容の概略について 要望された医 薬品 一般名 : ノギテカン塩酸塩 (JAN), トポテカン (INN) 販売名 : ハイカムチン注射用 1.1mg 会社名 :
 資料 4-5 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 ( 案 ) ノギテカン塩酸塩卵巣癌 1. 要望内容の概略について 要望された医 薬品 一般名 : ノギテカン塩酸塩 (JAN), トポテカン (INN) 販売名 : ハイカムチン注射用 1.1mg 会社名 : 日本化薬株式会社 要望者名 日本臨床腫瘍学会 卵巣がん体験者の会スマイリー 日本産婦人科学会 日本婦人科腫瘍学会
資料 4-5 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 ( 案 ) ノギテカン塩酸塩卵巣癌 1. 要望内容の概略について 要望された医 薬品 一般名 : ノギテカン塩酸塩 (JAN), トポテカン (INN) 販売名 : ハイカムチン注射用 1.1mg 会社名 : 日本化薬株式会社 要望者名 日本臨床腫瘍学会 卵巣がん体験者の会スマイリー 日本産婦人科学会 日本婦人科腫瘍学会
2. 要望内容における医療上の必要性について (1) 適応疾病の重篤性についての該当性ユーイング肉腫は致死的な疾患であり 適応疾病の重篤性は ア に該当すると判断した (2) 医療上の有用性についての該当性平成 24 年 3 月 23 日に開催された第 11 回医療上の必要性の高い未承認薬 適応外薬
 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 テモゾロミド 再発 難治性ユーイング肉腫 1. 要望内容の概略について 要望され た医薬品 一般名 : テモゾロミド 販売名 : テモダールカプセル 20 mg 同カプセル 100 mg 同点滴静注用 100 mg 会社名 :MSD 株式会社 要望者名 日本小児血液 がん学会 要望内容効能 効果再発 難治性ユーイング肉腫
医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 テモゾロミド 再発 難治性ユーイング肉腫 1. 要望内容の概略について 要望され た医薬品 一般名 : テモゾロミド 販売名 : テモダールカプセル 20 mg 同カプセル 100 mg 同点滴静注用 100 mg 会社名 :MSD 株式会社 要望者名 日本小児血液 がん学会 要望内容効能 効果再発 難治性ユーイング肉腫
Microsoft Word - 別添 [公知78]オキサリプラチン公知報告書(案)130411
![Microsoft Word - 別添 [公知78]オキサリプラチン公知報告書(案)130411 Microsoft Word - 別添 [公知78]オキサリプラチン公知報告書(案)130411](/thumbs/94/118214475.jpg) 資料 4 1 オキサリプラチンの取扱いについて オキサリプラチンの切除不能進行 再発胃癌に対する開発については 平成 21 年 6 月から8 月の要望募集において要望が提出され ( 要望者 : 日本胃癌学会 ) 平成 22 年 10 月 6 日に開催された第 5 回医療上の必要性の高い未承認薬 適応外薬検討会議で医療上の必要性が高いと判断され 平成 22 年 12 月 13 日に開発要請を行ったところである
資料 4 1 オキサリプラチンの取扱いについて オキサリプラチンの切除不能進行 再発胃癌に対する開発については 平成 21 年 6 月から8 月の要望募集において要望が提出され ( 要望者 : 日本胃癌学会 ) 平成 22 年 10 月 6 日に開催された第 5 回医療上の必要性の高い未承認薬 適応外薬検討会議で医療上の必要性が高いと判断され 平成 22 年 12 月 13 日に開発要請を行ったところである
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
鑑-H リンゼス錠他 留意事項通知の一部改正等について
 日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
日医発第 617 号 ( 保 154) 平成 30 年 8 月 29 日 都道府県医師会長殿 日本医師会長横倉義武 医薬品医療機器等法上の効能 効果等の変更に伴う留意事項の一部改正等について 平成 30 年 8 月 21 日付け保医発 0821 第 1 号厚生労働省保険局医療課長通知により 添付資料の通り保険適用上の取扱いに関する留意事項が一部改正されましたのでお知らせ申し上げます 今回の改正は 同日付けで添付資料の医薬品の効能
5_使用上の注意(37薬効)Web作業用.indd
 34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生年月日 住所 M T S H 西暦 電話番号 年月日 ( ) - 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 ( ) - 家族構成 ( ) - ( ) - ( ) - ( ) - 担当医情報 医
 佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
佐賀県肺がん地域連携パス様式 1 ( 臨床情報台帳 1) 患者様情報 氏名 性別 男性 女性 生 住所 M T S H 西暦 電話番号 氏名 ( キーパーソンに ) 続柄居住地電話番号備考 家族構成 情報 医療機関名 診療科 住所 電話番号 紹介医 計画策定病院 (A) 連携医療機関 (B) 疾患情報 組織型 遺伝子変異 臨床病期 病理病期 サイズ 手術 有 無 手術日 手術時年齢 手術 有 無 手術日
ベバシズマブ併用 FOLFOX/FOLFIRI療法
 第 5 回福岡大学病院と院外薬局とのがん治療連携勉強会 ベバシズマブ併用 FOLFOX/FOLFIRI 療法 福岡大学病院腫瘍 血液 感染症内科 田中俊裕 本日の講演内容 大腸がんの治療方法について概説 アバスチン併用 FOLFOX/FOLFIRI 療法の治 療成績について 2005 年にがんで死亡した人は 325,941 例 ( 男性 196,603 例 女性 129,338 例 ) 2 位 4
第 5 回福岡大学病院と院外薬局とのがん治療連携勉強会 ベバシズマブ併用 FOLFOX/FOLFIRI 療法 福岡大学病院腫瘍 血液 感染症内科 田中俊裕 本日の講演内容 大腸がんの治療方法について概説 アバスチン併用 FOLFOX/FOLFIRI 療法の治 療成績について 2005 年にがんで死亡した人は 325,941 例 ( 男性 196,603 例 女性 129,338 例 ) 2 位 4
10 年相対生存率 全患者 相対生存率 (%) (Period 法 ) Key Point 1 10 年相対生存率に明らかな男女差は見られない わずかではあ
 (ICD10: C91 C95 ICD O M: 9740 9749, 9800 9999) 全体のデータにおける 治癒モデルの結果が不安定であるため 治癒モデルの結果を示していない 219 10 年相対生存率 全患者 相対生存率 (%) 52 52 53 31 29 31 26 23 25 1993 1997 1998 01 02 06 02 06 (Period 法 ) 21 17 55 54
(ICD10: C91 C95 ICD O M: 9740 9749, 9800 9999) 全体のデータにおける 治癒モデルの結果が不安定であるため 治癒モデルの結果を示していない 219 10 年相対生存率 全患者 相対生存率 (%) 52 52 53 31 29 31 26 23 25 1993 1997 1998 01 02 06 02 06 (Period 法 ) 21 17 55 54
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
<4D F736F F D2089BB8A7797C C B B835888E790AC8C7689E6>
 2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
094 小細胞肺がんとはどのような肺がんですか んの 1 つです 小細胞肺がんは, 肺がんの約 15% を占めていて, 肺がんの組 織型のなかでは 3 番目に多いものです たばことの関係が強いが 小細胞肺がんは, ほかの組織型と比べて進行が速く転移しやすいため, 手術 可能な時期に発見されることは少
 執筆者倉田宝保 松井薫 094 小細胞肺がんとはどのような肺がんですか んの 1 つです 小細胞肺がんは, 肺がんの約 15% を占めていて, 肺がんの組 織型のなかでは 3 番目に多いものです たばことの関係が強いが 小細胞肺がんは, ほかの組織型と比べて進行が速く転移しやすいため, 手術 可能な時期に発見されることは少なく, 手術が行われることはまれです 手術療 法は通常,Ⅰ 期 ( ほかの臓器にはもちろん,
執筆者倉田宝保 松井薫 094 小細胞肺がんとはどのような肺がんですか んの 1 つです 小細胞肺がんは, 肺がんの約 15% を占めていて, 肺がんの組 織型のなかでは 3 番目に多いものです たばことの関係が強いが 小細胞肺がんは, ほかの組織型と比べて進行が速く転移しやすいため, 手術 可能な時期に発見されることは少なく, 手術が行われることはまれです 手術療 法は通常,Ⅰ 期 ( ほかの臓器にはもちろん,
がん化学(放射線)療法レジメン申請書
 がん化学 ( 放射線 ) 療法レジメン申請書 申請期日診療科名診療科長署名申請医師署名登録確認日 2010 年 11 月 2 日 受付番号がん腫 ( コード ) レジメン登録ナンバー * 記入不要です * * * 登録削除日 がん種レジメン名実施区分使用分類適応分類 入院 日常診療 ( 試験以外 ) 術前補助化学療法 非ホジキ ンリンパ腫 非ホジキンリンパ腫 MTX-AraC 療法 外来 単施設自主研究
がん化学 ( 放射線 ) 療法レジメン申請書 申請期日診療科名診療科長署名申請医師署名登録確認日 2010 年 11 月 2 日 受付番号がん腫 ( コード ) レジメン登録ナンバー * 記入不要です * * * 登録削除日 がん種レジメン名実施区分使用分類適応分類 入院 日常診療 ( 試験以外 ) 術前補助化学療法 非ホジキ ンリンパ腫 非ホジキンリンパ腫 MTX-AraC 療法 外来 単施設自主研究
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
資料 4 6 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 ( 案 ) ダカルバジン褐色細胞腫 ( 傍神経節細胞腫を含む ) 1. 要望内容の概略について 要望された医薬品 一般名 : ダカルバジン 販売名 : ダカルバジン注用 100 会社名 : 協和発酵キリン株式
 資料 4 6 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 ( 案 ) ダカルバジン褐色細胞腫 ( 傍神経節細胞腫を含む ) 1. 要望内容の概略について 要望された医薬品 一般名 : ダカルバジン 販売名 : ダカルバジン注用 100 会社名 : 協和発酵キリン株式会社 要望者名 褐色細胞腫を考える会 一般社団法人日本内分泌学会 個人 要望内容効能 効果褐色細胞腫
資料 4 6 医療上の必要性の高い未承認薬 適応外薬検討会議公知申請への該当性に係る報告書 ( 案 ) ダカルバジン褐色細胞腫 ( 傍神経節細胞腫を含む ) 1. 要望内容の概略について 要望された医薬品 一般名 : ダカルバジン 販売名 : ダカルバジン注用 100 会社名 : 協和発酵キリン株式会社 要望者名 褐色細胞腫を考える会 一般社団法人日本内分泌学会 個人 要望内容効能 効果褐色細胞腫
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん
 米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
米国で承認された エロツズマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 新潟県立がんセンター新潟病院内科臨床部長張高明先生です Q1: エロツズマブという薬が米国で承認されたと聞きましたが どのような薬ですか? エロツズマブについてエロツズマブは 患者さんで増殖しているがん細胞の骨髄腫細胞や 細菌やウイルスなどの人の体内に入ってきた異物 ( 抗原 ) を攻撃するナチュラルキラー細胞
悪性黒色腫(メラノーマ)薬物療法の手引き version
 一般社団法人日本皮膚悪性腫瘍学会 悪性黒色腫 ( メラノーマ ) 薬物療法の手引き version1. 2019 2014 年における免疫チェックポイント阻害薬である抗 PD-1 抗体ニボルマブと低分子性分子標的薬である BRAF 阻害薬ベムラフェニブの相次ぐ製造販売承認に端を発する新規薬剤の開発の成功と実地臨床への応用によって 進行期の悪性黒色腫に対する薬物療法は画期的かつ急激な変革期を迎えた このような薬物療法の進化を受けて
一般社団法人日本皮膚悪性腫瘍学会 悪性黒色腫 ( メラノーマ ) 薬物療法の手引き version1. 2019 2014 年における免疫チェックポイント阻害薬である抗 PD-1 抗体ニボルマブと低分子性分子標的薬である BRAF 阻害薬ベムラフェニブの相次ぐ製造販売承認に端を発する新規薬剤の開発の成功と実地臨床への応用によって 進行期の悪性黒色腫に対する薬物療法は画期的かつ急激な変革期を迎えた このような薬物療法の進化を受けて
CJLSG1202 説明文書 間質性肺炎を合併している化学療法未治療非小細胞肺癌非扁平上皮癌に 対するペメトレキセド + カルボプラチン併用療法の臨床 II 相試験 1. はじめに当院では最新の治療を患者さんに提供するとともに 病気の原因や診断方法 治療方法および予防方法の改善に努力しています この
 説明文書 間質性肺炎を合併している化学療法未治療非小細胞肺癌非扁平上皮癌に 対するペメトレキセド + カルボプラチン併用療法の臨床 II 相試験 1. はじめに当院では最新の治療を患者さんに提供するとともに 病気の原因や診断方法 治療方法および予防方法の改善に努力しています この中には より良い治療効果を示す新しい薬を選び出すことやすでに発売されている薬を他の薬剤とうまく組み合わせて使用する方法を検討することなどがあります
説明文書 間質性肺炎を合併している化学療法未治療非小細胞肺癌非扁平上皮癌に 対するペメトレキセド + カルボプラチン併用療法の臨床 II 相試験 1. はじめに当院では最新の治療を患者さんに提供するとともに 病気の原因や診断方法 治療方法および予防方法の改善に努力しています この中には より良い治療効果を示す新しい薬を選び出すことやすでに発売されている薬を他の薬剤とうまく組み合わせて使用する方法を検討することなどがあります
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認され
 ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
ダラツムマブってどんな薬? 初発の患者さん ( 初めて治療を受ける患者さん ) の治験募集についてー 米国で承認された ダラツムマブ という新薬について Q&A 形式でご紹介します Q&A の監修は 名古屋市立大学病院血液 腫瘍内科診療部長飯田真介先生です Q1 ダラツムマブという薬が米国で承認されたと聞きました どのような薬ですか? ダラツズマブはどのような薬? 私たちの体は 病原菌などの異物 (
販売名 ベージニオ 錠に係る医薬品リスク管理計画書 (RMP) の概要 ベージニオ錠 50mg ベージニオ錠 100mg ベージニオ錠 150mg 有効成分 アベマシクリブ 製造販売業者 日本イーライリリー株式会社 薬効分類 提出年月 平成 30 年 9 月 ( 別紙様式 ) 1.1
 ベージニオ錠 50mg ベージニオ錠 100mg ベージニオ錠 150mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は日本イーライリリー株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 日本イーライリリー株式会社 販売名 ベージニオ 錠に係る医薬品リスク管理計画書 (RMP) の概要 ベージニオ錠 50mg ベージニオ錠 100mg
ベージニオ錠 50mg ベージニオ錠 100mg ベージニオ錠 150mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は日本イーライリリー株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 日本イーライリリー株式会社 販売名 ベージニオ 錠に係る医薬品リスク管理計画書 (RMP) の概要 ベージニオ錠 50mg ベージニオ錠 100mg
 資料 3 5 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 抗がん WG> 目次 < > 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬インターフェロンアルファ-2b( 要望番号 ;52) 1 オキサリプラチン ( 要望番号 ;79) 5 シスプラチン パクリタキセル カルボプラチン ( 要望番号 ;144) 9 医療上の必要性の高い未承認薬
資料 3 5 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 抗がん WG> 目次 < > 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬インターフェロンアルファ-2b( 要望番号 ;52) 1 オキサリプラチン ( 要望番号 ;79) 5 シスプラチン パクリタキセル カルボプラチン ( 要望番号 ;144) 9 医療上の必要性の高い未承認薬
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
(2) レパーサ皮下注 140mgシリンジ及び同 140mgペン 1 本製剤については 最適使用推進ガイドラインに従い 有効性及び安全性に関する情報が十分蓄積するまでの間 本製剤の恩恵を強く受けることが期待される患者に対して使用するとともに 副作用が発現した際に必要な対応をとることが可能な一定の要件
 保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
保医発 0331 第 9 号 平成 29 年 3 月 31 日 地方厚生 ( 支 ) 局医療課長都道府県民生主管部 ( 局 ) 国民健康保険主管課 ( 部 ) 長都道府県後期高齢者医療主管部 ( 局 ) 後期高齢者医療主管課 ( 部 ) 長 殿 厚生労働省保険局医療課長 ( 公印省略 ) 抗 PCSK9 抗体製剤に係る最適使用推進ガイドラインの策定に伴う留意事項の 一部改正について 抗 PCSK9
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能
 医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
医薬品の添付文書等を調べる場合 最後に 検索 をクリック ( 下部の 検索 ボタンでも可 ) 特定の文書 ( 添付文書以外の文書 ) の記載内容から調べる場合 検索 をクリック ( 下部の 検索 ボタンでも可 ) 最後に 1 2 3 調べたい医薬品の名称を入力 ( 名称の一部のみの入力でも検索可能 ) ( 医薬品の名称のみで検索する場合 34 の項目は未選択 未入力で可 ) 検索結果で表示したい文書を選択
70 頭頸部放射線療法 放射線化学療法
 頭頸部放射線療法 放射線化学療法の患者への歯科治療 口腔ケア (1) 総論 1) 頭頸部の放射線 化学放射線療法の特徴 2) 頭頸部がん放射線療法による口腔への影響 3) 頭頸部放射線療法における歯科の役割 (2) 放射線治療による口腔合併症 ( 有害事象 ) と対処 1) 局所療法と急性 晩期障害 2) 口腔粘膜炎 3) 口腔乾燥症 4) 歯性感染症 カンジダ性口内炎 5) 味覚異常 6) 放射線性骨髄炎
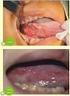
頭頸部放射線療法 放射線化学療法の患者への歯科治療 口腔ケア (1) 総論 1) 頭頸部の放射線 化学放射線療法の特徴 2) 頭頸部がん放射線療法による口腔への影響 3) 頭頸部放射線療法における歯科の役割 (2) 放射線治療による口腔合併症 ( 有害事象 ) と対処 1) 局所療法と急性 晩期障害 2) 口腔粘膜炎 3) 口腔乾燥症 4) 歯性感染症 カンジダ性口内炎 5) 味覚異常 6) 放射線性骨髄炎
1)表紙14年v0
 NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
がん化学(放射線)療法レジメン申請書
 がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2017 年 8 月 17 日受付番号 772 診療科名がん腫 ( コード ) * 診療科長名レジメン登録ナンバー * 申請医師名登録申請日 2017 年 8 月 17 日 審査区 ( 下記をチェックしてください ) 登録確認日 * 通常審査を希望 登録削除日 * 迅速審査を希望 注
がん化学 ( 放射線 ) 療法レジメン申請書 記載不備がある場合は審査対象になりません * は記入不要です 申請期日 2017 年 8 月 17 日受付番号 772 診療科名がん腫 ( コード ) * 診療科長名レジメン登録ナンバー * 申請医師名登録申請日 2017 年 8 月 17 日 審査区 ( 下記をチェックしてください ) 登録確認日 * 通常審査を希望 登録削除日 * 迅速審査を希望 注
放射線併用全身化学療法 (GC+RT 療法 ) 様の予定表 No.1 月日 経過 達成目標 治療 ( 点滴 内服 ) 検査 処置 活動 安静度 リハビリ 食事 栄養指導 清潔 排泄 / 入院当日 ~ 治療前日 化学療法について理解でき 精神的に安定した状態で治療が
 放射線併用全身化学療法 (GC+RT 療法 ) を受ける @PATIENTNAME 様の予定表 No.1 経過 検査 処置 リハビリ 栄養指導 入院当日 ~ 前日 化学療法について理解でき 精神的に安定した状態でが受けられる 現在内服している薬は通常通り内服して下さい * 必要に応じて薬剤管理の指導を行います 入院当日 採血を行います 入院中リハビリは特に予定していません 病院食を提供させていただきます
放射線併用全身化学療法 (GC+RT 療法 ) を受ける @PATIENTNAME 様の予定表 No.1 経過 検査 処置 リハビリ 栄養指導 入院当日 ~ 前日 化学療法について理解でき 精神的に安定した状態でが受けられる 現在内服している薬は通常通り内服して下さい * 必要に応じて薬剤管理の指導を行います 入院当日 採血を行います 入院中リハビリは特に予定していません 病院食を提供させていただきます
用法 用量 発作性夜間ヘモグロビン尿症における溶血抑制 mg mg mg mg kg 30kg 40kg 20kg 30kg 10kg 20kg 5kg 10kg 1900mg mg mg mg
 C EculizumabGenetical Recombination AMX 警告 1 2 禁忌 ( 次の患者には投与しないこと ) 1 2 組成 性状 ml mg mg mg mg mg ph ph mgml 効能 効果 発作性夜間ヘモグロビン尿症における溶血抑制 < 効能 効果に関連する使用上の注意 > 共通 1C5 C5b-9 b 発作性夜間ヘモグロビン尿症における溶血抑制 1 2 3 4
C EculizumabGenetical Recombination AMX 警告 1 2 禁忌 ( 次の患者には投与しないこと ) 1 2 組成 性状 ml mg mg mg mg mg ph ph mgml 効能 効果 発作性夜間ヘモグロビン尿症における溶血抑制 < 効能 効果に関連する使用上の注意 > 共通 1C5 C5b-9 b 発作性夜間ヘモグロビン尿症における溶血抑制 1 2 3 4
 - 1 - - 2 - - 3 - - 4 - - 5 - - 6 - - 7 - - 8 - - 9 - - 10 - - 11 - - 12 - - 13 - - 14 - - 15 - - 16 - - 17 - - 18 - - 19 - - 20 - - 21 - - 22 - - 23 - - 24 - - 25 - - 26 - - 27 - - 28 - - 29 - - 30 -
- 1 - - 2 - - 3 - - 4 - - 5 - - 6 - - 7 - - 8 - - 9 - - 10 - - 11 - - 12 - - 13 - - 14 - - 15 - - 16 - - 17 - - 18 - - 19 - - 20 - - 21 - - 22 - - 23 - - 24 - - 25 - - 26 - - 27 - - 28 - - 29 - - 30 -
( 様式甲 5) 氏 名 渡辺綾子 ( ふりがな ) ( わたなべあやこ ) 学 位 の 種 類 博士 ( 医学 ) 学位授与番号 甲 第 号 学位審査年月日 平成 27 年 7 月 8 日 学位授与の要件 学位規則第 4 条第 1 項該当 学位論文題名 Fibrates protect again
 ( 様式甲 5) 氏 名 渡辺綾子 ( ふりがな ) ( わたなべあやこ ) 学 位 の 種 類 博士 ( 医学 ) 学位授与番号 甲 第 号 学位審査年月日 平成 27 年 7 月 8 日 学位授与の要件 学位規則第 4 条第 1 項該当 学位論文題名 Fibrates protect against vascular endothelial dysfunction induced by paclitaxel
( 様式甲 5) 氏 名 渡辺綾子 ( ふりがな ) ( わたなべあやこ ) 学 位 の 種 類 博士 ( 医学 ) 学位授与番号 甲 第 号 学位審査年月日 平成 27 年 7 月 8 日 学位授与の要件 学位規則第 4 条第 1 項該当 学位論文題名 Fibrates protect against vascular endothelial dysfunction induced by paclitaxel
10 年相対生存率 全患者 相対生存率 (%) (Period 法 ) Key Point 1
 (ICD10: C81 85, C96 ICD O M: 9590 9729, 9750 9759) 治癒モデルの推定結果が不安定であったため 治癒モデルの結果を示していない 203 10 年相対生存率 全患者 相対生存率 (%) 71 68 50 53 52 45 47 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 43 38 41 76
(ICD10: C81 85, C96 ICD O M: 9590 9729, 9750 9759) 治癒モデルの推定結果が不安定であったため 治癒モデルの結果を示していない 203 10 年相対生存率 全患者 相対生存率 (%) 71 68 50 53 52 45 47 1993 1997 1998 2001 2002 2006 2002 2006 (Period 法 ) 43 38 41 76
Ⅲ-1-7 ( 別添様式 1) 未承認薬 適応外薬の要望 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児救急医学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 4 位 ( 全 4 要望中 ) 成 分 名 ( 一般名
 Ⅲ-1-7 ( 別添様式 未承認薬 適応外薬の要望 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児救急医学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 4 位 ( 全 4 要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 Ketorolac tromethamine ( 注射液 ) Toradol
Ⅲ-1-7 ( 別添様式 未承認薬 適応外薬の要望 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児救急医学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 4 位 ( 全 4 要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 Ketorolac tromethamine ( 注射液 ) Toradol
DRAFT#9 2011
 報道関係各位 2019 年 3 月 25 日 ユーシービージャパン株式会社 第一三共株式会社 抗てんかん剤 ビムパット 点滴静注 200mg 新発売のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン ユーシービーグループを総称して以下 ユーシービー ) と第一三共株式会社 ( 本社 : 東京都中央区 代表取締役社長 : 眞鍋淳
報道関係各位 2019 年 3 月 25 日 ユーシービージャパン株式会社 第一三共株式会社 抗てんかん剤 ビムパット 点滴静注 200mg 新発売のお知らせ ユーシービージャパン株式会社 ( 本社 : 東京都新宿区 代表取締役社長 : 菊池加奈子 以下 ユーシービージャパン ユーシービーグループを総称して以下 ユーシービー ) と第一三共株式会社 ( 本社 : 東京都中央区 代表取締役社長 : 眞鍋淳
用法・用量DB
 データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
データベース データベースの概要 医療用医薬品の添付文書に記載されているに関するデータベースです 処方薬の適正な投与量 ( 上限 下限 ) や投与日数 ( 上限 下限 ) などのチェック および患者さんへの服薬指導にご利用いただくことが可能です 本データベースは 医療用医薬品の添付文書に記載されているの情報を網羅しています データベースの特徴 年齢や体重 体表面積 適応病名 投与経路 療法毎にデータを作成しているため
抗菌薬の殺菌作用抗菌薬の殺菌作用には濃度依存性と時間依存性の 2 種類があり 抗菌薬の効果および用法 用量の設定に大きな影響を与えます 濃度依存性タイプでは 濃度を高めると濃度依存的に殺菌作用を示します 濃度依存性タイプの抗菌薬としては キノロン系薬やアミノ配糖体系薬が挙げられます 一方 時間依存性
 2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
Microsoft Word - Ⅱ docm
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 中外製薬株式会社 要望番号 成分名 ( 一般名 ) 販売名 未承認薬 適応外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 用法 用量 ( 要望された用法 用量について記載する ) II-210.1 ベバシズマブ ( 遺伝子組換え
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 中外製薬株式会社 要望番号 成分名 ( 一般名 ) 販売名 未承認薬 適応外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 用法 用量 ( 要望された用法 用量について記載する ) II-210.1 ベバシズマブ ( 遺伝子組換え
300828_課_薬生薬審発0828第1号_デュルバルマブ(遺伝子組換え)製剤の最適使用推進ガイドライン(非小細胞肺癌)について
 薬生薬審発 0828 第 1 号平成 3 0 年 8 月 2 8 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) デュルバルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 ) について 経済財政運営と改革の基本方針 2016( 平成 28 年 6 月 2 日閣議決定 ) において 革新的医薬品の使用の最適化推進を図ることが盛り込まれたことを受けて
薬生薬審発 0828 第 1 号平成 3 0 年 8 月 2 8 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) デュルバルマブ ( 遺伝子組換え ) 製剤の最適使用推進ガイドライン ( 非小細胞肺癌 ) について 経済財政運営と改革の基本方針 2016( 平成 28 年 6 月 2 日閣議決定 ) において 革新的医薬品の使用の最適化推進を図ることが盛り込まれたことを受けて
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
Ⅲ-1-31 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児血液 がん学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 7 位 ( 全 9 要望中 ) 成 分 名 (
 Ⅲ-1-31 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児血液 がん学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 7 位 ( 全 9 要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 クリゾチニブ XALKORI ファイザー株式会社日本血液学会
Ⅲ-1-31 未承認薬 適応外薬の要望 ( 別添様式 1) 1. 要望内容に関連する事項 要望者 ( 該当するものにチェックする ) 学会 ( 学会名 ; 日本小児血液 がん学会 ) 患者団体 ( 患者団体名 ; ) 個人 ( 氏名 ; ) 優先順位 7 位 ( 全 9 要望中 ) 成 分 名 ( 一般名 ) 販 売 名 会 社 名 国内関連学会 クリゾチニブ XALKORI ファイザー株式会社日本血液学会
ヒアルロン酸ナトリウム架橋体製剤 特定使用成績調査
 ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
