PowerPoint プレゼンテーション
|
|
|
- こうじ あかさか
- 4 years ago
- Views:
Transcription
1 治験の電子化
2 IRB 5 分間セミナー 第 1 回臨床研究の分類と治験 第 11 回 CRCの業務 ( その2) 第 2 回治験とGCPの動向 第 12 回治験中の臨床検査等の精度管理 第 3 回治験の計画 選定 合意 第 13 回 ALCOA 原則とは 第 4 回治験審査委員会の役割 第 14 回治験の電子化 第 5 回 CROとSMOの業務 第 15 回有害事象と副作用 第 6 回被験者の選定と同意取得 第 16 回治験の費用 ( 実施医療機関 ) 第 7 回逸脱とは 第 17 回治験の費用 ( 被験者 ) 第 8 回モニタリング 直接閲覧 監査第 18 回治験広告 第 9 回治験関係者の役割 第 19 回 GCP 調査 第 10 回 CRCの業務 ( その1) 第 20 回当院の取組み
3 治験の電子化 治験薬 国内 1 電子署名法 ( 平成 12 年 ) 2 個人情報保護法 ( 平成 15 年 ) 3 e- 文書法 ( 平成 16 年 ) 4 厚生労働省令第 44 号 ( 平成 17 年 ) 5 厚労省 ER/ES 通知 ( 平成 17 年 ) 治験の電子化に関わる通知等 海外 1 21CFR Part11(1997 FDA) 修正ガイダンス (2007) 2 HIPPA(2003 米国 ) 3 GAMP5(2008 GAMP Forum) 4 ANNEX 11 実行計画文書 (2009) 電子化における留意点 システムのバリデーション (CSV) 真正性 ( 故意 / 過失による 書換 消去 混同 改竄等の防止 本人認証 ) 見読性 ( 入力情報を必要に応じ すべて表示 印字できること ) 保存性 ( 法令等で定められた期間 復元可能な状態で保存すること ) 適切な運用体制 手順の作成 ID パスワードの適切な管理 ( なりすましの防止 ) 関係者への教育 訓練
4 紙ベース 診療情報 ( 紙カルテ ) 被験者登録 治験薬管理 被験者日誌 書類の郵送 治験の電子化 治験の電子化の一例 電子化 電子カルテ 施設を超えた診療情報のネットワーク化 IVRS(Interactive Voice Response System) IWRS(Interactive Web Response System) epro(patient Reported Outcome) CRF e-crf(edc:electronic Data Capture) 症例データ管理 CTD CDMS(Clinical Data Management System) e-ctd(common Technical Document: 医薬品承認申請様式 )
5 EDC 使用時の治験の流れ 選定時 治験開始時 治験実施中 治験終了時 環境整備等 説明 研修等 SDV クエリー等 データの固定 保管等 ネット / 電話回線 パソコン OS ユーザー登録 ユーザー研修 操作 セキュリティ 研修記録 誓約書 アカウントの発行と管理 入力データ閲覧 ダウンロード SDV で入力データの照合 クエリー (DCF) の作成 解決 データの承認 固定の確認 治験責任医師に CRF の電子媒体を CD-R 等にて提供
6 EDC 留意事項 トレーニング セキュリティ 留意事項 医療機関および治験依頼者の全ユーザーに対して Face to Face Training または e-learning 等により研修 ( 試験途中の追加者にも実施すること ) 研修記録の作成 保管が必要 研修内容および役割に応じたアカウントの発行 ( 分担リストへの追加 削除時期に連動 ) ログインは ID( ユーザー名 ) とパスワードにより実施 パスワードは他人にわからないように本人が管理 ( 定期的な変更も必要 ) なりすまし ID( ユーザー名 ) の他人との共有は不可 席を外す場合はログアウトする 電子署名機能がある場合 ID( ユーザー名 ) とパスワードにより 手書き署名と同等の法的拘束力を持つ
7 EDC 適合性検査 薬機審長発第 号 ( 平成 25 年 3 月 27 日 ) 目的 適用する調査 手順 EDC を利用した業務のプロセスを 効果的かつ効率的に確認するため EDC 管理シート を導入する 治験等のデータ収集に EDC システムが利用されている場合例 )CRF 患者日誌 製販後調査の調査票作成 治験等のデータが 医療機関等から治験依頼者 (CRO) に電磁的に提供される場合 1 治験依頼者等は PMDA 形式の EDC 管理シートを作成し 適合性調査前に提出 2PMDA は EDC 管理シートを活用し 適合性調査 を実施 運用開始 2013 年 10 月 1 日
8 治験関連文書の電磁的記録の活用 審査管理課事務連絡 ( 平成 26 年 7 月 1 日 ) 交付方法 交付時の留意事項 事実経過の検証記録 ( 一例 ) 1 メール 2DVD-R 等 3 クラウド等システムによる交付 受領側からの事前承諾 受領側が電磁的記録の出力書面を作成できること 電磁的授与された文書の 交付側および受領側双方における保存 事実経過の検証の記録の作成および保存 メール交付時 送受信のメールの保存 送受信簿の作成 受領確認 本来の受領者への交付検証 DVD-R 等の交付時 送付状の複写および送付記録の保存 送付簿の作成 受領票等への受領者の署名 受領確認 クラウド等システムによる交付時 システムへのログ作成 受領簿の作成 保存ログへの受領記録作成
9 リモート SDV(R-SDV) R-SDV とは R-SDV での必要事項 R-SDV の手法 メリット ( 一例 ) 問題点 ( 一例 ) 実際に治験実施医療機関を訪問するのではなく 専用のシステム等を通じて遠隔地から実施する SDV のこと オフサイトモニタリングの一手法 R-SDV の手順書の整備 利用環境の整備 (PC 回線 セキュリティ 部屋等 ) 利用者への教育 ( 個人情報保護 情報セキュリティ SOP 等 ) とその記録 1 医療機関の資料 ( カルテ等 ) を直接専用システムを通じて 確認する方法 ( 例 ) 静岡がんセンター 金沢医療センター等 2PDF 化された医療機関の資料 ( カルテ等 ) を専用システムを通じ 確認する方法 ( 例 ) 近畿大学 北里大学等 (1) 治験の効率化 SDV に要する時間 費用等の削減 (2) 随時 迅速なデータ確認作業が可能 治験の質の向上 (1) すべての原資料は閲覧できない (2) 閲覧資料が原資料とはみなせない (3) 依頼者に R-SDV 専用の部屋が必要になる (4) 病院の治験関係者との面談機会の減少
10 CDISC:PMDA の動向 電子データ提出に関する基本的考え方 ( 平成 26 年 6 月 20 日 ) 承認申請時の電子データ提出に関する実務的事項について ( 平成 27 年 4 月 27 日 ) 背景 対象品目 PMDA 自らが臨床データ等を活用した解析や研究を進め 審査 相談において より合理的で効率的な評価 判断プロセスの構築を進める 医療用医薬品 データ標準 CDISC 標準 承認申請添付資料 対象となる資料 原則 ectd 1 すべての第 Ⅱ 相および第 Ⅲ 相試験の成績 2 第 Ⅰ 相試験および臨床薬理試験のうち 次に掲げる試験の成績 高悪性腫瘍剤での第 Ⅰ 相試験 日本人と外国人の双方での第 Ⅰ 相試験 ICH E14 ガイドラインに基づく QT/QTc 試験
11 CDISC( シーディスク ) とは CDISC (Clinical Data Interchange Standards Consortium) は 非営利 の国際的 学際的な組織 CDISC は 臨床研究 治験領域のデータ標準を策定しており これらの データ標準を CDISC と呼ぶ CDISC に比肩するデータ標準は存在しておらず 唯一の世界標準 米国 FDA 日本の PMDA が申請時に臨床試験データを CDISC 形式で提出 することを今後義務付けることを通知している CDISC では治療領域ごとのデータ標準も進行中であり CDASH にも随時 反映される予定 CDASH (Clinical Data Acquisition Standaards Harmonization) は CDISC 標準の中で CRF( 症例報告書 ) におけるデータ収集項目の標準をまとめたもの
12 CDISC 利用のメリット メリット コストの削減と時間短縮 データの質の向上と効率化 関係者間でルールの事前共有が可能になる 複数試験を統合したデータベースの作成が容易になる 内容 依頼者 CRO 中央検査機関 医療機関 規制当局 共同開発会社等の組織間でデータを交換したり利用したりする力 (Interoperability) が飛躍的に高まる データを扱うシステムやツール それらの構成要素までを事前に作り込むことができ それらの使用経験を積むことにより完成度が高まる CRF の個々の記入欄や入力規則 CRF 記入の手引き等の部品を事前に用意できる 教育訓練や施設向けのトレーニング等の説明資料を充実させられる 1 つの治験の仕事の経験が次の治験でも活かしやすくなる Benefit-Risk 評価の更新 研究者に対する個別データ提供 DSUR の効率化 CTD における統合解析の効率化 Modeling&Simulation による開発成功の可能性の向上 留意点 FDA や PMDA への申請のみを考えて 提出前に CDISC 形式に変換することは 費用対効果の観点から得策ではないデータ収集段階 (CDASH) から導入すれば上記のメリットをすべて享受できる
<93648EA593498B4C985E82C98AD682B782E E838A F E315F C668DDA95AA292E786C7378>
 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 ( 版 :2013 年 9 月 1 日 ver2.0) 2 3 電磁的記録として扱う治験関連文書 電磁的記録の交付
1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 ( 版 :2013 年 9 月 1 日 ver2.0) 2 3 電磁的記録として扱う治験関連文書 電磁的記録の交付
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下
 北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
北里大学病院モニタリング 監査 調査の受け入れ標準業務手順 ( 製造販売後臨床試験 ) 第 1 条 ( 目的 ) 本手順書は 北里大学病院において製造販売後臨床試験 ( 以下 試験とする ) 依頼者 ( 試験依頼者が業務を委託した者を含む 以下同じ ) が実施する直接閲覧を伴うモニタリング ( 以下 モニタリング という ) 監査の受け入れ 並びに試験審査委員会( 治験審査委員会が兼ねる 以下 治験審査委員会
本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員
 ( 第 1 版 :2015 年 7 月 1 日 ) 本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員会の間での電子的記録の作成, 交付, 受領及び保存に用いるシステム規定や文書等で責任者の行うべき業務の権限を与えられ,
( 第 1 版 :2015 年 7 月 1 日 ) 本手順書で使用する用語の定義 用語電子的記録書面電子的記録利用システム実務担当者原データ治験関連文書サイボウズサイボウズメッセージ 定義人の知覚では認識できない, 電子式等の方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験責任医師並びに治験審査委員会の間での電子的記録の作成, 交付, 受領及び保存に用いるシステム規定や文書等で責任者の行うべき業務の権限を与えられ,
治験関連文書の電磁化に関する手順書 治験依頼者による治験等の実施に係る標準業務手順書 補遺 医師主導による治験等の実施に係る標準業務手順書 補遺 山口大学医学部附属病院 2018 年 4 月 01 日第 1.0 版
 治験関連文書の電磁化に関する手順書 治験依頼者による治験等の実施に係る標準業務手順書 補遺 医師主導による治験等の実施に係る標準業務手順書 補遺 山口大学医学部附属病院 2018 年 4 月 01 日第 1.0 版 第 1 条目的本補遺は, 治験関連文書の電磁的記録 ( 以下, 電子資料 という ) の活用に関して適正な管理 運用を図り, 治験手続きの信頼性を確保し, 効率性を推進するために必要な事項を定めるものである
治験関連文書の電磁化に関する手順書 治験依頼者による治験等の実施に係る標準業務手順書 補遺 医師主導による治験等の実施に係る標準業務手順書 補遺 山口大学医学部附属病院 2018 年 4 月 01 日第 1.0 版 第 1 条目的本補遺は, 治験関連文書の電磁的記録 ( 以下, 電子資料 という ) の活用に関して適正な管理 運用を図り, 治験手続きの信頼性を確保し, 効率性を推進するために必要な事項を定めるものである
関西医科大学附属病院治験関連文書を電磁的記録として扱う際に確認すべきチェックリスト ( 第 2.1 版 ) 2019/05/07 番号 必須 授受 保存 確認内容チェック項目メモ欄 ( 協議事項を記載する ) 備考 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 電磁的記
 1 実施医療機関の長等の承諾 2 3 4 電磁的記録として扱う治験関連文書 電磁的記録の交付 受領手段 汎用性のあるファイル形式を利用することの指定有無 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認
1 実施医療機関の長等の承諾 2 3 4 電磁的記録として扱う治験関連文書 電磁的記録の交付 受領手段 汎用性のあるファイル形式を利用することの指定有無 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認
PowerPoint プレゼンテーション
 研究開発課題名難病 希少疾患の医薬品開発におけるクリニカルイノベーションネットワーク構想の推進を目指した疾患登録システム ( 患者レジストリ ) の構築 研究開発代表者 国立研究開発法人国立精神 神経医療研究センター 資料 2-3 トランスレーショナルメディカルセンター 臨床研究支援室長 発表内容 本研究の目標 実施体制 Remudy の実績と課題 目指すもの 疾患登録システム レジストリの信頼性について
研究開発課題名難病 希少疾患の医薬品開発におけるクリニカルイノベーションネットワーク構想の推進を目指した疾患登録システム ( 患者レジストリ ) の構築 研究開発代表者 国立研究開発法人国立精神 神経医療研究センター 資料 2-3 トランスレーショナルメディカルセンター 臨床研究支援室長 発表内容 本研究の目標 実施体制 Remudy の実績と課題 目指すもの 疾患登録システム レジストリの信頼性について
( 別紙 ) 承認申請時の電子データ提出に関する基本的考え方について ( 平成 26 年 6 月 20 日付け薬食審査発 0620 第 6 号厚生労働省医薬食品局審査管理課長通知 ) 新旧対照表 ( 別添 ) 改正後 承認申請時の電子データ提出に関する基本的考え方 1. 承認申請時に電子データ提出を
 ( 別紙 ) 承認申請時の電子データ提出に関する基本的考え方について ( 平成 26 年 6 月 20 日付け薬食審査発 0620 第 6 号厚生労働省医薬食品局審査管理課長通知 ) 新旧対照表 ( 別添 ) 改正後 承認申請時の電子データ提出に関する基本的考え方 1. 承認申請時に電子データ提出を求める背景 2. 電子データの提出対象となる品目と資料の範囲 (1) 対象となる品目 原則として 医薬品の承認申請について
( 別紙 ) 承認申請時の電子データ提出に関する基本的考え方について ( 平成 26 年 6 月 20 日付け薬食審査発 0620 第 6 号厚生労働省医薬食品局審査管理課長通知 ) 新旧対照表 ( 別添 ) 改正後 承認申請時の電子データ提出に関する基本的考え方 1. 承認申請時に電子データ提出を求める背景 2. 電子データの提出対象となる品目と資料の範囲 (1) 対象となる品目 原則として 医薬品の承認申請について
治験関連文書を電磁的記録として扱う際に確認すべきチェックリスト ( 第 2 版 ) 番号 必須 授受 保存 確認内容チェック項目メモ欄 ( 協議事項を記載する ) 備考 主な確認資料及びその版数 / 制定日 1. 長崎大学病院治験審査委員会に係る電子化に関する要項 ( 平成 26 年 2 月 10
 主な確認資料及びその版数 / 制定日 1. 長崎大学病院治験審査委員会に係る電子化に関する要項 ( 平成 26 年 2 月 10 日 ) 2. 3. 4. 5. 同じ確認資料を複数回利用する場合は本メモ欄に記載し 各項目にはの記載ののみでよい 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認
主な確認資料及びその版数 / 制定日 1. 長崎大学病院治験審査委員会に係る電子化に関する要項 ( 平成 26 年 2 月 10 日 ) 2. 3. 4. 5. 同じ確認資料を複数回利用する場合は本メモ欄に記載し 各項目にはの記載ののみでよい 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認
ワークシート 原資料 電子カルテ EDC SDV 監査 質問 当院の状況 原資料 原資料のうち 電子情報として取り扱われているものを教えてください データの保管期間は治験終了から 15 年を満たしていますか? 診療録 ( 入院 外来 ) 臨床検査値 画像情報 (X 線 内視鏡等 ) 波形情報 ( 心
 ワークシート 原資料 電子カルテ EDC SDV 監査 質問 当院の状況 原資料 原資料のうち 電子情報として取り扱われているものを教えてください データの保管期間は治験終了から 15 年を満たしていますか? 診療録 ( 入院 外来 ) 臨床検査値 画像情報 (X 線 内視鏡等 ) 波形情報 ( 心電図 脳波等 ) 薬剤オーダー記録 その他 ( ) スキャン等により紙媒体を電子化している 原資料と治験関連記録の保存期間は決まっていますか?
ワークシート 原資料 電子カルテ EDC SDV 監査 質問 当院の状況 原資料 原資料のうち 電子情報として取り扱われているものを教えてください データの保管期間は治験終了から 15 年を満たしていますか? 診療録 ( 入院 外来 ) 臨床検査値 画像情報 (X 線 内視鏡等 ) 波形情報 ( 心電図 脳波等 ) 薬剤オーダー記録 その他 ( ) スキャン等により紙媒体を電子化している 原資料と治験関連記録の保存期間は決まっていますか?
関西医科大学附属病院治験関連文書を電磁的記録として扱う際に確認すべきチェックリスト ( 第 3.0 版 ) 2019/10/08 番号 必須 授受 保存 確認内容チェック項目メモ欄 ( 協議事項を記載する ) 備考 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾
 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 主な確認資料及びその版数 / 制定日 1. 治験に係わる標準業務手順書 (2017 年 4 月 1 日改訂 ) 2.
1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 主な確認資料及びその版数 / 制定日 1. 治験に係わる標準業務手順書 (2017 年 4 月 1 日改訂 ) 2.
治験関連文書を電磁的記録として扱う際に確認すべきチェックリスト 広島大学病院 ( 第 2 版 /2019 年 7 月 16 日 ) 番号 必須 授受 保存 確認内容チェック項目メモ欄 ( 協議事項を記載する ) 備考 主な確認資料及びその版数 / 制定日 1. 広島大学病院治験業務支援システム カッ
 主な確認資料及びその版数 / 制定日 1. 広島大学病院治験業務支援システム カット ドゥ スクエア 運用マニュアル ( 第 1.1 版 /2019 年 6 月 12 日 ) 同じ確認資料を複数回利用する場合は本メモ欄に記載し 各項目にはの記載ののみでよい 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 (
主な確認資料及びその版数 / 制定日 1. 広島大学病院治験業務支援システム カット ドゥ スクエア 運用マニュアル ( 第 1.1 版 /2019 年 6 月 12 日 ) 同じ確認資料を複数回利用する場合は本メモ欄に記載し 各項目にはの記載ののみでよい 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 (
Advance_LIMS+ESER_ pdf
 Software for Wellreader, LIMS + ER/ES 指針対応ソフト Software for Wellreader, LIMS + ER/ES 指針対応ソフト エンドトキシン試験測定データの LIMS への送信を実現 GMPをはじめとする品質保証のあり方は PIC/SやICHのハーモナイゼーションの進展により 日々変化しています さらに GMPでは 1ヒューマンエラーを最小限に抑えること
Software for Wellreader, LIMS + ER/ES 指針対応ソフト Software for Wellreader, LIMS + ER/ES 指針対応ソフト エンドトキシン試験測定データの LIMS への送信を実現 GMPをはじめとする品質保証のあり方は PIC/SやICHのハーモナイゼーションの進展により 日々変化しています さらに GMPでは 1ヒューマンエラーを最小限に抑えること
<4D F736F F F696E74202D EA18CB18AD B68F9182C982A882AF82E993648EA593498B4C985E82CC8A C98AD682B782E98AEE967B93498D6C82A695FB817682CC82DC82C682DF817C8F4390B32E >
 治験関連文書における電磁的記録の 活用に関する基本的考え方 のまとめ JSQA GCP 部会特別プロジェクト 3 1 GCPにおいて 治験に係る様々な文書の交付及び保存が規定されていますが 治験関連業務の効率化として電磁的記録の更なる活用が期待されています これに伴い 平成 25 年 7 月 1 日に事務連絡 1) が発出され その後 平成 26 年 7 月 1 日に一部改正 された事務連絡 2)
治験関連文書における電磁的記録の 活用に関する基本的考え方 のまとめ JSQA GCP 部会特別プロジェクト 3 1 GCPにおいて 治験に係る様々な文書の交付及び保存が規定されていますが 治験関連業務の効率化として電磁的記録の更なる活用が期待されています これに伴い 平成 25 年 7 月 1 日に事務連絡 1) が発出され その後 平成 26 年 7 月 1 日に一部改正 された事務連絡 2)
治験関連文書を電磁的記録として扱う際に確認すべきチェックリスト ( 第 1 版 ) 番号 必須 授受 保存 確認内容チェック項目メモ欄 ( 協議事項を記載する ) 備考 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機
 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 主な確認資料及びその版数 / 制定日 1. 久留米大学臨床試験審査委員会における電磁的記録の活用に関するマニュアル
1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 主な確認資料及びその版数 / 制定日 1. 久留米大学臨床試験審査委員会における電磁的記録の活用に関するマニュアル
<4D F736F F D E34208EA18CB18EE891B182AB977697CC C8E8DB782B591D682A688CB978A>
 Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
Ver.2018.4 治験手続き要領 医療法人渓仁会手稲渓仁会病院治験事務局 治験の手続き要領は以下の通りとする 製造販売後臨床試験も以下に準じる 1. 治験審査委員会 (IRB) 開催日 書類提出期限 IRB 開催日は原則 毎月第 1 水曜日です 手続き書類の提出期限は IRB 開催日の 3 週間前です 開催予定日は手稲渓仁会病院治験管理センターホームページ ( 以下 HP) の 治験依頼者の方へ
福井大学医学部附属病院 治験手続きの電磁化における標準業務手順書 ( 第 1 版 :2018 年 10 月 1 日 )
 福井大学医学部附属病院 治験手続きの電磁化における標準業務手順書 ( 第 1 版 :2018 年 10 月 1 日 ) 本手順書で使用する用語の定義 用語電磁的記録書面電磁的記録利用システムコンピュータ システム バリデーション実務担当者原データ治験関連文書 定義人の知覚では認識できない, 電子式 磁気式 光学式などの方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長,
福井大学医学部附属病院 治験手続きの電磁化における標準業務手順書 ( 第 1 版 :2018 年 10 月 1 日 ) 本手順書で使用する用語の定義 用語電磁的記録書面電磁的記録利用システムコンピュータ システム バリデーション実務担当者原データ治験関連文書 定義人の知覚では認識できない, 電子式 磁気式 光学式などの方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長,
<4D F736F F D D318EA18CB18EE891B182AB82CC93648EA589BB82C982A882AF82E995578F808BC696B18EE88F878F E31322E31816A>
 日本医科大学武蔵小杉病院 ( 第 1 版 :2016 年 12 月 1 日 ) 本手順書で使用する用語の定義 用語電磁的記録書面電磁的記録利用システムコンピュータ システム バリデーション実務担当者原データ治験関連文書 定義人の知覚では認識できない, 電子式 磁気式 光学式などの方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験並びに治験審査委員会の間での電磁的記録の作成,
日本医科大学武蔵小杉病院 ( 第 1 版 :2016 年 12 月 1 日 ) 本手順書で使用する用語の定義 用語電磁的記録書面電磁的記録利用システムコンピュータ システム バリデーション実務担当者原データ治験関連文書 定義人の知覚では認識できない, 電子式 磁気式 光学式などの方法で記録され, コンピュータで処理される記録紙媒体による資料治験依頼者, 実施医療機関の長, 治験並びに治験審査委員会の間での電磁的記録の作成,
2015 年 9 月 1 日 プロジェクト / 試験番号 : 医療機関名 : 神戸大学医学部附属病院 担当 CRA: チェックリスト記入日 : 確認者 ( 上長 ) の署名及び確認日 : 治験関連文書の電磁的交付の可否 : 可 / 否 番号 必須 授受 保存 1 実施医療機関の長等の承諾 確認内容チ
 プロジェクト / 試験 : 医療機関名 : 神戸大学医学部附属病院 担当 CRA: チェックリスト記入日 : 確認者 ( 上長 ) の署名及び確認日 : 治験関連文書の電磁的交付の可否 : 可 / 否 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾
プロジェクト / 試験 : 医療機関名 : 神戸大学医学部附属病院 担当 CRA: チェックリスト記入日 : 確認者 ( 上長 ) の署名及び確認日 : 治験関連文書の電磁的交付の可否 : 可 / 否 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾
医師主導治験取扱要覧
 15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
15. 監査の実施に関する手順書 1. 目的と適用範囲本手順書は 当該治験において 及び監査担当者が 監査を適切に実施するための手順その他必要な事項を定めるものである なお が 本手順に係る業務を 治験調整委員会への業務委嘱に関する手順書 によって治験調整委員会に委嘱する場合 当該業務については 本手順書中の を 治験調整委員会 と読み替える 2. 実施体制及び責務 2.1. の責務 (1) は 当該治験の品質保証のため
徳島大学病院で治験関連文書を電磁的記録として扱う際に確認すべきチェックリスト 番号 必須 授受 保存 確認内容チェック項目メモ欄 ( 協議事項を記載する ) 備考 主な確認資料及びその版数 / 制定日 1. 徳島大学病院における治験手続きの電磁化に関する手順書 ( 平成 30 年 7 月 13 日
 主な確認資料及びその版数 / 制定日 1. 徳島大学病院における治験手続きの電磁化に関する手順書 ( 平成 30 年 7 月 13 日 ) 2. カット ドゥ スクエアシステムの概要 :2018 年 6 月 20 日 3. カット ドゥ スクエア利用規約 : 第 2.1 版 (2013 年 4 月 1 日 ) 4, カット ドゥ スクエアマニュアル担当者電子原本管理 ~ 同じ確認資料を複数回利用する場合は本メモ欄に記載し
主な確認資料及びその版数 / 制定日 1. 徳島大学病院における治験手続きの電磁化に関する手順書 ( 平成 30 年 7 月 13 日 ) 2. カット ドゥ スクエアシステムの概要 :2018 年 6 月 20 日 3. カット ドゥ スクエア利用規約 : 第 2.1 版 (2013 年 4 月 1 日 ) 4, カット ドゥ スクエアマニュアル担当者電子原本管理 ~ 同じ確認資料を複数回利用する場合は本メモ欄に記載し
<284A504D41816A88E397C38B408AD693648EA589BB91CE899E92B28DB E838A F3294C55F F93FA967B88E389C891E58A
 1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 主な確認資料及びその版数 / 制定日 1. 日本医科大学武蔵小杉病院における治験手続きの電磁化における標準業務手順書
1 実施医療機関の長等の承諾 電磁的記録として扱う治験関連文書 ( 範囲 ) の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 電磁的記録の交付 受領手段の承諾 SOP 等 施設の正式文書の記載 実施医療機関の長からの確認 実務担当者からの確認 主な確認資料及びその版数 / 制定日 1. 日本医科大学武蔵小杉病院における治験手続きの電磁化における標準業務手順書
内容 1. はじめに 大規模治験ネットワーク登録医療機関への支援内容 治験実施医療機関情報の登録と公開 登録の条件 事前確認 大規模治験ネットワーク への登録方法 登録の手順 登録でき
 大規模治験ネットワーク 登録マニュアル Ver1.1 2013/4/1 公益社団法人日本医師会治験促進センター 0 内容 1. はじめに... 2 2. 大規模治験ネットワーク登録医療機関への支援内容... 2 3. 治験実施医療機関情報の登録と公開... 3 4. 登録の条件... 4 5. 事前確認... 5 6. 大規模治験ネットワーク への登録方法... 6 6-1 登録の手順... 6 6-2
大規模治験ネットワーク 登録マニュアル Ver1.1 2013/4/1 公益社団法人日本医師会治験促進センター 0 内容 1. はじめに... 2 2. 大規模治験ネットワーク登録医療機関への支援内容... 2 3. 治験実施医療機関情報の登録と公開... 3 4. 登録の条件... 4 5. 事前確認... 5 6. 大規模治験ネットワーク への登録方法... 6 6-1 登録の手順... 6 6-2
Ⅰ バイタルリンク 利用申込書 ( 様式 1-1)( 様式 ) の手続 バイタルリンク を利用する者 ( 以下 システム利用者 という ) は 小松島市医師会長宛に あらかじ め次の手順による手続きが必要になります 新規登録手続の手順 1 <システム利用者 ( 医療 介護事業者 )>
 医療介護連携情報ネットワーク バイタルリンク 利用における 個人情報の適切な取扱いの手引き 平成 29 年月日版 一般社団法人小松島市医師会 Ⅰ バイタルリンク 利用申込書 ( 様式 1-1)( 様式 2-1 2-2) の手続 バイタルリンク を利用する者 ( 以下 システム利用者 という ) は 小松島市医師会長宛に あらかじ め次の手順による手続きが必要になります 新規登録手続の手順 1
医療介護連携情報ネットワーク バイタルリンク 利用における 個人情報の適切な取扱いの手引き 平成 29 年月日版 一般社団法人小松島市医師会 Ⅰ バイタルリンク 利用申込書 ( 様式 1-1)( 様式 2-1 2-2) の手続 バイタルリンク を利用する者 ( 以下 システム利用者 という ) は 小松島市医師会長宛に あらかじ め次の手順による手続きが必要になります 新規登録手続の手順 1
Microsoft PowerPoint - 01CDISC概要短縮版.ppt
 CDISC 標準の概要 東京大学医学部附属病院大学病院医療情報ネットワーク研究センター木内貴弘 目次 1.CDISC 標準について 2. 医療の世界のデータ交換標準と臨床研究の世界のデータ交換標準 3.CDISC 標準を活用した効率的な臨床研究 1.CDISC 標準について CDISC とは? Clinical Data Interchange Standards Consortium の略 ( 非営利の臨床データ標準化団体
CDISC 標準の概要 東京大学医学部附属病院大学病院医療情報ネットワーク研究センター木内貴弘 目次 1.CDISC 標準について 2. 医療の世界のデータ交換標準と臨床研究の世界のデータ交換標準 3.CDISC 標準を活用した効率的な臨床研究 1.CDISC 標準について CDISC とは? Clinical Data Interchange Standards Consortium の略 ( 非営利の臨床データ標準化団体
公益社団法人日本医師会治験促進センターの事業は 国立研究開発法人日本医療研究開発機構 (AMED) の委託研究であり本日はその成果の一部を発表します カット ドゥ スクエアが 実現する電磁化と etmf 対応について 電磁化推進シンポジウム医療機関の治験関連文書の電磁化に係る課題解決に向けて < 東
 公益社団法人日本医師会治験促進センターの事業は 国立研究開発法人日本医療研究開発機構 (AMED) の委託研究であり本日はその成果の一部を発表します カット ドゥ スクエアが 実現する電磁化と etmf 対応について 電磁化推進シンポジウム医療機関の治験関連文書の電磁化に係る課題解決に向けて < 東京会場 >2017 年 10 月 25 日 ( 水 ) 日本医師会館 < 福岡会場 >2017 年 11
公益社団法人日本医師会治験促進センターの事業は 国立研究開発法人日本医療研究開発機構 (AMED) の委託研究であり本日はその成果の一部を発表します カット ドゥ スクエアが 実現する電磁化と etmf 対応について 電磁化推進シンポジウム医療機関の治験関連文書の電磁化に係る課題解決に向けて < 東京会場 >2017 年 10 月 25 日 ( 水 ) 日本医師会館 < 福岡会場 >2017 年 11
ICH-GCPとJ-GCPとの比較表
 参考資料 10 我が国の GCP と ICH-GCP の主な 1 治験の契約に関する規定 1-1 契約者に関する規定 1-2 実施医療機関の長との契約を規定したことに伴う規定 2 治験審査委員会 (IRB) に関する規定 2-1 IRB の設置に関する規定 2-2 IRB への審議依頼に関する規定 1/11 1. 治験の契約に関する規定 1-1. 契約者に関する規定 ICH-GCP 1.17( 用語の定義
参考資料 10 我が国の GCP と ICH-GCP の主な 1 治験の契約に関する規定 1-1 契約者に関する規定 1-2 実施医療機関の長との契約を規定したことに伴う規定 2 治験審査委員会 (IRB) に関する規定 2-1 IRB の設置に関する規定 2-2 IRB への審議依頼に関する規定 1/11 1. 治験の契約に関する規定 1-1. 契約者に関する規定 ICH-GCP 1.17( 用語の定義
<4D F736F F D208EA18CB182C98AD682B782E995578F808BC696B18EE88F878F E38E748EE593B1816A E7B8D732E646F637
 治験に関する標準業務手順書 ( 医師主導治験 ) 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医師主導治験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 (
治験に関する標準業務手順書 ( 医師主導治験 ) 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医師主導治験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 (
<4D F736F F F696E74202D208EA18CB B90B389BB8DEC8BC694C F E B93C782DD8EE682E890EA97705D205B8CDD8AB
 治験等適正化作業班における 検討 独立行政法人国立病院機構本部伊藤澄信 第 6 回治験中核病院 拠点医療機関等協議会 本日の内容 設置の経緯等について 主な検討内容について 今後の課題について その他 1 設置の経緯 (1) 1. 設置の背景 新たな治験活性化 5 カ年計画の中間見直しに関する検討会 報告の 重点的取組事項 ( アクションプラン ) の進捗 において 今後 取組みをより加速かつ強化すべき課題
治験等適正化作業班における 検討 独立行政法人国立病院機構本部伊藤澄信 第 6 回治験中核病院 拠点医療機関等協議会 本日の内容 設置の経緯等について 主な検討内容について 今後の課題について その他 1 設置の経緯 (1) 1. 設置の背景 新たな治験活性化 5 カ年計画の中間見直しに関する検討会 報告の 重点的取組事項 ( アクションプラン ) の進捗 において 今後 取組みをより加速かつ強化すべき課題
目次 1. 目的と適用範囲 定義 原則 使用機器 審査資料交付システム タブレット端末 管理運用体制 電磁的記録管理運用責任者の役割 電磁的記録管理運用担当者の役割
 特定非営利活動法人臨床研究の倫理を考える会 治験審査委員会 倫理審査委員会における電磁的記録の 活用に係る標準業務手順書 版数 : 初版承認日 : 2014 年 4 月 18 日承認者 : 理事長橋爪敬三 この手順書は 2014 年 4 月 21 日から施行する 目次 1. 目的と適用範囲... 1 2. 定義... 1 3. 原則... 1 4. 使用機器... 2 4.1 審査資料交付システム...
特定非営利活動法人臨床研究の倫理を考える会 治験審査委員会 倫理審査委員会における電磁的記録の 活用に係る標準業務手順書 版数 : 初版承認日 : 2014 年 4 月 18 日承認者 : 理事長橋爪敬三 この手順書は 2014 年 4 月 21 日から施行する 目次 1. 目的と適用範囲... 1 2. 定義... 1 3. 原則... 1 4. 使用機器... 2 4.1 審査資料交付システム...
<4D F736F F D A835E838A F8B7982D18AC48DB85F20534F A68CEB8E9A E9A8F4390B38DCF2
 自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
自治医科大学人を対象とした医学系研究に関するモニタリング及び監査の標準業務手順書 ver.1.0(2015 年 5 月 15 日 ) 1. 目的等 1) 目的 (1) 本手順書は 自治医科大学の教職員が 人を対象とする医学系研究に関する倫理指針 ( 平成 26 年文部科学省 厚生労働省告示第 3 号 ) 及び指針告示に伴う通知ならびにガイダンス ( 以下 指針 指針告示に伴う通知及びガイダンスを合わせて
Microsoft PowerPoint - 運用 [互換モード]
![Microsoft PowerPoint - 運用 [互換モード] Microsoft PowerPoint - 運用 [互換モード]](/thumbs/91/105850431.jpg) 押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
押印省略 電子申請に伴う 統一書式の運用について 独立行政法人国立病院機構東京医療センター 2012.11.1 Ver.1.0 東京医療センターにおける 書式運用基本方針 東京医療センターの書式運用基本方針 1 東京医療センター 企業主導治験に係る標準業務手順書より抜粋 第 6 章治験事務局の設置及び業務第 23 条 ( 略 ) 3 治験事務局は 院長の指示により 次の業務を行う ( 略 ) (4)
操作マニュアル(ユーザ画面)
 (Document Receive and Safety Information management System) 操作マニュアル 株式会社ファイブリングス Ver.1.1 作成日 2016 年 4 月 1 日 DRaSIS について I. 本システムの概略 本システムは 治験関連文書及び安全性情報の共有及び一元管理を目的としたクラウドシステムです ダウンロード 治験調整委員会事務局 受信確認
(Document Receive and Safety Information management System) 操作マニュアル 株式会社ファイブリングス Ver.1.1 作成日 2016 年 4 月 1 日 DRaSIS について I. 本システムの概略 本システムは 治験関連文書及び安全性情報の共有及び一元管理を目的としたクラウドシステムです ダウンロード 治験調整委員会事務局 受信確認
静岡県立静岡がんセンター臨床研究事務局の業務手順書
 治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
治験薬管理者の業務手順書 更新履歴 版 承認日 承認者 1.0 平成 15 年 3 月 14 日 施行 経営戦略会議 2.0 平成 15 年 4 月 15 日 改正 経営戦略会議 3.0 平成 16 年 3 月 31 日 改正 経営戦略会議 4.0 平成 17 年 6 月 20 日 改正 経営戦略会議 5.0 平成 18 年 3 月 10 日 改正 経営戦略会議 6.0 平成 20 年 1 月 28
第 4 章治験責任医師の業務 目次 1. 目的と適用範囲 1 2. 治験責任医師の要件 1 3. 治験実施計画書の遵守に関する合意 1 4. 同意説明文書の作成 1 5. 治験分担医師及び治験協力者のリストの作成 2 6. 治験の実施依頼 ( 新規 変更 継続 ) 3 7. 治験の実施等の了承 3
 第 4 章 治験責任医師の業務 第 4 章治験責任医師の業務 目次 1. 目的と適用範囲 1 2. 治験責任医師の要件 1 3. 治験実施計画書の遵守に関する合意 1 4. 同意説明文書の作成 1 5. 治験分担医師及び治験協力者のリストの作成 2 6. 治験の実施依頼 ( 新規 変更 継続 ) 3 7. 治験の実施等の了承 3 8. 治験の契約 3 9. 被験者の選定 3 10. 被験者の同意の取得
第 4 章 治験責任医師の業務 第 4 章治験責任医師の業務 目次 1. 目的と適用範囲 1 2. 治験責任医師の要件 1 3. 治験実施計画書の遵守に関する合意 1 4. 同意説明文書の作成 1 5. 治験分担医師及び治験協力者のリストの作成 2 6. 治験の実施依頼 ( 新規 変更 継続 ) 3 7. 治験の実施等の了承 3 8. 治験の契約 3 9. 被験者の選定 3 10. 被験者の同意の取得
標準業務手順 目次
 浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
浜松医科大学医学部附属病院治験審査委員会標準的業務手順書 第 1 章治験審査委員会 ( 目的と適用範囲 ) 第 1 条本手順書は GCP 省令等に基づいて 浜松医科大学医学部附属病院治験審査委員会の運営に関する手続及び記録の保存方法を定めるものである 2 本手順書は 医薬品及び医療機器の製造販売承認申請又は承認事項一部変更承認申請 ( 以下 承認申請 という ) の際に提出すべき資料の収集のために行う治験に対して適用する
UMIN INDICE Lower level data communication protocol for CDISC ODM規約
 UMIN INDICE Lower level data communication protocol for CDISC ODM 規約 API Ver2.7 用 UMIN INDICE システムに臨床研究データを CDISC ODM 形式で電子的に送付する場合の ODM 下層レベルのデータ交換規約 UMIN センター 2013/05/16 目次 1 概要...- 2-1.1 UMIN センター...-
UMIN INDICE Lower level data communication protocol for CDISC ODM 規約 API Ver2.7 用 UMIN INDICE システムに臨床研究データを CDISC ODM 形式で電子的に送付する場合の ODM 下層レベルのデータ交換規約 UMIN センター 2013/05/16 目次 1 概要...- 2-1.1 UMIN センター...-
本日の内容 1. 医薬品の再審査に係る関連法規 2. 医薬品の再審査申請資料の適合性調査 2.1. GPSP 実地調査における調査の視点 2.2. 適合性書面調査における調査の視点 2.3. ( 参考 ) 医薬品再審査適合性調査相談の現況 3. 適合性調査の効率化に向けて 3.1. 安全性情報管理シ
 医薬品の製造販売後調査の 現状と留意点 1 本日の内容 1. 医薬品の再審査に係る関連法規 2. 医薬品の再審査申請資料の適合性調査 2.1. GPSP 実地調査における調査の視点 2.2. 適合性書面調査における調査の視点 2.3. ( 参考 ) 医薬品再審査適合性調査相談の現況 3. 適合性調査の効率化に向けて 3.1. 安全性情報管理シートの任意提出と事前提出資料 ( 実施手続き通知の改正 )
医薬品の製造販売後調査の 現状と留意点 1 本日の内容 1. 医薬品の再審査に係る関連法規 2. 医薬品の再審査申請資料の適合性調査 2.1. GPSP 実地調査における調査の視点 2.2. 適合性書面調査における調査の視点 2.3. ( 参考 ) 医薬品再審査適合性調査相談の現況 3. 適合性調査の効率化に向けて 3.1. 安全性情報管理シートの任意提出と事前提出資料 ( 実施手続き通知の改正 )
管理者マニュアル
 管理者マニュアル 目次 1. KING OF TIME セキュアログインについて... 1 1.1. 本システムの主な機能... 1 1.2. 動作環境... 1 1.3. 使用できる認証方法... 2 2. はじめに... 3 2.1. ログイン... 3 2.2. 管理画面の構成... 4 3. KING OF TIME( 勤怠管理 ) との従業員連携について... 5 4. ユーザー設定について...
管理者マニュアル 目次 1. KING OF TIME セキュアログインについて... 1 1.1. 本システムの主な機能... 1 1.2. 動作環境... 1 1.3. 使用できる認証方法... 2 2. はじめに... 3 2.1. ログイン... 3 2.2. 管理画面の構成... 4 3. KING OF TIME( 勤怠管理 ) との従業員連携について... 5 4. ユーザー設定について...
【押印あり】日本医学会宛
 別紙 再生医療等製品患者登録システムへの参加協力のお願い 患者登録システムの目的 患者登録システムは 再生医療等製品の市販後の使用状況や患者予後等のデータを収集し 迅速な安全対策や新たな製品開発等を通じて 医療の向上に役立てることを目的としています 患者登録システムは 製品毎に構築 運用されます この患者登録システムは 一般的には レジストリ と呼ばれることもあります 構築形態例 患者登録システムの対象
別紙 再生医療等製品患者登録システムへの参加協力のお願い 患者登録システムの目的 患者登録システムは 再生医療等製品の市販後の使用状況や患者予後等のデータを収集し 迅速な安全対策や新たな製品開発等を通じて 医療の向上に役立てることを目的としています 患者登録システムは 製品毎に構築 運用されます この患者登録システムは 一般的には レジストリ と呼ばれることもあります 構築形態例 患者登録システムの対象
JCROA自主ガイドライン第4版案 GCP監査WG改訂案及び意見
 受託業務の適正な実施に関する日本 CRO 協会の自主ガイドライン ( 第 4 版 ) 目 次 1. 本ガイドライン制定の背景 2. 目的 3. 関連法規の遵守 4. 受託業務の範囲 5. 受託の検討 6. 受託業務の品質管理及び品質保証 7. 健康被害補償と損害賠償 8. 教育 9. モニタリング 10. 情報セキュリティ 11. 本会員の重大事態への対応 1/5 1. 本ガイドライン制定の背景日本
受託業務の適正な実施に関する日本 CRO 協会の自主ガイドライン ( 第 4 版 ) 目 次 1. 本ガイドライン制定の背景 2. 目的 3. 関連法規の遵守 4. 受託業務の範囲 5. 受託の検討 6. 受託業務の品質管理及び品質保証 7. 健康被害補償と損害賠償 8. 教育 9. モニタリング 10. 情報セキュリティ 11. 本会員の重大事態への対応 1/5 1. 本ガイドライン制定の背景日本
12_モニタリングの実施に関する手順書
 12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
12_ モニタリングの実施に関する手順書 静岡県立大学大学院薬食生命科学総合学府薬学研究院薬食研究推進センター版数 :1.0 版作成年月日 :2014 月 8 月 1 日 ( 最終確定 :2015 年 1 月 14 日 ) 1. 目的と適用範囲 本手順書は 当該研究において モニターが モニタリングを適切に実施するための手順 その他必要な事項を定めるものである 2. 実施体制及び責務 2.1 研究責任者の責務研究責任者は
PowerPoint Template
 電子契約 Agree 導入のご案内 1. 電子契約 Agree について 2. Agree の利用料金について 3. 事前準備について 更新日 :2017 年 7 月 21 日 1. 電子契約 Agree について 電子契約とは 従来 書面に押印して取り交わしていた契約を電子的に行うものです 当事者が合意した契約書の電子データ (PDF) をクラウド上にアップロードし 双方の署名者が電子署名を行う方法により締結します
電子契約 Agree 導入のご案内 1. 電子契約 Agree について 2. Agree の利用料金について 3. 事前準備について 更新日 :2017 年 7 月 21 日 1. 電子契約 Agree について 電子契約とは 従来 書面に押印して取り交わしていた契約を電子的に行うものです 当事者が合意した契約書の電子データ (PDF) をクラウド上にアップロードし 双方の署名者が電子署名を行う方法により締結します
1
 1 3 2008 4 19 69 20 82 12241251 IRB IRB CRC CRC 2000 EDC 2 baseline 19 20 Network draft protocol feasibilitystudy 20 CCR 1 9 timeline 40 coordinating centre Minnesota e-learning seminar 3 114 125 144 67
1 3 2008 4 19 69 20 82 12241251 IRB IRB CRC CRC 2000 EDC 2 baseline 19 20 Network draft protocol feasibilitystudy 20 CCR 1 9 timeline 40 coordinating centre Minnesota e-learning seminar 3 114 125 144 67
平成 30 年度データマネジャー養成研修 研修生募集要項 主催千葉大学医学部附属病院実施千葉大学医学部附属病院臨床試験部 1. 研修の目的 ICH-GCP の改訂や CDISC(Clinical Data Interchange Standards Consortium) 標準の規格での PMDA
 平成 30 年度データマネジャー養成研修 研修生募集要項 主催千葉大学医学部附属病院実施千葉大学医学部附属病院臨床試験部 1. 研修の目的 ICH-GCP の改訂や CDISC(Clinical Data Interchange Standards Consortium) 標準の規格での PMDA への申請データの提出など 治験や臨床研究のデータ管理を取り巻く環境が変化しています その中で 臨床試験のデータの質の維持
平成 30 年度データマネジャー養成研修 研修生募集要項 主催千葉大学医学部附属病院実施千葉大学医学部附属病院臨床試験部 1. 研修の目的 ICH-GCP の改訂や CDISC(Clinical Data Interchange Standards Consortium) 標準の規格での PMDA への申請データの提出など 治験や臨床研究のデータ管理を取り巻く環境が変化しています その中で 臨床試験のデータの質の維持
概要 PMDAにおける次世代審査 相談体制の構築 データ標準の利用 承認申請時の電子データ提出に関する基本的考え方 ( 案 ) について パイロット実施について CDISC 利用に関する今後の検討と展望 2014/05/16 CDISC 概説コース 2
 CDISC 概説コース PMDA の取り組みと 日本における CDISC の利用について 独立行政法人医薬品医療機器総合機構次世代審査等推進室 / スペシャリスト ( 生物統計担当 ) 安藤友紀 CDISC 2012 1 概要 PMDAにおける次世代審査 相談体制の構築 データ標準の利用 承認申請時の電子データ提出に関する基本的考え方 ( 案 ) について パイロット実施について CDISC 利用に関する今後の検討と展望
CDISC 概説コース PMDA の取り組みと 日本における CDISC の利用について 独立行政法人医薬品医療機器総合機構次世代審査等推進室 / スペシャリスト ( 生物統計担当 ) 安藤友紀 CDISC 2012 1 概要 PMDAにおける次世代審査 相談体制の構築 データ標準の利用 承認申請時の電子データ提出に関する基本的考え方 ( 案 ) について パイロット実施について CDISC 利用に関する今後の検討と展望
治験実施に必要な手続きについて (HP 用 ) 治験 製造販売後臨床試験 聖マリアンナ医科大学病院治験管理室 聖マリアンナ医科大学病院治験管理室 2011 年 10 月作成 2013 年 1 月改訂 2014 年 4 月改訂 2018 年 4 月改定 2018 年 5 月改定 Ⅰ. 治験審査委員会
 治験実施に必要な手続きについて (HP 用 ) 治験 製造販売後臨床試験 2011 年 10 月作成 2013 年 1 月改訂 2014 年 4 月改訂 2018 年 4 月改定 2018 年 5 月改定 Ⅰ. 治験審査委員会 (IRB) と連絡先 治験審査委員会名称 治験審査委員会設置者 聖マリアンナ医科大学附属病院等治験審査委員会 St. Marianna University Group Institutional
治験実施に必要な手続きについて (HP 用 ) 治験 製造販売後臨床試験 2011 年 10 月作成 2013 年 1 月改訂 2014 年 4 月改訂 2018 年 4 月改定 2018 年 5 月改定 Ⅰ. 治験審査委員会 (IRB) と連絡先 治験審査委員会名称 治験審査委員会設置者 聖マリアンナ医科大学附属病院等治験審査委員会 St. Marianna University Group Institutional
臨床試験(治験)の手続きについて
 臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
臨床試験 ( 治験 製造販売後臨床試験 ) の手続きについて 本書は 昭和大学横浜市北部病院における臨床試験 ( 治験 製造販売後臨床試験 ) の手続き等に関して記したものです 始める前にご一読下さい なお 下記手続きにおいて必要書類を提出される場合は臨床試験支援室 ( 連絡先 :10 ページ参照 ) までご連絡下さい - 試験依頼前 - 関係書類の入手 当院の臨床試験 ( 治験 製造販売後臨床試験
マイナンバー対策セミナー(実践編) 「マイナンバー対策マニュアル」を利用した具体的な対策方法について
 マイナンバー対策セミナー ( 実践編 ) マイナンバー対策マニュアル を利用した具体的な対策方法について 2015 年 9 月 -10 月 1 はじめに マイナンバー対策 の本質を理解する マイナンバー対策 は あらゆる対処をすることにより リスクを潰そうとする取り組みではない マイナンバー対策 の目的は リスクを管理できるようになることである マイナンバー対策マニュアル P1-P3 2 2 ゴール像
マイナンバー対策セミナー ( 実践編 ) マイナンバー対策マニュアル を利用した具体的な対策方法について 2015 年 9 月 -10 月 1 はじめに マイナンバー対策 の本質を理解する マイナンバー対策 は あらゆる対処をすることにより リスクを潰そうとする取り組みではない マイナンバー対策 の目的は リスクを管理できるようになることである マイナンバー対策マニュアル P1-P3 2 2 ゴール像
目次 1. はじめに 2. 実際の応募手続き 2-a. 手続きを始める前に 2-b. 研究開発提案書様式の取得 2-c. 応募の新規登録 2-d. 応募情報の入力 2
 免疫アレルギー疾患等実用化研究事業 ( 移植医療技術開発研究分野 ) 2019 年度 1 次公募に係る府省共通研究開発管理システム (e-rad) への入力方法について 戦略推進部 難病研究課 2018 年 11 月 1 目次 1. はじめに 2. 実際の応募手続き 2-a. 手続きを始める前に 2-b. 研究開発提案書様式の取得 2-c. 応募の新規登録 2-d. 応募情報の入力 2 1. はじめに
免疫アレルギー疾患等実用化研究事業 ( 移植医療技術開発研究分野 ) 2019 年度 1 次公募に係る府省共通研究開発管理システム (e-rad) への入力方法について 戦略推進部 難病研究課 2018 年 11 月 1 目次 1. はじめに 2. 実際の応募手続き 2-a. 手続きを始める前に 2-b. 研究開発提案書様式の取得 2-c. 応募の新規登録 2-d. 応募情報の入力 2 1. はじめに
Microsoft Word - 【061115】用語集(案).doc
 調査班報告書記載用語解説 平成 18 年 10 月 厚生労働省医政局研究開発振興課 - 1 - 本用語集は 次期治験活性化計画策定に係る検討会の各調査班で作成された報告書 ( 概要版を含む ) の中に記載されている用語 略語を解説するものである ( 略語編 ) ADaM Analysis Dataset Model 規制当局提出用解析データセットモデル のこと CCRP Certified Clinical
調査班報告書記載用語解説 平成 18 年 10 月 厚生労働省医政局研究開発振興課 - 1 - 本用語集は 次期治験活性化計画策定に係る検討会の各調査班で作成された報告書 ( 概要版を含む ) の中に記載されている用語 略語を解説するものである ( 略語編 ) ADaM Analysis Dataset Model 規制当局提出用解析データセットモデル のこと CCRP Certified Clinical
<4D F736F F D208CF897A689BB94C795F18D908F A2E646F63>
 への利用がまだ主体であり 製薬会社 CRO 内での使用に限られている 治験効率化の必要な部分は むしろ医療機関内における治験実施の部分の方が大きい 医療機関における治験 IT 化については 日本がイニシアチブをとれるように 日本の医療機関において 電子カルテの CDISC 標準仕様対応及び CDISC 標準仕様対応の治験情報システムを早急に開発 運用することが望まれる 今後 CDISC 標準仕様の策定
への利用がまだ主体であり 製薬会社 CRO 内での使用に限られている 治験効率化の必要な部分は むしろ医療機関内における治験実施の部分の方が大きい 医療機関における治験 IT 化については 日本がイニシアチブをとれるように 日本の医療機関において 電子カルテの CDISC 標準仕様対応及び CDISC 標準仕様対応の治験情報システムを早急に開発 運用することが望まれる 今後 CDISC 標準仕様の策定
PowerPoint プレゼンテーション
 別紙 日本形成外科学会疾患登録データベース入力マニュアル 施設実績集計システム 一般社団法人 National Clinical Database Ver..00 08. 目次 08 年次症例より 学会への施設実績報告の申請はオンライン申請に変更となりました 提出期間内であれば何度でも再提出が可能です その他の申請方法は日本形成外科学会事務局にお問合せください NCD 症例登録ポータル画面について各種機能について学会への提出方法について報告内容確認方法について学会への再提出方法について登録症例詳細データについてお問合せ
別紙 日本形成外科学会疾患登録データベース入力マニュアル 施設実績集計システム 一般社団法人 National Clinical Database Ver..00 08. 目次 08 年次症例より 学会への施設実績報告の申請はオンライン申請に変更となりました 提出期間内であれば何度でも再提出が可能です その他の申請方法は日本形成外科学会事務局にお問合せください NCD 症例登録ポータル画面について各種機能について学会への提出方法について報告内容確認方法について学会への再提出方法について登録症例詳細データについてお問合せ
スライド 1
 地域医療連携システムを活用した RSDV( 遠隔直接閲覧 ) 国立病院機構金沢医療センター山谷明正 1. 金沢医療センターの概要 当院の概要 独立行政法人国立病院機構金沢医療センター 病床数 :650 床診療科目数 :23 科医師数 :93 名病院機能地域医療支援病院 災害拠点病院 ( 地域 ) 小児救急医療拠点病院 がん診療連携拠点病院 ( 地域 ) エイズ治療拠点病院 DPC 対象病院 2004
地域医療連携システムを活用した RSDV( 遠隔直接閲覧 ) 国立病院機構金沢医療センター山谷明正 1. 金沢医療センターの概要 当院の概要 独立行政法人国立病院機構金沢医療センター 病床数 :650 床診療科目数 :23 科医師数 :93 名病院機能地域医療支援病院 災害拠点病院 ( 地域 ) 小児救急医療拠点病院 がん診療連携拠点病院 ( 地域 ) エイズ治療拠点病院 DPC 対象病院 2004
院内 SOP 等の入手 (web*/ メール / 郵送 ) 施設 SOP の入手 IC 施設テンプレート 契約書式の確認 IRB の SOP 入手 要件確認 費用算定基準の確認 ( 研究費 負担軽減費 保険外併用療養費等 ) 依頼手続きスケジュール確認 モニタリングの実施方法 場所等確認 院内 /I
 資料 7-4 当該施設が候補施設として浮上 ( マーケット 論文等々 ) 依頼者 施設 対応者 備考 事前情報収集とアポイント取得 事前アンケート調査 (FAX/e-mail) アンケートへの協力依頼 (TEL) アンケート / 機密保持同意書の可否回答 アンケート用紙 / 機密保持同意書 / プロトコール概要などの郵送 対象疾患患者数 組入れ可能例数 依頼者からのアンケート用紙に基づく調査の実施
資料 7-4 当該施設が候補施設として浮上 ( マーケット 論文等々 ) 依頼者 施設 対応者 備考 事前情報収集とアポイント取得 事前アンケート調査 (FAX/e-mail) アンケートへの協力依頼 (TEL) アンケート / 機密保持同意書の可否回答 アンケート用紙 / 機密保持同意書 / プロトコール概要などの郵送 対象疾患患者数 組入れ可能例数 依頼者からのアンケート用紙に基づく調査の実施
Microsoft PowerPoint - 【e-Rad設定】研究者用(H30年度)二次新システム未対応
 厚生労働科学研究費補助金の応募に係る 府省共通研究開発管理システム (e-rad) への 入力方法について < 注意事項 > e-radは平成 30 年 2 月 28 日 ( 水 ) から 新システムに移行しました ユーザビリティ改善の観点から 画面デザイン メニュー構成等が全面的に刷新されました 新システムのマニュアルは e-radポータルサイトに掲載しています 主な変更点についても記載しておりますので
厚生労働科学研究費補助金の応募に係る 府省共通研究開発管理システム (e-rad) への 入力方法について < 注意事項 > e-radは平成 30 年 2 月 28 日 ( 水 ) から 新システムに移行しました ユーザビリティ改善の観点から 画面デザイン メニュー構成等が全面的に刷新されました 新システムのマニュアルは e-radポータルサイトに掲載しています 主な変更点についても記載しておりますので
な技術がある この技術は 臨床研究 治験活性化 5 か年計画 2012 でも提案されており 当協会でも本技術を利用した治験関連書式の授受について 信頼性確保と効率化の両面で検討していく 3. 規制上 押印は必須ではなく 押印以外の方法で当該書類の信頼性を担保することにより 実質上は問題ないことを実施
 2012 年 5 月 22 日 各位殿 日本製薬工業協会医薬品評価委員会 臨床評価部会長中島唯善 電子化情報部会長庄本幸司 平素は臨床評価部会ならびに電子化情報部会の運営に関しご高配いただき誠にありがとうございます さて 平成 24 年 3 月 7 日に研究開発振興課長 審査管理課長の二課長通知により 新たな 治験の依頼等に係る統一書式 について ( 以下 統一書式通知 ) が発出され 治験依頼者と実施医療機関の協議により押印が省略できるとともに
2012 年 5 月 22 日 各位殿 日本製薬工業協会医薬品評価委員会 臨床評価部会長中島唯善 電子化情報部会長庄本幸司 平素は臨床評価部会ならびに電子化情報部会の運営に関しご高配いただき誠にありがとうございます さて 平成 24 年 3 月 7 日に研究開発振興課長 審査管理課長の二課長通知により 新たな 治験の依頼等に係る統一書式 について ( 以下 統一書式通知 ) が発出され 治験依頼者と実施医療機関の協議により押印が省略できるとともに
目次 1. はじめに 2. 実際の応募手続き 3. 応募手続き完了の確認 2
 革新的バイオ医薬品創出基盤技術開発事業 H27 年度公募に係る府省共通研究開発管理システム (e-rad) への入力方法について 1 目次 1. はじめに 2. 実際の応募手続き 3. 応募手続き完了の確認 2 1-a. はじめに 1 注意事項 1. 平成 27 年度の革新的バイオ医薬品創出基盤技術開発事業への応募は 必ず e-rad を利用して下さい 2. e-rad の使用に当たっては 研究機関および研究者の事前登録が必要です
革新的バイオ医薬品創出基盤技術開発事業 H27 年度公募に係る府省共通研究開発管理システム (e-rad) への入力方法について 1 目次 1. はじめに 2. 実際の応募手続き 3. 応募手続き完了の確認 2 1-a. はじめに 1 注意事項 1. 平成 27 年度の革新的バイオ医薬品創出基盤技術開発事業への応募は 必ず e-rad を利用して下さい 2. e-rad の使用に当たっては 研究機関および研究者の事前登録が必要です
NACCS をはじめてご利用される方 1. 仮アカウントの発行 NACCS をはじめてご利用される方 NACCS をはじめてご利用される場合または事業所追加の申込をされる場合は 仮アカウントの発行から新 規の利用申込を行います ご利用いただける手続きはログイン画面から始めます NACCS のご利用開
 . 仮アカウントの発行 NACCS をはじめてご利用される場合または事業所追加の申込をされる場合は 仮アカウントの発行から新 規の利用申込を行います ご利用いただける手続きはログイン画面から始めます NACCS のご利用開始までは 新規の利用申込の後 継続して システム設定の申込 を行う必要があります 継続の手続きについては 利用開始までのガイダンス (P9) をご参照ください ログイン画面 ログインのリンク
. 仮アカウントの発行 NACCS をはじめてご利用される場合または事業所追加の申込をされる場合は 仮アカウントの発行から新 規の利用申込を行います ご利用いただける手続きはログイン画面から始めます NACCS のご利用開始までは 新規の利用申込の後 継続して システム設定の申込 を行う必要があります 継続の手続きについては 利用開始までのガイダンス (P9) をご参照ください ログイン画面 ログインのリンク
Microsoft PowerPoint - PCG-AssessmentReportSummary (J) v2.0d3.pptx
 PCG Solutions / Viedoc 供給者アセスメント報告書のご紹介 2017 年 8 月アズビル株式会社 はじめに アズビルは ( スポンサからの委託に依らず ) 独自にPCG Solutions AB( 以下 PCG Solutions) に対してサプライヤアセスメントを実施しました このアセスメント結果をまとめた PCG Solutions / Viedoc 供給者アセスメント報告書
PCG Solutions / Viedoc 供給者アセスメント報告書のご紹介 2017 年 8 月アズビル株式会社 はじめに アズビルは ( スポンサからの委託に依らず ) 独自にPCG Solutions AB( 以下 PCG Solutions) に対してサプライヤアセスメントを実施しました このアセスメント結果をまとめた PCG Solutions / Viedoc 供給者アセスメント報告書
特定臨床研究に関する手順書
 学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
学校法人日本医科大学における特定臨床研究に関する手順書 ( 新規申請分 ) 1. 目的 本手順書は 学校法人日本医科大学における特定臨床研究に関する規程 ( 以下 規程 という ) を円滑に運用するために 本法人における手順を示すものである 2. 用語の定義 2.1 全般本手順書において使用する用語は 規程において使用する用語の例によるものとする 2.2 付属所属長規程第 5 条第 2 項により 理事長は実施医療機関の管理者の権限を次に定める付属所属長に委任しているため
医療機器開発マネジメントにおけるチェック項目
 2018 年 11 月作成 医療機器開発マネジメントにおけるチェック項目 1. 各ステージゲートにおけるチェック項目 (1) チェック項目作成の目的従来個々の事業において実施されていた 事前 中間 事後の各ゲートにおける評価項目 Go/no-go の判断を 医療機器開発全期間を通して整理し 共通認識化する 技術的観点及び事業化の観点の双方を意識し 医療機器開発の特性を考慮したチェック項目を設定する
2018 年 11 月作成 医療機器開発マネジメントにおけるチェック項目 1. 各ステージゲートにおけるチェック項目 (1) チェック項目作成の目的従来個々の事業において実施されていた 事前 中間 事後の各ゲートにおける評価項目 Go/no-go の判断を 医療機器開発全期間を通して整理し 共通認識化する 技術的観点及び事業化の観点の双方を意識し 医療機器開発の特性を考慮したチェック項目を設定する
<4D F736F F D2090BB91A294CC94848CE392B28DB8905C90BF8E9E92F18F6F8F9197DE82A882E682D1928D88D38E968D E48DEC90AC816A
 申請時提出書類 ( 新規 ) 医薬品等の製造販売後調査実施依頼申請書 様式第 1 ( 以下 依頼書 ) 医薬品等の製造販売後調査実施申請書 様式第 2 ( 以下 申請書 ) 医薬品等の製造販売後調査実施に関する通知書 ( 病院用 依頼者用 ) 様式第 3 様式第 4 ( 以下 通知書 ) 医薬品等の製造販売後調査実施契約書 ( 病院用 依頼者用 ) 様式第 5 様式第 5の2 ( 以下 契約書 )
申請時提出書類 ( 新規 ) 医薬品等の製造販売後調査実施依頼申請書 様式第 1 ( 以下 依頼書 ) 医薬品等の製造販売後調査実施申請書 様式第 2 ( 以下 申請書 ) 医薬品等の製造販売後調査実施に関する通知書 ( 病院用 依頼者用 ) 様式第 3 様式第 4 ( 以下 通知書 ) 医薬品等の製造販売後調査実施契約書 ( 病院用 依頼者用 ) 様式第 5 様式第 5の2 ( 以下 契約書 )
医師主導治験実施医療機関を対象とした調査協力のお願い Ver 医師主導治験における治験調整事務局業務の標準化 効率化に関する研究 班へのご協力をいただき ありがとうございます 本研究班では 医師主導治験を実施する医療機関において 準備や実施に役立つ教育コンテンツやモデル標準業務手順
 医師主導治験実施医療機関を対象とした調査協力のお願い 医師主導治験における治験調整事務局業務の標準化 効率化に関する研究 班へのご協力をいただき ありがとうございます 本研究班では 医師主導治験を実施する医療機関において 準備や実施に役立つ教育コンテンツやモデル標準業務手順書 ロードマップなどを作成し 公開することを目指しています 本調査では 医師主導治験の現状やニーズに沿った成果物を提供するため
医師主導治験実施医療機関を対象とした調査協力のお願い 医師主導治験における治験調整事務局業務の標準化 効率化に関する研究 班へのご協力をいただき ありがとうございます 本研究班では 医師主導治験を実施する医療機関において 準備や実施に役立つ教育コンテンツやモデル標準業務手順書 ロードマップなどを作成し 公開することを目指しています 本調査では 医師主導治験の現状やニーズに沿った成果物を提供するため
独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版
 独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版 第 1 章総則 1. 目的と適用範囲この標準業務手順書は 独立行政法人国立病院機構仙台医療センターにおける医薬品の再審査申請 再評価申請の際に提出すべき資料の収集のための 使用成績調査 及び 特定使用成績調査
独立行政法人国立病院機構仙台医療センターにおける医薬 品等の使用成績調査 特定使用成績調査及び副作用 感染 症報告 その他の受託研究の実施に関する標準業務手順書 2018 年 7 月 26 日第 9 版 第 1 章総則 1. 目的と適用範囲この標準業務手順書は 独立行政法人国立病院機構仙台医療センターにおける医薬品の再審査申請 再評価申請の際に提出すべき資料の収集のための 使用成績調査 及び 特定使用成績調査
記 1. 適用対象本通知は 製造販売業者等が GPSP 省令第 2 条第 3 項に規定する DB 事業者が提供する同条第 2 項に規定する医療情報データベースを用いて同条第 1 項第 2 号に規定する製造販売後データベース調査を実施し 医薬品の再審査等の申請資料を作成する場合に適用する GPSP 省
 記 1. 適用対象本通知は 製造販売業者等が GPSP 省令第 2 条第 3 項に規定する DB 事業者が提供する同条第 2 項に規定する医療情報データベースを用いて同条第 1 項第 2 号に規定する製造販売後データベース調査を実施し 医薬品の再審査等の申請資料を作成する場合に適用する GPSP 省令第 2 条第 2 項において 医療情報データベース とは 一定の期間において収集される診療録その他の診療に関する記録
記 1. 適用対象本通知は 製造販売業者等が GPSP 省令第 2 条第 3 項に規定する DB 事業者が提供する同条第 2 項に規定する医療情報データベースを用いて同条第 1 項第 2 号に規定する製造販売後データベース調査を実施し 医薬品の再審査等の申請資料を作成する場合に適用する GPSP 省令第 2 条第 2 項において 医療情報データベース とは 一定の期間において収集される診療録その他の診療に関する記録
< F2D8E9197BF A836F815B2E6A7464>
 ( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
( 第 1 回検討会の資料 3 の P.16) 治験薬 GMP の概要 治験薬の品質を保証することで 不良な治験薬から被験者を保護する 均一な品質の治験薬を用いることで 治験の信頼性を確保する 治験薬と市販後製品とで同一の品質を保証することで 市販後製品の有効性と安全性を確保する 根拠 医薬品の臨床試験の実施の基準に関する省令(GCP 省令 ) に基づく通知 治験薬の製造管理及び品質管理基準及び治験薬の製造施設の構造設備基準
3 治験実施計画書目的 当該治験について 治験実施計画書が手順書に従い適切に作成及び改訂されていることを確認する 次の事項を調べる (1) 治験実施計画書の記載項目 ( 再生医療等製品 GCP 省令第 7 条第 1 項に規定する項目 ) (2) 治験実施計画書の作成 改訂の手順と日付 (3) 治験計
 別添 10 再生医療等製品 GCP 省令チェックリスト Ⅰ 治験依頼者 ( 受託機関を含む ) 用 1 組織及び体制目的 治験の依頼及び管理に当たって 再生医療等製品 GCP 省令に沿った業務を行うために適切にして十分な人材を有し かつ 組織及び体制が確立していることを確認する 1 治験依頼者の組織 ( 当該被験機器の開発組織を含む ) と再生医療等製品 G CP 省令に係わる組織との関係 2 治験の依頼及び管理の業務に従事する者の氏名
別添 10 再生医療等製品 GCP 省令チェックリスト Ⅰ 治験依頼者 ( 受託機関を含む ) 用 1 組織及び体制目的 治験の依頼及び管理に当たって 再生医療等製品 GCP 省令に沿った業務を行うために適切にして十分な人材を有し かつ 組織及び体制が確立していることを確認する 1 治験依頼者の組織 ( 当該被験機器の開発組織を含む ) と再生医療等製品 G CP 省令に係わる組織との関係 2 治験の依頼及び管理の業務に従事する者の氏名
目次 1. よくあるご質問一覧 回答一覧 改訂履歴 Page- 2
 第 3 版 2018 年 11 月 目次 1. よくあるご質問一覧... 3 2. 回答一覧... 4 3. 改訂履歴... 16 Page- 2 1. よくあるご質問一覧 以下の質問をクリックすると 回答ページへリンクします Q.1 メールアドレス変更 ユーザー登録情報 パスワード変更 メニューを押しても画面が変わらない Q.2 ログインしようとすると 901 エラー と表示されてログインできない
第 3 版 2018 年 11 月 目次 1. よくあるご質問一覧... 3 2. 回答一覧... 4 3. 改訂履歴... 16 Page- 2 1. よくあるご質問一覧 以下の質問をクリックすると 回答ページへリンクします Q.1 メールアドレス変更 ユーザー登録情報 パスワード変更 メニューを押しても画面が変わらない Q.2 ログインしようとすると 901 エラー と表示されてログインできない
PowerPoint プレゼンテーション
 UHCT ACReSS V01L50 第 1 章概要 目 次 1.UHCT ACReSS とは? 2. 対象となる試験は? 3. システムを利用するための条件は? 4. システム利用開始までの手順は? 5. システム利用権限 ( 資格 ) 6. 機能一覧と利用権限マップ 7. データ管理について 8.ICH-GCP 対応 9.CSV(Computerized System Validation) 10.
UHCT ACReSS V01L50 第 1 章概要 目 次 1.UHCT ACReSS とは? 2. 対象となる試験は? 3. システムを利用するための条件は? 4. システム利用開始までの手順は? 5. システム利用権限 ( 資格 ) 6. 機能一覧と利用権限マップ 7. データ管理について 8.ICH-GCP 対応 9.CSV(Computerized System Validation) 10.
V-CUBE ミーティング
 V-CUBE ミーティング Presence Appli ご利用マニュアル ブイキューブ 2012/11/30 この文書は Web 会議システム V-CUBE ミーティング ( 以下 ミーティング ) の機能 Presence Appli のマニュアルです 更新履歴 更新日 内容 2012/11/30 画像修正 文言修正 2012/05/16 画像修正 2011/09/15 画像修正 2011/08/01
V-CUBE ミーティング Presence Appli ご利用マニュアル ブイキューブ 2012/11/30 この文書は Web 会議システム V-CUBE ミーティング ( 以下 ミーティング ) の機能 Presence Appli のマニュアルです 更新履歴 更新日 内容 2012/11/30 画像修正 文言修正 2012/05/16 画像修正 2011/09/15 画像修正 2011/08/01
目次 1. 教育ネットひむかファイル転送サービスについて ファイル転送サービスの利用方法 ファイル転送サービスを利用する ( ひむか内 ) ファイル転送サービスへのログイン ひむか内 PCでファイルを送受信する
 教育ネットひむか ファイル転送サービス ユーザーマニュアル 目次 1. 教育ネットひむかファイル転送サービスについて... 2 1.1 ファイル転送サービスの利用方法... 2 2. ファイル転送サービスを利用する ( ひむか内 )... 3 2.1 ファイル転送サービスへのログイン... 3 2.2 ひむか内 PCでファイルを送受信する... 4 2.3 ひむか内 PCで外部 PCから送信されたファイルを受信する...
教育ネットひむか ファイル転送サービス ユーザーマニュアル 目次 1. 教育ネットひむかファイル転送サービスについて... 2 1.1 ファイル転送サービスの利用方法... 2 2. ファイル転送サービスを利用する ( ひむか内 )... 3 2.1 ファイル転送サービスへのログイン... 3 2.2 ひむか内 PCでファイルを送受信する... 4 2.3 ひむか内 PCで外部 PCから送信されたファイルを受信する...
Ⅱ. 国立がんセンター研究センター用申請書の作成について Ⅱ-1. カット ドゥ スクエアにおける中央病院と東病院の表示区分 がん研究センターにおいては 中央病院と東病院が独立して治験を実施する一方 実施医療機関としては 独立行政法人がん研究センター となることから カット ドゥ スクエアにおいて
 新統一書式入力支援システム カット ドゥ スクエア の利用方法について Ⅰ. 統一書式入力支援システムの種類 1. 治験促進センターが公開している統一書式に基づく文書作成を支援するシステムは以下の二 つがあります 1 統一書式入力支援システム ( 以下 旧システム という ) 2008 年 3 月 31 日に公開したシステムで各端末 (PC) に必要なソフトウェアをインストールすることでインターネットに接続することなく使用することができます
新統一書式入力支援システム カット ドゥ スクエア の利用方法について Ⅰ. 統一書式入力支援システムの種類 1. 治験促進センターが公開している統一書式に基づく文書作成を支援するシステムは以下の二 つがあります 1 統一書式入力支援システム ( 以下 旧システム という ) 2008 年 3 月 31 日に公開したシステムで各端末 (PC) に必要なソフトウェアをインストールすることでインターネットに接続することなく使用することができます
弊社の紹介 創業 :2002 年 社員数 :110 名 (2014 年 10 月現在 ) 業務内容 : CRC 業務 ( 治験 臨床研究 医師主導治験 その他調査 ) 治験事務局 IRB 事務局運営支援業務 医師主導治験調整事務局支援業務 医療機関体制整備支援業務 GCP 教育 CRC 教育 CRA
 カット ドゥ スクエア (CtDoS2) の 事例紹介 ~ 治験依頼者 - 実施医療機関 -IRB の三者間で CtDoS2 を活用してみて ~ 株式会社新日本科学臨床薬理研究所九州エリア支援部鹿児島支援室サイトマネジメントチーム黒木沙織 1 弊社の紹介 創業 :2002 年 社員数 :110 名 (2014 年 10 月現在 ) 業務内容 : CRC 業務 ( 治験 臨床研究 医師主導治験 その他調査
カット ドゥ スクエア (CtDoS2) の 事例紹介 ~ 治験依頼者 - 実施医療機関 -IRB の三者間で CtDoS2 を活用してみて ~ 株式会社新日本科学臨床薬理研究所九州エリア支援部鹿児島支援室サイトマネジメントチーム黒木沙織 1 弊社の紹介 創業 :2002 年 社員数 :110 名 (2014 年 10 月現在 ) 業務内容 : CRC 業務 ( 治験 臨床研究 医師主導治験 その他調査
管理者マニュアル
 管理者マニュアル 目次 1. KING OF TIME セキュアログインについて... 1 1.1. 本システムの主な機能... 1 1.2. 動作環境... 1 1.3. 使用できる認証方法... 2 2. はじめに... 3 2.1. ログイン... 3 2.2. 管理画面の構成... 4 3. KING OF TIME( 勤怠管理 ) との従業員連携について... 5 4. ユーザー設定について...
管理者マニュアル 目次 1. KING OF TIME セキュアログインについて... 1 1.1. 本システムの主な機能... 1 1.2. 動作環境... 1 1.3. 使用できる認証方法... 2 2. はじめに... 3 2.1. ログイン... 3 2.2. 管理画面の構成... 4 3. KING OF TIME( 勤怠管理 ) との従業員連携について... 5 4. ユーザー設定について...
製造販売後調査事務手続き等 について
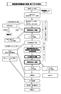 製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
製造販売後調査の実施 終了までの流れ 調査申し込み希望 調査面談シートをご提出下さい 事前予約後臨床研究センターへの訪問 不 研究的要素を含む場合 倫理委員会 実施不可 不 : 実施不可 1 年毎に実施状況報告書提出 場合によっては途中精算可能 契約期間が 1 年以上の場 臨床研究センター訪問ヒアリング資料の提出 手続きの説明 薬事委員会にて審議 契約書締結後 実施 実施要綱等変更の発生登録期間 契約期間延長希望症例追加希望
Microsoft PowerPoint - 【配布・WEB公開用】ACRONET_Kitahara.ppt [互換モード]
![Microsoft PowerPoint - 【配布・WEB公開用】ACRONET_Kitahara.ppt [互換モード] Microsoft PowerPoint - 【配布・WEB公開用】ACRONET_Kitahara.ppt [互換モード]](/thumbs/101/148661957.jpg) 解析業務プロセスにおいて効率的な仕様書作成と Define.xml への変換北原孝志, 東島正堅 株式会社 ACRONET 生物統計部北西由武, 吉田祐樹塩野義製薬株式会社解析センター The efficient preparation of Specification and its conversion into Define.xml on the process of statistical
解析業務プロセスにおいて効率的な仕様書作成と Define.xml への変換北原孝志, 東島正堅 株式会社 ACRONET 生物統計部北西由武, 吉田祐樹塩野義製薬株式会社解析センター The efficient preparation of Specification and its conversion into Define.xml on the process of statistical
Ver 年 10 月 15 日 改訂履歴 版数 改訂 年月日 改訂 頁 改訂内容 年 3 月 19 日 - 初版作成 年 6 月 12 日 4~ 手順の細分化 年 8 月 21 日 9, 13 複数研究対応に関する内容の追加 1
 臨床研究実施計画 研究概要公開システム 操作マニュアル 登録者編 Ver.1.3 2018 年 10 月 15 日 改訂履歴 版数 改訂 年月日 改訂 頁 改訂内容 1.0 2018 年 3 月 19 日 - 初版作成 1.1 2018 年 6 月 12 日 4~ 手順の細分化 1.2 2018 年 8 月 21 日 9, 13 複数研究対応に関する内容の追加 1.3 2018 年 10 月 15
臨床研究実施計画 研究概要公開システム 操作マニュアル 登録者編 Ver.1.3 2018 年 10 月 15 日 改訂履歴 版数 改訂 年月日 改訂 頁 改訂内容 1.0 2018 年 3 月 19 日 - 初版作成 1.1 2018 年 6 月 12 日 4~ 手順の細分化 1.2 2018 年 8 月 21 日 9, 13 複数研究対応に関する内容の追加 1.3 2018 年 10 月 15
臨床研究に関する標準業務手順書
 臨床研究に関する標準業務手順書 2018/04/01 第 15 版 改定履歴 日付 版 改定理由 改定箇所 内容 2010/02/06 1 新規制定 2010/04/14 2 COI 関連手順の明確化 フローチャートに COI に関する手順の追記 2010/08/19 3 様式 必要書類の追加 COI 関連様式の追記 安全性に関する報告の手順および様式 ( 様式 11) の追加 委託研究に関する手順
臨床研究に関する標準業務手順書 2018/04/01 第 15 版 改定履歴 日付 版 改定理由 改定箇所 内容 2010/02/06 1 新規制定 2010/04/14 2 COI 関連手順の明確化 フローチャートに COI に関する手順の追記 2010/08/19 3 様式 必要書類の追加 COI 関連様式の追記 安全性に関する報告の手順および様式 ( 様式 11) の追加 委託研究に関する手順
IAF ID 2:2011 Issue 1 International Accreditation Forum Inc. 国際認定機関フォーラム (IAF) IAF Informative Document ISO/IEC 17021:2006 から ISO/IEC 17021:2011 への マネ
 IAF ID 2:2011 International Accreditation Forum Inc. 国際認定機関フォーラム (IAF) IAF Informative Document ISO/IEC 17021:2006 から ISO/IEC 17021:2011 への マネジメントシステム認定移行のための IAF 参考文書 (IAF ID 2 : 2011) 注 : この文書は Informative
IAF ID 2:2011 International Accreditation Forum Inc. 国際認定機関フォーラム (IAF) IAF Informative Document ISO/IEC 17021:2006 から ISO/IEC 17021:2011 への マネジメントシステム認定移行のための IAF 参考文書 (IAF ID 2 : 2011) 注 : この文書は Informative
「 タイトル 」実施要領(案)
 テレカンファランスシステムを用いた症例コンサルテーション 実施手順書 1. 本コンサルテーションの概要 (1) 機器の基本構成 1) 卓上型テレカンファランス端末を電子カルテ等の診療用 PC のモニタとして利用します 2) 診療用 PC のモニタに出力される映像は テレカンファランスシステムで共有が可能です (2) 機器の設置 1) テレカンファランスシステムに係る通信機器は 岩手医大が協力医療機関へ貸与します
テレカンファランスシステムを用いた症例コンサルテーション 実施手順書 1. 本コンサルテーションの概要 (1) 機器の基本構成 1) 卓上型テレカンファランス端末を電子カルテ等の診療用 PC のモニタとして利用します 2) 診療用 PC のモニタに出力される映像は テレカンファランスシステムで共有が可能です (2) 機器の設置 1) テレカンファランスシステムに係る通信機器は 岩手医大が協力医療機関へ貸与します
<4D F736F F F696E74202D2090BB91A294CC94848CE392B28DB CC905C90BF82C982C282A282C45F F566F6C2E33>
 この冊 における製造販売後調査等とは 使 成績調査 特定使 成績調査 副作 感染症報告 です 1/Mar/2016 Vol.3 1 ホームページのご案内 1 当院ホームページに手続き内容や 必要書類等を UP しています 2 依頼者のページ 3 製造販売後調査について 1 治験のお知らせ 2 ホームページのご案内 2 当院ホームページに手続き内容や 必要書類等を UP しています 申請の内容に応じて
この冊 における製造販売後調査等とは 使 成績調査 特定使 成績調査 副作 感染症報告 です 1/Mar/2016 Vol.3 1 ホームページのご案内 1 当院ホームページに手続き内容や 必要書類等を UP しています 2 依頼者のページ 3 製造販売後調査について 1 治験のお知らせ 2 ホームページのご案内 2 当院ホームページに手続き内容や 必要書類等を UP しています 申請の内容に応じて
ライフサイクル管理 Systemwalker Centric Manager カタログ
 for Oracle Oracle Live Help ICTシステム管理 安定稼働 わかりやすい監視と復旧支援 監視コンソールを統合化 わかりやすい監視画面 リモート操作による対処復旧 Windowsや各種Unix Linux メインフレーム 遠隔地のサーバやクライアントの画面を 管理者 など マルチプラットフォーム環境の統合運用管理 の手元の画面から直接操作できます 複数のパソ が可能です
for Oracle Oracle Live Help ICTシステム管理 安定稼働 わかりやすい監視と復旧支援 監視コンソールを統合化 わかりやすい監視画面 リモート操作による対処復旧 Windowsや各種Unix Linux メインフレーム 遠隔地のサーバやクライアントの画面を 管理者 など マルチプラットフォーム環境の統合運用管理 の手元の画面から直接操作できます 複数のパソ が可能です
目次 1 章はじめに 本書の利用について Web ブラウザーについて 章 kintone でタイムスタンプに対応したアプリを作成する kintone にログインする kintone でアプリを作成する
 for kintone 操作マニュアル Ver.1.6.1 目次 1 章はじめに... 1 1.1 本書の利用について... 1 1.2 Web ブラウザーについて... 1 2 章 kintone でタイムスタンプに対応したアプリを作成する... 2 2.1 kintone にログインする... 2 2.2 kintone でアプリを作成する... 2 2.2.1 作成するアプリに最低限必要なフィールド...
for kintone 操作マニュアル Ver.1.6.1 目次 1 章はじめに... 1 1.1 本書の利用について... 1 1.2 Web ブラウザーについて... 1 2 章 kintone でタイムスタンプに対応したアプリを作成する... 2 2.1 kintone にログインする... 2 2.2 kintone でアプリを作成する... 2 2.2.1 作成するアプリに最低限必要なフィールド...
PowerPoint プレゼンテーション
 JAMOTE 認証サービス サービスガイドライン適合事業所認定 Web 申請サイト操作手引き 2018 年 10 月 15 日第 4 版 JAMOTE 認証サービス株式会社 1.Web 申請サイトで行えること 申請書類の提出 : 本サイトにPDF 文書などをアップロードして頂きます 現地審査の日程調整 : 担当審査員との間で 現地審査の日程調整をして頂きます 2. 申請事業所の登録 登録 をクリックします
JAMOTE 認証サービス サービスガイドライン適合事業所認定 Web 申請サイト操作手引き 2018 年 10 月 15 日第 4 版 JAMOTE 認証サービス株式会社 1.Web 申請サイトで行えること 申請書類の提出 : 本サイトにPDF 文書などをアップロードして頂きます 現地審査の日程調整 : 担当審査員との間で 現地審査の日程調整をして頂きます 2. 申請事業所の登録 登録 をクリックします
目次 1. はじめに... 3 本システムご利用の前提について... 3 アカウント申請について... 3 本システムの機能について 基本の操作方法... 4 本システムにログイン / ログアウトする... 4 ファイルをダウンロードする 機能ごとの操作方法... 6
 操作マニュアル 目次 1. はじめに... 3 本システムご利用の前提について... 3 アカウント申請について... 3 本システムの機能について... 3 2. 基本の操作方法... 4 本システムにログイン / ログアウトする... 4 ファイルをダウンロードする... 5 3. 機能ごとの操作方法... 6 EDI 伝送状況を参照する... 6 企業 メールボックス情報を参照する... 6
操作マニュアル 目次 1. はじめに... 3 本システムご利用の前提について... 3 アカウント申請について... 3 本システムの機能について... 3 2. 基本の操作方法... 4 本システムにログイン / ログアウトする... 4 ファイルをダウンロードする... 5 3. 機能ごとの操作方法... 6 EDI 伝送状況を参照する... 6 企業 メールボックス情報を参照する... 6
PowerPoint プレゼンテーション
 第 Ⅳ 章 2 応用操作 ( グリーンファイル編 ) 1)TOP メニューからの登録作業員の登録 登録作業員を Top メニューからも登録することができます 現場が決まっていない場合の 事前登録でご活用ください (1) メニュー内の 協力会社作業員 DB 登録 をクリックする (2) 協力会社作業員 DB 登録 画面が表示されるので 登録作業員の登録 より作業員を登録する 以降 登録作業員の登録方法は
第 Ⅳ 章 2 応用操作 ( グリーンファイル編 ) 1)TOP メニューからの登録作業員の登録 登録作業員を Top メニューからも登録することができます 現場が決まっていない場合の 事前登録でご活用ください (1) メニュー内の 協力会社作業員 DB 登録 をクリックする (2) 協力会社作業員 DB 登録 画面が表示されるので 登録作業員の登録 より作業員を登録する 以降 登録作業員の登録方法は
CROCO について
 CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
CROCO について CROCO とは コース 正式名称 Clinical Research Online Professional Certification Program at Osaka University といい 大阪大学医学部附属病院が提供する 臨床研究に関する教育の e-learning サイトです 臨床研究を実施する研究者 専門職の方 倫理審査委員会の委員 事務局の方を対象に 臨床研究に必要な情報
カット ドゥ スクエアが出力する CSV ファイルついて カット ドゥ スクエアが出力する CSV ファイルについて説明いたします IRB の担当者が作成することができます IRB 議事概要に必要な項目を入力後 [CSV 出力 ] ボタンをクリックするとファイルが表示されます CSV ファイルの 1
![カット ドゥ スクエアが出力する CSV ファイルついて カット ドゥ スクエアが出力する CSV ファイルについて説明いたします IRB の担当者が作成することができます IRB 議事概要に必要な項目を入力後 [CSV 出力 ] ボタンをクリックするとファイルが表示されます CSV ファイルの 1 カット ドゥ スクエアが出力する CSV ファイルついて カット ドゥ スクエアが出力する CSV ファイルについて説明いたします IRB の担当者が作成することができます IRB 議事概要に必要な項目を入力後 [CSV 出力 ] ボタンをクリックするとファイルが表示されます CSV ファイルの 1](/thumbs/91/105199040.jpg) 2018 年 5 月 16 日 Ver.1.1 議事概要生成ツールの使い方カット ドゥ スクエア操作マニュアル番外編 カット ドゥ スクエアで出力される CSV ファイルを利用し 公開用の 治験審査委員会 (IRB) の会議の記録の概要 を効率よく生成することができます IRB の会議の記録の概要 を生成するためには Excel の準備とマクロ機能を有効にすることと 議事概要生成ツール のダウンロードが必要になり
2018 年 5 月 16 日 Ver.1.1 議事概要生成ツールの使い方カット ドゥ スクエア操作マニュアル番外編 カット ドゥ スクエアで出力される CSV ファイルを利用し 公開用の 治験審査委員会 (IRB) の会議の記録の概要 を効率よく生成することができます IRB の会議の記録の概要 を生成するためには Excel の準備とマクロ機能を有効にすることと 議事概要生成ツール のダウンロードが必要になり
<4D F736F F F696E74202D E48FE A92C789C192CA926D82C982C282A282C45F696E6F75652E >
 E2B(R3) 追加通知について 日本製薬団体連合会 E2B(R3) 実装プロジェクト井上学 1 本日のお話 追加通知の概要 これから検討すべきこと 2 追加通知 ( 公開 ) 予定の概要 2013 年 9 月 17 日の通知で 追って通知 とされた部分 ICH E2Bでの検討結果に伴う変更 技術的な部分の補足 Q&A 3 R2 と R3 の比較 R2 R3 報告様式 SGML XML(HL7 形式
E2B(R3) 追加通知について 日本製薬団体連合会 E2B(R3) 実装プロジェクト井上学 1 本日のお話 追加通知の概要 これから検討すべきこと 2 追加通知 ( 公開 ) 予定の概要 2013 年 9 月 17 日の通知で 追って通知 とされた部分 ICH E2Bでの検討結果に伴う変更 技術的な部分の補足 Q&A 3 R2 と R3 の比較 R2 R3 報告様式 SGML XML(HL7 形式
03
 電子文書取扱細則案 (03.3.19) 第 1 条定義 電子文書とは 文書取扱規程第 3 条に示されている文書のうち紙文書を除く電磁的 記録をいう ( プログラム及びデータの扱いは別紙 1 参照 ) 第 2 条電子文書取扱細則の位置付け本細則は 文書取扱規程第 2 条及び第 1 条に基づいてそれとの整合性を保ち 電子文書についてその取扱い及び管理に関する事項を定め 電子文書の (1) 原本性 (2)
電子文書取扱細則案 (03.3.19) 第 1 条定義 電子文書とは 文書取扱規程第 3 条に示されている文書のうち紙文書を除く電磁的 記録をいう ( プログラム及びデータの扱いは別紙 1 参照 ) 第 2 条電子文書取扱細則の位置付け本細則は 文書取扱規程第 2 条及び第 1 条に基づいてそれとの整合性を保ち 電子文書についてその取扱い及び管理に関する事項を定め 電子文書の (1) 原本性 (2)
でんき工事コーナー(高圧)基本操作説明
 でんき工事コーナー ( 高圧 ) 基本操作説明 ご説明フロー 1 でんき工事コーナー ( 高圧 ) へのアクセス方法 2 でんき工事コーナー ( 高圧 ) 紹介 3 お申込み操作方法のご説明 1 でんき工事コーナー ( 高圧 ) へのアクセス方法 2 でんき工事コーナー ( 高圧 ) へのアクセス方法 インターネットにて でんき工事コーナー高圧 と入力し検索ボタンをクリックします でんき工事コーナー高圧
でんき工事コーナー ( 高圧 ) 基本操作説明 ご説明フロー 1 でんき工事コーナー ( 高圧 ) へのアクセス方法 2 でんき工事コーナー ( 高圧 ) 紹介 3 お申込み操作方法のご説明 1 でんき工事コーナー ( 高圧 ) へのアクセス方法 2 でんき工事コーナー ( 高圧 ) へのアクセス方法 インターネットにて でんき工事コーナー高圧 と入力し検索ボタンをクリックします でんき工事コーナー高圧
<4D F736F F F696E74202D20362E208EA18CB182F08EC08E7B82B782E988E397C38B408AD682C982A882AF82E997AF88D3935F2E B8CDD8AB B83685D>
 治験を実施する医療機関における留意点 1 本日の内容 1. 企業主導治験での事例と留意事項治験実施体制に関する事例と留意事項個別症例に関する事例と留意事項 2. 医師主導治験での事例と留意事項 2 本日の内容 1. 企業主導治験での事例と留意事項治験実施体制に関する事例と留意事項個別症例に関する事例と留意事項 3 GCP 実地調査では 治験に関する記録から 治験が 被験者の人権 安全 福祉の向上を図り
治験を実施する医療機関における留意点 1 本日の内容 1. 企業主導治験での事例と留意事項治験実施体制に関する事例と留意事項個別症例に関する事例と留意事項 2. 医師主導治験での事例と留意事項 2 本日の内容 1. 企業主導治験での事例と留意事項治験実施体制に関する事例と留意事項個別症例に関する事例と留意事項 3 GCP 実地調査では 治験に関する記録から 治験が 被験者の人権 安全 福祉の向上を図り
<4D F736F F D208EA18CB182C98AD682B782E995578F808BC696B18EE88F878F E7B8D732E646F6378>
 治験に関する標準業務手順書 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医薬品及び医療機器の臨床試験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和
治験に関する標準業務手順書 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 趣旨 ) 第 1 条本手順書は 公益財団法人大原記念倉敷中央医療機構倉敷中央病院 ( 以下 本院 という ) において医薬品及び医療機器の臨床試験 ( 以下 治験 という ) を行う場合の取扱について必要な事項を定めるものである 2 本手順書は 医薬品 医療機器等の品質 有効性及び安全性の確保等に関する法律 ( 昭和
研究報告書レイアウト例(当該年度が最終年度ではない研究班の場合)
 長寿医療研究開発費平成 29 年度総括研究報告 治験関連情報の一元管理を可能とする治験管理システムの開発 (29-44) 主任研究者平島学国立長寿医療研究センター 治験 臨床研究推進センター ( 治験 臨床研究主任薬剤師 ) 研究要旨治験には 症例実施時に発生する費用があり 治験薬の投与期間や治験の進捗状況に応じて依頼者毎で請求時期が異なっている 現状では 契約 進捗 請求の情報が 別々の情報として管理されているため
長寿医療研究開発費平成 29 年度総括研究報告 治験関連情報の一元管理を可能とする治験管理システムの開発 (29-44) 主任研究者平島学国立長寿医療研究センター 治験 臨床研究推進センター ( 治験 臨床研究主任薬剤師 ) 研究要旨治験には 症例実施時に発生する費用があり 治験薬の投与期間や治験の進捗状況に応じて依頼者毎で請求時期が異なっている 現状では 契約 進捗 請求の情報が 別々の情報として管理されているため
ここを押さえておけば大丈夫 ‐ FDA・EMA GCP 査察のポイント‐
 ここを押さえておけば大丈夫 FDA EMA GCP 査察のポイント 日本ベーリンガーインゲルハイム株式会社 医薬開発本部クオリティマネジメント部中川孝 ノバルティスファーマ株式会社 薬事 信頼性保証本部宇佐美昌代 本演題発表に関連して 開示すべき COI 関係にある企業等はありません < はじめに > FDA/EMA 査察には ある程度決められた手順や水準等はありますが 公表された情報によると査察官
ここを押さえておけば大丈夫 FDA EMA GCP 査察のポイント 日本ベーリンガーインゲルハイム株式会社 医薬開発本部クオリティマネジメント部中川孝 ノバルティスファーマ株式会社 薬事 信頼性保証本部宇佐美昌代 本演題発表に関連して 開示すべき COI 関係にある企業等はありません < はじめに > FDA/EMA 査察には ある程度決められた手順や水準等はありますが 公表された情報によると査察官
パソコンバンクWeb21 操作マニュアル[導入・事前設定編]
![パソコンバンクWeb21 操作マニュアル[導入・事前設定編] パソコンバンクWeb21 操作マニュアル[導入・事前設定編]](/thumbs/91/105206260.jpg) 4 章利用者権限/メール配信を設定する4 章 利用者権限 / メール配信を設定する この章では Web21 の利用者権限の設定と 各種メール配信の設定方法について説明します この操作は管理専用 ID / 管理専用 ID( 副 ) の保有者のみが行えます 1. 利用者権限について 36 2. 利用者権限を設定する 37 3. メール配信について 41 4. メールアドレスを登録する 42 35 4 章利用者権限/メール配信を設定する4
4 章利用者権限/メール配信を設定する4 章 利用者権限 / メール配信を設定する この章では Web21 の利用者権限の設定と 各種メール配信の設定方法について説明します この操作は管理専用 ID / 管理専用 ID( 副 ) の保有者のみが行えます 1. 利用者権限について 36 2. 利用者権限を設定する 37 3. メール配信について 41 4. メールアドレスを登録する 42 35 4 章利用者権限/メール配信を設定する4
<ヒアリング内容 > 1 依頼者からの説明 ( 概要書 プロトコールの要点 をそれぞれ10 分程度で ) ハンドアウト等の資料を準備すること 2 質疑 応答 ( 手順の確認を中心に ) 3 提出資料の確認 検討 修正指示 4その他 当該治験で検討を要する事項についての協議 保険外併用療養費の支給対象
 Ⅰ) 新規治験の申請 藤田医科大学病院治験申請等に関する手順書 1. 実施体制 治験事務局 SMO 費用は院内費用とは別に算定するため 別途相談とする 臨床研究コーディネーター (CRC) CRC は 院内または SMO のどちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され ( 治験届提出後 14 日 ( 初回届けの場合は 30 日 ) 経過したか否かは問わない
Ⅰ) 新規治験の申請 藤田医科大学病院治験申請等に関する手順書 1. 実施体制 治験事務局 SMO 費用は院内費用とは別に算定するため 別途相談とする 臨床研究コーディネーター (CRC) CRC は 院内または SMO のどちらの選択も可能とする 2. ヒアリング (a) 予約に際しての条件 プロトコールが固定され ( 治験届提出後 14 日 ( 初回届けの場合は 30 日 ) 経過したか否かは問わない
目次 1 Agatha 管理者向けマニュアルの概要 Agatha 利用前のご確認 管理者ページ 管理者ページでできること 管理者ページへのアクセス Agatha 管理者ページ画面 ユーザー登録の流れ...
 Agatha 管理者向け操作ガイド 基本編 R2.4:2017 年 7 月 13 日 アガサ株式会社 1 目次 1 Agatha 管理者向けマニュアルの概要... 3 2 Agatha 利用前のご確認... 3 3 管理者ページ... 4 3.1 管理者ページでできること... 4 3.2 管理者ページへのアクセス... 4 3.3 Agatha 管理者ページ画面... 5 3 ユーザー登録の流れ...
Agatha 管理者向け操作ガイド 基本編 R2.4:2017 年 7 月 13 日 アガサ株式会社 1 目次 1 Agatha 管理者向けマニュアルの概要... 3 2 Agatha 利用前のご確認... 3 3 管理者ページ... 4 3.1 管理者ページでできること... 4 3.2 管理者ページへのアクセス... 4 3.3 Agatha 管理者ページ画面... 5 3 ユーザー登録の流れ...
前項に規定する事項のうち当該被験薬の治験薬概要書から予測できないもの に改め 同項を同条第三項とし 同条第一項の次に次の一項を加える 2治験依頼者は 被験薬について法第八十条の二第六項に規定する事項を知ったときは その発現症例一覧等を当該被験薬ごとに 当該被験薬について初めて治験の計画を届け出た日等
 厚生労働省令第二十四号薬事法(昭和三十五年法律第百四十五号)第十四条第三項(同条第九項及び同法第十九条の二第五項において準用する場合を含む ) 第十四条の四第四項及び第十四条の六第四項(これらの規定を同法第十九条の四において準用する場合を含む ) 第八十条の二第一項 第四項及び第五項並びに第八十二条の規定に基づき 医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令を次のように定める 平成二十年二月二十九日厚生労働大臣舛添要一医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令医薬品の臨床試験の実施の基準に関する省令(平成九年厚生省令第二十八号)の一部を次のように改正する
厚生労働省令第二十四号薬事法(昭和三十五年法律第百四十五号)第十四条第三項(同条第九項及び同法第十九条の二第五項において準用する場合を含む ) 第十四条の四第四項及び第十四条の六第四項(これらの規定を同法第十九条の四において準用する場合を含む ) 第八十条の二第一項 第四項及び第五項並びに第八十二条の規定に基づき 医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令を次のように定める 平成二十年二月二十九日厚生労働大臣舛添要一医薬品の臨床試験の実施の基準に関する省令の一部を改正する省令医薬品の臨床試験の実施の基準に関する省令(平成九年厚生省令第二十八号)の一部を次のように改正する
する 研究実施施設の環境 ( プライバシーの保護状態 ) について記載する < 実施方法 > どのような手順で研究を実施するのかを具体的に記載する アンケート等を用いる場合は 事前にそれらに要する時間を測定し 調査による患者への負担の度合いがわかるように記載する 調査手順で担当が複数名いる場合には
 参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
参考 : 様式 2( 記載例 ) ( 研究責任者 ) ( 本会倫理審査委員会 ) 西暦年月日 研究計画書 ( 第版 ) 公益社団法人富山県薬剤師会倫理審査委員会委員長様 計画者 ( 研究責任者 ) 所属 : 職名 : 氏名 : 印 1. 研究の名称 : 2. 研究の実施体制 研究責任者名所属職名役割及び責任 薬局管理薬剤師 研究分担者名 所属 職名 役割及び責任 薬局 薬剤師 病院 科 病院薬剤部
