~ こ治験方法の概略を示す
|
|
|
- あきお はかまや
- 4 years ago
- Views:
Transcription
1 ~ こ治験方法の概略を示す
2 表 治験方法の概略 : 第 III 相試験 < 淋菌性尿道炎オープン >(2/2) 対象 ( つづき ) 被験者数治験デザイン用法 用量投与期間評価項目評価スケジュール統計解析手法 3) 薬剤吸収に影響を与えるような胃腸障害患者 ( クローン病患者 潰瘍性大腸炎患者 胃全摘患者など ) 4) 治験薬投与前 28 日以内に尿道炎の治療を受けた患者 5) 尿道炎以外の治療のためにアジスロマイシンが治験薬投与前 4 日以内に投与された患者 (4) 倫理的配慮 1) シタフロキサシンの治験への参加歴を有する患者 2) 過去に 開発中の薬剤の治験に参加している場合 本治験の同意取得時点で当該薬剤の投与終了日から 30 日あるいは半減期の 5 倍以上のいずれか長い期間を経過していない患者 ( または その内容が不明な場合は 90 日を経過していない患者 ) 3) 本治験の実施医療機関の関係者 治験依頼者の社員およびその家族 (5) その他感染症の経過や治療効果に影響を及ぼす何らかの要因を有するなどの理由を含め 治験責任医師または治験分担医師が治験の対象として不適当と判断した患者 1. 計画時 :20 名 ( ただし シタフロキサシンの MIC が 0.25 µg/ml 以上を示す N. gonorrhoeae が分離された被験者の評価が 5 名終了した時点で登録を終了 ) 2. 解析時 : 登録被験者数 13 名 中央登録方式による多施設共同オープン試験 シタフロキサシン 1 回 200 mg 経口投与 単回投与 1. 有効性 1.1 主要評価項目有効率 1.2 副次評価項目 Microbiological outcome の Eradication 率 1.3 その他の評価項目 Clinical outcome の Cure 率 尿道スミア中白血球の正常化率 Microbiological outcome と Clinical outcome の関係 Microbiological outcome の主要背景因子別 Eradication 率 消失率 原因菌別 MIC 別消失率 著効率 主要背景因子別著効率 有効率 原因菌別有効率 原因菌別 MIC 別有効率 Clinical outcome のクラミジア混合感染の有無別 Cure 率 2. 安全性有害事象発現率 副作用発現率 臨床検査値の推移 表 参照 1. 有効性点推定値とその両側 95% 信頼区間を算出した 主たる解析対象集団は治験実施計画書に適合した対象集団 (PPS) とした 2. 安全性有害事象発現率と副作用発現率の点推定値およびその両側 95% 信頼区間を算出した 臨床検査値の推移は 投与開始前を基準とした Wilcoxon 符号付順位検定を行った ( ただし 検定の P 値は記述的指標として扱った ) 血液検査は時期別に要約統計量を算出し 尿検査は時期別に頻度集計を行った 406
3 表 評価スケジュール : 第 III 相試験 < 淋菌性尿道炎オープン > 観察 検査項目 実施時期投与前日 ~ 投与日投与後 3~8 日 同意 患者背景 治験中の性交渉の有無 自覚症状 有害事象発現の有無 随時 尿道分泌物量および性状 尿道スミア中白血球数 細菌学的検査 a) 鏡検法 淋菌培養 ( 集中 ) PCR 法 b) ( 集中 ) 血液検査 尿検査 : 必ず実施する : 必要に応じて実施する a: 治験開始前に N. gonorrhoeae の存在が確認されていない場合に検査する b:chlamydia trachomatis について検査する 被験者数の設定根拠 抗菌薬臨床評価のガイドライン では 淋菌感染症における経口抗菌薬の適応疾患の決定に必要な最低被験者数を 淋菌性尿道炎 10 名と規定している 一方 淋菌性尿道炎を適応症とするには 少なくとも 90% の有効率を確保する必要があると考えた 本治験の期待有効率を 90% と見積もった場合 その両側 95% 信頼区間が ±10% におさまるためには 35 名が必要である しかし 近年 N. gonorrhoeae の市販ニューキノロン系抗菌薬に対する耐性化が急速に進んでいること およびシタフロキサシンの淋菌感染症に対する単回投与での有効性は確認されていないことから 淋菌性尿道炎に対する単回投与での有効性を瀬踏み的に検討する目的で 10 名を目標被験者数として本治験を開始した 登録被験者数が 9 名となった段階で シタフロキサシンの MIC が 0.25 µg/ml 以上を示した N. gonorrhoeae は臨床分離株 9 株中 3 株であった この株数ではキノロン耐性淋菌に対する臨床効果を評価するには不十分であると判断し 目標被験者数を 20 名に変更するとともに シタフロキサシンの MIC が 0.25 µg/ml 以上を示す N. gonorrhoeae が分離された被験者 5 名の評価が終了した時点で登録を終了することとした 用法 用量の設定根拠後期第 II 相試験 < 泌尿器科オープン>( 添付資料番号 (6 群 )-3 参照 ) では 淋菌性尿道炎患者にシタフロキサシンを 7 日間投与し その臨床効果を UTI 薬効評価基準 ( 第 3 版 ) 追補 により判定した 50 mg 2/ 日の投与開始後 3 日の有効率は 100%(14/14) であり 50 mg 2/ 日投与で十分な臨床効果が得られると考えた 一方 2002 年に実施された 臨床分離株の各種抗菌薬に対する感受性サーベイランス で得られた N. gonorrhoeae に対するシタフロキサシンの MIC 90 は 0.5 µg/ml で 407
4 あった また 第 I 相試験 ( 添付資料番号 ) におけるシタフロキサシンの 50 mg 100 mg 200 mg 単回投与時の C max はそれぞれ 0.51 µg/ml 1.00 µg/ml 1.86 µg/ml であった 単回投与で N. gonorrhoeae に対して十分な臨床効果を得るには 50 mg もしくは 100 mg では不十分であり 少なくともほぼ 4MIC 90 の C max が必要と考え シタフロキサシンの用量は 200 mg と設定した 47.2 被験者の内訳本治験の登録被験者は 13 名であった このうち 1 名は治験薬投与前に除外基準に抵触していることが判明したため 未投与とした 残りの 12 名の被験者はすべて治験を完了した 47.3 解析対象安全性解析対象集団 最大の解析対象集団 (FAS) および PPS はいずれも 12 名とした 47.4 被験者背景年齢 (Mean ± SD 以下同様) は 30 ± 8 歳 体重は ± 15.2 kg BMI は 25.3 ± 4.8 であった C. trachomatis との混合感染は 12 名中 2 名に認められた 47.5 有効性の結果 主要評価項目 : 有効率有効率は 75.0%(9/12 95%CI = 42.8%, 94.5%) であった 副次評価項目 :Microbiological outcome における Eradication 率 Eradication 率は 75.0%(9/12) であった その他の有効性評価項目 Clinical outcome の Cure 率 Cure 率は 83.3%(10/12) であった 尿道スミア中白血球の正常化率正常化率は 83.3%(10/12) であった 消失率 N. gonorrhoeae の消失率は 75.0%(9/12) であった MIC 別の消失率は シタフロキサシンの MIC が 0.06 µg/ml 以下の株では 100%(8/8) であった 一方 MIC が 0.12 µg/ml 以上のキノロン耐性株では MIC 0.25 µg/ml の 408
5 1 株が消失したのみであり 消失率は 25.0%(1/4) であった 47.6 安全性の結果 死亡本治験では死亡は認められなかった 重篤な有害事象本治験では重篤な有害事象は認められなかった 重要な有害事象本治験では重要な有害事象は認められなかった 有害事象 副作用の分析 有害事象 副作用 有害事象有害事象発現状況を表 に示す 有害事象は 12 名中 5 名 (41.7%) に 7 件認められた 有害事象 ( 基本語 ) とその発現率は 下痢 血中カリウム増加が各 16.7%(2/12) 頭痛 血中ビリルビン増加 血中乳酸脱水素酵素増加が各 8.3%(1/12) であった 表 有害事象発現状況 : 第 III 相試験 < 淋菌性尿道炎オープン > 評価被験者数 12 発現被験者数 (%) 5(41.7) 95% 信頼区間 a) (%) (15.2, 72.3) 発現件数 7 b) b) 器官別大分類基本語被験者数 (%) 件数 神経系障害全体 1(8.3) 1 頭痛 1(8.3) 1 胃腸障害全体 2(16.7) 2 下痢 2(16.7) 2 臨床検査全体 3(25.0) 4 a:f 分布による信頼区間 b:meddra/j V.9.0 血中ビリルビン増加 1(8.3) 1 血中乳酸脱水素酵素増加 1(8.3) 1 血中カリウム増加 2(16.7) 副作用副作用は 12 名中 3 名 (25.0%) に 4 件認められた 409
6 副作用 ( 基本語 ) とその発現率は 下痢 16.7%(2/12) 頭痛 血中ビリルビン増加が各 8.3%(1/12) であった 重症度別の有害事象 副作用 重症度別の有害事象有害事象はすべて軽度であった 重症度別の副作用副作用はすべて軽度であった 臨床検査値の評価投与前後の血液検査の対応のある Wilcoxon 符号付順位検定による比較で P 値が 0.05 未満となった項目を表 に示す 好中球で平均値の低下が 好酸球 リンパ球 単球で平均値の上昇が認められた 投与前後の尿検査の対応のある Wilcoxon 符号付順位検定による比較で P 値が 0.05 未満となった項目は認められなかった 表 変動が認められた血液検査項目 : 第 III 相試験 < 淋菌性尿道炎オープン> a) 検査項目投与前投与後検定結果 好酸球 (%) P = ± ± 1.7 好酸球 ( 実数 ) (/ mm ) P = ± ± 好中球 (%) P = ± ± リンパ球 (%) P = 単球 (%) 上段 :n 下段 :Mean ± SD a:wilcoxon 符号付順位検定 26.3 ± ± ± ± 1.6 P = 結論淋菌性尿道炎に対するシタフロキサシン 200 mg 単回投与の十分な有効性は確認できなかった その原因は therapeutic time の不足にあると推察した 淋菌性尿道炎に対して十分な有効性を得るためには 投与量の増量 投与回数の増加等 さらに検討を重ねる必要がある 安全性に重大な問題は認められなかった 410
7 ~ こ治験方法の概略を示す
8 対象 ( つづき ) 被験者数 治験デザイン 用法 用量 投与期間 評価項目 評価スケジュール 表 治験方法の概略 : 後期第 II 相試験 < 皮膚科オープン >(2/2) (3) 経口剤による治療が不適当と考えられる患者 (4) 重篤な基礎疾患 合併症を有し 治験薬の有効性 安全性の評価が困難な患者 (5) 治験薬投与開始前に他の抗菌薬が投与され 既に症状が改善しつつある患者 (6) 原因の如何を問わず 光線過敏症を有する患者 (7) キノロン系抗菌薬にアレルギーおよび重篤な副作用の既往のある患者 (8) てんかんなどの痙攣性疾患またはこれらの既往歴のある患者 (9) 高度の心あるいは腎機能障害のある患者および中等度以上 ( 目安として トランスアミナーゼが 100 を超えるもの ) の肝機能検査値異常が認められている患者 (10) 老化が進行し有効性および安全性評価に不適当と考えられる患者 (11) 痴呆および脳軟化症患者など自覚症状を表現することに障害をもつ患者 (12) 妊婦 妊娠している可能性のある女性 授乳中の女性および投与期間中に妊娠が予測される女性 (13) その他 治験担当医師が不適当と判断した患者なお薬物動態評価被験者では 投与開始前 1 週間以内に他の抗菌薬が投与された患者は除外とした 1. 計画時 : 臨床評価被験者 190 名 薬物動態評価被験者 30 名 2. 解析時 : 登録被験者数 ; 臨床評価被験者 198 名 ( うち原資料保存不備 13 名 ) 薬物動態評価被験者 9 名 ( うち原資料保存不備 2 名 ) オープン試験 1. 臨床評価被験者シタフロキサシン 1 回 50 mg または 100 mg 1 日 1 回または 2 回食後経口投与 ただし 1 回 50 mg 1 日 3 回投与も可とした なお 臨床効果の評価中は用法 用量を変更しないこととした 2. 薬物動態評価被験者シタフロキサシン 1 回 50 mg または 100 mg 単回または反復経口投与 1. 臨床評価被験者 :7 日間 投与期間の延長を要する場合でも 14 日間を超えない 2. 薬物動態評価被験者 : 単回投与 臨床評価被験者を登録する場合は最長 7 日間 1. 有効性投与終了 中止時の有効率 陰性化率 消失率 全般改善度 a) 2. 安全性副作用発現率 臨床検査値異常変動発現率 概括安全度 3. 有用性 4. 薬物動態血清中濃度 組織中濃度 組織中濃度 / 血清中濃度 調査 観察項目 投与開始前 投与開始後 4 日 投与開始後 7 日 ( 中止 終了時 ) 患者背景 除外規定 感染症重症度 体温 症状 所見 全般改善度 細菌学的検査 (1 日前 ~ 開始日 ) ( 終了日 ~1 日後 ) 随伴症状 臨床検査 (7 日前 ~ 開始日 ) ( 終了日 ~7 日後 ) : 必須 : 可能な限り実施する 統計解析手法有効性 ( 有効率 陰性化率 消失率 改善率 ) 安全性( 副作用発現率 臨床検査値異常変動発現率 安全率 ) 有用率およびそれらの対象被験者条件による層別集計 用量別集計を行った 薬物動態については 予め解析項目は定めなかった a: 随伴症状および臨床検査値異常変動は MedDRA/J V.9.0 を用いて読替えを行い 臨床検査異常変動発現率は副作用発現率に含めて再集計した 412
9 被験者数の設定根拠皮膚科領域感染症に対するシタフロキサシンの有効性と安全性を評価し 臨床用量の範囲を検討するとともに 抗菌薬の適応のガイドライン ( 改正案 ) に規定されている各疾患の原因菌分離被験者数を確保するために必要な被験者数として 190 名を臨床評価被験者数の目標とした 内訳は下記のとおりとした 急性表在性毛包炎 30 名 せつ せつ腫症 よう 尋常性毛瘡 45 名 伝染性膿痂疹 尋常性膿瘡 15 名 急性化膿性爪囲炎 瘭疽 リンパ管炎 丹毒 蜂窩織炎 ( 蜂巣炎 ) 30 名 化膿性汗腺炎 感染性粉瘤 その他の皮下膿瘍 40 名 外傷 熱傷 手術創などの二次感染 30 名薬物動態評価被験者数は これまでの各種ニューキノロン系抗菌薬の臨床試験で設定された被験者数を基に 30 名を目標とした 用法 用量の設定根拠前期第 II 相試験で 呼吸器感染症 ( 肺炎および慢性下気道感染症 ) および尿路感染症 ( 単純性および複雑性尿路感染症 ) に対して シタフロキサシン 1 回 50 mg または 100 mg 1 日 1 回または 2 回を投与した結果 いずれの用法 用量においても十分な臨床効果が得られた 副作用発現率は 50 mg 2/ 日に比べ 100 mg 2/ 日ではやや高かったが 副作用の内容および重症度に投与量による違いは認められず 100 mg 2/ 日でも安全性は確保し得ると考えた また 第 I 相試験での血清中濃度推移と非臨床試験での組織移行 皮膚科領域感染症の主要な原因菌に対するシタフロキサシンの MIC から 1 日 50~200 mg で治療効果が期待された 以上のことから 本治験の用法 用量を 1 回 50 mg または 100 mg 1 日 1 回または 2 回食後経口投与とした 48.2 被験者の内訳臨床評価被験者の内訳を図 に示す 本治験に登録された臨床評価被験者は 198 名であり このうち原資料保存不備は 13 名であった 原資料が確認できた被験者は 185 名であり うち完了被験者は 160 名 未完了被験者は 25 名であった 未完了理由の内訳は 被験者の申し出 が 3 名 効果不十分 が 4 名 有害事象の発現 が 12 名 基準に抵触 が 1 名 来院せず が 3 名 その他 が 2 名であった また 登録された薬物動態評価被験者は 9 名であり このうち原資料保存不備は 2 名であった 原資料が確認できた被験者は 7 名であり すべての被験者が治験を完了した 413
10 原資料が確認できた被験者 185 名 完了 160 名 未完了 25 名 被験者の申し出 3 名 効果不十分 4 名 有害事象の発現 12 名 基準に抵触 1 名 来院せず 3 名 その他 2 名 図 臨床評価被験者の内訳 : 後期第 II 相試験 < 皮膚科オープン> 48.3 解析対象各解析対象集団を表 に示す 臨床評価被験者のうち 有効性解析対象集団は 142 名 細菌学的効果解析対象集団は 98 名 (163 株 ) 安全性解析対象集団は 180 名とした 薬物動態評価被験者のうち 薬物動態解析対象集団は 6 名 安全性解析対象集団は 6 名とした 表 解析対象集団 : 後期第 II 相試験 < 皮膚科オープン > 臨床評価被験者 薬物動態評価被験者 被験者数有効性解析対象集団 142 細菌学的効果対象集団 98 安全性解析対象集団 180 薬物動態解析対象集団 6 安全性解析対象集団 被験者背景臨床評価被験者の背景を表 に示す 有効性解析対象集団 142 名の内訳は急性表在性毛包炎が 21 名 びまん性表在性感染症が 9 名 毛包 爪囲感染症が 36 名 びまん性深在性感染症が 23 名 慢性膿皮症 ( 膿瘍性疾患 ) が 48 名 潰瘍の二次感染が 5 名であった 414
11 表 臨床評価被験者背景 : 後期第 II 相試験 < 皮膚科オープン > 項目疾患名性別年齢 ( 歳 ) 第 I 群表在性皮膚感染症 有効性解析対象集団 n = 142 安全性解析対象集団 n = 180 (a) 毛包感染症 : 急性表在性毛包炎 (b) びまん性表在性感染症 : 伝染性膿痂疹 尋常性膿瘡 浅在性二次感染 ( 表在性 II 度およびより浅い熱傷の二次感染を含む ) 第 II 群深在性皮膚感染症 (a) 毛包 爪囲感染症 : せつ せつ腫症 よう 尋常性毛瘡 急性化膿性爪囲炎 瘭疽 (b) びまん性深在性感染症 : リンパ管炎 丹毒 蜂窩織炎 ( 蜂巣炎 ) 深在性二次感染( 潰瘍の二次感染は除く ) 第 III 群慢性膿皮症 ( 膿瘍性疾患 ): 感染性粉瘤 化膿性汗腺炎 その他の皮下膿瘍 第 IV 群潰瘍の二次感染 : 下腿潰瘍 深在性 II 度およびそれより深い熱傷の二次感染 5 8 男 女 未満 以上 30 未満 以上 40 未満 以上 50 未満 以上 60 未満 以上 70 未満 以上 80 未満 以上 有効性の結果有効率は全体で 71.1%(101/142) であった 消失率は全体で 89.6%(146/163) であった 48.6 薬物動態の結果 2 名に 50 mg 4 名に 100 mg を単回投与した時の皮膚組織内濃度は それぞれ投与後 2.3~3.0 時間で 0.077~0.327 µg/g 投与後 0.8~2.5 時間で 0.017~0.821 µg/g であった 血清中濃度は それぞれ投与後 2.2~4.5 時間で 0.02~0.341 µg/ml 投与後 0.8~ 3.0 時間で 0.053~1.687 µg/ml であった また 皮膚組織中濃度の対血清中濃度比は 概ね 0.5 であった 48.7 安全性の結果 死亡本治験では死亡は認められなかった 415
12 重篤な有害事象本治験では重篤な有害事象は認められなかった 有害事象 副作用の分析 有害事象有害事象発現状況を表 に示す 有害事象は 臨床評価被験者 180 名中 65 名 (36.1%) に 104 件認められた 主な有害事象 ( 基本語 発現率 5% 以上 ) とその発現率は 下痢 13.9%(25/180) 血中トリグリセリド増加 5.0%(9/180) であった 薬物動態評価被験者では有害事象は認められなかった 表 有害事象発現状況 : 後期第 II 相試験 < 皮膚科オープン >(1/2) 臨床評価被験者 評価被験者数 180 発現被験者数 (%) 65(36.1) 95% 信頼区間 (%) (29.1, 43.1) 発現件数 104 b) 器官別大分類 b) 基本語 被験者数 (%) 件数 神経系障害 全体 4(2.2) 5 浮動性めまい 1(0.6) 1 頭痛 3(1.7) 3 傾眠 1(0.6) 1 眼障害 全体 1(0.6) 1 羞明 1(0.6) 1 耳および迷路障害 全体 1(0.6) 1 耳鳴 1(0.6) 1 心臓障害 全体 1(0.6) 1 動悸 1(0.6) 1 胃腸障害 全体 29(16.1) 36 腹部膨満 1(0.6) 1 上腹部痛 1(0.6) 1 便秘 1(0.6) 1 下痢 25(13.9) 28 悪心 2(1.1) 2 胃不快感 1(0.6) 1 嘔吐 1(0.6) 1 直腸しぶり 1(0.6) 1 皮膚および 全体 1(0.6) 1 皮下組織障害 紅斑 1(0.6) 1 筋骨格系および 全体 1(0.6) 1 結合組織障害 筋骨格硬直 1(0.6) 1 全身障害および 全体 1(0.6) 1 投与局所様態 異常感 1(0.6) 1 a: 正規近似による信頼区間 b:meddra/j V
13 表 有害事象発現状況 : 後期第 II 相試験 < 皮膚科オープン >(2/2) 臨床評価被験者 評価被験者数 180 a) 器官別大分類 a) 基本語 被験者数 (%) 件数 臨床検査 全体 37(20.6) 57 アラニン アミノトランスフェラーゼ増加 8(4.4) 8 アスパラギン酸アミノトランスフェラーゼ増加 4(2.2) 4 抱合ビリルビン増加 2(1.1) 2 血中ビリルビン増加 3(1.7) 3 血中クレアチンホスホキナーゼ増加 7(3.9) 7 血中乳酸脱水素酵素増加 2(1.1) 2 血中カリウム減少 1(0.6) 1 血中カリウム増加 1(0.6) 1 血中トリグリセリド増加 9(5.0) 9 C- 反応性蛋白増加 2(1.1) 2 好酸球数増加 2(1.1) 2 尿中ブドウ糖陽性 2(1.1) 2 単球数増加 1(0.6) 1 白血球数減少 4(2.2) 4 白血球数増加 2(1.1) 2 血沈亢進 2(1.1) 2 尿沈渣陽性 3(1.7) 4 血小板数増加 1(0.6) 1 a:meddra/j V 副作用副作用は 臨床評価被験者 180 名中 54 名 (30.0%) に 78 件認められた 主な副作用 ( 基本語 発現率 5% 以上 ) とその発現率は 下痢 12.8%(23/180) であった 薬物動態評価被験者では副作用は認められなかった 48.8 結論シタフロキサシン 1 回 50 mg 1 日 2 回または 3 回 ならびに 100 mg 1 日 2 回経口投与は 皮膚科領域感染症に対して有効であると考えた 安全性については 下痢などの胃腸障害の他 血中トリグリセリド増加などが認められ 今後の検討が必要であると考えた 417
14 前期第 II 相試験 ( 添付資料番号 5.3~5.2 ~ こ治験方法の概略を示す
15 対象 ( つづき ) 被験者数 治験デザイン 用法 用量 投与期間 表 治験方法の概略 : 後期第 II 相試験 < 外科オープン >(2/3) (2) 症状 所見の確実な観察が可能な患者であり A グループ研究班では入院 外来は問わないが B グループ研究班では入院に限る (3) 腹部疼痛を有する患者で 少なくとも右下腹部に限局性の圧痛を認める患者 (4) 虫垂炎としての症状 所見が明確な患者 (5)A グループ研究班の対象は 保存的療法が可能と判断される虫垂炎患者なお 保存的療法の選択は 多変量解析による臨床所見 検査所見の重症スコア によるスコアが 20 以下を参考とする (6)B グループ研究班の対象は 腹腔鏡下の手術が適応となる蜂窩織炎性虫垂炎 壊疽性虫垂炎および穿孔性虫垂炎のうち腹腔内汚染が限局している患者 3. 除外基準 3.1 臨床評価被験者 外科一般感染症 (1) 経口剤による治療が不適当と考えられる患者 (2) 重篤な基礎疾患 合併症を有し 治験薬の有効性 安全性の評価が困難な患者 (3) 治験薬投与開始前に他の抗菌薬が投与され 既に症状が改善しつつある患者 (4) キノロン系抗菌薬にアレルギーおよび重篤な副作用の既往のある患者 (5) てんかんなどの痙攣性疾患またはこれらの既往歴のある患者 (6) 高度の心あるいは腎機能障害のある患者および中等度以上の肝機能検査値異常が認められている患者 (7) 老化が進行しており 有効性および安全性評価に不適当と考えられる患者 (8) 痴呆および脳軟化症患者など自覚症状を表現することに障害をもつ患者 (9) 妊婦 妊娠している可能性のある女性 授乳中の女性および投与期間中に妊娠が予測される女性 (10) その他 治験担当医師が不適当と判断した患者 虫垂炎およびそれによる限局性腹膜炎 (1) 外科一般感染症の除外基準 (1)~(5) および (7)~(10) に該当する患者 (2) 虫垂炎研究班 A グループでは 保存的療法が不適当と判断される蜂窩織炎性虫垂炎の患者 および壊疽性虫垂炎 穿孔性虫垂炎が疑われる患者 (3) 虫垂炎研究班 B グループ研究班では 汎発性腹膜炎を併発している患者 (4) 高度の心 肝あるいは腎機能障害のある患者 およびすでに肝機能検査値異常が認められている患者 1. 計画時 : 臨床評価被験者 150 名 薬物動態評価被験者数は設定せず 2. 解析時 : 登録被験者数 ; 臨床評価被験者 137 名 ( うち原資料保存不備 24 名 ) 薬物動態評価被験者 62 名 ( 臨床評価被験者の 23 名を含む )( うち原資料保存不備 6 名 ) オープン試験 1. 臨床評価被験者 1.1 外科一般感染症 : シタフロキサシン 1 回 50 mg または 100 mg 1 日 1 回または 2 回食後経口投与 1.2 虫垂炎およびそれによる限局性腹膜炎 : 1 回 100 mg 1 日 2 回経口投与 2. 薬物動態評価被験者 1 日最高用法 用量は 1 回 100 mg 1 日 2 回 1. 臨床評価被験者 :3~7 日間 投与期間の延長を要する場合でも 14 日間を超えない 2. 薬物動態評価被験者 : 設定せず 評価項目 1. 有効性投与終了 中止時の有効率 陰性化率 消失率 a) 2. 安全性副作用発現率 臨床検査値異常変動発現率 概括安全度 3. 有用性 4. 薬物動態血清中濃度 組織中濃度 a: 随伴症状および臨床検査値異常変動は MedDRA/J V.9.0 を用いて読替えを行い 臨床検査異常変動発現率は副作用発現率に含めて再集計した 419
16 表 治験方法の概略 : 後期第 II 相試験 < 外科オープン >(3/3) 評価スケジュール 1. 外科一般感染症 調査 観察項目投与開始前投与開始後 3~5 日 投与開始後 7 日 ( 中止 終了時 ) 患者背景 除外規定 臨床症状 毎日調査 白血球数 CRP 超音波検査 * 細菌学的検査 随伴症状 毎日調査 臨床検査 : 必須 : 可能な限り実施する *: 胆嚢炎 肝膿瘍のみ 2. 虫垂炎およびそれによる限局性腹膜炎 急性虫垂炎の保存的治療研究班 (A グループ研究班 ) 調査 観察項目投与開始前投与開始後 3 日 投与開始後 5~7 日 ( 中止 終了時 ) 患者背景 除外規定 臨床症状可能な限り毎日調査体温 腹痛部位 圧痛 悪心 嘔吐 筋性防御 腹膜刺激症状 白血球数 CRP 超音波検査 随伴症状毎日調査臨床検査 : 必須 : 可能な限り実施する 急性虫垂炎および限局性腹膜炎の腹腔鏡下手術研究班 (B グループ研究班 ) 調査 観察項目投与開始前投与開始後 3 日 投与開始後 5~14 日 ( 中止 終了時 ) 患者背景 除外規定 臨床症状可能な限り毎日調査体温 腹痛部位 圧痛 悪心 嘔吐 筋性防御 腹膜刺激症状 白血球数 CRP 超音波検査 細菌学的検査 随伴症状毎日調査臨床検査 : 必須 : 可能な限り実施する 統計解析手法有効性 ( 有効率 陰性化率 消失率 ) 安全性( 副作用発現率 臨床検査値異常変動発現率 安全率 ) 有用率およびそれらの対象被験者条件による層別集計 用量別集計を行った 薬物動態については 予め解析項目は定めなかった a: 随伴症状および臨床検査値異常変動は MedDRA/J V.9.0 を用いて読替えを行い 臨床検査異常変動発現率は副作用発現率に含めて再集計した 420
17 被験者数の設定根拠外科領域感染症に対するシタフロキサシンの有効性と安全性を評価し 臨床用量の範囲を検討するとともに 抗菌薬の適応のガイドライン ( 改正案 ) に規定されている各疾患の原因菌分離被験者数を確保するために必要な被験者数として 150 名を臨床評価被験者数の目標とした 内訳は下記のとおりとした 肛門周囲膿瘍 25 名 外傷 熱傷 手術創などの ( 表在性 ) 二次感染 30 名 胆嚢炎 胆管炎 30 名 肝膿瘍 5 名 乳腺炎 10 名 虫垂炎およびそれによる限局性腹膜炎 50 名急性虫垂炎 (A グループ研究班 ) 30 名急性虫垂炎およびそれによる限局性腹膜炎 (B グループ研究班 ) 20 名薬物動態評価被験者の目標被験者数は設定しなかった 用法 用量の設定根拠前期第 II 相試験で 呼吸器感染症 ( 肺炎および慢性下気道感染症 ) および尿路感染症 ( 単純性および複雑性尿路感染症 ) に対して シタフロキサシン 1 回 50 mg または 100 mg 1 日 1 回または 2 回を投与した結果 いずれの用法 用量においても十分な臨床効果が得られた 副作用発現率は 50 mg 2/ 日に比べ 100 mg 2/ 日ではやや高かったが 副作用の内容および重症度に投与量による違いは認められず 100 mg 2/ 日でも安全性は確保し得ると考えた また 第 I 相試験での血清中濃度推移と非臨床試験での組織移行 外科感染症の主要な原因菌に対するシタフロキサシンの MIC から 1 日 50~200 mg で治療効果が期待された 以上のことから 本治験の用法 用量を 1 回 50 mg または 100 mg 1 日 1 回または 2 回食後経口投与とした 投与期間は 同系統の薬剤が外科領域感染症の臨床試験で設定している 3~14 日間とした 49.2 被験者の内訳臨床評価被験者の内訳を図 に示す 本治験に登録された臨床評価被験者は 137 名であり このうち原資料保存不備は 24 名であった 原資料が確認できた被験者は 113 名であり うち完了被験者は 93 名 未完了被験者は 20 名であった 未完了理由の内訳は 被験者の者の申し出 が 2 名 効果不十分 が 5 名 有害事象の発現 が 3 名 基準に抵触 が 2 名 来院せず が 5 名 その他 が 3 名であった また 登録された薬物動態評価被験者は 62 名 ( 臨床評価被験者 23 名を含む ) であり このうち原資料保存不備は 6 名であった 原資料が確認できた被験者は 56 名 ( 臨床評価被験者 17 名を含む ) であり すべての被験者が治験を完了した 421
18 原資料が確認できた被験者 113 名 完了 93 名 未完了 20 名 被験者の申し出効果不十分有害事象の発現基準に抵触来院せずその他 2 名 5 名 3 名 2 名 5 名 3 名 図 臨床評価被験者の内訳 : 後期第 II 相試験 < 外科オープン > 49.3 解析対象各解析対象集団を表 に示す 臨床評価被験者のうち 有効性解析対象集団は 86 名 細菌学的効果解析対象集団は 48 名 (149 株 ) 安全性解析対象集団は 103 名とした 薬物動態評価被験者のうち薬物動態解析対象集団は 52 名 安全性解析対象集団は 38 名とした 表 解析対象集団 : 後期第 II 相臨床試験 < 外科オープン > 臨床評価被験者 薬物動態評価被験者 被験者数有効性解析対象集団 86 細菌学的効果対象集団 48 安全性解析対象集団 103 薬物動態解析対象集団 52 安全性解析対象集団 38 a) a: 臨床評価被験者と同一の 14 名は 臨床評価被験者として安全性を評価 49.4 被験者背景臨床評価被験者の背景を表 に示す 有効性解析対象集団 86 名の内訳は肛門周囲膿瘍が 18 名 外傷 熱傷 手術創などの ( 表在性 ) 二次感染が 24 名 胆嚢炎 胆管炎が 9 名 乳腺炎が 4 名 虫垂炎およびそれによる限局性腹膜炎が 31 名であった 422
19 表 臨床評価被験者背景 : 後期第 II 相試験 < 外科オープン > 疾患名 性別 年齢 ( 歳 ) 項目 有効性解析対象集団 安全性解析対象集団 n = 86 n = 103 肛門周囲膿瘍 外傷 熱傷 手術創などの表在性二次感染 a) 胆嚢炎 胆管炎 9 12 b) 乳腺炎 4 6 虫垂炎およびそれによる限局性腹膜炎 その他 0 3 男 女 未満 以上 30 未満 以上 40 未満 以上 50 未満 以上 60 未満 以上 70 未満 以上 80 未満 以上 6 6 a: 安全性解析対象集団で胆嚢炎 胆管炎 肝膿瘍 b: 安全性解析対象集団で乳腺炎 乳輪下膿瘍 49.5 有効性の結果有効率は全体で 81.4%(70/86) であった 消失率は全体で 94.6%(141/149) であった 49.6 薬物動態の結果 100 mg を単回投与した時の血清中濃度 (Mean 以下同様) は 投与後 1.0~7.2 時間で 0.42 µg/ml であった 組織中濃度は 胆嚢では投与後 1.8~7.2 時間で 1.71 µg/g 胆嚢胆汁では投与後 1.9~7.3 時間で µg/ml 胆管胆汁では投与後 1.0~12.0 時間で 3.29 µg/ml 肝臓では投与後 3.2~7.0 時間で 1.75 µg/g 門脈血では投与後 3.0~6.6 時間で 0.61 µg/ml 虫垂では投与後 1.7~5.3 時間で 0.44 µg/g 腹膜では投与後 1.8~ 2.3 時間で 0.25 µg/g 腹腔内貯留液では投与後 1.2~4.8 時間で 0.33 µg/ml であった 100 mg 2 回投与時の血清中濃度は 投与後 1.0~23.5 時間で 0.56 µg/ml あった 組織中濃度は 胆嚢では投与後 2.9~3.4 時間で 2.06 µg/g 胆嚢胆汁では投与後 2.9~ 3.4 時間で µg/ml であった 423
20 49.7 安全性の結果 死亡本治験では死亡は認められなかった 重篤な有害事象重篤な有害事象として 薬物動態評価被験者 1 名に血中クレアチンホスホキナーゼ増加が 1 件認められた 本被験者は 薬物動態評価 ( 胆嚢および胆汁中移行 ) のため シタフロキサシン 100 mg を手術前 ( 腹腔鏡下胆嚢摘出術 ) に単回投与された 投与前 2 日の検査で CK(CPK) は 58 IU/L であったが 手術後の CK(CPK) は 8,079 IU/L と上昇を認めた 投与後 1 日にはさらに 14,593 IU/L まで上昇したが 腎機能障害および自覚症状は認められなかった 無処置にて投与後 7 日に 331 IU/L と急速に改善し 投与後 27 日には 65 IU/L に回復した 本事象は担当医により 手術の侵襲から予測される上昇よりも高度であると判断され シタフロキサシンとの因果関係は 多分関係あり 重症度は 重度 と判定された 有害事象 副作用の分析 有害事象有害事象発現状況を表 に示す 有害事象は 臨床評価被験者では 103 名中 28 名 (27.2%) に 46 件 薬物動態評価被験者では 38 名中 3 名 (7.9%) に 7 件認められた 主な有害事象 ( 基本語 発現率 5% 以上 ) とその発現率は 臨床評価被験者では下痢 アラニン アミノトランスフェラーゼ増加が各 5.8%(6/103) であった 薬物動態評価被験者では アラニン アミノトランスフェラーゼ増加が 5.3%(2/38) であった 424
21 表 有害事象発現状況 : 後期第 II 相試験 < 外科オープン > 臨床評価被験者 薬物動態評価被験者 評価被験者数 発現被験者数 (%) 28(27.2) 3(7.9) 95% 信頼区間 (%) (18.6, 35.8) (0.0, 16.5) 発現件数 46 7 b) 器官別大分類 b) 基本語 被験者数 (%) 件数 被験者数 (%) 件数 神経系障害 全体 1(1.0) 頭痛 1(1.0) 胃腸障害 全体 8(7.8) 便秘 1(1.0) 下痢 6(5.8) 悪心 1(1.0) 胃不快感 1(1.0) 嘔吐 1(1.0) 臨床検査 全体 21(20.4) 35 3(7.9) 7 アラニン アミノトランスフェラーゼ増加 6(5.8) 6 2(5.3) 2 アスパラギン酸アミノトランスフェラーゼ増加 3(2.9) 3 1(2.6) 1 血中ビリルビン増加 1(1.0) 1 1(2.6) 1 血中コリンエステラーゼ減少 1(1.0) 血中クレアチンホスホキナーゼ増加 2(1.9) 2 1(2.6) 1 血中クレアチニン増加 1(1.0) 血中乳酸脱水素酵素増加 1(1.0) 1 1(2.6) 1 血中トリグリセリド増加 4(3.9) 血中尿素減少 1(1.0) 好酸球数増加 5(4.9) γ-グルタミルトランスフェラーゼ増加 3(2.9) ロイシンアミノペプチダーゼ上昇 1(1.0) 白血球数減少 0 0 1(2.6) 1 白血球数増加 1(1.0) 尿中ウロビリン陽性 1(1.0) 血中アルカリホスファターゼ増加 4(3.9) a: 正規近似による信頼区間 b:meddra/j V 副作用副作用は 臨床評価被験者では 103 名中 19 名 (18.4%) に 31 件 薬物動態評価被験者では 38 名中 1 名 (2.6%) に 5 件認められた 臨床評価被験者および薬物動態評価被験者で 発現率 5% 以上の副作用は認められなかった 425
22 49.8 結論シタフロキサシンは 1 回 50 mg または 100 mg 1 日 2 回経口投与により 胆嚢炎 胆管炎 虫垂炎およびそれによる限局性腹膜炎に対して十分な臨床効果および細菌学的効果を示した しかし 乳腺炎 肛門周囲膿瘍および外傷 熱傷 手術創などの表在性二次感染に対する臨床効果はやや不十分であった 安全性については 下痢などの胃腸障害の他 アラニン アミノトランスフェラーゼ増加などが認められた また 1 名において血中クレアチンホスホキナーゼの高度上昇が認められた 従って シタフロキサシンの使用にあたっては 十分な観察が必要であると考えた 426
表 治験方法の概略 : 第 III 相試験 < 複雑性尿路感染症 DBT 用量比較 >(2/2) (3) 安全性評価または有効性評価に対する配慮 1) 尿路にカテーテルを留置している患者 ( ただし 体内留置カテーテル使用患者および自己導尿を行っている患者はカテーテル非留置とし
 表 2.7.6.37-1 治験方法の概略 : 第 III 相試験 < 複雑性尿路感染症 DBT 用量比較 >(2/2) (3) 安全性評価または有効性評価に対する配慮 1) 尿路にカテーテルを留置している患者 ( ただし 体内留置カテーテル使用患者および自己導尿を行っている患者はカテーテル非留置として扱う ) 2) 尿道炎 前立腺炎 精巣上体炎のいずれかを併発している患者または過去 1 年 (365
表 2.7.6.37-1 治験方法の概略 : 第 III 相試験 < 複雑性尿路感染症 DBT 用量比較 >(2/2) (3) 安全性評価または有効性評価に対する配慮 1) 尿路にカテーテルを留置している患者 ( ただし 体内留置カテーテル使用患者および自己導尿を行っている患者はカテーテル非留置として扱う ) 2) 尿道炎 前立腺炎 精巣上体炎のいずれかを併発している患者または過去 1 年 (365
p 13
 p 12 p 13 p 14 p 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 10. 安全性 (1) 副作用 ( 臨床検査値異常を含む ) 総症例 1030 例中 副作用が報告されたのは 519 例 (50.4%) でした 主な症状は鼓腸 197 例 (19.1%) 下痢 188 例 (18.3%) 腹部膨満
p 12 p 13 p 14 p 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 10. 安全性 (1) 副作用 ( 臨床検査値異常を含む ) 総症例 1030 例中 副作用が報告されたのは 519 例 (50.4%) でした 主な症状は鼓腸 197 例 (19.1%) 下痢 188 例 (18.3%) 腹部膨満
2.7.3(5 群 ) 呼吸器感染症臨床的有効性グレースビット 錠 細粒 表 (5 群 )-3 疾患別陰性化率 疾患名 陰性化被験者数 / 陰性化率 (%) (95%CI)(%) a) 肺炎 全体 91/ (89.0, 98.6) 細菌性肺炎 73/ (86
 2.7.3(5 群 ) 呼吸器感染症臨床的有効性グレースビット 錠 細粒 表 2.7.3.3.2(5 群 )-2 原因菌別臨床効果 原因菌 肺炎 慢性呼吸器病変の二次感染 急性上気道感染症群 5 群合計 単独菌 83 82(98.8) 67 61(91.0) 14 14(100) 164 157(95.7) 複数菌 (2 種 ) 14 14(100) 7 7(100) 2 2 23 23(100)
2.7.3(5 群 ) 呼吸器感染症臨床的有効性グレースビット 錠 細粒 表 2.7.3.3.2(5 群 )-2 原因菌別臨床効果 原因菌 肺炎 慢性呼吸器病変の二次感染 急性上気道感染症群 5 群合計 単独菌 83 82(98.8) 67 61(91.0) 14 14(100) 164 157(95.7) 複数菌 (2 種 ) 14 14(100) 7 7(100) 2 2 23 23(100)
ヒアルロン酸ナトリウム架橋体製剤 特定使用成績調査
 ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) 特定使用成績調査 (J-STEP/EL) 謹啓時下ますますご清祥のこととお喜び申し上げます 平素より格別のご高配を賜り 厚く御礼申し上げます さて ヒアルロン酸ナトリウム架橋体製剤 ( サイビスクディスポ 関節注 2mL) は 保存的非薬物治療及び経口薬物治療が十分奏功しない疼痛を有する変形性膝関節症の患者を対象に 本剤の製造販売後の使用実態下における複数回使用を含めた安全性及び有効性について確認することを目的として
シプロフロキサシン錠 100mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを
 シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
耐性菌届出基準
 37 ペニシリン耐性肺炎球菌感染症 (1) 定義ペニシリン G に対して耐性を示す肺炎球菌による感染症である (2) 臨床的特徴小児及び成人の化膿性髄膜炎や中耳炎で検出されるが その他 副鼻腔炎 心内膜炎 心嚢炎 腹膜炎 関節炎 まれには尿路生殖器感染から菌血症を引き起こすこともある 指定届出機関の管理者は 当該指定届出機関の医師が (2) の臨床的特徴を有する者を診察した結果 症状や所見からペニシリン耐性肺炎球菌感染症が疑われ
37 ペニシリン耐性肺炎球菌感染症 (1) 定義ペニシリン G に対して耐性を示す肺炎球菌による感染症である (2) 臨床的特徴小児及び成人の化膿性髄膜炎や中耳炎で検出されるが その他 副鼻腔炎 心内膜炎 心嚢炎 腹膜炎 関節炎 まれには尿路生殖器感染から菌血症を引き起こすこともある 指定届出機関の管理者は 当該指定届出機関の医師が (2) の臨床的特徴を有する者を診察した結果 症状や所見からペニシリン耐性肺炎球菌感染症が疑われ
減量・コース投与期間短縮の基準
 用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
用法 用量 通常 成人には初回投与量 (1 回量 ) を体表面積に合せて次の基準量とし 朝食後および夕食後の 1 日 2 回 28 日間連日経口投与し その後 14 日間休薬する これを 1 クールとして投与を繰り返す ただし 本剤の投与によると判断される臨床検査値異常 ( 血液検査 肝 腎機能検査 ) および消化器症状が発現せず 安全性に問題がない場合には休薬を短縮できるが その場合でも少なくとも
症例報告書の記入における注意点 1 必須ではない項目 データ 斜線を引くこと 未取得 / 未測定の項目 2 血圧平均値 小数点以下は切り捨てとする 3 治験薬服薬状況 前回来院 今回来院までの服薬状況を記載する服薬無しの場合は 1 日投与量を 0 錠 とし 0 錠となった日付を特定すること < 演習
 ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
ABC-123 臨床試験進行または再発胃癌患者に対するプラセボを対照薬とした無作為化二重盲検比較試験症例報告書 治験実施計画書番号 P123-31-V01 被験者識別コード 割付番号 治験実施医療機関名 ご自分の医療機関 お名前を記載して下さい 症例報告書記載者名 症例報告書記載者名 治験責任医師 ( 署名又は記名 押印 ) 治験責任医師記載内容確認完了日 印 2 0 年 月 日 1 症例報告書の記入における注意点
MIC MIC...
 50 mg 10% 2.7.36 2.7.36 2.7.36... 1 1.6... 1 2.6... 3 3.6... 5 3.16... 5 3.26... 12 3.36... 16 4.6... 17 5.6... 19 6.6... 20 2.7.3.3.16-1 MIC... 9 2.7.3.3.16-2 MIC... 10 2.7.3.3.16-3 MIC E. coli... 11
50 mg 10% 2.7.36 2.7.36 2.7.36... 1 1.6... 1 2.6... 3 3.6... 5 3.16... 5 3.26... 12 3.36... 16 4.6... 17 5.6... 19 6.6... 20 2.7.3.3.16-1 MIC... 9 2.7.3.3.16-2 MIC... 10 2.7.3.3.16-3 MIC E. coli... 11
ン (LVFX) 耐性で シタフロキサシン (STFX) 耐性は1% 以下です また セフカペン (CFPN) およびセフジニル (CFDN) 耐性は 約 6% と耐性率は低い結果でした K. pneumoniae については 全ての薬剤に耐性はほとんどありませんが 腸球菌に対して 第 3 世代セフ
 2012 年 12 月 5 日放送 尿路感染症 産業医科大学泌尿器科学教授松本哲朗はじめに感染症の分野では 抗菌薬に対する耐性菌の話題が大きな問題点であり 耐性菌を増やさないための感染制御と適正な抗菌薬の使用が必要です 抗菌薬は 使用すれば必ず耐性菌が出現し 増加していきます 新規抗菌薬の開発と耐性菌の増加は 永遠に続く いたちごっこ でしょう しかし 近年 抗菌薬の開発は世界的に鈍化していますので
2012 年 12 月 5 日放送 尿路感染症 産業医科大学泌尿器科学教授松本哲朗はじめに感染症の分野では 抗菌薬に対する耐性菌の話題が大きな問題点であり 耐性菌を増やさないための感染制御と適正な抗菌薬の使用が必要です 抗菌薬は 使用すれば必ず耐性菌が出現し 増加していきます 新規抗菌薬の開発と耐性菌の増加は 永遠に続く いたちごっこ でしょう しかし 近年 抗菌薬の開発は世界的に鈍化していますので
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
染症であり ついで淋菌感染症となります 病状としては外尿道口からの排膿や排尿時痛を呈する尿道炎が最も多く 病名としてはクラミジア性尿道炎 淋菌性尿道炎となります また 淋菌もクラミジアも検出されない尿道炎 ( 非クラミジア性非淋菌性尿道炎とよびます ) が その次に頻度の高い疾患ということになります
 2015 年 3 月 4 日放送 淋菌 クラミジア感染症の現状と問題点 産業医科大学泌尿器科講師濵砂良一主な性感染症淋菌感染症およびクラミジア感染症は 性感染症の一つであり 性感染症のなかで最も頻度の高い疾患です 性感染症とは 主に性的な行為によって病原体が感染する疾患であり この淋菌 クラミジア感染症の他に 梅毒 性器ヘルペス 尖圭コンジローマ HIV 感染症など数多くの疾患が含まれます これらの疾患の一部は
2015 年 3 月 4 日放送 淋菌 クラミジア感染症の現状と問題点 産業医科大学泌尿器科講師濵砂良一主な性感染症淋菌感染症およびクラミジア感染症は 性感染症の一つであり 性感染症のなかで最も頻度の高い疾患です 性感染症とは 主に性的な行為によって病原体が感染する疾患であり この淋菌 クラミジア感染症の他に 梅毒 性器ヘルペス 尖圭コンジローマ HIV 感染症など数多くの疾患が含まれます これらの疾患の一部は
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
副作用収集状況 市販直後調査期間中 (2011 年 4 月 11 日 ~2011 年 10 月 31 日 ) に収集された副作用は 200 例 258 件でした そのうち 重篤な副作用は 8 例 14 件でした 副作用の内訳を表 1 に示します 重篤な副作用は 高カルシウム血症 3 件 意識変容状態
 医師 薬剤師の先生方へ 2012 年 1 月 中外製薬株式会社 安全管理責任者 エディロール R カプセル 0.5µg 0.75µg 市販直後調査結果のご報告 市販直後調査期間 :2011 年 4 月 11 日 ~2011 年 10 月 31 日 謹啓 先生方におかれましては ますますご清祥のこととお慶び申し上げます 平素は格別のご高配を賜り 厚く御礼申し上げます エディロール カプセル 0.5µg
医師 薬剤師の先生方へ 2012 年 1 月 中外製薬株式会社 安全管理責任者 エディロール R カプセル 0.5µg 0.75µg 市販直後調査結果のご報告 市販直後調査期間 :2011 年 4 月 11 日 ~2011 年 10 月 31 日 謹啓 先生方におかれましては ますますご清祥のこととお慶び申し上げます 平素は格別のご高配を賜り 厚く御礼申し上げます エディロール カプセル 0.5µg
BMP7MS08_693.pdf
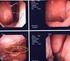
 106 第IX章 写真 1 胆囊捻転症症例 1 重症胆囊炎) ab cd a. 術中写真 1 b. 術中写真 2 c. 腹部超音波検査 d. 浮遊胆囊 Gross の分類 写真 2 胆囊捻転症症例 2 重症胆囊炎) ab c a. CT 胆囊壁の肥厚と造影不良(A) 胆囊周囲液体貯留(B) b. MRI T 2強 調 像 に お け る pericholecystic high signal 矢 印
106 第IX章 写真 1 胆囊捻転症症例 1 重症胆囊炎) ab cd a. 術中写真 1 b. 術中写真 2 c. 腹部超音波検査 d. 浮遊胆囊 Gross の分類 写真 2 胆囊捻転症症例 2 重症胆囊炎) ab c a. CT 胆囊壁の肥厚と造影不良(A) 胆囊周囲液体貯留(B) b. MRI T 2強 調 像 に お け る pericholecystic high signal 矢 印
2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社 (TPC) 大阪市中央区道修町四丁目 1 番 1 号 治験課題名 : びらん性食道炎の患者を対象にした TAK-438 の 20 mg を 1 日 1 回経口投与したときの有効性及び安全性を 1 日 1 回経口投与
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要 治験情報 : 治験依頼者名 : 武田薬品工業株式会社
2012 年 1 月 25 日放送 歯性感染症における経口抗菌薬療法 東海大学外科学系口腔外科教授金子明寛 今回は歯性感染症における経口抗菌薬療法と題し歯性感染症からの分離菌および薬 剤感受性を元に歯性感染症の第一選択薬についてお話し致します 抗菌化学療法のポイント歯性感染症原因菌は嫌気性菌および好
 2012 年 1 月 25 日放送 歯性感染症における経口抗菌薬療法 東海大学外科学系口腔外科教授金子明寛 今回は歯性感染症における経口抗菌薬療法と題し歯性感染症からの分離菌および薬 剤感受性を元に歯性感染症の第一選択薬についてお話し致します 抗菌化学療法のポイント歯性感染症原因菌は嫌気性菌および好気性菌の複数菌感染症です 嫌気性菌の占める割合が 高くおよそ 2:1 の頻度で検出されます 嫌気性菌では
2012 年 1 月 25 日放送 歯性感染症における経口抗菌薬療法 東海大学外科学系口腔外科教授金子明寛 今回は歯性感染症における経口抗菌薬療法と題し歯性感染症からの分離菌および薬 剤感受性を元に歯性感染症の第一選択薬についてお話し致します 抗菌化学療法のポイント歯性感染症原因菌は嫌気性菌および好気性菌の複数菌感染症です 嫌気性菌の占める割合が 高くおよそ 2:1 の頻度で検出されます 嫌気性菌では
モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全
 モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
モビコール配合内用剤 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 モビコール 配合内用剤に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 モビコール 配合内用剤 有効成分 マクロゴール4000 塩化ナトリウム 炭酸水素ナトリウム 塩化カリウム
中心傾向の解析 ΔΔQTcF は 投与開始後 1 時間で最も大きく 3.4 msec となり その後はより小さな値で推移し 投与開始 8 時間以降では群間の差がほとんどなかった カテゴリカル解析 QT 間隔の絶対値が 1 回以上 450 msec を超えた被験者数は
 8.5.2 薬力学 8.5.2.1 主要解析項目 t max 時の ΔQT/QTc の最小二乗平均値とその差を表 2.7.6.8.5-2 に示す t max 時の ΔQTcF の最小二乗平均値は レボフロキサシン群で 2.1 msec と延長 プラセボ群で 1.3 msec と短縮し t max 時の ΔΔQTcF は 3.4 msec( 片側 95%CI 上限 = 5.2 msec) であった なお
8.5.2 薬力学 8.5.2.1 主要解析項目 t max 時の ΔQT/QTc の最小二乗平均値とその差を表 2.7.6.8.5-2 に示す t max 時の ΔQTcF の最小二乗平均値は レボフロキサシン群で 2.1 msec と延長 プラセボ群で 1.3 msec と短縮し t max 時の ΔΔQTcF は 3.4 msec( 片側 95%CI 上限 = 5.2 msec) であった なお
目次.7.3(5 群 ) 呼吸器感染症臨床的有効性の概要....(5 群 ) 背景および概観....(5 群 ) 個々の試験結果の要約 (5 群 ) 全試験を通しての結果の比較と解析 (5 群 ) 試験対象集団 (5 群 ) 全有効性試験の結果の比較検討..
 シタフロキサシン水和物 グレースビット 錠 50 mg 細粒 0%.7.3(5 群 ) 呼吸器感染症 臨床的有効性の概要 第一三共株式会社 目次.7.3(5 群 ) 呼吸器感染症臨床的有効性の概要....(5 群 ) 背景および概観....(5 群 ) 個々の試験結果の要約... 3 3.(5 群 ) 全試験を通しての結果の比較と解析... 7 3.(5 群 ) 試験対象集団... 7 3.(5 群
シタフロキサシン水和物 グレースビット 錠 50 mg 細粒 0%.7.3(5 群 ) 呼吸器感染症 臨床的有効性の概要 第一三共株式会社 目次.7.3(5 群 ) 呼吸器感染症臨床的有効性の概要....(5 群 ) 背景および概観....(5 群 ) 個々の試験結果の要約... 3 3.(5 群 ) 全試験を通しての結果の比較と解析... 7 3.(5 群 ) 試験対象集団... 7 3.(5 群
抗菌薬の殺菌作用抗菌薬の殺菌作用には濃度依存性と時間依存性の 2 種類があり 抗菌薬の効果および用法 用量の設定に大きな影響を与えます 濃度依存性タイプでは 濃度を高めると濃度依存的に殺菌作用を示します 濃度依存性タイプの抗菌薬としては キノロン系薬やアミノ配糖体系薬が挙げられます 一方 時間依存性
 2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
<4D F736F F D B A814089FC92F982CC82A8926D82E782B95F E31328C8E5F5F E646F63>
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ 抗悪性腫瘍剤 ( ブルトン型チロシンキナーゼ阻害剤 ) ( 一般名 : イブルチニブ ) 2016 年 12 月 この度 抗悪性腫瘍剤 イムブルビカ カプセル 140 mg ( 以下標記製品 ) につきまして 再発又は難治性のマントル細胞リンパ腫 の効能追加承認を取得したことに伴い
Microsoft Word - todaypdf doc
 2014 年 4 月 9 日放送 急性急性胆管胆管炎 胆嚢炎胆嚢炎診療診療ガイドライン 2013 の活用法活用法 帝京大学外科准教授三浦文彦はじめに 2013 年 1 月に改訂 出版された急性胆管炎 胆嚢炎診療ガイドライン (Tokyo Guidelines 2013 以下 TG13) について お話しさせていただきます 急性胆管炎 胆嚢炎診療ガイドラインは 2005 年 9 月に日本語版第 1 版が
2014 年 4 月 9 日放送 急性急性胆管胆管炎 胆嚢炎胆嚢炎診療診療ガイドライン 2013 の活用法活用法 帝京大学外科准教授三浦文彦はじめに 2013 年 1 月に改訂 出版された急性胆管炎 胆嚢炎診療ガイドライン (Tokyo Guidelines 2013 以下 TG13) について お話しさせていただきます 急性胆管炎 胆嚢炎診療ガイドラインは 2005 年 9 月に日本語版第 1 版が
糖尿病経口薬 QOL 研究会研究 1 症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12
 症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12 患者背景同意取得時から試験開始までの状況について記入 性別 男 女 年齢生年月日 歳 西暦年月日 身長. cm 体重. kg 腹囲. cm 糖尿病罹病期間 西暦年月 ~ 現在 喫煙 合併症 あり なし飲酒 あり
症例報告書 新規 2 型糖尿病患者に対する経口糖尿病薬クラス別の治療効果と QOL の相関についての臨床試験 施設名医師氏名割付群記入年月日 症例登録番号 / 被験者識別コード / 1/12 患者背景同意取得時から試験開始までの状況について記入 性別 男 女 年齢生年月日 歳 西暦年月日 身長. cm 体重. kg 腹囲. cm 糖尿病罹病期間 西暦年月 ~ 現在 喫煙 合併症 あり なし飲酒 あり
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに
 ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
RA に対する長期投与試験 [RLN3] 13/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(2) 全症例 YM mg BID 投与時 YM mg BID 以上増量時 自律神経系障害 8(5.1%)[8] 2(
![RA に対する長期投与試験 [RLN3] 13/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(2) 全症例 YM mg BID 投与時 YM mg BID 以上増量時 自律神経系障害 8(5.1%)[8] 2( RA に対する長期投与試験 [RLN3] 13/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(2) 全症例 YM mg BID 投与時 YM mg BID 以上増量時 自律神経系障害 8(5.1%)[8] 2(](/thumbs/92/108546146.jpg) 2.7.6.43 RA に対する長期投与試験 [RLN3] 12/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(1) 全症例 YM177 200mg BID 投与時 関連性が否定できない害事象 YM177 300mg BID 以上増量時 安全性解析対象例数 156 156 45 全事象 135(86.5%)[412]37(23.7%)[50]122(78.2%)[325]31(19.9%)[41]
2.7.6.43 RA に対する長期投与試験 [RLN3] 12/26 投与群 WHO ART 器官別大分類基本語 有害事象の発現率 ( 安全性解析対象例 )(1) 全症例 YM177 200mg BID 投与時 関連性が否定できない害事象 YM177 300mg BID 以上増量時 安全性解析対象例数 156 156 45 全事象 135(86.5%)[412]37(23.7%)[50]122(78.2%)[325]31(19.9%)[41]
葉酸とビタミンQ&A_201607改訂_ indd
 L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
L FO AT E VI TAMI NB12 医療関係者用 葉酸 とビタミンB ビタミンB12 アリムタ投与に際して 警告 1 本剤を含むがん化学療法に際しては 緊急時に十分対応できる医療施設において がん化学療 法に十分な知識 経験を持つ医師のもとで 本剤の投与が適切と判断される症例についてのみ投 与すること 適応患者の選択にあたっては 各併用薬剤の添付文書を参照して十分注意すること また 治療開始に先立ち
日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI 関連の企業などはありません
 医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
医薬品副作用データベース (JADER) を用いた市販後の副作用発現状況の検討 加藤祐太 1)2) 岸達生 3) 高松昭司 2) 白石正 4) 1) 山形大学医学部医薬品医療機器評価学講座 2) 医薬品医療機器総合機構安全第二部 3) 医薬品医療機器総合機構信頼性保証部 4) 山形大学医学部附属病院薬剤部 日本医薬品安全性学会 COI 開示 筆頭発表者 : 加藤祐太 演題発表に関連し 開示すべき COI
スライド 1
 感染と CRP 感染と CRP メニュー 1.Sepsis 1 診断的 価値 Intensive Care Med 2002 2 重症度 3 治療効果 予後判定 判定 Crit Care 2011 Infection 2008 2.ICU Patients 3.VAP Crit Care 2006 Chest 2003 Crit Care Med 2002 Heart & Lung 2011
感染と CRP 感染と CRP メニュー 1.Sepsis 1 診断的 価値 Intensive Care Med 2002 2 重症度 3 治療効果 予後判定 判定 Crit Care 2011 Infection 2008 2.ICU Patients 3.VAP Crit Care 2006 Chest 2003 Crit Care Med 2002 Heart & Lung 2011
医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1
 医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1 顆粒球コロニー刺激因子 (Granulocyte Colony-Stimulating Factor: G-CSF) 一般名 : フィルグラスチム 調達法 国内企業より無償提供 製造元または供給元の名称協和発酵キリン
医師主導治験 急性脊髄損傷患者に対する顆粒球コロニー刺激因子を用いたランダム化 プラセボ対照 二重盲検並行群間比較試験第 III 相試験 千葉大学大学院医学研究院整形外科 千葉大学医学部附属病院臨床試験部 1 顆粒球コロニー刺激因子 (Granulocyte Colony-Stimulating Factor: G-CSF) 一般名 : フィルグラスチム 調達法 国内企業より無償提供 製造元または供給元の名称協和発酵キリン
目次 C O N T E N T S 1 下痢等の胃腸障害 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副
 目次 C O N T E N T S 1 下痢等の胃腸障害 3 1.1 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 5 1.2 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副作用発現状況 6 胃腸障害に関連する重篤な副作用発現症例 6 1.3 消化性潰瘍, 炎症性腸疾患等の胃腸疾患のある患者さんにおける安全性について
目次 C O N T E N T S 1 下痢等の胃腸障害 3 1.1 下痢について 3 下痢の副作用発現状況 3 最高用量別の下痢の副作用発現状況 3 下痢の程度 4 下痢の発現時期 4 下痢の回復時期 5 下痢による投与中止時期 5 1.2 下痢以外の胃腸障害について 6 下痢以外の胃腸障害の副作用発現状況 6 胃腸障害に関連する重篤な副作用発現症例 6 1.3 消化性潰瘍, 炎症性腸疾患等の胃腸疾患のある患者さんにおける安全性について
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国ま
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください AD-4833MET/CCT-001 治験総括報告書初版
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください AD-4833MET/CCT-001 治験総括報告書初版
あった AUCtはで ± ng hr/ml で ± ng hr/ml であった 2. バイオアベイラビリティの比較およびの薬物動態パラメータにおける分散分析の結果を Table 4 に示した また 得られた AUCtおよび Cmaxについてとの対数値
 モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
菌種 報告年 株数 MIC(μg/mL) Range MIC50 MIC > ( 幾何平均 ) C.tropicalis >
 生物学的同等性試験におけるイトリゾール カプセル 50 のロット間での統計学 的有意差が本剤の有効性及び安全性に与える影響について イトリゾール カプセル 50 は,1993 年に内臓真菌症 ( 深在性真菌症 ), 深在性皮膚真菌症及び表在性皮膚真菌症を適応症として承認され, その後,1999 年に爪白癬等の適応を追加,2004 年及び 2006 年にはそれぞれ爪白癬のパルス療法および注射剤からの切り替えとしての新用法
生物学的同等性試験におけるイトリゾール カプセル 50 のロット間での統計学 的有意差が本剤の有効性及び安全性に与える影響について イトリゾール カプセル 50 は,1993 年に内臓真菌症 ( 深在性真菌症 ), 深在性皮膚真菌症及び表在性皮膚真菌症を適応症として承認され, その後,1999 年に爪白癬等の適応を追加,2004 年及び 2006 年にはそれぞれ爪白癬のパルス療法および注射剤からの切り替えとしての新用法
Microsoft Word - JAID_JSC 2014 正誤表_ 原稿
 JAID/JSC 感染症治療ガイド 2014 表 記載にりがありましたので, 下記のように追加 訂させていただきます 2016 年 9 月 JAID/JSC 感染症治療ガイド ガイドライン作成委員会 P106 Ⅶ 呼吸器感染症,A-2 院内肺炎 3 Definitive Therapy P. aeruginosa 多剤耐性の場合 CL:5mg/kg 1 回ローディング その 24 時間後に以下の維持用量を開始する
JAID/JSC 感染症治療ガイド 2014 表 記載にりがありましたので, 下記のように追加 訂させていただきます 2016 年 9 月 JAID/JSC 感染症治療ガイド ガイドライン作成委員会 P106 Ⅶ 呼吸器感染症,A-2 院内肺炎 3 Definitive Therapy P. aeruginosa 多剤耐性の場合 CL:5mg/kg 1 回ローディング その 24 時間後に以下の維持用量を開始する
(Microsoft PowerPoint - \201iweb\214\374\201j2009_11 \222\307\225\342\225i\224\255\224\204\210\304\223\340.PPT)
 平成 21 年 11 月 13 日 Drug Information 平成 21 年 11 月度追補品販売のごのご案内 謹啓時下ますますご清栄のこととお慶び申し上げます 平素は 格別のご高配を賜り 厚く御礼申し上げます さて この度平成 21 年 11 月 13 日付官報にて アムロジピン OD 錠 2.5mg 5mg KRM サルポグレラートサルポグレラート塩酸塩錠 50mg 100mg KRM
平成 21 年 11 月 13 日 Drug Information 平成 21 年 11 月度追補品販売のごのご案内 謹啓時下ますますご清栄のこととお慶び申し上げます 平素は 格別のご高配を賜り 厚く御礼申し上げます さて この度平成 21 年 11 月 13 日付官報にて アムロジピン OD 錠 2.5mg 5mg KRM サルポグレラートサルポグレラート塩酸塩錠 50mg 100mg KRM
2.0 概要治験情報 : 治験依頼者名 : 武田薬品工業株式会社 大阪市中央区道修町四丁目 1 番 1 号 治験課題名 : 健康成人男性を対象に TAK-536TCH の最終製剤を単回経口投与したときの食事の影響を検討する第 1 相無作為化非盲検クロスオーバー試験 治験課題名の短縮
 この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要治験情報 : 治験依頼者名 : 武田薬品工業株式会社
この試験情報は一般公開のみを目的に作成されたものです この試験情報はあくまで単一の試験から得られた結果であり この試験の医薬品から得られるすべての情報を基にした全体的なベネフィットとリスクを反映したものではない可能性があります 医療関係者の皆様は 武田薬品の医薬品のご使用にあたり 必ずそれぞれの国または地域の添付文書の情報を必ず確認してください 2.0 概要治験情報 : 治験依頼者名 : 武田薬品工業株式会社
試験デザイン :n=152 試験開始前に第 VIII 因子製剤による出血時止血療法を受けていた患者群を 以下のい ずれかの群に 2:2:1 でランダム化 A 群 (n=36) (n=35) C 群 (n=18) ヘムライブラ 3 mg/kg を週 1 回 4 週間定期投与し その後 1.5 mg/k
 各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
各位 2018 年 5 月 21 日 ヘムライブラ の 2 本の第 III 相国際共同治験の成績を世界血友病連盟 (WFH)2018 世界大会で発表 中外製薬株式会社 ( 本社 : 東京 代表取締役社長 CEO: 小坂達朗 ) は 血友病 A 治療薬ヘムライブラ [ 一般名 : エミシズマブ ( 遺伝子組換え )] について 第 III 相国際共同治験である HAVEN 3 試験 (NCT02847637)
1. 医薬品リスク管理計画を策定の上 適切に実施すること 2. 国内での治験症例が極めて限られていることから 製造販売後 一定数の症例に係るデータが集積されるまでの間は 全 症例を対象に使用成績調査を実施することにより 本剤使用患者の背景情報を把握するとともに 本剤の安全性及び有効性に関するデータを
 薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
薬生薬審発 0525 第 3 号薬生安発 0525 第 1 号平成 30 年 5 月 25 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局医薬品審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局医薬安全対策課長 ( 公印省略 ) トファシチニブクエン酸塩製剤の使用に当たっての留意事項について トファシチニブクエン酸塩製剤 ( 販売名 : ゼルヤンツ錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠 50mg 医薬品リスク管理計画書 (RMP) の概要 有効成分 タペンタ 錠 100mg 製造販売業者 ヤンセンファーマ株式会社 薬効分類 821 提出年月 平成 30 年
 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任はヤンセンファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ヤンセンファーマ株式会社 タペンタ 錠 25mg タペンタ 錠 50mg タペンタ 錠 100mg に係る 販売名 タペンタ 錠 25mg タペンタ 錠
 一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
一般名 : オファツムマブ ( 遺伝子組換え ) 製剤 はじめに ( 適正使用に関するお願い )4 治療スケジュール6 投与に際しての注意事項 7 7 8 8 9 1 1 11 12 13 14 15 重大な副作用とその対策 18 18 28 32 34 36 4 42 44 45 参考資料 5 付録 55 55 55 64 3 1 はじめに4 はじめ 5 に1 2 治療スケジュール6 対象患者の選択インフォームドコンセント投与準備
改訂の理由及び調査の結果直近 3 年度の国内副作用症例の集積状況 転帰死亡症例 国内症例が集積したことから専門委員の意見も踏まえた調査の結果 改訂することが適切と判断した 低カルニチン血症関連症例 16 例 死亡 0 例
 ピボキシル基を有する抗菌薬の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1セフカペンピボキシ 1フロモックス小児用細粒 100mg 同錠ル塩酸塩水和物 75mg 同錠 100mg( 塩野義製薬株式 2セフジトレンピボキ会社 ) 他シル 2メイアクト MS 小児用細粒 10% 同 3セフテラムピボキシ MS 錠 100mg(Meiji Seika
ピボキシル基を有する抗菌薬の 使用上の注意 の改訂について 成分名該当商品名効能 効果改訂の概要 成分名該当商品名 ( 承認取得者 ) 1セフカペンピボキシ 1フロモックス小児用細粒 100mg 同錠ル塩酸塩水和物 75mg 同錠 100mg( 塩野義製薬株式 2セフジトレンピボキ会社 ) 他シル 2メイアクト MS 小児用細粒 10% 同 3セフテラムピボキシ MS 錠 100mg(Meiji Seika
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
<4D F736F F D2089BB8A7797C C B B835888E790AC8C7689E6>
 2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
2012 年 4 月更新作成者 : 宇根底亜希子 化学療法看護エキスパートナース育成計画 1. 目的江南厚生病院に通院あるいは入院しているがん患者に質の高いケアを提供できるようになるために 看護師が化学療法分野の知識や技術を習得することを目的とする 2. 対象者 1 ) レベル Ⅱ 以上で各分野の知識と技術習得を希望する者 2 ) 期間中 80% 以上参加できる者 3. 教育期間 時間間 1 年間の継続教育とする
糖尿病診療における早期からの厳格な血糖コントロールの重要性
 2019 年 2 月 13 日放送 ESBL 産生菌と尿路感染症の治療戦略 岡山大学病院泌尿器科講師和田耕一郎はじめに私が頂きましたテーマは ESBL 産生菌と尿路感染症の治療戦略 です これから ESBL 産生菌の分離状況や薬剤感受性 さらに岡山大学病院泌尿器科における抗菌薬の使用例について紹介したいと思います 尿路感染症を取り巻く状況まず 尿路感染症を取り巻く状況について説明します 近年 各種抗菌薬に耐性を示す細菌の増加が国内外で大きな問題となっていることに加えて
2019 年 2 月 13 日放送 ESBL 産生菌と尿路感染症の治療戦略 岡山大学病院泌尿器科講師和田耕一郎はじめに私が頂きましたテーマは ESBL 産生菌と尿路感染症の治療戦略 です これから ESBL 産生菌の分離状況や薬剤感受性 さらに岡山大学病院泌尿器科における抗菌薬の使用例について紹介したいと思います 尿路感染症を取り巻く状況まず 尿路感染症を取り巻く状況について説明します 近年 各種抗菌薬に耐性を示す細菌の増加が国内外で大きな問題となっていることに加えて
ィニバックス点滴静注用 0.25 g 同キット点滴静注用 0.25 g に変更された ( 平成 23 年 6 月 7 日 ) 注 2) 新規有効成分含有医薬品の再審査期間について に係る通知 ( 平成 19 年 4 月 1 日付け薬食発第 号 ) に基づき 0.25 g 製剤の再審査
 再審査報告書 平成 29 年 10 月 23 日医薬品医療機器総合機構 販 売 1) 名注 フィニバックス点滴静注用 0.25 g 同点滴静注用 0.5 g 同キット点滴静注用 0.25 g 有 効 成 分 名 ドリペネム水和物 申 請 者 名 塩野義製薬株式会社 承認の効能 効果 承認の用法 用量 承認年月日承認事項一部変更承認年月日 再審査期間 1. 8 年注 2) 備考 < 適応菌種 > ドリペネムに感性のブドウ球菌属
再審査報告書 平成 29 年 10 月 23 日医薬品医療機器総合機構 販 売 1) 名注 フィニバックス点滴静注用 0.25 g 同点滴静注用 0.5 g 同キット点滴静注用 0.25 g 有 効 成 分 名 ドリペネム水和物 申 請 者 名 塩野義製薬株式会社 承認の効能 効果 承認の用法 用量 承認年月日承認事項一部変更承認年月日 再審査期間 1. 8 年注 2) 備考 < 適応菌種 > ドリペネムに感性のブドウ球菌属
(別添様式)
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名 要望された医薬品 ユーシービージャパン株式会社要望番号 Ⅱ-254.2 成分名 Lacosamide ( 一般名 ) Vimpat 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) 未承認薬 適応外薬 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作
Microsoft Word _2180AMY10104_K104_1.doc
 アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
アボネックス 筋注用シリンジ ( インターフェロン β-1a) 第 2 部 CTD 概要 ジェンザイム ジャパン株式会社 目次 2.7.6.1 個々の試験の一覧... 1 2.7.6.2 個々の試験の概要 2.7.6.2.1 試験 C90-042 の概要外国人健康志願者における IFNβ-1a(XG90xx) の用量漸増試験 ( 試験報告書 5.3.1.1-1)... 7 2.7.6.2.2 試験
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 <その他分野 ( 消化器官用薬 解毒剤 その他 )> 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号
 資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
資料 3 1 医療上の必要性に係る基準 への該当性に関する専門作業班 (WG) の評価 < 代謝 その他 WG> 目次 小児分野 医療上の必要性の基準に該当すると考えられた品目 との関係本邦における適応外薬ミコフェノール酸モフェチル ( 要望番号 ;II-231) 1 医療上の必要性の基準に該当しないと考えられた品目 本邦における適応外薬ミコフェノール酸モフェチル
‡BUNITE_Studyƒv?ƒgƒR??−iFinal_Ver_−j _docx
 調査実施計画書 経口糖尿病治療薬 ( インクレチン関連薬関連薬を含む ) 投与に関する実態調査研究 UNITE Study (Use of a New and Innovative Therapy for diabetes: Evaluation study) 社団法人日本糖尿病協会 第 1.0 版 2010 年 3 月作成 目次 1. 研究の概要 1 2. はじめに 3 3. 調査の目的 3 4.
調査実施計画書 経口糖尿病治療薬 ( インクレチン関連薬関連薬を含む ) 投与に関する実態調査研究 UNITE Study (Use of a New and Innovative Therapy for diabetes: Evaluation study) 社団法人日本糖尿病協会 第 1.0 版 2010 年 3 月作成 目次 1. 研究の概要 1 2. はじめに 3 3. 調査の目的 3 4.
ハイゼントラ20%皮下注1g/5mL・2g/10mL・4g/20mL
 CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
CSL19-158 医薬品の適正使用に欠かせない情報です 必ずお読みください 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 2019 年 3 月血漿分画製剤 ( 皮下注用人免疫グロブリン製剤 ) この度 標記製品の製造販売承認事項の一部変更が承認されました それに伴い 効能又は効果 用法及び用量 及び 使用上の注意 等を改訂いたしましたので お知らせいたします 改訂添付文書を封入した製品がお手元に届くまでには若干の日時を要しますので
untitled
 1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
1 2 重要ポイント 臨床試験研究費 ( 治験薬管理費を含む ) は 試験デザイン 治験薬投与期間 検査項目数などの治験内容に基づき 各ポイントの合計により算出されます 以下について 事前に治験依頼者と協議し 契約書を締結する必要があります 各金額 支払い時期 支払方法 被験者負担軽減費 保険外併用療養費支給対象外費の適用範囲等併せて 各部門や他科へ研究費の配分がある場合 追加請求が発生しないよう契約締結までに確認が必要です
レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14 回 製造販売業者 EA ファーマ株式会社 薬効分類 提出年月 平成 29 年 10 月 1.1. 安全性検討事項 重要な特
 レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
レクタブル 2mg 注腸フォーム 14 回 に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はEAファーマ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません EA ファーマ株式会社 レクタブル 2 mg 注腸フォーム 14 回に係る医薬品リスク管理計画書 (RMP) の概要 販売名 レクタブル 2 mg 注腸フ 有効成分 ブデソニド ォーム14
Microsoft Word - sa_niflec_ doc
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 効能又は効果 用法及び用量 使用上の注意改訂のお知らせ 経口腸管洗浄剤 発売 2009 年 4 月 製造販売 この度 経口腸管洗浄剤ニフレック 内用において 効能又は効果 用法及び用量 の追加承認を取得したことに伴い 添付文書を以下のとおり改訂致しましたのでご案内申し上げます 今後のご使用につきましては 下記内容をご参照下さいますようお願い申し上げます
モニタリング計画書・報告書
 0 ... 2... 2... 2... 3 4.1.... 3 4.1.1.... 3 4.1.2.... 4 4.1.3.... 4 4.1.4.... 5 4.2.... 5 4.3.... 6 4.4.... 6... 6 5.1.... 6 5.1.1.... 7 5.1.2.... 8 5.1.3.... 9 5.1.4.... 9 5.2.... 15 5.2.1.... 15 5.2.2....
0 ... 2... 2... 2... 3 4.1.... 3 4.1.1.... 3 4.1.2.... 4 4.1.3.... 4 4.1.4.... 5 4.2.... 5 4.3.... 6 4.4.... 6... 6 5.1.... 6 5.1.1.... 7 5.1.2.... 8 5.1.3.... 9 5.1.4.... 9 5.2.... 15 5.2.1.... 15 5.2.2....
Microsoft PowerPoint - 薬物療法専門薬剤師制度_症例サマリー例_HP掲載用.pptx
 薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
薬物療法専門薬剤師の申請 及び症例サマリーに関する Q&A 注意 : 本 Q&A の番号は独立したものであり 医療薬学会 HP にある 薬物療法専門薬剤師制度の Q&A の番号と関連性はありません 薬物療法専門薬剤師認定制度の目的 幅広い領域の薬物療法 高い水準の知識 技術及び臨床能力を駆使 他の医療従事者と協働して薬物療法を実践 患者に最大限の利益をもたらす 国民の保健 医療 福祉に貢献することを目的
GCP 遵守の陳述本治験は, ヘルシンキ宣言 に基づく倫理的原則, 薬事法第 14 条第 3 項, 第 80 条の 2 に規定する基準, 並びに医薬品の臨床試験の実施の基準に関する省令 ( 平成 9 年 3 月 27 日付厚生省令第 28 号 ) を遵守して実施された すべての治験にかかわる文書,
 1. 標題ページ 治験の標題 E3810 臨床第 Ⅲ 相試験 非びらん性胃食道逆流症 治験総括報告書 非びらん性胃食道逆流症患者を対象とした E3810 の有効性と安全性を検討するプラセボ対照の二重盲検比較試験 治験薬名 E3810[ 一般名 : ] 対象疾患 デザイン比較目的 期間 用量 被験者母集団治験依頼者治験実施計画書番号開発のフェーズ 非びらん性胃食道逆流症 多施設共同無作為化二重盲検比較試験プラセボ非びらん性胃食道逆流症患者を対象として,E3810
1. 標題ページ 治験の標題 E3810 臨床第 Ⅲ 相試験 非びらん性胃食道逆流症 治験総括報告書 非びらん性胃食道逆流症患者を対象とした E3810 の有効性と安全性を検討するプラセボ対照の二重盲検比較試験 治験薬名 E3810[ 一般名 : ] 対象疾患 デザイン比較目的 期間 用量 被験者母集団治験依頼者治験実施計画書番号開発のフェーズ 非びらん性胃食道逆流症 多施設共同無作為化二重盲検比較試験プラセボ非びらん性胃食道逆流症患者を対象として,E3810
D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体 (S- 体 ) のみを含有するプロトンポンプ阻害剤である ネキシウム (D961H の日本における販売名 ) 錠 20 mg 及び 40 mg は を対象として
 第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
第 2 部 CTD の概要 一般名 : エソメプラゾールマグネシウム水和物 版番号 : 2.2 緒言 ネキシウム カプセル ネキシウム 懸濁用顆粒分包 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています D961H は AstraZeneca R&D Mӧlndal( スウェーデン ) において開発された オメプラゾールの一方の光学異性体
Microsoft Word - LIA RMP_概要ver2.docx
 リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
リアルダ錠 1200mg に係る 医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任は持田製薬株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 持田製薬株式会社 リアルダ錠 1200mg に係る医薬品リスク管理計画書 (RMP) の概要 販売名リアルダ錠 1200mg 有効成分メサラジン 製造販売業者持田製薬株式会社薬効分類 872399 提出年月
膿疱性乾癬の効能追加 ( 承認事項の 部変更承認 ) に伴う改訂 改訂内容 ( 該当部のみ抜粋 ) 警告 1.~3. 4. 関節リウマチ患者では, 本剤の治療を行う前に, 少なくとも 1 剤の抗リウマチ薬等の使用を十分勘案すること. また, 本剤についての十分な知識とリウマチ治療の経験をもつ医師が使
 - 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
- 医薬品の適正使 に かせない情報です 必ずお読みください - 添付文書改訂のお知らせ 注 ) 物由来製品 劇薬 処 箋医薬品 2018 年 3-4 月 この度 新たな効能として膿疱性乾癬が承認され (20mg 製剤を除く ) これに伴い添付文書 ( 効能 効果 用法 用量 使用上の注意 等 ) を改訂致しました 今後のご使用に際しましては 以下の内容をご参照くださいますようお願い申し上げます なお
はじめに この 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 は を服用される患者さんが 服用状況 体調の変化 検査結果の経過などを記録するための冊子です は 催奇形性があり サリドマイドの同類薬です は 胎児 ( お腹の赤ちゃん ) に障害を起こす可能性があります 生まれてくる赤ちゃんに
 を服用される方へ 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 使用開始日年月日 ( 冊目 ) はじめに この 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 は を服用される患者さんが 服用状況 体調の変化 検査結果の経過などを記録するための冊子です は 催奇形性があり サリドマイドの同類薬です は 胎児 ( お腹の赤ちゃん ) に障害を起こす可能性があります 生まれてくる赤ちゃんに被害を及ぼすことがないよう
を服用される方へ 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 使用開始日年月日 ( 冊目 ) はじめに この 成人 T 細胞白血病リンパ腫 (ATLL) の治療日記 は を服用される患者さんが 服用状況 体調の変化 検査結果の経過などを記録するための冊子です は 催奇形性があり サリドマイドの同類薬です は 胎児 ( お腹の赤ちゃん ) に障害を起こす可能性があります 生まれてくる赤ちゃんに被害を及ぼすことがないよう
改訂後改訂前 << 効能 効果に関連する使用上の注意 >> 関節リウマチ 1. 過去の治療において 少なくとも1 剤の抗リウマチ薬 ( 生物製剤を除く ) 等による適切な治療を行っても 疾患に起因する明らかな症状が残る場合に投与すること 2. 本剤とアバタセプト ( 遺伝子組換え ) の併用は行わな
 - 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
- 医薬品の適正使用に欠かせない情報です 必ずお読み下さい - 警告 効能 効果 用法 用量 使用上の注意 等改訂のお知らせ ヒト型抗ヒト TNFα モノクローナル抗体製剤 ( 一般名 : ゴリムマブ ( 遺伝子組換え )) 2017 年 4 月 製造販売元ヤンセンファーマ株式会社発売元田辺三菱製薬株式会社 この度 標記製品 ( 以下 本剤 ) シンポニー 皮下注 50mg シリンジ ( 一般名 :
第1回肝炎診療ガイドライン作成委員会議事要旨(案)
 資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
資料 1 C 型慢性肝疾患 ( ゲノタイプ 1 型 2 型 ) に対する治療フローチャート ダクラタスビル + アスナプレビル併用療法 ソホスブビル + リバビリン併用療法 ソホスブビル / レジパスビル併用療法 オムビタスビル / パリタプレビル / リトナビル併用療法 (± リバビリン ) エルバスビル + グラゾプレビル併用療法 ダクラタスビル / アスナプレビル / ベクラブビル 3 剤併用療法による抗ウイルス治療に当たっては
2012 年 2 月 29 日放送 CLSI ブレイクポイント改訂の方向性 東邦大学微生物 感染症学講師石井良和はじめに薬剤感受性試験成績を基に誰でも適切な抗菌薬を選択できるように考案されたのがブレイクポイントです 様々な国の機関がブレイクポイントを提唱しています この中でも 日本化学療法学会やアメ
 2012 年 2 月 29 日放送 CLSI ブレイクポイント改訂の方向性 東邦大学微生物 感染症学講師石井良和はじめに薬剤感受性試験成績を基に誰でも適切な抗菌薬を選択できるように考案されたのがブレイクポイントです 様々な国の機関がブレイクポイントを提唱しています この中でも 日本化学療法学会やアメリカ臨床検査標準委員会 :Clinical and Laboratory Standards Institute
2012 年 2 月 29 日放送 CLSI ブレイクポイント改訂の方向性 東邦大学微生物 感染症学講師石井良和はじめに薬剤感受性試験成績を基に誰でも適切な抗菌薬を選択できるように考案されたのがブレイクポイントです 様々な国の機関がブレイクポイントを提唱しています この中でも 日本化学療法学会やアメリカ臨床検査標準委員会 :Clinical and Laboratory Standards Institute
PowerPoint プレゼンテーション
 アトピー性皮膚炎患者を対象とした鶏冠由来食用ヒアルロン酸 ECM E の有効性についての多施設共同並行群間二重盲検比較による経口投与食品試験 林博道 (1 1), 浦川徹 (1 2), 呉成浩 (2), 吉田均 (3 1), 安藤晃禎 (3 2), 木許泉 (4) アダプトゲン製薬株式会社代表取締役 (1 1) プロジェクトマネージャー (1 2) 三本木クリニック院長兼臨床試験責任医師 (2) 医療法人メドック健康クリニック院長兼臨床試験責任医師
アトピー性皮膚炎患者を対象とした鶏冠由来食用ヒアルロン酸 ECM E の有効性についての多施設共同並行群間二重盲検比較による経口投与食品試験 林博道 (1 1), 浦川徹 (1 2), 呉成浩 (2), 吉田均 (3 1), 安藤晃禎 (3 2), 木許泉 (4) アダプトゲン製薬株式会社代表取締役 (1 1) プロジェクトマネージャー (1 2) 三本木クリニック院長兼臨床試験責任医師 (2) 医療法人メドック健康クリニック院長兼臨床試験責任医師
重篤な副作用は 自然流産の 1 例 1 件であった 本症例は 本剤服用後も性交があり どの時点での妊娠か判断できず 本剤と自然流産との関連は評価できないと考えた 非重篤な副作用のうち 使用上の注意から予測できない副作用は 腹部膨満及び月経困難症各 2 件 腹部不快感 口内炎 ざ瘡 尿臭異常 月経障害
 再審査報告書 販 売 名ノルレボ錠 0.75 mg 有 効 成 分 名レボノルゲストレル 申 請 者 名あすか製薬株式会社 承 認 の 緊急避妊 効 能 効 果 承 認 の 用 法 用 量 承 認 年 月 日平成 23 年 2 月 23 日 再 審 査 期 間 4 年 備 考 平成 28 年 5 月 13 日 医薬品医療機器総合機構 性交後 72 時間以内にレボノルゲストレルとして 1.5 mg を
再審査報告書 販 売 名ノルレボ錠 0.75 mg 有 効 成 分 名レボノルゲストレル 申 請 者 名あすか製薬株式会社 承 認 の 緊急避妊 効 能 効 果 承 認 の 用 法 用 量 承 認 年 月 日平成 23 年 2 月 23 日 再 審 査 期 間 4 年 備 考 平成 28 年 5 月 13 日 医薬品医療機器総合機構 性交後 72 時間以内にレボノルゲストレルとして 1.5 mg を
スライド 1
 薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
薬生審査発 0328 第 1 号薬生安発 0328 第 2 号平成 28 年 3 月 28 日 都道府県各保健所設置市衛生主管部 ( 局 ) 長殿特別区 厚生労働省医薬 生活衛生局審査管理課長 ( 公印省略 ) 厚生労働省医薬 生活衛生局安全対策課長 ( 公印省略 ) ビガバトリン製剤の使用に当たっての留意事項について ビガバトリン製剤 ( 販売名 : サブリル散分包 500mg 以下 本剤 という
 エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
エムプリシティ点滴静注用 300 mg エムプリシティ点滴静注用 400 mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容についての責任はブリストル マイヤーズスクイブ株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません ブリストル マイヤーズスクイブ株式会社 医薬品リスク管理計画書 平成 29 年 10 月 16 日 独立行政法人医薬品医療機器総合機構理事長殿
より詳細な情報を望まれる場合は 担当の医師または薬剤師におたずねください また 患者向医薬品ガイド 医療専門家向けの 添付文書情報 が医薬品医療機器総合機構のホームページに掲載されています
 くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
くすりのしおり内服剤 2014 年 6 月作成薬には効果 ( ベネフィット ) だけでなく副作用 ( リスク ) があります 副作用をなるべく抑え 効果を最大限に引き出すことが大切です そのために この薬を使用される患者さんの理解と協力が必要です 商品名 : バルサルタン錠 20mg AA 主成分 : バルサルタン (Valsartan) 剤形 : 淡黄色の錠剤 直径約 7.2mm 厚さ約 3.1mm
Microsoft Word - 届出基準
 第 4 三類感染症 1 コレラ (1) 定義コレラ毒素 (CT) 産生性コレラ菌 (Vibrio cholerae O1) 又は V. cholerae O139 による急性感染性腸炎である (2) 臨床的特徴潜伏期間は数時間から 5 日 通常 1 日前後である 近年のエルトールコレラは軽症の水様性下痢や軟で経過することが多いが まれに 米のとぎ汁 様の臭のない水様を 1 日数リットルから数十リットルも排泄し
第 4 三類感染症 1 コレラ (1) 定義コレラ毒素 (CT) 産生性コレラ菌 (Vibrio cholerae O1) 又は V. cholerae O139 による急性感染性腸炎である (2) 臨床的特徴潜伏期間は数時間から 5 日 通常 1 日前後である 近年のエルトールコレラは軽症の水様性下痢や軟で経過することが多いが まれに 米のとぎ汁 様の臭のない水様を 1 日数リットルから数十リットルも排泄し
2006 年 3 月 3 日放送 抗菌薬の適正使用 市立堺病院薬剤科科長 阿南節子 薬剤師は 抗菌薬投与計画の作成のためにパラメータを熟知すべき 最初の抗菌薬であるペニシリンが 実質的に広く使用されるようになったのは第二次世界大戦後のことです それまで致死的な状況であった黄色ブドウ球菌による感染症に
 2006 年 3 月 3 日放送 抗菌薬の適正使用 市立堺病院薬剤科科長 阿南節子 薬剤師は 抗菌薬投与計画の作成のためにパラメータを熟知すべき 最初の抗菌薬であるペニシリンが 実質的に広く使用されるようになったのは第二次世界大戦後のことです それまで致死的な状況であった黄色ブドウ球菌による感染症に対して ペニシリンは劇的な効果を発揮しました しかし その後ペニシリンが広範囲に使用されたことによって
2006 年 3 月 3 日放送 抗菌薬の適正使用 市立堺病院薬剤科科長 阿南節子 薬剤師は 抗菌薬投与計画の作成のためにパラメータを熟知すべき 最初の抗菌薬であるペニシリンが 実質的に広く使用されるようになったのは第二次世界大戦後のことです それまで致死的な状況であった黄色ブドウ球菌による感染症に対して ペニシリンは劇的な効果を発揮しました しかし その後ペニシリンが広範囲に使用されたことによって
糖尿病診療における早期からの厳格な血糖コントロールの重要性
 2018 年 12 月 19 日放送 急性胆管炎 胆嚢炎診療ガイドライン 2018 国際医療福祉大学消化器外科教授吉田雅博ガイドラインの作成経過急性胆道感染症 ( 急性胆管炎 急性胆囊炎 ) は急性期に適切な対処が必要であり 特に 急性胆管炎 なかでも重症急性胆管炎では急性期に適切な診療が行われないと早期に死亡に至ることもあります これに対し 2005 年に出版されたガイドライン初版によって世界に向けて診断基準
2018 年 12 月 19 日放送 急性胆管炎 胆嚢炎診療ガイドライン 2018 国際医療福祉大学消化器外科教授吉田雅博ガイドラインの作成経過急性胆道感染症 ( 急性胆管炎 急性胆囊炎 ) は急性期に適切な対処が必要であり 特に 急性胆管炎 なかでも重症急性胆管炎では急性期に適切な診療が行われないと早期に死亡に至ることもあります これに対し 2005 年に出版されたガイドライン初版によって世界に向けて診断基準
2012 年 11 月 21 日放送 変貌する侵襲性溶血性レンサ球菌感染症 北里大学北里生命科学研究所特任教授生方公子はじめに b 溶血性レンサ球菌は 咽頭 / 扁桃炎や膿痂疹などの局所感染症から 髄膜炎や劇症型感染症などの全身性感染症まで 幅広い感染症を引き起こす細菌です わが国では 急速な少子
 2012 年 11 月 21 日放送 変貌する侵襲性溶血性レンサ球菌感染症 北里大学北里生命科学研究所特任教授生方公子はじめに b 溶血性レンサ球菌は 咽頭 / 扁桃炎や膿痂疹などの局所感染症から 髄膜炎や劇症型感染症などの全身性感染症まで 幅広い感染症を引き起こす細菌です わが国では 急速な少子 高齢化社会を迎えていますが 基礎疾患を有する人々の増加とともに これらの菌による市中での侵襲性感染症が再び増加しており
2012 年 11 月 21 日放送 変貌する侵襲性溶血性レンサ球菌感染症 北里大学北里生命科学研究所特任教授生方公子はじめに b 溶血性レンサ球菌は 咽頭 / 扁桃炎や膿痂疹などの局所感染症から 髄膜炎や劇症型感染症などの全身性感染症まで 幅広い感染症を引き起こす細菌です わが国では 急速な少子 高齢化社会を迎えていますが 基礎疾患を有する人々の増加とともに これらの菌による市中での侵襲性感染症が再び増加しており
「 」 説明および同意書
 EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
EDP( エトポシド + ドキソルビシン + シスプラチン ) 療法 説明および同意書 四国がんセンター泌尿器科 患者氏名 ( ) さん 御本人さんのみへの説明でよろしいですか? ( 同席者の氏名をすべて記載 ) ( ( はい ) ) < 病名 > 副腎がん 転移部位 ( ) < 治療 > EDP 療法 (E: エトポシド D: ドキソルビシン P: シスプラチン ) < 治療開始予定日 > 平成
た 18 歳以上の AD/HD 患者を対象に 日本人を含むアジア人によるプラセボ対照二重盲検比較試験及びその長期継続投与試験が現在実施されており 本剤の製造販売者によれば これらの試験成績に基づき 本剤の成人期 AD/HD 患者への追加適応に関する承認事項一部変更承認申請が行われる予定とされている
 ( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
( 別添 1) 平成 22 年 6 月 3 日薬事 食品衛生審議会医薬品第一部会資料 ( 抜粋 ) ストラテラカプセル 5mg 他の小児期 AD/HD 患者の成人期への 継続使用について 平成 22 年 6 月 3 日 医薬食品局審査管理課 1. 背景ストラテラカプセル 5mg 同 10mg 同 25mg( 以下 本剤 という ) は 小児期における注意欠陥 / 多動性障害 (AD/HD) の効能
Microsoft Word - 茬çfl�宛玺0618第1å‘·_æŠ¥èŒ¬é•£å®łã†¦é•ıç�¥ï¼‹ã…¡ã…‹ã…łã…«ã…�ㅳ;.doc
 薬生安発 0 6 1 8 第 1 号 令和元年 6 月 1 8 日 日本製薬団体連合会 安全性委員会委員長殿 厚生労働省医薬 生活衛生局医薬安全対策課長 使用上の注意 の改訂について 令和元年度第 3 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会 ( 令和元年 5 月 31 日開催 ) における審議結果等を踏まえ 医薬品の 使用上の注意 の改訂が必要と考えますので 下記のとおり必要な措置を講ずるよう関係業者に対し周知徹底方お願い申し上げます
薬生安発 0 6 1 8 第 1 号 令和元年 6 月 1 8 日 日本製薬団体連合会 安全性委員会委員長殿 厚生労働省医薬 生活衛生局医薬安全対策課長 使用上の注意 の改訂について 令和元年度第 3 回薬事 食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会 ( 令和元年 5 月 31 日開催 ) における審議結果等を踏まえ 医薬品の 使用上の注意 の改訂が必要と考えますので 下記のとおり必要な措置を講ずるよう関係業者に対し周知徹底方お願い申し上げます
2017 年 9 月 画像診断部 中央放射線科 造影剤投与マニュアル ver 2.0 本マニュアルは ESUR 造影剤ガイドライン version 9.0(ESUR: 欧州泌尿生殖器放射線学会 ) などを参照し 前マニュアルを改訂して作成した ( 前マニュアル作成 2014 年 3 月 今回の改訂
 2017 年 9 月 画像診断部 中央放射線科 造影剤投与マニュアル ver 2.0 本マニュアルは ESUR 造影剤ガイドライン version 9.0(ESUR: 欧州泌尿生殖器放射線学会 ) などを参照し 前マニュアルを改訂して作成した ( 前マニュアル作成 2014 年 3 月 今回の改訂 2017 年 8 月 ) 新たなエビデンスの報告や運用上困難な場合は適宜変更を加える 1. 造影剤アレルギーの既往を有する患者への対応
2017 年 9 月 画像診断部 中央放射線科 造影剤投与マニュアル ver 2.0 本マニュアルは ESUR 造影剤ガイドライン version 9.0(ESUR: 欧州泌尿生殖器放射線学会 ) などを参照し 前マニュアルを改訂して作成した ( 前マニュアル作成 2014 年 3 月 今回の改訂 2017 年 8 月 ) 新たなエビデンスの報告や運用上困難な場合は適宜変更を加える 1. 造影剤アレルギーの既往を有する患者への対応
<4D F736F F D DC58F4994C5817A54524D5F8AB38ED28CFC88E396F B CF8945C8CF889CA92C789C1816A5F3294C52E646
 患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
患者向医薬品ガイド トレムフィア皮下注 100mg シリンジ 2018 年 11 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) トレムフィア皮下注 100mgシリンジ Tremfya Subcutaneous Injection 100mg syringe グセルクマブ ( 遺伝子組換え ) Guselkumab(Genetical Recombination) 100mg 患者向医薬品ガイドについて
10,000 L 30,000 50,000 L 30,000 50,000 L 図 1 白血球増加の主な初期対応 表 1 好中球増加 ( 好中球 >8,000/μL) の疾患 1 CML 2 / G CSF 太字は頻度の高い疾患 32
 白血球増加の初期対応 白血球増加が 30,000~50,000/μL 以上と著明であれば, 白血病の可能性が高い すぐに専門施設 ( ) に紹介しよう ( 図 1) 白血球増加があれば, まず発熱など感染症を疑う症状 所見に注目しよう ( 図 1) 白血球増加があれば, 白血球分画を必ずチェックしよう 成熟好中球 ( 分葉核球や桿状核球 ) 主体の増加なら, 反応性好中球増加として対応しよう ( 図
白血球増加の初期対応 白血球増加が 30,000~50,000/μL 以上と著明であれば, 白血病の可能性が高い すぐに専門施設 ( ) に紹介しよう ( 図 1) 白血球増加があれば, まず発熱など感染症を疑う症状 所見に注目しよう ( 図 1) 白血球増加があれば, 白血球分画を必ずチェックしよう 成熟好中球 ( 分葉核球や桿状核球 ) 主体の増加なら, 反応性好中球増加として対応しよう ( 図
医療法人高幡会大西病院 日本慢性期医療協会統計 2016 年度
 医療法人高幡会大西病院 日本慢性期医療協会統計 2016 年度 職員のインフルエンザワクチンの接種率 ワクチン接種率 =C( 自院内にてインフルエンザワクチンを接種した職員数 ) /B( ワクチン接種最終日の職員数 ) 100 年度 ワクチン接種最終日の職員数 ( 人 ) 自院内にてインフルエンザワクチンを接種した職員数 ( 人 ) 職員のインフルエンザワクチンの接種率 (%) 平成 26 年度 151
医療法人高幡会大西病院 日本慢性期医療協会統計 2016 年度 職員のインフルエンザワクチンの接種率 ワクチン接種率 =C( 自院内にてインフルエンザワクチンを接種した職員数 ) /B( ワクチン接種最終日の職員数 ) 100 年度 ワクチン接種最終日の職員数 ( 人 ) 自院内にてインフルエンザワクチンを接種した職員数 ( 人 ) 職員のインフルエンザワクチンの接種率 (%) 平成 26 年度 151
Ⅰ. 改訂内容 ( 部変更 ) ペルサンチン 錠 12.5 改 訂 後 改 訂 前 (1) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本剤の作用が増強され, 副作用が発現するおそれがあるので, 併用しないこと ( 過量投与 の項参照) 本剤投与中の患者に本薬の注射剤を追加投与した場合, 本
 医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
医薬品の適正使用に欠かせない情報です 必ずお読み下さい 使用上の注意 改訂のお知らせ 2006 年 1 月日本ベーリンガーインゲルハイム株式会社 注 ) 処方せん医薬品 ( ジピリダモール製剤 ) = 登録商標注 ) 注意 - 医師等の処方せんにより使用すること 謹啓時下ますますご清祥のこととお慶び申し上げます 平素は弊社製品につきましてご愛顧を賜り厚く御礼申し上げます さて, この度, 自主改訂によりペルサンチン
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果
 2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
2015 年 11 月 5 日 乳酸菌発酵果汁飲料の継続摂取がアトピー性皮膚炎症状を改善 株式会社ヤクルト本社 ( 社長根岸孝成 ) では アトピー性皮膚炎患者を対象に 乳酸菌 ラクトバチルスプランタルム YIT 0132 ( 以下 乳酸菌 LP0132) を含む発酵果汁飲料 ( 以下 乳酸菌発酵果汁飲料 ) の飲用試験を実施した結果 アトピー性皮膚炎症状を改善する効果が確認されました なお 本研究成果は
スライド 1
 1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
1/5 PMDA からの医薬品適正使用のお願い ( 独 ) 医薬品医療機器総合機構 No.6 2012 年 1 月 ラミクタール錠 ( ラモトリギン ) の重篤皮膚障害と用法 用量遵守 早期発見について ラミクタール錠は 用法 用量 を遵守せず投与した場合に皮膚障害の発現率が高くなることが示されている ( 表 1 参照 ) ため 用法 用量 を遵守することが平成 20 年 10 月の承認時より注意喚起されています
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示され
 添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
添付文書情報 の検索方法 1. 検索条件を設定の上 検索実行 ボタンをクリックすると検索します 検索結果として 右フレームに該当する医療用医薬品の販売名の一覧が 販売名の昇順で表示されます 2. 右のフレームで参照したい販売名をクリックすると 新しいタブで該当する医療用医薬品の添付文書情報が表示されます 検索条件設定時の注意 検索はテキスト文章 (SGML 又は XML) が対象となっており 画像及び
untitled
 1 2 有害事象とは何ですか? 有害事象 (Adverse Event) 治験薬又は製造販売後臨床試験薬を投与された被験者に生じたすべての好ましくない又は意図しない疾病又はその徴候をいう 当該治験薬又は当該製造販売後臨床試験薬との因果関係の有無は問わない 副作用とは何ですか? 副作用 (Adverse Drug Reaction) 治験薬 ( 対象薬として用いられる市販薬を除く ) については以下のとおり
1 2 有害事象とは何ですか? 有害事象 (Adverse Event) 治験薬又は製造販売後臨床試験薬を投与された被験者に生じたすべての好ましくない又は意図しない疾病又はその徴候をいう 当該治験薬又は当該製造販売後臨床試験薬との因果関係の有無は問わない 副作用とは何ですか? 副作用 (Adverse Drug Reaction) 治験薬 ( 対象薬として用いられる市販薬を除く ) については以下のとおり
アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社 薬効分類 提出年月 平成 30 年 10 月 1.1. 安全性検討事項 重要な特定されたリスク 頁 重要な潜在
 アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
アビガン錠 200mg に係る医薬品リスク管理計画書 本資料に記載された情報に係る権利及び内容の責任は, 富士フイルム富山化学株式会社にあります 当該情報を適正使用以外の営利目的に利用することはできません 富士フイルム富山化学株式会社 アビガン錠 200mg に係る 医薬品リスク管理計画書 (RMP) の概要 販売名 アビガン錠 200mg 有効成分 ファビピラビル 製造販売業者 富士フイルム富山化学株式会社
名称未設定
 健感発 00 第 1 号 令和元年 月 日 都道府県知事 各保健所設置市長 特別区長 殿 厚生労働省健康局結核感染課長 ( 公印省略 元号を改める政令の施行に伴う通知様式の改正について 元号を改める政令 ( 平成 31 年政令第 13 号 が平成 31 年 月 1 日に公布され 同年 月 1 日から施行されたことに伴い 健康局結核感染課関係の通知等において示している様式については 平成 を 令和 に変更する等
健感発 00 第 1 号 令和元年 月 日 都道府県知事 各保健所設置市長 特別区長 殿 厚生労働省健康局結核感染課長 ( 公印省略 元号を改める政令の施行に伴う通知様式の改正について 元号を改める政令 ( 平成 31 年政令第 13 号 が平成 31 年 月 1 日に公布され 同年 月 1 日から施行されたことに伴い 健康局結核感染課関係の通知等において示している様式については 平成 を 令和 に変更する等
1)表紙14年v0
 NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
NHO µ 医師が治療により回復が期待できないと判断する 終末期 であると医療チームおよび本人 家族が判断する 患者の意志表明は明確であるか? いいえ はい 意思は文書化されているか? はい 患者には判断能力があるか? 医療チームと患者家族で治療方針を相談する 患者の意思を推量できる場合には それを尊重する はい はい 患者の意思を再確認する はい 合意が得られたか? はい いいえ 倫理委員会などで議論する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類
 未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
未承認薬 適応外薬の要望に対する企業見解 ( 別添様式 ) 1. 要望内容に関連する事項 会社名要望された医薬品要望内容 CSL ベーリング株式会社要望番号 Ⅱ-175 成分名 (10%) 人免疫グロブリン G ( 一般名 ) プリビジェン (Privigen) 販売名 未承認薬 適応 外薬の分類 ( 該当するものにチェックする ) 効能 効果 ( 要望された効能 効果について記載する ) ( 要望されたについて記載する
<4D F736F F D DC58F4994C5817A53544C2094E789BA928D5F8AB38ED28CFC834B F94CC94848CB392C78B4C C5292E646F63>
 ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
ステラーラ皮下注 45mg シリンジ 患者向医薬品ガイド 2018 年 7 月更新 この薬は? 販売名 一般名 含有量 (1 シリンジ中 ) ステラーラ皮下注 45mg シリンジ Stelara Subcutaneous Injection 45mg syringe ウステキヌマブ ( 遺伝子組換え ) Ustekinumab(Genetical Recombination) 45mg 患者向医薬品ガイドについて
5_使用上の注意(37薬効)Web作業用.indd
 34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
34 ビタミン主薬製剤 1 ビタミン A 主薬製剤 使用上の注意と記載条件 1. 次の人は服用前に医師又は薬剤師に相談することあ医師の治療を受けている人 い妊娠 3 ヵ月以内の妊婦, 妊娠していると思われる人又は妊娠を希望する人 ( 妊娠 3 ヵ月前から妊娠 3 ヵ月までの間にビタミン A を 1 日 10,000 国際単位以上摂取した妊婦から生まれた児に先天異常の割合が上昇したとの報告がある )
臨床試験の実施計画書作成の手引き
 臨床試験実施計画書 汗中乳酸測定システムを用いた 組織酸素代謝評価の検討 聖マリアンナ医科大学救急医学 神奈川県川崎市宮前区菅生 2-16-1 電話 :044-977-8111( 医局内線 3931) 医局 FAX:044-979-1522 責任医師森澤健一郎 kmori0079@yahoo.co.jp 臨床試験実施予定期間 : 承認後 ~ 2018 年 6 月 30 日まで 作成日 :2016 年
臨床試験実施計画書 汗中乳酸測定システムを用いた 組織酸素代謝評価の検討 聖マリアンナ医科大学救急医学 神奈川県川崎市宮前区菅生 2-16-1 電話 :044-977-8111( 医局内線 3931) 医局 FAX:044-979-1522 責任医師森澤健一郎 kmori0079@yahoo.co.jp 臨床試験実施予定期間 : 承認後 ~ 2018 年 6 月 30 日まで 作成日 :2016 年
デベルザ錠20mg 適正使用のお願い
 2014 年 3 月作成薬価基準未収載 - 医薬品の適正使用に欠かせない情報です 使用前に必ずお読みください - 適正使用のお願い 処方せん医薬品 : 注意 - 医師等の処方せんにより使用すること 製造販売元 販売元 適応となる患者さんとデベルザ錠の使い方 本剤を投与する前に 以下のことを確認してください 2 型糖尿病の患者さんですか 本剤の効能 効果は 2 型糖尿病 です 1 型糖尿病の患者さんは
2014 年 3 月作成薬価基準未収載 - 医薬品の適正使用に欠かせない情報です 使用前に必ずお読みください - 適正使用のお願い 処方せん医薬品 : 注意 - 医師等の処方せんにより使用すること 製造販売元 販売元 適応となる患者さんとデベルザ錠の使い方 本剤を投与する前に 以下のことを確認してください 2 型糖尿病の患者さんですか 本剤の効能 効果は 2 型糖尿病 です 1 型糖尿病の患者さんは
ミリプラチン 臨床的安全性の概要 Page 1 ミリプラチン製造販売承認申請 CTD 第 2 部 2.7 臨床概要 臨床的安全性の概要 大日本住友製薬株式会社
 ミリプラチン 2.7.4 臨床的安全性の概要 Page 1 ミリプラチン製造販売承認申請 CTD 第 2 部 2.7 臨床概要 2.7.4 臨床的安全性の概要 大日本住友製薬株式会社 ミリプラチン 2.7.4 臨床的安全性の概要 Page 2 目次 2.7.4 臨床的安全性の概要 2.7.4.1 医薬品への曝露...11 2.7.4.1.1 総括的安全性評価計画及び安全性試験の記述...11 2.7.4.1.2
ミリプラチン 2.7.4 臨床的安全性の概要 Page 1 ミリプラチン製造販売承認申請 CTD 第 2 部 2.7 臨床概要 2.7.4 臨床的安全性の概要 大日本住友製薬株式会社 ミリプラチン 2.7.4 臨床的安全性の概要 Page 2 目次 2.7.4 臨床的安全性の概要 2.7.4.1 医薬品への曝露...11 2.7.4.1.1 総括的安全性評価計画及び安全性試験の記述...11 2.7.4.1.2
Microsoft Word - 第14回定例会_平田様_final .doc
 クロスオーバー実験のデザインと解析 - テレメトリー法によ る QT/QTc 試験の実データを用いた検討 - II. クロスオーバー実験の統計解析 4) 有意差検定と信頼区間方式の解析の比較 平田篤由 薬理統計グループ安全性薬理チーム 要約 : ヒトの QT/QTc 評価試験における判断基準は,QTc 間隔の 95% 信頼区間の上限が 10ms を越えるかどうかである. 一方, 非臨床試験のイヌを用いたテレメトリー
クロスオーバー実験のデザインと解析 - テレメトリー法によ る QT/QTc 試験の実データを用いた検討 - II. クロスオーバー実験の統計解析 4) 有意差検定と信頼区間方式の解析の比較 平田篤由 薬理統計グループ安全性薬理チーム 要約 : ヒトの QT/QTc 評価試験における判断基準は,QTc 間隔の 95% 信頼区間の上限が 10ms を越えるかどうかである. 一方, 非臨床試験のイヌを用いたテレメトリー
3 病床数 施設 ~19 床 床 床以上 284 (3 施設で未回答 ) 4 放射線専門医数 ( 診断 治療を含む ) 施設 ~5 人 226 6~10 人 人
 造影剤使用に関するアンケート調査 集計報告 2015.7.21 日本医学放射線学会造影剤安全性委員会 ヨードおよびガドリニウム造影剤の安全使用に関して 国内における使用実態を調査するために 2015 年 2 月に 全国の総合修練施設 191 施設 修練施設 521 施設 特殊修練施設 13 施設 計 724 施設にアンケート回答を要請いたしました 計 329 施設から回答を得ましたので ( 回答率
造影剤使用に関するアンケート調査 集計報告 2015.7.21 日本医学放射線学会造影剤安全性委員会 ヨードおよびガドリニウム造影剤の安全使用に関して 国内における使用実態を調査するために 2015 年 2 月に 全国の総合修練施設 191 施設 修練施設 521 施設 特殊修練施設 13 施設 計 724 施設にアンケート回答を要請いたしました 計 329 施設から回答を得ましたので ( 回答率
試験実施者 ( 企業名 ) 商品名 試験結果の概要 武田薬品工業株式会社 インフルエンザワクチン ( 開発コード :TAK-850) 有効成分名 A/H1N1/California/07/ A/H3N2/Victoria/361/ 試験の名称 試験実施医療機関及び試験責任医師
 試験実施者 ( 企業名 ) 商品名 試験結果の概要 武田薬品工業株式会社 インフルエンザワクチン ( 開発コード :TAK-850) 有効成分名 A/H1N1/California/07/2009 + A/H3N2/Victoria/361/2011 + 試験の名称 試験実施医療機関及び試験責任医師名 公表文献 ( 本試験結果の報告文献 ) 試験期間 ( 最初の被験者の同意取得日 ~ 最後の被験者の治療期終了日試験のフェーズ
試験実施者 ( 企業名 ) 商品名 試験結果の概要 武田薬品工業株式会社 インフルエンザワクチン ( 開発コード :TAK-850) 有効成分名 A/H1N1/California/07/2009 + A/H3N2/Victoria/361/2011 + 試験の名称 試験実施医療機関及び試験責任医師名 公表文献 ( 本試験結果の報告文献 ) 試験期間 ( 最初の被験者の同意取得日 ~ 最後の被験者の治療期終了日試験のフェーズ
市販直後調査の実施状況 デベルザ 錠 アプルウェイ 錠 一般的名称 イプラグリフロジン L- プロリン ダパグリフロジンプロピレン グリコール水和物 ルセオグリフロジン水和物 トホグリフロジン水和物 調査実施期間 製造承認 2014/04/30 製造承認 2014/08/22 製造承認 2014/0
 市販直後調査の副作用集計 市販直後調査期間 : 各販売元市販直後調査第三回中間報告より 市販直後調査の実施状況 デベルザ 錠 アプルウェイ 錠 一般的名称 イプラグリフロジン L- プロリン ダパグリフロジンプロピレン グリコール水和物 ルセオグリフロジン水和物 トホグリフロジン水和物 調査実施期間 製造承認 2014/04/30 製造承認 2014/08/22 製造承認 2014/08/14 製造承認
市販直後調査の副作用集計 市販直後調査期間 : 各販売元市販直後調査第三回中間報告より 市販直後調査の実施状況 デベルザ 錠 アプルウェイ 錠 一般的名称 イプラグリフロジン L- プロリン ダパグリフロジンプロピレン グリコール水和物 ルセオグリフロジン水和物 トホグリフロジン水和物 調査実施期間 製造承認 2014/04/30 製造承認 2014/08/22 製造承認 2014/08/14 製造承認
