ダサチニブ水和物 薬物動態試験の概要文 Page 1 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 薬物動態試験の概要文 ブリストル マイヤーズ株式会社
|
|
|
- つづる ひめい
- 5 years ago
- Views:
Transcription
1 ダサチニブ水和物 薬物動態試験の概要文 Page 1 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 薬物動態試験の概要文 ブリストル マイヤーズ株式会社
2 ダサチニブ水和物 薬物動態試験の概要文 Page 2 用語及び略語一覧 ADME adsorption, distribution, metabolism, 吸収 分布 代謝及び排泄 elimination AUC(0-T) area under the concentration vs. time curve from 0 to time of the last 0 時間から測定可能であった最終時点までの血漿中濃度曲線下面積 measurable concentration AUC(IT) area under the concentration vs. time curve extrapolated to infinity 無限大時間までの血漿中濃度曲線下面積 BDC bile-duct-cannulated 胆管へのカニューレ挿入 BID bis in die, twice a day 1 日 2 回 ( 投与 ) (drug administration) BMS Bristol-Myers Squibb ブリストル マイヤーズスクイブ社 BW body weight 体重 C B blood concentration 血中濃度 CL plasma clearance 血漿中濃度によるクリアランス Cmax maximum concentration 最高濃度 CML chronic myelogenous leukemia 慢性骨髄性白血病 C p plasma concentration 血漿中濃度 CV coefficient of variation 変動係数 CYP cytochrome P450 チトクローム P450 EDTA ethylenediaminetetraacetic acid エチレンジアミン四酢酸 F absolute bioavailability 絶対生物学的利用率 FMO flavin containing monooxygenase フラビン含有モノオキシゲナーゼ酵素 GIT gastrointestinal tract 消化管 GLP good laboratory practice 医薬品の安全性に関する非臨床試験の実施の基準 HCl hydrochloric acid 塩酸 HH human hepatocytes ヒト肝細胞 HLM human liver microsomes ヒト肝ミクロソーム HPLC high performance liquid 高速液体クロマトグラフィー chromatography hpxr human pregnane X receptor ヒトプレグナン X 受容体 IA intra-arterial 動脈内 ( 投与 ) IC 50 concentration required for 50% inhibition 50% 阻害するのに必要な濃度
3 ダサチニブ水和物 薬物動態試験の概要文 Page 3 IV Intravenous 静脈内 ( 投与 ) LC/MS LC/MS/MS, LC/MS n liquid chromatography with mass spectrometry liquid chromatography with tandem mass spectrometry 液体クロマトグラフィー / マススペクトロメトリー 液体クロマトグラフィー / タンデムマススペクトロメトリー L/kg liters per kilogram 単位キログラム当たりのリットル LLQ lower limit of quantitation 定量下限 LSC liquid scintillation counting 液体シンチレーションカウンター M3a, M3b M4 M5 M6 monohydroxylated -oxide metabolites of dasatinib -dealkylated amine metabolite of dasatinib piperazine -oxide metabolite of dasatinib carboxylic acid metabolite of dasatinib ダサチニブのモノヒドロキシ -オキシド体 ダサチニブの - 脱アルキル化アミン体 (BMS ) ダサチニブのピペラジン環の -オキシド体 (BMS ) ダサチニブのカルボン酸体 (BMS ) M7 mono-oxidation product of M6 M6 のモノオキシド体 M8, M8a, M8b, M8c glucuronide conjugates of dasatinib ダサチニブのグルクロン酸抱合体 M9 dehydrogenated metabolite of dasatinib ダサチニブの脱水素体 M13 sulfate conjugate of dasatinib ダサチニブの硫酸抱合体 M14 piperazine ring-open metabolite of dasatinib ダサチニブのピペラジン環の開環体 M15 bis-oxidation product of dasatinib ダサチニブのビスオキシド体 M20 4-hydroxy-chloromethylphenyl metabolite of dasatinib M21 sulfate conjugate of M20 M20 の硫酸抱合体 ダサチニブの 4-ヒドロキシクロロメチルフェニル体 (BMS ) M22 mono-oxidation product of dasatinib ダサチニブのモノオキシド体 M23, M23a, M23b monohydroxylated products of M6 M6 のモノヒドロキシ体 M24 hydroxybenzyl metabolite of dasatinib ダサチニブのヒドロキシベンジル体 (BMS ) M25 piperazine ring-open product of M4 M4 のピペラジン環の開環体 M26 taurine conjugate of M6 M6 のタウリン抱合体 M28a, M28b hydroxylated metabolites of M4 M4 のヒドロキシ体 M29a, M29b, M29c bis-hydroxylated metabolites of dasatinib ダサチニブのビスヒドロキシ体
4 ダサチニブ水和物 薬物動態試験の概要文 Page 4 M30 sulfate conjugate of M6 のモノヒドロキシ体の硫酸抱合体 monohydroxylated M6 M31 sulfate conjugate of bis-hydroxylated dasatinib ダサチニブのビスヒドロキシ体の硫酸抱合体 M34 monohydroxylated, -oxide M6 のモノヒドロキシ -オキシド体 derivative of M6 M35a, M35b glucuronide conjugates of dehydrogenated dasatinib ダサチニブの脱水素化体のグルクロン酸抱合体 M36 glucuronide conjugate of monohydroxylated M6 M6 のモノヒドロキシ体のグルクロン酸抱合体 M37a, M37b glucuronide conjugate of monohydroxylated dasatinib ダサチニブのモノヒドロキシ体のグルクロン酸抱合体 MH monkey hepatocytes サル肝細胞 MLM monkey liver microsomes サル肝ミクロソーム mra messenger ribonucleic acid 伝令リボ核酸 ng nanogram ナノグラム PCR polymerase chain reaction ポリメラーゼ連鎖反応 P-gp p-glycoprotein P 糖蛋白 PO per os, oral 経口投与 RH rat hepatocytes ラット肝細胞 RLM rat liver microsomes ラット肝ミクロソーム SD standard deviation 標準偏差 t 1/2 apparent terminal elimination half life 終末消失相半減期 TK Toxicokinetic トキシコキネティクス Tmax time to reach Cmax Cmax に到達する時間 UGT uridine diphosphate-glucuronosyltransferase ウリジンジホスフェート-グルクロノシルトランスフェラーゼ enzymes UV ultraviolet detection 紫外線吸収検出器 Vss steady state volume of distribution 定常状態における分布容積
5 ダサチニブ水和物 薬物動態試験の概要文 Page 5 目次 1 まとめ 分析法 吸収 ダサチニブの in vitro 透過性の評価 マウス ラット ウサギ イヌ サル 分布 分布容積 組織内分布 蛋白結合及び血球への分配 胎盤及び乳汁移行 代謝 ( 動物間の比較 ) In vivo 代謝 ラット サル ヒト In vitro 代謝 ヒトチトクローム P450 酵素の誘導あるいは阻害 排泄 ラット サル ヒト 薬物動態学的薬物相互作用 その他の薬物動態試験 考察及び結論 参考文献... 41
6 ダサチニブ水和物 薬物動態試験の概要文 Page 6 表一覧 表 2-1: トキシコキネティクス試験 (GLP 適合 ) 及び生殖発生毒性試験においてダサチニ ブの測定に用いたバリデートされた分析法の要約 表 3-1: マウス ラット イヌ及びサルにおけるダサチニブの薬物動態パラメータ 表 5-1: ダサチニブと in vivo 及び in vitro 試験の試料から同定された代謝物の構造式 表 6-1: ラット サル及びヒトにおける [ 14 C] ダサチニブ投与後の放射能排泄率の要約... 36
7 ダサチニブ水和物 薬物動態試験の概要文 Page 7 図一覧 図 2-1: ダサチニブ及び [ 14 C] ダサチニブの化学構造 図 5-1: In vivo におけるダサチニブの推定代謝経路... 28
8 ダサチニブ水和物 薬物動態試験の概要文 Page 8 1 まとめダサチニブ (BMS ) は 複数のチロシンキナーゼを強力に阻害する ここでは マウス ラット イヌ及びサルにおけるダサチニブの薬物動態の試験成績を要約する これら試験ではダサチニブの吸収 分布 代謝及び排泄 (ADME) を評価した また 毒性試験においては曝露を確認 検討し GLP を適用した主要な毒性試験の評価のサポートとして トキシコキネティクス (TK) を評価した GLP 適用トキシコキネティクス試験において ラット ウサギあるいはサルの血漿中ダサチニブ濃度をバリデートされた高速液体クロマトグラフィー / タンデム型質量分析 (LC/MS/MS) 法により測定した このバリデートされた LC/MS/MS 法は高感度で 真度及び精度に優れた測定法であった 探索的試験で用いたその他の分析法には LC/MS LC/MS n LC/UV 液体シンチレーションカウンターあるいは液体クロマトグラフィー / ラジオクロマトグラフィー分析 ( 放射能測定用 ) などがある ダサチニブはマウス ラット イヌ及びサルに経口投与後 速やかに吸収された 単回経口投与後の生物学的利用率の平均値は 14~34% であった ラット及びサルにおいて ダサチニブの全身曝露量は投与量に依存し 明らかな性差は認められなかった 1 日 1 回の反復投与により顕著な蓄積は観察されなかった Caco-2 細胞系におけるダサチニブの透過係数は約 102 nm/sec であり これはヒトにおける経口吸収率が 50% 以上である薬物と同程度の値である ダサチニブは Caco-2 細胞を用いた透過性試験において P 糖蛋白の基質であることが示されたが P 糖蛋白ノックアウトマウスにおけるダサチニブの吸収は野生型マウスと類似していた また Caco-2 細胞による透過性試験の結果 ダサチニブに P 糖蛋白の阻害作用は認められなかったことから P 糖蛋白の基質となる薬剤との併用により薬物間相互作用を引き起こす可能性は低いと考えられた ダサチニブのマウス ラット イヌ サル及びヒト血清に対する蛋白結合率は高値を示した (> 91%) また BMS についてもヒト血清に対して高い結合率 (> 93%) を示した 100~500 ng/ml の濃度範囲で ダサチニブ及び BMS の蛋白結合率は濃度に依存した変化を示さなかった ダサチニブの血漿中濃度に対する血液中濃度比 ( 血液中濃度 [C 血液 ]/ 血漿中濃度 [C 血漿 ]) は 1.1( ラット )~1.8( ヒト ) であり 血球への分布が認められた マウス ラット イヌ 及びサルにおける定常状態分布容積 (Vss) の平均値はそれぞれの動物種の全身水分量より大きいことから ダサチニブは血管外に広範囲にわたって分布すると考えられた ラットに [ 14 C] ダサチニブを経口投与後 放射能はラットの組織に広範囲にわたって分布した 投与した放射能に対して検出された放射能の割合が最も高かった組織は消化管及び肝臓であった 妊娠ラットに [ 14 C] ダサチニブを単回経口投与後 放射能は胎盤を通過し 胎児にまで分布した 胎児組織中の放射能レベルは母動物組織よりも低かった また 授乳期ラットに [ 14 C] ダサチニブを単回経口投与後 放射能は乳汁中へ分泌された ヒトにおけるダサチニブの代謝経路はラットやサルと定性的に類似していた ヒト ラット及びサルの 3 種すべてから同定された代謝物は クロロメチルフェニル環の水酸化体 ピペラジン環の - 酸化体 及びヒドロキシエチル部位の - 脱アルキル化体 ヒドロキシエチル部位のカルボン酸への酸化 ダサチニブのグルクロン酸及び硫酸抱合体 あるいは酸化代謝物であった
9 ダサチニブ水和物 薬物動態試験の概要文 Page 9 ヒトの血漿中代謝物のプロファイルはサルと非常に類似しており ヒトで認められたすべての代謝物はサルの血漿中にも存在した ラット サル及びヒト血漿中に存在する薬剤に関連した化合物のうち 最も多く存在したものは未変化体であった 様々な動物種及びヒトの肝ミクロソーム及び肝細胞を用いた in vitro 試験から得られた代謝プロファイルは in vivo から得られた代謝プロファイルと矛盾しないものであった ダサチニブの酸化的代謝には CYP3A4 FMO3 及び未知の酸化還元酵素を含む多数の酵素が関与していた 酸化代謝物である M4 M20 及び M24 は in vitro においてほとんどが CYP3A4 により生成されており ヒトの in vivo ではダサチニブの投与量の 38% に相当する量であったことから CYP3A4 はダサチニブの代謝クリアランスに大きく寄与する主要な代謝酵素であると考えられた しかしながら その他の酵素 すなわち FMO3( フラビン含有モノオキシゲナーゼ酵素 ) 酸化還元酵素 及び UGTs( ウリジンジホスフェート-グルクロノシルトランスフェラーゼ ) のダサチニブの代謝への寄与の程度については 現在のところ不明である マウス ラット イヌ及びサルにおいてダサチニブの全身クリアランスは 25( イヌ )~62 ml/min/kg( マウス ) の範囲であり 中程度から高度のクリアランスが示された 経口投与後の終末消失相半減期 (t 1/2 ) は 2( マウス )~5 時間 ( イヌ ) の範囲であった ラット サル及びヒトに [ 14 C] ダサチニブを経口投与後 ダサチニブ由来の放射能は主に糞便中に排泄 (> 76%) され 尿中への排泄は投与量の 7% 未満であった 胆管カニューレを挿入したラット及びサルに [ 14 C] ダサチニブを静脈内投与したとき 胆汁中に排泄された放射能は約 67% であり 尿中には約 10~12% が排泄された 更に 胆管カニューレ挿入サルについては 糞便中に約 14% が排泄されており ダサチニブ及びその代謝物の腸管への分泌が示唆された 胆汁中排泄と同様に腸内分泌がヒトにおける糞便中への排泄に寄与している可能性がある サルの胆汁中に存在した未変化体は投与量の 3% であり 尿中未変化体は 0.1% であった ラットにおいてもサルと同様に 胆汁中及び尿中放射能の未変化体の画分はわずかであったことから これら動物種でダサチニブの消失に大きく寄与しているのは代謝であると考えられた ダサチニブは初代ヒト肝細胞培養系において CYP1A2, CYP2B6, CYP2C9, あるいは CYP3A4 を誘導しなかった また これら知見と同様に in vitro においてダサチニブは hpxr を活性化しなかった したがって ダサチニブが CYP 酵素を誘導し 薬物間相互作用を引き起こす可能性は低い ダサチニブはヒト肝ミクロソームにおいて CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6 及び 2E1 の酵素活性をほとんど阻害しないか 又は弱い阻害作用を示したが CYP2C8 に対しては阻害作用を示し CYP3A4 では時間依存型の阻害作用を示した ヒト肝ミクロソームにおける CYP2C8 の競合阻害の K i 値は 3.6 μm(1757 ng/ml) であり CYP3A4 の時間依存型阻害の K I 値及び K inact 値はそれぞれ 1.9 μm(927 ng/ml) 及び min -1 であった 慢性骨髄性白血病 (CML) 患者に 70 mg を 1 日 2 回 反復投与したときの定常状態時の Cmax は 0.12 μm(57 ng/ml) であった CYP2C8 阻害について Cmax/K i 比は 0.1 未満であり CYP2C8 の基質となる薬剤とダサチニブとの併用による薬物間相互作用が発現する可能性は低い In vitro における阻害パラメータ値と定常状態時の血漿中濃度から ダサチニブは CYP3A4 に対して弱い阻害作用を示すと予測される しかし ダサチニブの CYP3A4 に対する阻害様式が時間依存型であることから in vivo での CYP3A4 阻害の
10 ダサチニブ水和物 薬物動態試験の概要文 Page 10 強さを評価することは困難であった 以上のように ヒトと比較したマウス ラット イヌ及びサルにおけるダサチニブの吸収 分布 代謝及び排泄のプロファイルから ダサチニブとその代謝物の安全性を評価するのにこれら動物種は適当であったと考えられた
11 ダサチニブ水和物 薬物動態試験の概要文 Page 11 2 分析法 UV 検出器や質量分析計を連結した高速液体クロマトグラフィー (HPLC) 法を用いて試料中のダサチニブ ( 図 2-1) 濃度を測定した 図 2-1: ダサチニブ及び [ 14 C] ダサチニブの化学構造 CH 3 Cl H O CH 3 S H OH ダサチニブ (BMS ) CH 3 Cl H O CH 3 S * H OH [ 14 C] ダサチニブ (BMS ) * : 標識位置を示す トキシコキネティクス試験 (GLP 適合 ) 及び生殖発生毒性試験から得られた血漿試料のダサチニブ濃度を バリデートされた高速液体クロマトグラフィー / タンデム型質量分析 (LC/MS/MS) 法により定量した 1)2)3) ( 表 薬物動態試験概要表 ) 探索的試験から得られた試料のダサチニブ及びその代謝物濃度については LC/MS LC/MS n LC/UV 液体シンチレーションカウンターあるいは液体クロマトグラフィー / ラジオクロマトグラフィー分析 ( 放射能測定用 ) により定量した ヒト血清蛋白結合試料についてはダサチニブとその活性代謝物である BMS (M4) を バリデートされた LC/MS/MS 法 4) ( 表 薬物動態試験概要表 ) で測定した 様々な動物種の試料の測定に関する個々のバリデートされた分析方法の詳細について 表 2-1 に示す このバリデートされた分析法は ダサチニブ及び BMS を測定するのに適した 高感度で 真度及び精度に優れた定量法であった ( 表 薬物動態試験概要表 ) ひとつの試験で 同一動物種から得られた同じ生体試料種 分析物質については 同じ測定法を用いて定量した 固相抽出後にグラジエント溶出法 ( 移動相の組成を連続的に変化させる勾配溶出法 ) により逆相系 LC/MS/MS で定量したが ヒト血清の透析試料を測定する際には アイソクラティック
12 ダサチニブ水和物 薬物動態試験の概要文 Page 12 溶出法 ( 一定組成の溶離液による均一濃度での溶出法 ) を採用した 抗凝固剤として EDTA を添加したラット ウサギ及びサル血漿において ダサチニブは少なくとも 24 時間 室温で安定であった ラット血漿では ダサチニブは-20 C で少なくとも 14 週間安定であり ウサギ血漿では少なくとも 4 週間 サル血漿では少なくとも 17 週間安定であった また ダサチニブの凍結 融解繰り返し時の安定性については ラット及びサル血漿で少なくとも 3 回までは安定であった 1)2)3) ( 表 薬物動態試験概要表 ) [ 14 C] ダサチニブ ( 図 2-1) による in vivo 試験では 血漿 尿及び胆汁試料を液体シンチレーターと混合し 液体シンチレーションカウンター (LSC) により総放射能量を直接計測した 非妊娠及び妊娠ラットにおける血液 乳汁 糞便及び様々な組織 器官をホモジネートした試料については 可溶化剤を使用するか 燃焼により 14 CO 2 を捕捉し LSC により測定した ダサチニブの代謝を検討するために実施した [ 14 C] ダサチニブによる in vitro 及び in vivo 試験で 代謝物の同定には LC/MS n 分析法を用いた ラジオクロマトグラフのプロファイルは HPLC により分離 採取した画分を TopCount TX 96-well 放射能検出器により測定した結果から あるいは HPLC と連結した放射能検出器により測定した結果から得られた 化学的に合成した BMS , BMS (M5) 及び BMS (M6) 並びに微生物を用いて生合成した BMS (M20) 及び BMS (M24) を標品とし in vitro 及び in vivo 代謝物の同定に利用した ヒト肝細胞による誘導試験 5) ( 表 薬物動態試験概要表 ) 及びヒト肝ミクロソームによる阻害試験 6) ( 表 薬物動態試験概要表 ) に関しては 特異的なプローブ基質と共にインキュベーションした後 CYP 酵素の活性を測定した 一定時間インキュベーションした後 マーカーとなる代謝物を LC/MS/MS 法により定量した また 誘導試験 5) ( 表 薬物動態試験概要表 ) において CYP 酵素をコード化する mra レベルを TaqMan 定量的リアルタイムポリメラーゼ連鎖反応 (PCR) 法により測定した Caco-2 透過試験で得られた試料のダサチニブ濃度を UV 検出器を用いた高速液体クロマトグラフィーにより定量した 7) 代謝反応様式の検討 及び血球への分配を検討する試験 及び探索的な薬物動態及び毒性試験から得られた試料については LC/MS/MS により分析した 7) 初期の測定法と GLP 適用 LC/MS/MS 法をバリデートし 個々の試験から得られた分析結果については それぞれであらかじめ設定した条件に適合した場合にその結果を適用できることとした このように 様々な試験で異なる分析法を採用しているが 算出された PK データの妥当性やその解釈について影響を及ぼすことはなかった
13 ダサチニブ水和物 薬物動態試験の概要文 Page 13 表 2-1: トキシコキネティクス試験 (GLP 適合 ) 及び生殖発生毒性試験においてダサチニブの測定に用いたバリデートされた分析法の要約 動物種 / ヒトラットウサギサルヒト マトリックス ( 分析対象 ) 血漿 ( ダサチニブ b ) 血漿 ( ダサチニブ ) 血漿 ( ダサチニブ ) 分析法 定量下限 (ng/ml) 定量上限 (ng/ml) LC/MS/MS 2 2,000 LC/MS/MS 2 2,000 LC/MS/MS 2 2,000 試験番号 Study DDBS008 Study Study DDBS007 血清 : 透析緩衝液 (1:1) Study ( ダサチニブ BMS ) LC/MS/MS 1 1,
14 ダサチニブ水和物 薬物動態試験の概要文 Page 14 3 吸収 3.1 ダサチニブの in vitro 透過性の評価 Caco-2 細胞によるダサチニブの膜透過性を検討した 7) ( 表 薬物動態試験概要表 ) 50 μm(24.4 μg/ml) で頂端膜側から基底膜側へ (A B) の平均透過係数は 102 nm/sec であり ヒトでの経口吸収が良好 (> 50%) である化合物と同程度であった B A の向きの平均透過係数は 222 nm/sec であり A B の向きでの平均透過係数の約 2 倍であったことから 腸管側に排出するトランスポータの関与が示唆された 特異的な P 糖蛋白阻害剤である GF の存在下では A B の向きの透過係数が 161 nm/sec まで大きくなったが B A の向きでは 126 nm/sec まで小さくなったことから ダサチニブは P 糖蛋白の基質である可能性がある 7) Caco-2 細胞において [ 3 H]-ジゴキシン (5 μm) をプローブ基質として用い P 糖蛋白活性に対するダサチニブの影響について検討した 7) ( 表 薬物動態試験概要表 ) ベラパミル(10 μm) を陽性対照として用いた 陽性対照のベラパミルはジゴキシンの Caco-2 細胞を介した透過を 59% 阻害したが ダサチニブ (1 及び 10 μm) による明らかな阻害はみられなかった この結果から ダサチニブは P 糖蛋白の阻害剤ではないと考えられ P 糖蛋白の基質である薬剤との併用投与により薬物間相互作用を引き起こす可能性は低いと考えられる 3.2 マウスマウスを用いて 2 つの薬物動態試験を実施した 1 つの試験ではダサチニブの薬物動態と生物学的利用率を検討した もう 1 つの薬物動態試験では P 糖蛋白ノックアウトマウスと野生型マウスを用いてダサチニブの経口吸収に及ぼす P 糖蛋白の影響を検討した マウスにおけるダサチニブの薬物動態パラメータを表 3-1 に示す 7) ( 表 薬物動態試験概要表 ) ダサチニブをプロピレングリコール/ 水混合溶液 (1:1) に溶解し 10 mg/kg の投与量で雌ヌードマウスに静脈内投与したときの全身クリアランスは 61.7 ml/min/kg であり 定常状態分布容積は 4.2 L/kg であった ダサチニブをプロピレングリコール / 水混合溶液 (1:1) に溶解し 5 及び 15 mg/kg の投与量で単回経口投与したときの雌ヌードマウスにおける絶対生物学的利用率の平均値は それぞれ 17% 及び 14% であった 7) ( 表 薬物動態試験概要表 ) ダサチニブの血漿中濃度は どちらの投与量でも投与後 2 時間付近で最高濃度に到達した ノックアウトマウス及び野生型マウスを用いて ダサチニブを 50 mm 酢酸ナトリウム緩衝液 (ph 4.6) に溶解し 10 mg/kg 投与したときのダサチニブの経口吸収に対する P 糖蛋白の影響を検討した 7) ( 表 薬物動態試験概要表 ) 野生型マウスと P 糖蛋白ノックアウトマウスにおいて投与後 8 時間に消化管から得られたダサチニブは それぞれ投与量の約 15 及び 14% であった また 野生型マウスと比較してノックアウトマウスで全身曝露量 (Cmax 及び AUC) の増加は認められなかった これらの結果から P 糖蛋白がダサチニブの経口吸収を制限している可能性は低いと考えられる
15 ダサチニブ水和物 薬物動態試験の概要文 Page 15 表 3-1: マウス ラット イヌ及びサルにおけるダサチニブの薬物動態パラメータ 動物種 投与 投与量 Cmax Tmax AUC(IT) t 1/2 CL Vss F 経路 (mg/kg) (μg/ml) (h) (μg h/ml) (h) (ml/min/kg) (L/kg) (%) マウス a IV PO PO ラット a IA ± ± ± ±2.2 - PO ± ± ± ± ±15 イヌ b IV ± ±2.0 25± ±0.8 - PO ± ± ± ± ±13 サル b IV ± ±0.1 34± ±0.1 - a b PO ± ± ±0.02 プロピレングリコール / 水混合溶液 (1:1) により投与. 50 mm 酢酸ナトリウム緩衝液溶液 (ph 4.6) により投与. 出典 : Study MAP005 7) 2.2± ±2 3.3 ラット 雄 SD ラットを用いて 2 つの薬物動態試験を実施した 1 つの試験ではダサチニブの薬物動態と生物学的利用率を検討した もう 1 つの薬物動態試験では ダサチニブの経口生物学的利用率における肝通過の寄与を評価した この他 胆管カニューレ挿入ラットを用いて排泄経路及び代謝を検討しているが これは第 5 項代謝及び第 6 項排泄の項で言及する また 単回及び反復投与毒性試験ではトキシコキネティクスを評価した 薬物動態パラメータを表 3-1 に示す 7) ( 表 薬物動態試験概要表 ) ダサチニブ 10 mg/kg を プロピレングリコール / 水混合溶液 (1:1) に溶解して絶食下で 10 分間動脈内投与したときの雄 SD ラットにおける全身クリアランスは 26.4 ± 7.8 ml/min/kg であり 定常状態分布容積は 6.3 ± 2.2 L/kg であった ダサチニブをプロピレングリコール / 水混合溶液 (1:1) に溶解し 10 mg/kg の投与量で絶食下単回経口投与したときの絶対経口生物学的利用率の平均値は約 27% であった 7) ( 表 薬物動態試験概要表 ) また 雄 SD ラットに絶食下で 10 mg/kg を 30 分間門脈内に投与し 経口生物学的利用率に対する肝通過の寄与を評価した 7) ( 表 薬物動態試験概要表 ) 門脈内投与時の AUC 値 (7.7 ± 2.7 μg h/ml, n = 3) は 10 分間動脈内投与時 (6.8 ± 2.3 μg h/ml, n = 3) と同程度であり ダサチニブはラットにおいて肝通過による初回通過効果をあまり受けないものと考えられた 14 日間反復投与探索毒性試験において 雌雄 SD ラットにおけるダサチニブの全身曝露量を評価した 7) ( 表 薬物動態試験概要表 ) ダサチニブを 50 mm 酢酸ナトリウム緩衝液 (ph 4.6) に溶解し 1, 15 及び 30 mg/kg の投与量で 1 日 1 回 1 群あたり雌雄各 3 匹に経口投与した 試
16 ダサチニブ水和物 薬物動態試験の概要文 Page 16 験 1 日目及び 14 日目の投与後 1, 2, 4, 8, 12 及び 24 時間に採血し 血漿中ダサチニブ濃度を LC/MS/MS 法により定量した 7) 雌雄両ラットで 1 及び 14 日目の AUC は投与量の増加と共に増加した 1 日目において 1 及び 15 mg/kg の投与量で雌雄ラットの曝露量は類似していたが 30 mg/kg では雌ラットの方が大きい曝露量を示した 1 及び 15 mg/kg の投与量で雌雄ラットに 14 日間 1 日 1 回反復投与したとき 1 日目と比較して 14 日目の曝露量は減少した 30 mg/kg の投与量については 14 日間の試験期間中にラットが死亡したため 1 日目と 14 日目の曝露量の比較はできなかった 1 ヵ月間反復投与毒性試験 (GLP 適合 ) において ダサチニブを 80.0 mm クエン酸ナトリウム緩衝液 (ph 3.0~3.1) に溶解し 1, 15 及び 25 mg/kg の投与量で 1 群あたり雌雄各 15 匹に4 サイクル経口投与した 8) ( 表 薬物動態試験概要表 ) 1サイクルは 5 日間の連続投与と引き続いての 2 日間の休薬とした 合計の投与回数は個体あたり 20 回であった 試験 1 日目及び 26 日目の投与後 1, 2, 4, 8, 12 及び 24 時間 (1 匹当たり 2 時点 ) に採血し 血漿中ダサチニブ濃度を LC/MS/MS 法により定量した 1) 雌ラットのダサチニブの全身クリアランスは雄と類似していた 1 日目及び 26 日目において Cmax 値は投与量比よりも小さな増加を示したが AUC はほぼ投与量に比例して増加した 投与量が 15 及び 25 mg/kg では 雌雄の両方とも 26 日目の AUC 値は 1 日目よりも小さかった 6 ヵ月間反復投与毒性試験 (GLP 適合 ) において ダサチニブを 80 mm クエン酸ナトリウム緩衝液 (ph 4.6) に溶解し 1.5, 4 及び 15 mg/kg の投与量で 1 日 1 回 1 群あたり雌雄各 9 匹に経口投与した 9) ( 表 薬物動態試験概要表 ) 15 mg/kg/ 日は毒性発現用量であったため 8 ~16 週目に 10 mg/kg/ 日まで減量し 更に 17 週目には 8 mg/kg/ 日まで減量した 試験 1 日目 13 週目及び 26 週目の投与後 1, 2, 4, 8, 12 及び 24 時間 (1 匹当たり 2 時点 ) に採血し 血漿中ダサチニブ濃度を LC/MS/MS 法により定量した 1) 1.5~4 mg/kg/ 日の投与量で 26 週間 1 日 1 回投与したときの全身曝露量比は投与量比と同程度であった 最高用量で ダサチニブの AUC は投与量比以上の増加を示した Cmax は試験した投与量範囲で投与量に比例して増加した また全身曝露量は雌雄ラットで類似していた 26 週間反復投与後 ダサチニブの全身曝露量の一貫した蓄積や減少は認められなかった 生殖発生毒性試験において 妊娠 6~15 日にダサチニブを 80 mm クエン酸ナトリウム緩衝液に溶解し 2.5, 5, 10 及び 20 mg/kg の投与量で 1 日 1 回 1 群あたり雌 SD ラット 10 匹に経口投与した 10) ( 表 薬物動態試験概要表 ) 妊娠 15 日の投与後 1, 4 及び 8 時間にラット 5 匹から血液試料を採取し 更に それぞれの投与量での最終投与後 2, 6 及び 24 時間に残りのラット 5 匹から血液試料を採取した後 血漿中ダサチニブ濃度を LC/MS/MS 法により定量した 1) 妊娠ラットにおけるダサチニブの全身曝露量はほぼ投与量に比例して増加した 2.5~5 mg/kg/ 日の間で AUC はおおよそ投与量に比例して増加したが 5~10 mg/kg/ 日の間では AUC は投与量比以上の増加を示した 10~20 mg/kg/ 日の間で 全身曝露量の増加は観察されなかった ほとんどのサンプリングポイントで血漿中濃度の個体間変動は中程度であったが 5 mg/kg/ 日の投与群の投与後 4 時間の濃度については個体間変動が大きく 変動係数は 101% であった
17 ダサチニブ水和物 薬物動態試験の概要文 Page ウサギ生殖発生毒性試験において 妊娠 7~19 日にダサチニブを 80 mm クエン酸ナトリウム緩衝溶液に溶解し 0.5, 2 及び 6 mg/kg/ 日の投与量で 雌ウサギ ( ニュージーランド白色種 )5 匹に経口投与した 11) ( 表 薬物動態試験概要表 ) 19 日目の投与後 0.5, 1, 2, 4, 8 及び 24 時間に血液試料を採取し 血漿中ダサチニブ濃度を LC/MS/MS 法により定量した 3) ウサギにおけるダサチニブの全身曝露量は投与量に依存して増加した 0.5~2 mg/kg/ 日及び 2~6 mg/kg/ 日の間で AUC はほぼ投与量に比例して増加した 3.5 イヌ雄ビーグル犬を用いて薬物動態試験を実施し ダサチニブの薬物動態と絶対経口生物学的利用率を検討した 薬物動態パラメータを表 3-1 に示す 7) ( 表 薬物動態試験概要表 ) ダサチニブを 50 mm 酢酸ナトリウム緩衝液 (ph 4.6) に溶解し 3 mg/kg の投与量で雄ビーグル犬に絶食下で単回経口投与したときの絶対経口生物学的利用率の平均値は 34 ± 13% であった また 絶食下で 1.2 mg/kg を 10 分間点滴静脈内投与したときのダサチニブの全身クリアランス及び定常状態分布容積は それぞれ 25 ± 6.3 ml/min/kg 及び 4.7 ± 0.8 L/kg であった 3.6 サルカニクイザルを用いて 2 つの薬物動態試験を実施した 1 つの試験ではダサチニブの薬物動態と生物学的利用率を検討した もう 1 つの薬物動態試験では ダサチニブの遊離塩基あるいは塩酸塩のカプセル剤を投与し ダサチニブの曝露量を溶液に溶解して投与したときと比較した この他 胆管カニューレ挿入サルを用いて排泄経路及び代謝を検討した試験を実施しており これは代謝 ( 第 項 ) 及び排泄 ( 第 項 ) の項で言及する また 単回及び反復投与毒性試験ではトキシコキネティクスを評価した 生物学的利用率を検討した試験における薬物動態パラメータを表 3-1 に示す 7) ( 表 薬物動態試験概要表 ) カニクイザルに絶食下でダサチニブ 2 mg/kg を 10 分間点滴静脈内投与したときのダサチニブの全身クリアランス及び定常状態分布容積は それぞれ 34 ± 4.1 ml/min/kg 及び 3.5 ± 0.1 L/kg であった カニクイザルにダサチニブを 50 mm 酢酸ナトリウム緩衝液 (ph 4.6) に溶解して 5 mg/kg の投与量で絶食下 単回経口投与したときの絶対経口生物学的利用率の平均値は 15 ± 2% であった ダサチニブを遊離塩基として 4.7 mg/kg カプセルで投与したときの絶対経口生物学的利用率の平均値は 13 ± 8% で 塩酸塩として 4.9 mg/kg を投与したときには 10 % であった 7) ( 表 薬物動態試験概要表 ) 緩衝溶液による投与時と比較して 遊離塩基あるいは塩酸塩のカプセル剤では 曝露量がそれぞれ 19% 及び 32% 低下した しかし 遊離塩基とその塩酸塩の間では 曝露量は同程度であった 反復投与探索毒性試験において ダサチニブを 50 mm 酢酸ナトリウム緩衝液 (ph 4.2~4.6) に溶解し 1, 10, 15, 25 及び 62.5 mg/kg/ 日の投与量で 1 群あたり雌雄各 1 匹に経口投与した 7) ( 表
18 ダサチニブ水和物 薬物動態試験の概要文 Page 薬物動態試験概要表 ) 1 日 1 回 5 日間の連続投与後に休薬を 2 日間とり 更に 5 日間投与する間歇投与 ( 合計 10 回の投与 ) を行った 試験 1 日目及び 12 日目に採血し 血漿中ダサチニブ濃度を LC/MS/MS 法により定量した 7) 雌雄サルのいずれも投与量の増加に伴って AUC は増加した 投与量が 1, 10, 15 及び 25 mg/kg/ 日では 雌サルの方が曝露量が小さかったが 62.5 mg/kg では雌サルの AUC の方が大きかった また 投与量が 1, 10 及び 15 mg/kg/ 日で反復投与後の 12 日目の AUC が 1 日目と比較して低下した 高用量側の 25 及び 62.5 mg/kg/ 日については 12 日目前に試験を終了したため 1 日目と 12 日目の AUC について比較できなかった 単回投与毒性試験 (GLP 適合 ) において ダサチニブを 80 mm 酢酸ナトリウム緩衝液 (ph 3.2) に溶解し 15, 25 及び 45 mg/kg/ 日の投与量で 1 群あたりカニクイザル雌雄各 2 匹に単回経口投与した 12) ( 表 薬物動態試験概要表 ) 投与後 1, 2, 4, 8, 12 及び 24 時間に採血し 血漿中ダサチニブ濃度を LC/MS/MS 法により定量した 2) 投与量の増加に伴ってダサチニブの全身曝露量は増加した 15~45 mg/kg/ 日の間で AUC はほぼ投与量に比例して増加した ダサチニブの全身曝露量は雌雄で類似していた 1 ヵ月間歇投与毒性試験 (GLP 適合 ) において ダサチニブを 80 mm クエン酸ナトリウム緩衝液 (ph 3.0~3.1) に溶解し 1, 5 及び 15 mg/kg/ 日の投与量で 1 群あたりカニクイザル雌雄各 4 匹に 1 日 1 回 経口投与した 13) ( 表 薬物動態試験概要表 ) 5 日間の連続投与後に休薬を 2 日間設け 1サイクルとした 合計の投与回数は個体あたり 20 回であった 試験 1 日目及び 26 日目の投与後 1, 2, 4, 8, 12 及び 24 時間に採血し 血漿中ダサチニブ濃度を LC/MS/MS 法により定量した 2) 1~15 mg/kg/ 日の間で AUC は投与量比以上に増加した ダサチニブの全身曝露量は雌雄で類似していた また 26 日目の AUC は 1 日目と同程度であり 間歇投与を行った 26 日間でダサチニブの蓄積は認められなかった カニクイザルの 9 ヵ月間反復投与毒性試験 (GLP 適合 ) において 遊離塩基のダサチニブを 80 mm クエン酸ナトリウム緩衝溶液に溶解し 1 日 1 回 経口投与した 14) ( 表 薬物動態試験概要表 ) 当初 投与量を 1, 3 及び 10 mg/kg/ 日とし 1 群あたりカニクイザル雌雄各 6 匹に経口投与したが 高投与量 (10 mg/kg/ 日 ) での過度な毒性の発現により 高投与量では 7 日目に その他の投与量群では 8 日目に投与を中断した 高投与量群に代わりの 2 匹を組み入れ 5 日間の連続投与後休薬を 2 日間設ける投与スケジュールで 15 日目に投与を再開した その後 高投与量群については 83 日目 (12 週目 ) に 4.5 mg/kg にまで投与量を減量し 中間の投与量群 (3 mg/kg/ 日 ) については 190 日目 (27 週目 ) に 2 mg/kg まで減量した 高投与群は 毒性の発現により 181 日目 (26 週目 ) に試験を終了した 試験 1 日目 100 日目 (15 週目 ) 195 日目 (28 週目 ) 及び 282 日目 (41 週目 ) の投与後 1, 2, 4, 8, 12 及び 24 時間に採血し 血漿中ダサチニブ濃度を LC/MS/MS 法により定量した 2) サルにおけるダサチニブの全身曝露量は投与量の増加に伴って増加した 1 日目において 1~10 mg/kg の間で AUC は投与量比以上に増加したが 100, 195 及び 282 日目においてはダサチニブの全身曝露量はほぼ投与量に比例して増加した ダサチニブの全身曝露量は雌雄で類似していた ダサチニブの全身曝露量に 41 週間の反復投与による明らかな蓄積や低下は認められなかった
19 ダサチニブ水和物 薬物動態試験の概要文 Page 19 4 分布 4.1 分布容積表 3-1 に示すように マウス ラット イヌ及びサルにおける定常状態分布容積の平均値は, それぞれ 4.2 L/kg( 表 薬物動態試験概要表 ) 6.3 L/kg( 表 薬物動態試験概要表 ) 4.7 L/kg( 表 薬物動態試験概要表 ) 及び 3.5 L/kg( 表 薬物動態試験概要表 ) であった 7) これらの値はそれぞれの動物種の全身水分量よりも大きく これら動物種においてダサチニブが広範に血管外に分布していることが示唆された 4.2 組織内分布組織内分布において [ 14 C] ダサチニブ (10 mg/kg, 120 μci/kg) を ph 3.1 となるように調製した 14 mm 塩酸 /50 mm クエン酸緩衝液 (1: 1.5) の溶液として 24 匹の雄 Long Evans ラットに経口投与した 放射能は様々な組織及び器官に広範に分布した 15) ( 表 及び表 薬物動態試験概要表 ) 眼で投与後 12 時間に最高放射能濃度に到達したのを除き 組織中放射能は投与後 1 又は 4 時間に最高濃度に到達した 血中及び血漿中放射能濃度は投与後 4 時間に最高濃度に到達し それぞれ 457 及び 438 ng eq./g であった 15) ( 表 薬物動態試験概要表 ) 血中濃度の定量が可能であったサンプリングポイントである投与後 1 及び 4 時間で 血液 : 血漿比は 1.0 であり 放射能の均等な分布が示唆された 15) ( 表 薬物動態試験概要表 ) 検出された放射能の投与した放射能に対する割合が最も大きかった組織は 消化管及び肝臓であり 投与経路が経口であること 並びに主な排泄経路が糞便中であることと矛盾しない結果であった 投与後 1 及び 4 時間での血漿中濃度に対する組織中濃度の比は 大部分の組織で 1 以上であったが 脳 精巣及び骨については 1 よりも小さかった 投与後 168 時間では 22 組織中 4 組織 ( 副腎 眼 腎臓及び肝臓 ) のみから放射能を検出した 投与後 24 及び 168 時間まで組織及び消化管に残存した放射能は それぞれ投与した放射能の 8.19 及び 0.01% であった 15) 雄雌の SD ラットに [ 14 C] ダサチニブ (10 mg/kg) を単回経口投与し 組織内分布をオートラジオグラフィーで検討した 16) 雄雌の SD ラットともに 消化管及び胆汁中に高い放射能が検出された ( 表 及び-4 薬物動態試験概要表 ) 消化管における放射能が高かったことは 投与経路が経口であること 胆汁中へ排泄されること 並びに主な排泄経路が糞便中であることと矛盾しない結果であった 放射能の Cmax が高かった組織は 副腎 肝臓 脾臓 腎皮質 腎髄質 腎臓 及び腸間膜リンパ節であった 一方 Cmax が定量下限未満であったのは 雄雌ラットの小脳 大脳 眼水晶体 髄質 嗅脳及び脊髄 並びに雄ラットの眼であった また 雄ラットの精巣においてわずかに放射能が検出されたことから 放射能は血液 - 精巣関門を通過することが示唆された 16) 組織中濃度に明らかな性差はみられなかった SD ラットにおける組織内分布のプロファイルは ほとんどすべてのサンプリングポイントで眼の放射能が定量下限未満であったことを除いて Long Evans ラットと類似していた 15)16) 更に 無色素皮膚における放射能の t 1/2 (3.3 時間 ) は有色素皮膚での t 1/2 (18.1 時間 ) と比べてかなり短かった 15) これらの結果から
20 ダサチニブ水和物 薬物動態試験の概要文 Page 20 ダサチニブはメラニン色素に対して比較的高い親和性を示すと考えられるが 色素組織を有する動物種であるサルの毒性試験において 臨床上問題となるような用量に相関した眼や皮膚に関する毒性所見は認められていない 4.3 蛋白結合及び血球への分配ダサチニブの蛋白結合率を動物及びヒトの血清を用いてダサチニブ濃度を 10 μm(4880 ng/ml) として平衡透析法により検討した 血清中及び透析緩衝液中のダサチニブ濃度は LC/MS/MS 法により測定した 7) ダサチニブの蛋白結合率は マウス ラット イヌ サル及びヒトでそれぞれ 91.8, 97.4, 95.8, 96.9 及び 93.9% であった 7) ( 表 薬物動態試験概要表 ) また ダサチニブと - 脱アルキル化体の代謝物 (BMS ) のヒト血清における蛋白結合率を検討するために 別途試験を実施した この試験では 薬物濃度を 100 及び 500 ng/ml とした 17) ( 表 薬物動態試験概要表 ) 血清中及び透析緩衝液中のダサチニブ及び BMS 濃度は LC/MS/MS 法により測定した 4)18) ダサチニブの蛋白結合率は ダサチニブ濃度が 100 及び 500 ng/ml でそれぞれ 96.3% 及び 96.4% であった また BMS の蛋白結合率は BMS 濃度が 100 及び 500 ng/ml で それぞれ 93.7% 及び 93.1% であった この濃度範囲で ダサチニブ及び BMS の蛋白結合率に濃度に依存した変化は認められなかった ダサチニブ濃度を 10 μm (4880 ng/ml) としたときのマウス ラット イヌ サル及びヒト血液における血球移行率を検討した 7) ( 表 薬物動態試験概要表 ) 30 分間インキュベーションした後の血漿中濃度に対する血液濃度の比 (C 血液 /C 血漿 ) は マウス ラット イヌ サル及びヒトでそれぞれ 1.2 ± 0.1, 1.1 ± 0.2, 1.3 ± 0.1, 1.5 ± 0.1 及び 1.8 ± 0.1 であり 血球への分布が認められた インキュベーション時間を 2 時間とした場合にも同様の結果が得られた 4.4 胎盤及び乳汁移行非妊娠 妊娠及び授乳期の雌 SD ラットに [ 14 C] ダサチニブ (10 mg/kg) を単回経口投与し 組織内分布と乳汁への移行を検討した 16) 単回経口投与後 [ 14 C] ダサチニブ由来の放射能は母動物及び胎児の組織に広く分布した ( 表 薬物動態試験概要表 ) 投与後 24 時間まで 採取したすべての組織で放射能が検出された また 母動物の血液 大脳及び子宮 並びに胎児の腎及び肝臓を除いたすべての組織で投与後 72 時間まで放射能が検出された [ 14 C] ダサチニブを単回経口投与した時 母動物における血液及び血漿中放射能の Cmax はそれぞれ 102 及び 88.7 ng eq./g であり 投与後 8 時間に到達した 一方 胎児における血液中放射能の Cmax は 39.5 ng eq./g であり 投与後 12 時間で到達した 母動物の組織中放射能の Cmax は 肺 腎臓 肝臓及び胎盤で最も高く 大脳及び羊水で最も低かった 胎児の組織中放射能は 肝臓 屠殺体及び脳で最も高く 血液で最も低かった これらの結果から [ 14 C] ダサチニブ由来の放射能は 胎盤を通過することが示された 胎児の脳 ( すべてのサンプリング時間 ) 及び血液 ( 投与後 24~72 時間 ) を除いて 胎児の組織中放射能濃度は母動物の同じ組織中濃度よりも低かった 妊娠 18 日に投与したラットにおいて 母動物の脳中から放射能が検出され [ 14 C] ダサチニブ由来の放射能は血液 - 脳関門を通過することが示唆されたが 放
21 ダサチニブ水和物 薬物動態試験の概要文 Page 21 射能レベルは低かった 組織 / 母動物血漿の平均放射能濃度比は 母動物の羊水及び大脳 並びに投与後 4 時間までのすべての胎児組織を除き すべての組織で 1 以上であった また 投与後 24 時間では 大脳を除く定量可能な放射能レベルにあったすべての組織で 組織 / 母動物血漿の平均放射能濃度比が 1 以上であった ( 表 薬物動態試験概要表 ) 妊娠 18 日に投与した妊娠ラットのオートラジオグラフィーによる組織内分布の成績は 屠殺後に組織を採取して検討した成績と矛盾しなかった また 放射能レベルは低いものの [ 14 C] ダサチニブ由来の放射能が胎盤を通過することが示された ( 表 薬物動態試験概要表 ) [ 14 C] ダサチニブ由来の乳汁中放射能の Cmax は 2070 ng eq./g であり 投与後 8 時間で到達した ( 表 及び-6 薬物動態試験概要表 ) その後 乳汁中放射能濃度は徐々に低下し 投与後 72 時間には ng eq./g まで低下した このときの t 1/2 は 5.53 時間であった 乳汁及び血漿における AUC(IT) 平均値はそれぞれ 及び 1150 ng eq. h/g であった 乳汁中 / 血漿中放射能濃度の平均値比は 2.36~37.2 であり すべてのサンプリングポイントで 1 以上であった 以上のように [ 14 C] ダサチニブを妊娠ラットに単回経口投与した時 [ 14 C] ダサチニブ由来の放射能は胎盤を通過し 胎児にまで分布することが示され 全般的に胎児組織中放射能は母動物組織中放射能よりも低いレベルであった また 授乳期のラットに [ 14 C] ダサチニブを単回経口投与した時 放射能は乳汁中へ移行した [ 14 C] ダサチニブ由来の放射能は血液 - 脳関門を通過することが示唆されたが 放射能レベルは低かった
22 ダサチニブ水和物 薬物動態試験の概要文 Page 22 5 代謝 ( 動物間の比較 ) 5.1 In vivo 代謝 [ 14 C] ダサチニブを用いて ラット サル及びヒトにおける経口投与時の代謝物を検討した 19) ( 表 薬物動態試験概要表 ) また 胆管カニューレ挿入ラットにおける経口投与及び静脈内投与時 並びに胆管カニューレ挿入サルにおける静脈内投与時の代謝物についても分析した 19)20) ( 表 薬物動態試験概要表 ) これら代謝試験ではすべて雄を対象とし 血漿中 尿中 胆汁中及び糞便中代謝物のプロファイルは HPLC-ラジオクロマトグラフィーにより検討した また 代謝物を LC/MS n 及び MR により同定した 加えて HPLC での保持時間とマススペクトルのフラグメントのパターンを合成した標品と比較した この結果 酸化による代謝物及び抱合体を含む合計で 29 種の代謝物がラット サル及びヒトの in vivo 試料から検出された 酸化による代謝物として ヒドロキシクロロメチルフェニル体 (M20, M24) ヒドロキシエチル基が脱離する- 脱アルキル化体 (M4) ピペラジン環の-オキシド体(M5) 及び側鎖アルコールのカルボン酸への酸化体 (M6) 親化合物の脱水素体(M9) 及びこれら酸化経路の組み合わせによる代謝物 (M3a, M3b, M7, M14, M15, M22, M23a, M23b, M25 及び M34) が同定された また 抱合体としては 親化合物であるダサチニブのグルクロン酸抱合体 (M8a, M8b, M8c) 及び硫酸抱合体 (M13) モノヒドロキシ体のグルクロン酸抱合体 (M37a, M37b) 及び硫酸抱合体 (M21) M6 のタウリン抱合体 (M26) M6 のモノヒドロキシ体のグルクロン酸抱合体 (M36) 及び硫酸抱合体 (M30) M9 のグルクロン酸抱合体 (M35a, M35b) 並びにビスヒドロキシ体の硫酸抱合体(M31) が同定された ダサチニブと動物及びヒトから同定された代謝物の構造式をに 代謝経路を表 5-1 に示す 19)20) ( 表 薬物動態試験概要表 ) 5 種の主要な酸化代謝物 (M4, M5, M6, M20 及び M24) は標品を調製して検討した 標品の HPLC における保持時間とマススペクトルのフラグメントのパターンは ラット サル及びヒトで検出された対応する代謝物のものと一致した
23 ダサチニブ水和物 薬物動態試験の概要文 Page 23 表 5-1: ダサチニブと in vivo 及び in vitro 試験の試料から同定された代謝物の構造式 代謝物 構造式 a 由来 ダサチニブ BMS Cl H O CH 3 S CH 3 H OH ラット : RLM, RH, 血漿, 尿, 胆汁, 糞便サル : MLM, MH, 血漿, 尿, 胆汁, 糞便 ヒト : HLM, HH, 血漿, 尿, 糞便 M3a, M3b b ダサチニブのモノヒドロキシ -オキシド体 +O Cl H O CH 3 S CH 3 H O OH ラット : RLM, 尿 ( 未処置ラット ) サル : MLM, 血漿, 尿, 胆汁ヒト : HLM, 血漿, 尿 M4 BMS ダサチニブの - 脱アルキル化体 Cl H O CH 3 S CH 3 H H ラット : RLM, RH, 血漿, 尿, 胆汁, 糞便サル : MLM, MH, 血漿, 尿 ( 未処置ラット ), 胆汁, 糞便ヒト : HLM, HH, 血漿, 尿, 糞便 M5 BMS ダサチニブのピペラジン環の -オキシド Cl H O CH 3 S CH 3 H O OH ラット : RLM, RH, 血漿, 尿, 胆汁サル : MLM, MH, 血漿, 尿, 胆汁ヒト : HLM, HH, 血漿, 尿 体 M6 BMS ダサチニブのカルボン酸体 Cl H O CH 3 S CH 3 H O OH ラット : RLM, RH, 血漿, 尿, 胆汁, 糞便サル : MLM, MH, 血漿, 尿, 胆汁, 糞便ヒト : HLM, HH, 血漿, 尿, 糞便 CH 3 ラット : 尿 ( 未処置ラット ), 糞便 M7 M6 のモノオキシド体 Cl H O CH 3 S H +O O OH ( 未処置ラット ) サル : MLM, MH, 血漿, 尿, 胆汁, 糞便 ヒト : HH, 血漿, 尿
24 ダサチニブ水和物 薬物動態試験の概要文 Page 24 代謝物 構造式 a 由来 M8, M8a, M8b, M8c b ダサチニブのグルク Cl H O CH 3 S CH 3 H +Glucuronide OH ラット : 血漿 (M8, BDC ラット ), (M8c, 未処置ラット ), 尿 (M8, BDC ラット ),(M8a, M8b, 未処置ラット ), 胆汁 (M8) ロン酸抱合体 サル : 血漿 (M8a, M8b), 尿 (M8a, M8b), 胆汁 (M8a, M8b) ヒト : 血漿 (M8a, M8b), 尿 (M8a) M9 ダサチニブの脱水素体 M-2 Cl H O CH 3 S CH 3 H OH サル : MLM, MH, 糞便ヒト : HLM, 糞便 M13 ダサチニブの硫酸抱合体 Cl H O CH 3 S CH 3 H +SO 3 OH ラット : 血漿 M14 CH 3 ダサチニブのピペラジン環の開環反応による脱アルキル化体 Cl H O CH 3 S H H H OH ラット (BDC ラット ): 血漿, 尿, 胆汁 M15 ダサチニブのビスオキシド体 Cl H O CH 3 S CH 3 H +2O OH ラット (BDC ラット ): 胆汁 M20 BMS ダサチニブの 4-ヒドロキシクロロメチルフェニル体 HO Cl H O CH 3 S CH 3 H OH ラット : RLM, RH, 尿, 糞便サル : MLM, MH, 血漿, 尿, 胆汁, 糞便ヒト : HLM, HH, 血漿, 尿, 糞便
25 ダサチニブ水和物 薬物動態試験の概要文 Page 25 代謝物 構造式 a 由来 M21 M20 の硫酸抱合体 HO Cl H O CH 3 S CH 3 H +SO 3 OH ラット : RH, 尿 ( 未処置ラット ), 胆汁サル : MH, 血漿, 尿 ( 未処置サル ), 胆汁 ヒト : HH, 血漿, 尿 CH 3 M22 ダサチニブのモノオキシド体 Cl H O CH 3 S H +O OH ラット : 血漿 (BDC ラット ), 胆汁 M23, M23a, M23b b M6 のモノヒドロキシ体 +O Cl H O CH 3 S CH 3 H O OH ラット : 胆汁, 糞便サル : MLM, MH, 血漿, 胆汁, 糞便ヒト : HH, 血漿, 糞便 M24 BMS ダサチニブのヒドロキシベンジル体 Cl H O CH 2 OH S CH 3 H OH ラット : RLM, RH, 血漿 (BDC ラット ), 尿 (BDC ラット ), 胆汁, 糞便サル : MLM, MH, 血漿, 尿, 胆汁, 糞便 ヒト : HLM, HH, 血漿, 尿, 糞便 M25 M4 のピペラジン環の開環体 Cl H O CH 3 S H CH 3 H H 2 ラット : 尿 (BDC ラット ) CH 3 M26 M6 のタウリン抱合体 Cl H O CH 3 S H O H SO 3 H ラット : 胆汁
26 ダサチニブ水和物 薬物動態試験の概要文 Page 26 代謝物 構造式 a 由来 +O CH 3 M28a, M28b b M4 のヒドロキシ体 Cl H O CH 3 S H H サル : MLM, ヒト : HLM M29a, M29b, M29c b ダサチニブのビスヒドロキシ体 Cl +2O H O CH 3 S CH 3 H OH サル : MLM ヒト : HLM M30 M6 のモノヒドロキシ体の硫酸抱合体 +O, +SO 3 Cl H O CH 3 S CH 3 H O OH サル : MH, 血漿, 胆汁ヒト : HH, 血漿 M31 +2O CH 3 +SO 3 ダサチニブのビスヒドロキシ体の硫酸抱合体 Cl H O CH 3 S H OH サル : MH, 血漿, 胆汁ヒト : 血漿 +O CH 3 M34 M6 のモノヒドロキシ -オキシド体 Cl H O CH 3 S H O O OH サル : 血漿, 尿, 胆汁ヒト : 血漿, 尿 M35a, M35b b M9 のグルクロン酸抱合体 M-2 CH 3 +Glucuronide Cl H S O CH 3 H OH サル : 血漿 (M35a), 胆汁 (M35a, M35b) ヒト : 血漿 (M35a), 尿 (M35a)
27 ダサチニブ水和物 薬物動態試験の概要文 Page 27 代謝物 構造式 a 由来 M36 M6 のモノヒドロキシ体のグルクロン酸抱 +O Cl H O CH 3 S CH 3 H +Glucuronide O OH サル : 胆汁ヒト : 尿 合体 +O CH 3 +Glucuronide M37a, M37b b ダサチニブのモノヒドロキシ体のグルク Cl H O CH 3 S H OH サル : 血漿, 胆汁ヒト : 血漿, 尿 ロン酸抱合体 RH = ラット肝細胞, MH = サル肝細胞, HH = ヒト肝細胞, RLM = ラット肝ミクロソーム, MLM = サル肝ミクロソーム a M4, M5 及び M6 の構造は それぞれ BMS , BMS 及び BMS の合成標品と比較し HPLC での保持時間及び LC/MS のフラグメントパターンから同定した 19)20). M20 と M24 の構造は HLM あるいは微生物による反応物から単離した BMS 及び BMS と比較し 同定した 19)21). その他の代謝物については ダサチニブ M4, M5, M6, M20 及び M24 のマススペクトルにおけるフラグメントパターンと比較して推定した. b 代謝物 M3, M8, M23, M28, M29, M35 及び M37 について 記号 a, b 又は c はお互い異性体であることを示す. 官能基が付加される正確な位置については不明である. 出典 : 表 , , ,
28 ダサチニブ水和物 薬物動態試験の概要文 Page 28 図 5-1: In vivo におけるダサチニブの推定代謝経路 主要な代謝経路と代謝物 ラット (M8, M8a,b,c) サル (M8a,b) ヒト (M8a,b) サル ヒト ラット サル ヒト ラット ラット サル ヒト ラット ラット サル ヒト ラット サル ヒト ラット サル ヒト 多代謝経路から生成する代謝物 ラット サル ヒト ラット サル ヒト ラット ラット サル ヒト ラット ラット サル ヒト ラット サル ヒト ラット ラット サル ヒト サル ヒト サル ヒト サル ヒト サル ヒト サル (M35a,b) ヒト (M35a) 代謝物 M28a, M28b, M29a, M29b 及び M29c は in vitro のみで検出され 上図では示していない. 出典 : 表
29 ダサチニブ水和物 薬物動態試験の概要文 Page ラット SD ラットに [ 14 C] ダサチニブを経口投与 (15 mg/kg, 80 μci/kg) したとき 19) ( 表 薬物動態試験概要表 ) 並びに SD ラット又はカニューレ挿入ラットに経口又は静脈内投与 (10 mg/kg, 60 μci/kg) したときのダサチニブの代謝について検討した 20) ( 表 薬物動態試験概要表 ) ラットに [ 14 C] ダサチニブを経口又は静脈内投与したとき 投与後 1, 4 及び 8 時間の血漿中放射能は主に未変化体によるものであり 血漿中放射能の 34~55% を占めた 主な血漿中代謝物はピペラジン環の -オキシド体である M5 ダサチニブのグルクロン酸抱合体である M8 及び M8c ダサチニブの硫酸抱合体である M13 であった わずかに検出されたラットの代謝物として M4, M6, M14, M22 及び M24 が同定された ラットにおいて 胆汁中排泄はダサチニブ及び代謝物の消失に大きく寄与し 尿中排泄の薬剤消失への寄与はわずかであった ( 第 項薬物動態試験の概要文 ) 未変化体は 経口投与時には投与量の 6% が胆汁中に排泄され 静脈内投与時には 11% が排泄された 主な胆汁中代謝物は ピペラジン環の -オキシド体である M5 ヒドロキシ体の硫酸抱合体である M21 グルクロン酸抱合体である M8 カルボン酸体である M6 - 脱アルキル化アミン体である M4 であった わずかに検出された代謝物は M14, M15, M22, M23, M24 及び M26 であった カニューレを挿入していない SD ラットにダサチニブを経口投与したときの糞便中放射能は 主に未変化体によるものであり 投与量の 42% が未変化体として糞便中に排泄された また 投与量の 13% 及び 8% がそれぞれカルボン酸体 (M6) 及びヒドロキシ体 (M20) として糞便中に排泄されたが その他の酸化代謝物である M4, M7, M23a, M23b 及び M24 はそれぞれ 4% 未満であった 抱合体や -オキシド化代謝物が検出されなかったことから 胆汁中にみられたこれらの代謝物は糞便として排泄される前に腸内で加水分解又は還元されることが示唆された 投与経路に関係なく 尿中に排泄された放射能のうち 最も大きな割合を占めたのはピペラジン環の -オキシド体である M5 であったが それでも投与した放射能量の 8% 以下であった 尿中からは この他にも未変化体 M3a, M3b, M4, M6, M7, M8a, M8b, M14, M20, M21, M24 及び M25 が検出されたが いずれも 1% 未満であった 以上のように ラットにおいて ダサチニブは胆汁中及び尿中に排泄される前に非常に広範に代謝されることが示された サル雄サルに [ 14 C] ダサチニブを経口投与 (10 mg/kg) したとき 19) ( 表 薬物動態試験概要表 ) 並びにカニューレ挿入雄サルに 10 分間持続静脈内投与 (2 mg/kg) したときのダサチニブの代謝について検討した 19) ( 表 薬物動態試験概要表 ) 血漿中放射能のうち 未変化体が最も大きな割合を占め 投与後 4 時間で血漿中放射能の約 32% を占めた 19 種の代謝物がサルの血漿中から検出された これら代謝物のうち 最も大きな割合を占めたのは グルクロン酸抱合体の M8a 及び M6 のモノヒドロキシ体の硫酸抱合体である M30 であった その他のサルの血漿中代謝物として M3a, M3b, M4, M5, M6, M7, M8b, M20, M21, M23a, M23b, M24, M31, M34, M35a, M37a 及び M37b が同定された
30 ダサチニブ水和物 薬物動態試験の概要文 Page 30 ラットと同様に [ 14 C] ダサチニブを経口及び静脈内投与した放射能の大部分がそれぞれ糞便中又は胆汁中に排泄されたが 尿中への排泄は少なく 10% 未満であった ( 第 項薬物動態試験の概要文 ) 静脈内投与後 サルの胆汁中に排泄された未変化体はわずかであり 投与量の約 3% であった 胆汁中から 21 種類の代謝物が同定された サルにおける主な胆汁中代謝物は モノヒドロキシ体の硫酸抱合体である M21 カルボン酸体である M6 M6 のモノオキシド体である M7 及び M6 のモノヒドロキシ体の硫酸抱合体である M30 であった 他に 投与量の 5% 未満に相当する代謝物として M3a, M3b, M4, M5, M8a, M8b, M20, M23a, M23b, M24, M31, M34, M35a, M35b, M36, M37a 及び M37b が検出された カニューレを挿入していないサルに経口投与後の糞便中放射能は 主に未変化体によるものであり 投与量の 25% が未変化体として糞便中に排泄された また 投与量の 14% 及び 12% がそれぞれカルボン酸体 (M6) 及びヒドロキシ体 (M20) として糞便中に排泄され その他にも酸化代謝物である M4, M7, M9, M23a, M23b 及び M24 が検出された ラットと同様に 糞便中から抱合体や -オキシド化に関連した代謝物が検出されなかったことから これら胆汁代謝物は糞便として排泄される前に腸内で加水分解又は還元されることが示唆された ラットと同様に サルにおける主な尿中代謝物は ピペラジン環の -オキシド体である M5 であったが その尿中への排泄率は投与量の 7% 以下であった この他にも未変化体 M3a, M3b, M4, M6, M7, M8a, M8b, M20, M21, M24 及び M34 が尿中から検出されたが いずれも 1% 未満であった 以上のように サルにおいて ダサチニブは胆汁中及び尿中に排泄される前に非常に広範に代謝されることが示された ヒト 8 例の健康成人男子に [ 14 C] ダサチニブを経口投与 (100 mg, 120 μci) したときのダサチニブの代謝について検討した 19) ( 表 薬物動態試験概要表 ) ヒトにおけるダサチニブの代謝はラット及びサルと類似していた 血漿中放射能のうち 最も大きな割合を占めたのは未変化体であり 投与後 2 時間で血漿中放射能の約 26% を占めた サル血漿から検出された 19 種の代謝物がヒトの血漿からも検出された 投与後 2 時間のヒト血漿からダサチニブのヒドロキシ体である M20, M20 の硫酸抱合体である M21, 及び M6 のモノヒドロキシ体の硫酸抱合体である M30 が検出され 血漿中放射能に対する割合はそれぞれ 13, 10 及び 7% であった この他にも M3a, M3b, M4, M5, M6, M7, M8a, M8b, M23a, M23b, M24, M31, M34, M35a, M37a 及び M37b が血漿中から検出されたが いずれも血漿中放射能の 5% 未満であった ラット及びサルで観察されたように ヒトにおいても [ 14 C] ダサチニブを経口投与した放射能の大部分が糞便中に排泄された 尿中への排泄は少なく 投与量の 4% 未満であった ( 第 項薬物動態試験の概要文 ) 29) 主な糞便中代謝物はダサチニブのヒドロキシ体である M20 であり 投与量の 31% が M20 として糞便中に排泄された また 投与量の 19% が未変化体として糞便中に排泄され その他にもサルの糞便中から検出された 6 種類の酸化代謝物 (M4, M6, M9, M23a, M23b 及び M24) がヒトにおいても検出された ラット及びサルと同様に 糞便中から抱合体や -オキシド化に関連した代謝物が検出されなかった ラットやサルの胆汁中には抱合体や -オキ
31 ダサチニブ水和物 薬物動態試験の概要文 Page 31 シド化に関連した代謝物が認められ これら胆汁代謝物は糞便として排泄される前に腸内で加水分解又は還元されていることが示されており ヒトにおいても同様のことが起こり得ると考えられる 更に ラットやサルと同様に ヒトにおける経口投与後の主な尿中代謝物は ピペラジン環の -オキシド体である M5 であったが その尿中への排泄率は投与量の 1.4% であった この他にも未変化体 M3a, M3b, M4, M6, M7, M8a, M20, M21, M24, M34, M35a, M36, M37a 及び M37b が尿中から検出されたが いずれも投与量の 0.3% 以下であった 以上のように ラットやサルと同様に ヒトにおいてもダサチニブは排泄される前に非常に広範に代謝されることが示された 5.2 In vitro 代謝 [ 14 C] ダサチニブを用いて ラット サル及びヒト肝ミクロソーム並びに肝細胞における in vitro 代謝を検討した 22) ( 表 薬物動態試験概要表 ) 肝細胞系では ダサチニブの代謝はサルが最も速く (3 時間の変換率 39%) ヒト(22%) 及びラット (11%) の順であった 肝ミクロソームでも同様の傾向が認められ サル ヒト及びラット肝ミクロソームで 3 時間の変換率はそれぞれ 72, 65 及び 46% であった 肝細胞における代謝プロファイルは ラット サル及びヒトの間で定性的に類似していた 22) ラット サル及びヒト肝細胞のインキュベーションにより 酸化代謝物と抱合体の両方が生成した 10 種類の代謝物 (M4~M7, M20, M21, M23a, M23b, M24 及び M30) がヒト肝細胞のインキュベーションにより生成し サル肝細胞においてもこれら代謝物は検出された ラット肝細胞においては M4~M6, M20, M21 及び M24 のみが検出された それぞれの動物種の肝細胞において観察された酸化代謝物は各動物種のミクロソームのインキュベーションによっても生成された 22) 合計で 16 種類の代謝物 (M3a, M3b, M4~M7, M9, M20, M23a, M23b, M24, M28a, M28b, M29a, M29b 及び M29c) がミクロソームのインキュベーションにより同定された これらのうち 13 種類の代謝物が (M3a, M3b, M4~M6, M9, M20, M24, M28a, M28b, M29a, M29b 及び M29c) がヒト肝ミクソームの系で検出され これら代謝物はすべてサル肝ミクロソームでも検出された ラット肝ミクロソームでは M3a, M3b, M4~M6, M20, 及び M24 のみが検出された サル及びヒト肝ミクロソームにおいて 水酸化体である M20 及び M24 が最も生成量が多い代謝物であった これらを合わせると サル及びヒトにおける生成量は総放射能量のそれぞれ 30% 及び 39% に相当した 一方 ラット肝ミクロソームでは ピペラジン環の - オキシド体である M5 が最も生成量が多い代謝物であり 総放射能量の 37% であった これらの結果は サル及びヒトにおいて M20 及び M24 が主要な代謝物であるのに対し ラットでは M5 が主要な代謝物であるという in vivo の成績と矛盾しない成績であった ダサチニブの代謝に寄与する多様な酵素を同定するための予備的な試験において 遺伝子組み換えヒト CYP 酵素を用い ダサチニブ濃度を 1, 10 及び 100 μm としてインキュベーションした 7) ( 表 薬物動態試験概要表 ) ヒト肝で観察される各 CYP 酵素の発現系において ダサチニブの消失で表される代謝速度から CYP3A4 がダサチニブの代謝に大きく寄与する主要な
32 ダサチニブ水和物 薬物動態試験の概要文 Page 32 代謝酵素として同定され その他の酵素によっても代謝され得ると考えられた ヒト ADME 試験の結果を基に より詳細に代謝を検討するヒト肝ミクロソーム及び酵素発現系 (CYP1A1, 1A2, 1B1, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 3A4, 3A5, 4A11 及び FMO3) における追加試験を実施した 試験には [ 14 C] ダサチニブを用い 主要な代謝物である M4, M5, M6, M20 及び M24 の生成に関与する酵素を同定した 21) ( 表 薬物動態試験概要表 ) In vivo 試験において ラット サル及びヒトから複数のダサチニブのグルクロン酸抱合体が認められたが ダサチニブのグルクロン酸抱合化に関与するウリジンジホスフェート-グルクロノシルトランスフェラーゼ (UGT) 酵素については同定されていない 酵素発現系において [ 14 C] ダサチニブは CYP1A1, 1A2, 1B1, 3A5, 3A4 及び FMO3 により代謝され M4, M5, M20 及び M24 を生成したが CYP2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 又は 4A11 による M4, M5, M20 及び M24 への代謝は認められなかった ヒト肝における各 CYP 及び FMO3 酵素の相対的な存在量から CYP3A4 が M4, M20 及び M24 を生成する主要な酵素であり FMO3 が M5 を生成する主要な酵素と考えられた この推定はヒト肝ミクロソームを用いた阻害試験の成績で M4, M20 及び M24 の生成が CYP を全般的に阻害する 1-aminobenzotriazole 及び CYP3A4 を特異的に阻害するケトコナゾール トレアンドマイシン及び抗 CYP3A4 抗体により阻害されたことからも支持された 21) 温度に敏感な FMO3 酵素を不活性化するが CYP 酵素の活性は維持する処置として ヒト肝ミクロソーム又は FMO3 発現系を 45 C で 5 分間 インキュベートした この処置により M5 の生成が阻害された 代謝物 M6 はいずれの発現系酵素においても検出されなかったが ヒト肝ミクロソーム及びヒト肝 S9 のインキュベーションにより生成した これらの知見から ダサチニブの代謝による M6 の生成には酸化還元酵素が関与している可能性が示唆される ヒト肝ミクロソームにおいて M4, M5, M20 及び M24 の生成に濃度依存性が認められた M4, M5, M20 及び M24 の生成はミカエリス-メンテン型の速度式で表現され 触媒効率 (V max /K m ) はそれぞれ 10.8, 14.2, 279, 及び 10.0 μl/mg protein/min であった 21) ( 表 薬物動態試験概要表 ) V max /K m 比から CYP3A4 は M4 や M24 と比べて M20 をかなり効率よく生成すると考えられた この結果は ヒトにおいて M20 がダサチニブの投与量の 31% を占めているのに対し M4 及び M24 は それぞれ投与量の 4.2% 以下であることと矛盾しない成績であった 19) ( 表 薬物動態試験概要表 ) 以上のように in vitro と in vivo 試験の結果から ラット サル及びヒトにおいてダサチニブは多数の酸化代謝物及び抱合体へと代謝されることが示された また CYP3A4, FMO3 及び未同定の酸化還元酵素を含む多種の酵素がダサチニブの代謝に寄与している ヒトにおいて 代謝物 M4, M20 及び M24 は合計で投与量の 38% に相当しており CYP3A4 がダサチニブの代謝クリアランスに大きく寄与する主要な酵素であると考えられた その他の酵素 すなわち FMO3 酸化還元酵素 及び UGTs のダサチニブの代謝への寄与の程度については 現在のところ不明である 5.3 ヒトチトクローム P450 酵素の誘導あるいは阻害初めに in vitro でのヒトプレグナン X レセプター (hpxr) 転写活性化試験法により ダサチニブが CYP3A4 を誘導する可能性について評価した ダサチニブの濃度は 0.1, 1, 10 及び 25 μm とし リファンピシンを陽性対照として 0.1, 1, 5 及び 10 μm の濃度で検討した 7) ( 表 薬
33 ダサチニブ水和物 薬物動態試験の概要文 Page 33 物動態試験概要表 ) 試験に用いたダサチニブの濃度では CYP3A4 の hpxr 依存性のトランス活性化を促進しなかったが リファンピシンは濃度に依存して hpxr を 2~37 倍活性化した これらの結果から ダサチニブには hpxr の活性化を介した CYP3A4 の誘導作用がほとんどないと考えられた ダサチニブが肝 CYP 酵素 (CYP1A2, 2B6, 2C9 及び 3A4) を誘導する可能性について 更にヒト肝細胞による検討を加えた 5) ( 表 薬物動態試験概要表 ) この試験では 3 例のドナーから得られたヒト肝細胞の初代培養を用い ダサチニブ濃度を 0.2, 1, 5 及び 25 μm とした 陽性対照である 3-methylcholanthrene(2 μm) フェノバルビタール(1000 μm) 及びリファンピシン (10 μm) では陽性対照として適切に酵素活性と CYP mra 発現レベルが増加したが ダサチニブでは明らかな酵素活性及び mra 発現の増加は認められなかった 5) これらの試験成績から 25 μm ( 約 12.2 μg/ml) までの濃度で ダサチニブは CYP1A2, 2B6, 2C9 及び 3A4 の酵素活性を誘導しないと考えられた 試験した最高濃度は ダサチニブ 70 mg を 1 日 2 回 7 日間反復投与したときの CML 患者における Cmax の 100 倍を超える値である 23) これらの成績から CYP1A2, 2B6, 2C9 又は 3A4 で主に代謝される併用薬剤の曝露量を低下させる可能性はかなり低いと考えられる 0.1~50 μm(0.05~24.4 μg/ml) の濃度でダサチニブが肝 CYP 酵素 (CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 及び 3A4) を阻害する可能性について ヒト肝ミクロソームを用いて検討した ( 表 及び 薬物動態試験概要表 ) 更に ダサチニブが同じ濃度範囲で CYP 酵素に対し 時間依存的な代謝様式を示すかどうか評価した ダサチニブは 50 μm までの濃度範囲で CYP1A2, 2B6, 2C19, 2D6 又は 2E1 を阻害しなかったが CYP2A6, 2C8 及び 2C9 を阻害し IC 50 値それぞれ 35, 12 及び 50 μm であった また ダサチニブは CYP3A4 を阻害し ミダゾラム及びテストステロンを基質とした場合の IC 50 は それぞれ 18 及び 10 μm であった ダサチニブによる CYP2C8 の阻害について 競合阻害モデルで算出される K i 値 ( 阻害定数 ) は 3.6 μm であった 6) ( 表 薬物動態試験概要表 ) ダサチニブは CYP3A4 に対して時間依存的な阻害を示し ミダゾラムをプローブ基質とした場合には K I 値 ( 不活性化の最大速度定数の 1/2 の速度に達する濃度 ) 及び k inact 値 ( 不活性化の最大速度定数 ) がそれぞれ 1.9 μm 及び min -1 であった その他の酵素については時間依存的な阻害を示す傾向は観察されなかった 今回のヒト肝ミクロソームにおける阻害試験の結果は 先に実施した個々の CYP 発現系による試験で CYP1A2, 2C9, 2C19 及び 2D6 に対する IC 50 値が 32 μm 以上であったという成績と矛盾しない成績であった また ダサチニブは CYP3A4 を時間依存的に阻害すると考えられた 7) ダサチニブによる CYP3A4 の時間依存型阻害の程度について K I 値及び k inact 値を算出し 時間依存型阻害を示すことが知られているジルチアゼムとエリスロマイシンと比較した 24) ジルチアゼムの K I 値及び k inact 値はそれぞれ 2.8 μm 及び min -1 であり エリスロマイシンではそれぞれ 5.1 μm 及び min -1 であった 6) ( 表 薬物動態試験概要表 ) これらの成績から in vitro において ダサチニブはジルチアゼム及びエリスロマイシンと類似した阻害特性を有することが示された CML 患者において ダサチニブ 70 mg を 1 日 2 回 反復投与したときの定常状態時の Cmax 平均値が 0.12 μm(57 ng/ml, 変動係数 65%) 23) であり Cmax/K i 比は 0.1 未満となることから CYP2C8
34 ダサチニブ水和物 薬物動態試験の概要文 Page 34 の基質となる薬剤との併用により薬物間相互作用が発現する可能性は低いと考えられた 25) ダサチニブによる CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6 及び 2E1 の阻害についても同様に 各酵素の IC 50 値から これら酵素の基質となる薬剤との併用により薬物間相互作用が発現する可能性は低いと考えられた また in vitro での阻害パラメータと定常状態時のダサチニブの血漿中濃度から ダサチニブによる CYP3A4 の阻害は弱いと考えられるが 時間依存型の阻害様式であるため in vivo での阻害の強さを予測することは困難である
35 ダサチニブ水和物 薬物動態試験の概要文 Page 35 6 排泄マウス ラット イヌ及びサルにおける静脈内投与後あるいは動脈内投与後 ( ラット ) の全身クリアランスを検討した ( 表 , -3, -4 及び-5 薬物動態試験概要表 ) マウス ラット イヌ及びサルにおけるダサチニブの全身クリアランスは 62, 26, 25 及び 34 ml/min/kg であった ( 表 3-1) また マウス ラット イヌ及びサルにおける経口投与時の終末消失相半減期は 2~5 時間であった 6.1 ラットマスバランス試験において 雄 SD ラットに [ 14 C] ダサチニブ (15 mg/kg, 80 μci/kg) を 80 mm クエン酸緩衝液 (ph 3.1) に溶解して単回経口投与したときの尿中及び糞便中放射能排泄量を検討した 26) ( 表 薬物動態試験概要表 ) この試験では ラット(3 匹 ) から様々な時間間隔で投与後 168 時間まで尿及び糞便を採取した 168 時間までに投与した放射能の 6.5% が尿中に排泄され そのうち 0.7% が未変化体に相当した 投与した放射能の大部分 (76.4%) は糞便中に排泄された また ケージを洗浄した際の残渣試料に含まれた放射能は 6.7% であった 投与後 168 時間後の屠殺動物に残存した平均放射能量は投与した放射能の 0.31% であり この時間までにほぼ完全に放射能は排泄されていたと考えられた 放射能の排泄は速やかで 投与後 48 時間の放射能排泄率は 75% を超えていた カニューレ挿入ラット ( 雄 ) に [ 14 C] ダサチニブ (10 mg/kg, 60 μci/kg) を 50 mm 酢酸緩衝液 (ph 4.0) に溶解して単回で経口又は静脈内投与し ( 各処置に 2 匹 ) 尿中及び胆汁中放射能排泄量を検討した 20) ( 表 薬物動態試験概要表 ) 投与後 12 時間まで尿を採取した 経口及び静脈内投与後 投与した放射能のそれぞれ約 3.2% 及び 12.0% が尿中に排泄され 胆汁中にはそれぞれ 35.8% 及び 67.4% が排泄された また 経口投与したラットの消化管に投与した放射能の 53% が残存していた 尿中及び胆汁中に排泄された放射能のうち未変化体は それぞれ投与量の 0.7% 未満及び 12% 未満であった このように 経口及び静脈内投与後の胆汁中放射能排泄率は尿中排泄率と比較して高いことから ラットにおいて 胆汁中排泄はダサチニブとその代謝物の消失に大きく寄与し 主要な排泄経路であると考えられた 6.2 サルマスバランス試験において 3 匹の雄カニクイザルに [ 14 C] ダサチニブ (10 mg/kg, 30 μci/kg) を 80 mm クエン酸緩衝液 (ph 3.1) に溶解して単回経口投与したときの尿中及び糞便中放射能排泄量を検討した 27) ( 表 薬物動態試験概要表 ) この試験では 様々な時間間隔で投与後 168 時間まで尿及び糞便を採取した 168 時間までに投与した放射能の 3.0% が尿中に排泄され 大部分 (76.8%) は糞便中に排泄された また ケージを洗浄した際の残渣試料に含まれた放射能は 8.8% であり これを含めた全体の放射能排泄率は 88.7% であった 放射能の排泄は速やかで 投与後 48 時間の放射能排泄率は約 80% であった カニューレ挿入カニクイザル ( 雄 ) に [ 14 C] ダサチニブ (2 mg/kg, 30 μci/kg) を 80 mm クエン酸
36 ダサチニブ水和物 薬物動態試験の概要文 Page 36 緩衝液 (ph 3.1) に溶解して単回静脈内投与し ( 各処置に 3 匹 ) 尿中及び胆汁中放射能排泄量を検討した 28) ( 表 薬物動態試験概要表 ) 投与後 72 時間まで尿 胆汁及び糞便を採取し 放射能量を測定した結果 投与後 72 時間までの尿中 胆汁中及び糞便中放射能排泄率は それぞれ 9.9%, 67.2% 及び 13.7% であった この結果から サルにおいて胆汁中排泄はダサチニブとその代謝物の消失に大きく寄与する主要な排泄経路であることが示された また ダサチニブ及びその代謝物の腸管への分泌が示唆された 6.3 ヒト ADME 試験において 8 例の健康成人男子に [ 14 C] ダサチニブ (100 mg, 120 μci) をクエン酸緩衝溶液で単回経口投与したときの尿中及び糞便中放射能排泄量を検討した 29) ( 表 薬物動態試験概要表 ) この試験では 様々な時間間隔で投与後 216 時間まで尿及び糞便を採取した 216 時間までに 投与した放射能の大部分 (85.3%) は糞便中に排泄された 一方 放射能の尿中排泄率は投与量のわずか 3.6% であり 未変化体は投与量の約 0.1% であった ラット サル及びヒトにおける各採取試料における放射能排泄率を表 6-1 に示す 表 6-1: ラット サル及びヒトにおける [ 14 C] ダサチニブ投与後の放射能排泄率の要約 動物種 投与量試料採取放射能の排泄率 (%) ( 投与経路 ) 間隔尿胆汁糞便合計 ラット 15 mg/kg( 経口 ) 時間 6.5 A a BDC ラット 10 mg/kg( 経口 ) 0-12 時間 C 39.0 b 10 mg/kg( 静注 ) 0-12 時間 C 79.4 サル 10 mg/kg( 経口 ) 時間 3.0 A c BDC サル 2 mg/kg( 静注 ) 0-72 時間 ヒト 100 mg( 経口 ) 時間 3.6 A a ケージを洗浄した際の残渣試料に含まれた放射能は 6.7% で 投与後 168 時間後の屠殺動物に残存した平均放 射能量は投与した放射能の 0.31% であり これらを含めた排泄率の合計は 89.8% であった. b 経口投与後 12 時間でラットの消化管に投与した放射能の 53% が残存しており これを含めた排泄率の合計は 92.0% であった. c 投与後 168 時間でケージを洗浄した際の残渣試料に含まれた放射能は 8.84% であり これを含めた全体の放射 能排泄率は 88.6% であった. A: 該当せず C: 採取せず
37 ダサチニブ水和物 薬物動態試験の概要文 Page 37 7 薬物動態学的薬物相互作用 非臨床試験において 薬物動態学的相互作用試験は実施していない
38 ダサチニブ水和物 薬物動態試験の概要文 Page 38 8 その他の薬物動態試験 その他の非臨床薬物動態試験は実施していない
39 ダサチニブ水和物 薬物動態試験の概要文 Page 39 9 考察及び結論マウス ラット イヌ及びサルを含む複数の動物種における非臨床試験を実施し in vitro 及び in vivo においてダサチニブの吸収 分布 代謝及び排泄を評価した また 主要な毒性試験 (GLP 適合 ) の評価のサポートとして TK を評価した ラット及びサルが毒性試験の主要な動物種である TK 試験 (GLP 適合 ) において ラット ウサギあるいはサルの血漿中ダサチニブ濃度をバリデートされた LC/MS/MS 法により測定した このバリデートされた LC/MS/MS 法は高感度で 真度及び精度に優れた測定法であった 探索的試験でではその他に LC/MS LC/MS n LC/UV 液体シンチレーションカウンター又は液体クロマトグラフィー / ラジオクロマトグラフィー分析 ( 放射能測定用 ) の分析法を用いた ダサチニブはマウス ラット イヌ及びサルに経口投与後 速やかに吸収された 単回経口投与後の生物学的利用率の平均値は 14~34% であった ラット及びサルにおいて ダサチニブの全身曝露量は投与量に依存し 明らかな性差は認められなかった 1 日 1 回の反復投与後に顕著な蓄積は観察されなかった Caco-2 細胞系におけるダサチニブの透過係数は約 102 nm/sec であり これはヒトにおける経口吸収が 50% 以上である薬物と同程度の値である ダサチニブは Caco-2 細胞を用いた透過性試験において P 糖蛋白の基質であることが示されたが P 糖蛋白ノックアウトマウスにおけるダサチニブの吸収は野生型マウスと類似していた また Caco-2 細胞を用いた透過性分析の結果 ダサチニブは P 糖蛋白の阻害剤ではないことから P 糖蛋白の基質となる薬剤との併用により薬物間相互作用を引き起こす可能性は低い マウス ラット イヌ サル及びヒト血清に対するダサチニブの蛋白結合率は高かった (> 91%) 血漿中濃度に対する血液中濃度比は 1.1( ラット )~1.8( ヒト ) であり 血球への分布が認められた マウス ラット イヌ 及びサルにおける定常状態分布容積 (Vss) の平均値はそれぞれの動物種の全身水分量より大きいことから ダサチニブは血管外に広範囲にわたって分布すると考えられた ラットに [ 14 C] ダサチニブを経口投与後 ダサチニブはラットの組織に広範囲にわたって分布した 投与量に対する組織中放射能の割合が最も高かった組織は消化管及び肝臓であった 妊娠ラットに [ 14 C] ダサチニブを単回経口投与後 放射能は胎盤を通過し 胎児にまで分布した 胎児組織中の放射能レベルは母動物組織よりも低かった また 授乳期ラットに [ 14 C] ダサチニブを単回経口投与後 放射能は乳汁中へ分泌された ヒトにおけるダサチニブの代謝経路はラットやサルと定性的に類似していた ヒト ラット及びサルから同定された代謝物は ヒドロキシクロロメチルフェニル体 ピペラジン環の -オキシド体 及びヒドロキシエチル部位の - 脱アルキル化体 ヒドロキシエチル部位のカルボン酸への酸化 ダサチニブのグルクロン酸及び硫酸抱合体 又は酸化代謝物であった ヒトの血漿中代謝物のプロファイルはサルと非常に類似しており ヒトで認められたすべての代謝物はサルの血漿中にも存在した ラット サル及びヒトの血漿から検出された薬剤に関連する化合物のうち 最も多量に存在したものは未変化体であった 種々の動物種及びヒトの肝ミクロソーム及び肝細胞を用いた in vitro 試験から得られた代謝プロファイルは in vivo から得られたプロファイルと矛盾しないものであった ダサチニブの酸化的
40 ダサチニブ水和物 薬物動態試験の概要文 Page 40 代謝には CYP3A4 FMO3 及び未同定の酸化還元酵素を含む多数の酵素が関与していた 酸化代謝物である M4 M20 及び M24 は in vitro においてほとんどが CYP3A4 により生成されており ヒトの in vivo ではダサチニブの投与量の 38% に相当する量であったことから CYP3A4 はダサチニブの代謝クリアランスに大きく寄与する主要な代謝酵素であると考えられた しかしながら その他の酵素 すなわち FMO3 酸化還元酵素 及び UGTs のダサチニブの代謝への寄与の程度については 現在のところ不明である マウス ラット イヌ及びサルにおいてダサチニブの全身クリアランスは 25( イヌ )~62 ml/min/kg( マウス ) の範囲であり 中程度から高値のクリアランスを示した 経口投与後の終末消失相 t 1/2 は 2( マウス )~5 時間 ( イヌ ) の範囲であった ラット サル及びヒトに [ 14 C] ダサチニブを経口投与後 ダサチニブ由来の放射能は主に糞便中に排泄 (> 76%) され 尿中への排泄は投与量の 7% 未満であった 胆管カニューレ挿入ラット及びサルに [ 14 C] ダサチニブを静脈内投与後 胆汁中に排泄された放射能は約 67% であり 尿中には約 10~12% が排泄された 更に 胆管カニューレ挿入サルでは 糞便中に約 14% が排泄されており ダサチニブ及びその代謝物の腸管への分泌が示唆された 胆汁中排泄と同様に腸分泌がヒトにおける糞便中への排泄に寄与している可能性がある サルの胆汁中には未変化体は投与量の 3% であり 尿中未変化体は 0.1% であった ラットにおいてもサルと同様に 胆汁中及び尿中放射能の未変化体の画分はわずかであったことから これら動物種でダサチニブの消失に大きく寄与しているのは代謝であると考えられた また ヒトにおいても代謝はダサチニブの消失に大きく寄与していた ダサチニブはヒト肝細胞において CYP1A2 CYP2B6 CYP2C9 あるいは CYP3A4 を誘導しなかった また これら知見と同様に in vitro においてダサチニブは hpxr を活性化しなかった したがって ダサチニブが CYP 酵素を誘導することによる薬物間相互作用を引き起こす可能性は低いと考えられる ダサチニブはヒトミクロソーム系で CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6 及び 2E1 の酵素活性をほとんど阻害しなかったが CYP2C8 に対しては阻害作用を示し CYP3A4 では時間依存型の阻害作用を示した ヒト肝ミクロソームにおいて CYP2C8 の競合阻害の K i 値は 3.6 μm(1756 ng/ml) あり CYP3A4 の時間依存型阻害の K I 値及び K inact 値はそれぞれ 1.9 μm(927 ng/ml) 及び min -1 であった 慢性骨髄性白血病 (CML) 患者に 70 mg を 1 日 2 回 反復投与したときの定常状態時の Cmax は約 0.12 μm(57 ng/ml, 変動係数 65%) であった 23) CYP2C8 阻害について Cmax/K i 比は 0.1 未満であり CYP2C8 の基質となる薬剤とダサチニブとの併用による薬物間相互作用が発現する可能性は低い In vitro における阻害パラメータ値と定常状態時の血漿中濃度からは ダサチニブは CYP3A4 に対して弱い阻害作用を示すと予測される しかし CYP3A4 に対しては時間依存型の阻害様式であることから in vivo での CYP3A4 阻害の強さを評価することは困難であった 以上のように ヒトと比較したマウス ラット イヌ及びサルにおけるダサチニブの吸収 分布 代謝及び排泄のプロファイルから ダサチニブとその代謝物の安全性を評価するのにこれら動物種は適当であったと考えられた
41 ダサチニブ水和物 薬物動態試験の概要文 Page 参考文献 1) 2) 3) 4) 5) 6) 7) 8) 9) 10) 11). Quantitative determination of BMS in rat K 3 EDTA plasma by LC/MS/MS, Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ). Quantitative determination of BMS in monkey K 3 EDTA plasma by LC/MS/MS, Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ). Quantitative determination of BMS in rabbit K 3 EDTA plasma by LC/MS/MS, Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ). Partial Method Validation for the Quantitative Determination of BMS and BMS in 1:1 Human Serum/Dialysis Buffer by LC/MS/MS, Report. Advion BioServices. 20. BMS Document Control o..( 第 項 ). In Vitro Assessment of BMS as an Inducer of Cytochrome P450 Expression in Cultured Human Hepatocytes, Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ). In Vitro Evaluation of BMS as an Inhibitor of Human Cytochrome P450 Enzymes, Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ). Preclinical Evaluation of the Pharmacokinetics and Metabolism of BMS , Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ),,. BMS : One-Month Intermittent Dose Oral Toxicity Study in Rats (Study o. DS02158), Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ). BMS : Six-Month Oral Toxicity Study in Rats (DS03072), Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ). BMS : Oral Study of Embryo-Fetal Development in Rats (Study D04078), Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ). BMS : Oral Study of Embryo-Fetal Development in Rabbits (Study D04080), Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 )
42 ダサチニブ水和物 薬物動態試験の概要文 Page 42 12) 13) 14) 15) 16) 17) 18) 19) 20) 21) 22),. BMS : Single-Dose Oral Toxicity Study in Monkeys (Study DS02147), Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ),, Pearson RC. BMS : One-Month Intermittent Dose Oral Toxicity Study in Monkeys (Study o. DS02159), Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ),. ine Month Oral Toxicity Study in Cynomolgus Monkeys (DS03073), Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ). Tissue Distribution of Radioactivity in Male Long-Evans Rats Following Oral Administration of [ 14 C]BMS (Study o. MBA00038), Report., 20. BMS Document Control o..( 第 項 ). Lacteal Excretion and Fetal Tissue Distribution of Radioactivity in Pregnant Female Sprague Dawlwy Rats and Tissue Distribution of Radioactivity in Male and on-pregnant Female Sprague Dawley Rats Following Oral Administration of [ 14 C]BMS (Study ID ), Report BMS Document Control o.. ( 第 項 ). In Vitro Protein Binding Determination of BMS in Human Serum Using Equilibrium Dialysis, Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ) and. Determination of BMS and BMS in 1:1 Human Serum/Dialysis Buffer in an In Vitro Protein Binding Study. Advion Biosciences, Inc. Bionalytical Study Report 05264BTH_BP.DOC. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ),,,. Biotransformation of [ 14 C]Dasatinib (BMS ) in Rats, Monkeys, and Humans, Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ),. Biotransformation of [ 14 C] BMS after Intravenous and Oral Administration to Bile Duct Cannulated Rats, Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ),,, Christopher L. Identification of Enzymes Involved in the Oxidative Metabolism of [ 14 C]Dasatinib (BMS ), Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ),,. Biotransformation of [ 14 C]Dasatinib in Hepatocyte and Liver Microsomal Preparations from Rat, Monkey and Human, Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 )
43 ダサチニブ水和物 薬物動態試験の概要文 Page 43 23) 24) 25) 26) 27) 28) 29) Ascending-Dose Studies in Chronic Myelogenous Leukemia Patients Resistant or Intolerant to Imatinib Mesylate - Preliminary Pharmacokinetic Data for Study CA (as of, 20 ), Report. Bristol-Myers Squibb Pharmaceutical Research Institute. 20. BMS Document Control o..( 第 項 ) Zhou, S, Chan SY, Goh BC, Chan E, Duan W, Huang M, McLeod HL. Mechanism-Based Inhibition of Cytochrome P450 3A4 by Therapeutic Drugs. Clin. Pharmacokinet. 2005;44(3): ( 第 項 ) Bjornsson TD, Callaghan JT, Einholf HJ et.al. Perspective: The Conduct of In Vitro and In Vivo Drug-Drug Interaction Studies: A Pharmaceutical Research and Manufacturers of America (PhRMA) Perspective. Drug Metabolism and Disposition. 2003;31(7): ( 第 項 ). Mass Balance of Radioactivity After Oral Administration of [ 14 C]BMS to Male Rats (Study o. MBA00096), Report., 20. BMS Document Control o..( 第 項 ). Pharmacokinetics of Radiolabeled BMS and Excretion of Radioactivity after Oral Administration of [ 14 C]BMS to Male Cynomolgus Monkeys (Study o. MBA00097), Report., 20. BMS Document Control o..( 第 項 ). Biliary Excretion of Radioactivity after Intravenous Administration of [ 14 C]BMS to Male Cynomolgus Monkeys (Study o. MBA00127), Report., 20. BMS Document Control o..( 第 項 ). [ 14 C]BMS : Total Radioactivity Analysis of Clinical Trial Samples for Clinical Protocol umber CA (Study o. MBA00129), Report., 20. BMS Document Control o..( 第 項 )
薬物動態試験 : 単回投与後の組織分布 ( その3) 薬物動態試験 : 反復投与後の組織分布 薬物動態試験 : 反復投与後の組織分布 ( 続き ) 薬物動態試験 : 反復投与後の組織分布 ( 続き )...
 2.6.5 目次 2.6.5...4 2.6.5.1 薬物動態試験 : 一覧表 ( その1)...4 2.6.5.1 薬物動態試験 : 一覧表 ( その2)...5 2.6.5.1 薬物動態試験 : 一覧表 ( その3)...6 2.6.5.1 薬物動態試験 : 一覧表 ( その4)...7 2.6.5.1 薬物動態試験 : 一覧表 ( その5)...8 2.6.5.2 薬物動態試験 : 分析方法及びバリデーション試験
2.6.5 目次 2.6.5...4 2.6.5.1 薬物動態試験 : 一覧表 ( その1)...4 2.6.5.1 薬物動態試験 : 一覧表 ( その2)...5 2.6.5.1 薬物動態試験 : 一覧表 ( その3)...6 2.6.5.1 薬物動態試験 : 一覧表 ( その4)...7 2.6.5.1 薬物動態試験 : 一覧表 ( その5)...8 2.6.5.2 薬物動態試験 : 分析方法及びバリデーション試験
2.6.4 薬物動態試験の概要文 目次 略語 略号一覧 薬物動態試験の概要文 まとめ 吸収 分布 代謝 ( 動物種間の比較 ) 排泄
 タリオン 錠 5mg, タリオン 錠 10mg タリオン OD 錠 5mg, タリオン OD 錠 10mg 製造販売承認事項一部変更承認申請書 添付資料 第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 田辺三菱製薬株式会社 1 2.6.4 薬物動態試験の概要文 目次 略語 略号一覧... 3 2.6.4 薬物動態試験の概要文... 5 2.6.4.1
タリオン 錠 5mg, タリオン 錠 10mg タリオン OD 錠 5mg, タリオン OD 錠 10mg 製造販売承認事項一部変更承認申請書 添付資料 第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 田辺三菱製薬株式会社 1 2.6.4 薬物動態試験の概要文 目次 略語 略号一覧... 3 2.6.4 薬物動態試験の概要文... 5 2.6.4.1
(2) 健康成人の血漿中濃度 ( 反復経口投与 ) 9) 健康成人男子にスイニー 200mgを1 日 2 回 ( 朝夕食直前 ) 7 日間反復経口投与したとき 血漿中アナグリプチン濃度は投与 2 日目には定常状態に達した 投与 7 日目における C max 及びAUC 0-72hの累積係数はそれぞれ
 1. 血漿中濃度 (1) 健康成人の血漿中濃度 ( 単回経口投与 ) 8) 健康成人男子にスイニー 100mg 又は200mgを空腹時に単回経口投与したときの血漿中アナグリプチン濃度は 投与後約 1~ 2 時間で C maxに達した後 二相性の消失を示し t 1/2αは約 2 時間 t 1/2βは約 6 時間であった C max 及びAUC0- は投与量の増加に伴って増加した 血漿中アナグリプチン濃度推移
1. 血漿中濃度 (1) 健康成人の血漿中濃度 ( 単回経口投与 ) 8) 健康成人男子にスイニー 100mg 又は200mgを空腹時に単回経口投与したときの血漿中アナグリプチン濃度は 投与後約 1~ 2 時間で C maxに達した後 二相性の消失を示し t 1/2αは約 2 時間 t 1/2βは約 6 時間であった C max 及びAUC0- は投与量の増加に伴って増加した 血漿中アナグリプチン濃度推移
非臨床概要薬物動態試験の目次 項目 - 頁 薬物動態試験の概要文 p まとめ p 分析方法 p 被験物質 p
 非臨床概要薬物動態試験の目次 項目 - 頁 2.6.4. 薬物動態試験の概要文... 2.6.4 - p. 1 2.6.4.1. まとめ... 2.6.4 - p. 1 2.6.4.2. 分析方法... 2.6.4 - p. 4 2.6.4.2.1. 被験物質... 2.6.4 - p. 4 2.6.4.2.2. 分析法... 2.6.4 - p. 4 2.6.4.3. 吸収... 2.6.4 -
非臨床概要薬物動態試験の目次 項目 - 頁 2.6.4. 薬物動態試験の概要文... 2.6.4 - p. 1 2.6.4.1. まとめ... 2.6.4 - p. 1 2.6.4.2. 分析方法... 2.6.4 - p. 4 2.6.4.2.1. 被験物質... 2.6.4 - p. 4 2.6.4.2.2. 分析法... 2.6.4 - p. 4 2.6.4.3. 吸収... 2.6.4 -
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル
 ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
ロペラミド塩酸塩カプセル 1mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロペラミド塩酸塩は 腸管に選択的に作用して 腸管蠕動運動を抑制し また腸管内の水分 電解質の分泌を抑制して吸収を促進することにより下痢症に効果を示す止瀉剤である ロペミン カプセル 1mg は 1 カプセル中ロペラミド塩酸塩 1 mg を含有し消化管から吸収されて作用を発現する このことから
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社
 オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
オクノベル錠 150 mg オクノベル錠 300 mg オクノベル内用懸濁液 6% 2.1 第 2 部目次 ノーベルファーマ株式会社 Page 2 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 第 2 部 :CTD の概要 ( サマリー ) 2.1 CTD の目次 ( 第 2 部から第 5 部 ) 2.2 諸言 2.3 品質に関する概括資料 2.3.I 諸言 2.3.S 原薬 ( オクスカルバゼピン,
薬物動態試験の概要文
 アマージ錠 2.5mg 製造販売承認申請 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.5 薬物動態試験概要表 グラクソ スミスクライン株式会社 目次 頁 2.6.4. 薬物動態試験の概要文 1 2.6.4.1. まとめ 1 2.6.4.2. 分析法 4 2.6.4.2.1. 被験物質 4 2.6.4.2.2. 分析方法 4 2.6.4.3. 吸収
アマージ錠 2.5mg 製造販売承認申請 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.5 薬物動態試験概要表 グラクソ スミスクライン株式会社 目次 頁 2.6.4. 薬物動態試験の概要文 1 2.6.4.1. まとめ 1 2.6.4.2. 分析法 4 2.6.4.2.1. 被験物質 4 2.6.4.2.2. 分析方法 4 2.6.4.3. 吸収
ダクラタスビル塩酸塩 薬物動態試験の概要文 Page 2 用語及び略語一覧 ATP adenosine triphosphate アデノシン三リン酸 AUC area under the concentration-time curve 血中濃度曲線下面積 AUC(INF) area u
 ダクラタスビル塩酸塩 2.6.4 薬物動態試験の概要文 Page 1 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 ブリストル マイヤーズ株式会社 ダクラタスビル塩酸塩 2.6.4 薬物動態試験の概要文 Page 2 用語及び略語一覧 ATP adenosine triphosphate アデノシン三リン酸 AUC area under the concentration-time
ダクラタスビル塩酸塩 2.6.4 薬物動態試験の概要文 Page 1 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 ブリストル マイヤーズ株式会社 ダクラタスビル塩酸塩 2.6.4 薬物動態試験の概要文 Page 2 用語及び略語一覧 ATP adenosine triphosphate アデノシン三リン酸 AUC area under the concentration-time
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに
 ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
ピルシカイニド塩酸塩カプセル 50mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにピルジカイニド塩酸塩水和物は Vaughan Williams らの分類のクラスⅠCに属し 心筋の Na チャンネル抑制作用により抗不整脈作用を示す また 消化管から速やかに吸収され 体内でもほとんど代謝を受けない頻脈性不整脈 ( 心室性 ) に優れた有効性をもつ不整脈治療剤である
第 2 部 CTD の概要 一般名 : バンデタニブ 版番号 : 薬物動態試験の概要文 カプレルサ 錠 100 mg 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています
 第 2 部 CTD の概要 一般名 : バンデタニブ 版番号 : 2.6.4 薬物動態試験の概要文 カプレルサ 錠 100 mg 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.4 薬物動態試験の概要文一般名 : バンデタニブ 目次 頁 目次...2 略語及び専門用語一覧表...6 1 まとめ...
第 2 部 CTD の概要 一般名 : バンデタニブ 版番号 : 2.6.4 薬物動態試験の概要文 カプレルサ 錠 100 mg 本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します 弊社の事前の承諾なく本資料の内容を他に開示することは禁じられています 2.6.4 薬物動態試験の概要文一般名 : バンデタニブ 目次 頁 目次...2 略語及び専門用語一覧表...6 1 まとめ...
シプロフロキサシン錠 100mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを
 シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
シプロフロキサシン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにシプロフロキサシン塩酸塩は グラム陽性菌 ( ブドウ球菌 レンサ球菌など ) や緑膿菌を含むグラム陰性菌 ( 大腸菌 肺炎球菌など ) に強い抗菌力を示すように広い抗菌スペクトルを有し 上気道感染症 尿路感染症 皮膚感染症などに有効なニューキノロン系の合成抗菌剤である シプロキサン 錠
アセナピンマレイン酸塩舌下錠 薬物動態試験概要表 Page 1 目次 薬物動態試験概要表 薬物動態試験一覧表 分析方法及びバリデーション試験 薬物動態試験 : 単回投与時の薬物動態
 アセナピンマレイン酸塩舌下錠 2.6.5 薬物動態試験概要表 Page 1 目次 2.6.5 薬物動態試験概要表... 4 2.6.5.1 薬物動態試験一覧表... 4 2.6.5.2 分析方法及びバリデーション試験... 6 2.6.5.3 薬物動態試験 : 単回投与時の薬物動態... 7 2.6.5.3.A 雌 CD-1 マウスに単回, 皮下投与後の Org 5222( アセナピン ) の各エナンチオマーの動態プロファイルの比較...
アセナピンマレイン酸塩舌下錠 2.6.5 薬物動態試験概要表 Page 1 目次 2.6.5 薬物動態試験概要表... 4 2.6.5.1 薬物動態試験一覧表... 4 2.6.5.2 分析方法及びバリデーション試験... 6 2.6.5.3 薬物動態試験 : 単回投与時の薬物動態... 7 2.6.5.3.A 雌 CD-1 マウスに単回, 皮下投与後の Org 5222( アセナピン ) の各エナンチオマーの動態プロファイルの比較...
MDV 薬物動態試験の概要文 目次 薬物動態試験の概要文 まとめ 分析法 吸収及び血中濃度 分布 代謝 排泄...35
 2.6.4 薬物動態試験の概要文 目次 2.6.4 薬物動態試験の概要文...3 2.6.4.1 まとめ...5 2.6.4.2 分析法...8 2.6.4.3 吸収及び血中濃度...12 2.6.4.4 分布...22 2.6.4.5 代謝...24 2.6.4.6 排泄...35 2.6.4.7 薬物動態学的薬物相互作用...37 2.6.4.8 その他の薬物動態試験...37 2.6.4.9
2.6.4 薬物動態試験の概要文 目次 2.6.4 薬物動態試験の概要文...3 2.6.4.1 まとめ...5 2.6.4.2 分析法...8 2.6.4.3 吸収及び血中濃度...12 2.6.4.4 分布...22 2.6.4.5 代謝...24 2.6.4.6 排泄...35 2.6.4.7 薬物動態学的薬物相互作用...37 2.6.4.8 その他の薬物動態試験...37 2.6.4.9
Microsoft Word - m2-6-4-pharmacokinetics-written-summary_ver 1.9_類縁物質おきかえ-1…
 1 目次...8 2.6.4.1 まとめ...8 2.6.4.1.1 Org 25969 の薬物動態...8 2.6.4.1.2 Org 25969 がロクロニウムの薬物動態特性に及ぼす影響... 11 2.6.4.1.3 Org 48302 の薬物動態...12 2.6.4.2 分析法...16 2.6.4.2.1 ラット血漿中の Org 25969 を測定する液体クロマトグラフィー -タンデム質量分析法のバリデーション
1 目次...8 2.6.4.1 まとめ...8 2.6.4.1.1 Org 25969 の薬物動態...8 2.6.4.1.2 Org 25969 がロクロニウムの薬物動態特性に及ぼす影響... 11 2.6.4.1.3 Org 48302 の薬物動態...12 2.6.4.2 分析法...16 2.6.4.2.1 ラット血漿中の Org 25969 を測定する液体クロマトグラフィー -タンデム質量分析法のバリデーション
ータについては Table 3 に示した 両製剤とも投与後血漿中ロスバスタチン濃度が上昇し 試験製剤で 4.7±.7 時間 標準製剤で 4.6±1. 時間に Tmaxに達した また Cmaxは試験製剤で 6.3±3.13 標準製剤で 6.8±2.49 であった AUCt は試験製剤で 62.24±2
 ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
ロスバスタチン錠 mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにロスバスタチンは HMG-CoA 還元酵素を競合的に阻害することにより HMG-CoA のメバロン酸への変更を減少させ コレステロール生合成における早期の律速段階を抑制する高コレステロール血症治療剤である 今回 ロスバスタチン錠 mg TCK とクレストール 錠 mg の生物学的同等性を検討するため
トリアムシノロンアセトニド マキュエイド硝子体内注用 40mg 医薬品製造販売承認事項一部変更承認申請書 添付資料 CTD 第 2 部 ( 資料概要 ) 2.6 非臨床試験の概要文及び概要表 薬物動態試験の概要文 わかもと製薬株式会社 1
 トリアムシノロンアセトニド マキュエイド硝子体内注用 40mg 医薬品製造販売承認事項一部変更承認申請書 添付資料 CTD 第 2 部 ( 資料概要 ) 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 わかもと製薬株式会社 1 2.6.4 薬物動態試験の概要文マキュエイド硝子体内注用 目次 2.6.4 薬物動態試験の概要文... 4 2.6.4.1 まとめ... 4 2.6.4.2
トリアムシノロンアセトニド マキュエイド硝子体内注用 40mg 医薬品製造販売承認事項一部変更承認申請書 添付資料 CTD 第 2 部 ( 資料概要 ) 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 わかもと製薬株式会社 1 2.6.4 薬物動態試験の概要文マキュエイド硝子体内注用 目次 2.6.4 薬物動態試験の概要文... 4 2.6.4.1 まとめ... 4 2.6.4.2
3. 安全性本治験において治験薬が投与された 48 例中 1 例 (14 件 ) に有害事象が認められた いずれの有害事象も治験薬との関連性は あり と判定されたが いずれも軽度 で処置の必要はなく 追跡検査で回復を確認した また 死亡 その他の重篤な有害事象が認められなか ったことから 安全性に問
 フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
フェキソフェナジン塩酸塩錠 6mg TCK の生物学的同等性試験 バイオアベイラビリティの比較 辰巳化学株式会社 はじめにフェキソフェナジン塩酸塩は 第二世代抗ヒスタミン薬の一つであり 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーターの遊離を抑制すると共に ヒスタミンの H1 作用に拮抗することにより アレルギー症状を緩和する 今回 フェキソフェナジン塩酸塩錠 6mg
目次 生物薬剤学試験及び関連する分析法 背景及び概観 製剤開発過程 バイオアベイラビリティ メマンチン塩酸塩の絶対バイオアベイラビリティ メマン
 メマリー錠 5 mg メマリー錠 10 mg メマリー錠 20 mg ( メマンチン塩酸塩 ) CTD 第 2 部 CTD の概要 2.7 臨床概要 2.7.1 生物薬剤学試験及び関連する分析法 第一三共株式会社 1 M2-GD-4-9912 目次 2.7.1 生物薬剤学試験及び関連する分析法...6 2.7.1.1 背景及び概観...6 2.7.1.1.1 製剤開発過程...6 2.7.1.1.2
メマリー錠 5 mg メマリー錠 10 mg メマリー錠 20 mg ( メマンチン塩酸塩 ) CTD 第 2 部 CTD の概要 2.7 臨床概要 2.7.1 生物薬剤学試験及び関連する分析法 第一三共株式会社 1 M2-GD-4-9912 目次 2.7.1 生物薬剤学試験及び関連する分析法...6 2.7.1.1 背景及び概観...6 2.7.1.1.1 製剤開発過程...6 2.7.1.1.2
あった AUCtはで ± ng hr/ml で ± ng hr/ml であった 2. バイオアベイラビリティの比較およびの薬物動態パラメータにおける分散分析の結果を Table 4 に示した また 得られた AUCtおよび Cmaxについてとの対数値
 モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
モンテルカストチュアブル錠 5mg TCK の生物学的同等性試験 ( 口中溶解後 水なし投与 ) バイオアベイラビリティの比較 辰巳化学株式会社 はじめにモンテルカストナトリウムは アレルギーのメディエーターの 1 つであるロイコトリエン (LT) の受容体の内 cyslt1 受容体を遮断する抗アレルギー薬である 今回 モンテルカストチュアブル錠 5mg TCK とキプレス チュアブル錠 5mg の生物学的同等性を検討するため
2.6.4 薬物動態試験の概要文 Bayer Yakuhin, Ltd. Page 1 of 薬物動態試験の概要文の目次 まとめ 分析法 血漿中 rfⅧ 濃度の測定 薬物動態データ
 Bayer Yakuhin, Ltd. Page 1 of 15 の目次 2.6.4.1 まとめ... 2 2.6.4.2 分析法... 3 2.6.4.2.1 血漿中 rfⅧ 濃度の測定... 3 2.6.4.2.2 薬物動態データの取り扱い... 4 2.6.4.3 吸収... 5 2.6.4.3.1 単回投与後の薬物動態... 5 2.6.4.3.1.1 ラット... 5 2.6.4.3.1.2
Bayer Yakuhin, Ltd. Page 1 of 15 の目次 2.6.4.1 まとめ... 2 2.6.4.2 分析法... 3 2.6.4.2.1 血漿中 rfⅧ 濃度の測定... 3 2.6.4.2.2 薬物動態データの取り扱い... 4 2.6.4.3 吸収... 5 2.6.4.3.1 単回投与後の薬物動態... 5 2.6.4.3.1.1 ラット... 5 2.6.4.3.1.2
PowerPoint プレゼンテーション
 酵素 : タンパク質の触媒 タンパク質 Protein 酵素 Enzyme 触媒 Catalyst 触媒 Cataylst: 特定の化学反応の反応速度を速める物質 自身は反応の前後で変化しない 酵素 Enzyme: タンパク質の触媒 触媒作用を持つタンパク質 第 3 回 : タンパク質はアミノ酸からなるポリペプチドである 第 4 回 : タンパク質は様々な立体構造を持つ 第 5 回 : タンパク質の立体構造と酵素活性の関係
酵素 : タンパク質の触媒 タンパク質 Protein 酵素 Enzyme 触媒 Catalyst 触媒 Cataylst: 特定の化学反応の反応速度を速める物質 自身は反応の前後で変化しない 酵素 Enzyme: タンパク質の触媒 触媒作用を持つタンパク質 第 3 回 : タンパク質はアミノ酸からなるポリペプチドである 第 4 回 : タンパク質は様々な立体構造を持つ 第 5 回 : タンパク質の立体構造と酵素活性の関係
2.6.4 薬物動態試験の概要文
 ポプスカイン 0.75% 注 75mg/10mL ポプスカイン 0.75% 注 150mg/20mL ポプスカイン 0.25% 注 25mg/10mL ポプスカイン 0.25% 注バッグ 250mg/100mL ポプスカイン 0.75% 注シリンジ 75mg/10mL ポプスカイン 0.25% 注シリンジ 25mg/10mL に関する資料 第 2 部 丸石製薬株式会社 薬物動態試験の化学構造式一覧表
ポプスカイン 0.75% 注 75mg/10mL ポプスカイン 0.75% 注 150mg/20mL ポプスカイン 0.25% 注 25mg/10mL ポプスカイン 0.25% 注バッグ 250mg/100mL ポプスカイン 0.75% 注シリンジ 75mg/10mL ポプスカイン 0.25% 注シリンジ 25mg/10mL に関する資料 第 2 部 丸石製薬株式会社 薬物動態試験の化学構造式一覧表
グルコースは膵 β 細胞内に糖輸送担体を介して取り込まれて代謝され A T P が産生される その結果 A T P 感受性 K チャンネルの閉鎖 細胞膜の脱分極 電位依存性 Caチャンネルの開口 細胞内 Ca 2+ 濃度の上昇が起こり インスリンが分泌される これをインスリン分泌の惹起経路と呼ぶ イ
 薬効薬理 1. 作用機序 アナグリプチンはジペプチジルペプチダーゼ -4(DPP-4) の競合的かつ可逆的な選択的阻害剤である インクレチンであるグルカゴン様ペプチド-1(GL P-1) 及びグルコース依存性インスリン分泌刺激ポリペプチド (GI P) は グルコース依存的なインスリン分泌促進作用やグルカゴン分泌抑制作用等 ( 主にGLP-1の作用 ) を有するが 24) DPP-4により分解されて活性を失う
薬効薬理 1. 作用機序 アナグリプチンはジペプチジルペプチダーゼ -4(DPP-4) の競合的かつ可逆的な選択的阻害剤である インクレチンであるグルカゴン様ペプチド-1(GL P-1) 及びグルコース依存性インスリン分泌刺激ポリペプチド (GI P) は グルコース依存的なインスリン分泌促進作用やグルカゴン分泌抑制作用等 ( 主にGLP-1の作用 ) を有するが 24) DPP-4により分解されて活性を失う
トラゼンタ錠 5mg CTD 第 2 部資料概要 2.6 非臨床試験の概要文及び概要表 薬物動態試験の概要文 日本ベーリンガーインゲルハイム株式会社
 トラゼンタ錠 5mg CTD 第 2 部資料概要 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 日本ベーリンガーインゲルハイム株式会社 2.6.4 薬物動態試験の概要文 1. 要 約 2. 分析法... 1... 4... 13 2.1 薬物濃度分析法... 13 2.1.1 マウスの血漿および尿中のリナグリプチンおよびCD 1790の定量... 13 2.1.2 ラットの血漿および尿中のリナグリプチンおよびCD
トラゼンタ錠 5mg CTD 第 2 部資料概要 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 日本ベーリンガーインゲルハイム株式会社 2.6.4 薬物動態試験の概要文 1. 要 約 2. 分析法... 1... 4... 13 2.1 薬物濃度分析法... 13 2.1.1 マウスの血漿および尿中のリナグリプチンおよびCD 1790の定量... 13 2.1.2 ラットの血漿および尿中のリナグリプチンおよびCD
添付文書の薬物動態情報 ~基本となる3つの薬物動態パラメータを理解する~
 SAJP.SA.18.02.0496(2) 添付文書の薬物動態情報 基本となる 3 つの 薬物動態パラメータを理解する 城西国際大学薬学部 臨床統計学研究室山村重雄 医療用医薬品添付文書とは 目的 : 患者の安全を確保し 適正使用を図るために必要な情報を医師 歯科医師および薬剤師などの医療関係者に提供する 法的規制 : 医薬品医療機器等法第 52 条で記載内容が定められ 医薬品の製造販売業者は医薬品には情報を付与することが義務
SAJP.SA.18.02.0496(2) 添付文書の薬物動態情報 基本となる 3 つの 薬物動態パラメータを理解する 城西国際大学薬学部 臨床統計学研究室山村重雄 医療用医薬品添付文書とは 目的 : 患者の安全を確保し 適正使用を図るために必要な情報を医師 歯科医師および薬剤師などの医療関係者に提供する 法的規制 : 医薬品医療機器等法第 52 条で記載内容が定められ 医薬品の製造販売業者は医薬品には情報を付与することが義務
2.6(2) 項略号一覧 (1) 略号 省略していない表現 AUC area under the plasma concentration-time curve( 血漿中濃度 - 時間曲線下面積 ) AUC all area under the plasma concentration-time c
 テリボン皮下注用 56.5 μg 第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 (2) 薬物動態 旭化成ファーマ株式会社 2.6(2) 項略号一覧 (1) 略号 省略していない表現 AUC area under the plasma concentration-time curve( 血漿中濃度 - 時間曲線下面積 ) AUC all area under the plasma
テリボン皮下注用 56.5 μg 第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 (2) 薬物動態 旭化成ファーマ株式会社 2.6(2) 項略号一覧 (1) 略号 省略していない表現 AUC area under the plasma concentration-time curve( 血漿中濃度 - 時間曲線下面積 ) AUC all area under the plasma
薬物動態開発の経緯 特性製品概要臨床成績副作用 mgを空腹時に単回経口投与副作用また 日本人及び白人健康成人男性において アピキサバン 薬物動態薬物動態非臨床試験に関する事項非臨床試験に関する事項1. 血中濃度 (1) 単回投与 (CV185013) 11) 日本人健康成人男性
 薬物動態開発の経緯 特性製品概要臨床成績副作用2.5 1 25 5mgを空腹時に単回経口投与副作用また 日本人及び白人健康成人男性において アピキサバン 薬物動態薬物動態非臨床試験に関する事項非臨床試験に関する事項1. 血中濃度 (1) 単回投与 (CV18513) 11) 日本人健康成人男性 12 例に アピキサバン 2.5 1mg を空腹時に単回経口投与 したとき 投与後 3 3.5 時間で最高血漿中濃度に達し
薬物動態開発の経緯 特性製品概要臨床成績副作用2.5 1 25 5mgを空腹時に単回経口投与副作用また 日本人及び白人健康成人男性において アピキサバン 薬物動態薬物動態非臨床試験に関する事項非臨床試験に関する事項1. 血中濃度 (1) 単回投与 (CV18513) 11) 日本人健康成人男性 12 例に アピキサバン 2.5 1mg を空腹時に単回経口投与 したとき 投与後 3 3.5 時間で最高血漿中濃度に達し
アミヴィッド静注 CTD 第 2 部 2.1 第 2 部から第 5 部の目次 富士フイルム RI ファーマ株式会社
 CTD 第 2 部 富士フイルム RI ファーマ株式会社 ( 空白ページ ) 2 第 2 部 ( モジュール 2): CTD の概要 ( サマリー ) ---------------------------------------------- 第 2 巻 2.2 緒言 2.3 品質に関する概括資料緒言 2.3.S 原薬 (AV-105, ) 2.3.S 原薬 ( フロルベタピル ( 18 F),
CTD 第 2 部 富士フイルム RI ファーマ株式会社 ( 空白ページ ) 2 第 2 部 ( モジュール 2): CTD の概要 ( サマリー ) ---------------------------------------------- 第 2 巻 2.2 緒言 2.3 品質に関する概括資料緒言 2.3.S 原薬 (AV-105, ) 2.3.S 原薬 ( フロルベタピル ( 18 F),
目次 薬物動態試験の概要表 薬物動態試験一覧表
 ペグインターフェロンアルファ -2b( 遺伝子組換え ) 第 2 部 CTD の概要 (6) 非臨床試験の概要文及び概要表 5 薬物動態試験の概要表 シェリング プラウ株式会社 目次 2.6.5 薬物動態試験の概要表........................................................... 1 2.6.5.1 薬物動態試験一覧表.........................................................
ペグインターフェロンアルファ -2b( 遺伝子組換え ) 第 2 部 CTD の概要 (6) 非臨床試験の概要文及び概要表 5 薬物動態試験の概要表 シェリング プラウ株式会社 目次 2.6.5 薬物動態試験の概要表........................................................... 1 2.6.5.1 薬物動態試験一覧表.........................................................
加工デンプン(栄養学的観点からの検討)
 加工デンプン ( 栄養学的観点からの検討 ) 加工デンプンは 未加工デンプンが有する物理化学的性状を変化させ 利便性の拡大を図るために加工処理を施したものであり 通常 未加工デンプンに代わるものとして用いられる デンプンは三大栄養素の一つである炭水化物の摂取源であることから 炭水化物の摂取量 加工デンプンの摂取量 加工デンプンの体内動態 ( 消化酵素分解率 ) から 加工デンプンの食品への使用について栄養学的観点からの検討を行う
加工デンプン ( 栄養学的観点からの検討 ) 加工デンプンは 未加工デンプンが有する物理化学的性状を変化させ 利便性の拡大を図るために加工処理を施したものであり 通常 未加工デンプンに代わるものとして用いられる デンプンは三大栄養素の一つである炭水化物の摂取源であることから 炭水化物の摂取量 加工デンプンの摂取量 加工デンプンの体内動態 ( 消化酵素分解率 ) から 加工デンプンの食品への使用について栄養学的観点からの検討を行う
プロトコール集 ( 研究用試薬 ) < 目次 > 免疫組織染色手順 ( 前処理なし ) p2 免疫組織染色手順 ( マイクロウェーブ前処理 ) p3 免疫組織染色手順 ( オートクレーブ前処理 ) p4 免疫組織染色手順 ( トリプシン前処理 ) p5 免疫組織染色手順 ( ギ酸処理 ) p6 免疫
 < 目次 > 免疫組織染色手順 ( 前処理なし ) p2 免疫組織染色手順 ( マイクロウェーブ前処理 ) p3 免疫組織染色手順 ( オートクレーブ前処理 ) p4 免疫組織染色手順 ( トリプシン前処理 ) p5 免疫組織染色手順 ( ギ酸処理 ) p6 免疫組織染色手順 ( ギ酸処理後 マイクロウェーブまたはオートクレーブ処理 )p7 抗原ペプチドによる抗体吸収試験 p8 ウエスタン ブロッティング
< 目次 > 免疫組織染色手順 ( 前処理なし ) p2 免疫組織染色手順 ( マイクロウェーブ前処理 ) p3 免疫組織染色手順 ( オートクレーブ前処理 ) p4 免疫組織染色手順 ( トリプシン前処理 ) p5 免疫組織染色手順 ( ギ酸処理 ) p6 免疫組織染色手順 ( ギ酸処理後 マイクロウェーブまたはオートクレーブ処理 )p7 抗原ペプチドによる抗体吸収試験 p8 ウエスタン ブロッティング
目次頁略号一覧表 まとめ 反復投与毒性試験 ラット ラット 7 日間経口投与試験及び 4 週間回復性試験 ( 試験番号 TX CTD ) 考察及び結論
 ソホスブビル 第 2 部 CTD の概要 2.6 非臨床試験の概要文及び概要表 2.6.6 毒性試験の概要文 ギリアド サイエンシズ株式会社 1 目次頁略号一覧表... 4 1 まとめ... 6 2 反復投与毒性試験... 7 2.1 ラット... 7 2.1.1 ラット 7 日間経口投与試験及び 4 週間回復性試験 ( 試験番号 TX-334-2012 CTD 4.2.3.2.1)... 7 3
ソホスブビル 第 2 部 CTD の概要 2.6 非臨床試験の概要文及び概要表 2.6.6 毒性試験の概要文 ギリアド サイエンシズ株式会社 1 目次頁略号一覧表... 4 1 まとめ... 6 2 反復投与毒性試験... 7 2.1 ラット... 7 2.1.1 ラット 7 日間経口投与試験及び 4 週間回復性試験 ( 試験番号 TX-334-2012 CTD 4.2.3.2.1)... 7 3
PowerPoint プレゼンテーション
 Institute of Accelerator Analysis Ltd. HPLC Drug Concentration (ng/ml) 7 6 5 4 3 2 1 B D F Drug Concentration (ng/ml) 450 400 350 300 250 200 150 100 50 CREAM (MD) T007 (MD) CREAM (TD) 0 0 2
Institute of Accelerator Analysis Ltd. HPLC Drug Concentration (ng/ml) 7 6 5 4 3 2 1 B D F Drug Concentration (ng/ml) 450 400 350 300 250 200 150 100 50 CREAM (MD) T007 (MD) CREAM (TD) 0 0 2
添付文書がちゃんと読める 薬物動態学 著 山村重雄竹平理恵子城西国際大学薬学部臨床統計学
 添付文書がちゃんと読める 薬物動態学 著 山村重雄竹平理恵子城西国際大学薬学部臨床統計学 1 序章 吸収された薬物は, 体の中で ( distribution) します 分布 とは, 体の中で薬物がどのように存在しているかを示しています 体の中の薬物の 分布 には大きく 2 つの要素が関わっています 1 つは, 薬物の, もう 1 つは薬物のです 血液中では, 薬物の一部分は血液中のタンパク ( たとえばアルブミンや
添付文書がちゃんと読める 薬物動態学 著 山村重雄竹平理恵子城西国際大学薬学部臨床統計学 1 序章 吸収された薬物は, 体の中で ( distribution) します 分布 とは, 体の中で薬物がどのように存在しているかを示しています 体の中の薬物の 分布 には大きく 2 つの要素が関わっています 1 つは, 薬物の, もう 1 つは薬物のです 血液中では, 薬物の一部分は血液中のタンパク ( たとえばアルブミンや
第2章マウスを用いた動物モデルに関する研究
 . ホルムアルデヒドおよびトルエン吸入曝露によるマウスのくしゃみ様症状の定量 およびトルエン代謝物の測定 研究協力者 : 欅田尚樹 嵐谷奎一 ( 産業医科大学産業保健学部 ) (1) 研究要旨ホルムアルデヒド曝露により特異的にくしゃみの増加が観察されたが トルエン曝露でくしゃみの誘発はなかった トルエンの曝露指標として 尿中代謝産物である馬尿酸を測定した 曝露直後には高く翌日には正常レベルに戻っており
. ホルムアルデヒドおよびトルエン吸入曝露によるマウスのくしゃみ様症状の定量 およびトルエン代謝物の測定 研究協力者 : 欅田尚樹 嵐谷奎一 ( 産業医科大学産業保健学部 ) (1) 研究要旨ホルムアルデヒド曝露により特異的にくしゃみの増加が観察されたが トルエン曝露でくしゃみの誘発はなかった トルエンの曝露指標として 尿中代謝産物である馬尿酸を測定した 曝露直後には高く翌日には正常レベルに戻っており
Microsoft Word - å�¦ä½“è«ŒæŒ⁄æ�£æœ¬ doc
 博士論文 熟成ニンニク抽出液に特徴的な水溶性イオウ化合物類の 体内動態と薬物相互作用に関する研究 平成 29 年 9 月 天野浩貴 目次略語一覧... 3 構造式一覧... 4 要約... 5 総論の部... 8 緒言... 8 第 I 章 SAC のラットにおける代謝 排泄 および血中動態... 11 第 1 節 N-アセチル化 S- 酸化 および γ-グルタミル化代謝物の同定... 12 1-a
博士論文 熟成ニンニク抽出液に特徴的な水溶性イオウ化合物類の 体内動態と薬物相互作用に関する研究 平成 29 年 9 月 天野浩貴 目次略語一覧... 3 構造式一覧... 4 要約... 5 総論の部... 8 緒言... 8 第 I 章 SAC のラットにおける代謝 排泄 および血中動態... 11 第 1 節 N-アセチル化 S- 酸化 および γ-グルタミル化代謝物の同定... 12 1-a
抗菌薬の殺菌作用抗菌薬の殺菌作用には濃度依存性と時間依存性の 2 種類があり 抗菌薬の効果および用法 用量の設定に大きな影響を与えます 濃度依存性タイプでは 濃度を高めると濃度依存的に殺菌作用を示します 濃度依存性タイプの抗菌薬としては キノロン系薬やアミノ配糖体系薬が挙げられます 一方 時間依存性
 2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
2012 年 1 月 4 日放送 抗菌薬の PK-PD 愛知医科大学大学院感染制御学教授三鴨廣繁抗菌薬の PK-PD とは薬物動態を解析することにより抗菌薬の有効性と安全性を評価する考え方は アミノ配糖体系薬などの副作用を回避するための薬物血中濃度モニタリング (TDM) の分野で発達してきました 近年では 耐性菌の増加 コンプロマイズド ホストの増加 新規抗菌薬の開発の停滞などもあり 現存の抗菌薬をいかに科学的に使用するかが重要な課題となっており
本日の内容 HbA1c 測定方法別原理と特徴 HPLC 法 免疫法 酵素法 原理差による測定値の乖離要因
 HbA1c 測定系について ~ 原理と特徴 ~ 一般社団法人日本臨床検査薬協会 技術運営委員会副委員長 安部正義 本日の内容 HbA1c 測定方法別原理と特徴 HPLC 法 免疫法 酵素法 原理差による測定値の乖離要因 HPLC 法 HPLC 法原理 高速液体クロマトグラフィー 混合物の分析法の一つ 固体または液体の固定相 ( 吸着剤 ) 中で 液体または気体の移動相 ( 展開剤 ) に試料を加えて移動させ
HbA1c 測定系について ~ 原理と特徴 ~ 一般社団法人日本臨床検査薬協会 技術運営委員会副委員長 安部正義 本日の内容 HbA1c 測定方法別原理と特徴 HPLC 法 免疫法 酵素法 原理差による測定値の乖離要因 HPLC 法 HPLC 法原理 高速液体クロマトグラフィー 混合物の分析法の一つ 固体または液体の固定相 ( 吸着剤 ) 中で 液体または気体の移動相 ( 展開剤 ) に試料を加えて移動させ
メキニスト錠 0.5mg メキニスト錠 2mg 製造販売承認申請書添付資料 第 2 部 ( モジュール 2)CTD の概要 ( サマリー ) 2.6. 非臨床試験の概要文及び概要表 薬物動態試験の概要文 薬物動態試験概要表 ノバルティスファーマ株式会社
 メキニスト錠 0.5mg メキニスト錠 2mg 製造販売承認申請書添付資料 第 2 部 ( モジュール 2)CTD の概要 ( サマリー ) 2.6. 非臨床試験の概要文及び概要表 2.6.4. 薬物動態試験の概要文 2.6.5. 薬物動態試験概要表 ノバルティスファーマ株式会社 非臨床概要薬物動態試験の目次 項目 - 頁 2.6.4. 薬物動態試験の概要文... 2.6.4 p. 1 2.6.4.1.
メキニスト錠 0.5mg メキニスト錠 2mg 製造販売承認申請書添付資料 第 2 部 ( モジュール 2)CTD の概要 ( サマリー ) 2.6. 非臨床試験の概要文及び概要表 2.6.4. 薬物動態試験の概要文 2.6.5. 薬物動態試験概要表 ノバルティスファーマ株式会社 非臨床概要薬物動態試験の目次 項目 - 頁 2.6.4. 薬物動態試験の概要文... 2.6.4 p. 1 2.6.4.1.
創薬 創剤における探索動態研究の役割と課題 布施英一協和発酵工業株式会社医薬研究センター薬物動態研究所 1. はじめに弊社では 1990 年代初期より探索ステージにおける動態研究の体制を整備してきた 特に 1996 年から探索動態専門のグループを立ち上げ 欧州の製薬会社での経験を有するコンサルタント
 創薬 創剤における探索動態研究の役割と課題 布施英一協和発酵工業株式会社医薬研究センター薬物動態研究所 1. はじめに弊社では 1990 年代初期より探索ステージにおける動態研究の体制を整備してきた 特に 1996 年から探索動態専門のグループを立ち上げ 欧州の製薬会社での経験を有するコンサルタントと契約し 1 年に 1-2 回のコンサルティングを実施し 欧米の製薬会社の探索動態の方法論を取り入れてきた
創薬 創剤における探索動態研究の役割と課題 布施英一協和発酵工業株式会社医薬研究センター薬物動態研究所 1. はじめに弊社では 1990 年代初期より探索ステージにおける動態研究の体制を整備してきた 特に 1996 年から探索動態専門のグループを立ち上げ 欧州の製薬会社での経験を有するコンサルタントと契約し 1 年に 1-2 回のコンサルティングを実施し 欧米の製薬会社の探索動態の方法論を取り入れてきた
untitled
 1% 1 mg 1 mg 2 CTD 6 Section 2.6.1 Introduction 2.6.1 H 1 descarboethoxyloratadinesch 34117 7.9 SCH 34117 2.6.1-1 O OC 2 H 5 Cl N N JAN Loratadine (JANINN) ethyl 4-(8-chloro-5,6-dihydro-11H-benzo[5,6]
1% 1 mg 1 mg 2 CTD 6 Section 2.6.1 Introduction 2.6.1 H 1 descarboethoxyloratadinesch 34117 7.9 SCH 34117 2.6.1-1 O OC 2 H 5 Cl N N JAN Loratadine (JANINN) ethyl 4-(8-chloro-5,6-dihydro-11H-benzo[5,6]
医療用医薬品最新品質情報集 ( ブルーブック ) 初版有効成分リトドリン塩酸塩 品目名 ( 製造販売業者 ) 後発医薬品 品目名 ( 製造販売業者 ) 先発医薬品 効能 効果用法 用量添加物 1) 解離定数 (25 ) 1) 溶解度 (37 ) 1 ウテロン錠 5mg サンド 2
 医療用医薬品最新品質情報集 ( ブルーブック ) 2018.7.13 初版有効成分リトドリン塩酸塩 品目名 ( 製造販売業者 ) 後発医薬品 品目名 ( 製造販売業者 ) 先発医薬品 効能 効果用法 用量添加物 1) 解離定数 (25 ) 1) 溶解度 (37 ) 1 ウテロン錠 5mg サンド 2 塩酸リトドリン錠 5mg YD 陽進堂 3 リトドリン錠 5mg PP ポーラファルマ 4 ルテオニン錠
医療用医薬品最新品質情報集 ( ブルーブック ) 2018.7.13 初版有効成分リトドリン塩酸塩 品目名 ( 製造販売業者 ) 後発医薬品 品目名 ( 製造販売業者 ) 先発医薬品 効能 効果用法 用量添加物 1) 解離定数 (25 ) 1) 溶解度 (37 ) 1 ウテロン錠 5mg サンド 2 塩酸リトドリン錠 5mg YD 陽進堂 3 リトドリン錠 5mg PP ポーラファルマ 4 ルテオニン錠
記載データ一覧 品目名 製造販売業者 BE 品質再評価 1 マグミット錠 250mg 協和化学工業 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 # 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 # 5 酸化マグネシ
 医療用医薬品最新品質情報集 ( ブルーブック ) 2017.7.7 初版 有効成分 酸化マグネシウム 品目名 ( 製造販売業者 ) 1 マグミット錠 250mg 協和化学工業 後発医薬品 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 5 酸化マグネシウム錠 250mg ケンエー
医療用医薬品最新品質情報集 ( ブルーブック ) 2017.7.7 初版 有効成分 酸化マグネシウム 品目名 ( 製造販売業者 ) 1 マグミット錠 250mg 協和化学工業 後発医薬品 2 酸化マグネシウム錠 250mg TX みらいファーマ 3 酸化マグネシウム錠 250mg モチダ 持田製薬販売 4 酸化マグネシウム錠 250mg マイラン マイラン製薬 5 酸化マグネシウム錠 250mg ケンエー
レグパラ 錠 25mg レグパラ 錠 75mg 第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 薬物動態試験 キリンファーマ株式会社
 レグパラ 錠 25mg レグパラ 錠 75mg 第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 薬物動態試験 キリンファーマ株式会社 目次...1 2.6.4.1 まとめ...1 2.6.4.2 分析法...6 2.6.4.3 吸収...8 2.6.4.4 分布...16 2.6.4.5 代謝...24 2.6.4.6 排泄...35 2.6.4.7 薬物動態学的薬物相互作用...40
レグパラ 錠 25mg レグパラ 錠 75mg 第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 薬物動態試験 キリンファーマ株式会社 目次...1 2.6.4.1 まとめ...1 2.6.4.2 分析法...6 2.6.4.3 吸収...8 2.6.4.4 分布...16 2.6.4.5 代謝...24 2.6.4.6 排泄...35 2.6.4.7 薬物動態学的薬物相互作用...40
資料4-4 木酢液の検討状況について
 資料 4-4 木酢液の検討状況について 木酢液の薬効 薬害 安全性等に係る検討に関し 第 6 回及び第 8 回合同 会合において 以下のとおり整理された 安全性 薬効 薬害に係る試験の実施 ( 論点 ) 第 6 回合同会合において検討した結果 変異原性試験 ( 復帰突然変異原性試験 ) の結果について指摘があった また 1) 木酢液 に含まれるホルムアルデヒドについては IARC( 国際ガン研究機関
資料 4-4 木酢液の検討状況について 木酢液の薬効 薬害 安全性等に係る検討に関し 第 6 回及び第 8 回合同 会合において 以下のとおり整理された 安全性 薬効 薬害に係る試験の実施 ( 論点 ) 第 6 回合同会合において検討した結果 変異原性試験 ( 復帰突然変異原性試験 ) の結果について指摘があった また 1) 木酢液 に含まれるホルムアルデヒドについては IARC( 国際ガン研究機関
パナテスト ラットβ2マイクログロブリン
 研究用試薬 2014 年 4 月作成 EIA 法ラット β 2 マイクログロブリン測定キット PRH111 パナテスト A シリーズラット β 2- マイクロク ロフ リン 1. はじめに β 2 - マイクログロブリンは, 血液, 尿, および体液中に存在し, ヒトでは腎糸球体障害, 自己免疫疾患, 悪性腫瘍, 肝疾患などによって血中濃度が変化するといわれています. また,β 2 - マイクログロブリンの尿中濃度は,
研究用試薬 2014 年 4 月作成 EIA 法ラット β 2 マイクログロブリン測定キット PRH111 パナテスト A シリーズラット β 2- マイクロク ロフ リン 1. はじめに β 2 - マイクログロブリンは, 血液, 尿, および体液中に存在し, ヒトでは腎糸球体障害, 自己免疫疾患, 悪性腫瘍, 肝疾患などによって血中濃度が変化するといわれています. また,β 2 - マイクログロブリンの尿中濃度は,
本書の読み方 使い方 ~ 各項目の基本構成 ~ * 本書は主に外来の日常診療で頻用される治療薬を取り上げています ❶ 特徴 01 HMG-CoA 代表的薬剤ピタバスタチン同種同効薬アトルバスタチン, ロスバスタチン HMG-CoA 還元酵素阻害薬は主に高 LDL コレステロール血症の治療目的で使 用
 本書の読み方 使い方 ~ 各項目の基本構成 ~ * 本書は主に外来の日常診療で頻用される治療薬を取り上げています ❶ 特徴 01 HMG-CoA 代表的薬剤ピタバスタチン同種同効薬アトルバスタチン, ロスバスタチン HMG-CoA 還元酵素阻害薬は主に高 LDL コレステロール血症の治療目的で使 用される その強力なコレステロール低下作用と, コレステロール低下作用を 介さない作用 ( 血管内皮機能改善作用,
本書の読み方 使い方 ~ 各項目の基本構成 ~ * 本書は主に外来の日常診療で頻用される治療薬を取り上げています ❶ 特徴 01 HMG-CoA 代表的薬剤ピタバスタチン同種同効薬アトルバスタチン, ロスバスタチン HMG-CoA 還元酵素阻害薬は主に高 LDL コレステロール血症の治療目的で使 用される その強力なコレステロール低下作用と, コレステロール低下作用を 介さない作用 ( 血管内皮機能改善作用,
使用上の注意 1. 慎重投与 ( 次の患者には慎重に投与すること ) 1 2X X 重要な基本的注意 1TNF 2TNF TNF 3 X - CT X 4TNFB HBsHBcHBs B B B B 5 6TNF 7 8dsDNA d
 2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
2015 5 7 201410 28 TNF 阻害薬 TNFFab シムジア 皮下注 200mg シリンジ Cimzia 200mg Syringe for S.C. Injection セルトリズマブペゴル ( 遺伝子組換え ) 製剤 873999 22400AMX01488000 20132 20133 20155 20079 警告 1. 2. 1 2 X - CT 3. TNF 4. 1 禁忌
論文題目 腸管分化に関わるmiRNAの探索とその発現制御解析
 論文題目 腸管分化に関わる microrna の探索とその発現制御解析 氏名日野公洋 1. 序論 microrna(mirna) とは細胞内在性の 21 塩基程度の機能性 RNA のことであり 部分的相補的な塩基認識を介して標的 RNA の翻訳抑制や不安定化を引き起こすことが知られている mirna は細胞分化や増殖 ガン化やアポトーシスなどに関与していることが報告されており これら以外にも様々な細胞諸現象に関与していると考えられている
論文題目 腸管分化に関わる microrna の探索とその発現制御解析 氏名日野公洋 1. 序論 microrna(mirna) とは細胞内在性の 21 塩基程度の機能性 RNA のことであり 部分的相補的な塩基認識を介して標的 RNA の翻訳抑制や不安定化を引き起こすことが知られている mirna は細胞分化や増殖 ガン化やアポトーシスなどに関与していることが報告されており これら以外にも様々な細胞諸現象に関与していると考えられている
Agilent RapidFire 365 ハイスループット質量分析システム 創薬プロセスを加速する HTS システムテクノロジー
 Agilent RapidFire 365 ハイスループット質量分析システム 創薬プロセスを加速する HTS システムテクノロジー Agilent RapidFire 365 HTS RapidFire 365 MS ADME RapidFire 365 1 2 RapidFire 1 8 RapidFire 365 12 63 Agilent BenchBot 20,000 60 RapidFire
Agilent RapidFire 365 ハイスループット質量分析システム 創薬プロセスを加速する HTS システムテクノロジー Agilent RapidFire 365 HTS RapidFire 365 MS ADME RapidFire 365 1 2 RapidFire 1 8 RapidFire 365 12 63 Agilent BenchBot 20,000 60 RapidFire
ルグリセロールと脂肪酸に分解され吸収される それらは腸上皮細胞に吸収されたのちに再び中性脂肪へと生合成されカイロミクロンとなる DGAT1 は腸管で脂質の再合成 吸収に関与していることから DGAT1 KO マウスで認められているフェノタイプが腸 DGAT1 欠如に由来していることが考えられる 実際
 学位論文の内容の要旨 論文提出者氏名 津田直人 論文審査担当者 主査下門顕太郎副査吉田雅幸横関博雄 論文題目 Intestine-Targeted DGAT1 Inhibition Improves Obesity and Insulin Resistance without Skin Aberrations in Mice ( 論文内容の要旨 ) < 要旨 > Diacylglycerol O-acyltransferase
学位論文の内容の要旨 論文提出者氏名 津田直人 論文審査担当者 主査下門顕太郎副査吉田雅幸横関博雄 論文題目 Intestine-Targeted DGAT1 Inhibition Improves Obesity and Insulin Resistance without Skin Aberrations in Mice ( 論文内容の要旨 ) < 要旨 > Diacylglycerol O-acyltransferase
アントシアニン
 肝機能改善効果を有する 紫サツマイモジュースの開発 1. 紫サツマイモ について ( アントシアニンの構造等 ). 紫サツマイモ アントシアニンの体内吸収性 3. 紫サツマイモ の有効性とメカニズム アントシアニン アヤムラサキ について 商品特性 : 1. 紫サツマイモ アヤムラサキ の搾汁を 100% 使用したサツマイモ搾汁飲料. 着色料 甘味料不使用 3. 食物繊維 0.4g (15mLあたり)
肝機能改善効果を有する 紫サツマイモジュースの開発 1. 紫サツマイモ について ( アントシアニンの構造等 ). 紫サツマイモ アントシアニンの体内吸収性 3. 紫サツマイモ の有効性とメカニズム アントシアニン アヤムラサキ について 商品特性 : 1. 紫サツマイモ アヤムラサキ の搾汁を 100% 使用したサツマイモ搾汁飲料. 着色料 甘味料不使用 3. 食物繊維 0.4g (15mLあたり)
スライド 1
 Detection of bound phenolic acids: prevention by ascorbic acid and ethylenediaminetetraacetic acid of degradation of phenolic acids during alkaline hydrolysis ( 結合フェノール酸の検出 : アルカリ加水分解中のアスコルビン酸と EDTA によるフェノール酸の劣化防止
Detection of bound phenolic acids: prevention by ascorbic acid and ethylenediaminetetraacetic acid of degradation of phenolic acids during alkaline hydrolysis ( 結合フェノール酸の検出 : アルカリ加水分解中のアスコルビン酸と EDTA によるフェノール酸の劣化防止
日本標準商品分類番号 カリジノゲナーゼの血管新生抑制作用 カリジノゲナーゼは強力な血管拡張物質であるキニンを遊離することにより 高血圧や末梢循環障害の治療に広く用いられてきた 最近では 糖尿病モデルラットにおいて増加する眼内液中 VEGF 濃度を低下させることにより 血管透過性を抑制す
 日本標準商品分類番号 872491 カリジノゲナーゼの血管新生抑制作用 カリジノゲナーゼは強力な血管拡張物質であるキニンを遊離することにより 高血圧や末梢循環障害の治療に広く用いられてきた 最近では 糖尿病モデルラットにおいて増加する眼内液中 VEGF 濃度を低下させることにより 血管透過性を抑制することが示されたが 血管新生に対するカリジノゲナーゼの影響を評価した報告はない そこで今回 網膜血管新生に対するカリジノゲナーゼの役割を同定するため
日本標準商品分類番号 872491 カリジノゲナーゼの血管新生抑制作用 カリジノゲナーゼは強力な血管拡張物質であるキニンを遊離することにより 高血圧や末梢循環障害の治療に広く用いられてきた 最近では 糖尿病モデルラットにおいて増加する眼内液中 VEGF 濃度を低下させることにより 血管透過性を抑制することが示されたが 血管新生に対するカリジノゲナーゼの影響を評価した報告はない そこで今回 網膜血管新生に対するカリジノゲナーゼの役割を同定するため
Microsoft PowerPoint - 薬学会2009新技術2シラノール基.ppt
 シラノール基は塩基性化合物のテーリングの原因 いや違う! クロマニックテクノロジーズ長江徳和 日本薬学会 9 年会 緒言緒言 逆相型固定相中の残存シラノール基は, 吸着やピークテーリング等の原因であるとされている 残存シラノール基に基づく主な相互作用は, 吸着, イオン交換, 水素結合である これらの二次効果相互作用を積極的に利用することで, 極性化合物に対して特異的な保持を示す新規な逆相固定相の創出が可能であると思われる
シラノール基は塩基性化合物のテーリングの原因 いや違う! クロマニックテクノロジーズ長江徳和 日本薬学会 9 年会 緒言緒言 逆相型固定相中の残存シラノール基は, 吸着やピークテーリング等の原因であるとされている 残存シラノール基に基づく主な相互作用は, 吸着, イオン交換, 水素結合である これらの二次効果相互作用を積極的に利用することで, 極性化合物に対して特異的な保持を示す新規な逆相固定相の創出が可能であると思われる
解析センターを知っていただく キャンペーン
 005..5 SAS 問題設定 目的 PKパラメータ (AUC,Cmax,Tmaxなど) の推定 PKパラメータの群間比較 PKパラメータのバラツキの評価! データの特徴 非反復測定値 個体につき 個の測定値しか得られない plasma concentration 非反復測定値のイメージ図 測定時点間で個体の対応がない 着目する状況 plasma concentration 経時反復測定値のイメージ図
005..5 SAS 問題設定 目的 PKパラメータ (AUC,Cmax,Tmaxなど) の推定 PKパラメータの群間比較 PKパラメータのバラツキの評価! データの特徴 非反復測定値 個体につき 個の測定値しか得られない plasma concentration 非反復測定値のイメージ図 測定時点間で個体の対応がない 着目する状況 plasma concentration 経時反復測定値のイメージ図
目次 略号及び用語の定義一覧 まとめ 分析方法 吸収 単回投与後の薬物動態 反復投与後の薬物動態 分布
 リオナ 錠 250mg ( クエン酸第二鉄水和物 ) 第 2 部 CTD の概要 ( サマリー ) 2.6 非臨床試験の概要文及び概要表 日本たばこ産業株式会社 目次 略号及び用語の定義一覧... 4... 5 2.6.4.1 まとめ... 5 2.6.4.2 分析方法... 6 2.6.4.3 吸収... 7 2.6.4.3.1 単回投与後の薬物動態... 7 2.6.4.3.2 反復投与後の薬物動態...
リオナ 錠 250mg ( クエン酸第二鉄水和物 ) 第 2 部 CTD の概要 ( サマリー ) 2.6 非臨床試験の概要文及び概要表 日本たばこ産業株式会社 目次 略号及び用語の定義一覧... 4... 5 2.6.4.1 まとめ... 5 2.6.4.2 分析方法... 6 2.6.4.3 吸収... 7 2.6.4.3.1 単回投与後の薬物動態... 7 2.6.4.3.2 反復投与後の薬物動態...
HIGAマウス.xls
 HIGA/NscSlc 由来 HIGA/NscSlc は 武曾らにより 1996 年に ddy マウスより確立された IgA 腎症モデルである 当社では 本マウスを 2002 年に日本新薬より導入 以後生産 供給を行っている 毛色 アルビノ 特徴 若週齢より血中 IgA 値高い ヒト IgA 腎症と症状が類似している 腎糸球体における IgA の沈着 メサンギウム細胞の増殖等が若週齢のうちに始まり
HIGA/NscSlc 由来 HIGA/NscSlc は 武曾らにより 1996 年に ddy マウスより確立された IgA 腎症モデルである 当社では 本マウスを 2002 年に日本新薬より導入 以後生産 供給を行っている 毛色 アルビノ 特徴 若週齢より血中 IgA 値高い ヒト IgA 腎症と症状が類似している 腎糸球体における IgA の沈着 メサンギウム細胞の増殖等が若週齢のうちに始まり
Taro-kv12250.jtd
 ニューカッスル病 マレック病 ( ニューカッスル病ウイルス由来 F 蛋白遺伝子導入マレック病ウイルス 1 型 ) 凍結生ワクチン 平成 22 年 8 月 12 日 ( 告示第 2288 号 ) 新規追加 ニューカッスル病ウイルスのF 蛋白をコードする遺伝子を弱毒マレック病ウイルス (1 型 ) に挿入して得られた組換え体ウイルスを培養細胞で増殖させて得た感染細胞浮遊液を凍結したワクチンである 1 小分製品の試験
ニューカッスル病 マレック病 ( ニューカッスル病ウイルス由来 F 蛋白遺伝子導入マレック病ウイルス 1 型 ) 凍結生ワクチン 平成 22 年 8 月 12 日 ( 告示第 2288 号 ) 新規追加 ニューカッスル病ウイルスのF 蛋白をコードする遺伝子を弱毒マレック病ウイルス (1 型 ) に挿入して得られた組換え体ウイルスを培養細胞で増殖させて得た感染細胞浮遊液を凍結したワクチンである 1 小分製品の試験
大学院博士課程共通科目ベーシックプログラム
 平成 30 年度医科学専攻共通科目 共通基礎科目実習 ( 旧コア実習 ) 概要 1 ). 大学院生が所属する教育研究分野における実習により単位認定可能な実習項目 ( コア実習項目 ) 1. 組換え DNA 技術実習 2. 生体物質の調製と解析実習 3. 薬理学実習 4. ウイルス学実習 5. 免疫学実習 6. 顕微鏡試料作成法実習 7. ゲノム医学実習 8. 共焦点レーザー顕微鏡実習 2 ). 実習を担当する教育研究分野においてのみ単位認定可能な実習項目
平成 30 年度医科学専攻共通科目 共通基礎科目実習 ( 旧コア実習 ) 概要 1 ). 大学院生が所属する教育研究分野における実習により単位認定可能な実習項目 ( コア実習項目 ) 1. 組換え DNA 技術実習 2. 生体物質の調製と解析実習 3. 薬理学実習 4. ウイルス学実習 5. 免疫学実習 6. 顕微鏡試料作成法実習 7. ゲノム医学実習 8. 共焦点レーザー顕微鏡実習 2 ). 実習を担当する教育研究分野においてのみ単位認定可能な実習項目
豚丹毒 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 23 年 2 月 8 日 ( 告示第 358 号 ) 新規追加 1 定義シードロット規格に適合した豚丹毒菌の培養菌液を不活化し アルミニウムゲルアジュバントを添加したワクチンである 2 製法 2.1 製造用株 名称豚丹
 豚丹毒 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 23 年 2 月 8 日 ( 告示第 358 号 ) 新規追加 1 定義シードロット規格に適合した豚丹毒菌の培養菌液を不活化し アルミニウムゲルアジュバントを添加したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚丹毒菌多摩 96 株 ( 血清型 2 型 ) 又はこれと同等と認められた株 2.1.2 性状感受性豚に接種すると
豚丹毒 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 23 年 2 月 8 日 ( 告示第 358 号 ) 新規追加 1 定義シードロット規格に適合した豚丹毒菌の培養菌液を不活化し アルミニウムゲルアジュバントを添加したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚丹毒菌多摩 96 株 ( 血清型 2 型 ) 又はこれと同等と認められた株 2.1.2 性状感受性豚に接種すると
Vol. 36, Special Issue, S 3 S 18 (2015) PK Phase I Introduction to Pharmacokinetic Analysis Focus on Phase I Study 1 2 Kazuro Ikawa 1 and Jun Tanaka 2
 Vol. 36, Special Issue, S 3 S 18 (2015) PK Phase I Introduction to Pharmacokinetic Analysis Focus on Phase I Study 1 2 Kazuro Ikawa 1 and Jun Tanaka 2 1 2 1 Department of Clinical Pharmacotherapy, Hiroshima
Vol. 36, Special Issue, S 3 S 18 (2015) PK Phase I Introduction to Pharmacokinetic Analysis Focus on Phase I Study 1 2 Kazuro Ikawa 1 and Jun Tanaka 2 1 2 1 Department of Clinical Pharmacotherapy, Hiroshima
Microsoft Word - 日本語要約_4000字_.docx
 心疾患に罹患したイヌおよびネコの血漿中 N 末端 prob 型ナトリウム利尿ペプチド濃度の診断的意義に関する研究 The diagnostic significance of plasma N-terminal pro-b type natriuretic peptide concentration in dogs and cats with cardiac diseases 学位論文の内容の要約
心疾患に罹患したイヌおよびネコの血漿中 N 末端 prob 型ナトリウム利尿ペプチド濃度の診断的意義に関する研究 The diagnostic significance of plasma N-terminal pro-b type natriuretic peptide concentration in dogs and cats with cardiac diseases 学位論文の内容の要約
薬物動態開発の経緯 特性製品情報(3) 薬物動態に対する食事の影響 ( 外国人データ )(B66119)12) 品情報臨床成績臨床成績薬物動態薬物動態薬効薬理薬効薬理一般薬理 毒性一般薬理 毒性(2) 反復投与 (CV18546) 11) 日本人健康成人男性 6 例に アピキサバン 1 回 2.5
 薬物動態開発の経緯 特性製品情報2.5 1 25 5mgを空腹時に単回経口投与品情報また 日本人及び白人健康成人男性において アピキサバン 臨床成績臨床成績薬物動態薬物動態薬効薬理薬効薬理一般薬理 毒性一般薬理 毒性1. 血中濃度 (1) 単回投与 (CV18513) 1) 日本人健康成人男性 12 例に アピキサバン2.5 1mgを空腹時に単回経口投与 したとき 投与後 3 3.5 時間で最高血漿中濃度に達し
薬物動態開発の経緯 特性製品情報2.5 1 25 5mgを空腹時に単回経口投与品情報また 日本人及び白人健康成人男性において アピキサバン 臨床成績臨床成績薬物動態薬物動態薬効薬理薬効薬理一般薬理 毒性一般薬理 毒性1. 血中濃度 (1) 単回投与 (CV18513) 1) 日本人健康成人男性 12 例に アピキサバン2.5 1mgを空腹時に単回経口投与 したとき 投与後 3 3.5 時間で最高血漿中濃度に達し
すとき, モサプリドのピーク面積の相対標準偏差は 2.0% 以下である. * 表示量 溶出規格 規定時間 溶出率 10mg/g 45 分 70% 以上 * モサプリドクエン酸塩無水物として モサプリドクエン酸塩標準品 C 21 H 25 ClFN 3 O 3 C 6 H 8 O 7 :
 モサプリドクエン酸塩散 Mosapride Citrate Powder 溶出性 6.10 本品の表示量に従いモサプリドクエン酸塩無水物 (C 21 H 25 ClFN 3 O 3 C 6 H 8 O 7 ) 約 2.5mgに対応する量を精密に量り, 試験液に溶出試験第 2 液 900mLを用い, パドル法により, 毎分 50 回転で試験を行う. 溶出試験を開始し, 規定時間後, 溶出液 20mL
モサプリドクエン酸塩散 Mosapride Citrate Powder 溶出性 6.10 本品の表示量に従いモサプリドクエン酸塩無水物 (C 21 H 25 ClFN 3 O 3 C 6 H 8 O 7 ) 約 2.5mgに対応する量を精密に量り, 試験液に溶出試験第 2 液 900mLを用い, パドル法により, 毎分 50 回転で試験を行う. 溶出試験を開始し, 規定時間後, 溶出液 20mL
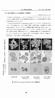 ,...~,.'~ 表 2.6.2.2-26 試験管内 PAE 菌株薬剤 MIC (µg/ml) PAE (h) 1 MIC 4 MIC STFX 0.025 0.92 2.35 S. aureus FDA 209-P LVFX 0.20 0.68 2.68 CPFX 0.20 1.05 1.59 SPFX 0.10 0.35 1.07 STFX 0.025 2.33 1.14 E. coli KL-16
,...~,.'~ 表 2.6.2.2-26 試験管内 PAE 菌株薬剤 MIC (µg/ml) PAE (h) 1 MIC 4 MIC STFX 0.025 0.92 2.35 S. aureus FDA 209-P LVFX 0.20 0.68 2.68 CPFX 0.20 1.05 1.59 SPFX 0.10 0.35 1.07 STFX 0.025 2.33 1.14 E. coli KL-16
豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株
 豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚繁殖 呼吸障害症候群ウイルス JJ1882 株又はこれと同等と認められた株 2.1.2
豚繁殖 呼吸障害症候群生ワクチン ( シード ) 平成 24 年 3 月 13 日 ( 告示第 675 号 ) 新規追加 1 定義シードロット規格に適合した弱毒豚繁殖 呼吸障害症候群ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を凍結乾燥したワクチンである 2 製法 2.1 製造用株 2.1.1 名称豚繁殖 呼吸障害症候群ウイルス JJ1882 株又はこれと同等と認められた株 2.1.2
2009年度業績発表会(南陽)
 高速イオンクロマトグラフィーによる ボイラ水中のイオン成分分析 のご紹介 東ソー株式会社 バイオサイエンス事業部 JASIS 217 新技術説明会 (217.9.8) rev.1 1. ボイラ水分析について ボイラ水の水質管理 ボイラ : 高圧蒸気の発生装置であり 工場, ビル, 病院など幅広い産業分野でユーティリティ源として利用されている 安全かつ効率的な運転には 日常の水質管理, ブロー管理が必須
高速イオンクロマトグラフィーによる ボイラ水中のイオン成分分析 のご紹介 東ソー株式会社 バイオサイエンス事業部 JASIS 217 新技術説明会 (217.9.8) rev.1 1. ボイラ水分析について ボイラ水の水質管理 ボイラ : 高圧蒸気の発生装置であり 工場, ビル, 病院など幅広い産業分野でユーティリティ源として利用されている 安全かつ効率的な運転には 日常の水質管理, ブロー管理が必須
日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 名称日本脳炎ウイル
 日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 2.1.1 名称日本脳炎ウイルス中山株薬検系又はこれと同等と認められた株 2.1.2 性状豚腎初代細胞で増殖し がちょう 鶏初生ひな及びはとの赤血球を凝集する
日本脳炎不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した日本脳炎ウイルスを同規格に適合した株化細胞で増殖させて得たウイルス液を不活化したワクチンである 2 製法 2.1 製造用株 2.1.1 名称日本脳炎ウイルス中山株薬検系又はこれと同等と認められた株 2.1.2 性状豚腎初代細胞で増殖し がちょう 鶏初生ひな及びはとの赤血球を凝集する
報告書 H22-2A-09
 061-0293 1757 TEL 0133-23-1211 2.0% 0.5% in vitro QOL Quality of Life 1 MCE-400 400 mpa s Duck Algin 350M M/G 0.8 70 80 C 20% 50 C 1.0% 5 C SV-10 5 C 10 ml E TV 20H model E 1 34 R24 1 ml 5 C 30 6 12 30
061-0293 1757 TEL 0133-23-1211 2.0% 0.5% in vitro QOL Quality of Life 1 MCE-400 400 mpa s Duck Algin 350M M/G 0.8 70 80 C 20% 50 C 1.0% 5 C SV-10 5 C 10 ml E TV 20H model E 1 34 R24 1 ml 5 C 30 6 12 30
審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ
![審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ 審査報告 (1) 別紙 平成 29 年 4 月 3 日 本申請において 申請者が提出した資料及び医薬品医療機器総合機構における審査の概略等は 以下 のとおりである 申請品目 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノ](/thumbs/92/110667825.jpg) 審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
審査報告書 平成 29 年 5 月 17 日 独立行政法人医薬品医療機器総合機構 る 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりであ 記 [ 販売名 ] ジャドニュ顆粒分包 90 mg 同顆粒分包 360 mg [ 一般名 ] デフェラシロクス [ 申請者 ] ノバルティスファーマ株式会社 [ 申請年月日 ] 平成 28 年 7 月 28 日 [ 剤形 含量
アスナプレビル 2.4 非臨床試験の概括評価 Page 2 用語及び略語一覧 ADME absorption, distribution, metabolism and excretion 吸収 分布 代謝及び排泄 ALP alkaline phosphatase アルカリフォスファターゼ ALT
 アスナプレビル 2.4 非臨床試験の概括評価 Page 1 CTD 第 2 部 2.4 非臨床試験の概括評価 ブリストル マイヤーズ株式会社 アスナプレビル 2.4 非臨床試験の概括評価 Page 2 用語及び略語一覧 ADME absorption, distribution, metabolism and excretion 吸収 分布 代謝及び排泄 ALP alkaline phosphatase
アスナプレビル 2.4 非臨床試験の概括評価 Page 1 CTD 第 2 部 2.4 非臨床試験の概括評価 ブリストル マイヤーズ株式会社 アスナプレビル 2.4 非臨床試験の概括評価 Page 2 用語及び略語一覧 ADME absorption, distribution, metabolism and excretion 吸収 分布 代謝及び排泄 ALP alkaline phosphatase
生物学に関する実験例 - 生化学 / 医療に関する実験例 ラジオアッセイ法によるホルモン測定 [ 目的 ] 本実習では, 放射免疫測定 (Radioimmunoassay,RIA) 法による血中インスリンとイムノラジオメトリックアッセイ ( 免疫放射定測定 Immunoradiometric ass
![生物学に関する実験例 - 生化学 / 医療に関する実験例 ラジオアッセイ法によるホルモン測定 [ 目的 ] 本実習では, 放射免疫測定 (Radioimmunoassay,RIA) 法による血中インスリンとイムノラジオメトリックアッセイ ( 免疫放射定測定 Immunoradiometric ass 生物学に関する実験例 - 生化学 / 医療に関する実験例 ラジオアッセイ法によるホルモン測定 [ 目的 ] 本実習では, 放射免疫測定 (Radioimmunoassay,RIA) 法による血中インスリンとイムノラジオメトリックアッセイ ( 免疫放射定測定 Immunoradiometric ass](/thumbs/104/163903931.jpg) 生物学に関する実験例 - 生化学 / 医療に関する実験例 ラジオアッセイ法によるホルモン測定 [ 目的 ] 本実習では, 放射免疫測定 (Radioimmunoassay,RIA) 法による血中インスリンとイムノラジオメトリックアッセイ ( 免疫放射定測定 Immunoradiometric assay, IRMA) 法による血清中のレニンを定量を通して 今日用いられている種々のインビトロ検査法の原理並びに両者の違い等を理解する
生物学に関する実験例 - 生化学 / 医療に関する実験例 ラジオアッセイ法によるホルモン測定 [ 目的 ] 本実習では, 放射免疫測定 (Radioimmunoassay,RIA) 法による血中インスリンとイムノラジオメトリックアッセイ ( 免疫放射定測定 Immunoradiometric assay, IRMA) 法による血清中のレニンを定量を通して 今日用いられている種々のインビトロ検査法の原理並びに両者の違い等を理解する
4.6 生殖発生毒性 その他の毒性 光毒性 抗原性及び免疫毒性 毒性発現の機序に関する試験 依存性 代謝物の安全性評価 不純物の安全性評
 Table of Contents 1 非臨床試験計画概略... 7 2 薬理試験... 10 2.1 効力を裏付ける試験... 10 2.1.1 活性及びジェノタイプ網羅性... 10 2.1.2 特異性及び選択性... 11 2.1.3 各種細胞における細胞毒性... 11 2.1.4 作用機序... 11 2.1.4.1 NS5B ポリメラーゼに対する作用... 11 2.1.4.2 耐性...
Table of Contents 1 非臨床試験計画概略... 7 2 薬理試験... 10 2.1 効力を裏付ける試験... 10 2.1.1 活性及びジェノタイプ網羅性... 10 2.1.2 特異性及び選択性... 11 2.1.3 各種細胞における細胞毒性... 11 2.1.4 作用機序... 11 2.1.4.1 NS5B ポリメラーゼに対する作用... 11 2.1.4.2 耐性...
アスナプレビル 毒性試験の概要文 Page 2 用語及び略語一覧 8-MOP 8-methoxypsoralen 8- メトキシソラレン ALP alkaline phosphatase アルカリホスファターゼ ALT alanine aminotransferase アラニンアミノトラ
 アスナプレビル 2.6.6 毒性試験の概要文 Page 1 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 2.6.6 毒性試験の概要文 ブリストル マイヤーズ株式会社 アスナプレビル 2.6.6 毒性試験の概要文 Page 2 用語及び略語一覧 8-MOP 8-methoxypsoralen 8- メトキシソラレン ALP alkaline phosphatase アルカリホスファターゼ
アスナプレビル 2.6.6 毒性試験の概要文 Page 1 CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 2.6.6 毒性試験の概要文 ブリストル マイヤーズ株式会社 アスナプレビル 2.6.6 毒性試験の概要文 Page 2 用語及び略語一覧 8-MOP 8-methoxypsoralen 8- メトキシソラレン ALP alkaline phosphatase アルカリホスファターゼ
11.3. 海外におけるガイダンス FDA のガイダンス EU のガイダンス 12. 註 13. 質疑応答集 1. はじめに本文書は 新医薬品の開発および医薬品の適正使用に必要なヒトにおける薬物動態情報を得ることを目的に 医薬品の承認申請時に添付する資料または既承認医
 医薬品の臨床薬物動態試験について ( 平成一三年六月一日 ) ( 医薬審発第七九六号 ) ( 各都道府県衛生主管部 ( 局 ) 長あて厚生労働省医薬局審査管理課長通知 ) 医薬品の製造 ( 輸入 ) 承認申請に際し添付すべき資料のうち 臨床試験 ( 治験 ) に関する資料については 平成 4 年 6 月 29 日薬新薬第 43 号通知別添 新医薬品の臨床評価に関する一般指針について 及び平成 10
医薬品の臨床薬物動態試験について ( 平成一三年六月一日 ) ( 医薬審発第七九六号 ) ( 各都道府県衛生主管部 ( 局 ) 長あて厚生労働省医薬局審査管理課長通知 ) 医薬品の製造 ( 輸入 ) 承認申請に際し添付すべき資料のうち 臨床試験 ( 治験 ) に関する資料については 平成 4 年 6 月 29 日薬新薬第 43 号通知別添 新医薬品の臨床評価に関する一般指針について 及び平成 10
CHEMOTHERAPY JUNE 1988 ( })-1-ethyl-6,8-difluoro-1,4-dihydro-7-(3-methyl-l-piperaziny1) 4-oxo-3-quinolinecarboxylic acid hydrochloride Fig. 1. Chemica
 CHEMOTHERAPY JUNE 1988 ( })-1-ethyl-6,8-difluoro-1,4-dihydro-7-(3-methyl-l-piperaziny1) 4-oxo-3-quinolinecarboxylic acid hydrochloride Fig. 1. Chemical structure of NY-198 VOL. 36 5-2 CHEMOTHERAPY Mouse
CHEMOTHERAPY JUNE 1988 ( })-1-ethyl-6,8-difluoro-1,4-dihydro-7-(3-methyl-l-piperaziny1) 4-oxo-3-quinolinecarboxylic acid hydrochloride Fig. 1. Chemical structure of NY-198 VOL. 36 5-2 CHEMOTHERAPY Mouse
新規 P2X4 受容体アンタゴニスト NCP-916 の鎮痛作用と薬物動態に関する検討 ( 分野名 : ライフイノベーション分野 ) ( 学籍番号 )3PS1333S ( 氏名 ) 小川亨 序論 神経障害性疼痛とは, 体性感覚神経系の損傷や疾患によって引き起こされる痛みと定義され, 自発痛やアロディ
 九州大学学術情報リポジトリ Kyushu University Institutional Repository 新規 P2X4 受容体アンタゴニスト NCP-916 の鎮痛作用と薬物動態に関する検討 小川, 亨 http://hdl.handle.net/2324/178378 出版情報 : 九州大学, 216, 博士 ( 創薬科学 ), 課程博士バージョン : 権利関係 : やむを得ない事由により本文ファイル非公開
九州大学学術情報リポジトリ Kyushu University Institutional Repository 新規 P2X4 受容体アンタゴニスト NCP-916 の鎮痛作用と薬物動態に関する検討 小川, 亨 http://hdl.handle.net/2324/178378 出版情報 : 九州大学, 216, 博士 ( 創薬科学 ), 課程博士バージョン : 権利関係 : やむを得ない事由により本文ファイル非公開
スライド 1
 非線形混合効果モデルにおける Visual Predictive Check (VPC)) の性能に関する検討 寺内理絵 新城博子 笠井英史株式会社ベルシステム 24 医薬関連サービス本部臨床管理 1 局 Examination of the performance of visual predictive check (VPC) in nonlinear mixed-effect model Rie
非線形混合効果モデルにおける Visual Predictive Check (VPC)) の性能に関する検討 寺内理絵 新城博子 笠井英史株式会社ベルシステム 24 医薬関連サービス本部臨床管理 1 局 Examination of the performance of visual predictive check (VPC) in nonlinear mixed-effect model Rie
生理学 1章 生理学の基礎 1-1. 細胞の主要な構成成分はどれか 1 タンパク質 2 ビタミン 3 無機塩類 4 ATP 第5回 按マ指 (1279) 1-2. 細胞膜の構成成分はどれか 1 無機りん酸 2 リボ核酸 3 りん脂質 4 乳酸 第6回 鍼灸 (1734) E L 1-3. 細胞膜につ
 の基礎 1-1. 細胞の主要な構成成分はどれか 1 タンパク質 2 ビタミン 3 無機塩類 4 ATP 第5回 (1279) 1-2. 細胞膜の構成成分はどれか 1 無機りん酸 2 リボ核酸 3 りん脂質 4 乳酸 第6回 (1734) 1-3. 細胞膜について正しい記述はどれか 1 糖脂質分子が規則正しく配列している 2 イオンに対して選択的な透過性をもつ 3 タンパク質分子の二重層膜からなる 4
の基礎 1-1. 細胞の主要な構成成分はどれか 1 タンパク質 2 ビタミン 3 無機塩類 4 ATP 第5回 (1279) 1-2. 細胞膜の構成成分はどれか 1 無機りん酸 2 リボ核酸 3 りん脂質 4 乳酸 第6回 (1734) 1-3. 細胞膜について正しい記述はどれか 1 糖脂質分子が規則正しく配列している 2 イオンに対して選択的な透過性をもつ 3 タンパク質分子の二重層膜からなる 4
<4D F736F F F696E74202D D95698EBF B C8B4B8A698E8E8CB181698D828BB4816A44325F D9770>
 第 10 回医薬品品質フォーラムシンポジウム生物学的同等性試験ガイドラインの改訂に向けて 医薬品品質フォーラム溶出試験 WG での議論から - 規格試験としての溶出試験 製薬協製剤研究部会アステラス製薬製剤研究所高橋豊 1 はじめに 議論に至った背景 溶出試験の規格試験設定については 各社が個別に当局と相談して設定しているが レビューアにより対応が異なるケースがある BE ガイドラインに関する議論から派生した課題も含めて
第 10 回医薬品品質フォーラムシンポジウム生物学的同等性試験ガイドラインの改訂に向けて 医薬品品質フォーラム溶出試験 WG での議論から - 規格試験としての溶出試験 製薬協製剤研究部会アステラス製薬製剤研究所高橋豊 1 はじめに 議論に至った背景 溶出試験の規格試験設定については 各社が個別に当局と相談して設定しているが レビューアにより対応が異なるケースがある BE ガイドラインに関する議論から派生した課題も含めて
後発医薬品の生物学的同等性試験ガイドライン
 AUC (ng hr/ml) C max (ng/ml) 333.47 70.72 324.49 66.82 46.28 11.53 45.61 13.44 AUC - C max 出典 : 厚生労働省医薬食品局審査管理課長通知より抜粋 ( 別添 ) 後発医薬品の生物学的同等性試験ガイドライン 目 次 第 1 章緒言第 2 章用語第 3 章試験 A. 経口通常製剤及び腸溶性製剤 Ⅰ. 標準製剤と試験製剤
AUC (ng hr/ml) C max (ng/ml) 333.47 70.72 324.49 66.82 46.28 11.53 45.61 13.44 AUC - C max 出典 : 厚生労働省医薬食品局審査管理課長通知より抜粋 ( 別添 ) 後発医薬品の生物学的同等性試験ガイドライン 目 次 第 1 章緒言第 2 章用語第 3 章試験 A. 経口通常製剤及び腸溶性製剤 Ⅰ. 標準製剤と試験製剤
Epilepsy2015
 Key Concepts 1. 患者個々の治療のゴールをできるだけ早く設定 てんかんの薬物治療 薬物治療学 小川竜一 か または他の抗てんかん薬へ切り替える 第一 選択薬とは異なる作用機序の薬物 3. 年齢や合併症 服薬コンプライアンスなどの基本 情報も抗てんかん薬の選択に影響 2. 抗てんかん薬の投与が中止できる患者も存在する 決定する必要がある 50%~70%は単剤で管理でき る 2 慢性の脳の病気
Key Concepts 1. 患者個々の治療のゴールをできるだけ早く設定 てんかんの薬物治療 薬物治療学 小川竜一 か または他の抗てんかん薬へ切り替える 第一 選択薬とは異なる作用機序の薬物 3. 年齢や合併症 服薬コンプライアンスなどの基本 情報も抗てんかん薬の選択に影響 2. 抗てんかん薬の投与が中止できる患者も存在する 決定する必要がある 50%~70%は単剤で管理でき る 2 慢性の脳の病気
CTD 1.9
 CTD 1.9 1.9 3 1.9 (1) JAN 16 12 17 6 23 0623001 JAN Bortezomib {(1R)-3--1-[(2S)-3--2-(-2-)] () } {(1R)-3-Methyl-1-[(2S)-3-phenyl-2-(pyrazine-2-carboxamido)propanamido]butyl}boronic acid (2) INN bortezomib
CTD 1.9 1.9 3 1.9 (1) JAN 16 12 17 6 23 0623001 JAN Bortezomib {(1R)-3--1-[(2S)-3--2-(-2-)] () } {(1R)-3-Methyl-1-[(2S)-3-phenyl-2-(pyrazine-2-carboxamido)propanamido]butyl}boronic acid (2) INN bortezomib
レスピア静注 経口液 60mg 第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 薬物動態試験の概要文 ノーベルファーマ株式会社
 第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 ノーベルファーマ株式会社 2.6.4 薬物動態試験の概要文 目次 2.6.4 薬物動態試験の概要文...3 2.6.4.1 まとめ...3 2.6.4.2 分析方法及び試験材料...7 2.6.4.2.1 分析方法...7 2.6.4.2.2 試験材料...7 2.6.4.3 吸収...9 2.6.4.4
第 2 部 ( モジュール 2) 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 ノーベルファーマ株式会社 2.6.4 薬物動態試験の概要文 目次 2.6.4 薬物動態試験の概要文...3 2.6.4.1 まとめ...3 2.6.4.2 分析方法及び試験材料...7 2.6.4.2.1 分析方法...7 2.6.4.2.2 試験材料...7 2.6.4.3 吸収...9 2.6.4.4
スライド 1
 3 年次前期専門科目群 Ⅰ ( 必修科目 ) 2 単位 医療薬剤学 Ⅰ 8 回目 生物薬剤学講座児玉庸夫 1 医療薬剤学 Ⅰ は医薬品の有効性と 安全性を基礎から理解するための学問 医薬品 有効性 安全性 2 講義の内容 (1) 第 1 回薬物の生体内運命 第 2 回薬物の副作用 ( 薬物有害反応 )( 小テスト ) 第 3 回薬物の循環系移行と排泄 ( 小テスト ) 第 4 回薬物の投与方法と経口投与製剤
3 年次前期専門科目群 Ⅰ ( 必修科目 ) 2 単位 医療薬剤学 Ⅰ 8 回目 生物薬剤学講座児玉庸夫 1 医療薬剤学 Ⅰ は医薬品の有効性と 安全性を基礎から理解するための学問 医薬品 有効性 安全性 2 講義の内容 (1) 第 1 回薬物の生体内運命 第 2 回薬物の副作用 ( 薬物有害反応 )( 小テスト ) 第 3 回薬物の循環系移行と排泄 ( 小テスト ) 第 4 回薬物の投与方法と経口投与製剤
生殖発生毒性試験の実施時期について
 S5(R3) Informal 医薬品の生殖発生毒性試験法 ( 改訂 ) 日本製薬工業協会 ICH プロジェクト委員会 S5(R3) Informal WG トピックリーダー藤原道夫 1 本日の内容 1. リスボンInformal WG 対面会議開催に至る経緯 2. ミネアポリス会議以後の活動 3. S5(R3) コンセプトペーパーの変遷 4. S5(R3) に向けて検討されるべき事項 5. S5(R3)
S5(R3) Informal 医薬品の生殖発生毒性試験法 ( 改訂 ) 日本製薬工業協会 ICH プロジェクト委員会 S5(R3) Informal WG トピックリーダー藤原道夫 1 本日の内容 1. リスボンInformal WG 対面会議開催に至る経緯 2. ミネアポリス会議以後の活動 3. S5(R3) コンセプトペーパーの変遷 4. S5(R3) に向けて検討されるべき事項 5. S5(R3)
バイオジェン ジャパン株式会社 Page 薬物動態試験の概要文 フマル酸ジメチル テクフィデラカプセル 120mg テクフィデラカプセル 240mg 第 2 部 ( モジュール 2): CTD の概要 ( サマリー ) 薬物動態試験の概要文 バイオジェン ジャパン株式会社
 バイオジェン ジャパン株式会社 Page 1 テクフィデラカプセル 120mg テクフィデラカプセル 240mg 第 2 部 ( モジュール 2): CTD の概要 ( サマリー ) 2.6.4 薬物動態試験の概要文 バイオジェン ジャパン株式会社 バイオジェン ジャパン株式会社 Page 2 目次 頁 2.6.4.1 まとめ... 7 2.6.4.2 分析法... 8 2.6.4.2.1 マウス血漿分析法...
バイオジェン ジャパン株式会社 Page 1 テクフィデラカプセル 120mg テクフィデラカプセル 240mg 第 2 部 ( モジュール 2): CTD の概要 ( サマリー ) 2.6.4 薬物動態試験の概要文 バイオジェン ジャパン株式会社 バイオジェン ジャパン株式会社 Page 2 目次 頁 2.6.4.1 まとめ... 7 2.6.4.2 分析法... 8 2.6.4.2.1 マウス血漿分析法...
CTD 第 2 部 2.6 非臨床試験の概要文及び概要表 薬物動態試験の概要文 MSD 株式会社
 CTD 第 2 部 2.6.4 薬物動態試験の概要文 MSD 株式会社 2.6.4 薬物動態試験の概要文 目次 頁 表一覧... 2 図一覧... 3 略号及び用語の定義... 4 2.6.4.1 まとめ... 5 2.6.4.2 分析法... 6 2.6.4.3 吸収... 7 2.6.4.4 分布... 12 2.6.4.5 代謝... 16 2.6.4.6 排泄... 28 2.6.4.7 薬物動態学的相互作用...
CTD 第 2 部 2.6.4 薬物動態試験の概要文 MSD 株式会社 2.6.4 薬物動態試験の概要文 目次 頁 表一覧... 2 図一覧... 3 略号及び用語の定義... 4 2.6.4.1 まとめ... 5 2.6.4.2 分析法... 6 2.6.4.3 吸収... 7 2.6.4.4 分布... 12 2.6.4.5 代謝... 16 2.6.4.6 排泄... 28 2.6.4.7 薬物動態学的相互作用...
本品約2g を精密に量り、試験液に水900mLを用い、溶出試験法第2法により、毎分50回転で試験を行う
 ベンフォチアミン 138.3mg/g ピリドキシン塩酸塩 100mg/g シアノコバラミン 1mg/g 散 Benfotiamine 138.3mg/g Pyridoxine Hydrochloride 100mg/g and Cyanocobalamin 1mg/g Powder 溶出性 6.10 本品約 0.5g を精密に量り, 試験液に水 900mL を用い, パドル法により, 毎分 50 回転で試験を行う.
ベンフォチアミン 138.3mg/g ピリドキシン塩酸塩 100mg/g シアノコバラミン 1mg/g 散 Benfotiamine 138.3mg/g Pyridoxine Hydrochloride 100mg/g and Cyanocobalamin 1mg/g Powder 溶出性 6.10 本品約 0.5g を精密に量り, 試験液に水 900mL を用い, パドル法により, 毎分 50 回転で試験を行う.
抑制することが知られている 今回はヒト子宮内膜におけるコレステロール硫酸のプロテ アーゼ活性に対する効果を検討することとした コレステロール硫酸の着床期特異的な発現の機序を解明するために 合成酵素であるコ レステロール硫酸基転移酵素 (SULT2B1b) に着目した ヒト子宮内膜は排卵後 脱落膜 化
 論文の内容の要旨 論文題目 着床期ヒト子宮内膜におけるコレステロール硫酸の発現調節機序及び機能の解析 指導教員武谷雄二教授 東京大学大学院医学系研究科 平成 15 年 4 月入学 医学博士課程 生殖 発達 加齢医学専攻 清末美奈子 緒言 着床とは 受精卵が分割し形成された胚盤胞が子宮内膜上皮へ接着 貫通し 子 宮内膜間質を浸潤して絨毛構造を形成するまでの一連の現象をいう 胚盤胞から分化した トロフォブラストが浸潤していく過程で
論文の内容の要旨 論文題目 着床期ヒト子宮内膜におけるコレステロール硫酸の発現調節機序及び機能の解析 指導教員武谷雄二教授 東京大学大学院医学系研究科 平成 15 年 4 月入学 医学博士課程 生殖 発達 加齢医学専攻 清末美奈子 緒言 着床とは 受精卵が分割し形成された胚盤胞が子宮内膜上皮へ接着 貫通し 子 宮内膜間質を浸潤して絨毛構造を形成するまでの一連の現象をいう 胚盤胞から分化した トロフォブラストが浸潤していく過程で
馬ロタウイルス感染症 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した馬ロタウイルス (A 群 G3 型 ) を同規格に適合した株化細胞で増殖させて得たウイルス液を不活化し アジュバント
 馬ロタウイルス感染症 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した馬ロタウイルス (A 群 G3 型 ) を同規格に適合した株化細胞で増殖させて得たウイルス液を不活化し アジュバントを添加したワクチンである 2 製法 2.1 製造用株 2.1.1 名称馬ロタウイルス Ho-5MA 株又はこれと同等と認められた株
馬ロタウイルス感染症 ( アジュバント加 ) 不活化ワクチン ( シード ) 平成 24 年 7 月 4 日 ( 告示第 1622 号 ) 新規追加 1 定義シードロット規格に適合した馬ロタウイルス (A 群 G3 型 ) を同規格に適合した株化細胞で増殖させて得たウイルス液を不活化し アジュバントを添加したワクチンである 2 製法 2.1 製造用株 2.1.1 名称馬ロタウイルス Ho-5MA 株又はこれと同等と認められた株
1)~ 2) 3) 近位筋脱力 CK(CPK) 高値 炎症を伴わない筋線維の壊死 抗 HMG-CoA 還元酵素 (HMGCR) 抗体陽性等を特徴とする免疫性壊死性ミオパチーがあらわれ 投与中止後も持続する例が報告されているので 患者の状態を十分に観察すること なお 免疫抑制剤投与により改善がみられた
 適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
適正使用に欠かせない情報です 必ずお読みください 使用上の注意 改訂のお知らせ 注 1) 処方箋医薬品 ATORVASTATIN TABLETS AMALUET COMBINATION TABLETS 注 1) 処方箋医薬品 PRAVASTATIN SODIUM TABLETS 注 1) 注意 - 医師等の処方箋により使用すること PITAVASTATIN CALCIUM TABLETS 2016
<4D F736F F D B82C982C282A282C482512E646F63>
 サンプル条件および固定化分子の選択 Biacoreの実験ではセンサーチップに固定化する分子をリガンド それに対して結合を測定する分子をアナライトと呼びます いずれの分子をリガンドとし アナライトとするかは 実験系を構築する上で重要です 以下にサンプルに適したリガンド アナライトの設計方法やサンプルの必要条件などをご紹介します アナライト リガンド センサーチップ (1) タンパク質リガンドとしてもアナライトとしても用いることができます
サンプル条件および固定化分子の選択 Biacoreの実験ではセンサーチップに固定化する分子をリガンド それに対して結合を測定する分子をアナライトと呼びます いずれの分子をリガンドとし アナライトとするかは 実験系を構築する上で重要です 以下にサンプルに適したリガンド アナライトの設計方法やサンプルの必要条件などをご紹介します アナライト リガンド センサーチップ (1) タンパク質リガンドとしてもアナライトとしても用いることができます
2.1 目次 アレジオン点眼液 0.05% 第 2 部 ( モジュール 2): CTD の概要 ( サマリー ) 2.1 第 2 部 ( モジュール 2) から第 5 部 ( モジュール 5) の目次 参天製薬株式会社 1
 アレジオン点眼液 0.05% 第 2 部 ( モジュール 2): CTD の概要 ( サマリー ) 2.1 第 2 部 ( モジュール 2) から第 5 部 ( モジュール 5) の目次 参天製薬株式会社 1 第 2 部 ( モジュール 2):CTD の概要 ( サマリー ) 2.1 第 2 部 ( モジュール 2) から第 5 部 ( モジュール 5) の目次 2.2 緒言 2.3 品質に関する概括資料
アレジオン点眼液 0.05% 第 2 部 ( モジュール 2): CTD の概要 ( サマリー ) 2.1 第 2 部 ( モジュール 2) から第 5 部 ( モジュール 5) の目次 参天製薬株式会社 1 第 2 部 ( モジュール 2):CTD の概要 ( サマリー ) 2.1 第 2 部 ( モジュール 2) から第 5 部 ( モジュール 5) の目次 2.2 緒言 2.3 品質に関する概括資料
テイカ製薬株式会社 社内資料
 テイカ製薬株式会社社内資料 アレルギー性結膜炎治療剤トラニラスト点眼液.5% TS TRANILAST Ophthalmic Solution.5% TS 生物学的同等性に関する資料 発売元 : 興和株式会社 製造販売元 : テイカ製薬株式会社 9 年 月作成 TSTR5BE9 ラット及びモルモットアレルギー性結膜炎モデルにおける生物学的同等性試験 Ⅰ. 試験の目的トラニラスト点眼液.5% TS および標準製剤の生物学的同等性をラット受動感作アレルギー性結膜炎モデル及びモルモット能動感作アレルギー性結膜炎モデルを用い薬力学的に検討した
テイカ製薬株式会社社内資料 アレルギー性結膜炎治療剤トラニラスト点眼液.5% TS TRANILAST Ophthalmic Solution.5% TS 生物学的同等性に関する資料 発売元 : 興和株式会社 製造販売元 : テイカ製薬株式会社 9 年 月作成 TSTR5BE9 ラット及びモルモットアレルギー性結膜炎モデルにおける生物学的同等性試験 Ⅰ. 試験の目的トラニラスト点眼液.5% TS および標準製剤の生物学的同等性をラット受動感作アレルギー性結膜炎モデル及びモルモット能動感作アレルギー性結膜炎モデルを用い薬力学的に検討した
スライド 1
 3 年次前期専門科目群 Ⅰ ( 必修科目 ) 2 単位 医療薬剤学 Ⅰ 10 回目 生物薬剤学講座児玉庸夫 1 医療薬剤学 Ⅰ は医薬品の有効性と 安全性を基礎から理解するための学問 医薬品 有効性 安全性 2 講義の内容 (1) 第 1 回薬物の生体内運命 第 2 回薬物の副作用 ( 薬物有害反応 )( 小テスト ) 第 3 回薬物の循環系移行と排泄 ( 小テスト ) 第 4 回薬物の投与方法と経口投与製剤
3 年次前期専門科目群 Ⅰ ( 必修科目 ) 2 単位 医療薬剤学 Ⅰ 10 回目 生物薬剤学講座児玉庸夫 1 医療薬剤学 Ⅰ は医薬品の有効性と 安全性を基礎から理解するための学問 医薬品 有効性 安全性 2 講義の内容 (1) 第 1 回薬物の生体内運命 第 2 回薬物の副作用 ( 薬物有害反応 )( 小テスト ) 第 3 回薬物の循環系移行と排泄 ( 小テスト ) 第 4 回薬物の投与方法と経口投与製剤
薬物動態学の最初の発展期である 1960 年代中頃から 1970 年代初めになると Metzler が NONLIN という名の非線形解析プログラムを紹介し ( [Metzler, 1969]) Benet は線 形マミラリーモデル ( 図 8-1) の一般化した解法を初めて発表した ( [Bene
![薬物動態学の最初の発展期である 1960 年代中頃から 1970 年代初めになると Metzler が NONLIN という名の非線形解析プログラムを紹介し ( [Metzler, 1969]) Benet は線 形マミラリーモデル ( 図 8-1) の一般化した解法を初めて発表した ( [Bene 薬物動態学の最初の発展期である 1960 年代中頃から 1970 年代初めになると Metzler が NONLIN という名の非線形解析プログラムを紹介し ( [Metzler, 1969]) Benet は線 形マミラリーモデル ( 図 8-1) の一般化した解法を初めて発表した ( [Bene](/thumbs/82/85983678.jpg) 8. 薬物動態パラメータ (PK パラメータ )/Pharmacokinetic parameters(pk parameters) 薬物動態パラメータ /Pharmacokinetic parameters (PK パラメータ /PK parameters) という用語を解説するには その意味する範囲を理解するため 薬物動態解析の歴史的発 展に触れなければならないので 冒頭に紹介した Wagner
8. 薬物動態パラメータ (PK パラメータ )/Pharmacokinetic parameters(pk parameters) 薬物動態パラメータ /Pharmacokinetic parameters (PK パラメータ /PK parameters) という用語を解説するには その意味する範囲を理解するため 薬物動態解析の歴史的発 展に触れなければならないので 冒頭に紹介した Wagner
1. Caov-3 細胞株 A2780 細胞株においてシスプラチン単剤 シスプラチンとトポテカン併用添加での殺細胞効果を MTS assay を用い検討した 2. Caov-3 細胞株においてシスプラチンによって誘導される Akt の活性化に対し トポテカンが影響するか否かを調べるために シスプラチ
 ( 様式甲 5) 学位論文内容の要旨 論文提出者氏名 論文審査担当者 主査 朝日通雄 恒遠啓示 副査副査 瀧内比呂也谷川允彦 副査 勝岡洋治 主論文題名 Topotecan as a molecular targeting agent which blocks the Akt and VEGF cascade in platinum-resistant ovarian cancers ( 白金製剤耐性卵巣癌における
( 様式甲 5) 学位論文内容の要旨 論文提出者氏名 論文審査担当者 主査 朝日通雄 恒遠啓示 副査副査 瀧内比呂也谷川允彦 副査 勝岡洋治 主論文題名 Topotecan as a molecular targeting agent which blocks the Akt and VEGF cascade in platinum-resistant ovarian cancers ( 白金製剤耐性卵巣癌における

 測定した また Scrは酵素法にて測定し その参考基 r =0.575 p
測定した また Scrは酵素法にて測定し その参考基 r =0.575 p