本文/YA9056A
|
|
|
- さあしゃ おおばま
- 6 years ago
- Views:
Transcription
1 pp. FTIR Asp Asp Archae Halobacterium salinarum ATP diphytanylglycerol diether Proton transfer mechanism in bacteriorhodopsin FTIR spectroscopy and internal water molecules Akio Maeda Department of Biochemistry, University of Illinois at Urbana Champaign, Urbana, Illinois, U.S.A. G GPCR Helix G Lys CH N C E E Asp N H E Asp Water Asp Arg Glu Glu C nm Asp Thr
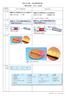
2 1 6 生化学 第8 巻 第1 1号 2 レチナールの変化 共鳴ラマン分光法 バクテリオロドプシンのレチナールは シッフ塩基を形 成する C15 N 結合を含めて 五つある二重結合のすべて が trans 型 の 全 trans 型 の も の と そ の C13 C15 C14 結 合 と N 結合 図2参照 が共に cis 型になった1 3 1 5-dicis 型のものよりなり 両者は熱平衡状態にある 光ですべて の分子が5 6 8nm に吸収極大をもつ全 trans 型に変換され る 光によるプロトンポンプを起こすのは全 trans 型レチ ナールをもつバクテリオロドプシンのみで 以下 BR と表 す 光により BR に起こされる反応は 2秒ほどで終了し もとの BR に戻る このような速い反応は 閃光照射後に 起こる変化を フェムト秒からミリ秒にわたる時間分解能 をもつ分光法を適宜使って調べる バクテリオロドプシン がすぐれた研究対象である理由の一つは このタンパク質 の最も根幹をなす部分のレチナールが光で変化し 可視部 領域での吸収スペクトル あるいは可視光で励起される共 鳴ラマンスペクトルの変化から中間体を同定し 反応過程 をリアルタイムで追跡できることにある 1ps 1 13 sec で生じる励起状態の I46 からはじまり 1ps で基底状 態である K61 で1 3-cis 型になる9 その後 赤外分光法で 同定された KL1 を経て マイクロ秒からミリ秒の時間帯 にある L543 M412 N54 O64 と続く一連の中間体が プロ トンポンプの各段階をなす中間体として同定され 最後に 図1 C 側からみたバクテリオロドプシンの三量体 少し傾け ている リボンはヘリックス レチナールが Lys2 1 6を通じて Helix G に結合していることを球モデルで示す 棒モデルは diphytanylglycerol diether を構成要素とする脂質 protein databank entry PDB ;1BRR6 により PyMol7 を用いて作図 もとの BR568 に戻ることが確認された 図2 これを光サ イクルと呼ぶ11 可視光による共鳴ラマン法のように 色の基になるレチ ナールに限定して振動バンドを解析する方法を使って レ チナール分子の各化学結合に起こる変化を同位元素置換で 図2 中間体とプロトン移動経路 プロトン移動の順序と相当する中間体の間の遷移を左に プロトン移動の経路をその右に 関係する残基の位置関係 PDB 1C3W8 により PyMol7 を用いて作図 を右に示す PRG proton release group については本文参照 1 3 1 4 1 5はレチナールの炭素原子 の番号 N はシッフ塩基の窒素原子を示す
3 C C cis L N H BR C M N H N O trans L M Asp FTIR a M BR FTIR M cm M C cm Asp Glu cm Asp M BR C cm Asp M Asp FTIR FTIR X native FTIR Asp ph M ph pka M KCl Asp O M Glu Glu Gln BR Glu Arg Tyr M FTIR cm cm continuum band a Glu Glu Glu Glu Arg BR FTIR a FTIR M BR b µs L BR c K L BR
4 Tyr Zundel PRG proton releasing group N FTIR BR Asp N Asp E Asp C Asp O D N Asp Asp BR PRG BR L L PRG Asp Asp BR E N H ph BR N NMR Asp Asp Water L -cis N H BR C Asp Water M C L Kouyama BR C Val Thr Leu Ala Lys Lue Val L Thr Asp Phe Asp Thr Val T V L M M T V D N Lys Trp Leu Val W F L M V A L K L a cm K L b H O cm cm L O H c M T V L T V D N Thr Asp L L V A L M W F FTIR L C L Asp L cavity L M M FTIR L cm O H a nm Asp Thr L Phe F L F L Phe Phe
5 1 9 2 8年 1 1月 図4 Asp9 6 シッフ塩基 Asp8 5の BR および各中間体におけるプロトン親和性と ph7でのプ ロトン化状態の変化 プロトン親和性の大小として概念的に示したので 厳密な pka 値ではない 下の方に向けて親和 性が大きく pka で3以下から1 1以上にわたる 両矢印は水がプロトンへの親和性を与える相 互作用に関与することを示す SB はシッフ塩基 SBH はプロトン化シッフ塩基を示す 定にしていることが結論される この構造の安定化に寄与 していた水クラスターがなくなるとともに シッフ塩基の プロトンに対する親和性は減少して M になる53 55 図4 M1 M2 小さくて動きやすい しかも極性の水分子をス ペーサー あるいはコファクターとして 中間体の間の速 い構造変化を行っていると考える L の別の結晶解析モデル56 57 には C 側の水のクラスター はない 結晶と native な膜標品の違いもさることながら X 線によりレチナールが損傷を受けた可能性42 がこの違い の最も大きな原因と考えている 図5 L のシッフ塩基の C 側から見下した構造 PDB 1ucq42 に より PyMoll7 を用いて作図 M に お け る Leu9 3 Val4 9の 側 鎖 PDB 1iw98 を そ の 下 のシッフ塩基がみえるようにドットで示す 6 室温の L のゆるい水クラスター BR を2 3 K で光照射すると M が安定にできる ところ が1 7 K での光照射でえた L を2 3 K に暖めても M に変 化せず もとの BR にもどる58 水との相互作用のため Val4 9の置換では影響される水分子はなく53 55 結晶解析 に シッフ塩基が強くプロトン化状態に保たれているため の結果も合わせて M ではシッフ塩基のそばには水分子 と推測される それでは室温の L ではどうなっているか はないものとみられる 室温での時間分解 FTIR スペクトルには L が存在する時 L では Leu9 3 Val4 9の側鎖がフリップし 水のクラ 間帯に重なって 光で励起されたレチナールからのエネル スターをいれるスペースをつくる M になるとその側鎖 ギーで熱せられた水分子 タンパク質部分の変化が現れ がドットで示すように空洞を塞ぎ 図5 水を排除する る31 59 その中に L と M の変換に追随して変化する よ 図5の L のモデルには示していないがこの場所に4分子 り高い振動数の 水素結合の極めて弱い数分子の水の変化 の水のクラスターがあり このような構造が C 側を向 1 4 が捉えられる 図3b 室温で L と N のシッフ塩基の いて他に支えをもたない L のプロトン化シッフ塩基を安 N H が同じような水素結合を形成して C 側を向いてい 4 2 4 3
6 N Thr Leu Val C L N L C C L L M L L N K L L FTIR N N H C K L Asp N FTIR L N FTIR L N Val Pro V A N Val N V A N Asp L Leu Val Ala L N C M L N M L M M N Asp M N Asp L L M M N M M M L M N M M Asp BR Asp pka Asp ph M PRG BR Asp PRG pka PRG Asp pka Asp pka PRG Asp pka Asp PRG pka ph M PRG PRG pka O Asp Thr D T Asp PRG Asp M N Asp M Asp pka Asp N pka ph M Asp Asp PRG Asp BR E Asp
7 BR E PDB c w PyMol Luecke Arg Asp Tyr Arg M Arg M Asp BR Asp Tyr Arg M Glu PRG pka Arg Takeda M M Lys Lys Gly Lys Pro Helix G E Helix G Glu Helix F Glu M Glu E Q M Asp Glu Glu Arg Asp Asp Asp Arg D N R Q M C H M D N M Asp L M L Asp Tyr Y N Asp Tyr M Asp BR Asp Asp Arg Tyr Asp Tyr Asp Arg M R A M Arg Tyr Helix G Phe M Helix G M cm C O Tyr Liu Figure Tyr Y D Asp Helix G Pro Val Thr Tyr SRII HtrII M Helix G Val Tyr Phe Helix G Tyr Asp M Asp
8 Asp BR Thr M Asp Asp C O cm a Thr Asn Thr C OH Asp BR Water Water N H Water L Asp Water ph L ms Water M Asp M cm a O H Arg Arg Asp Asp Water Arg Arg Asp Asp Water Trp M Asp Asp Tyr Tyr Asp N BR N Asp C O cm Asp N N Asp N O N Asp ph N O O BR Asp PRG Asp Asp O Arg Asp E Q M Asp Arg Asp M Asp Asp Trp M PDB i w PyMol Arg Tyr PRG O N H BR Asp Asp Asp Asp Asp pka BR BR Asp C O D O C OH BR Asp C OH Thr Asp BR pka L N pka N N L M M Asp ph ph M pka BR Thr Asp M Asp pka
9 N H L C Asp L M N H E L N H C L M M N nm Asp V A Asp N Asp N FTIR N L M M N ps K KL Na H anitiporter FTIR NMR GPCR G Glu Glu G C Asp Gly C O Glu FTIR GPCR β -adrenergic receptor mediator SRI SRII PR SRI SRII HtrI HtrII pka Asp GPR BR m BPR SRII PR Asp pka Glu E C F ATP P ATPase
10 ATP Ebrey Gennis Lanyi Balashov Oesterhelt, D. & Stoeckenius, W. Nature New Biol.,,. Oesterhelt, D. & Stoeckenius, W. Proc. Natl. Acad. Sci. USA,,. Henderson, R. & Unwin, P.N. Nature,,. Kushwaha, S.C., Kates, M., & Martin, W.C. Can. J. Biochem.,,. Corcelli, A., Lattanzio, V.M., Mascolo, G., Papadia, P., & Fanizzi, F. J. Lipid Res.,,. Essen, L.-O., Siegert, R., Lehmann, W.D., & Oesterhelt, D. Proc. Natl. Acad. Sci. USA,,. DeLano, W. PYMOL, DeLano Scientific, San Carlos, CA, USA. Luecke, H., Schobert, B., Richter, H.-T., Cartailler, J.-P., & Lanyi, J.K. J. Mol. Biol.,,. Kobayashi, T., Saito, T., & Ohtani, H. Nature,,. Sasaki, J., Yuzawa, T., Kandori, H., Maeda, A., & Hamaguchi, H. Biophys. J.,,. Lozier, R.H., Bogomolni, R.A., & Stoeckenius, W. Biophys. J.,,. Smith, S.O., Lugtenburg, J., & Mathies, R.A. J. Membrane Biol.,,. Morgan, J.E., Gennis, R.B., & Maeda, A. Photochem. Photobiol.,,. Morgan, J.E., Vakkasoglu, A.S., Gennis, R.B., & Maeda, A. Biochemistry,,. Maeda, A. Isr. J. Chem.,,. Maeda, A. Biochemistry Moscow,,. Barth, A. & Zscherp, C. Quart. Rev. Biophys.,,. Engelhard, M., Gerwert, K., Hess, B., Kreutz, W., & Siebert, F. Biochemistry,,. Braiman,M.S.,Mogi,T.,Marti,T.,Stern,L.J.,Khorana,H. G., & Rothschild, K.J. Biochemistry,,. Fahmy, K., Weidlich, O., Engelhard, M., Sigrist, H., & Siebert, F. Biochemistry,,. Liu, X.-M., Sonar, S., Lee, C.-P., Coleman, M., RajBhandary, U.L., & Rothschild, K.J. Biophys. Chem.,,. Matsui, Y., Sakai, K., Murakami, M., Shiro, Y., Adachi, S., Okumura, H., & Kouyama, T. J. Mol. Biol.,,. Heberle, J. & Dencher, N.A. Proc. Natl. Acad. Sci. USA,,. Brown, L.S., Sasaki, J., Kandori, H., Maeda, A., Needleman, R.,&Lanyi,J.K. J. Biol. Chem.,,. Balashov, S.P., Imasheva, E.S., Ebrey, T.G., Chen, N., Menick, D.R., & Crouch, R.K. Biochemistry,,. Garczarek, F., Brown, L.S., Lanyi, J.K., & Gerwert, K. Proc. Natl. Acad. Sci. USA,,. Balashov, S.P., Govindjee, R., Kono, M., Imasheva, E.S., Lukashev, E., Ebrey, T.G., Crouch, R.K., Menick, D.R., & Feng, Y. Biochemistry,,. Govindjee, R., Kono, M., Balashov, S.P., Imasheva, E., Sheves, M., & Ebrey, T.G. Biochemistry,,. Rammelsberg, R., Huhn, G., Lüben, M., & Gerwert, K. Biochemistry,,. Garczarek, F. & Gerwert, K. Nature,,. Lórenz-Fonfría, V.A., Furutani, Y., & Kandori, H. Biochemistry,,. Zundel, G. Adv. Chem. Phys.,,. Maeda, A., Sasaki, J., Shichida, Y., Yoshizawa, T., Chang, M., Ni, B., Needleman, R., & Lanyi, J.K. Biochemistry,,. Hessling, B., Souvignir, G., & Gerwert, K. Biophys. J.,,. Otto, H., Marti, T., Holz, M., Mogi, T., Stern, L.J., Engel, F., Khorana, H.G., & Heyn, M.P. Proc. Natl. Acad. Sci. USA,,. Sheves, M., Albeck, A., Friedman, N., & Ottolenghi, M. Proc. Natl. Acad. Sci. USA,,.
11 Deng, H., Huang, L., Callender, R.H., & Ebrey, T.G. Biophys. J.,,. Herzfeld, J. & Lansing, J.C. Annu. Rev. Biophys. Biomol. Struct.,,. Maeda, A., Tomson, F.L., Gennis, R.B., Ebrey, T.G., & Balashov, S.P. Biochemistry,,. Maeda, A., Balashov, S.P., & Ebrey, T.G. In Light SensinginPlants Wada, M., Shimazaki, K., & Iino, M. eds. pp., Springer Verlag, Tokyo. Maeda, A., Morgan, J.E., Gennis, R.B., & Ebrey, T.G. Photochem. Photobiol.,,. Kouyama, T., Nishikawa, T., Tokuhisa, T., & Okumura, H. J. Mol. Biol.,,. Yamazaki, Y., Hatanaka, M., Kandori, H., Sasaki, J., Karstens, W.F.J., Raap, J., Lugtenburg, J., Bizounok, M., Herzfeld, J., Needleman, R., Lanyi, J.K., & Maeda, A. Biochemistry,,. Yamazaki, Y., Sasaki, J., Hatanaka, M., Kandori, H., Maeda, A., Needleman, R., Shinada, T., Yoshihara, K., Brown, L.S., & Lanyi, J.K. Biochemistry,,. Brown, L.S., Gat, Y., Sheves, M., Yamazaki, Y., Maeda, A., Needleman, R., & Lanyi, J.K. Biochemistry,,. Kandori, H., Yamazaki, Y., Hatanaka, M., Needleman, R., Brown, L.S., Richter, H.-T., Lanyi, J.K., & Maeda, A. Biochemistry,,. Maeda, A., Sasaki, J., Shichida, Y., & Yoshizawa, T. Biochemistry,,. Kandori, H. Biochim. Biophys. Acta,,. Maeda, A., Tomson, F.L., Gennis, R.B., Balashov, S.P., & Ebrey, T.G. Biochemistry,,. Maeda, A., Balashov, S.P., Lugtenburg, J., Verhoeven, M.A., Herzfeld, J., Belenky, M., Gennis, R.B., Tomson, F.L., & Ebrey, T.G. Biochemistry,,. Maeda, A., Herzfeld, J., Belenky, M., Needleman, R., Gennis, R.B., Balashov, S.P., & Ebrey, T.G. Biochemistry,,. Yamazaki, Y., Kandori, H., Needleman, R., Lanyi, J.K., & Maeda, A. Biochemistry,,. Schobert, B., Brown, L.S., & Lanyi, J.K. J. Mol. Biol.,,. Maeda, A., Tomson, F.L., Gennis, R.B., Kandori, H., Ebrey, T.G., & Balashov, S.P. Biochemistry,,. Edman, K., Royant, A., Larsson, G., Jacobson, F., Taylor, T., van der Spoel, D., Landau, E.M., Pebay-Peyroula, E., & Neutze, R. J. Biol. Chem.,,. Lanyi, J.K. & Schobert, B. J. Mol. Biol.,,. Iwasa, T., Tokunaga, F., & Yoshizawa, T. Biophys. Struct. Mech.,,. Garczarek, F., Wang, J., El-Sayed, M., & Gerwert, K. Biophys. J.,,. Chizhov, I., Chenavskii, D.S., Engelhard, M., Mueller, K.-H., Zubov, B.V., & Hess, B. Biophys. J.,,. Váró,G.&Kesthelyi,L. Biophys. J.,,. Pfefferlé, J.-M., Maeda, A., Sasaki, J., & Yoshizawa, T. Biochemistry,,. Hu, J.G., Sun, B.Q., Petkova, A.T., Griffin, R.G., & Herzfeld, J. Biochemistry,,. Maeda, A., Gennis, R.B., Balashov, S.P., & Ebrey, T.G. Biochemistry,,. Yamazaki, Y., Tuzi, S., Saitô, H., Kandori, H., Needleman, R., Lanyi, J.K., & Maeda, A. Biochemistry,,. Váró,G.&Lanyi,J.K. Biochemistry,,. Kelemen, L., Galajda, P., Szaraz, S., & Ormos, P. Biophys. J.,,. Zimányi, L., Váró, G., Chang, M., Ni, B., Needleman, R., & Lanyi, J.K. Biochemistry,,. Balashov, S.P., Lu, M., Imasheva, E.S., Govindjee, R., Ebrey, T.G., Othersen III, B., Chen, Y., Crouch, R.K., & Menick, D. R. Biochemistry,,. Mukohata, Y. & Kaji, Y. Arch. Biochem. Biophys.,,. Ogurusu, T., Maeda, A., Sasaki, N., & Yoshizawa, T. Biochim. Biophys. Acta,,. Schobert, B. & Lanyi, J.K. J. Biol. Chem.,,. Kolbe, M., Besir, H., Essen, L.-O., & Oesterhelt, D. Science,,. Sasaki, J., Brown, L.S., Chon, Y.-S., Kandori, H., Maeda, A., Needleman, R., & Lanyi, J.K. Science,,. Facciotti, M.T., Rouhani, S., & Glaeser, R.M. FEBS Lett.,,. Brown, L.S. & Lanyi, J.K. Proc. Natl. Acad. Sci. USA,,. Kouyama, T., Nasuda-Kouyama, T., Ikegami, A., Mathew, M. K., & Stoeckenius, W. Biochemistry,,. Braiman, M.S., Dioumaev, A.K., & Lewis, J.R. Biophys. J.,,. Balashov, S.P., Govindjee, R., Imasheva, E.S., Misra, S., Ebrey, T.G., Feng, Y., Crouch, R.K., & Menick, D.R. Biochemistry,,. Govindjee, R., Misra, S., Balashov, S., Ebrey, T., Crouch, R. K.,&Menick,D.R. Biophys. J.,,. Takeda, K., Matsui, Y., Kamiya, N., Adachi, S.-I., Okumura, H., & Kouyama, T. J. Mol. Biol.,,. Lazarova, T., Sanz, C., Querol, E., & Padrós, E. Biophys. J.,,. Brown, L.S., Váró, G., Hatanaka, M., Sasaki, J., Kandori, H., Maeda, A., Friedman, N., Sheves, M., Needleman, R., & Lanyi, J.K. Biochemistry,,. Govindjee, R., Balashov, S.P., Ebrey, T.G., Oesterhelt, D., Steinberg, G., & Sheves, M. J. Biol. Chem.,,. Brown, L.S., Needleman, R., & Lanyi, J.K. Biochemistry,,. Morgan, J.E., Vakkasoglu, A.S., Lugtenburg, J., Gennis, R.B., & Maeda, A. Biochemistry,, in press. Sonar, S., Marti, T., Rath, P., Fischer, W., Coleman, M., Nilsson, A., Khorana, H.G., & Rothschild, K.J. J. Biol. Chem.,,. Sudo, Y. & Spudich, J.L. Proc. Natl. Acad. Sci. USA,,. Kandori, H., Yamazaki, Y., Shichida, Y., Raap, J., Lugtenburg, J., Belenky, M., & Herzfeld, J. Proc. Natl. Acad. Sci. USA,,. Russell, T.S., Coleman, M., Rath, P., Nilsson, A., & Rothschild, R.J. Biochemistry,,. Hayashi, S. & Ohmine, I. J. Phys. Chem. B,,.
12 Hatanaka, M., Sasaki, J., Kandori, H., Ebrey, T.G., Needleman, R., Lanyi, J.K., & Maeda, A. Biochemistry,,. Dioumaev, A.K., Brown, L.S., Needleman, R., & Lanyi, J.K. Biochemistry,,. Zscherp, C., Schlesinger, R., & Heberle, J. Biochem. Biophys. Res. Commun.,,. Száraz, S., Oesterhelt, D., & Ormos, P. Biophys. J.,,. Zscherp, C., Schlesinger, R., Tittor, J., Oesterhelt, D., & Heberle, J. Proc. Natl. Acad. Sci. USA,,. Sasaki, J., Lanyi, J.K., Needleman, R., Yoshizawa, T., & Maeda, A. Biochemistry,,. Bondar, A.-N., Fischer, S., Smith, J.C., Elstner, M., & Suhai, S. J. Am. Chem. Soc.,,. Hayashi, S., Tajkhorshid, E., & Schulten, K. Biophys. J.,,. Arkin, I.T., Xu, H., Jensen, M. O., Arbely, E., Bennett, E.R., Bowers, K.J., Chow, E., Dror, R.O., Eastwood, M.P., Flitman- Tene, R., Gregersen, B.A., Klepeis, J.L., Kolossváry, I., Shan, Y.,&Shaw,D.E. Science,,. Henzler-Wildman, K. & Kern, D. Nature,,. Lansing, J.C., Hohwy, M., Jaroniec, C.P., Creemers, A.F.L., Lugtenburg, J., Herzfeld, J., & Griffin, R.G. Biochemistry,,. Arnis, A. & Hofmann, K.P. Proc. Natl. Acad. Sci. USA,,. Nagata, T., Terakita, A., Kandori, H., Shichida, Y., & Maeda, A. Biochemistry,,. Li, J., Edwards, P.C., Burghammer, M., Villa, C., & Schertler, G.F.X. J. Mol. Biol.,,. Rosenbaum, D.M., Cherezov, V., Hanson, M.A., Rasmussen, S.G.F., Thian, F.S., Kobilka, T.S., Choi, H.-J., Yao, X.-J., Weis, W.I., Stevens, R.C., & Kobilka, B.K. Science,,. Murakami, M. & Kouyama, T. Nature,,. Spudich, J.L. & Bogomolni, R.A. Nature,,. Takahashi, T., Tomioka, H., Kamo, N., & Kobatake, Y. FEMS Microbiol. Lett.,,. Spudich, J.L. Mol. Microbiol.,,. Bogomolni, R.A., Stoeckenius, W., Szundi, I., Perozo, E., Olson, K.D., & Spudich, J.L. Proc. Natl. Acad. Sci. USA,,. Sudo, Y., Iwamoto, M., Shimono, K., Sumi, M., & Kamo, N. Biophys. J.,,. Béjá, O., Spudich, E.N., Spudich, J.L., Leclerc, M., & De- Long, E.F. Nature,,. Wang, W.-W., Sineschchekov, O.A., Spudich, E.N., & Spudich, J.L. J. Biol. Chem.,,. Dioumaev, A.K., Brown, L.S., Shih, J., Spudich, E.N., Spudich, J.L., & Lanyi, J.K. Biochemistry,,. Fillingame, R.H. & Dmitriev, O.Y. Biochim. Biophys. Acta,,. Pederson, B.P., Buch-Pederson, M.J., Morth, J.P., Palmgren, M.G., & Nissen, P. Nature,,.
Database Center for Life Science Online Service Natronobacterium pharaonis Crystal structure of phoborhodopsin : Mechanisms of color tuning and signal
 Natronobacterium pharaonis Crystal structure of phoborhodopsin : Mechanisms of color tuning and signal transduction Needleman, R., Lanyi, J. K. : Science, 269,73-75 (1995) 3) Bogomolni, R. A., Stoeckenius,
Natronobacterium pharaonis Crystal structure of phoborhodopsin : Mechanisms of color tuning and signal transduction Needleman, R., Lanyi, J. K. : Science, 269,73-75 (1995) 3) Bogomolni, R. A., Stoeckenius,
Vol. 35, No 解説 細菌の走光性を解明する 奈良敏文 1, 田母神淳 1, 加茂直樹 1 松山大学薬学部生物物理化学研究室 1 要旨 Halobacterium salinarum 80 キーワード SRII HtrII two-component system 1. はじ
 解説 細菌の走光性を解明する 奈良敏文 1, 田母神淳 1, 加茂直樹 1 松山大学薬学部生物物理化学研究室 1 要旨 Halobacterium salinarum 80 キーワード SRII HtrII two-component system 1. はじめに bacteriorhodopsin BR 1) 1975 Hildebrand & Dencher Halobacterium salinarum
解説 細菌の走光性を解明する 奈良敏文 1, 田母神淳 1, 加茂直樹 1 松山大学薬学部生物物理化学研究室 1 要旨 Halobacterium salinarum 80 キーワード SRII HtrII two-component system 1. はじめに bacteriorhodopsin BR 1) 1975 Hildebrand & Dencher Halobacterium salinarum
1_alignment.ppt
 " " " " n " n n " n " n n n " n n n n " n LGPSSKQTGKGW-SRIWDN! + +! LN-ITKSAGKGAIMRLGDA! " n -------TGKG--------!! -------AGKG--------! " n w w w " n w w " " " 11 12 " n w w w " n w w A! M! O! A!
" " " " n " n n " n " n n n " n n n n " n LGPSSKQTGKGW-SRIWDN! + +! LN-ITKSAGKGAIMRLGDA! " n -------TGKG--------!! -------AGKG--------! " n w w w " n w w " " " 11 12 " n w w w " n w w A! M! O! A!
本文/YA4278I
 pp. D- D-DAO DAO D- D- D- D- o- DAO-D- D-DAO DAO Hans Krebs FAD X DAO DAO DAO D- Structure and reaction mechanism of D-amino acid oxidase Yasuzo Nishina School of Health Sciences, Kumamoto University,
pp. D- D-DAO DAO D- D- D- D- o- DAO-D- D-DAO DAO Hans Krebs FAD X DAO DAO DAO D- Structure and reaction mechanism of D-amino acid oxidase Yasuzo Nishina School of Health Sciences, Kumamoto University,
 1) Y. Hatefi: Annu. Rev. Biochem., 54, 1015 (1985). 2) H. Weiss, T. Friedrich, G. Hofhaus & D. Preis: Eur. 4) M. Yamaguchi & Y. Hatefi: Biochemistry, 32, 1935 (1993). 5) K. Leonard, H. Haiker & H. Weiss:
1) Y. Hatefi: Annu. Rev. Biochem., 54, 1015 (1985). 2) H. Weiss, T. Friedrich, G. Hofhaus & D. Preis: Eur. 4) M. Yamaguchi & Y. Hatefi: Biochemistry, 32, 1935 (1993). 5) K. Leonard, H. Haiker & H. Weiss:
 1) van Meer, G., Op den Kamp, J. A.: J. Cell. Biochem., 19, 193-2040982) 2) Gaffet, P., Bettache, N., Bienvenue, A.: Biochemistry, 34, 6762-6769(1995) 3) Sims, P. J., Wiedmer, T.: Thromb. Haemost., 86,
1) van Meer, G., Op den Kamp, J. A.: J. Cell. Biochem., 19, 193-2040982) 2) Gaffet, P., Bettache, N., Bienvenue, A.: Biochemistry, 34, 6762-6769(1995) 3) Sims, P. J., Wiedmer, T.: Thromb. Haemost., 86,
10中西_他.indd
 Streptomyces mobaraensis N N N Sm b Sm N N Sm Sm Sm ' ' Sm Sm ak K k K bk k K Sm Sm a b S. mobaraensis a b a b Sm b b bb b b Sm Sm S. lividans ab Sm ab Sm ab ab ab ab SmSm S. lividansab S. lividans ab
Streptomyces mobaraensis N N N Sm b Sm N N Sm Sm Sm ' ' Sm Sm ak K k K bk k K Sm Sm a b S. mobaraensis a b a b Sm b b bb b b Sm Sm S. lividans ab Sm ab Sm ab ab ab ab SmSm S. lividansab S. lividans ab
 Kazumitsu Ueda, E-mail : uedak@kais.kyoto-u.ac.jp http : //cseika-1, kais.kyoto-u.ac.j p Molecular mechanism of multidrug transporter MDR I : ABC in host-defense machinery 32P-ATP 1) Chen, C., Chin,
Kazumitsu Ueda, E-mail : uedak@kais.kyoto-u.ac.jp http : //cseika-1, kais.kyoto-u.ac.j p Molecular mechanism of multidrug transporter MDR I : ABC in host-defense machinery 32P-ATP 1) Chen, C., Chin,
本文/YA9255F
 pp. ATP ε ATP ATP ATP ε Bacillus PS ATP ATP H H µ H ATP ATP ADP µ H ATP FoF -ATP FoF -ATP µ H H ADP ATP H Na On the regulatory role of the epsilon subunit in ATP synthase Yasuyuki Kato-Yamada Department
pp. ATP ε ATP ATP ATP ε Bacillus PS ATP ATP H H µ H ATP ATP ADP µ H ATP FoF -ATP FoF -ATP µ H H ADP ATP H Na On the regulatory role of the epsilon subunit in ATP synthase Yasuyuki Kato-Yamada Department
Title 蛋白質における光駆動プロトン移動と水素結合 Author(s) 石北, 央 ; 斉藤, 圭亮 Citation 生物物理 (2013), 53(4): Issue Date URL 201
 Title 蛋白質における光駆動 Author(s) 石北, 央 ; 斉藤, 圭亮 Citation 生物物理 (2013), 53(4): 198-201 Issue Date 2013-07 URL http://hdl.handle.net/2433/176483 2013 by THE BIOPHYSICAL SOCIETY O Right is not the published version.
Title 蛋白質における光駆動 Author(s) 石北, 央 ; 斉藤, 圭亮 Citation 生物物理 (2013), 53(4): 198-201 Issue Date 2013-07 URL http://hdl.handle.net/2433/176483 2013 by THE BIOPHYSICAL SOCIETY O Right is not the published version.
BioMolChem
 C C C C C C C C C C C C C C 1 + + + + + 3 C C 3 Cl Li + 3 C C 3! 2 C 2 + + + C 3 3 C 3 C 2 C 3 C 3 + 3 C C 3 3 C 3 C 3 C + + + Ph Ph 2 + Ph Ph Ph 3 ! #$%&!" '()*% +,-./#0-&1 C 2 2340-& + "5678./9%&+,#37*3:
C C C C C C C C C C C C C C 1 + + + + + 3 C C 3 Cl Li + 3 C C 3! 2 C 2 + + + C 3 3 C 3 C 2 C 3 C 3 + 3 C C 3 3 C 3 C 3 C + + + Ph Ph 2 + Ph Ph Ph 3 ! #$%&!" '()*% +,-./#0-&1 C 2 2340-& + "5678./9%&+,#37*3:
Database Center for Life Science Online Service (http : // taxonomy.zoology.gla.ac.uk/rod/treeview.html) Takaaki Abe, Michiaki Unno*, Tohru Onogawa*,
 (http : // taxonomy.zoology.gla.ac.uk/rod/treeview.html) Takaaki Abe, Michiaki Unno*, Tohru Onogawa*, E mail : takaabe@mail.cc.tohoku.ac.jp Taro Tokui, Molecular identification of organic anion transporter
(http : // taxonomy.zoology.gla.ac.uk/rod/treeview.html) Takaaki Abe, Michiaki Unno*, Tohru Onogawa*, E mail : takaabe@mail.cc.tohoku.ac.jp Taro Tokui, Molecular identification of organic anion transporter
本文/YAY116K
 pp. GH GH GH β- - D- β- β- β- - EC J Alkalitolerant mechanism and improvement of alkalitolerancy of glycoside hydrolases Satoshi Nakamura Department of Bioengineering, Tokyo Institute of Technology, J
pp. GH GH GH β- - D- β- β- β- - EC J Alkalitolerant mechanism and improvement of alkalitolerancy of glycoside hydrolases Satoshi Nakamura Department of Bioengineering, Tokyo Institute of Technology, J
tary adenylate cyclase activating polypeptide ; PA-
 Conformation of a peptide ligand bound to its G-protein coupled receptor and its implication for ligand transportation tary adenylate cyclase activating polypeptide ; PA- molecular biology (ed. Rich,
Conformation of a peptide ligand bound to its G-protein coupled receptor and its implication for ligand transportation tary adenylate cyclase activating polypeptide ; PA- molecular biology (ed. Rich,
色覚(初組4).pm
 733 3 1 520 1 8 4 0.2500 1 30012 1 AB 3 22 3 1 2 http://www.nig.ac.jp/labs/devgen/mou.html 734 1.1 360nm 830nm 380nm 780nm 540nm 580nm 660nm 540nm 660nm Log relative corneal sensitivity 0 1 2 400 500 600
733 3 1 520 1 8 4 0.2500 1 30012 1 AB 3 22 3 1 2 http://www.nig.ac.jp/labs/devgen/mou.html 734 1.1 360nm 830nm 380nm 780nm 540nm 580nm 660nm 540nm 660nm Log relative corneal sensitivity 0 1 2 400 500 600
Microsoft Word _abstract_kasai_ikeya2_tk.docx
 科学研究費補助金新学術領域研究 スパースモデリングの深化と高次元データ駆動科学の創成 最終成果報告会 (207/2/8-20) NMR (NMR) NMR! SpM NMR NMR NMR (MaxEnt) (CS) NMR (SpM) NMR NMR ( ) 2 NMR NMR 2 NMR NMR NMR n n- 2 NMR E-mail: kigawa@riken.jp 2 (non-uniform
科学研究費補助金新学術領域研究 スパースモデリングの深化と高次元データ駆動科学の創成 最終成果報告会 (207/2/8-20) NMR (NMR) NMR! SpM NMR NMR NMR (MaxEnt) (CS) NMR (SpM) NMR NMR ( ) 2 NMR NMR 2 NMR NMR NMR n n- 2 NMR E-mail: kigawa@riken.jp 2 (non-uniform
 64) M.L. Gefter, R.L. Russell: J. Mol. Biol., 39, 145 (1969) 65) F. Harada, F. Kimura and S. Nishimura: Biochim. Biophys. Acta., 182, 590 (1969) 65a) F.H.C. Crick: J. Mol, Biol., 19, 548 (1966); M. Nirenberg
64) M.L. Gefter, R.L. Russell: J. Mol. Biol., 39, 145 (1969) 65) F. Harada, F. Kimura and S. Nishimura: Biochim. Biophys. Acta., 182, 590 (1969) 65a) F.H.C. Crick: J. Mol, Biol., 19, 548 (1966); M. Nirenberg
36 th IChO : - 3 ( ) , G O O D L U C K final 1
 36 th ICh - - 5 - - : - 3 ( ) - 169 - -, - - - - - - - G D L U C K final 1 1 1.01 2 e 4.00 3 Li 6.94 4 Be 9.01 5 B 10.81 6 C 12.01 7 N 14.01 8 16.00 9 F 19.00 10 Ne 20.18 11 Na 22.99 12 Mg 24.31 Periodic
36 th ICh - - 5 - - : - 3 ( ) - 169 - -, - - - - - - - G D L U C K final 1 1 1.01 2 e 4.00 3 Li 6.94 4 Be 9.01 5 B 10.81 6 C 12.01 7 N 14.01 8 16.00 9 F 19.00 10 Ne 20.18 11 Na 22.99 12 Mg 24.31 Periodic
03J_sources.key
 Radiation Detection & Measurement (1) (2) (3) (4)1 MeV ( ) 10 9 m 10 7 m 10 10 m < 10 18 m X 10 15 m 10 15 m ......... (isotope)...... (isotone)......... (isobar) 1 1 1 0 1 2 1 2 3 99.985% 0.015% ~0% E
Radiation Detection & Measurement (1) (2) (3) (4)1 MeV ( ) 10 9 m 10 7 m 10 10 m < 10 18 m X 10 15 m 10 15 m ......... (isotope)...... (isotone)......... (isobar) 1 1 1 0 1 2 1 2 3 99.985% 0.015% ~0% E
 Various function and toxicity of iron Key words 1) Hentze, M. W. et al: Cell, 117, 285-297 (2004) 2) Ganz, T.: Blood, 102, 783-788 (2003) 3) Nemeth, E. et al.: Science, 306, 2090-2093 (2004) 4) Hentze,
Various function and toxicity of iron Key words 1) Hentze, M. W. et al: Cell, 117, 285-297 (2004) 2) Ganz, T.: Blood, 102, 783-788 (2003) 3) Nemeth, E. et al.: Science, 306, 2090-2093 (2004) 4) Hentze,
1 1 H Li Be Na M g B A l C S i N P O S F He N Cl A e K Ca S c T i V C Mn Fe Co Ni Cu Zn Ga Ge As Se B K Rb S Y Z Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb T e
 No. 1 1 1 H Li Be Na M g B A l C S i N P O S F He N Cl A e K Ca S c T i V C Mn Fe Co Ni Cu Zn Ga Ge As Se B K Rb S Y Z Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb T e I X e Cs Ba F Ra Hf Ta W Re Os I Rf Db Sg Bh
No. 1 1 1 H Li Be Na M g B A l C S i N P O S F He N Cl A e K Ca S c T i V C Mn Fe Co Ni Cu Zn Ga Ge As Se B K Rb S Y Z Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb T e I X e Cs Ba F Ra Hf Ta W Re Os I Rf Db Sg Bh
Database Center for Life Science Online Service
 1) Epps, H. M., Gale, E. F.: Biochem. J., 36, 619-623 (1942) 2) Monod, J.: Recherches sur la croissance des cultures bacteriennes, Ph. D. thesis. Her mann,paris (1942) 3) Magasanik, B.: Cold Spring Harbor
1) Epps, H. M., Gale, E. F.: Biochem. J., 36, 619-623 (1942) 2) Monod, J.: Recherches sur la croissance des cultures bacteriennes, Ph. D. thesis. Her mann,paris (1942) 3) Magasanik, B.: Cold Spring Harbor
The function and structure of NAD kinase: the key enzyme for biosynthesis of NADP (H) Database Center for Life Science Online Service Key words Shigey
 The function and structure of NAD kinase: the key enzyme for biosynthesis of NADP (H) Key words Shigeyuki Kawai, Chikako Fukuda, Kousaku Murata E-mail : kawais@kais.kyoto-u.ac.jp, chikakko@kais.kyotou.ac.jp,
The function and structure of NAD kinase: the key enzyme for biosynthesis of NADP (H) Key words Shigeyuki Kawai, Chikako Fukuda, Kousaku Murata E-mail : kawais@kais.kyoto-u.ac.jp, chikakko@kais.kyotou.ac.jp,
Database Center for Life Science Online Service Discovery, analysis and chemical mechanism of protein splicing
 Discovery, analysis and chemical mechanism of protein splicing VMA1 VMA1 2) Anraku, Y.: Genes to Cells, 2, 359-367 (1997) 3) Perler, F. B.: Cell, 92,1-4 (1998) 4) Perler, F. B.: Trends Biochem.
Discovery, analysis and chemical mechanism of protein splicing VMA1 VMA1 2) Anraku, Y.: Genes to Cells, 2, 359-367 (1997) 3) Perler, F. B.: Cell, 92,1-4 (1998) 4) Perler, F. B.: Trends Biochem.
 4) H. Takayama et al.: J. Med. Chem., 45, 1949 (2002). 5) H. Takayama et al.: J. Am. Chem. Soc., 112, 8635 (2000). 6) H. Takayama et al.: Tetrahedron Lett., 42, 2995 (2001). 9) M. Kitajima et al: Chem.
4) H. Takayama et al.: J. Med. Chem., 45, 1949 (2002). 5) H. Takayama et al.: J. Am. Chem. Soc., 112, 8635 (2000). 6) H. Takayama et al.: Tetrahedron Lett., 42, 2995 (2001). 9) M. Kitajima et al: Chem.
(a) (b) (c) (d) 1: (a) (b) (c) (d) (a) (b) (c) 2: (a) (b) (c) 1(b) [1 10] 1 degree k n(k) walk path 4
![(a) (b) (c) (d) 1: (a) (b) (c) (d) (a) (b) (c) 2: (a) (b) (c) 1(b) [1 10] 1 degree k n(k) walk path 4 (a) (b) (c) (d) 1: (a) (b) (c) (d) (a) (b) (c) 2: (a) (b) (c) 1(b) [1 10] 1 degree k n(k) walk path 4](/thumbs/91/105665060.jpg) 1 vertex edge 1(a) 1(b) 1(c) 1(d) 2 (a) (b) (c) (d) 1: (a) (b) (c) (d) 1 2 6 1 2 6 1 2 6 3 5 3 5 3 5 4 4 (a) (b) (c) 2: (a) (b) (c) 1(b) [1 10] 1 degree k n(k) walk path 4 1: Zachary [11] [12] [13] World-Wide
1 vertex edge 1(a) 1(b) 1(c) 1(d) 2 (a) (b) (c) (d) 1: (a) (b) (c) (d) 1 2 6 1 2 6 1 2 6 3 5 3 5 3 5 4 4 (a) (b) (c) 2: (a) (b) (c) 1(b) [1 10] 1 degree k n(k) walk path 4 1: Zachary [11] [12] [13] World-Wide
2007050781......_.L.O...z.W
 a s d f g a s d f g h j k l 0 in vitro in vivo in vitro in vivo in vivo in vivo in vitro Metabolism Metabolism Endocr Endocr Endocrinol Ann NYA cad Sci J clin Endocr Metab
a s d f g a s d f g h j k l 0 in vitro in vivo in vitro in vivo in vivo in vivo in vitro Metabolism Metabolism Endocr Endocr Endocrinol Ann NYA cad Sci J clin Endocr Metab
スライド 1
 タンパク質 ( 生化学 1) 平成 29 年 4 月 20 日病態生化学分野 分子酵素化学分野教授 山縣和也 生化学 1のスケジュール 4 月 20 日 講義開始 6 月 1 日 中間試験 9 月 25 日 生化学 1 試験 講義日程 内容は一部変更があります 講義資料 ( 山縣 吉澤分 ): 熊本大学病態生化学 で検索 ID: Biochem2 パスワード :76TgFD3Xc 生化学 1 の合否判定は
タンパク質 ( 生化学 1) 平成 29 年 4 月 20 日病態生化学分野 分子酵素化学分野教授 山縣和也 生化学 1のスケジュール 4 月 20 日 講義開始 6 月 1 日 中間試験 9 月 25 日 生化学 1 試験 講義日程 内容は一部変更があります 講義資料 ( 山縣 吉澤分 ): 熊本大学病態生化学 で検索 ID: Biochem2 パスワード :76TgFD3Xc 生化学 1 の合否判定は
(1) GGT阻害剤
 (GGT) (glutathione, GSH, -L-Glu-L-Cys-Gly) Cys 1 10 mm GSSG GSH 98% - + H 3 N COO - γ- O H N O N H SH O γ-glu Cys Gly OH - (GGT, EC 2.3.2.2) GGT (GSH) GSX - Glu Cys(X)-Gly 1-2) GGT - 1 hydrolases transferases
(GGT) (glutathione, GSH, -L-Glu-L-Cys-Gly) Cys 1 10 mm GSSG GSH 98% - + H 3 N COO - γ- O H N O N H SH O γ-glu Cys Gly OH - (GGT, EC 2.3.2.2) GGT (GSH) GSX - Glu Cys(X)-Gly 1-2) GGT - 1 hydrolases transferases
1...z04/08/.e2
 August 2004 29 α α 30 Functional Glycomics News Letter No.4 α α August, 2004 31 β ü β α β α 32 Functional Glycomics News Letter No.4 α β August, 2004 33 34 Functional Glycomics News Letter No.4 α β ü August,
August 2004 29 α α 30 Functional Glycomics News Letter No.4 α α August, 2004 31 β ü β α β α 32 Functional Glycomics News Letter No.4 α β August, 2004 33 34 Functional Glycomics News Letter No.4 α β ü August,
37-4.indd
 ISSN 0916-3328 東京大学アイソトープ総合センター VOL. 37 NO. 4 2007. 3. 26 アイソトープ総合センターの将来展望 40 18 18 20 3 800 1/3 1300 14 18 20 3 19 2 生きた細胞内の分子過程を 時間 空間計測する蛍光プローブの開発 1. はじめに Fura-2 Fura-2 198 1, 2 3, 4 2. 生体脂質分子の機能とその分析
ISSN 0916-3328 東京大学アイソトープ総合センター VOL. 37 NO. 4 2007. 3. 26 アイソトープ総合センターの将来展望 40 18 18 20 3 800 1/3 1300 14 18 20 3 19 2 生きた細胞内の分子過程を 時間 空間計測する蛍光プローブの開発 1. はじめに Fura-2 Fura-2 198 1, 2 3, 4 2. 生体脂質分子の機能とその分析
タンパク質を物性科学的に見た場合、単なるアミド結合の集合体であると片づけるにはもったいなさすぎる
 Precise Functional Analysis of Biological Macromolecules Promoted by the Encounter of Crystallographic and Spectroscopic Molecular Structure Analyses Takamitsu Kohzuma*, Sachiko Yanagisawa, and Tomotake
Precise Functional Analysis of Biological Macromolecules Promoted by the Encounter of Crystallographic and Spectroscopic Molecular Structure Analyses Takamitsu Kohzuma*, Sachiko Yanagisawa, and Tomotake
寄稿論文 規則性無機ナノ空間が創り出す新しい触媒能 | 東京化成工業
 MCM-41 M41 MCM-41 M41 2 3 m 2 /g nm nm Mn Ti Ti H N 2 S Ti-MCM-41, H H N H H 2 2 -Urea, CH 2 Cl 2, H 2 S + S 1b 2b 3b 54%, 58% ee Ti M41 H 2 As 4 ZP 4 ZP ZS ZS 5 Me Me Me Me M41 / 15 mg MeH 1.0 mmol 89%
MCM-41 M41 MCM-41 M41 2 3 m 2 /g nm nm Mn Ti Ti H N 2 S Ti-MCM-41, H H N H H 2 2 -Urea, CH 2 Cl 2, H 2 S + S 1b 2b 3b 54%, 58% ee Ti M41 H 2 As 4 ZP 4 ZP ZS ZS 5 Me Me Me Me M41 / 15 mg MeH 1.0 mmol 89%
Database Center for Life Science Online Service Signal transduction of growth factor mediated by heparin heparan sulfate
 Signal transduction of growth factor mediated by heparin heparan sulfate 1) Zhu. X.. Komiya, H., Chirino, A.. Faham. S.. Fox, G. M., Arakawa, T., Hsu, B.T., Rees, D. C.: Science. 251, 90-93 (1991)
Signal transduction of growth factor mediated by heparin heparan sulfate 1) Zhu. X.. Komiya, H., Chirino, A.. Faham. S.. Fox, G. M., Arakawa, T., Hsu, B.T., Rees, D. C.: Science. 251, 90-93 (1991)
a L = Ψ éiγ c pa qaa mc ù êë ( - )- úû Ψ 1 Ψ 4 γ a a 0, 1,, 3 {γ a, γ b } η ab æi O ö æo ö β, σ = ço I α = è - ø çèσ O ø γ 0 x iβ γ i x iβα i
 解説 4 matsuo.mamoru jaea.go.jp 4 eizi imr.tohoku.ac.jp 4 maekawa.sadamichi jaea.go.jp i ii iii i Gd Tb Dy g khz Pt ii iii Keywords vierbein 3 dreibein 4 vielbein torsion JST-ERATO 1 017 1. 1..1 a L = Ψ
解説 4 matsuo.mamoru jaea.go.jp 4 eizi imr.tohoku.ac.jp 4 maekawa.sadamichi jaea.go.jp i ii iii i Gd Tb Dy g khz Pt ii iii Keywords vierbein 3 dreibein 4 vielbein torsion JST-ERATO 1 017 1. 1..1 a L = Ψ
 Minamiooya, Machida, Tokyo 194, Japan] RNA World, A Key Step in the Origin of Life : Inspection from the View Point of Biological Evolution 1) Crick, F. H. C.: Sym. Soc. Exp. Biol., 12, 548-555
Minamiooya, Machida, Tokyo 194, Japan] RNA World, A Key Step in the Origin of Life : Inspection from the View Point of Biological Evolution 1) Crick, F. H. C.: Sym. Soc. Exp. Biol., 12, 548-555
…h…L…–…†…fi…g1
 21 1326 1328 2002 22 4375 4377 2003 34 6 848 849 2005 9 10 15 1067 1070 1996 49 133 166 2003 1 2 2 3 4 4 1 3 23 311 313 2004 5 1 118 7604 7607 1996 15 1 33 6627 6629 2000 12 649 155 167 2003 76 23 7007
21 1326 1328 2002 22 4375 4377 2003 34 6 848 849 2005 9 10 15 1067 1070 1996 49 133 166 2003 1 2 2 3 4 4 1 3 23 311 313 2004 5 1 118 7604 7607 1996 15 1 33 6627 6629 2000 12 649 155 167 2003 76 23 7007
 (Quality of Life; QL) QL (Nerve Growth Factor; NGF) NGF PC12 6- (6-HITC) NGF NGF NGF PTP1B 6-HITC PTP1B NGF PTP1B 6-HITC PTP1B 6-HITC NGF 6-HITC 6-HITC in vivo 464-8601 Tel: 052-789-4126 20-Hydroxyecdysone
(Quality of Life; QL) QL (Nerve Growth Factor; NGF) NGF PC12 6- (6-HITC) NGF NGF NGF PTP1B 6-HITC PTP1B NGF PTP1B 6-HITC PTP1B 6-HITC NGF 6-HITC 6-HITC in vivo 464-8601 Tel: 052-789-4126 20-Hydroxyecdysone
 46 12 3 1 ATP ( ) ATP ~P 1~P hyd Gº 1 1 1950 ~P hyd Gº Hansia et al. Biophys Chem 119: 127, 2006 ~P hyd Gº 1? ATP hyd Gº ATP ATP ATP ~P ε ~P George [BBA 223: 1, 1970] ~P 2) hyd Gº 1. ph Mg 2+ 2. 1 2 2
46 12 3 1 ATP ( ) ATP ~P 1~P hyd Gº 1 1 1950 ~P hyd Gº Hansia et al. Biophys Chem 119: 127, 2006 ~P hyd Gº 1? ATP hyd Gº ATP ATP ATP ~P ε ~P George [BBA 223: 1, 1970] ~P 2) hyd Gº 1. ph Mg 2+ 2. 1 2 2
 Review Fumio Imamoto1, Takefumi Sone1, Kazuhide Yahata1, Yukari Sasaki1, Masatoshi Takagi2, Kazuhiro Maeshima2, Naoko 25) Dong, W. K. et al.: Gene, 91, 217-223 (1990) 26) Masatsugu, T. et al.:
Review Fumio Imamoto1, Takefumi Sone1, Kazuhide Yahata1, Yukari Sasaki1, Masatoshi Takagi2, Kazuhiro Maeshima2, Naoko 25) Dong, W. K. et al.: Gene, 91, 217-223 (1990) 26) Masatsugu, T. et al.:
本文3/YA8183E
 pp. N Tom Tom Tom - Tom µm Soft interaction for the recognition of mitochondrial targeting signal Daisuke Kohda Division of Structural Biology, Medical Institute of Bioregulation, Kyushu University, Maidashi,
pp. N Tom Tom Tom - Tom µm Soft interaction for the recognition of mitochondrial targeting signal Daisuke Kohda Division of Structural Biology, Medical Institute of Bioregulation, Kyushu University, Maidashi,
 Stress-responsive MAP kinases 15) Lu, H. T., Yang, D. D., Wysk, M., Gatti, E., Mellman, I., Davis, R. J., Flavell, R. A. : EMBO J., 18,1845-1857 (1999) 16) Lu, B., Yu, H., Chow, C., Li, B., Zheng,
Stress-responsive MAP kinases 15) Lu, H. T., Yang, D. D., Wysk, M., Gatti, E., Mellman, I., Davis, R. J., Flavell, R. A. : EMBO J., 18,1845-1857 (1999) 16) Lu, B., Yu, H., Chow, C., Li, B., Zheng,
 Kazumitsu Ueda, [Department of Applied Life Science, Kyoto University Graduate School of Agriculture, Kitashirakawa, Sakyo-ku, Kyoto 606-01, Japan] Molecular Mechanisms for Drug Transport by MDR1/P-glycoprotein
Kazumitsu Ueda, [Department of Applied Life Science, Kyoto University Graduate School of Agriculture, Kitashirakawa, Sakyo-ku, Kyoto 606-01, Japan] Molecular Mechanisms for Drug Transport by MDR1/P-glycoprotein
ウェブ23Brev2
 23B 23B.1 23B.1.1 23B.1.2 23B.2 23B.2.1 23B.2.2 a b 23B.3 23B.3.1 23B.3.2 23B.4 23B.4.1 23B.4.2 23B.4.3 23B.5 23B.5.1 23B.5.2 23B.6 23B.6.1 a b c Edman d e 23B.6.2 23B.6.3 23B.7 23B.7.1 a b c 23B.7.2 23B.7.3
23B 23B.1 23B.1.1 23B.1.2 23B.2 23B.2.1 23B.2.2 a b 23B.3 23B.3.1 23B.3.2 23B.4 23B.4.1 23B.4.2 23B.4.3 23B.5 23B.5.1 23B.5.2 23B.6 23B.6.1 a b c Edman d e 23B.6.2 23B.6.3 23B.7 23B.7.1 a b c 23B.7.2 23B.7.3
 Review Column 1) Extavour, C. G., Akam, M. : Development, 130, 5869-5884 (2003) 2) Saitou, M. et al.: Philos. Trans. R. Soc. Lond. B. Biol. Sci., 358,1363-1370(2003) 3) Eddy, E. M. : Int. Rev.
Review Column 1) Extavour, C. G., Akam, M. : Development, 130, 5869-5884 (2003) 2) Saitou, M. et al.: Philos. Trans. R. Soc. Lond. B. Biol. Sci., 358,1363-1370(2003) 3) Eddy, E. M. : Int. Rev.
 Correlation between molecular evolution of P450s and evolution of plant secondary metabolism Masaharu Mizutani E-mail : mizutani@scl.kyoto-u.ac.jp URL : http://biofun.kuicr.kyoto-u.ac.jp/index-j.html 13)
Correlation between molecular evolution of P450s and evolution of plant secondary metabolism Masaharu Mizutani E-mail : mizutani@scl.kyoto-u.ac.jp URL : http://biofun.kuicr.kyoto-u.ac.jp/index-j.html 13)
 Tomohiro Terada, Ken-ichi Inui, Peptide transporter family situ 1) Matthews, D.M. : Physiol. Rev., 55, 537-608(1975) 2) Ganapathy, V.. Leibach, F.H.: Am. J. Physiol. Gastro intest. Liver Physiol.,
Tomohiro Terada, Ken-ichi Inui, Peptide transporter family situ 1) Matthews, D.M. : Physiol. Rev., 55, 537-608(1975) 2) Ganapathy, V.. Leibach, F.H.: Am. J. Physiol. Gastro intest. Liver Physiol.,
本文/YA8183H
 pp. AQP AQP AQP AQPZ GlpF pf pf pf matrix AQP A Comparative molecular simulations of water permeation in aquaporins Akinori Kidera and Mitsunori Ikeguchi Department of Supramolecular Biology, Yokohama
pp. AQP AQP AQP AQPZ GlpF pf pf pf matrix AQP A Comparative molecular simulations of water permeation in aquaporins Akinori Kidera and Mitsunori Ikeguchi Department of Supramolecular Biology, Yokohama
Lipids of Seeds Manjiro NODA Department of Agricultural Chemistry, College of Agriculture, Kyoto Prefectural University (Sakyo-ku, Kyoto)
 Lipids of Seeds Manjiro NODA Department of Agricultural Chemistry, College of Agriculture, Kyoto Prefectural University (Sakyo-ku, Kyoto) and Other Lipids", Vol. 11, p. 137 (1970) 2) C.Y. Hopkins,
Lipids of Seeds Manjiro NODA Department of Agricultural Chemistry, College of Agriculture, Kyoto Prefectural University (Sakyo-ku, Kyoto) and Other Lipids", Vol. 11, p. 137 (1970) 2) C.Y. Hopkins,
Database Center for Life Science Online Service Science, Osaka University, Toyonaka 560, Japan] Protein Dynamics Revealed by an Ultrafast Time-resolve
![Database Center for Life Science Online Service Science, Osaka University, Toyonaka 560, Japan] Protein Dynamics Revealed by an Ultrafast Time-resolve Database Center for Life Science Online Service Science, Osaka University, Toyonaka 560, Japan] Protein Dynamics Revealed by an Ultrafast Time-resolve](/thumbs/94/118373084.jpg) Science, Osaka University, Toyonaka 560, Japan] Protein Dynamics Revealed by an Ultrafast Time-resolved Spectroscopy of Tryptophan 2) Karplus, M., McCammon, J.A.: Ann. Rev. Biochem., 53, 263-300
Science, Osaka University, Toyonaka 560, Japan] Protein Dynamics Revealed by an Ultrafast Time-resolved Spectroscopy of Tryptophan 2) Karplus, M., McCammon, J.A.: Ann. Rev. Biochem., 53, 263-300
pp * Yw; Mq 1. 1L 20 cc [1] Sonoluminescence: Light emission from acoustic cavitation bubble. Pak-Kon Choi (Departm
![pp * Yw; Mq 1. 1L 20 cc [1] Sonoluminescence: Light emission from acoustic cavitation bubble. Pak-Kon Choi (Departm pp * Yw; Mq 1. 1L 20 cc [1] Sonoluminescence: Light emission from acoustic cavitation bubble. Pak-Kon Choi (Departm](/thumbs/94/118261255.jpg) 73 7 2017 pp. 447 454 447 * 43.25.Yw; 78.60.Mq 1. 1L 20 cc [1] Sonoluminescence: Light emission from acoustic cavitation bubble. Pak-Kon Choi (Department of Physics, Meiji University, Kawasaki, 214 8571)
73 7 2017 pp. 447 454 447 * 43.25.Yw; 78.60.Mq 1. 1L 20 cc [1] Sonoluminescence: Light emission from acoustic cavitation bubble. Pak-Kon Choi (Department of Physics, Meiji University, Kawasaki, 214 8571)
 Spatio-temporal regulation of ERK1/2 MAP kinase 20) Murphy, L. 0., MacKeigan, J. P., Blenis, J.: Mol. Cell. Biol., 24, 144-153 (2004) 21) Harada, T., Morooka, T., Ogawa, S., Nishida, E.: Nature Cell
Spatio-temporal regulation of ERK1/2 MAP kinase 20) Murphy, L. 0., MacKeigan, J. P., Blenis, J.: Mol. Cell. Biol., 24, 144-153 (2004) 21) Harada, T., Morooka, T., Ogawa, S., Nishida, E.: Nature Cell
PowerPoint プレゼンテーション
 2004 3 3 2 3 4 5 6 7 8 9 10 T. Ito, A. Yamamoto, et al., J. Chem. Soc., Chem. Commun., 136 (1974) J. Chem. Soc., Dalton Trans., 1783 (1974) J. Chem. Soc., Dalton Trans., 1398 (1975) 11 T.Ito, A. Yamamoto,
2004 3 3 2 3 4 5 6 7 8 9 10 T. Ito, A. Yamamoto, et al., J. Chem. Soc., Chem. Commun., 136 (1974) J. Chem. Soc., Dalton Trans., 1783 (1974) J. Chem. Soc., Dalton Trans., 1398 (1975) 11 T.Ito, A. Yamamoto,
Database Center for Life Science Online Service
 Database Center for Life Science Online Service Database Center for Life Science Online Service Database Center for Life Science Online Service Database Center for Life Science Online Service SMN (Survival
Database Center for Life Science Online Service Database Center for Life Science Online Service Database Center for Life Science Online Service Database Center for Life Science Online Service SMN (Survival
Juntendo Medical Journal
 The hair growth effect of minoxidil Susumu OTOMO, Ph. D. Key words : minoxidil, minoxidil sulfate, hair growth, K+-channel opener, male pattern baldness Dept. of Pharmacology, Research Center Taisho Pharmaceutical
The hair growth effect of minoxidil Susumu OTOMO, Ph. D. Key words : minoxidil, minoxidil sulfate, hair growth, K+-channel opener, male pattern baldness Dept. of Pharmacology, Research Center Taisho Pharmaceutical
Microsoft PowerPoint - protein1.ppt [互換モード]
![Microsoft PowerPoint - protein1.ppt [互換モード] Microsoft PowerPoint - protein1.ppt [互換モード]](/thumbs/92/108226396.jpg) 生物物理化学 1 セントラルドグマ (central doguma) DA から蛋白質が作られるまでの道筋 フランシス クリックが提唱した 原核生物と真核生物では 若干関与するタンパク質が異なるが 基本的には同じメカニズムで転写 翻訳 タンパク合成が行われる 原核生物 : 核膜が無い ( 構造的に区別出来る核を持たない ) 細胞 ( これを原核細胞という ) から成る生物で 細菌類や藍藻類がこれに属する
生物物理化学 1 セントラルドグマ (central doguma) DA から蛋白質が作られるまでの道筋 フランシス クリックが提唱した 原核生物と真核生物では 若干関与するタンパク質が異なるが 基本的には同じメカニズムで転写 翻訳 タンパク合成が行われる 原核生物 : 核膜が無い ( 構造的に区別出来る核を持たない ) 細胞 ( これを原核細胞という ) から成る生物で 細菌類や藍藻類がこれに属する
本文/YA9255C
 pp. E- -SH X in vitro in vivo -SH Structure-based drug development and medical biological application of cathepsin specific inhibitors Nobuhiko Katunuma Institute for Health Sciences, Tokushima Bunri University,Nishihamabouji,
pp. E- -SH X in vitro in vivo -SH Structure-based drug development and medical biological application of cathepsin specific inhibitors Nobuhiko Katunuma Institute for Health Sciences, Tokushima Bunri University,Nishihamabouji,
本文/YA3180D
 pp. D- Frontier Science in Amino Acid and Protein Research D- D- N - D- D- D-DAP, EC D-DaaA Ser β- D D- Discovery of D-stereoselective amino acid amidases, and their use in kinetic resolution of amino
pp. D- Frontier Science in Amino Acid and Protein Research D- D- N - D- D- D-DAP, EC D-DaaA Ser β- D D- Discovery of D-stereoselective amino acid amidases, and their use in kinetic resolution of amino
表1.eps
 Vol.1 C ontents 1 2 cell-free EMBO J Proc. Natl. Acad. Sci. USA NatureEMBO J 3 RNA NatureEMBO J Nature EMBO J 4 5 HCV HCV HCV HCV RNA HCV in situ 6 7 8 Nat Struct Mol Biol J Biol Chem Nat Commun J Virol
Vol.1 C ontents 1 2 cell-free EMBO J Proc. Natl. Acad. Sci. USA NatureEMBO J 3 RNA NatureEMBO J Nature EMBO J 4 5 HCV HCV HCV HCV RNA HCV in situ 6 7 8 Nat Struct Mol Biol J Biol Chem Nat Commun J Virol
狂牛病調査第2巻1章,2章.doc
 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 2.1 A LD50/30mg () 10 ND 1 2.8 ND ND ND 11 ND 2.3 1.0 ND ND 11 ND ND 1.3 1.7 ND 13 ND
21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 2.1 A LD50/30mg () 10 ND 1 2.8 ND ND ND 11 ND 2.3 1.0 ND ND 11 ND ND 1.3 1.7 ND 13 ND
その科学と技術 No.48( )
 45 CI +,,* a-, +0 a-, +0 a-, +., a-, + +, - +, CD CF - CTS CD a-cd b-cd g-cd a- +., 0 1 2 - +33-. CI CI CD CD a- +., CI a- +0, CD Bacillus circulans T--*.*. 13 a-, +0 CI-1 CI-2. CI-3 +* / CI 0 CI-1 CI-+1
45 CI +,,* a-, +0 a-, +0 a-, +., a-, + +, - +, CD CF - CTS CD a-cd b-cd g-cd a- +., 0 1 2 - +33-. CI CI CD CD a- +., CI a- +0, CD Bacillus circulans T--*.*. 13 a-, +0 CI-1 CI-2. CI-3 +* / CI 0 CI-1 CI-+1
™·”õ/sec3_p63_84/fiü“eflÅ
 Section3 64 1 65 Section 3 1 2 3 4 5 6 7 8 9 10 11 12 13 14 1 Babara E. Ainsworth et al. Med. Sci. Sports. Exevc.1993 66 67 Section 3 1 10 9 8 1 2 3 4 7 6 5 6 7 5 1 2 3 4 68 69 Section 3 2 70 Section 3
Section3 64 1 65 Section 3 1 2 3 4 5 6 7 8 9 10 11 12 13 14 1 Babara E. Ainsworth et al. Med. Sci. Sports. Exevc.1993 66 67 Section 3 1 10 9 8 1 2 3 4 7 6 5 6 7 5 1 2 3 4 68 69 Section 3 2 70 Section 3
 26 2 27 1 2 NFE 13.5 8.0 3.8 71.7 1.7 11.5 12.1 1.8 70.5 2.4 11.8 10.6 2.1 68.8 4.4 13.8 7.9 2.3 73.7 0.9 11.7 46.1 1.3 29.4 5.6 3 Defa Li Asian-Aust. J. Anim. Sci. 2002, 15(8), 1191-1197 Corn and brown
26 2 27 1 2 NFE 13.5 8.0 3.8 71.7 1.7 11.5 12.1 1.8 70.5 2.4 11.8 10.6 2.1 68.8 4.4 13.8 7.9 2.3 73.7 0.9 11.7 46.1 1.3 29.4 5.6 3 Defa Li Asian-Aust. J. Anim. Sci. 2002, 15(8), 1191-1197 Corn and brown
1 2 LDA Local Density Approximation 2 LDA 1 LDA LDA N N N H = N [ 2 j + V ion (r j ) ] + 1 e 2 2 r j r k j j k (3) V ion V ion (r) = I Z I e 2 r
![1 2 LDA Local Density Approximation 2 LDA 1 LDA LDA N N N H = N [ 2 j + V ion (r j ) ] + 1 e 2 2 r j r k j j k (3) V ion V ion (r) = I Z I e 2 r 1 2 LDA Local Density Approximation 2 LDA 1 LDA LDA N N N H = N [ 2 j + V ion (r j ) ] + 1 e 2 2 r j r k j j k (3) V ion V ion (r) = I Z I e 2 r](/thumbs/91/104998910.jpg) 11 March 2005 1 [ { } ] 3 1/3 2 + V ion (r) + V H (r) 3α 4π ρ σ(r) ϕ iσ (r) = ε iσ ϕ iσ (r) (1) KS Kohn-Sham [ 2 + V ion (r) + V H (r) + V σ xc(r) ] ϕ iσ (r) = ε iσ ϕ iσ (r) (2) 1 2 1 2 2 1 1 2 LDA Local
11 March 2005 1 [ { } ] 3 1/3 2 + V ion (r) + V H (r) 3α 4π ρ σ(r) ϕ iσ (r) = ε iσ ϕ iσ (r) (1) KS Kohn-Sham [ 2 + V ion (r) + V H (r) + V σ xc(r) ] ϕ iσ (r) = ε iσ ϕ iσ (r) (2) 1 2 1 2 2 1 1 2 LDA Local
381
 P381 P386 P396 P397 P401 P423 P430 P433 P435 P437 P448 P451 P452 381 382 383 384 385 3.0mm 5.0mm 3.0mm 5.0mm SK SK3.0mm SK5.0mm 3.0mm PUR PUR3.0mm 2.0mm 2.0mm3.0mm 2.5mm 2.5mm3.0mm 3.0mm 5.0mm 3.0mm 1.8mm
P381 P386 P396 P397 P401 P423 P430 P433 P435 P437 P448 P451 P452 381 382 383 384 385 3.0mm 5.0mm 3.0mm 5.0mm SK SK3.0mm SK5.0mm 3.0mm PUR PUR3.0mm 2.0mm 2.0mm3.0mm 2.5mm 2.5mm3.0mm 3.0mm 5.0mm 3.0mm 1.8mm
Perl + α. : DNA, mrna,,
 2009 Perl + α. : DNA, mrna,, DNA .. DNA A C G T DNA 2 A-T, C-G DNA NH 2 NH 2 O - O O N P O - O CH 2 O N N O - O P O CH 2 O N O - O O P O NH 2 O - O - N CH 2 O N O OH OH OH DNA or RNA (U) (A) (G) (C)
2009 Perl + α. : DNA, mrna,, DNA .. DNA A C G T DNA 2 A-T, C-G DNA NH 2 NH 2 O - O O N P O - O CH 2 O N N O - O P O CH 2 O N O - O O P O NH 2 O - O - N CH 2 O N O OH OH OH DNA or RNA (U) (A) (G) (C)
untitled
 E-mail: khatano@fms.saitama-u.ac.jp Tel & Fax: 048-858-3535 Toxin Virus Bacterium Glycolipid Glycoprotein Vero toxin (Stx1 and Stx2) Side view Bottom view H H H H N H Grobotriaosyl Ceramide (Gb 3 : Galα1-4Galβ1-4Glcβ-Cer)
E-mail: khatano@fms.saitama-u.ac.jp Tel & Fax: 048-858-3535 Toxin Virus Bacterium Glycolipid Glycoprotein Vero toxin (Stx1 and Stx2) Side view Bottom view H H H H N H Grobotriaosyl Ceramide (Gb 3 : Galα1-4Galβ1-4Glcβ-Cer)
untitled
 5 28 EAR CCLECCN ECCN 1. 2. 3. 4. 5.EAR page 1 of 28 WWW.Agilent.co.jp -> Q&A ECCN 10020A 10070A 10070B 10070C 10071A 10071B 10072A 10073A 10073B 10073C 10074A 10074B 10074C 10076A 10229A 10240B 10430A
5 28 EAR CCLECCN ECCN 1. 2. 3. 4. 5.EAR page 1 of 28 WWW.Agilent.co.jp -> Q&A ECCN 10020A 10070A 10070B 10070C 10071A 10071B 10072A 10073A 10073B 10073C 10074A 10074B 10074C 10076A 10229A 10240B 10430A
会誌62_01
 光合成研究 21 (3) 2011 解説 光合成水分解 酸素発生を可能にする光化学系IIの原子構造 岡山大学 大学院 自然科学研究科 沈 建仁* 1. はじめに を経て 2分子の水を1分子の酸素 4つのプロトンと 酸素発生型光合成において 光化学 II (Photosystem 4つの電子に分解することが分かっている K o kサイ II, PSII) における水分解 酸素発生反応の機構は最大 クル
光合成研究 21 (3) 2011 解説 光合成水分解 酸素発生を可能にする光化学系IIの原子構造 岡山大学 大学院 自然科学研究科 沈 建仁* 1. はじめに を経て 2分子の水を1分子の酸素 4つのプロトンと 酸素発生型光合成において 光化学 II (Photosystem 4つの電子に分解することが分かっている K o kサイ II, PSII) における水分解 酸素発生反応の機構は最大 クル
 drug development Toshimi Michigami, E-mail : michigami@mch.pref.osaka.jp Keiichi Ozono, E-mail : keioz@ped.med.osaka-u.ac.jp The progress in the research on vitamin D 1) McCollum, E. V. et al.:
drug development Toshimi Michigami, E-mail : michigami@mch.pref.osaka.jp Keiichi Ozono, E-mail : keioz@ped.med.osaka-u.ac.jp The progress in the research on vitamin D 1) McCollum, E. V. et al.:
Structure and Strength of Acid-Base in Aqueous Medium Aritsune KAJI* and Masaru NAKAHARA* * Department of Chemistry, Faculty of Science, Kyoto Univers
 Structure and Strength of Acid-Base in Aqueous Medium Aritsune KAJI* and Masaru NAKAHARA* * Department of Chemistry, Faculty of Science, Kyoto University 1) J. Hayami, N. Ono, A. Kaji, Tetrahedron
Structure and Strength of Acid-Base in Aqueous Medium Aritsune KAJI* and Masaru NAKAHARA* * Department of Chemistry, Faculty of Science, Kyoto University 1) J. Hayami, N. Ono, A. Kaji, Tetrahedron
ochem2_30
 第 30 回 有機化合物の構造決定 (2) NMR NMR NMR 質量分析法 赤外分光法 NMR 1. 質量分析法の原理 1913 Thomson (Proc. R. Soc. Lond. A 1913, 89, 1 26) Thomson Thomson 20 Ne 22 Ne Thomson mv/qb m q v B m/q Thomson 1 EI 法 ( electron ionization,
第 30 回 有機化合物の構造決定 (2) NMR NMR NMR 質量分析法 赤外分光法 NMR 1. 質量分析法の原理 1913 Thomson (Proc. R. Soc. Lond. A 1913, 89, 1 26) Thomson Thomson 20 Ne 22 Ne Thomson mv/qb m q v B m/q Thomson 1 EI 法 ( electron ionization,
Vol.53 No. 11 (2008) 1327
 Molecules that regulate morphology of the plasma membrane Shiro Suetsugu, Kazunori Takano E-mail : suetsugu@iam.u-tokyo.ac.jp 1326 Vol.53 No. 11 (2008) Vol.53 No. 11 (2008) 1327 1328 Vol.53 No. 11 (2008)
Molecules that regulate morphology of the plasma membrane Shiro Suetsugu, Kazunori Takano E-mail : suetsugu@iam.u-tokyo.ac.jp 1326 Vol.53 No. 11 (2008) Vol.53 No. 11 (2008) 1327 1328 Vol.53 No. 11 (2008)
案内最終.indd
 1 2 3 4 5 6 IC IC R22 IC IC http://www.gifu-u.ac.jp/view.rbz?cd=393 JR JR JR JR JR 7 / JR IC km IC km IC IC km 8 F HPhttp://www.made.gifu-u.ac.jp/~vlbi/index.html 9 Q01a N01a X01a K01a S01a T01a Q02a N02a
1 2 3 4 5 6 IC IC R22 IC IC http://www.gifu-u.ac.jp/view.rbz?cd=393 JR JR JR JR JR 7 / JR IC km IC km IC IC km 8 F HPhttp://www.made.gifu-u.ac.jp/~vlbi/index.html 9 Q01a N01a X01a K01a S01a T01a Q02a N02a
Microsoft Word - note02.doc
 年度 物理化学 Ⅱ 講義ノート. 二原子分子の振動. 調和振動子近似 モデル 分子 = 理想的なバネでつながった原子 r : 核間距離, r e : 平衡核間距離, : 変位 ( = r r e ), k f : 力の定数ポテンシャルエネルギー ( ) k V = f (.) 古典運動方程式 [ 振動数 ] 3.3 d kf (.) dt μ : 換算質量 (m, m : 原子, の質量 ) mm
年度 物理化学 Ⅱ 講義ノート. 二原子分子の振動. 調和振動子近似 モデル 分子 = 理想的なバネでつながった原子 r : 核間距離, r e : 平衡核間距離, : 変位 ( = r r e ), k f : 力の定数ポテンシャルエネルギー ( ) k V = f (.) 古典運動方程式 [ 振動数 ] 3.3 d kf (.) dt μ : 換算質量 (m, m : 原子, の質量 ) mm
<4D F736F F D208D5D94A681408BC690D18FD089EE>
 A02 "Dynamics of Double-Layer Restructuring on a Platinum Electrode covered by CO: Laser-Induced Potential Transient Measurement" Akira Yamakata and Masatoshi Osawa The Journal of Physical Chemistry C
A02 "Dynamics of Double-Layer Restructuring on a Platinum Electrode covered by CO: Laser-Induced Potential Transient Measurement" Akira Yamakata and Masatoshi Osawa The Journal of Physical Chemistry C
Pr Pfr Arabidopsis thaliana, At 5 phya-e bacteriophytochrome photoreceptor BphP Pseudomonas aeruginosa, Pa Deinococcus radiodurans, Dr 4) N- C- 2A N-
 55 4 181-186 2015 DOI: 10.2142/biophys.55.181 2015 6 9 解説 Immovable plants see the light condition precisely to adjust themselves to their environment. For this purpose, plants have acquired a variety
55 4 181-186 2015 DOI: 10.2142/biophys.55.181 2015 6 9 解説 Immovable plants see the light condition precisely to adjust themselves to their environment. For this purpose, plants have acquired a variety
2 A B A B A A B Ea 1 51 Ea 1 A B A B B A B B A Ea 2 A B Ea 1 ( )k 1 Ea 1 Ea 2 Arrhenius 53 Ea R T k 1 = χe 1 Ea RT k 2 = χe 2 Ea RT 53 A B A B
 5. A B B A B A B B A A B A B 2 A [A] B [B] 51 v = k[a][b] 51 A B 3 0 273.16 A B A B A B A A [A] 52 v= k[a] 52 A B 55 2 A B A B A A B Ea 1 51 Ea 1 A B A B B A B B A Ea 2 A B Ea 1 ( )k 1 Ea 1 Ea 2 Arrhenius
5. A B B A B A B B A A B A B 2 A [A] B [B] 51 v = k[a][b] 51 A B 3 0 273.16 A B A B A B A A [A] 52 v= k[a] 52 A B 55 2 A B A B A A B Ea 1 51 Ea 1 A B A B B A B B A Ea 2 A B Ea 1 ( )k 1 Ea 1 Ea 2 Arrhenius
…h…L…–…†…fi…g1
 RY RO RR RW LN LM LB LC MH MG MB RD RM RG LD CW SB VR BB EB PW PY PP PG PB 0 contents WR LR MR BR DR PM SM MC CB BO 0 P P7 P P5 P9 P 0 P4 P48 P54 P60 P66 P 04 RY RO RR RW RD RM RG LN LM LB LC LD MH MG
RY RO RR RW LN LM LB LC MH MG MB RD RM RG LD CW SB VR BB EB PW PY PP PG PB 0 contents WR LR MR BR DR PM SM MC CB BO 0 P P7 P P5 P9 P 0 P4 P48 P54 P60 P66 P 04 RY RO RR RW RD RM RG LN LM LB LC LD MH MG
セリン OH 基は極性をもつ 親水的である トレオニン OH 基は極性をもつ 親水的である チロシン OH 基は極性をもつ 親水的である 解離してマイナスの電荷を帯びる 4 側鎖 アラニン 疎水的である グリシンの次に単純 グリシン もっとも単純な構造のアミノ酸 α 炭素が不斉炭素でないので唯一立体
 生物化学概論 Ⅰ シケプリ セントラルドグマ DNA は情報を担っている分子ではありますが それ自体は何の機能も持ちません 情報は RNA に写し取られ rrna やtRNA のように RNA として機能するか あるいは mrna として情報が写し取られ リボソームがこの情報をもとにタンパク質を合成して はじめて機能を持った分子が作られます 情報の流れは常に DNA RNA タンパク質と流れていき
生物化学概論 Ⅰ シケプリ セントラルドグマ DNA は情報を担っている分子ではありますが それ自体は何の機能も持ちません 情報は RNA に写し取られ rrna やtRNA のように RNA として機能するか あるいは mrna として情報が写し取られ リボソームがこの情報をもとにタンパク質を合成して はじめて機能を持った分子が作られます 情報の流れは常に DNA RNA タンパク質と流れていき
 [Department of Pediatrics, Gifu University School Clinical. Pathological and Biochemical Abnormality in peroxisomal Disorders 1) Goldfischer, S., Moore, C. L., Johnson, A. B., Spiro, A. J., Valsamis,
[Department of Pediatrics, Gifu University School Clinical. Pathological and Biochemical Abnormality in peroxisomal Disorders 1) Goldfischer, S., Moore, C. L., Johnson, A. B., Spiro, A. J., Valsamis,
 Biology of spermatogenesis and spermatozoa in mammals. Biophys. Biochem. Cytol. Arch. Biochem. Biophys. Anat. Rec. Biol. Reprod. Mol. Hum. Reprod. Biol. Reprod. Reprod. Biol. Endocrinol. Aust. J. Zool.
Biology of spermatogenesis and spermatozoa in mammals. Biophys. Biochem. Cytol. Arch. Biochem. Biophys. Anat. Rec. Biol. Reprod. Mol. Hum. Reprod. Biol. Reprod. Reprod. Biol. Endocrinol. Aust. J. Zool.
Bio-No.57/3....
 2004. MAR. 3No.57 http://www.wako-chem.co.jp C O N T E N T S 2 Wako Bio Window No.57 MAR.2004 l l l l wako wako l l mmmmmmmmmmmmmmmmmmmmmmmmmmmmmmmmmm Wako Bio Window No.57 MAR.2004 3 4 Wako Bio Window
2004. MAR. 3No.57 http://www.wako-chem.co.jp C O N T E N T S 2 Wako Bio Window No.57 MAR.2004 l l l l wako wako l l mmmmmmmmmmmmmmmmmmmmmmmmmmmmmmmmmm Wako Bio Window No.57 MAR.2004 3 4 Wako Bio Window
Database Center for Life Science Online Service Chiharu Ueguchi, Molecular mechanism and biological function of t
 Chiharu Ueguchi, E-mail : cueguchi@agr.nagoya-u.ac.jp Molecular mechanism and biological function of the cytokinin signal tansduction pathway 1) Miller, C. 0., Skoog, F., von Saltza, M. H., Strong,
Chiharu Ueguchi, E-mail : cueguchi@agr.nagoya-u.ac.jp Molecular mechanism and biological function of the cytokinin signal tansduction pathway 1) Miller, C. 0., Skoog, F., von Saltza, M. H., Strong,
 Florigen in rice Key words Shojiro Tamaki, Ko Shimamoto E-mail : s-tamaki@bs.naist.jp, simamoto@bs.naist.jp URL : http://bsw3.naist.jp/simamoto/simaoto.html 1) Thomas, B., Vince-prue, D.: Photoperiodism
Florigen in rice Key words Shojiro Tamaki, Ko Shimamoto E-mail : s-tamaki@bs.naist.jp, simamoto@bs.naist.jp URL : http://bsw3.naist.jp/simamoto/simaoto.html 1) Thomas, B., Vince-prue, D.: Photoperiodism
CRA3689A
 AVIC-DRZ90 AVIC-DRZ80 2 3 4 5 66 7 88 9 10 10 10 11 12 13 14 15 1 1 0 OPEN ANGLE REMOTE WIDE SET UP AVIC-DRZ90 SOURCE OFF AV CONTROL MIC 2 16 17 1 2 0 0 1 AVIC-DRZ90 2 3 4 OPEN ANGLE REMOTE SOURCE OFF
AVIC-DRZ90 AVIC-DRZ80 2 3 4 5 66 7 88 9 10 10 10 11 12 13 14 15 1 1 0 OPEN ANGLE REMOTE WIDE SET UP AVIC-DRZ90 SOURCE OFF AV CONTROL MIC 2 16 17 1 2 0 0 1 AVIC-DRZ90 2 3 4 OPEN ANGLE REMOTE SOURCE OFF
[RP13]シリーズカタログ
![[RP13]シリーズカタログ [RP13]シリーズカタログ](/thumbs/99/140027433.jpg) 131520 : : : 2AAWG#24 : 2AAWG#22 1315 : AC30VDC42V 20 : AC100VDC140V 1. 1315 : 15m 20 : 30m DC1A -10 ~ +60-10 ~ +60 2. 1000M DC250V 3. AC300V1 4. 10s 10~55Hz/0.75mm 32 5. 10s 490m/s 2 11ms33 6. 7. 1315
131520 : : : 2AAWG#24 : 2AAWG#22 1315 : AC30VDC42V 20 : AC100VDC140V 1. 1315 : 15m 20 : 30m DC1A -10 ~ +60-10 ~ +60 2. 1000M DC250V 3. AC300V1 4. 10s 10~55Hz/0.75mm 32 5. 10s 490m/s 2 11ms33 6. 7. 1315
解禁時間:(テレビ、ラジオ)平成16年11月19日午前3時(新聞) 平成16年11月19日付け朝刊
 細菌が緑色を感じる仕組み 色素たんぱく質の新しい色決定機構 この度 名古屋大学大学院理学研究科の須藤雄気准教授 / 博士課程二年 鈴木大介氏らは JST 目的基礎研究事業の一環として 名古屋工業大学大学院工学研究科の神取秀樹教授 東京工業大学資源化学研究所の藤井正明教授らの研究グループの協力を得て 細菌の色覚センサーの色決定メカニズムを世界に先駆けて明らかにしました 多くの生物は 青 緑 赤のいわゆる三原色を三種
細菌が緑色を感じる仕組み 色素たんぱく質の新しい色決定機構 この度 名古屋大学大学院理学研究科の須藤雄気准教授 / 博士課程二年 鈴木大介氏らは JST 目的基礎研究事業の一環として 名古屋工業大学大学院工学研究科の神取秀樹教授 東京工業大学資源化学研究所の藤井正明教授らの研究グループの協力を得て 細菌の色覚センサーの色決定メカニズムを世界に先駆けて明らかにしました 多くの生物は 青 緑 赤のいわゆる三原色を三種
H1-H4
 42 S H He Li H He Li Be B C N O F Ne Be B C N O F Ne H He Li Be B H H e L i Na Mg Al Si S Cl Ar Na Mg Al Si S Cl Ar C N O F Ne Na Be B C N O F Ne Na K Sc T i V C r K Sc Ti V Cr M n F e C o N i Mn Fe Mg
42 S H He Li H He Li Be B C N O F Ne Be B C N O F Ne H He Li Be B H H e L i Na Mg Al Si S Cl Ar Na Mg Al Si S Cl Ar C N O F Ne Na Be B C N O F Ne Na K Sc T i V C r K Sc Ti V Cr M n F e C o N i Mn Fe Mg
Database Center for Life Science Online Service
 2) Shin, S. I., Fredman, V. H., Risser, P., Pol lack,r.: Proc. Natl. Acad. Sci. USA, 72, 4435-4439 (1975) 3) Marquardt, H., Todaro, G. J.: J. Biol. Chem., 256, 6859-6865 (1981) 4) Dicker, P., Pohjanpelto,
2) Shin, S. I., Fredman, V. H., Risser, P., Pol lack,r.: Proc. Natl. Acad. Sci. USA, 72, 4435-4439 (1975) 3) Marquardt, H., Todaro, G. J.: J. Biol. Chem., 256, 6859-6865 (1981) 4) Dicker, P., Pohjanpelto,
Generation of neural cells from embryonic stem cells Database Center for Life Science Online Service Takuya Yohei Okada Takahito Hideyuki Shimazaki Yo
 Generation of neural cells from embryonic stem cells Takuya Yohei Okada Takahito Hideyuki Shimazaki Yoshizaki* Okano McLean Hospital/Harvard University Udall Parkinson's Disease Research Center of Excellence
Generation of neural cells from embryonic stem cells Takuya Yohei Okada Takahito Hideyuki Shimazaki Yoshizaki* Okano McLean Hospital/Harvard University Udall Parkinson's Disease Research Center of Excellence
 図1 A:融 試 験 管 内 受 精 と胚 様 体 発 育 お よび 植 物 体 再 生(ト ウ モ ロ コ シ) 合 前 の卵 細 胞(E)と 精 細 胞(S).バ ー=50μm, B:第1回 の 分 裂(融 合42時 間 後).バ ー=50μm, C:多 細 胞体(5日 後).バ ー=100μm, D:分 極 した 多 細 胞 体.一 方 の 極 に 細 胞 層 が,も う一 方 に液 胞 の
図1 A:融 試 験 管 内 受 精 と胚 様 体 発 育 お よび 植 物 体 再 生(ト ウ モ ロ コ シ) 合 前 の卵 細 胞(E)と 精 細 胞(S).バ ー=50μm, B:第1回 の 分 裂(融 合42時 間 後).バ ー=50μm, C:多 細 胞体(5日 後).バ ー=100μm, D:分 極 した 多 細 胞 体.一 方 の 極 に 細 胞 層 が,も う一 方 に液 胞 の
本文/YA7305C
 Cao, Z., Tavender, T.J., Roszak, A.W., Cogdell, R.J., & Bulleid, N.J.J. Biol. Chem.,,. Meunier, L., Usherwood, Y.K., Chung, K.T., & Hendershot, L. M.Mol. Biol. Cell,,. Rutkevich, L.A., Cohen-Doyle, M.F.,
Cao, Z., Tavender, T.J., Roszak, A.W., Cogdell, R.J., & Bulleid, N.J.J. Biol. Chem.,,. Meunier, L., Usherwood, Y.K., Chung, K.T., & Hendershot, L. M.Mol. Biol. Cell,,. Rutkevich, L.A., Cohen-Doyle, M.F.,
生物有機化学
 質問への答え 速い 書き込みが追い付かない 空欄を開いたことを言ってほしいなるべくゆっくりやります ただし 生化学をできるだけ網羅し こんなの聞いたことない というところをなるべく残さないようにと思っています 通常の講義よりは速いでしょう 試験では細かいことは聞きません レーザーポインターが見にくい アンカータンパク質の内側 外側とは? 細胞内と細胞外です 動画の場所 Youtube で Harvard
質問への答え 速い 書き込みが追い付かない 空欄を開いたことを言ってほしいなるべくゆっくりやります ただし 生化学をできるだけ網羅し こんなの聞いたことない というところをなるべく残さないようにと思っています 通常の講義よりは速いでしょう 試験では細かいことは聞きません レーザーポインターが見にくい アンカータンパク質の内側 外側とは? 細胞内と細胞外です 動画の場所 Youtube で Harvard
Gauss Gauss ɛ 0 E ds = Q (1) xy σ (x, y, z) (2) a ρ(x, y, z) = x 2 + y 2 (r, θ, φ) (1) xy A Gauss ɛ 0 E ds = ɛ 0 EA Q = ρa ɛ 0 EA = ρea E = (ρ/ɛ 0 )e
 7 -a 7 -a February 4, 2007 1. 2. 3. 4. 1. 2. 3. 1 Gauss Gauss ɛ 0 E ds = Q (1) xy σ (x, y, z) (2) a ρ(x, y, z) = x 2 + y 2 (r, θ, φ) (1) xy A Gauss ɛ 0 E ds = ɛ 0 EA Q = ρa ɛ 0 EA = ρea E = (ρ/ɛ 0 )e z
7 -a 7 -a February 4, 2007 1. 2. 3. 4. 1. 2. 3. 1 Gauss Gauss ɛ 0 E ds = Q (1) xy σ (x, y, z) (2) a ρ(x, y, z) = x 2 + y 2 (r, θ, φ) (1) xy A Gauss ɛ 0 E ds = ɛ 0 EA Q = ρa ɛ 0 EA = ρea E = (ρ/ɛ 0 )e z
ü β 93
 Amyloid Fibril Formation and Protein Science Yuji GOTO Institute for Protein Research, Osaka University E-mail: ygoto@protein.osaka-u.ac.jp Abstract: Amyloid fibrils have been a critical subject in recent
Amyloid Fibril Formation and Protein Science Yuji GOTO Institute for Protein Research, Osaka University E-mail: ygoto@protein.osaka-u.ac.jp Abstract: Amyloid fibrils have been a critical subject in recent
The Heart Healthy Tocotrienol Complex Tocomin SupraBio
 The Heart Healthy Tocotrienol Complex Tocomin SupraBio The Heart Healthy Tocotrienol Complex Tocomin SupraBio 1. Fact Sheet No. 317; World Health Organization (WHO), 2007 2. LLOYD-JONES D. et al. Circulation
The Heart Healthy Tocotrienol Complex Tocomin SupraBio The Heart Healthy Tocotrienol Complex Tocomin SupraBio 1. Fact Sheet No. 317; World Health Organization (WHO), 2007 2. LLOYD-JONES D. et al. Circulation



